化合物的结晶复合物,其制备方法及其用于制备药物的用途与流程
发明领域
本发明涉及1-氰基-2-(4-环丙基-苄基)-4-(β-d-吡喃葡萄糖-1-基)-苯的结晶复合物,其制备方法以及其用于制备药物的用途。
发明背景
化合物1-氰基-2-(4-环丙基-苄基)-4-(β-d-吡喃葡萄糖-1-基)-苯(在后文将其称为“化合物a”)叙述于wo2007/128749中且具有如式a的化学结构。
其中所述的化合物对钠依赖性葡萄糖协同转运蛋白sglt,尤其sglt2具有有价值的抑制效果。如其中所述的化合物a的制备方法不会产生结晶形式。
特定药物活性当然成为药物活性剂在批准成为上市药物之前要满足的基本必要条件。然而,药物活性剂必须符合多项其他要求。这些要求是基于与活性物质自身的性质相关的各种参数。这些参数的非限制性实例为活性剂在各种环境条件下的稳定性、其在制备药物制剂期间的稳定性及活性剂在最终药物组合物中的稳定性。用于制备药物组合物的药物活性物质应尽可能纯且必须确保其在各种环境条件下具有长期储存的稳定性。有必要避免使用含有除实际活性物质之外的物质(例如其分解产物)的药物组合物;在此情形下,活性物质在药物中的含量可能小于所规定的含量。
制剂中药物的均一分布为一重要因素,尤其是当必须以低剂量给予药物时。为了确保均一分布,可例如通过研磨将活性物质的粒径减小至适宜水平。由于必须尽可能避免作为研磨(或微粉化)的副作用的药物活性物质的分解,除研磨处理所需的苛刻条件之外,必要的是应使活性物质在整个研磨处理中高度稳定。只有活性物质在研磨处理期间充分稳定,才可能以可重现的方式生产总是包含规定含量的活性物质的均质药物制剂。
在用于制备所需药物制剂的研磨处理中可能出现的另一问题在于由该处理引起的能量输入及对晶体表面的应力。在某些情形中,这可能导致多晶型变化、非晶化或晶格的变化。由于药物制剂的药物质量要求活性物质应总是具有相同的结晶形态,由此看来,结晶活性物质的稳定性及性质也要经历严格要求。
对于决定特定药物的贮存期而言,在药物组合物中的药物活性物质的稳定性也是重要的;贮存期为可无任何风险地给予药物的时间长度。因此,上述药物组合物中的药物在各种储存条件下的高度稳定性对于患者及制造商均有额外好处。
由于水的摄取而致的增加的重量,水分的吸收降低了药物活性物质的含量。倾向于吸水的药物组合物必须在储存期间防水,例如通过添加适宜的干燥剂或通过将药物储存在防水环境中。因此,优选地,药物活性物质应最好为微吸湿性的。
而且,明确定义的结晶形式的可获得性容许通过重结晶来纯化药物。
除了以上表明的要求,一般应明了任何能改进其物理及化学稳定性的药物组合物的固态变化相较于相同药物的较不稳定形式而言可产生显著优势。
因此,本发明的目的在于提供一种新的、稳定的化合物a的结晶形式,其满足如上述的那些针对药物活性物质所提出的重要要求。
发明目的
在第一方面中,本发明涉及一种或多种天然氨基酸与1-氰基-2-(4-环丙基-苄基)-4-(β-d-吡喃葡萄糖-1-基)-苯之间的结晶复合物。
鉴于该化合物a的药物疗效及结晶复合物的有利的理化性质,本发明的第二方面涉及一种包含如前文及后文所定义的一种或多种结晶复合物的药物组合物或药物。
本发明的另一方面涉及用作药物的结晶复合物。
在另一方面中,本发明涉及前文或后文所定义的一种或多种结晶复合物在制备适合治疗或预防可通过抑制钠依赖性葡萄糖协同转运蛋白sglt(优选sglt2)而影响的疾病或病症的药物组合物中的用途。
在另一方面中,本发明涉及前文或后文所定义的一种或多种结晶复合物在制备用于抑制钠依赖性葡萄糖协同转运蛋白sglt2的药物组合物的用途。
在另一方面中,本发明涉及一种制备前文和后文所定义的一种或多种结晶复合物的方法,该方法包括下列步骤:
(a)制备1-氰基-2-(4-环丙基-苄基)-4-(β-d-吡喃葡萄糖-1-基)-苯与一种或多种天然氨基酸于溶剂或溶剂混合物中的溶液;
(b)储存该溶液,使结晶复合物自溶液中沉淀析出;
(c)从该溶液中除去沉淀物;和
(d)任选地干燥该沉淀物直到已经除去任何过量的所述溶剂或溶剂混合物。
本领域技术人员从本发明的以下详细叙述和实施例可明了本发明的其他方面。
附图简述
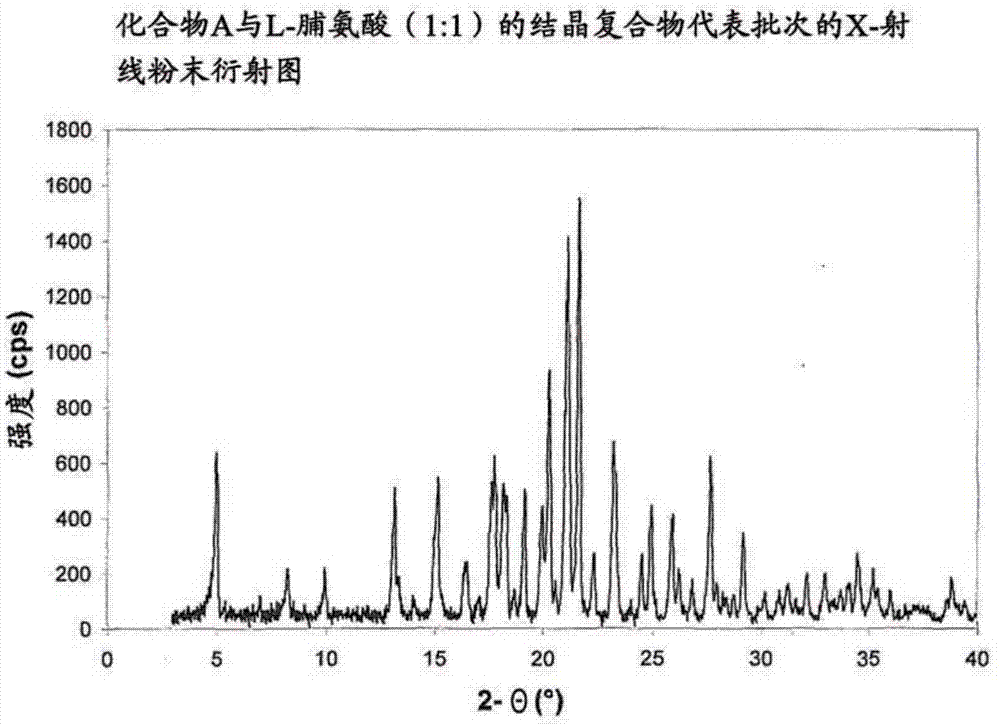
图1显示化合物a与l-脯氨酸的结晶复合物的x-射线粉末衍射图。
图2显示经由dsc测定的化合物a与l-脯氨酸的结晶复合物的熔点,及经由tg测定的化合物a与l-脯氨酸的结晶复合物的重量损失。
发明详述
出人意料地发现,存在天然氨基酸与化合物a之间的结晶复合物。该复合物满足前文提及的重要要求。因此,本发明涉及化合物a与一种或多种天然氨基酸之间的结晶复合物。
天然氨基酸优选呈其(d)或(l)对映异构体形式,最优选(l)对映异构体。
而且,根据本发明的那些结晶复合物优选在化合物a与一种天然氨基酸之间形成,最优选在化合物a与天然氨基酸的(l)对映异构体之间形成。
根据本发明的优选氨基酸选自苯丙胺酸和脯氨酸,特别是(l)-脯氨酸和(l)-苯丙胺酸。
根据一项优选实施方案,结晶复合物的特征在于该天然氨基酸为脯氨酸,特别是(l)-脯氨酸。
化合物a与天然氨基酸的摩尔比优选在约2:1至约1:3的范围内,更优选约1.5:1至约1:1.5,甚至更优选约1.2:1至约1:1.2,最优选约1:1。在后文中,将该实施方案称为“复合物(1:1)”或“1:1复合物”。
因此,根据本发明的一种优选结晶复合物为化合物a与脯氨酸、特别是化合物a与l-脯氨酸的复合物(1:1)。
根据一项优选实施方案,该化合物a与l-脯氨酸的结晶复合物,特别是1:1复合物为水合物。
结晶复合物与水的摩尔比优选在约1:0至1:3的范围内,更优选约1:0至1:2,甚至更优选约1:0.5至1:1.5,最优选约1:0.8至1:1.2,特别是约1:1。
化合物a与脯氨酸,特别是化合物a与l-脯氨酸及水的结晶复合物可通过其特征性x-射线粉末衍射(xrpd)图识别,并与其他结晶形式区别。
该结晶复合物优选通过包含在20.28、21.14及21.64°2θ(±0.1°2θ)的峰的x-射线粉末衍射图表征,其中该x-射线粉末衍射图是利用cukα1射线制得的。
具体地,该x-射线粉末衍射图包含在4.99、20.28、21.14、21.64及23.23°2θ(±0.1°2θ)的峰,其中该x-射线粉末衍射图是利用cukα1射线制得的。
更具体地,该x-射线粉末衍射图包含在4.99、17.61、17.77、20.28、21.14、21.64、23.23及27.66°2θ(±0.1°2θ)的峰,其中该x-射线粉末衍射图是利用cukα1射线制得的。
甚至更具体地,该x-射线粉末衍射图包含在4.99、15.12、17.61、17.77、18.17、20.28、21.14、21.64、23.23及27.66°2θ(±0.1°2θ)的峰,其中该x-射线粉末衍射图是利用cukα1射线制得的。
甚至更具体地,化合物a与l-脯氨酸的结晶复合物通过利用cukα1射线制得的粉末衍射图表征,其包含如表1所列的在2θ角度(±0.1°2θ)的峰。
表1:化合物a与l-脯氨酸的结晶复合物的x-射线粉末衍射图(仅列出2θ角度至多为30°的峰):
甚至更具体地,该结晶复合物通过利用cukα1射线制得的包含如图1所示的2θ角度(±0.1°2θ)的峰的x-射线粉末衍射图表征。
而且,化合物a与l-脯氨酸的该结晶复合物可通过以下表征:熔点大于89℃,特别是在约89℃至约115℃的范围内,更优选在约89℃至约110℃的范围内(经由dsc测定;评估为起始温度;加热速率10k/min)。可观察到该结晶复合物在脱水下熔化。图2显示所获得的dsc曲线。
化合物a与l-脯氨酸的该结晶复合物显示通过热重法(tg)测定的重量损失。观察到的重量损失表明结晶形式包含可通过吸收结合和/或可为晶格的一部分的水,即结晶形式可以结晶水合物存在。结晶形式中的水含量可在0至约10重量%的范围内,具体地0至约5重量%,甚至更优选约1.5至约5重量%。图2的虚线描绘介于2.8与3.8%的水之间的重量损失。由观察到的重量损失可估计为接近一水合物的化学计量。
该结晶复合物具有有利的理化性质,其在制备药物组合物中有益。具体地,该结晶复合物在各种环境条件下及在制备药物期间具有高度的物理和化学稳定性。例如,可获得特别适合用于固体药物制剂的生产方法中的呈某一形状及粒径的晶体。此外,该晶体显示容许晶体研磨的高度的机械稳定性。而且,结晶复合物不显示高度吸水倾向且为化学稳定的,即结晶复合物允许制备具有长贮存期的固体药物制剂。另一方面,结晶复合物在较宽的ph范围中具有有利的高溶解度,其在供经口给予的药物制剂中有利。
利用处于透射模式的stoe-stadip-衍射仪,其配有位置敏感检测器(oed)及作为x-射线源的cu-阳极(cukα1射线,
为容许实验误差,上述2θ值应考虑精确至±0.1°2θ,特别是±0.05°2θ。也就是说,当评估化合物a的晶体的给定样品是否为本发明的结晶形式时,若样品实验时观察到的2θ值落在特征值的±0.1°2θ的范围内,特别是若其落于特征值的±0.05°2θ的范围内,则其应视为与上述特征值相同。
通过利用dsc821(mettlertoledo)的dsc(差示扫描量热法)测定熔点。通过利用tga851(mettlertoledo)的热重法(tg)测定重量损失。
本发明的另一方面涉及制备如前文和后文所定义的本发明的结晶复合物的方法,该方法包括下列步骤:
(a)制备化合物a与一种或多种天然氨基酸于溶剂或溶剂混合物中的溶液;
(b)储存该溶液,使结晶复合物自溶液中沉淀析出;
(c)从该溶液中除去沉淀物;和
(d)任选地干燥该沉淀物直到已经除去任何过量的所述溶剂或溶剂混合物。
根据步骤(a),制备化合物a与一种或多种天然氨基酸于溶剂或溶剂混合物中的溶液。就结晶复合物而言,该溶液优选为饱和或至少近饱和或甚至过饱和的。在步骤(a)中,化合物(a)可溶于包含一种或多种天然氨基酸的溶液中,或该一种或多种天然氨基酸可溶于包含化合物a的溶液中。根据另一种替代操作,将化合物a溶于溶剂或溶剂混合物中产生第一溶液,并将一种或多种天然氨基酸溶于溶剂或溶剂混合物中产生第二溶液。之后,合并该第一溶液及该第二溶液,形成步骤(a)的溶液。
溶液中的天然氨基酸与化合物a的摩尔比优选对应于待获得的结晶复合物中的天然氨基酸与化合物a的摩尔比。因此,优选的摩尔比范围为约1:2至3:1,最优选约1:1。
适宜的溶剂优选地选自c1-4-烷醇、水、乙酸乙酯、乙腈、丙酮、乙醚、四氢呋喃和两种或更多种这些溶剂的混合物。
更优选的溶剂选自甲醇、乙醇、异丙醇、水和两种或更多种这些溶剂的混合物,特别是一种或多种这些有机溶剂与水的混合物。
特别优选的溶剂选自乙醇、异丙醇、水、以及乙醇和/或异丙醇与水的混合物。
在采用水与一种或多种c1-4-烷醇(特别是甲醇、乙醇和/或异丙醇,最优选乙醇)的混合物的情形下,水:烷醇的优选体积比的范围为约99:1至1:99,更优选约50:1至1:80;甚至更优选约10:1至1:60。
优选地,在约室温(约20℃)或在至多约为所使用的溶剂或溶剂混合物的沸点的升高温度下进行步骤(a)。
根据一项优选的实施方案,化合物a和/或一种或多种天然氨基酸和/或溶剂和溶剂混合物的起始物料包含至少为形成化合物a的水合物所需量的h2o含量;具体地每mol化合物a至少1mol、优选至少1.5mol水。甚至更优选地,水含量至少为每mol化合物a2mol水。这意味着作为起始物料的化合物a或一种或多种天然氨基酸或该溶剂或溶剂混合物,或这些化合物和/或溶剂的组合包含如上指定的h2o含量。例如,若步骤(a)中的化合物a或天然氨基酸的起始物料确实包含如上指定的足量水,则不强制要求溶剂的水含量。
为了降低本发明的结晶复合物在溶液中的溶解度,可在步骤(a)和/或步骤(b)中,优选在步骤(a)期间或在步骤(b)开始时添加一种或多种抗溶剂(antisolvent)。水为适宜抗溶剂的一个实例。优选地选择抗溶剂的含量以获得结晶复合物的过饱和或饱和溶液。
在步骤(b)中,将溶液储存足以获得沉淀物(即结晶复合物)的时间。步骤(b)中的溶液的温度约等于或低于步骤(a)中的温度。在储存期间,优选地降低溶液的温度,优选降低至20℃至0℃的范围内的温度或甚至更低的温度。可在搅拌或无搅拌下进行步骤(b)。如本领域技术人员所知,通过步骤(b)中的时间周期及温度差异,可控制所获得晶体的大小、形状及质量。而且,可通过本领域中已知的方法,例如通过机械手段诸如例如利用玻璃棒刮擦或摩擦反应容器的接触表面,可引发结晶。任选地可利用晶种接种(近)饱和或过饱和溶液。
在步骤(c)中,可通过已知方法,例如过滤、吸滤、倾析或离心从沉淀物中除去一种或多种溶剂。
在步骤(d)中,可通过本领域技术人员已知的方法,例如通过优选在真空中降低一种或多种溶剂的分压,和/或通过在高于约20℃、优选在低于100℃、甚至更优选低于85℃的温度范围内加热,而从沉淀物中除去过量的溶剂。
可通过如国际申请案wo2007/128749中具体性和/或一般性叙述或引用的方法合成化合物a。而且,可如国际申请案wo2007/128749(其全文以引用的方式并入本文中)中叙述的方式研究化合物a的生物性质。
本发明的结晶复合物优选地用作呈实质上纯形式的药物活性物质,即实质上不含化合物a的其他结晶形式。然而,本发明也包括与另外一种或多种结晶形式混合的结晶复合物。若药物活性物质为结晶形式的混合物,优选地,该物质包括至少50重量%,甚至更优选至少90重量%,最优选至少95重量%的如本文中所述的结晶复合物。
鉴于其抑制sglt活性的能力,本发明的结晶复合物适合用于治疗和/或预防性治疗可通过抑制sglt活性、尤其是sglt-2活性而影响的病症或疾病。本发明的结晶复合物也适合制备用于治疗和/或预防性治疗可通过抑制sglt活性、尤其是sglt-2活性而影响的病症或疾病的药物组合物。因此,本发明的结晶复合物适合用于治疗人类ii型糖尿病。
达成治疗或预防的相应活性所需的剂量通常取决于患者、疾病或病症的性质及严重性及投药方法及频率,且由患者的医生来决定。便利地,通过静脉内途径的剂量可为1至100mg,通过经口途径的剂量可为1至1000mg,在各情形中一日给予1至4次。为此目的,本发明的药物组合物优选地包括根据本发明的结晶复合物以及一种或多种惰性常规载体和/或稀释剂。这些药物组合物可调配成常规盖伦制剂,诸如普通片剂或包衣片剂、胶囊、粉剂、悬浮液或栓剂。
在前文及后文中,在结构式的各情形中未明确显示羟基中的h原子。以下合成实施例用于说明制备化合物a及其与天然氨基酸l-脯氨酸的结晶复合物的方法。其仅视为通过举例的方式描述的一种可能方法,而不限制本发明于其内容。术语“室温”及“环境温度”可互换使用并表示约20℃的温度。使用下列简写:
dmf二甲基甲酰胺
nmpn-甲基-2-吡咯烷酮
thf四氢呋喃
起始化合物的制备
实施例i
4-溴-3-羟甲基-1-碘-苯
将草酰氯(13.0ml)添加至含于ch2cl2(200ml)中的2-溴-5-碘-苯甲酸(49.5g)的溶液中。添加dmf(0.2ml)并在室温该搅拌溶液6h。接着,减压下浓缩溶液并将残余物溶于thf(100ml)中。在冰浴中冷却所得溶液及逐份添加libh4(3.4g)。移除冷却浴并在室温搅拌该混合物1h。利用thf稀释反应混合物并利用0.1m盐酸处理。接着,分离有机层并利用乙酸乙酯萃取水层。干燥(na2so4)合并的有机层并减压下蒸发溶剂以获得粗产物。
产量:47.0g(理论值的99%)
实施例
4-溴-3-氯甲基-1-碘-苯
将亚硫酰氯(13ml)添加至4-溴-3-羟甲基-1-碘-苯(47.0g)于包含dmf(0.1ml)的二氯甲烷(100ml)中的悬浮液中。在环境温度搅拌该混合物3h。接着,减压下除去溶剂及过量试剂。利用甲醇湿磨残余物并干燥。
产量:41.0g(理论值的82%)
实施例iii
4-溴-1-碘-3-苯氧基甲基-苯
将溶于4mkoh溶液(60ml)中的苯酚(13g)添加至溶于丙酮(50ml)中的4-溴-3-氯甲基-1-碘-苯(41.0g)中。添加nai(0.5g)并在50℃搅拌所得混合物过夜。接着,添加水并利用乙酸乙酯萃取所得混合物。干燥(na2so4)合并的萃取物并减压下蒸发溶剂。通过硅胶色谱法(环己烷/乙酸乙酯19:1)纯化残余物。
产量:38.0g(理论值的79%)
实施例iv
1-溴-4-(1-甲氧基-d-吡喃葡萄糖-1-基)-2-(苯氧基甲基)-苯
将含于thf(11ml)中的2miprmgcl溶液添加至悬浮于thf(11ml)中的无水licl(0.47g)中。在室温搅拌该混合物直到所有licl溶解。在氩气氛下,将该溶液滴加至4-溴-1-碘-3-苯氧基甲基-苯(8.0g)在四氢呋喃(40ml)中的冷却至-60℃的溶液中。将溶液升温至-40℃接着添加含于四氢呋喃(5ml)中的2,3,4,6-四-o-(三甲基甲硅烷基)-d-吡喃葡萄糖酮(10.7g,90%的纯度)。将所得溶液在冷却浴中升温至-5℃并在该温度另外搅拌30min。添加nh4cl水溶液并利用乙酸乙酯萃取所得混合物。经硫酸钠干燥合并的有机萃取物并减压下除去溶剂。将残余物溶于甲醇(80ml)中并利用甲磺酸(0.6ml)处理以单独产生更稳定的正位异构体(anomer)。在35-40℃搅拌反应溶液过夜后,利用固体nahco3中和溶液并减压下除去甲醇。利用nahco3水溶液稀释剩余物并利用乙酸乙酯萃取所得混合物。经硫酸钠干燥合并的萃取物并蒸发溶剂以产生粗产物,其无需纯化即进行还原。
产量:7.8g(理论值的93%)
实施例v
1-溴-4-(2,3,4,6-四-o-乙酰基-d-吡喃葡萄糖-1-基)-2-(苯氧基甲基)-苯
以使温度保持低于-10℃的速率,将三氟化硼乙醚(4.9ml)添加至1-溴-4-(1-甲氧基-d-吡喃葡萄糖-1-基)-2-(苯氧基甲基)-苯(8.7g)及三乙基硅烷(9.1ml)在二氯甲烷(35ml)及乙腈(50ml)中的冷却至-20℃的溶液中。历时1.5h将所得溶液升温至0℃接着利用碳酸氢钠水溶液处理。搅拌所得混合物0.5h,除去有机溶剂并利用乙酸乙酯萃取残余物。经硫酸钠干燥合并的有机层并除去溶剂。将残余物溶于二氯甲烷(50ml)及吡啶(9.4ml)中,按序添加乙酸酐(9.3ml)及4-二甲基氨基吡啶(0.5g)至该溶液中。在环境温度搅拌该溶液1.5h接着利用二氯甲烷稀释。利用1m盐酸洗涤该溶液两次并经硫酸钠干燥。在除去溶剂后,使残余物自乙醇重结晶以提供呈无色固体的产物。
产量:6.78g(理论值的60%)
质谱(esi+):m/z=610/612(br)[m+nh4]+
实施例vi
2-(苯氧基甲基)-4-(2,3,4,6-四-o-乙酰基-d-吡喃葡萄糖-1-基)-苯甲腈
利用氩气冲洗装有氰化锌(1.0g)、锌(30mg)、pd2(二亚苄基丙酮)3*chcl3(141mg)及三叔丁基
产量:4.10g(理论值的84%)
质谱(esi+):m/z=557[m+nh4]+
或者,在210℃,由1-溴-4-(2,3,4,6-四-o-乙酰基-d-吡喃葡萄糖-1-基)-2-(苯氧基甲基)-苯开始,利用含于nmp中的氰化亚铜(i)(2当量),合成上述化合物。
实施例vii
2-溴甲基-4-(2,3,4,6-四-o-乙酰基-d-吡喃葡萄糖-1-基)-苯甲腈
将含于乙酸(15ml)中的33%氢溴酸溶液添加至含于乙酸(10ml)中的2-苯氧基甲基-4-(2,3,4,6-四-o-乙酰基-d-吡喃葡萄糖-1-基)-苯甲腈(0.71g)及乙酸酐(0.12ml)的溶液中。在55℃搅拌所得溶液6h接着在冰浴中冷却。利用冷冻碳酸钾水溶液中和反应混合物,并利用乙酸乙酯萃取所得混合物。经硫酸钠干燥合并的有机萃取物并减压下除去溶剂。将残余物溶于乙酸乙酯/环己烷(1:5)中,通过过滤分离沉淀物并在50℃干燥以产生纯产物。
产量:0.52g(理论值的75%)
质谱(esi+):m/z=543/545(br)[m+nh4]+
实施例viii
4-环丙基-苯基硼酸
将含于己烷(14.5ml)中的2.5m正丁基锂溶液滴加至溶于thf(14ml)及甲苯(50ml)并冷却至-70℃的1-溴-4-环丙基-苯(5.92g)中。在-70℃搅拌所得溶液30min,然后添加硼酸三异丙酯(8.5ml)。将溶液升温至-20℃接着利用4m盐酸水溶液(15.5ml)处理。将反应混合物进一步升温至室温接着分离有机相。利用乙酸乙酯萃取水相并干燥(硫酸钠)合并的有机相。蒸发溶剂并利用醚与环己烷的混合物洗涤残余物以产生呈无色固体的产物。
产量:2.92g(理论值的60%)
质谱(esi-):m/z=207(cl)[m+hcoo]-
化合物a的制备:
1-氰基-2-(4-环丙基-苄基)-4-(β-d-吡喃葡萄糖-1-基)-苯
向填充ar的烧瓶中添加2-溴甲基-4-(2,3,4,6-四-o-乙酰基-d-吡喃葡萄糖-1-基)-苯甲腈(1.60g)、4-环丙基-苯基硼酸(1.0g)、碳酸钾(1.85g)及丙酮与水的3:1脱气混合物(22ml)。在室温搅拌混合物5min,然后在冰浴中冷却。接着添加二氯化钯(30mg)并在环境温度搅拌反应混合物16h。接着利用盐水稀释混合物并利用乙酸乙酯萃取。经硫酸钠干燥合并的萃取物并减压下除去溶剂。将残余物溶于甲醇(20ml)并利用4m氢氧化钾水溶液(4ml)处理。在环境温度下搅拌所得溶液1h接着利用1m盐酸中和。蒸发甲醇,利用盐水稀释残余物并利用乙酸乙酯萃取。经硫酸钠干燥所收集的有机萃取物,并除去溶剂。在硅胶上色谱分离(二氯甲烷/甲醇1:0->8:1)残余物。
产量:0.91g(理论值的76%)
质谱(esi+):m/z=413[m+nh4]+
与l-脯氨酸的结晶复合物(1:1)的制备
将溶于2.1ml乙醇与水的混合物(10:1的体积比)中的l-脯氨酸(0.34g)添加至溶于2ml乙醇中的1-氰基-2-(4-环丙基-苄基)-4-(β-d-吡喃葡萄糖-1-基)-苯(1.17g,按上述的方式获得)的溶液中。在环境温度静置所得溶液。约16h后,通过过滤分离出呈白色晶体的结晶复合物。若需要,可通过利用例如玻璃棒或金属刮刀刮擦或通过以晶种接种而引发结晶。通过在略高温度(30至50℃)、真空下储存晶体约4h以除去残留溶剂,以产生l-脯氨酸与1-氰基-2-(4-环丙基-苄基)-4-(β-d-吡喃葡萄糖-1-基)-苯的结晶1:1复合物1.27g。
根据以上制法获得若干批次的结晶复合物。x-射线粉末衍射图一致。经由dsc测定熔点并评估为起始温度。熔点的实例为约89℃、90℃、92℃、101℃及110℃。如表1所涵盖及如图1所描绘的x-射线粉末衍射图及图2中的dsc及tg图,对应于具有约90℃的熔点的批次。
具体地,本发明涉及如下各项:
1.1-氰基-2-(4-环丙基-苄基)-4-(β-d-吡喃葡萄糖-1-基)-苯与一种或多种天然氨基酸之间的结晶复合物。
2.项1的结晶复合物,其特征在于该天然氨基酸为脯氨酸。
3.项2的结晶复合物,其特征在于该结晶复合物为1-氰基-2-(4-环丙基-苄基)-4-(β-d-吡喃葡萄糖-1-基)-苯与脯氨酸的摩尔比范围为约2:1至约1:3的复合物。
4.项2或3的结晶复合物,其特征在于每摩尔1-氰基-2-(4-环丙基-苄基)-4-(β-d-吡喃葡萄糖-1-基)-苯的含水量为约0至3摩尔范围内。
5.项2、3或4的结晶复合物,其特征在于x-射线粉末衍射图包含在20.28、21.14及21.64°2θ(±0.1°2θ)的峰,其中该x-射线粉末衍射图是利用cukα1射线制得的。
6.项5的结晶复合物,其中该x-射线粉末衍射图进一步包含在4.99及23.23°2θ(±0.1°2θ)的峰,其中该x-射线粉末衍射图是利用cukα1射线制得的。
7.项5或6的结晶复合物,其中该x-射线粉末衍射图进一步包含在17.61、17.77及27.66°2θ(±0.1°2θ)的峰,其中该x-射线粉末衍射图是利用cukα1射线制得的。
8.项1的结晶复合物,其中至少50%的该复合物作为项5、6或7的结晶复合物存在。
9.药物组合物,其包含项1至8中一项或多项的一种或多种结晶复合物。
10.项1至8中一项或多项的结晶复合物,其用作药物。
11.项1至8中一项或多项的结晶复合物,其用于治疗或预防可通过抑制钠依赖性葡萄糖协同转运蛋白sglt影响的疾病或病症。
12.项1至8中一项或多项的结晶复合物,其用于抑制钠依赖性葡萄糖协同转运蛋白sglt2。
13.制备项1至8中一项或多项的结晶复合物的方法,该方法包括下列步骤:
(a)制备1-氰基-2-(4-环丙基-苄基)-4-(β-d-吡喃葡萄糖-1-基)-苯与一种或多种天然氨基酸于溶剂或溶剂混合物中的溶液;
(b)储存该溶液,使结晶复合物自溶液中沉淀析出;
(c)从该溶液中除去沉淀物;和
(d)任选地干燥该沉淀物直到已经除去任何过量的所述溶剂或溶剂混合物。
- 还没有人留言评论。精彩留言会获得点赞!