一种基于细胞的PCSK9抑制剂筛选方法与流程
本发明属于pcsk9抑制剂技术领域,具体涉及一种基于细胞的pcsk9抑制剂筛选方法。
背景技术
动脉粥样硬化是心血管系统疾病中最常见的疾病,也是危害人类健康的常见病。动脉粥样硬化的特点是受累动脉的病变从内膜开始,先后有多种病变合并存在,包括局部有脂质和复合糖类积聚、纤维组织增生和钙质沉着形成斑块,并有动脉中层的逐渐退变,继发性病变尚有斑块内出血、斑块破裂及局部血栓形成(称为粥样硬化-血栓形成,atherosclerosis-thrombosis)。由于在动脉内膜积聚的脂质外观呈黄色粥样,因此称为动脉粥样硬化。
pcsk9是kexin样前转化酶枯草杆菌蛋白酶家族的第9个成员,由692个氨基酸残基组成,主要表达于肝脏、肾脏以及小肠,并且作为一个分泌性蛋白存在于血液中。pcsk9主要在内质网合成,首先形成一个75kda的前体,其未成熟的前体包含一个n端信号肽序列、一个前结构域、一个催化结构域和一个富含半光氨酸的c端结构域。随后在内质网中pcsk9在其第152位残基处经历一次自动催化性裂解,形成一个14kda的前结构域片段和一个包含催化结构域和c端结构域的57kda成熟片段。裂解后的前结构域仍然以非共价键结合在催化结构域上,与成熟片段形成一个复合体,并作为一个分子伴侣与成熟片段一起离开内质网转运到高尔基体中,在高尔基体中经过乙酰化等一系列修饰后最终分泌到血液中。前结构域的结合可能发挥着抑制蛋白酶催化活性的作用,是pcsk9正确折叠并离开内质网所必需的。大多数前蛋白转化酶在离开内质网后会经历二次蛋白酶解加工作用,从而释放前结构域,暴露酶活性。而离开内质网后的pcsk9没有经历这种二次加工过程,因此pcsk9是唯一没有蛋白质底物的枯草杆菌蛋白酶样丝氨酸蛋白酶。肝脏是血液中pcsk9的主要来源。由于检测时使用的特异性抗体以及标准值的不同,人血浆中pcsk9浓度的平均值变化范围较大。
他汀类药物是目前应用最广的降脂药物,是预防和治疗动脉粥样硬化性心血管疾病的基石,然而他汀类药物的局限性日益显露,研发针对脂类代谢不同靶点的新型降脂药物成为热点之一,随着pcsk9的发现,pcsk9抑制剂这类新型降脂药受到极大的关注,为降脂治疗提供了更多的选择,为很多无法耐受他汀类药物及他汀治疗效果不佳的患者带来福音。
pcsk9具有强大的降低ldl-c的作用。安慰剂对照研究表明,pcsk9抑制剂能够使ldl-c水平较基线降低50%~70%。每2周给予evolocumab140mg皮下注射,能够使ldl-c从115mg/dl~124mg/dl降至39mg/dl~49mg/dl。除了ldl-c的减少,动脉粥样斑块负荷和动脉粥样硬化解剖也与心血管不良事件相关。研究发现,与安慰剂组相比,每月evolocumab420mg皮下注射,动脉粥样硬化体积百分比下降0.95%,差异有统计学意义,且64.3%的患者粥样斑块消退。而且evolocumab的不良反应少,发生比例非常低,尚未见重大不良事件。上述提到了他汀类药物的多项副作用,pcsk9抑制剂具有良好的安全性和耐受性。此外,gauss-3研究发现pcsk9抑制剂可以帮助降低他汀类药物的耐药性。而且,sler和odyssey两项试验都表明pcsk9抑制剂能够明显降低死亡、心肌梗死、缺血性中风等心脑血管事件。因此,筛选研发治疗动脉粥样硬化引起的心肌梗死、缺血性中风等心脑血管疾病的pcsk9抑制剂有重要意义。
传统的pcsk9抑制剂的筛选时基于阻碍pcsk9蛋白和ldlr结合而设计的,hepg2细胞是一种肝癌细胞,细胞表面存在低密度脂蛋白胆固醇受体(ldlr),也可以分泌表达pcsk9,但是浓度特别低,由于pcsk9的表达量特别低,所以用于筛选的窗口就特别窄,所以在细胞水平,往往进行单剂量的功能验证,很难进行ic50的计算,影响pcsk9抑制剂的筛选。因此,现有技术存在的问题是,细胞中pcsk9的表达量特别低,所以用于筛选的窗口特别窄,增加了pcsk9抑制剂的筛选难度。
技术实现要素:
本发明提供的一种基于细胞的pcsk9抑制剂筛选方法,解决了现有细胞中pcsk9的表达量特别低,所以用于筛选的窗口特别窄,增加了pcsk9抑制剂筛选难度的问题。
本发明的目的是提供一种基于细胞的pcsk9抑制剂筛选方法,包括以下步骤:
s1,细胞的处理
s11,传代细胞,收集待测细胞样品;所述细胞为肝类细胞;
s12,加药处理
利用dmso或者pbs溶解所述待测细胞样品,加入待测药物和重组rhpcsk9;培养细胞20-24h,得到加药处理细胞液;其中所述重组rhpcsk9是根据人pcsk9基因的cdna序列合成pcsk9基因,然后将pcsk9基因整合入真核表达载体pcmv-c-his,得到的真核表达载体pcmv-pcsk9-his;其中所述待测药物为待筛选的pcsk9抑制剂;
s2,使用ripa细胞裂解液裂解细胞,并收集裂解后的上清液;
s3,western-blot检测
s2中所得上清液进行上样前处理,处理后上清溶液进行western-blot,检测ldlr抗体含量,同时利用β-actin蛋白作为内标标定蛋白总量,比较ldlr抗体和β-actin蛋白的检测结果,ldlr抗体的条带灰度值与β-actin蛋白的条带灰度值比值越大,证明该待测药物对pcsk9的抑制效果越强。
优选的,上述基于细胞的pcsk9抑制剂筛选方法,所述肝类细胞为hepg2细胞。
优选的,上述基于细胞的pcsk9抑制剂筛选方法,s12中,所述待测药物为evolocumab,加入evolocumab后使加药处理细胞液中该药物的浓度为50-100nmol/l。
优选的,上述基于细胞的pcsk9抑制剂筛选方法,每100ml待测细胞样品加入的dmso≤0.5ml。
优选的,上述基于细胞的pcsk9抑制剂筛选方法,s2的具体步骤如下:
s21,吸出并弃去加药处理细胞液中培养液,保留细胞沉淀;
s22,pbs漂洗细胞沉淀两次;
s23,向ripa细胞裂解液中加入蛋白酶抑制剂pi,蛋白酶抑制剂pi与ripa细胞裂解液的体积比例为1:99,混匀得到染料-裂解液复合物,2-3min后向细胞沉淀加入染料-裂解液复合物,吹散细胞,并将细胞移至离心管内,冰上孵育20min;14000rpm离心10min,取上清液至新的离心管,得到上清液。
优选的,上述基于细胞的pcsk9抑制剂筛选方法,所述pbs为pbsbuffer或者0.1mol/l、ph=7.4的pbs缓冲液,其中pbsbuffer的配制方法如下:称取nacl8g,kcl0.2g,na2hpo41.42g,kh2po40.27g;加入800ml的纯水,充分搅拌溶解,加浓hcl调至ph7.4;加纯水将溶液定容至1l。
优选的,上述基于细胞的pcsk9抑制剂筛选方法,上清液进行上样前处理的具体步骤如下:
(1)调整上清液的蛋白浓度为1μg/μl,得到特定浓度溶液;
(2)取24μl特定浓度溶液加入6μl上样缓冲液,得到复合溶液;
(3)变性蛋白:复合溶液于100℃水浴加热10min,2000rpm离心2min,冷却到室温,即得到处理后上清溶液。
与现有技术相比,本发明提供的基于细胞的pcsk9抑制剂筛选方法具有以下有益效果:
本发明方法通过往细胞中添加重组pcsk9蛋白,找到最佳的添加浓度和作用时间,扩大pcsk9与肝类细胞上ldlr的作用窗口,更容易进行pcsk9抑制剂的筛选。
附图说明
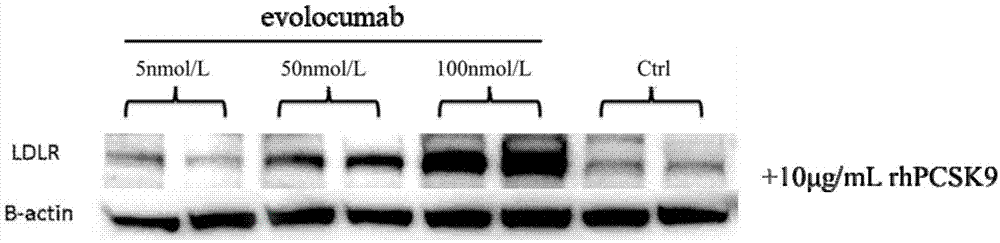
图1是添加了10μg/ml重组rhpcsk9的western-blot图;
图2是未添加重组rhpcsk9的western-blot图。
具体实施方式
下面结合具体实施例对本发明进行详细说明,但不应理解为本发明的限制。下列实施例中未注明具体条件的试验方法,通常按照常规条件操作,由于不涉及发明点,故不对其步骤进行详细描述。
本发明提供的一种基于细胞的pcsk9抑制剂筛选方法,包括以下步骤:
s1,细胞的处理
s11,传代细胞,收集待测细胞样品;所述细胞为肝类细胞;
s12,加药处理
利用dmso或者pbs溶解所述待测细胞样品,加入待测药物和重组rhpcsk9;培养细胞20-24h,得到加药处理细胞液;其中所述重组rhpcsk9是根据人pcsk9基因的cdna序列合成pcsk9基因,然后将pcsk9基因整合入真核表达载体pcmv-c-his,得到的真核表达载体pcmv-pcsk9-his;其中所述待测药物为待筛选的pcsk9抑制剂;
s2,使用ripa细胞裂解液裂解细胞,并收集裂解后的上清液;
s3,western-blot检测
s2中所得上清液进行上样前处理,处理后上清溶液进行western-blot,检测ldlr抗体含量,同时利用β-actin蛋白作为内标标定蛋白总量,比较ldlr抗体和β-actin蛋白的检测结果,ldlr抗体的条带灰度值与β-actin蛋白的条带灰度值比值越大,证明该待测药物对pcsk9的抑制效果越强。
优选的,本发明提供的一种基于细胞的pcsk9抑制剂筛选方法,具体包括以下实施例。
下述实施例中,所用实验试剂如下:(1)0.25g/100ml胰酶;(2)mem完全培养液;(3)pbs缓冲液(0.1mol/l,ph=7.4);(4)ripa细胞裂解液(康为生物);(5)pbsbuffer(配制方法如下:称nacl8g,kcl0.2g,na2hpo41.42g,kh2po40.27g;加入800ml的纯水(ro水),充分搅拌溶解,加浓hcl调至ph7.4;加纯水将溶液定容至1l后,室温保存);(6)12%分离胶10ml(配方如下:3.3ml纯水,4.0ml30%丙烯酰胺溶液,2.5ml1.5mtris-hcl(ph8.8),0.1ml10%sds,0.1ml10%过硫酸铵,0.004mltemed);(7)5%浓缩胶2ml(3.4ml纯水,0.83ml30%丙烯酰胺溶液,0.63ml1.5mtris-hcl(ph8.8)(配方:0.05ml10g/100mlsds,0.05ml10%过硫酸铵,0.005mltemed);(8)电泳缓冲液(称glycine94g,tris15.1g,sds5.0g置于1l烧杯中;加入800ml的纯水,搅拌溶解;加纯水将溶液定容至1l后,室温保存);(9)封闭液(5%脱脂奶粉,配制方法如下:称取2.5g脱脂奶粉置于50ml试管中,加tbst适量,摇匀,50ml量筒定容);(10)转膜液(配制方法如下:称量glycine14.4g,tris3.03g,置于1l烧杯中;向烧杯中加入600ml纯水,充分搅拌溶解,定容至800ml;再加入200ml甲醇;室温保存);(11)1mtris-cl(ph7.4)(称取121.1gtris溶剂溶解于800ml水中;加浓盐酸70ml;定容至1l);(12)10%tween20(配制方法如下:量取tween2050ml至500ml烧杯中;向烧杯中加入300ml纯水,充分搅拌溶解,定容至500ml);(13)tbst(配制方法如下:称取9gnacl于烧杯中,加800ml纯水;加2ml体积分数10﹪tween20后充分混匀;加1mtris-cl(ph7.4)10ml,充分搅拌混匀,定容至1l);(14)bca试剂盒(康为生物);(15)ecl试剂盒(索莱宝);(16)丽春红染液(索莱宝);(17)evolocumab(美国安进公司repatha).
下述实施例中,所用实验器材如下:5%co2培养箱,12孔板,离心机,96孔板,酶标仪,水浴锅,电泳装置,转膜仪,化学发光成像仪。
实施例1
一种基于细胞的pcsk9抑制剂筛选方法,包括以下步骤:
s1,hepg2细胞的处理
s11,传代hepg2细胞
将3×105个/ml浓度的hepg2细胞传代至12孔板,5%co2,37℃培养箱培养24h,细胞生长至50%-60%汇合度;
s12,加药处理
利用dmso(二甲基亚砜)或者pbsbuffer或者0.1mol/l、ph=7.4的pbs缓冲液溶解所述待测细胞样品,加入阳性药物evolocumab(所述待测药物为待筛选的pcsk9抑制剂)和重组rhpcsk9,并使加药处理细胞液中该evolocumab的浓度为100nmol/l,使重组rhpcsk9的终浓度为10μg/ml;之后将样品转移到12孔板细胞中,继续培养细胞24h,得到加药处理细胞液;每100ml待测细胞样品加入的dmso(二甲基亚砜)为0.5ml。
其中,重组rhpcsk9参照专利cn107267491所述的方法构建成pcmv-pcsk9-his载体,即根据人pcsk9基因的cdna序列合成pcsk9基因,然后将pcsk9基因整合入真核表达载体pcmv-c-his,得到真核表达载体pcmv-pcsk9-his,该真核表达载体pcmv-pcsk9-his可在细胞内表达出较多量的重组pcsk9蛋白;
s2,使用ripa细胞裂解液裂解细胞,并收集裂解后的上清液
s21,吸出并弃去加药处理细胞液中培养液,保留细胞沉淀;
s22,每孔加2mlpbsbuffer或者2ml0.1mol/l、ph=7.4的pbs缓冲液漂洗细胞沉淀两次;
s23,向ripa细胞裂解液中蛋白酶抑制剂pi,pi与ripa细胞裂解液的体积比例为1:99,混匀得到染料-裂解液复合物,2min后向每孔的细胞沉淀加入染料-裂解液复合物200μl,吹散细胞,并将细胞移至1.5ml离心管内,冰上孵育20min裂解细胞;14000rpm离心10min,取上清液至新的1.5ml离心管,得到上清液;bca蛋白定量法定量上清液中蛋白含量。
s3,western-blot检测
s2中所得上清液进行上样前处理,处理后上清溶液进行western-blot,检测ldlr抗体含量,同时利用β-actin蛋白作为内标标定蛋白总量,比较ldlr抗体和β-actin蛋白的检测结果ldlr抗体的条带灰度值与β-actin蛋白的条带灰度值比值越大(越强),证明该evolocumab药物对pcsk9的抑制效果越强。
s31,蛋白溶液上样前处理如下:
(1)调整s2中所得上清液的蛋白浓度为1μg/μl,得到特定浓度溶液;
(2)取24μl特定浓度溶液加入6μl上样缓冲液(1m、ph6.8的tris-hcl1.25ml,0.5gsds,25mgbpb(溴酚蓝),2.5ml甘油,0.25mlβ-巯基乙醇,去离子水定容至5ml),得到复合溶液;
(3)变性蛋白:复合溶液于100℃水浴加热10min,2000rpm离心2min,冷却到室温,即得到处理后上清溶液;
s32,western-blot
a,清洗玻璃板
b,制备8%分离胶10ml
取15ml试管,加4.6ml纯水,2.7ml30%丙烯酰胺溶液,2.5ml1.5mol/ltris-hcl(ph8.8),0.1ml10%sds,0.1ml10%过硫酸铵,0.01mltemed,混匀,沿玻璃板边沿快速注2块胶,注胶的高度为离玻璃板顶部1cm。用正丁醇加满玻璃板槽压胶,40min凝胶后将正丁醇倒掉,并用纯水冲洗分离胶8次。
c,制备5%浓缩胶5ml
取5ml试管,加3.4ml纯水,0.83ml30%丙烯酰胺溶液,0.63ml1.0mol/ltris-hcl(ph6.8),0.05ml10%sds,0.05ml10%过硫酸铵,0.005mltemed,沿玻璃板边沿快速注胶,并快速插入梳子。
d,上样
把凝好的胶放入电泳槽内加入sds-page电泳缓冲液,轻轻拔掉梳子,样品每孔上样(处理后上清溶液)36μl,蛋白marker上样5μl,加入凝胶孔内,80v电压,2h待溴酚蓝刚刚跑出凝胶下面时,停止电泳轻轻撬动玻璃板,取出凝胶,拔掉浓缩胶,。
e,膜的预处理
剪一块和胶大小一致的pvdf膜和两块同样大小的滤纸(5cm,7.5cm),把pvdf膜入甲醇中处理1min,取出后入纯水中漂洗,把滤纸、凝胶和漂洗过的pvdf膜放入转膜液中,浸泡10min。
f,转膜
按照滤纸、pvdf膜、凝胶、滤纸的顺序从正极到负极依次铺好,每铺一层用玻璃板赶出其中可能存在的气泡,转膜仪槽中加入转膜液,60ma恒流在搅拌情况下转膜90min。
g,丽春红染色
转膜完成后用纯水清洗一次,丽春红染色10min,然后用tbst漂洗至脱色完全。
h,封闭
把pvdf膜放入封闭液,排气泡,封口,37℃摇床孵育1h。
i,一抗孵育
beta-actin抗体1:20000稀释:取0.4μl一抗加8mltbst,混匀。
ldlr抗体1:1000稀释:取2μl一抗加2mlpbst,混匀。
把封闭后的pvdf膜在43kd处剪开,放入抗体溶液中,4℃一抗过夜,孵育完成后,tbst洗膜6次,每次5min。
j,二抗孵育
把一抗对应的二抗用pbst1:5000稀释,取1μl一抗加5mltbst混匀,pvdf膜放入抗体溶液中,室温孵育1h,孵育完成后tbst洗膜6次,每次5min。
k,ecl显色
分别取3ml的ecl-a和ecl-b,混匀,放置使之至室温,用镊子取出漂洗过的膜用纯水冲洗一次,搭在滤纸上沥干洗液,将膜放入孵育盒中加显色液,孵育3min,沥干显色液,在化学发光成像仪中曝光,拍照。
其中,western-blot结果如图1-2所示,其中图1是“s12中”添加了10μg/ml重组rhpcsk9的western-blot图;图2是“s12中”未添加重组rhpcsk9的western-blot图。从图1可以看出,当evolocumab的添加量为100nmol/l,重组rhpcsk9的添加量为10μg/ml时条带亮度显著高于其他组,说明rhpcsk9的添加量可扩大pcsk9与ldlr的作用窗口,准确的筛选出降低肝细胞表面ldlr的阳性化合物,在pcsk9抑制剂筛选方面提供有力的依据,为该类新药的研发提供保障。从图2中可以看出未添加重组rhpcsk9时,各组间条带灰度值的显著小于添加重组rhpcsk9的各组。
需要说明的是,本发明中涉及数值范围时,应理解为每个数值范围的两个端点以及两个端点之间任何一个数值均可选用,由于采用的步骤方法与实施例相同,为了防止赘述,本发明描述了优选的实施例。尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例做出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 还没有人留言评论。精彩留言会获得点赞!