用于制备PVA水凝胶的方法、使用其制备的PVA水凝胶及复合材料与流程
本发明涉及用于制备聚乙烯醇(pva)水凝胶的方法、使用其制备的pva水凝胶及复合材料。
背景技术
聚乙烯醇(pva)是由碳、氧和氢原子组成的最重要的合成聚合物之一,并且在有氧和无氧条件下均可生物降解,广泛用于商业、工业、医疗和营养保健领域。pva可以很容易地溶解在水中。pva对于生物医学、组织工程和软机器人应用是非常重要的。
目前,pva水凝胶通常通过两种常用机制合成,包括使用交联剂如谷氨酸盐的化学键合和/或如冷冻和融化的物理方式。采用这两种方式制备pva水凝胶均存在制备过程复杂、难于控制交联度等问题。人们期望能开发一种方法,其能以简便的方式制备性能优异的pva水凝胶,使得pva水凝胶能更合适地应用在植入式电子学、纳米医学和微创技术以及生物医学等领域。
技术实现要素:
本发明人意外地发现,通过使用碱性溶液对pva进行凝胶化可以简便的方式获得pva水凝胶。通过引入这种新颖的凝胶化机制,可获得能应用于各种领域的具有优异性能的pva水凝胶。
本发明提供了一种pva水凝胶,该pva水凝胶具有1mpa-20mpa的弹性模量和10mpa-100mpa的极限强度。
进一步地,本发明的pva水凝胶在加入水时具有65-95%的变形恢复率。优选地,本发明的pva水凝胶在加入水时具有70-92%的变形恢复率。此处,变形恢复率通过下式计算:变形恢复率=pva水凝胶在加入水时的变形恢复长度/pva水凝胶的拉伸变形长度。
进一步地,本发明的pva水凝胶的接触角为15-20度。
本发明还涉及一种复合材料,其包括该pva水凝胶。
优选地,所述复合材料包括该pva水凝胶和掺入在该pva水凝胶内的磁性纳米粒子。
优选地,所述复合材料包括该pva水凝胶和掺入在该pva水凝胶内的石墨烯。
优选地,所述复合材料包括该pva水凝胶和掺入在该pva水凝胶内的碳纳米管。
优选地,所述复合材料包括该pva水凝胶和掺入在该pva水凝胶内的尿素。
优选地,所述复合材料包括由该pva水凝胶形成的层和涂覆在该pva水凝胶上的聚苯胺。
优选地,所述复合材料包括依次层叠的由含有银纳米颗粒的pva水凝胶形成的层、由pva水凝胶形成的层和由含有碳纳米管的pva水凝胶形成的层。
本发明还涉及一种新颖的制备pva水凝胶的方法,其包括将分子量为100-1000k的聚乙烯醇与水混合获得pva溶液,接着将pva溶液倒入培养皿,经干燥后制得pva膜,之后将pva膜浸入摩尔浓度为1~10m的碱性溶液中,获得pva水凝胶。与现有的制备pva水凝胶的方法相比,本发明的方法能以更简便的方式制造性能优异的pva水凝胶。
在本发明的方法中,作为碱性溶液的例子,包括naoh、koh、lioh、氨水、碳酸钠、碳酸氢钠等的溶液。
考虑到pva水凝胶的力学性能,优选地,碱性溶液为naoh溶液或koh溶液,摩尔浓度为3~10m。更优选地,碱性溶液为naoh溶液或koh溶液,摩尔浓度为3~6m。
优选地,本发明的方法还包括用纯水洗涤pva水凝胶。
优选地,本发明的方法还包括对该pva水凝胶进行脱水处理。该脱水处理能进一步提高pva水凝胶的机械强度。
优选地,该脱水处理为在室温下空气干燥2-8小时。
优选地,该脱水处理使用微型风扇在室温下干燥2-5小时。
优选地,在本发明的方法中,聚乙烯醇与水按质量比1:5~1:30混合,并在60℃的振荡浴中放置过夜,获得pva溶液。
优选地,在本发明的方法中,聚乙烯醇与水混合获得浓度为10%的pva溶液,以及该pva溶液与碱性溶液之间按重量份数计的比率为1:3-10。
优选地,pva溶液倒入培养皿后在室温下干燥8-24小时。
优选地,pva膜浸入碱性溶液中1-60分钟;进一步优选地,pva膜浸入碱性溶液中10-20分钟。
本发明还涉及使用上述方法制得的pva水凝胶,所述pva水凝胶具有优异的力学性能、形状记忆性、亲水性、生物相容性、3d可打印性或可注射性等性能。
本发明还涉及pva水凝胶的应用,用于制造导管、可3d打印的溶液、可注射电子器件、微流体通道、生物可吸收传感器、微型机器人中的任一种。
本发明还涉及pva水凝胶的应用,用于制造组织工程支架、手术缝合线、医用手套和避孕套中的任一种。
本发明通过用碱性溶液将pva凝胶化,可提供具有优异的力学性能、形状记忆性、亲水性、生物相容性、3d可打印性或可注射性等性能的多功能聚乙烯醇水凝胶。通过本发明的新的凝胶化机制,可将pva与其他材料组合制成新的复合材料。从3d打印和微流控技术中受益的能力为这种用于不同工业领域的新型材料的商业化提供了很大的希望。本发明可提供一种强韧的pva水凝胶,其可承载比其重量高1500倍的重量。该pva水凝胶的简易制造工艺和生物相容性不仅可以代表下一代电阻导管的良好候选,而且还可以结合基于导管的监测系统。考虑到其良好的形状记忆性,可将由此制得的pva水凝胶用于制造组织工程支架、手术缝合线、医用手套和避孕套中。该新型材料提出了无数在药物输送、生物医学装置、生物机器人和生物医学领域中的应用。
附图说明
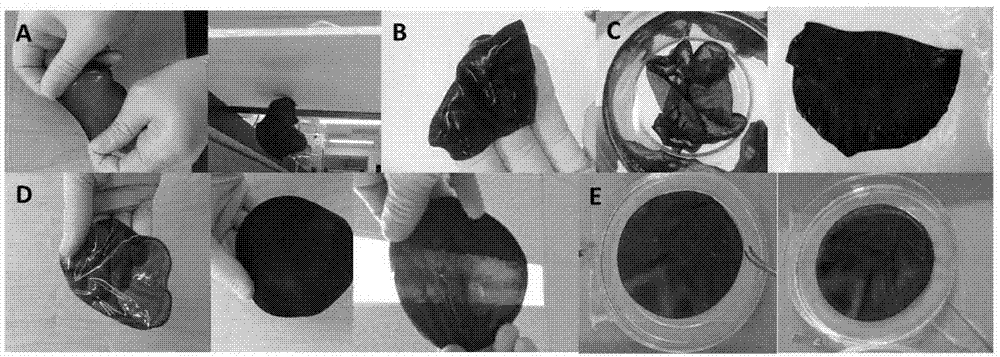
图1所示为通过本发明的方法将10%pva溶液与不同纳米材料组合制得的基于pva水凝胶的复合材料,其中图a为pva与mnp(磁性纳米粒子)的组合;图b为pva与剥离石墨烯的组合;图c为含cnt(碳纳米管)的pva超薄膜;图d为经过一次涂覆和多次涂覆后涂有pani(聚苯胺)的pva;图e为通过涂有pani的pva进行颜色变化的ph感应。
图2a所示为完全水解的pva的化学结构,图2b所示为部分水解的pva的化学结构。
图3a所示为部分水解的pva水溶液的化学结构,图3b显示干的pva膜通过加入具有强氢键的浓缩naoh溶液而固化。
图4a所示为本发明的用摩尔浓度为6m的naoh制备的pva水凝胶的atr-ftir结果,图4b所示为干的原始pva膜的atr-ftir结果。
图5所示为本发明的以不同比率混合pva和尿素获得的水凝胶的sem图(用于测定溶胀比),其中图a为将pva和尿素按质量百分比以90:10的比率混合并倒入培养皿中,干燥后经氢氧化钠凝胶化获得的水凝胶,图b为将5ml尿素(摩尔浓度为8m)与5mlpva(添加0.4grpva粉末)混合,干燥后用氢氧化钠进行凝胶化获得的样品。
图6所示为本发明的由不同浓度naoh(摩尔浓度分别为1m、3m和6m)制成的pva水凝胶的atr-ftir结果。
图7a、7b和7c分别为本发明的用摩尔浓度为1m、3m和6m的naoh制备的pva水凝胶的照片。
图8所示为本发明的用不同种类和不同浓度的氢氧化物固化的10%pva水凝胶的拉伸结果,其中图8a为拉伸测试期间pva水凝胶的照片;图8b为用不同浓度的naoh制备的pva水凝胶的应力-应变曲线和弹性模量(使用浓度分别为3m、5m和6m的naoh制得的样品的尺寸(长度、宽度和厚度)为15、5、0.1(单位:mm),使用浓度为1m的naoh制得的样品的尺寸为(长度、宽度和厚度)12、5、0.05(单位:mm),测试速度为10mm/min);图8c为用koh、naoh和lioh制备的pva水凝胶的应力-应变曲线和弹性模量(使用koh和naoh制得的样品的尺寸(长度、宽度和厚度)为15、5、0.1(单位:mm);使用lioh制得的样品的尺寸(长度、宽度和厚度)为15、3、0.05(单位:mm),测试速度为10mm/min);图8d为用naoh(摩尔浓度为6m)固化的pva水凝胶的拉伸结果并测试3次(样品尺寸(长度、宽度和厚度):120、10、0.3(单位:mm)(位于最下端的曲线);118、10、0.3(单位:mm)(位于中间的曲线);111、10、0.3(单位:mm)(位于最上端的曲线),速度为5mm/min);图8e为将pva水凝胶条带空气干燥2.5小时的拉伸性能(5mm/min的测试速度,样品尺寸为111、10、0.3(单位:mm)(位于上端的曲线)(第2次);94、10、0.3(mm)(位于下端的曲线)(第1次));图8f为在室内条件下的循环拉伸试验(通过倒入20mlpva制成的pva样品被切割成长度、宽度和厚度分别为17、5和0.1(单位:mm)的尺寸);图8g为当使用外部湿度产生增湿器以避免试验过程中脱水时,pva水凝胶的循环拉伸试验(用20毫升pva溶液制成长度、宽度和厚度分别为25、5和0.1(单位:mm)的水凝胶,测试速度为20mm/min),其中左上图、右上图和左下图分别为在12%-40%、22%-70%和25%-100%的应变范围内进行循环,右下图为同一样品在保湿条件下的应力-应变曲线。
图9a所示为本发明的pva水凝胶的耐尖锐物体性,图9b所示为用pva-pani涂层带承载15kg重量。
图10所示为pva水凝胶在加热下的降解试验,其中图10a、10b和10c为常规pva水凝胶膜的sem观察图;图10d、10e和10f为在70℃下加热30分钟的pva膜的sem图像,其中图10a、10b、10d、10e的样品在sem之前镀金,图10c和10f的样品没有镀金。
图11所示为测量的接触角(ca),其中图11a显示对于pdms,ca=92.718°;图11b显示对于仅干燥的pva水凝胶样品,ca=56.88°;图11c显示对于本发明的经naoh凝胶化的pva水凝胶样品(液滴落下后5秒),ca=16.608°。
图12所示为本发明的pva水凝胶的形状记忆性,其中图12a显示将pva条带浸入6m的naoh溶液中并从13mm拉长至36mm,然后将其浸入水中,几秒钟后恢复其原始长度;图12b显示由于加水而产生的收缩力可将500gr重量提升至3.5cm;图12c显示由于加水而产生的收缩力可将200gr重量提升至10cm;图12d中所示为与12b、12c、12e所用相同的样品,其中l0是原始长度,l1是当样品拉长到32mm时的长度,l2与测试后浸入水中的时间有关;图12e所示为加水引起的收缩力。
图13a和13b所示为本发明的浸入naoh溶液中的pva水凝胶的sem图像,图13c和13d所示为本发明的pva水凝胶的sem图像,其首先浸入naoh溶液中,然后完全拉伸到塑性区域(箭头表示拉伸方向)。
图14所示为本发明的pva水凝胶的edx结果,其中图14a所示为浸入naoh溶液中的pva水凝胶的sem图像,其具有用于edx分析的选定区域;图14b和14c所示为选定区域中的元素的原子和重量百分比以及定量结果。
图15a和15b所示为本发明的包含三层的复合材料的横截面的sem图像,其中左侧层为pva-cnt、中间层为单独的pva、右侧层为pva-银纳米颗粒;图15c和15d所示为具有cnt(左侧)和不具有cnt(右侧)的两层之间的高分辨率边界;图15e和15f所示为含银纳米颗粒的pva层的更高分辨率。
图16所示为本发明的cnt-pva-银纳米颗粒复合材料的edx结果,其中图16a为包含三层的复合材料的横截面的sem图像和选择用于edx研究的三个区域;图16b、16c和16d为每个选定区域的元素百分比和定量结果。
图17a显示基于本发明的pva水凝胶的不同直径的管的合成,图17b显示施加高压空气时,管表现得像气球,图17c显示干燥时管很坚固,但与水接触的区域是弹性的,所以在高压空气通过该管时,该管会模仿气球。
图18所示为具有开放式大孔结构和与脑组织类似力学性能的可注射网状电子器件,其为映射和调节大脑活动提供了新的微创方法。
图19a所示为3d打印过程中打印时的pva-cnt溶液,图19b为固化的3d打印网,图19c和19d为3d打印网通过直径为400μm的小型移液管尖端进行注射。
图20所示为在薄pva膜上打印的pva-cnt导电油墨。
图21a所示为pva水凝胶膜上微流体通道的合成,图21b所示为在pva水凝胶膜上打印的藻酸盐以及逐层固化。
图22a和22b所示为通过使用用于制造管子的小棒在pva管上制作的微流体通道的光学图像,其中含有染料的水被注入通道并将管子放置在uv下的水内以在微流控系统中显示流体,图22b显示在管壁上具有多个打印的微通道的大管子。
图23a为包含生物可吸收性温度和流量传感器、记忆模块和治疗用纳米颗粒的生物可吸收性电子支架(bes)的示意图,其中可以使用nir曝光来启动治疗功能;图23b所示为将bes置于气囊导管上以在体内将其输送到犬颈总动脉中;图23c所示为在气囊导管膨胀之前(左侧)和之后(右侧),犬模型中气囊导管和bes的x射线图像;图23d所示为在犬颈总动脉中体内植入的bes;图23e所示为体内bes的体绘制ct图像。
图24a为带有打印的cnt网的管子(用于记录与内部压力相关的信号变化)的照片;图24b所示为安装有由cnt/pva制成的传感器(该传感器连接到流体可以通过的管子)的导管的照片。
图25所示为pva-明胶膜,其通过如下方式获得:将5mlpva溶液倒在培养皿上,待干燥后在naoh溶液中静置以形成凝胶。
图26所示为显示肝小叶微结构和制造线状肝脏微器官的合成方法的示意图,其中图26a显示肝小叶微结构:实质肝细胞(ph)从血窦中分离并形成厚度为1的肝细胞层的线状结构,其中肝细胞索被内皮细胞(ec)层覆盖,并且在ph与ec之间,存在星状细胞布置在其中的窦周隙(thespaceofdisse);图26b显示结合肝细胞和3t3细胞的藻酸盐水凝胶微纤维用微流控系统制造,其下图显示了凝胶化之前和之后的封装细胞的藻酸盐线的横截面图。
图27所示为用于逐层微凝胶制造的液滴聚焦微流体通道的示意图,其中带黑点的浅灰色是含有药物的pva水凝胶,深色是另一种pva溶液作为第二层,其液滴可以通过使用naoh溶液作为凝胶溶液形成。
具体实施方式
本发明提供一种制备pva水凝胶的方法,该方法包括将pva溶液在模具中定型干燥后浸泡在碱性溶液中以获得pva水凝胶。
下面结合实施例和附图对本发明进行具体说明,但本发明不限于此。
实施例1
通过将分子量为205,000的pva溶解在蒸馏水中,制成10%pva(100mg/ml;10gpva溶于100ml蒸馏水中)并且在60℃加热的振荡浴中放置过夜,形成pva粘性溶液。然后将20ml的10%pva溶液倒于直径10cm的玻璃皿中,在室温下干燥过夜,接着浸入摩尔浓度为1m的naoh溶液中10-20分钟,凝胶化后用纯水洗涤,洗净后沥干水分,密封保存。
实施例2
使用与实施例1相同的方法制备pva水凝胶,所不同的只是将naoh的浓度变为3m。
实施例3
使用与实施例1相同的方法制备pva水凝胶,所不同的只是将naoh的浓度变为5m。
实施例4
使用与实施例1相同的方法制备pva水凝胶,所不同的只是将naoh的浓度变为6m。
实施例5
使用与实施例4相同的方法制备pva水凝胶,所不同的只是将naoh变为lioh。
实施例6
使用与实施例4相同的方法制备pva水凝胶,所不同的只是将naoh变为koh。
实施例7
使用与实施例4相同的方法制备pva水凝胶,所不同的只是对获得的pva水凝胶在室温下空气干燥2.5小时。
比较例1
将聚乙烯醇与水按质量比10:100进行混合,搅拌条件下置于85-90℃,恒温油浴中完全溶解,获得pva溶液。然后将pva溶液放入冰箱中,在-20℃的温度下,冷冻18小时后,置于室温下解冻3小时,如此冻融循环进行3次,获得常规pva水凝胶。
本发明设计的pva水凝胶具有均匀掺入不同纳米材料的能力。在这里,通过使用本发明的上述方法,将10%的pva溶液与磁性纳米粒子(mnp)、剥离的石墨烯、碳纳米管(cnt)和聚苯胺(pani)组合使用,制备了各种基于本发明的pva水凝胶的复合材料。
根据图1a可知,将pva与mnp组合导致可拉伸的磁性膜,其可用作磁致动器(将0.1gr磁性纳米粒子添加至5ml的pva溶液中并超声处理和搅拌,然后浇注至培养皿中,干燥后浸入氢氧化钠溶液中凝胶化,制得掺有mnp的pva水凝胶膜)。图1a显示了磁膜如何随着磁铁的运动而舞动。图1b显示剥离的石墨烯完美嵌入pva网络并制成均匀分布的膜。图1c是用pva和cnt(pva和cnt10mg/ml)制成的非常薄的纳米膜,其中将溶液倾倒在培养皿上并干燥过夜,然后浸入氢氧化钠溶液中凝胶化,制得均匀的掺有cnt的pva水凝胶膜,右侧的图像显示当10ml溶液留在培养皿上干燥时的图像。图1d所示为经过一次涂覆和多次涂覆后涂有pani(聚苯胺)的pva膜,据观察,pani可以很好地涂覆在pva膜上,可以在ph指示剂中提供许多应用或用于超级电容器。如图1d和图1e所示,涂有pani的pva膜可以通过将其颜色从酸性环境下的绿色变为碱性环境下的紫色,有效检测ph值的变化。本发明的制备方法提供了可调整的厚度生产。由图1a-1e可知,本发明的pva水凝胶具有优异的结合各种材料的能力,可用于制备各种复合材料。
表征
通过edx、傅里叶变换红外光谱(ftir)和扫描电子显微镜(sem)来表征本发明的pva水凝胶,对本发明的pva水凝胶的机械和化学性质、溶胀比以及降解性等进行了研究。凝胶机理和ftir分析
全部水解和部分水解的pva聚合物的化学结构分别如图2a和图2b所示。对于部分水解的pva聚合物(将pva称为部分水解的聚合物),残留的乙酸酯分子存在于聚合物中。在pva溶液中,水分子与相邻的pva网络形成氢键(参见图2)。当pva溶液被干燥时,在pva的羟基之间形成弱氢键,而残留的乙酸酯阻碍另外的氢键。将pva膜浸入高浓度碱性溶液中后,残留的乙酸酯将被除去,从而导致水凝胶膜产生更强的氢键(参见图3)。如edx和ftir分析所示,使用水来洗涤pva水凝胶,从而除去钠离子和羟基离子,并调节合成材料的ph值。
图4提供了各种样品的ftir光谱,以帮助进一步讨论所制备的复合膜。图4a所示为用naoh处理的交联pva的ftir光谱;图4b所示为原始pva的ftir光谱,其具有在3000-3600cm-1(宽的-oh拉伸)、2800-3000cm-1(c-h烷基拉伸)、1733cm-1(残留的乙酸酯ch3co2-的c=o拉伸)、1300-1500cm-1(c-h弯曲)和1084cm-1(c-o拉伸)的典型峰。
交联pva的ftir光谱显示pva的所有预期特征峰,但在1733cm-1处的峰显著收缩(或几乎消失),这证明乙酸酯被成功除去(参见图4a)。
在原始pva和交联pva的ftir光谱中,发现在1084cm-1(c-o拉伸)和1142cm-1(c-o-c拉伸)的峰。交联pva在1142cm-1处的峰强度增加,这表明交联pva的结晶度增加。
将交联的pva垫在水中浸泡数天以确保成功的交联工序。为了阐明机理,将pva水凝胶浸入摩尔浓度为8m的尿素溶液中并保持过夜,导致pva水凝胶溶解。这一事实揭示了氢键的重要作用。此外,将pva溶液与尿素按90/10重量百分比(pva/尿素)混合以制备pva-尿素水凝胶。图5中的sem图揭示多孔尺寸增加,这可能是由于阻碍了pva水凝胶中的氢键所导致的。
用摩尔浓度分别为1m、3m和6m的naoh制备的实施例1、实施例2和4的pva水凝胶的ftir结果显示在图6中。随着naoh的过量,残留的乙酸酯拾取(acetatepick)被更多地减少。考虑到pva的力学性能和凝胶化,可以看到用1m的naoh制成的实施例1中的水凝胶是非常薄弱的。因此,去除残留的乙酸酯不是导致强氢键的主要原因,naoh溶液的高浓度起到了关键作用。用上述不同浓度的naoh制成的pva的光学照片如图7所示。
力学性能
图8a显示了拉伸测试期间的pva-naoh(naoh的摩尔浓度为6m)样品。当该pva水凝胶达到高应变(约300%应变)时,观察到样品从透明到白色的颜色变化,这表明内部的pva链平行排列并且更有序。
图8b研究了由不同浓度的naoh制备的实施例1-4的pva水凝胶的拉伸性能和力学性能。通过计算每个组的三个样品结果的平均值获得报告的弹性模量(在50%应变下)。可以看出,实施例1中的使用1m的naoh胶凝的样品,弹性模量非常小,为0.04mpa,并且具有非常薄弱的薄膜。然而,当naoh的浓度增加到3m、5m和6m时,则获得强的pva水凝胶薄膜,弹性模量提高到1mpa的数量级并且极限强度显著增加到10mpa的数量级。当拉伸到至少100%应变时,观察到所有样品的线性弹性行为。该膜表现出优异的可拉伸性能,超过其原始长度的350%。这种伸长受拉伸机性能的影响,因为大多数样品从夹具上滑落或由于夹具用以保持样品的应力集中而在边缘处切割。因此,所有数据显示pva水凝胶的最小强度和伸长。为了确保最快的凝胶化和强大的性能,用浓度为6m的氢氧化物制成的pva水凝胶用于本发明的实验。图8c比较了用不同种类的氢氧化物(包括lioh、naoh和koh)凝胶化的实施例4-6的pva水凝胶的拉伸性能。结果显示,使用lioh导致薄弱的pva水凝胶,而使用naoh和koh则表现出强的力学性能,极限强度大于10mpa,杨氏模量大于1.3mpa。
图8d和8e进一步研究了干燥对pva水凝胶的力学性能的影响。将30ml10%的pva倒入大培养皿中,干燥后经6m的氢氧化钠溶液凝胶化形成0.3mm厚的pva水凝胶膜。将pva水凝胶样品保存在蒸馏水中,在从样品表面擦去水之后,以5mm/min的速度对pva水凝胶的拉伸性能测试三次,结果如图8d所示。每次,该pva水凝胶表现出更强的行为,由此可知,脱水对pva水凝胶的机械强度起着关键作用。根据图8d可以看出,当pva水凝胶更干燥时,极限强度和杨氏模量增加。
对于干燥2.5小时的实施例7的pva水凝胶重复进行拉伸试验,结果如图8e所示。以5mm/min的速度对该样品测试2次。在第一次测试中,它被拉伸至30%并从夹具中滑落,在第二次测试中,该水凝胶精确地遵循与之前的在2.5小时后所显示的结果相同的趋势,这表明,在该测试期间干燥对力学性能的影响可忽略。
在图8f中,在从pva水凝胶样品表面除去水之后,将该水凝胶用于拉伸循环测试,并在30%至58%应变之间拉伸释放10个循环。可以看出,在循环拉伸过程中,水凝胶被干燥,从而影响力学性能,如在第十次循环中所见,与第一次循环相比,最大强度提高了14%(10个循环大约需要8分钟)。
对于图8g的相同pva水凝胶样品重复进行循环拉伸测试并且为了评估干燥效果,这次将水凝胶暴露于产生水蒸气的增湿器中以防止在循环测试期间水的蒸发。图8g所示的循环试验表明,左上图、右上图和左下图分别代表12%-40%、22%-70%和25%-100%应变下的循环拉伸和松弛结果。与在室内条件下测试凝胶的图8f相比,仅在第一次循环和最后一次循环之间有差异,突出显示了水合对拉伸行为的影响。进一步测试相同的样品,显示存在图8g中左上图所示的湿度下的拉伸行为。
倒入5mlpva溶液干燥后经naoh处理制成的pva水凝胶如图9所示。该膜具有优异的耐尖锐金属、刮刀和轻轻推针的性能。图9b显示了用于承载15kg重量的涂有pani的pva水凝胶的照片。
降解性、形态和溶胀比
本发明的pva水凝胶的降解性通过将该水凝胶在水中放置1年来评估,并且未观察到降解。为了提高pva水凝胶的降解度,可以进行与可降解材料结合的研究。例如,尿素可以弱化pva的分子内作用和氢键,并改变晶格能和结晶度。当在尿素溶液中浸泡过夜时,pva水凝胶溶解在尿素溶液(摩尔浓度为8m)中。对于pva水凝胶来说,观察到非常稳定的化学性质,因为其即使浸泡在强酸中时也保持其性质。
加热0.5mm厚的pva水凝胶膜;对于低于50℃的温度,该水凝胶非常稳定,但在70℃左右,水凝胶开始再生并消失。将该水凝胶膜在70℃加热30分钟并收集和在室温下保持在水中过夜。这种加热处理实质上降低了其力学性能并提高了溶胀比。根据以下公式计算该研究的溶胀比:溶胀比=[wf-w0/w0];其中wf为完全溶胀状态下的水凝胶重量,w0为干燥状态的重量。
对于比较例1中的常规pva水凝胶,溶胀比约为0.8。但是,当水凝胶被加热并收集时,溶胀比增加到9.5。在冷冻和干燥后,将常规pva水凝胶(图10a、b、c)和经加热的pva水凝胶(图10d、e、f)用于sem研究。如图10所示,对于加热样品,多孔尺寸显著增加。考虑到热降解,引入了可回收和可重复使用的器件范围。
接触角
通过测量接触角(ca)评估本发明的pva水凝胶的亲水性能。图11a显示了具有92.7°接触角的pdms上的水滴。图11b显示了凝胶化前干燥的pva膜具有56.88°的ca。图11c显示了本发明的经naoh凝胶化的pva膜具有16°的ca,这表明本发明的pva水凝胶富含亲水性表面(液滴接触膜5秒后,计算接触角)。
形状记忆性和人造肌肉
本发明的实施例4中的pva水凝胶的形状记忆性如图12a和12b所示。将pva条带从原来的13cm长度拉伸至36cm,这表明在浸入naoh溶液后,条带延伸至其原始长度的300%。在加入水后,条带保持其塑性变形并在短时间内恢复到15cm(具有约91%的变形恢复率(通过如下计算获得:(36cm-15cm)/(36cm-13cm)=91%);恢复260%的应变比)。这个过程与能够移动500gr重量(相当于175mj能量)的强大收缩力相关联。
另外,在2小时内风干的样品显示,它们在加入水时可以恢复超过其原始长度的70%(具有26、8、0.1(mm)尺寸的样品被拉伸至100mm,并且放置在水中几分钟,然后拿出并进行测定)。最大长度为32.6mm,显示恢复了67.4mm的塑性变形(具有约91%的变形恢复率),并且具有相同性能和外观的样品可重复使用。
向培养皿中倒入20mlpva溶液,干燥后浸入naoh溶液中5min后制成pva水凝胶条带,用于人造肌肉测试并测量收缩力。条带的初始长度为l0=12cm,用naoh润湿后拉伸至l1=32cm,装载500gr后进一步拉长至l2=43cm。根据图12b、12c,由于添加水而引起的水凝胶收缩力可将0.2kg重量提升至10cm以及将0.5kg重量提升至3.5cm。使用相同的样品进行拉伸测试以测量收缩力。类似地,条带被拉长到l1=32cm,并位于抓握面之间(图12d)。校准后,手动拉长条带以达到5n的预载荷,以模拟重量悬挂。在将水连续添加到水凝胶条带的两侧的同时测量该力。在50秒内收缩力增加到10n时的最大值(图12e)。
图13a和13b显示了本发明的浸入naoh溶液中的pva水凝胶的sem图像。图13c和13d显示pva水凝胶拉伸到其塑性区域。比较高分辨率图像(图13b和13d),显而易见地,当水凝胶被完全拉伸时,材料织物变成扁平结构。而且,图13d中出现的裂缝与拉伸方向垂直。在拉伸后的条带中加水后,这些裂纹可以消除,相应于恢复塑性变形。因此,微观自我修复现象是显而易见的。
在图14中研究了本发明的保持在naoh溶液中的pva水凝胶膜的edx结果。与常规pva水凝胶膜相比,本发明的氧气百分比更高。另外,确认可以用水除去元素na。
逐层制造和应用
本发明方法的逐层制造的能力使设计具有各种性质的多功能复合材料成为可能。制备了一种具有含银纳米颗粒(np)的pva、单独的pva和含cnt的pva的复合膜,并用sem研究其横截面(图15),显示出微米厚度的清晰边界。第一种溶液:10%银纳米颗粒和10%pva混合;第二种溶液:10%pva;第三种溶液:8.8%cnt和10%pva混合。将0.5gr的每种溶液分三步浇注在小培养皿上。浇注第一种溶液并完全干燥,然后类似地倒入第二种溶液和第三种溶液并风干。之后,倒入6m的naoh溶液浸没干燥的pva复合膜以完成凝胶化。用两点探针仪测量的cnt的电导率为30-50kohm/cm,银纳米颗粒为400-600kohm,pva为10mohm。
图16显示本发明的复合材料中各层的edx结果。根据结果可知,与另两层相比,pva-cnt层含有最高量的碳元素。银拾取(agpick)也出现在第三层。因此,本发明的方法能够合成具有不同材料和性质的微米级膜和纳米级膜。
管和导管
导管是微创心脏治疗中一个非常重要的工具。目前,不同类型的聚合物可用于制造导管,包括硅、尼龙、聚氨酯、聚对苯二甲酸乙二醇酯(pet)、胶乳和热塑性弹性体。然而,目前的导管存在机械性能较差,舒适性和安全性仍有待提高的问题
强大的弹性和具有粗糙表面的耐用植入物是导管中的重要因素。鉴于优异的表面粗糙度,本发明开发的pva水凝胶作为永久的和临时的(可生物降解的)导管基植入物是有益的。通过本发明的方法可以制造具有可调机械性能和厚度的微管。为了制造小管,将金属棒浸入10%的pva溶液中,并通过具有附加的干燥风扇的定制电机旋转,进行单层涂层(图17a)。随着速度提高到更高的频率,可以实现均匀的涂层。重复涂覆过程以达到所需的厚度。各种基于pva的溶液可用于涂覆以获得不同的复合材料。干燥后,将带涂层的棒浸泡在naoh溶液中10分钟进行凝胶化。它们很容易从金属棒上剥落并用水冲洗。
气囊导管(逐层制造)
开发的管也可以用作气囊导管。由于具有弹性,管子就像气球一样起作用,并且在用流体加压时可以吹气。根据下面的图14b可知,当水凝胶干燥时,它在空气通过时对施加的压力具有很强的抵抗力。使用水来润湿管的特定部分以恢复其弹性特性,其在施加压力后像气球一样吹气(图14c)。
3d打印制作和应用
pva与不同材料混合的能力可获得粘性可打印溶液。这可以帮助合成不同范围的打印油墨。
可注射电子器件
将pva水凝胶与柔韧的可生物降解的、无线和可注射电子器件相结合,可以提供微创手术和大脑活动的长期监测系统。与使用pva水凝胶相关的一个挑战是缺乏对实时相互作用的可控剂量。这可以通过使用逐层水凝胶、微流控技术或可注射电子器件来解决。
使用结合了导电剂的10%pva溶液(具有10mg/mlcnt的10%pva溶液)能够制备可以使用本发明机制凝胶化的导电油墨。pva作为表面活性剂可以帮助有效地将碳纳米管分散在溶液中而不会凝结。首先,将10mg/ml的cnt分散在2%(重量百分比)的pva溶液中,超声处理并搅拌1小时。加入更多的pva以达到10wt%的pva,保持加热并在60℃下移动浴过夜。将pva-cnt油墨用作打印油墨以在培养皿背面打印电子网,如图19a和19b中所示。当打印品干燥时,加入naoh溶液以凝结pva和cnt网络用以固化。制得的网可以很容易地从基底上剥离,形成非常坚固和可拉伸的导电网,在可穿戴式传感器和可打印电子器件中提供无数应用。图19b显示了水中的几个打印网。打印非常薄的网的能力和高机械强度可以开发可注入的电子网;正如在图19中所看到的那样,即使经由小型移液管尖端的中空狭窄部位推出后,强凝胶仍能保持其完整性(图19c和19d)。
带pva膜的可拉伸电子板
还制造了包括pva-ag纳米线和pva-石墨烯的其他导电油墨。包含pva溶液的导电颗粒也可以印在干燥的pva水凝胶上,逐层打印并可在pva膜上打印电子板。图20显示了pva基材上的打印网,其良好地打印并与其基材组装(图20显示了pva基材上的打印网的性能)。为了制备基材,将5ml10wt%的pva倒入培养皿中并干燥过夜。然后,将pva-cnt打印在干燥的pva基材上,然后干燥几分钟,接着加入naoh用于固化(图20)。
微流体通道
流体力学领域涉及微观流体,从500微米到0.1微米的通道尺寸可以被认为是微流体通道。微流控芯片通常采用不同的方法和工艺用pdms膜制备,并且通常与用以增强微流控应用的亲水性的内通道表面改性相关。本发明为通常用pdms制造的微流体通道引入了新的替代方案。本发明的pva水凝胶已显示出可用作制造各种形状和尺寸的微流体通道的替代方法的能力,pva水凝胶在新型生物医学传感器和导管中的应用通过结合pva和导电纳米材料并且与3d打印制造相兼容来呈现,其为微流控芯片实验室系统提供了新的解决方案。
膜上微流体通道的合成
将20ml的10%pva溶液倒入大培养皿中并干燥过夜。然后,制备5%的藻酸盐溶液用于在pva膜上作为牺牲材料(sacrificialmaterial)进行打印。在打印不同的图案之后,具有3d打印的藻酸盐的干燥的pva用另外的20mlpva溶液覆盖并且在室温下再干燥一晚。然后,将干燥的pva膜浸入naoh溶液20分钟(图21a)。凝胶化后,用水洗涤膜,并将藻酸盐溶液从按压膜的边缘移除。洗涤通道并使水通过微小针头和注射器的通道来清除藻酸盐。如图21b所示,将在uv光下可追踪的黄色染料注入通道中。
pva管上3d微流体通道的合成
按照用于膜的相同工艺,可以在非平面表面打印形成微流体通道。为了显示这种能力,将金属棒浸入pva溶液中并在风扇下旋转以获得覆盖棒的均匀膜。这个过程重复了三次。然后,将藻酸盐打印在pva表面上。然后,将印有藻酸盐的pva再次浸入pva中并干燥三次,然后将该体系置于naoh溶液中20分钟。样品用水洗涤并容易地从棒上除去。样品放置在水中过夜以中和ph。然后将打印的藻酸盐推出通道,导致在pva管上形成微流体通道(图22)。
因此,本发明的基于pva的制造方法为开发新型微流体装置提供了新的机会,与常用pdms膜相比,其显示出更高的机械性能、可拉伸性、易制备性、亲水性表面和生物相容性。这种设计有益于引入新颖应用的芯片实验室的概念。
本发明开发的pva水凝胶可引入生物医学传感器,用于测量不同应用和环境下的流量、压力和生物活性,其具有可调的力学性能。将本发明的pva水凝胶和最近开发的廉价技术实验室与无线数据通信结合在一起可提供新一代的用于不同条件和不同器官的健康监测系统。重要的是,这可能为难以察觉的实时健康监测奠定基础。图24显示了带有打印的cnt基导电网的导管,用于记录内部流动导致的电阻信号。
其他潜在的应用
细胞培养、体外和体内应用
本发明的水凝胶的弹性和收缩性能可以提供一种新型的培养基质,刺激人类的肌肉像心肌一样具有收缩运动。pva可与细胞附着蛋白如明胶和多巴胺混合以改善细胞相容性并用于细胞培养研究。在接近具有优异细胞活力特性的pva和明胶的最佳混合物之后,可以合成用于不同应用的3d可打印细胞培养基。图25显示了与明胶混合的pva(10%pva和1%明胶)。药物输送
如所解释的,pva水凝胶可用于制造新的导管。导管是药物输送的手段之一,它可以将大体积的目标溶液输送到目标部位。另一方面,在管上设计微流体通道的能力可以使药物、细胞或分子以受控和连续的量到达期望的区域。
药物释放微胶囊和微凝胶
目前,不同范围的生物相容性天然的、合成的聚合物和蛋白质已用于活性剂的封装和延长释放。微流控技术通过将目标分子、药物或颗粒封装在微凝胶中提供了一种获得尺寸和性质受控系统的方法。放大能力可以让数千个微凝胶生产。藻酸盐和钙的物理凝胶化使得它们成为用于封装不同试剂的有趣组合,它们在微流控系统的帮助下以不同速度经由微通道通过共同流动的两种或更多种溶液以制备具有不同尺寸的微凝胶。藻酸盐-钙已广泛用于组织工程、细胞培养和药物输送(图26)
图26为显示肝小叶微结构和制造线状肝脏微器官的合成方法的示意图。图26a所示为肝小叶微结构:实质肝细胞(ph)从血窦中分离并形成厚度为1的肝细胞层的线状结构。肝细胞索被内皮细胞(ec)层覆盖,并且在ph与ec之间,存在星状细胞布置在其中的窦周隙(thespaceofdisse)。图26b显示结合肝细胞和3t3细胞的藻酸盐水凝胶微纤维用微流控系统制造,其下图显示了凝胶化之前和之后的封装细胞的藻酸盐线的横截面图。
本发明提出的机制可以提供一种制备不同水凝胶范围的新方法。通过将本发明pva的降解性提高到期望值并改变naoh的浓度,可以提供用于药物输送目的的新的控制释放机制。
当pva溶液为主流时,设计液滴聚焦的微流体通道,并且naoh作为分离器可以产生尺寸可控的pva微凝胶,其可以在微流体芯片的其他部分中进一步洗涤,所述微流体芯片定制设计用于从微凝胶中洗去naoh。设计具有多个共流的微流控系统可以便于为目标应用生产逐层微凝胶(图27)。pva水凝胶的弹性和粗糙表面以及电阻性能可能带来新的微胶囊家族。
微型机器人
根据pva水凝胶,通过结合纳米颗粒如mnp和逐层制造,可以开发一种磁性可控机制,并设计一个多功能微型机器人用于监测和药物输送系统。
纳米能源和超级电容器
将pva与石墨烯、cnt和pani等导电材料结合可以有利于纳米能源应用。将本研究中制备的pva-cnt和pva-石墨烯水凝胶电沉积并用pani涂覆多次,可以用作超级电容器。生物可吸收传感器
考虑到抗菌性改进以及可降解性调整,pva水凝胶可用于开发具有强的可拉伸粗糙亲水表面性能的生物可吸收传感器。
本发明提供了一种新颖的用于制备pva水凝胶的方法,其通过使用碱性溶液对pva进行凝胶化可以简便的方式获得pva水凝胶。通过本发明的方法,开发了具有各种有趣特性的pva水凝胶和基于其的复合材料,比如具有约1.5的低溶胀比的非常强的pva水凝胶。通过本发明的方法获得的pva水凝胶系材料可以是机械和化学稳定的,具有良好的性能并且与目标应用兼容。本发明的可规模化的工艺可以为任何应用提供便利的商业化。
- 还没有人留言评论。精彩留言会获得点赞!