2,5位取代的吡啶化合物及其应用的制作方法
本发明属于有机电致发光材料领域,特别涉及一类2,5位取代的吡啶化合物及其应用。
背景技术:
在有机电致发光器件
技术领域:
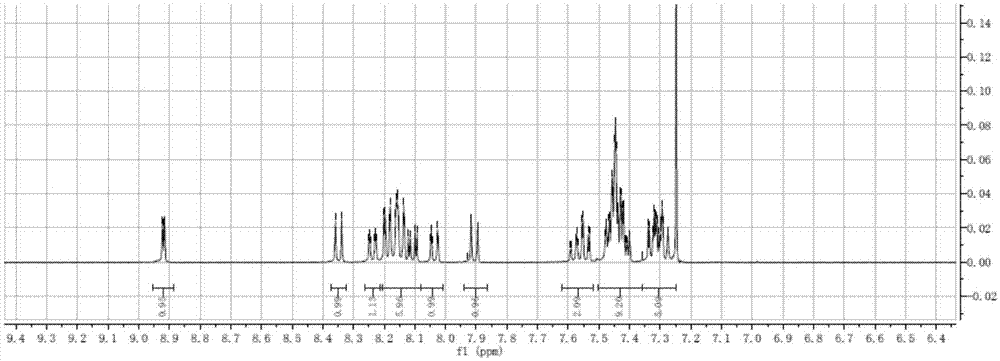
,可通过不同的方式实现高效、高寿命的发光,对于发射光谱的发光层,其中一种方式就是采用主客体掺杂的形式进行效率和寿命的提升。为了实现高效率的发光,避免能量从客体材料向主体材料的逆向能量回传,同时将三重态激子限定在发光层,主体材料的三重态能级应该大于掺杂材料的三重态能级。当主体材料的三重态能级小于掺杂材料的三重态能量时,将会发生从掺杂材料至主体材料能级反跃迁的现象,从而导致发光效率降低。因此,对于发光材料层,需要高热稳定性和高于掺杂材料三重态能量的主体材料。现有技术中,大部分主体材料是空穴传输型主体材料或电子传输型主体材料。由于载流子传输性能的不平衡,这种单极性的主体材料容易形成不利的窄的复合区域。通常,当使用空穴传输型主体材料时,在发光层和电子传输层界面会产生电荷复合区域,而当使用电子传输型主体材料时,在发光层和空穴传输层界面会产生电荷复合区域。然而弱的载流子迁移率和发光层中不平衡的电荷对有机发光器件的发光效率不利。同时,有机电致发光器件这种窄的电荷复合区域,会加快三重态-三重态湮灭过程,从而导致发光效率下降,尤其是在电流密度条件下。为了避免这种效应,通常采用的策略是:(1)使用两个发光层,其中一层使用空穴传输型主体材料,另一个发光层使用电子传输型主体材料;(2)将空穴传输型和电子传输型主体材料混合置于单个发光层中。然而,这两种策略使得器件的制备变得复杂,且混合的主体材料会导致相分离的问题。因此,为了达到高效的电致发光效果,需要发展具有平衡的载空穴和流子传输性能的主体材料,以拓宽电荷复合区域。技术实现要素:本发明的目的在于提供一种2,5位取代的吡啶化合物及其应用,该种2,5位取代的吡啶化合物是一种较好的蓝色磷光主体材料。本发明的目的通过以下技术方案实现:本发明的实施方式提供了一种2,5位取代的吡啶化合物,其具有通式(i)所示的结构:其中,x1、x2、y1、y2、z1、z2各自独立地表示n原子或crx,且所述rx表示氢原子、氘原子、卤素原子、c1-c24烷基、c1-c24烷氧基、c1-c24烷硫基、c2-c24烷胺基、c6-c72芳基、c6-c72芳氧基、c6-c72芳硫基、c7-c72芳胺基、c3-c72杂芳基、c3-c72杂芳氧基、c3-c72杂芳硫基或c4-c72杂芳胺基;n1-n8各自独立地表示n原子或cry,且所述ry表示氢原子、氘原子、卤素原子、c1-c24烷基、c1-c24烷氧基、c1-c24烷硫基、c2-c24烷胺基、c6-c72芳基、c6-c72芳氧基、c6-c72芳硫基、c7-c72芳胺基、c3-c72杂芳基、c3-c72杂芳氧基、c3-c72杂芳硫基或c4-c72杂芳胺基;g1、g2各自独立地表示氢原子、氘原子、卤素原子、c1-c24烷基、c1-c24烷氧基、c1-c24烷硫基、c2-c24烷胺基、c6-c72芳基、c6-c72芳氧基、c6-c72芳硫基、c7-c72芳胺基、c3-c72杂芳基、c3-c72杂芳氧基、c3-c72杂芳硫基、c4-c72杂芳胺基,且g1、g2中至少有一个为c6-c72芳基、c2-c24烷胺基、c3-c72杂芳基或c4-c72杂芳胺基。可选地,本发明的实施方式所提供的2,5位取代的吡啶化合物,具有通式(ii)所示的结构:其中,n1-n8各自独立地表示n原子或cry,且所述ry表示氢原子、氘原子、卤素原子、c1-c24烷基、c1-c24烷氧基、c1-c24烷硫基、c2-c24烷胺基、c6-c72芳基、c6-c72芳氧基、c6-c72芳硫基、c7-c72芳胺基、c3-c72杂芳基、c3-c72杂芳氧基、c3-c72杂芳硫基或c4-c72杂芳胺基;g1、g2各自独立地表示氢原子、氘原子、卤素原子、c1-c24烷基、c1-c24烷氧基、c1-c24烷硫基、c2-c24烷胺基、c6-c72芳基、c6-c72芳氧基、c6-c72芳硫基、c7-c72芳胺基、c3-c72杂芳基、c3-c72杂芳氧基、c3-c72杂芳硫基、c4-c72杂芳胺基,且g1、g2中至少有一个为c6-c72芳基、c2-c24烷胺基、c3-c72杂芳基或c4-c72杂芳胺基。可选地,在本发明的实施方式所提供的2,5位取代的吡啶化合物中,所述g1、g2为相同取代基。可选地,在本发明的实施方式所提供的2,5位取代的吡啶化合物中,所述g1、g2各自独立地具有式(iii-1)或(iii-2)所示的结构:其中,ar1、ar2各自独立地表示c1-c24烷基、c6-c72芳基、c3-c72杂芳基;ar1和ar2不相连或者ar1和ar2通过单键、双键、碳原子或杂原子相连;m1、m2、m3、m4各自独立地表示n原子或crz,且rz表示氢原子、氘原子、卤素原子、c1-c24烷基、c1-c24烷氧基、c1-c24烷硫基、c2-c24烷胺基、c6-c72芳基、c6-c72芳氧基、c6-c72芳硫基、c7-c72芳胺基、c3-c72杂芳基、c3-c72杂芳氧基、c3-c72杂芳硫基或c4-c72杂芳胺基;z表示氧原子、硫原子、砜基、亚砜基、nrm、crnro、sirprq或brr,rm、rn、ro、rp、rq、rr各自独立地表示c1-c24烷基、c6-c72芳基或c3-c72杂芳基。可选地,所述连接ar1和ar2的碳原子为一个或两个,所述碳原子被氢原子、氘原子、c1-c12烷基、c6-c36芳基或c3-c36杂芳基取代;所述杂原子为氧原子、硫原子、硅原子、氮原子或硼原子,所述硫原子不被取代或者被一个或两个氧原子取代,所述硅原子、氮原子或硼原子被氢原子、氘原子、c1-c12烷基、c6-c36芳基或c3-c36杂芳基取代。可选地,g1、g2、rx、ry、rz各自独立地具有选自如下之一的结构:其中,r1-r16各自独立地表示氢原子、氘原子、氟原子、c1-c6烷基、c1-c6烷氧基、c6-c18芳基、c3-c18杂芳基、c7-c18芳胺基、c4-c18杂芳胺基、c6-c18芳氧基或c3-c18杂芳氧基;r21-r26各自独立地表示氢原子、氘原子、氟原子、c1-c6烷基、c1-c6烷氧基、c6-c18芳基、c3-c18杂芳基、c7-c18芳胺基、c4-c18杂芳胺基、c6-c18芳氧基或c3-c18的杂芳氧基;r31-r34各自独立地表示氢原子、氘原子、氟原子、c1-c6烷基、c1-c6烷氧基、c6-c18芳基、c3-c18杂芳基、c7-c18芳胺基、c4-c18杂芳胺基、c6-c18芳氧基或c3-c18杂芳氧基;r101-r106各自独立地表示c1-c12烷基、c6-c18芳基或c3-c18杂芳基;r201-r205各自独立地表示c1-c12烷基、c6-c18芳基或c3-c18杂芳基。可选地,g1、g2、rx、ry、rz各自独立地具有如下之一的结构:其中,r210、r220、r230、r240、r250、r260、r310、r320、r340各自独立地表示氢原子、氘原子、甲基、乙基、丙基、丁基、戊基、己基、苯基、甲苯基、二甲基苯基、吡啶基、萘基、咔唑基或咔啉基;r2010表示甲基、乙基、丙基、丁基、戊基、己基、苯基、甲苯基、二甲基苯基、吡啶基或萘基。可选地,本发明的实施方式所提供的2,5位取代的吡啶化合物,具有选自如下之一的结构:本发明的实施方式还提供上述2,5位取代的吡啶化合物在有机电致发光器件中的应用。本发明的2,5位取代的吡啶化合物可以用在有机电致发光器件阴极和阳极之间,作为主体材料、客体材料或者辅助材料使用,所述主体材料可以为磷光主体材料,也可以为荧光主体材料;所述主体材料可以为蓝光主体材料,也可以为绿光或红光主体材料;所述辅助材料可以为空穴传输材料、空穴注入材料、空穴阻挡材料、电子传输材料、电子注入材料、电子阻挡材料或电荷产生材料。本发明的实施方式所提供的2,5位取代的吡啶化合物也可以用在有机电致发光器件阴极和阳极之外,作为覆盖层材料使用。优选地,本发明的实施方式所提供的2,5位取代的吡啶化合物为有机电致发光器件中的蓝色磷光主体材料。本发明的实施方式所提供的2,5位取代的吡啶化合物,通过吡啶基团和咔唑基团的嵌套组合,改善了电子和空穴在化合物内部的传输性能。本发明的实施方式所提供的2,5位取代的吡啶化合物,通过在咔唑或咔啉的2位或7位引入取代基,其玻璃化温度、三重态能级和热稳定性高,适合作为蓝色发光材料的主体材料,特别是深蓝色磷光发光材料的主体材料。附图说明图1为具体实施方式中制备的化合物h1的氢谱;图2为具体实施方式中制备的化合物h2的氢谱;图3为具体实施方式中制备的化合物h3的氢谱。具体实施方式为使本发明的目的、技术方案和优点更加清楚,下面将结合实施例对本发明的各具体实施方式进行详细的阐述。然而,本领域的普通技术人员可以理解,在本发明各实施方式中,为了使读者更好地理解本发明而提出了许多技术细节。但是,即使没有这些技术细节和基于以下各实施方式的种种变化和修改,也可以实现本发明各权利要求所要求保护的技术方案。化合物在本发明的一些具体实施方式中,提供了一种2,5位取代的吡啶化合物,其具有通式(i)所示的结构:其中,x1、x2、y1、y2、z1、z2各自独立地表示n原子或crx,且所述rx表示氢原子、氘原子、卤素原子、c1-c24烷基、c1-c24烷氧基、c1-c24烷硫基、c2-c24烷胺基、c6-c72芳基、c6-c72芳氧基、c6-c72芳硫基、c7-c72芳胺基、c3-c72杂芳基、c3-c72杂芳氧基、c3-c72杂芳硫基或c4-c72杂芳胺基;n1-n8各自独立地表示n原子或cry,且所述ry表示氢原子、氘原子、卤素原子、c1-c24烷基、c1-c24烷氧基、c1-c24烷硫基、c2-c24烷胺基、c6-c72芳基、c6-c72芳氧基、c6-c72芳硫基、c7-c72芳胺基、c3-c72杂芳基、c3-c72杂芳氧基、c3-c72杂芳硫基或c4-c72杂芳胺基;g1、g2各自独立地表示氢原子、氘原子、卤素原子、c1-c24烷基、c1-c24烷氧基、c1-c24烷硫基、c2-c24烷胺基、c6-c72芳基、c6-c72芳氧基、c6-c72芳硫基、c7-c72芳胺基、c3-c72杂芳基、c3-c72杂芳氧基、c3-c72杂芳硫基、c4-c72杂芳胺基,且g1、g2中至少有一个为c6-c72芳基、c2-c24烷胺基、c3-c72杂芳基或c4-c72杂芳胺基。在本发明的一些具体实施方式中,所提供的2,5位取代的吡啶化合物,具有通式(ii)所示的结构:其中,n1-n8各自独立地表示n原子或cry,且所述ry表示氢原子、氘原子、卤素原子、c1-c24烷基、c1-c24烷氧基、c1-c24烷硫基、c2-c24烷胺基、c6-c72芳基、c6-c72芳氧基、c6-c72芳硫基、c7-c72芳胺基、c3-c72杂芳基、c3-c72杂芳氧基、c3-c72杂芳硫基或c4-c72杂芳胺基;g1、g2各自独立地表示氢原子、氘原子、卤素原子、c1-c24烷基、c1-c24烷氧基、c1-c24烷硫基、c2-c24烷胺基、c6-c72芳基、c6-c72芳氧基、c6-c72芳硫基、c7-c72芳胺基、c3-c72杂芳基、c3-c72杂芳氧基、c3-c72杂芳硫基、c4-c72杂芳胺基,且g1、g2中至少有一个为c6-c72芳基、c2-c24烷胺基、c3-c72杂芳基或c4-c72杂芳胺基。在本发明的一些具体实施方式中,所述g1、g2为相同取代基。在本发明的一些具体实施方式中,所述g1、g2各自独立地具有式(iii-1)或(iii-2)所示的结构:其中,ar1、ar2各自独立地表示c1-c24烷基、c6-c72芳基、c3-c72杂芳基;ar1和ar2不相连或者ar1和ar2通过单键、双键、碳原子或杂原子相连;m1、m2、m3、m4各自独立地表示n原子或crz,且rz表示氢原子、氘原子、卤素原子、c1-c24烷基、c1-c24烷氧基、c1-c24烷硫基、c2-c24烷胺基、c6-c72芳基、c6-c72芳氧基、c6-c72芳硫基、c7-c72芳胺基、c3-c72杂芳基、c3-c72杂芳氧基、c3-c72杂芳硫基或c4-c72杂芳胺基;z表示氧原子、硫原子、砜基、亚砜基、nrm、crnro、sirprq或brr;且rm、rn、ro、rp、rq、rr各自独立地表示c1-c24烷基、c6-c72芳基或c3-c72杂芳基。在本发明的一些具体实施方式中,所述连接ar1和ar2的碳原子为一个或两个,所述碳原子被氢原子、氘原子、c1-c12烷基、c6-c36芳基或c3-c36杂芳基取代;所述杂原子为氧原子、硫原子、硅原子、氮原子或硼原子,所述硫原子不被取代或者被一个或两个氧原子取代,所述硅原子、氮原子或硼原子被氢原子、氘原子、c1-c12烷基、c6-c36芳基或c3-c36杂芳基取代。在本发明的一些具体实施方式中,g1、g2、rx、ry、rz各自独立地具有选自如下之一的结构:其中,r1-r16各自独立地表示氢原子、氘原子、氟原子、c1-c6烷基、c1-c6烷氧基、c6-c18芳基、c3-c18杂芳基、c7-c18芳胺基、c4-c18杂芳胺基、c6-c18芳氧基或c3-c18杂芳氧基;r21-r26各自独立地表示氢原子、氘原子、氟原子、c1-c6烷基、c1-c6烷氧基、c6-c18芳基、c3-c18杂芳基、c7-c18芳胺基、c4-c18杂芳胺基、c6-c18芳氧基或c3-c18的杂芳氧基;r31-r34各自独立地表示氢原子、氘原子、氟原子、c1-c6烷基、c1-c6烷氧基、c6-c18芳基、c3-c18杂芳基、c7-c18芳胺基、c4-c18杂芳胺基、c6-c18芳氧基或c3-c18杂芳氧基;r101-r106各自独立地表示c1-c12烷基、c6-c18芳基或c3-c18杂芳基;r201-r205各自独立地表示c1-c12烷基、c6-c18芳基或c3-c18杂芳基。在本发明的一些具体实施方式中,g1、g2、rx、ry、rz各自独立地具有如下之一的结构:其中,r210、r220、r230、r240、r250、r260、r310、r320、r340各自独立地表示氢原子、氘原子、甲基、乙基、丙基、丁基、戊基、己基、苯基、甲苯基、二甲基苯基、吡啶基、萘基、咔唑基或咔啉基;r2010表示甲基、乙基、丙基、丁基、戊基、己基、苯基、甲苯基、二甲基苯基、吡啶基或萘基。在本发明的一些具体实施方式中,所提供的2,5位取代的吡啶化合物具有选自如下之一的结构:通用合成路线:本发明的具体实施例也提供上述2,5位取代的吡啶化合物的制备方法,该类化合物可以通过如下式(syn-1)或(syn-2)所示的通用合成路线合成:其中,s1、s2各自独立地表示反应离去基团,反应离去基团是多种多样的,举例而不受限制的,可选择氟原子、氯原子、溴原子、碘原子、硼酸基团、硼酸酯基团;其他基团定义与本申请的通式(i)相同。上述反应离去基团,其在反应过程中离去时,可能是带电荷的,如氟原子在离去时多以负离子的形式离去。反应的投料顺序是不受限制的,举例的,可以先加入(s-a)和(s-b),随后加入(s-c);也可以先加入(s-b)和(s-c),随后加入(s-a);也可以三个同时加入。其中,s1、s2、sy1、sy2各自独立地表示反应离去基团,反应离去基团是多种多样的,举例而不受限制的,可选择氟原子、氯原子、溴原子、碘原子、硼酸基团、硼酸酯基团;s3也表示反应离去基团,举例而不受限制的,可选择氢原子、氟原子、氯原子、溴原子、碘原子、硼酸基团、硼酸酯基团;gg表示g1或g2基团;其他基团定义与本申请的通式(i)相同。上述反应离去基团,其在反应过程中离去时,可能是带电荷的,如氟原子在离去时多以负离子的形式离去。反应的投料顺序是不受限制的,举例的,可以先加入(sy-a)和(s-b),随后加入(sy-c),再加入(sy-d);也可以先加入(s-b)和(sy-c),随后加入(sy-d),再加入(sy-a);也可以先加入(sy-c)和(sy-d),然后加入(s-b),然后加入(sy-a)。本领域的技术人员容易理解的,当(sy-a)中的x1、y1、z1、n1、n2、n3、n4选择为cr基团,所述r为氘原子、c1-c24烷基、c1-c24烷氧基、c1-c24烷硫基、c2-c24烷胺基、c6-c72芳基、c6-c72芳氧基、c6-c72芳硫基、c7-c72芳胺基、c3-c72杂芳基、c3-c72杂芳氧基、c3-c72杂芳硫基或c4-c72杂芳胺基时,其通用的合成路线是相似的。具体的反应条件是不受限制的,举例如温度、溶剂的种类和用量、催化剂的种类和用量、助催化剂的种类和用量、碱的种类和用量、水的用量、反应底物的投料比,业内一般技术人员可以容易的从本发明实施例中的实施例进行合理的推广,选择的一般依据可以参考有机合成反应的相关文献、专利和书籍。涉及偶联反应,可以优先参考铃木反应和乌尔曼反应的相关资料。涉及烷基化的反应,可以优先参考付克烷基化的相关资料。合成示例:以下提供在本发明公开化合物的制备方法。但是本公开内容不意图限于本文中所叙述的方法的任一种。所属领域的技术人员可容易地修改所叙述的方法或者利用不同的方法来制备所公开的化合物的一种或多种。下列方面仅是示例性的,且不意图限制本公开内容的范围。温度、催化剂、浓度、反应物组成、以及其它工艺条件可改变,并且对于期望的配合物,本公开内容所属领域的技术人员可以容易的选择合适的反应物和条件。本发明实施例中的缩写含义:pe:石油醚;dcm:二氯甲烷;ea:乙酸乙酯;dmso-d6,氘代二甲基亚砜;cdcl3,氘代氯仿;methf:甲基四氢呋喃;pb(dba)2:三(二亚苄基丙酮)二钯;s-phos:2-双环己基膦-2',6'-二甲氧基联苯。实施例1:2-[2-(咔唑-9-基)-咔唑-9-基]-5-(咔唑-9-基)-吡啶(h1)的合成向反应瓶内加入2-(2-溴咔唑-9-基)-5-溴吡啶375mg,咔唑326mg,开启搅拌,依次加入碘化亚铜18mg,trans-环己二胺22mg,无水磷酸钾492mg,甲苯10ml。氮气置换体系3次后,体系升温至130度,保温24h后,降温加入10ml纯化水,分液,水相拥dcm20ml*2次萃取,合并有机相干燥,干燥后有机相浓缩干,过硅胶柱,洗脱剂dcm:pe=1:40~1:10,洗脱液浓缩干,得白色固体597.2mg,收率68%。1hnmr(400mhz,solvent:cdcl3)δppm:7.27~7.34(m,5h),7.36~7.48(m,9h),7.52~7.58(m,2h),7.88~7.93(dd,1h),8.03~8.06(m,1h),8.09~8.21(m,6h),8.21~8.24(m,1h),8.33~8.37(dd,1h),8.88~8.92(dd,1h)。质谱分子离子峰:m+=574.2。实施例2:2-[2-(1-n-咔啉-9-基)-咔唑-9-基]-5-(1-n咔啉-9-基)-吡啶(h2)的合成向反应瓶内加入2-(2-溴咔唑-9-基)-5-溴吡啶403mg,1-n咔啉336mg,开启搅拌,依次加入碘化亚铜19mg,trans-环己二胺45mg,无水磷酸钾811mg,甲苯16ml。氮气置换体系3次后,体系升温至130度,保温72h后,降温加入10ml纯化水,分液,水相拥dcm20ml*2次萃取,合并有机相干燥,干燥后有机相浓缩干,过硅胶柱,洗脱剂ea:pe=1:3,洗脱液浓缩干,得白色固体467mg,收率63%。1hnmr(400mhz,solvent:cdcl3)δppm:7.27~7.29(m,2h),7.31~7.44(m,3h),7.44~7.58(m,6h),7.93~7.96(dd,1h),8.05~8.08(dd,1h),8.10~8.16(m,2h),8.16~8.29(m,3h),8.32~8.36(m,1h),8.37~8.44(m,2h),8.44~8.51(m,2h),8.98~9.03(dd,1h)。质谱分子离子峰:m+=576.2。实施例3:2-[2-(3,6-二叔丁基咔唑-9-基)-咔唑-9-基]-5-(3,6-二叔丁基咔唑-9-基)-吡啶(h3)的合成向反应瓶内加入2-(2-溴咔唑-9-基)-5-溴吡啶315mg,3,6-二叔丁基咔唑458mg,开启搅拌,依次加入碘化亚铜30mg,trans-环己二胺27mg,无水磷酸钾500mg,甲苯10ml。氮气置换体系3次后,体系升温至130度,保温24h后,降温加入10ml纯化水,分液,水相拥dcm20ml*2次萃取,合并有机相干燥,干燥后有机相浓缩干,过硅胶柱,洗脱剂ea:pe=1:40,洗脱液浓缩干,得白色固体374mg,收率60%。1hnmr(400mhz,solvent:cdcl3)δppm:1.48(s,18h),1.49(s,18h),7.27~7.34(m,4h),7.35~7.52(m,4h),7.52~7.63(m,4h),7.63~7.67(dd,1h),7.92~8.05(m,2h),8.07~8.13(,m,1h),8.12~8.21(m,6h),8.23~8.30(m,1h),9.01~9.03(dd,1h)。质谱分子离子峰:m+=798.5。实施例4:2,5-[2-(咔唑-9-基)-咔唑-9-基]-吡啶(h4)的合成向反应瓶内加入2,5-二(2-溴咔唑-9-基)-吡啶290mg,咔唑340mg,开启搅拌,依次加入碘化亚铜60mg,trans-环己二胺70mg,无水磷酸钾1622mg,甲苯20ml。氮气置换体系3次后,体系升温至130度,保温24h后,降温加入30ml纯化水,分液,水相用dcm50ml*2次萃取,合并有机相干燥,干燥后有机相浓缩干,过硅胶柱,洗脱剂dcm:pe=1:40~1:10,洗脱液浓缩干,得白色固体330mg。质谱分子离子峰:m+=739.3。实施例5:2-[2-(4-n-咔啉-9-基)-咔唑-9-基]-5-(4-n咔啉-9-基)-吡啶(h5)的合成向反应瓶内加入2-(2-溴咔唑-9-基)-5-溴吡啶600mg,4-咔啉525mg,开启搅拌,依次加入碘化亚铜38mg,trans-环己二胺90mg,无水磷酸钾750mg,甲苯30ml。氮气置换体系3次后,体系升温至130度,保温24h后,降温加入10ml纯化水,分液,水相用dcm50ml*2次萃取,合并有机相干燥,干燥后有机相浓缩干,过硅胶柱,洗脱剂ea:pe=1:3,洗脱液浓缩干,得白色固体272mg。质谱分子离子峰:[m+h]+=577.2。实施例6:2,5-[2-(4-n-咔啉-9-基)-咔唑-9-基]-吡啶(h6)的合成向反应瓶内加入2,5-二(2-溴咔唑-9-基)-吡啶438mg,4-n-咔啉540mg,开启搅拌,依次加入碘化亚铜45mg,trans-环己二胺60mg,无水磷酸钾1200mg,甲苯30ml。氮气置换体系3次后,体系升温至130度,保温24h后,降温加入30ml纯化水,分液,水相用dcm50ml*2次萃取,合并有机相干燥,干燥后有机相浓缩干,过硅胶柱,洗脱剂ea:pe=1:40~1:10,洗脱液浓缩干,得白色固体200mg。质谱分子离子峰:[m+h]+=742.3。实施例7:2,5-[2-(1-n-咔啉-9-基)-咔唑-9-基]-吡啶(h7)的合成向反应瓶内加入2,5-二(2-溴咔唑-9-基)-吡啶600mg,1-n-咔啉800mg,开启搅拌,依次加入碘化亚铜90mg,trans-环己二胺90mg,无水磷酸钾1800mg,甲苯30ml。氮气置换体系3次后,体系升温至130度,保温24h后,降温加入20ml纯化水,分液,水相用dcm50ml*2次萃取,合并有机相干燥,干燥后有机相浓缩干,过硅胶柱,洗脱剂ea:pe=1:40~1:10,洗脱液浓缩干,得白色固体280mg。质谱分子离子峰:m+=741.3。实施例8:2,5-[2-(1-n-吩噁嗪基)-咔唑-9-基]-吡啶(h8)的合成向反应瓶内加入2,5-二(2-溴咔唑-9-基)-吡啶350mg,吩噁嗪320mg,开启搅拌,依次加入碘化亚铜45mg,trans-环己二胺60mg,无水磷酸钾800mg,甲苯30ml。氮气置换体系3次后,体系升温至130度,保温24h后,降温加入20ml纯化水,分液,水相用dcm50ml*2次萃取,合并有机相干燥,干燥后有机相浓缩干,过硅胶柱,洗脱剂ea:pe=1:40~1:10,洗脱液浓缩干,得白色固体260mg。质谱分子离子峰:m+=771.3。实施例9:2,5-[2-(2-二苯并呋喃基)-咔唑-9-基]-吡啶(h9)的合成向反应瓶内加入2,5-二(2-溴咔唑-9-基)-吡啶300mg,2-二苯并呋喃硼酸350mg,开启搅拌,依次加入四(三苯基膦)钯40mg,无水磷酸钾600mg,甲苯30ml,纯化水3ml。氮气置换体系3次后,体系升温至110度,保温24h后,降温加入20ml纯化水,分液,水相用dcm50ml*2次萃取,合并有机相干燥,干燥后有机相浓缩干,过硅胶柱,洗脱剂dcm:pe=1:40~1:10,洗脱液浓缩干,得白色固体420mg。质谱分子离子峰:m+=741.2。实施例10:2,-[2-(2-二苯并呋喃基)-咔唑-9-基]-5-(咔唑-9-基)-吡啶(h10)的合成向反应瓶内加入2-(2-(2-二苯并呋喃基)-咔唑-9-基)-5-溴吡啶560mg,咔唑260mg,开启搅拌,依次加入碘化亚铜28mg,trans-环己二胺60mg,无水磷酸钾500mg,甲苯30ml。氮气置换体系3次后,体系升温至130度,保温24h后,降温加入10ml纯化水,分液,水相用dcm20ml*2次萃取,合并有机相干燥,干燥后有机相浓缩干,过硅胶柱,洗脱剂dcm:pe=1:3,洗脱液浓缩干,得白色固体420mg。质谱分子离子峰:m+=575.2。发光性能检测例将上述化合物h1-h3溶解在methf中,在低温77k测量磷光发光光谱,得到第一三重态能级t1能级。测量荧光发光光谱,得到第一单重态s1能级。以10k/min升温速度,测量化合物的差示扫描量热dsc数据,得到玻璃化温度(tg)。采用业内常规的电化学方法测量homo和lumo值,通过测定有机物的氧化电位eox以直接推算homo能级数值,计算公式为homo=eox+4.74。再结合光谱法测得的带隙eg,计算公式为eg=hc/λabs=1240/λabs,间接计算出lumo能级数值,计算公式为lumo=homo-eg。相关化合物的光学和热力学数据如表1所示。表1化合物的光学和热力学数据化合物s1(ev)t1(ev)tg(℃)homolumoegh13.522.901305.501.983.52h23.572.931336.152.623.55h33.462.971545.462.023.44本领域的普通技术人员可以理解,上述各实施方式是实现本发明的具体实施例,而在实际应用中,可以在形式上和细节上对其作各种改变,而不偏离本发明的精神和范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1