一种分离细胞的方法与流程
本发明属于生物技术领域,涉及一种分离细胞的方法。
背景技术:
造血干细胞是一类成体多能干细胞,经多层级发育分化形成成熟的血液系统。造血干细胞是血液学研究领域的主要对象,是现代实验血液学研究的基础。造血干细胞的分离纯化及基因操作是血液学研究领域中最常用到的主要实验技术手段之一,如何能高效快捷地分离纯化造血干细胞是进行研究工作的首要任务。
当前实验室主流策略是通过两步法方案分离得到纯化的造血干细胞:首先去除绝大部分红细胞,保留白细胞;随后在白细胞中加入抗cd34磁珠进行孵育结合,经磁力架分选得到纯化的cd34+造血干细胞。在此基础上还有衍生的三步法分离造血干细胞等方案;现以衍生的三步法为例,详细介绍现有技术中造血干细胞分选的主要步骤及流程:第一步是粗分离和体积浓缩:主要是利用羟乙基淀粉沉淀红细胞,100ml肝素抗凝脐血与6%羟乙基淀粉(hes)按5:1混合,羟乙基淀粉终浓度为1%,经自然沉降60min,小心吸取上层液400g离心10min回收单个核细胞,10mlpbs悬浮;第二步是单个核细胞分离:15ml离心管中加入5mlficoll(密度1.077g/ml),在ficoll液相表面小心滴加10ml左右的细胞悬液,经慢升慢降400g离心30min,得到白细胞层,小心吸取中间细胞层,漂洗后0.5-1ml体积悬浮;第三步即特异性抗体标记并进行磁珠分选。细胞悬液中加入fcr封闭抗体和cd34+磁珠,孵育30min以上。对美天旎分选ms柱进行浸润、细胞过柱。漂洗去除非标记细胞后将ms柱移离磁铁,用pbs将特异标记的cd34+细胞退出ms柱,经400g离心回收细胞后种于培养基中。
上述技术方案,具有明显不可逾越的缺点:耗时长:需要2个人长达5小时以上才能分选得到造血干细胞;效率低:当前的三步法步骤繁琐,非精通人员很难熟练掌握;消耗精力:多个步骤需要小心翼翼的操作,需要全神贯注集中精力,劳动强度大。
虽然现阶段也有市场化的中间带隔层筛板的离心管销售,这种分层离心管也可以起到锐化分层界面的作用,但是该离心管价格昂贵,单管价格在50元左右,不适合长期规模化应用;而本发明创新应用液状石蜡作为分层封层剂,医用级别的液状石蜡价格低廉,完全可以更高性价比的解决问题。
cn103789259a公开一种自血液样品中同时分离间充质干细胞和造血干细胞的方法,该方法包括如下步骤:步骤a:收集血液样品,步骤b:分离血液样品中单核细胞成分,步骤c:单核细胞在单核细胞孵育液中孵育30-60分钟,步骤d:利用cd34抗体富集分离单核细胞成分中的造血干细胞,并回收cd34表达阴性的细胞组分,步骤e:使用包含notch-1的化学成分确定的造血干细胞扩增培养基培养造血干细胞,并使用添加了rock抑制剂的间充质干细胞培养基培养间充质干细胞。cn107446889a公开了一种脐血造血干细胞分离及存储的方法,包括以下步骤:取新采集的脐血,并加入有抗凝剂的采血袋中,并密封;将羟乙基淀粉与非结合胆红素加入纯水中;将混合液过树脂筛过滤;将脐血缓慢加入到混合液中,静置30-120分钟;静置后,收集上层含有白细胞的血浆层;将收集的血浆加入冲洗液冲洗多次,得到分离的造血干细胞;向造血干细胞中加入诱导液,在细胞培养瓶内进行诱导处理,然后培养;然后在造血干细胞置装入储存容器,于冰块中1-3h,然后取出,置于干冰中放置12-24h,之后取出,放置于液氮中冻存。目前有多种方案用于白细胞粗分离,如红细胞裂解、羟乙基淀粉沉淀红细胞、ficoll密度梯度离心等,各方案各有优缺点,总体而言耗时较长,操作要求小心翼翼,技术难度大、效率低下,平均单次分选需要2人操作5小时以上,不能适应当前高强度的实验室工作进展。
因此,研发一种简洁高效的分离方法,缩短分离纯化时间,降低操作难度,具有广阔的应用前景和巨大的市场价值。
技术实现要素:
针对现有技术的不足及实际的需求,本发明提供一种分离细胞的方法,所述方法创造性地在ficoll中加入液体石蜡,有效促进血液样品在ficoll上液面的稳定分层以及单个核细胞与血细胞的高效分离,辅以注射器的负压抽吸和培养基的洗脱步骤,各步骤各条件协同增效,相互配合,提高了分离纯化效率,具有广阔的应用前景和巨大的市场价值,为细胞分离提供了新的思路和方法。
为达此目的,本发明采用以下技术方案:
第一方面,本发明提供一种分离细胞的方法,包括如下步骤:
(1)将ficoll和液体石蜡加入容器中,离心后滴加血液样品,使得血液与ficoll形成分层液体;
(2)将步骤(1)分层后的液体进行离心后,在ficoll上液面形成白色层;
(3)将步骤(2)得到的白色层取出,离心漂洗得到单个核细胞。
所述ficoll指的是淋巴细胞分离液。
本发明中,发明人在长期的科研实践过程中,针对密度梯度离心过程的繁琐和费时等问题,通过大量实验摸索验证发现,液状石蜡与所有水相培养基等不互溶,相面清晰,不影响细胞结构形态,不溶解细胞组成,是理想的分层封层剂;因此,发明人在现有技术方案的基础上,创新思路,创造性地在ficoll分离液中加入液体石蜡,发挥其分层功能,利用液体石蜡将ficoll分层界面做到非常清晰的水平,这为良好的密度梯度离心效果提供了关键的前提条件,有效促进血液样品在ficoll上液面的稳定分层以及单个核细胞与血细胞的高效分离,极大缩短了分离纯化时间和操作难度。
本发明中,除了液体石蜡,还可拓展思维至任何不影响细胞结果形态,不溶解细胞组成,且与水相培养基不互溶的分层剂,为细胞分离方法提供了新的视野和思路。
液体石蜡,白油,别名石蜡油、白色油、矿物油,是由石油所得精炼液态烃的混合物,主要为饱和的环烷烃与链烷烃混合物,原油经常压和减压分馏、溶剂抽提和脱蜡,加氢精制而得;液体石蜡性状为无色透明油状液体,在日光下观察不显荧光,室温下无嗅无味,加热后略有石油臭,密度比重0.86-0.905(25度)不溶于水、甘油、冷乙醇,溶于苯、乙醚、氯仿、二硫化碳、热乙醇,与除蓖麻油外大多数脂肪油能任意混合,樟脑、薄荷脑及大多数天然或人造麝香均能被溶解,混溶于多数非挥发性油,对光、热、酸等稳定,但长时间接触光和热会慢慢氧化;在食品工业可用作被膜剂,我国《食品添加剂使用卫生标准》(gb2760-2014)中规定:可用于除胶基糖果以外的其他糖果、鲜蛋,最大使用量为5.0g/kg;其他使用参考:作为面包脱模剂,对烤盘腐蚀性小,不产生不愉快的气味;作为食品机械润滑剂,不腐蚀机械;此外也可用以延长水果、蔬菜、罐头的储存期;医用级白油也适用于制药工业,可作发生产轻泻用的内服剂及生产青霉素的消泡剂;液体石蜡在人体肠道不被吸收或消化,同时能妨碍水份的吸收医学上将其作为润滑性泻药使用,治疗老年人或儿童的便秘。大量摄入可致便软、腹泻;长期摄入可导致消化道障碍,影响脂溶性维生素a、d、k和钙、磷等的吸收。
优选地,步骤(1)所述血液样品包括外周血、骨髓穿刺、脐带血或白膜中的任意一种或至少两种的组合,优选为脐带血。
本发明中,凡是能用基于ficoll分离液的密度梯度离心法分离并发挥液体石蜡不互溶特性的样品均可,本申请采用的为脐带血。
优选地,步骤(1)所述ficoll与液体石蜡的体积比为1:(0.5-2.5),例如可以是1:0.5、1:1、1:1.5、1:2或1:2.5。
本发明中,对ficoll与液体石蜡的体积比的选择原理为:基于50ml离心管,在ficoll在添加十毫升的同时,保证能加入足量的血液样品,因此液体石蜡的添加量为5-25毫升。
优选地,步骤(1)所述离心的转速为400-2000g,例如可以是400g、600g、800g、1000g、1200g、1400g、1600g、1800g或2000g。
优选地,步骤(1)所述离心的时间为10-120s,例如可以是10s、30s、60s、90s、110s或120s。
本发明中,步骤(1)所述离心为瞬时离心。
优选地,步骤(2)所述离心的转速为800-1200g,例如可以是800g、900g、1000g、1100g或1200g。
优选地,步骤(2)所述离心的时间为10-20min,例如可以是10min、11min、12min、13min、14min、15min、16min、17min、18min、19min或20min。
优选地,步骤(3)所述离心的转速为500-1500g,例如可以是500g、700g、900g、1100g、1300g或1500g。
优选地,步骤(3)所述离心的时间为5-15min,例如可以是5min、6min、7min、8min、9min、10min、11min、12min、13min、14min或15min。
优选地,步骤(3)所述漂洗的稀释液包括1640培养基、dmem培养基、imdm培养基、pbs或2mmedta中的任意一种或至少两种的组合,优选为pbs和2mmedta的组合。
本发明中,步骤(3)所述漂洗的主要目的为去除血小板。
优选地,步骤(3)所述漂洗的次数为2-5次,例如可以是2次、3次、4次或5次。
本发明中,所述分离得到的单个核细胞在后续操作中可用于流式分选或磁珠分选等方法进行进一步的分离纯化,由于流式分选对仪器依赖度高,耗时更长,对细胞有损伤,限制了流式分选造血干细胞的应用,因此,本发明在后续操作中以cd34磁珠标记分选的方法分离造血干细胞。
所述单个核细胞主要为白细胞。
德国美天旎公司的cd34+造血干细胞分选磁珠是当前分离造血干细胞的金标准,关于其protocol可以参阅其网站说明及相关说明书。
优选地,所述方法还包括将步骤(3)得到的单个核细胞进行磁珠分选的步骤。
优选地,所述磁珠分选的方法包括如下步骤:
(1’)将步骤(3)得到的单个核细胞加入pbs悬浮后过细胞筛,加入阻断剂和cd34+磁珠进行孵育;
(2’)将步骤(1’)孵育后的细胞液过细胞筛后加到ms柱中进行负压抽吸过柱,然后加入pbs进行负压抽吸过柱漂洗;
(3’)向步骤(2’)的ms柱中加入stemspan培养基,移离磁铁架,负压抽吸,洗脱得到cd34细胞。
优选地,所述负压抽吸为采用注射器从柱子下端口对接,进行负压抽吸过柱。
优选地,所述细胞筛为30-40μm细胞筛,例如可以是30μm、32μm、34μm、35μm、36μm、38μm或40μm。
优选地,步骤(1’)所述阻断剂与cd34+磁珠的比例为1:1。
优选地,步骤(1’)所述孵育的时间为30-60min,例如可以是30min、40min、50min或60min。
优选地,步骤(2’)所述pbs的漂洗次数为2-5次,例如可以是2次、3次、4次或5次。
作为优选技术方案,一种分离细胞的方法,具体包括如下步骤:
(1)将体积比为1:(0.5-2.5)的ficoll和液体石蜡加入容器中,400-2000g离心10-120s后滴加血液样品,使得血液与ficoll形成分层液体;
(2)将步骤(1)分层后的液体进行慢升慢降800-1200g离心10-20min后,在ficoll上液面形成白色层;
(3)将步骤(2)得到的白色层取出,500-1500g离心5-15min,pbs+2mmedta稀释液漂洗2-5次得到单个核细胞;
(4)将步骤(3)得到的单个核细胞加入pbs悬浮后过30-40μm细胞筛,加入体积比为1:1的阻断剂和cd34+磁珠进行孵育30-60min;
(5)将步骤(4)孵育后的细胞液过细胞筛后加到ms柱中进行负压抽吸过柱,然后加入pbs进行负压抽吸过柱漂洗2-5次;
(6)向步骤(5)的ms柱中加入stemspan培养基,移离磁铁架,负压抽吸,洗脱得到cd34细胞。
本发明中,利用20ml注射器负压抽吸细胞,将20ml注射器与ms柱下方端口衔接,利用注射器抽吸负压功能,加速细胞悬液经过ms柱,显著提高最后一步分选效率;利用stemspan培养基直接洗脱特异标记的cd34+hspc,跳过pbs洗脱后的离心步骤,极大的避免了离心带来的细胞损耗;分离造血干细胞的步骤中辅以注射器负压抽吸和stemspan培养基洗脱,结合液体石蜡分层封层的作用,各步骤各条件协同增效,显著提高实验效率,缩短操作时间,保证细胞活力。
与现有技术相比,本发明具有如下有益效果:
本发明提供的技术方案能显著节约时间,目前能达到单人3小时实现分离,达到事半功倍的效果;简化实验流程,精简实验步骤,可以显著提高分离纯化效率;节省精力,无需高度小心翼翼的操作,轻松完成分离工作;效果显著,应用液体石蜡封层后的白膜更加明显,密度梯度离心接近完美。红细胞去除彻底,白细胞得到充分保留,能够显著提高效率,适应高强度的科研工作,为细胞分离提供新的思路和视野,具有广阔的应用前景和巨大的市场价值。
附图说明
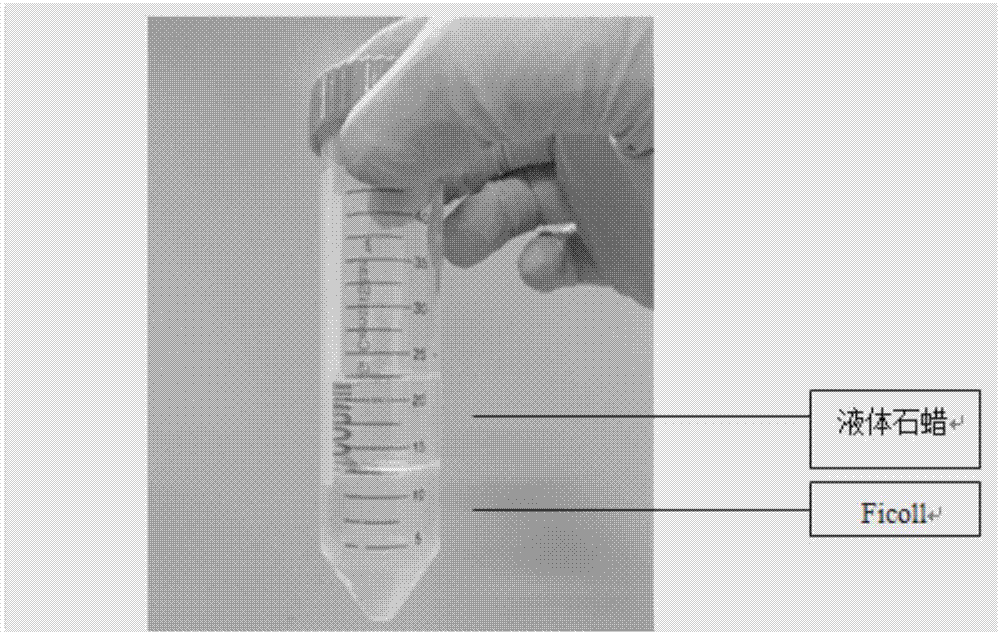
图1为本发明的ficoll与液体石蜡分层界面图;
图2(a)-图2(c)为在液体石蜡上方滴加血液的结果图,其中,图2(a)为刚开始滴加的结果图,图2(b)为滴加过程的结果图,图2(c)为滴加完成的结果图;
图3为本发明的滴加血液后离心形成的白色层的结果图;
图4为本发明的负压抽吸的操作图;
图5为本发明的单个核细胞(白细胞)数统计结果图。
具体实施方式
为更进一步阐述本发明所采取的技术手段及其效果,以下结合附图并通过具体实施方式来进一步说明本发明的技术方案,但本发明并非局限在实施例范围内。
方案需要准备的试剂耗材有:50mlep管、ficoll(天津灏洋生物淋巴细胞分离液,1.077g/ml)、液状石蜡、40μm细胞筛、pbs+2mmedta稀释液、pbs、美天旎cd34+分离磁珠、分离用ms柱、磁力架、stemspan培养基、细胞因子等。
实施例1
1.将新鲜采集的脐带血用50mlep管定量体积,倒入三角瓶中;加入pbs+2mmedta稀释液至终体积为280ml,一般一份脐血约100-150ml,稀释比例接近1:1,也可以不稀释,直接准备分层;
2.50mlep管中加入10mlficoll、10ml液状石蜡,800g离心1min,结果如图1所示,液体石蜡与ficoll分层稳定清晰;
3.用移液管转移35ml稀释后脐血至管中,滴加成线即可,完全不用非常小心的铺层,液状石蜡会将血液包裹成大滴停留在ficoll上方,并且逐渐融合,在ficoll与血液之间形成清晰锐利的分层界面,结果如图2(a)-图2(c)所示,其中,图2(a)为刚开始滴加的结果图,图2(b)为滴加过程的结果图,图2(c)为滴加完成的结果图,分层效果极佳;
4.慢升慢降1000g离心10min,结果如图3,由于分层界面清晰,液体之间没有任何混匀,因此红细胞会被彻底去除,而密度较低的白细胞则会在ficoll上液面形成明显白色层,白色层的清晰程度由原ficoll-血液-液状石蜡的分层决定;
5.真空泵吸去包括液状石蜡在内的上清至20ml刻度处,转移所有白细胞至新ep管中,加pbs+2mmedta稀释液至50ml,1000g离心10min,漂洗3次,得到白细胞。
实施例2
1.将实施例1得到的白细胞加入0.5-1mlpbs悬浮,过40μm细胞筛,转移至1.5mlep管,加入100μlfcr阻断剂和100μlcd34+磁珠,旋转孵育30min以上;
2.ms柱加1mlpbs润柱,将细胞孵育液过40μm细胞筛,加到ms柱中,过柱,由于白细胞量可能达到100-200million,过柱速度极慢,在此步骤有时需要等待半小时以上,因此对原方案进行优化,采用20ml注射器从下端口对接,负压抽吸法过柱,液流速度得到极大的提高,操作示意图如图4。
3.1mlpbs漂洗3次,均采用负压抽吸法过柱;
4.加入3mlstemspan培养基,将ms柱移离磁铁架,负压抽吸约1.5ml,用推柱将剩余液体推过ms柱,彻底洗脱所有特异标记的cd34细胞;
5.将所有液体转移至6孔板中,计数,加入细胞因子进行短时刺激培养。
对比例1
第一步是粗分离和体积浓缩:利用羟乙基淀粉沉淀红细胞,100ml肝素抗凝脐血与6%羟乙基淀粉(hes)按5:1混合,羟乙基淀粉终浓度为1%,经自然沉降60min,小心吸取上层液400g离心10min回收单个核细胞,10mlpbs悬浮;
第二步是单个核细胞分离:15ml离心管中加入5mlficoll(密度1.077),在ficoll液相表面小心滴加10ml左右的细胞悬液,经慢升慢降400g离心30min,得到白细胞层,小心吸取中间细胞层,漂洗后0.5-1ml体积悬浮。
第三步即特异性抗体标记并进行磁珠分选:细胞悬液中加入fcr封闭抗体和cd34+磁珠,孵育30min以上;对美天旎分选ms柱进行浸润、细胞过柱。漂洗去除非标记细胞后将ms柱移离磁铁,用pbs将特异标记的cd34+细胞退出ms柱,经400g离心回收细胞后种于培养基中。
与实施例2相比,对比例1的实验操作费时费力,需要两个人长达五小时的操作,步骤繁琐,耗费精力,而实施例1和实施例2一共仅需单人三小时实现分离,高效简洁,并稳定保持了细胞活性和产量。
对比例2
与实施例1相比,除了不添加液体石蜡外,其他步骤与实施例1相同。
与实施例1相比,对比例1的实验操作无法实现稳定清晰的分层,样品与ficoll存在混杂的情况,且后续离心操作容易失误,成功率低,耗时长,分离得到的细胞成分复杂。
实验检测
每100ml脐血使用pbs+2mmedta稀释液按照1:1比例稀释,采用常规分离方法(对比例2)和液体石蜡分层剂分离方法(实施例1),得到的单个核细胞(白细胞)数统计见图5所示;
由图5可知,液体石蜡分层剂分离方法的统计数明显高于常规分离方法,约为1.5倍,既显著节约了时间,也进一步提高了分离效率。
综上所述,本发明提供了一种分离细胞的方法,所述方法对基于ficoll分离液的密度梯度离心法进行改进,创造性地在ficoll中加入液体石蜡,有效促进血液样品在ficoll上液面的稳定分层以及单个核细胞(白细胞)与血细胞的高效分离;将分离得到的单个核细胞(白细胞)进行磁珠分选,辅以注射器的负压抽吸和培养基的洗脱步骤,各步骤各条件协同增效,相互配合,极大地缩短了分离纯化时间,降低了操作难度及精力消耗,提高了分离纯化效率,具有广阔的应用前景和巨大的市场价值,为细胞分离提供了新的思路和方法。
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!