一种检测生物体内硒半胱氨酸的生物发光探针及其制备方法和应用与流程
本发明属于有机合成及检测领域,具体涉及一种检测生物体内硒半胱氨酸的生物发光探针及其制备方法和用途。
背景技术:
生物发光成像(bioluminescenceimaging)是利用生物体内发生酶催化的化学反应而产生光子的原理进行的。最常见的生物发光体系是萤火虫萤光素酶(luciferase)-萤光素(luciferin)系统,其实质是萤光素酶在能量(atp)及氧存在的条件下催化底物萤光素,发生电子跃迁,分子由激发态回到稳态时产生光子,并释放出氧化型萤光素(oxyluciferin)。
硒半胱氨酸(selenocysteine,sec)是硒在体内的主要存在形式之一,其常位于硒蛋白的关键活性位点,从而参与多种重要的生理功能,包括甲状腺激素的产生、氧化还原调节及炎症调节等过程。鉴于硒半胱氨酸位于硒蛋白的活性中心,并对其酶活发挥重要作用,因此,建立准确可靠的方法检测硒半胱氨酸,对于研究硒化物参与的生理及病理过程是十分重要的。当前的硒半胱氨酸检测方法,主要包括:电泳技术或色谱方法(气相色谱(gc)或液相色谱(hplc))与荧光分析或质谱(ms)偶联,荧光探针技术。前二种技术需要破坏组织细胞,不能实现原位分析。而硒半胱氨酸荧光探针的开发,开辟了硒半胱氨酸的可视化检测方法。
基于小分子探针的荧光成像(fluorescenceimaging,fli)和生物发光成像(bioluminescenceimaging,bli)都是有效的可视化检测方法。但荧光成像需要激发光(一般<600nm),有生物体自身荧光背景,并且其荧光可受到环境的影响而导致淬灭。荧光成像的灵敏度也可能受到温度、ph、溶剂等各种因素的影响,从而影响检测的灵敏度。与荧光成像相比较,生物发光成像具有自身独特的优势:(1)不需要外源性激发光,组织自身发光少,几乎不存在背景信号干扰,并且萤光素酶催化氧化发光的效率极高(发光强度变化可达4-7个甚至12个数量级),使得检测的信噪比高、灵敏度高以及分辨率高,尤其适用于复杂生物背景下的高灵敏度成像;(2)组织穿透力强,更适用于无创、实时、连续的活体检测;(3)生物发光涉及的底物和酶对生物体基本无毒性,更加安全。因此,生物发光成像能够为内源性活性物质提供高灵敏度、安全无毒、无创实时的在体检测方法。
技术实现要素:
本发明的目的是在现有技术的基础上,提供一种用于检测硒半胱氨酸的生物发光探针,该探针能够定量的检测硒半胱氨酸,检测限可达8nm,表明该探针具有较高的检测灵敏度和选择性。
本发明的另一目的是提供一种上述生物发光探针制备方法。
本发明的又一发明目的是提供上述生物发光探针在硒半胱氨酸检测中的应用。
本发明的技术方案如下:
一种生物发光探针,其探针的结构式如下所示:
本发明利用萤光素酶-萤光素生物发光成像原理,以2,4-二硝基苯醚作为硒半胱氨酸(sec)识别基团,以萤光素作为萤光素酶识别底物(在d-萤光素的6位羟基上连接sec识别基团),构建得到识别sec的生物发光探针bf-1。在生理条件下(ph7.4),硒半胱氨酸的pka约为5.8,其他巯基化合物的约为pka8.5,因此,硒半胱氨酸的亲核能力强于其他巯基化合物(比如gsh,cys等),从而实现探针bf-1对sec的选择性识别。
探针bf-1识别sec原理为:d-luciferin的6位羟基被2,4-二硝基苯醚保护后,d-luciferin无法被萤光素酶识别,不能发出生物发光;当探针bf-1与sec发生亲核取代反应时,释放出萤光素,被萤光素酶识别发生酶促反应,产生生物发光。为了验证探针bf-1与sec的反应原理,bf-1与sec的tris-hcl缓冲液于37℃下反应1h,生成了黄绿色荧光物质,将其提取分离,通过hrms和hnmr证实bf-1与sec反应生成的黄绿色荧光物质是d-萤光素。上述结果进一步证明探针bf-1与sec反应原理如下所示。
识别sec的生物发光探针bf-1可以由如下方法制备,包括:
进一步识别sec的生物发光探针bf-1,包括以下步骤:
第一步:化合物ⅰ与吡啶盐酸盐进行反应,制备化合物ⅱ;
第二步:化合物ⅱ与d-半胱氨酸盐酸盐和碳酸钾进行反应,制备化合物ⅲ;
第三步:化合物ⅲ与化合物ⅳ、n,n-二异丙基乙胺进行反应,制备化合物bf-1。
更进一步详细的制备方法如下:以2-氰基-6-甲氧基苯并噻唑(化合物ⅰ)为原料,在吡啶盐酸盐作用下,发生脱甲基化反应,得到2-氰基-6-羟基苯并噻唑(化合物ⅱ);2-氰基-6-羟基苯并噻唑再与d-半胱氨酸在碳酸钾作用下反应得到d-萤光素(化合物ⅲ);d-萤光素(化合物ⅲ)在dipea(n,n-二异丙基乙胺)作用下,与2,4-二硝基氟苯(化合物ⅳ)缩合得到目标化合物bf-1。
在一种优选方案中,在第一步中,吡啶盐酸盐与化合物ⅰ的摩尔比为20~40:1。
进一步地,反应的温度为180~250℃;进一步优选为200℃。
进一步地,反应时间为1~4h。
在一种更优选方案中,在第二步中,化合物ⅱ溶于二氯甲烷和甲醇的混合液后再进行反应,所述混合液中二氯甲烷和甲醇体积比为1:1~1:3,可以再优选为1:1.5。
进一步地,在第二步中,d-半胱氨酸盐酸盐和碳酸钾溶于甲醇的水溶液后再与化合物ⅱ进行反应,d-半胱氨酸盐酸盐和化合物ⅱ的摩尔比为1:1~3:1;可以再优选为1.5:1。
本发明在第三步中,化合物ⅲ和化合物ⅳ的摩尔比例为1:1~1:3,可以再优选为1:1.5;反应的温度为20~40℃;反应时间为1~4h。本发明制备的生物发光探针作为检测硒半胱氨酸的应用,特别在肿瘤细胞和组织内作为检测硒半胱氨酸的应用。
采用本发明的技术方案,优势如下:
本发明提供的识别sec的生物发光探针bf-1,具有选择性好、灵敏度高、检测限低(8nm)及良好生物相容性等优点。
在tris-hcl缓冲液中,生物发光强度与硒半胱氨酸浓度呈现良好的线性关系,说明探针适合定量检测硒半胱氨酸,探针bf-1还实现了mcf-7-luc细胞中硒半胱氨酸的生物发光成像;更重要的是,探针bf-1也实现了活体水平(fvb-luc+转基因小鼠)内源性sec的灵敏检测,且响应较快,生物发光信号较稳定。
本发明又进一步应用该探针bf-1,检测了裸鼠移植瘤模型中肿瘤组织内的sec水平。本发明制备的探针bf-1是可视化和定量检测细胞、活体及肿瘤组织中硒半胱氨酸含量的有效工具,不仅能为生物体内硒半胱氨酸的生理与病理机制、信号转导研究提供新型的可视化检测方法,还对于揭示硒化合物的抗癌机制研究具有重要意义。
附图说明
图1是化合物ⅲ的1hnmr;
图2是化合物ⅲ的hrms图谱;hrms(esi+):(m+h)+calcd.forc11h9n2o3s2,281.0054;found,281.0049.(m+na)+calcd.forc11h8n2o3nas2,302.9874;found,302.9868;
图3是化合物bf-1的1hnmr;
图4是化合物bf-1的13cnmr;
图5是化合物bf-1与sec反应产物的1hnmr;
图6是化合物bf-1与sec反应产物的hrms图谱;hrms(esi+):(m+h)+calcd.forc11h9n2o3s2,281.0054;found,281.0050.(m+na)+calcd.forc11h8n2o3nas2,302.9874;found,302.9868;
图7是bf-1对sec的生物发光响应;bf-1(10μm)与sec(0,0.05,0.1,0.2,0.4,0.6,0.8,1,2,4,6,8,10,12,14,16,18,20,40,60,80,100,200and300μm)在tris-hcl缓冲液(50mm,含mgcl2=10mm,ph=7.4,1%dmso)中37℃孵育30min,再加入atp(2mm,50μl)和luciferase(2μg/ml)反应后,测量相对生物发光强度,其中,插入图为相对生物发光强度与sec(0-20μm)的线性关系;数据以mean±sd表示(n=3);
图8是bf-1对sec反应的时间;bf-1(10μm)与sec(100μm)在tris-hcl缓冲液(50mm,含mgcl2=10mm,ph=7.4,1%dmso)中37℃孵育(0,10,20,30,40,50and60min),再加入atp(2mm,50μl)和luciferase(2μg/ml)反应后,测量相对生物发光强度;数据以mean±sd表示(n=3);
图9是bf-1对sec的选择性;bf-1(10μm)与sec(20μm,40μm,100μm)、其它含硫化合物、硒化合物在tris-hcl缓冲液(50mm,含mgcl2=10mm,ph=7.4,1%dmso)中37℃孵育30min,再加入atp(2mm,50μl)和luciferase(2μg/ml)反应后,检测到的相对生物发光强度;1.blank;2.sec(20μm);3.sec(40μm);4.sec(100μm);5.hcy(100μm);6.hcy(1mm);7.cys(100μm);8.cys(1mm);9.gsh(1mm);10.gsh(10mm);11.gssg(1mm);12.s8(500μm);13.na2s(100μm);14.nac(100μm);15.na2seo3(100μm);16.na2se(100μm);17.se-methylselenocysteine(100μm);18.selenocystine(100μm);19.selenomethionine(100μm);数据以mean±sd表示(n=3);
图10是bf-1对sec的选择性;bf-1(10μm)与sec(20μm,40μm,100μm)、其它含硫化合物、硒化合物在tris-hcl缓冲液(50mm,含mgcl2=10mm,ph=7.4,1%dmso)中37℃孵育30min,再加入atp(2mm,50μl)和luciferase(2μg/ml)反应后,检测到的相对生物发光强度;1.blank;2.sec(20μm);3.sec(40μm);4.sec(100μm);5.ala;6.glu;7.trp;8.met;9.tyr;10.leu;11.val;12.ser;13.pro;14.arg;15.gly;16.phe;17.his;18.gln;19.asn;20.ile;21.thr;数据以mean±sd表示(n=3);
图11是bf-1对sec的选择性;bf-1(10μm)与sec(20μm,40μm,100μm)、金属阳离子(1mm)及其它还原试剂(1mm)在tris-hcl缓冲液(50mm,含mgcl2=10mm,ph=7.4,1%dmso)中37℃孵育30min,再加入atp(2mm,50μl)和luciferase(2μg/ml)反应后,测量相对生物发光强度.1.blank;2.sec(20μm);3.sec(40μm);4.sec(100μm);5.li+;6.na+;7.k+;8.mg2+;9.al3+;10.zn2+;11.mn2+;12.co2+;13.cd2+;14.ni2+;15.ca2+;16.hg2+;17.cu2+;18.fe2+;19.fe3+;20.ag+;21.dtt;22.nadh;23.glucose;24.ascorbicacid.数据以mean±sd表示(n=3);
图12bf-1对sec的选择性;bf-1(10μm)与sec(20μm,40μm,100μm)、其它阴离子(1mm)在tris-hcl缓冲液(50mm,含mgcl2=10mm,ph=7.4,1%dmso)中37℃孵育30min,再加入atp(2mm,50μl)和luciferase(2μg/ml)反应后,测量相对生物发光强度.1.blank;2.sec(20μm);3.sec(40μm);4.sec(100μm);5.f-;6.cl-;7.br-;8.i-;9.aco-;10.hco3-;11.n3-;12.no3-;13.so42-;14.s2o32-;15.scn-;16.c2o42-;17.s2o72-;18.hso3-;19.cn-;20.clo-;21.hpo42-.数据以mean±sd表示(n=3);
图13bf-1对sec的选择性;bf-1(10μm)与sec(20μm,40μm,100μm)、活性氧类和活性氮类(1mm)在tris-hcl缓冲液(50mm,含mgcl2=10mm,ph=7.4,1%dmso)中37℃孵育30min,再加入atp(2mm,50μl)和luciferase(2μg/ml)反应后,测量相对生物发光强度.1.blank;2.sec(20μm);3.sec(40μm);4.sec(100μm);5.h2o2;6.·ocl-;7.o2-;8.·oh;9.tbuooh;10.no;11.no2-.数据以mean±sd表示(n=3);
图14是mcf-7-luc细胞与bf-1(0,5,10,20,50,100μm)孵育24h细胞的存活率;数据以mean±sd表示(n=3);
图15是mcf-7-luc细胞与bf-1(10μm)孵育不同时间(0,6,12,18,24h)细胞的存活率;数据以mean±sd表示(n=3);
图16是外源性sec的细胞生物发光成像;(a)mcf-7-luc细胞与(sec)2(0,0.5,1,5,10,20μm)孵育12h,再与bf-1(10μm)孵育30min.(b)定量表示bf-1与不同浓度(sec)2反应的总光子通量(p/s/cm2/sr);数据以mean±sd表示(n=3);#p<0.001vs.control.
图17是不同孵育时间外源性sec的细胞生物发光成像;(a)mcf-7-luc细胞与(sec)2(5μm)分别孵育(0,1,6,12,24h),再与bf-1(10μm)孵育30min.(b)定量表示细胞的总光子通量(p/s/cm2/sr).数据以mean±sd表示(n=3).#p<0.001vs.control;
图18是内源性sec的细胞生物发光成像;(a)mcf-7-luc细胞与na2seo3(0,0.5,1,5,10,20μm)孵育12h,再与bf-1(10μm)孵育30min;(b)定量表示bf-1与不同浓度na2seo3反应的总光子通量(p/s/cm2/sr);数据以mean±sd表示(n=3);#p<0.001vs.control;
图19是不同孵育时间内源性sec的细胞生物发光成像;(a)mcf-7-luc细胞与na2seo3(5μm)孵育(0,1,6,12,24h),再与bf-1(10μm)孵育30min.(b)定量表示细胞的总光子通量(p/s/cm2/sr).结果以mean±sd表示(n=3).#p<0.001vs.control;
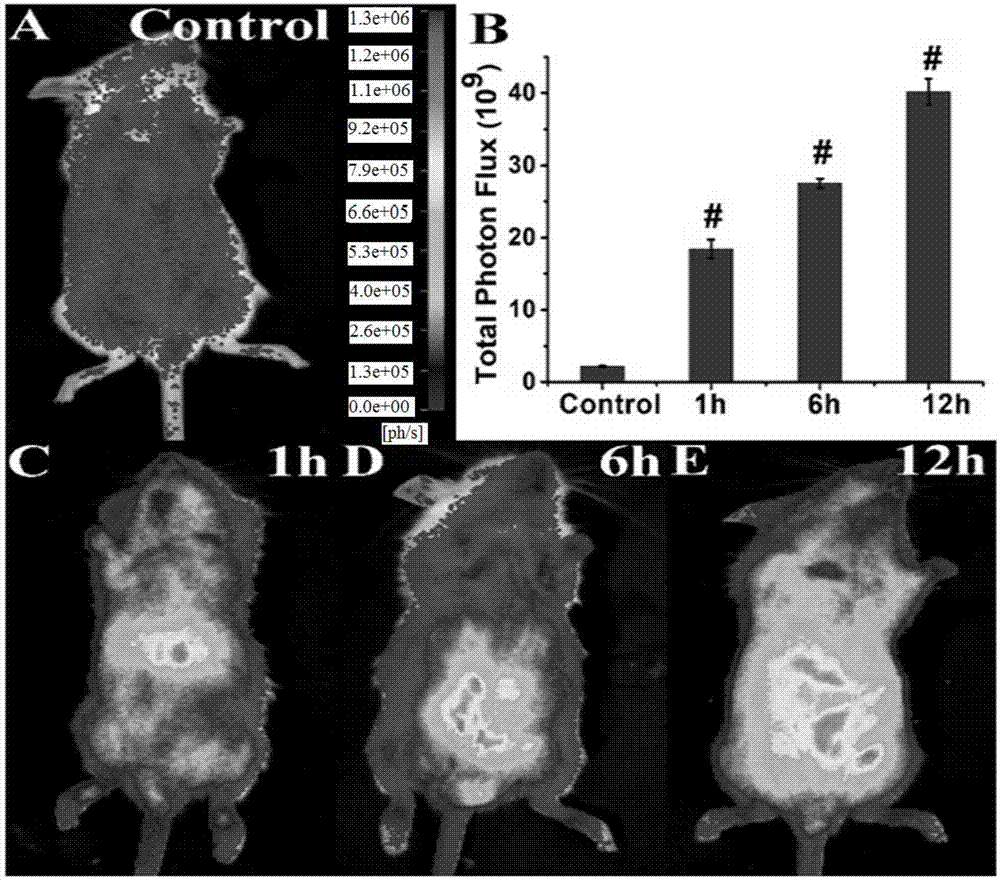
图20是外源性sec的活体生物发光成像;fvb-luc+小鼠腹腔注射bf-1(1.0mm,溶剂为100μl,dmso:saline=1:9)作为对照组(a);定量表示各组fvb-luc+小鼠(尾部除外)的总光子通量(p/sec/cm2/sr)(b);fvb-luc+小鼠腹腔注射5倍当量(sec)2(5mm,溶剂为100μlsaline),分别于1h(c),6h(d)和12h(e)后,腹腔注射bf-1(1.0mm,溶剂为100μl,dmso:saline=1:9),上述各图为探针bf-1腹腔注射20min时的成像;数据以mean±sd表示(n=3);与对照组相比较#p<0.001;
图21是内源性sec的活体生物发光成像;fvb-luc+小鼠腹腔注射bf-1(1.0mm,溶剂为100μl,dmso:saline=1:9)作为对照组(a);定量表示各组fvb-luc+小鼠(尾部除外)的总光子通量(p/sec/cm2/sr)(b);fvb-luc+小鼠腹腔注射5倍当量(sec)2(5mm,溶剂为100μlsaline),分别于1h(c),6h(d)和12h(e)后,腹腔注射bf-1(1.0mm,溶剂为100μl,dmso:saline=1:9),上述各图为探针bf-1腹腔注射20min时的成像;数据以mean±sd表示(n=3);与对照组相比较#p<0.001;
图22是内源性sec的活体生物发光成像;fvb-luc+小鼠腹腔注射bf-1(1.0mm,溶剂为100μl,dmso:saline=1:9)作为对照组(第一行);fvb-luc+小鼠腹腔注射1倍当量(sec)2(1mm,溶剂为100μlsaline),12h后,腹腔注射bf-1(1.0mm,溶剂为100μl,dmso:saline=1:9)(第二行);fvb-luc+小鼠腹腔注射5倍当量na2seo3(5mm,溶剂为100μlsaline),12h后,腹腔注射bf-1(1.0mm,溶剂为100μl,dmso:saline=1:9)(第三行);
图23是定量表示图22中fvb-luc+小鼠(尾部除外)的总光子通量(p/sec/cm2/sr);数据以mean±sd表示(n=3);
图24是肿瘤组织内sec的生物发光检测;裸鼠尾静脉注射bf-1(2.0mm,溶剂为100μlsaline,3%dmso,1%tween80)作为对照组(a);定量表示各组裸鼠肿瘤部位的全部光子通量(p/sec/cm2/sr)(b);裸鼠瘤内注射na2seo3(7mm,溶剂为100μlsaline),分别于1h(c);6h(d)和12h(e)后,尾静脉注射bf-1(2.0mm,溶剂为100μlsaline,3%dmso,1%tween80),数据以mean±sd表示(n=3);与对照组相比#p<0.001;
图25是肿瘤组织内sec的生物发光检测;裸鼠尾静脉注射bf-1(2.0mm,溶剂为100μlsaline,3%dmso,1%tween80)作为对照组(第一行);裸鼠瘤内注射0.5倍当量na2seo3(1mm,溶剂为100μlsaline),12h后,尾静脉注射bf-1(2.0mm,溶剂为100μlsaline,3%dmso,1%tween80)(第二行);裸鼠瘤内注射3.5倍当量na2seo3(7mm,溶剂为100μlsaline),12h后,尾静脉注射bf-1(2.0mm,溶剂为100μlsaline,3%dmso,1%tween80)(第三行);
图26是定量表示图25中裸鼠肿瘤组织部位的总光子通量(p/sec/cm2/sr);数据以mean±sd表示(n=3)。
具体实施方式
通过以下实施例并结合附图对本发明的识别sec的生物发光探针bf-1,作进一步的说明,但这些实施例不对本发明构成任何限制。
一、实施方法
1、材料与仪器
mtt细胞增殖/毒性检测试剂盒(biosharp公司);gibcodmem高糖培养基(美国lifetechnologies公司);gibco胎牛血清(美国lifetechnologies公司);青霉素(100μg/ml)和链霉素(100μg/ml)(美国lifetechnologies公司);薄层色谱使用gf254硅胶板(250μm),柱层析使用300-400目的硅胶(青岛海洋化工);其余试剂都是国产分析纯。
细胞:
mcf-7-luc是萤光素酶表达人乳腺癌细胞细胞株。
实验动物:
(1)种属和品系:健康雌性balb/cnude(spf级别),5-6周龄。(2)种属和品系:fvb-luc+转基因小鼠(萤光素酶表达小鼠)。
仪器:
ecz-400s核磁共振仪(日本jeol公司);lb983nightowlii小动物活体成像仪(德国berthold公司);yrt-3型熔点测定仪(天津市天大天发科技有限公司);abiq-starelite高分辨质谱仪(美国应用生物系统公司);二氧化碳培养箱(美国thermofisherscientific公司);酶标仪(clinibio公司thermofisherscientific,finland);自动双纯水蒸馏器(美国millipore公司);超净工作台(苏州净化设备有限公司);pb-21型ph计(德国sartorius公司);pharmaspecuv-2401pc紫外分光光度计(日本shimadzu公司);shb-iiis循环水式多用真空泵(郑州长城科工贸有限公司);rtcbasic磁力搅拌器(德国ika公司)。
2、溶液的配制
(1)bf-1溶液的配制:bf-1(4.5mg,0.01mmol)溶解于dmso(10ml)中得到1mm的探针溶液。探针溶液需要低温避光保存。
(2)sec储备液的配制:(sec)2(selenocystinedimethylester)(3.4mg,0.01mmol)与dtt(1.5mg,0.01mmol)溶解于去离子水(20ml)中得到1mm的sec溶液,将储备液稀释成1.0mm和100μm的溶液备用。sec储备液需要现用现配。
(3)含mgcl2(10mm)的tris-hcl缓冲液的配制:mgcl2(9.5mg,0.1mmol)溶解于tris-hcl缓冲液(10ml,50.0mm)中得到含mgcl2(10mm)的tris-hcl缓冲液。
(4)cys(l-半胱氨酸)储备液的配制:cys(12.1mg,0.1mmol)溶解于去离子(10ml)中得到10.0mm的储备液,将储备液稀释成1.0mm和100μm的溶液备用。
(5)hcy(同型半胱氨酸)储备液的配制:hcy(13.5mg,0.1mmol)溶解于去离子水(10ml)中得到10.0mm的储备液,将储备液稀释成1.0mm和100μm的溶液备用。
(6)gsh(谷胱甘肽)储备液的配制:gsh(30.7mg,0.1mmol)溶解于去离子水(10ml)中得到10.0mm储备液,将储备液稀释成1.0mm和100μm的溶液备用。
(7)na2s·9h2o(九水硫化钠)储备液的配制:5mgedta溶于25mlschlenk管中的10ml去离子水中,向溶液中通氮气15min。在氮气条件下,将na2s·9h2o(24.0mg,0.1mmol)溶于溶液中,得到10mmna2s储备液,将其稀释成1.0mm和100μm的溶液备用。na2s储备液需要现用现配。
(8)nac(n-乙酰-l-半胱氨酸)储备液的配制:nac(16.3mg,0.1mmol)溶解于去离子水(10ml)中得到10.0mm储备液,将储备液稀释成1.0mm和100μm的溶液备用。
(9)其他生物分析物的储备溶液,包括ala,glu,trp,met,tyr,leu,val,ser,pro,arg,gly,phe,his,gln,asn,ile,thr等氨基酸;licl,nacl,kcl,mgcl2,alcl3,zn(no3)2,mn(no3)2,co(no3)2,cd(no3)2,ni(no3)2,cacl2,hgcl2,cu(no3)2,fecl2,fecl3,agno3等金属盐;naf,nacl,kbr,ki,naaco,nahco3,nan3,nano3,na2so4,nascn,na2c2o4,na2s2o7,nahso3,kcn,naclo,na2hpo4等阴离子;还原剂(dtt,nadh),葡萄糖,抗坏血酸;硒化合物如na2seo3,na2se,se-甲基硒半胱氨酸,硒代胱氨酸,硒代蛋氨酸。
3、探针识别硒半胱氨酸原理
将bf-1(4.5mg,0.01mmol)溶于dmso(1ml)中,加入溶有(sec)2(3.4mg,0.01mmol)和dtt(1.5mg,0.01mmol)的tris-hcl缓冲液(1ml,50.0mm,ph=7.4,mgcl2=10mm),在37℃下反应1h。乙酸乙酯(3×10ml)萃取,浓缩,通过hrms和hnmr确认反应产物,从而确认探针bf-1的反应原理。
4、生物发光探针bf-1对sec的检测性能研究
溶液配制:dmso作溶剂的bf-1探针溶液占测试液总体积的1%;sec、氨基酸、金属离子、阴离子、活性氧和活性氮等识别物溶液按所需浓度加入后,用tris-hcl缓冲液(含mgcl2=10mm)稀释至测试液总体积的99%,测试液加入黑色96孔细胞培养板中,摇床37℃孵育30min后,再向每个孔加入atp(2mm,50μl)和luciferase(2μg/ml)。以不加入sec的测试液(用等体积的缓冲溶液代替sec溶液),作为空白对照。用lb983nightowlii小动物活体成像仪进行成像。选择生物发光模式,曝光时间60s。采用indigo软件进行图像和数据分析。每个数据至少平行测定3次,数据以mean±sd表示。
5、检测限的测定
探针自身的荧光发射光谱测定10次,计算10次测定的荧光强度的标准偏差。接着将探针与一定浓度范围内sec反应,得到sec浓度与荧光强度的线性方程。检测限的计算公式:检测限=3σ/k。σ代表空白样的标准偏差,k代表荧光强度与sec浓度线性方程的斜率。
6、细胞培养
mcf-7-luc是萤光素酶表达的人乳腺癌细胞,在细胞培养箱中以37℃、5%co2条件进行培养。细胞培养基是dmem高糖,含10%胎牛血清、青霉素-链霉素100μg/ml。细胞生长到对数生长期时,用胰酶消化,制成细胞悬液(5×106/ml)接种100μl到黑色96孔细胞培养板中。36h后,细胞贴壁张开,可以进行实验。
7、细胞毒性测试
探针及探针与sec反应后的产物对细胞生长的抑制作用是通过mtt法测定的。将细胞接种于96孔板上,密度为50,000细胞/孔,细胞在5%co2,37℃条件下培养。细胞与不同浓度的化合物孵育24h。以培养基中没有添加化合物的细胞作为对照。24h后,向每个孔中加入20μl的mtt染料(3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyltetrazoliumbromide,5mg/mlinphosphatebufferedsaline),继续37℃孵育4h。接着将剩余的mtt溶液除去,每孔加入150μl的dmso溶解甲瓒晶体,用摇床震荡10min后,用酶标仪(elx808iu,bio-tekinstrumentsinc,usa)测定570nm处的吸光度。每个样本至少有三个复孔,至少测定三次。采用huberandkoella方法计算ic50值。
8、细胞水平生物发光成像
8.1外源性sec的细胞成像
在细胞培养箱中,将mcf-7-luc细胞与不同浓度(sec)2(终浓度0,0.5,1,5,10,20μm,溶剂为10μlsaline)分别孵育(1h,6h,12h,24h)后,加入探针bf-1(终浓度10μm,溶剂为1μldmso),37℃孵育30min。在成像前,用磷酸盐缓冲液温和的洗涤三次。用lb983nightowlii小动物活体成像仪进行成像。选择生物发光模式,曝光时间60s。采用indigo软件进行图像和数据分析。
8.2内源性sec的细胞成像
在细胞培养箱中,将mcf-7-luc细胞与不同浓度na2seo3(溶剂为10μlsaline)分别孵育(1h,6h,12h,24h)后,加入探针bf-1(终浓度10μm,溶剂为1μldmso),37℃孵育30min。在成像前,用磷酸盐缓冲液温和的洗涤三次。用lb983nightowlii小动物活体成像仪进行成像。选择生物发光模式,曝光时间60s。采用indigo软件进行图像和数据分析。
9、动物饲养
balb/cnude雌性裸鼠,体重20-25g,5-6周龄。用雌性裸鼠来检测mcf-7-luc移植瘤中的sec。fvb-luc+转基因小鼠,体重20-25g。fvb-luc+转基因小鼠可全身表达萤光素酶,是bf-1对活体中sec实时成像的理想动物模型。以上所用动物协议由徐州医科大学动物保护与使用委员会批准,进行的动物实验符合中国法律在保护和使用实验动物的规定。balb/cnude小鼠和fvb-luc+小鼠饲养在特定的无病原体环境中。实验前一周使动物适用实验环境,置于自然昼夜节律光照条件下分笼群养,温度为(22±2)℃,湿度为50±10%,自由摄食饮水。
10、活体水平生物发光成像
10.1外源性sec的活体成像
成像前,fvb-luc+小鼠腹腔注射10%水合氯醛(0.04ml/10g)麻醉,雌雄随机分组。fvb-luc+小鼠腹腔注射探针bf-1(1.0mm,100μl,dmso:saline=1:9)作对照组;其它组小鼠腹腔注射(sec)2(1mm,5mm,100μlinsaline),分别于1h,6h,12h后,腹腔注射探针bf-1(1.0mm,100μl,dmso:saline=1:9),0-60min内,每隔5min用lb983nightowlii小动物活体成像仪进行成像。选择生物发光模式,曝光时间0.01s。采用indigo软件进行图像和数据分析。
10.2内源性sec的活体成像
成像前,fvb-luc+小鼠腹腔注射10%水合氯醛(0.04ml/10g)麻醉,雌雄随机分组。fvb-luc+小鼠腹腔注射探针bf-1(1.0mm,100μl,dmso:saline=1:9)作对照组;其他组小鼠腹腔注射na2seo3(1mm,5mm,100μlinsaline),分别于1h,6h,12h后,腹腔注射探针bf-1(1.0mm,100μl,dmso:saline=1:9),0-60min内,每隔5min用lb983nightowlii小动物活体成像仪进行成像。选择生物发光模式,曝光时间0.01s。采用indigo软件进行图像和数据分析。
11、裸鼠移植瘤模型的制备
收集mcf-7-luc,制成1×108个/ml的细胞悬液,以体积比1:1加入基质胶,混匀,每只balb/cnude雌性裸鼠适应环境1-2周后,腋下注射200μl。约4周后,肿瘤体积达200mm3的裸鼠可用于成像实验。
12、肿瘤组织内sec的生物发光检测
成像前,balb/cnude雌性裸鼠腹腔注射10%水合氯醛(0.04ml/10g)麻醉,随机分组。尾静脉注射探针bf-1(2.0mm,100μlsaline,3%dmso,1%tween80)的裸鼠作为空白对照组;其它组小鼠瘤内注射na2seo3(1mm,7mm,100μlsaline),分别于1h,6h,12h后,再尾静脉注射探针bf-1(2.0mm,100μlsaline,3%dmso,1%tween80),用lb983nightowlii小动物活体成像仪进行成像。选择生物发光模式,曝光时间0.01s。采用indigo软件进行图像和数据分析。
13、数据处理
数据以均数±标准差(mean±sd)表示,使用spss16.0软件进行统计分析。多组间比较采用完全随机设计的单因素方差分析(one-wayanova)。p<0.05表示差异有统计学意义。
二、实施例
实施例1:
化合物ⅱ的制备:将吡啶盐酸盐(1.8g,15.57mmol)加入15ml耐压管中,加热至200℃直至完全溶解。然后加入2-氰基-6-甲氧基苯并噻唑(100mg,0.53mmol),之后在200℃下反应2h。在冰浴下,将上述反应液用10%nahco3溶液调节ph至7。用etoac(15ml×5)萃取混合物,有机层经无水na2so4干燥并浓缩,减压除去溶剂。粗产物通过硅胶柱层析纯化(silica,hexane:etoac,8:1v/v),得到白色固体50mg,收率54.0%。tlc(silica,hexane:etoac,2:1v/v):rf=0.45.
实施例2:
化合物ⅲ的制备:将2-氰基-6-羟基苯并噻唑(100mg,0.57mmol)溶于dcm:meoh=2:3(10ml:15ml)混合溶液中,并向溶液通入n2。将d-半胱氨酸盐酸盐(136mg,0.86mmol)和k2co3(119mg,0.86mmol)溶于dih2o:meoh=1:1(3ml)混合溶液中,滴加进上述2-氰基-6-羟基苯并噻唑的溶液中,冰浴避光反应10min。反应完毕后,减压蒸馏除去dcm和meoh,然后用盐酸(1m)溶液将ph调节至2-3,有黄色沉淀析出。过滤沉淀,并用dih2o洗涤直至ph变为中性,得到d-luciferin粗产品,通过柱层析(silica,dcm:meoh:acoh,10:1:1v/v/v)纯化得到淡黄色固体128mg,产率80%。谱图见图1和图2。tlc(silica,dcm:meoh:acoh,5:1:1v/v/v):rf=0.60;1hnmr(400mhz,cd3od):δ7.87-7.90(m,1h),7.32-7.33(m,1h),7.04-7.7.07(m,1h),5.38(t,j=9.6hz,1h),3.73-3.77(m,2h);hrms(esi+):(m+h)+calcd.forc11h9n2o3s2,281.0054;found,281.0049;(m+na)+calcd.forc11h8n2o3nas2,302.9874;found,302.9868.
实施例3:
bf-1的制备:将d-萤光素(50mg,0.18mmol)、2,4-二硝基氟苯(49.8mg,0.27mmol)与dipea(23mg,0.18mmol)溶于无水ch2cl2(15ml)中,在25℃下反应2h。减压蒸馏除去溶剂,得到黄色粗品,粗产物通过柱层析(silica,dcm:meoh,60:1v/v)纯化得到白色固体24mg,收率30%。谱图见图3和图4。tlc(silica,dcm:meoh,4:1v/v):rf=0.40;1hnmr(400mhz,dmso-d6):δ8.94(d,j=2.8hz,1h),8.48(dd,j=9.2,2.8hz,1h),8.30(d,j=8.8hz,1h),8.16(d,j=2.4hz,1h),7.55(dd,j=8.8,2.4hz,1h),7.38(d,j=9.6hz,1h),5.47(t,j=8.8hz,1h),3.70-3.85(m,2h);13cnmr(100mhz,dmso-d6):δ171.52,164.86,161.88,154.90,153.57,150.94,142.56,140.35,137.58,130.27,126.46,122.46,121.03,120.76,114.39,78.72,35.40;hrms(esi+):(m+na)+calcd.forc17h10n4o7nas2,468.9888;found,468.9880.
三、效果验证
1、生物发光探针bf-1对sec的检测性能研究
1.1bf-1与sec反应的线性关系及检测限
将bf-1(10μm)与不同浓度的sec(0-300μm)孵育,观察生物发光强度与sec浓度之间的关系,由图7可见,随着sec浓度的增加,生物发光强度逐渐增强,bf-1与sec的反应比例为1:10时,生物发光强度达到峰值(580倍)。在tris-hcl缓冲液中,生物发光强度与sec(0-20μm)浓度范围内呈现良好的线性关系,检测限可达8nm。上述结果说明探针bf-1具有较高的检测灵敏度,可以对生物样本中nm级别的sec进行定量检测。化合物bf-1与sec反应产物的谱图如图5和图6所示。
1.2bf-1与sec反应的时间
将bf-1(10μm)与sec(100μm)孵育(0-60min),观察生物发光强度与孵育时间之间的关系,由图8可见,随着孵育时间的增加,生物发光强度逐渐增强,30min时,生物发光强度达到峰值(580倍),反应趋于完全。
1.3bf-1与sec的选择性研究
将bf-1与各种生物活性物质共同孵育,观察生物发光强度,由图9可见,在各种含硫化合物和含硒化合物中,只有sec(100μm)引起了较强的生物发光(580倍)。cys,hcy,gsh,gssg,s8,na2s,nac,na2seo3,na2se,se-methylselenocysteine,selenocystine,selenomethionine几乎没有产生明显的生物发光信号。
不含巯基的氨基酸(ala,glu,trp,met,tyr,leu,val,ser,pro,arg,gly,phe,his,gln,asn,ile,thr)(图10);金属盐(licl,nacl,kcl,mgcl2,alcl3,zn(no3)2,mn(no3)2,co(no3)2,cd(no3)2,ni(no3)2,cacl2,hgcl2,cu(no3)2,fecl2,fecl3,agno3);还原剂(dtt,nadh),葡萄糖,抗坏血酸(图11);阴离子(naf,nacl,kbr,ki,naaco,nahco3,nan3,nano3,na2so4,nascn,na2c2o4,na2s2o7,nahso3,kcn,naclo,na2hpo4)(图12);活性氧类(h2o2,·ocl-,o2-,·oh,tbuooh);活性氮物质(no2-,no)(图13)均未见明显的生物发光信号。因此,bf-1可以不受其他物质干扰,选择性地检测生物体内sec。
2、细胞水平生物发光成像
2.1外源性硒半胱氨酸的细胞生物发光成像
在生物发光成像前,首先检测探针bf-1的细胞毒性,mcf-7-luc细胞与bf-1(0,5,10,20,50,100μm)孵育24h后,在bf-1浓度低于10μm时,细胞的存活率在90%以上(图14)。mcf-7-luc细胞与bf-1(10μm)孵育6h、12h、18h以及24h后,细胞存活率仍在90%以上,说明bf-1毒性很低,而且在10μm浓度下,不会影响细胞的正常形态(图15)。
(sec)2在生物体内与巯基化合物反应可生产外源性sec。mcf-7-luc细胞与不同浓度(sec)2(终浓度0,0.5,1,5,10,20μm,溶剂为10μlsaline)孵育12h后,加入探针bf-1(终浓度10μm,溶剂为1μldmso),37℃孵育30min,于小动物活体成像仪下进行成像。由图16a可见,只孵育探针的细胞,呈现极其微弱的生物发光信号,推测这可能是由于内源性硒半胱氨酸引起的。mcf-7-luc与(sec)2孵育后,可见明亮的生物发光信号,且其生物发光强度随着(sec)2浓度增加而增强(61倍)(图16b)。此外,进一步考察(sec)2(5μm)孵育时间(1h,6h,12h,24h),再加入探针bf-1(终浓度10μm,溶剂为1μldmso)对生物发光强度的影响,发现随着(sec)2孵育时间的延长,产生的信号逐渐增强(分别是14,25,44,48倍)(图17)。上述结果说明,bf-1能够实现细胞中外源性硒半胱氨酸的生物发光成像。
2.2内源性硒半胱氨酸的细胞生物发光成像
本实验采用na2seo3作为内源性sec的来源。将mcf-7-luc细胞与不同浓度na2seo3(终浓度0,0.5,1,5,10,20μm,溶剂为10μlsaline)孵育(12h)后,加入探针(终浓度10μm,溶剂为1μldmso),37℃孵育30min,于活体成像仪下进行成像。由图18a可见,只孵育探针的细胞,呈现极其微弱的生物发光信号,推测这可能是由于内源性硒半胱氨酸引起的。mcf-7-luc与na2seo3孵育后,可见明亮的生物发光信号,且其生物发光强度随着na2seo3浓度增加而增强(44倍)(图18b)。此外,进一步考察na2seo3(5μm)孵育时间(1h,6h,12h,24h),再加入探针(终浓度10μm,溶剂为1μldmso)对生物发光强度的影响,发现随着na2seo3孵育时间的延长,产生的信逐渐增强(分别是5,14,31,39倍)(图19)。上述结果说明,bf-1能够实现细胞中内源性硒半胱氨酸的生物发光成像。
3、活体水平生物发光成像
3.1外源性硒半胱氨酸的活体生物发光成像
fvb-luc+小鼠腹腔注射探针bf-1(1.0mm,溶剂为100μl,dmso:saline=1:9)作对照组;另外三组,腹腔注射(sec)2(5mm,溶剂为100μlsaline),分别于1h,6h,12h后,再腹腔注射探针bf-1(1.0mm,溶剂为100μl,dmso:saline=1:9)。由图20可知,只注射探针时,小鼠有微弱的生物发光信号,推测这可能是由于内源性硒半胱氨酸引起的。小鼠腹腔注射(sec)2孵育后,可见有较强的生物发光信号(18倍)。此外,也考察了(sec)2注射后的时间对生物发光强度的影响,发现随着(sec)2注射后时间的延长,产生的生物发光信号逐渐增强(8,12.6,18倍)。上述结果说明,bf-1能够实现活体中外源性硒半胱氨酸的生物发光成像。
3.2内源性硒半胱氨酸的活体生物发光成像
fvb-luc+小鼠腹腔注射探针bf-1(1.0mm,溶剂为100μl,dmso:saline=1:9)作对照组;另外三组,腹腔注射na2seo3(5mm,溶剂为100μlsaline),分别于1h,6h,12h后,再腹腔注射探针bf-1(1.0mm,溶剂为100μl,dmso:saline=1:9)。考察na2seo3注射后的时间对生物发光强度的影响,发现随着na2seo3注射后时间的延长,产生的生物发光信号逐渐增强(4.2,6.6,11倍)(图21)。由图22可知,只注射探针时,有较弱生物发光,推测这可能是由于内源性硒半胱氨酸引起的,而且其生物发光强度从5-60min,基本没有变化。小鼠腹腔注射na2seo3(5倍当量)后,在5min即可观察到较强的生物发光信号(6.6倍),20min左右达到峰值(11倍)(图22,23),30min后逐渐下降。上述结果说明,探针bf-1与sec响应较快,且产生的生物发光信号较强且比较稳定。小鼠腹腔注射na2seo3(1倍当量)后,也可见生物发光信号,且其强度的变化趋势与5倍当量na2seo3基本一致,说明生物发光信号强度与na2seo3浓度呈正比(图23)。上述结果说明,bf-1能够实现活体中内源性硒半胱氨酸的生物发光成像。
4、肿瘤组织内sec的生物发光检测
基于bf-1探针在细胞和活体水平能够实现内源性sec的有效检测,进一步考察该探针是否适用于肿瘤组织内sec的检测。构建裸鼠移植瘤(mcf-7-luc)模型,裸鼠尾静脉注射探针(2.0mm,溶剂为100μlsaline,3%dmso,1%tween80)作对照组;瘤内注射na2seo3(1mm,7mm,溶剂为100μlsaline),分别于1h,6h,12h后,再尾静脉注射探针bf-1(2.0mm,溶剂为100μlsaline,3%dmso,1%tween80),用lb983nightowlii小动物活体成像仪进行成像。结果表明(图24),对照组有非常微弱的生物发光信号,推测可能是本底的内源性sec造成的;在瘤内注射na2seo3后,在肿瘤组织内可见较强的生物发光信号,并且随着na2seo3注射后的时间延长,生物发光强度逐渐增加(9.2,23,31倍)。小鼠腹腔注射na2seo3(3.5倍当量)后,在5min即可观察到较强的生物发光信号,10min左右达到峰值(31倍),随后逐渐下降(图25,26)。小鼠腹腔注射na2seo3(0.5倍当量)后,也可见生物发光信号(7倍),且其强度的变化趋势与3.5倍当量na2seo3基本一致,说明生物发光信号强度与na2seo3浓度呈正比。总之,结果表明探针bf-1可以作为体内监测肿瘤内源性sec的有效分析工具。
- 还没有人留言评论。精彩留言会获得点赞!