一种基因探针标记试剂盒及其应用的制作方法
本发明涉及基因探针标记技术领域,尤其是一种基因探针标记试剂盒及其应用。
背景技术:
现代医学发展至今日,对疾病的认识愈发深刻,很多种疾病的发生和发展都与基因的重组或重排有关,例如间变性淋巴瘤激酶,其编码基因表示为alk,首先发现于间变性大细胞淋巴瘤中,是靶向治疗的重要靶标之一。alk基因位于2号染色体上,长度为728kb,其cdna全长含有29个外显子,蛋白含有1620个氨基酸,分子量约为177千道尔顿(kda)。alk基因重排的断裂点位于外显子19和20之间,alk基因发生重排后多具有生物学功能,其表达产物为嵌合酪氨酸激酶,通过coiledcoil结构域形成多聚体,引起组成性的alk激活,alk信号可通过激活ras-mek-erk,jak3-stat3和pi3k-akt等下游信号通路持续地促进细胞增殖,导致肿瘤的产生和转移。
铜绿假单胞菌(p.aeruginosa)又称绿脓杆菌,在自然界分布广泛,为存在于土壤中的常见细菌之一,该菌是一种专性需氧型革兰氏阴性杆菌。其最适生长温度范围为25~30℃,其在普通培养基上可以生存并能产生两种水溶性的色素,一种是绿脓素(pyocynin),无荧光性,具有抗菌作用;另一种为荧光素(pyoverdin),呈绿色,具有显著荧光性。
现有的alk基因重排检测方法中包括荧光原位杂交(fish)技术,该方法检测alk基因重排具有高特异性和高准确性的优点,但是,由于荧光原位杂交技术在检测基因重排的过程中需要使用荧光标记的基因探针,当检测的样本数量不多时,现有fish技术的检测结果中,试剂的荧光强度是足够的,阅片人能准确地判读杂交信号,然而,一方面,肿瘤患者数量日益增多,导致采用荧光原位杂交(fish)技术检测alk基因重排的需求越来越大,由于阅片人数量有限,肿瘤患者采用fish技术的检测alk基因重排的结果需要等待更长时间才会传递给阅片人,此时,基因检测试剂(即探针)的荧光强度减弱,导致阅片人判读信号的难度加大,对检测结果的分析灵敏度也降低,出现错误诊断结果的可能性上升;另一方面,当医生结合患者的其它检测结果,对患者是否发生基因重排的结果产生怀疑,需要复检荧光原位杂交的拍片时,如果基因检测试剂(即探针)的荧光强度可以保持足够长的时间,可以省去再次进行荧光原位杂交(fish)技术检测alk基因重排的时间成本、人力成本和试剂成本,而现有的试剂盒中探针的荧光强度保持时间明显不够。
技术实现要素:
基于上述问题,本发明的目的在于克服上述现有技术的不足之处而提供一种标记基因探针的方法,该方法标记的探针的荧光信号稳定性显著增加,提升了基因重排检测结果的准确性,还可以显著降低检测成本。
为实现上述目的,本发明采取的技术方案包括以下几个方面:
在第一个方面,本发明提供了一种基因探针标记试剂盒,所述试剂盒包括绿色荧光染料,所述绿色荧光染料中含有铜绿假单胞菌荧光素。
优选地,所述铜绿假单胞菌荧光素在所述绿色荧光染料中的质量百分含量为5~10%。
优选地,所述绿色荧光染料中还含有选自各无机和有机荧光染料中的任意一种或多种。
优选地,所述绿色荧光染料中还含有alexafluor488nhsester。
优选地,所述绿色荧光染料由铜绿假单胞菌荧光素和alexafluor488nhsester组成。
优选地,所述试剂盒中还包括纳滤水、硼酸标记缓冲液。
更优选地,所述绿色荧光染料由7.3%的铜绿假单胞菌荧光素和92.7%的alexafluor488nhsester组成。本申请的发明人经多次试验发现,当铜绿假单胞菌荧光素在所述绿色荧光染料中的质量百分含量为5~10%时,标记后的dna探针用于fish技术的试验结果中,荧光信号强度可以保持的时间相比现有技术均得到显著延长;尤其是,当基因探针标记试剂盒中绿色荧光染料由7.3%的铜绿假单胞菌荧光素和92.7%的alexafluor488nhsester组成时,标记后的dna探针用于fish技术的试验结果中,荧光信号强度可以保持的时间相比现有技术延长得最多。
在第二个方面,本发明提供了一种alk基因重排检测试剂盒,包括标记荧光染料的、针对断裂点上游的第一组探针和针对断裂点下游的第二组探针,其中,第一组探针或第二组探针采用上述基因探针标记试剂盒进行荧光标记。应当说明的是,所述第一组探针和第二组探针的碱基序列并不限于一种,只要能分别与断裂点上游和断裂点下游核酸稳定地杂交、结合在一起即可,由此,第一组探针和第二组探针的碱基序列可以是很多种,其中1个或部分碱基发生了变化,并不影响该探针与断裂点上游或下游的核酸序列杂交,这类探针也属于本发明的alk基因重排检测试剂盒可用的,属于本发明的保护范畴;由此,所述第一组探针可以取自bac克隆rp11-798p1,ctd-3216p10,ctd-2042b15中的一种或多种,所述第二组探针可以取自bac克隆rp11-119l19,rp11-7d16,rp11-349e3中的一种或多种;对上述克隆分别提取质粒dna,纯化,氨基标记,荧光标记。氨基标记的方法为常规核酸标记方法,包括但不限于随机引物法、切口平移法、pcr法等,例如使用aminoallyl-dutp随机标记。荧光标记所述第一组探针与第二组探针的荧光染料颜色不一样。
需要说明的是,alk基因两端存在很多细菌人工染色体(bac)克隆,但这些克隆没有经过验证,缺乏特征性描述,且其中许多克隆为商品化克隆,只进行末端测序,存在约10%的错误率,体现为这些克隆标记后显示的不是目的片段或在目的片段之外,还存在较多杂交信号。同时,bac克隆还存在标记后信号强度不强或bac克隆之间信号不连续的情况。因此,获得特异性好、信号强度高且信号连续、不弥散的克隆是能够准确、灵敏地检测alk基因重排的关键。本发明经过多重分析和验证之后,最终选择确定的bac克隆rp11-798p1,ctd-3216p10,ctd-2042b15,rp11-119l19,rp11-7d16,rp11-349e3(这些克隆片段的序列均可从ucsc、empiregenomics或ncbi查询到,具体网址为http://genome.ucsc.edu/;http://www.empiregenomics.com/helixhq/clonecentral/search/human/;https://www.ncbi.nlm.nih.gov/genome/gdv/),其无论是在特异性、信号强度还是信号的连续性上都能满足检测要求,对上述bac克隆进行荧光标记,可以灵敏、准确地检测alk基因重排。
优选地,所述第一组探针或第二组探针采用上述基因探针标记试剂盒进行荧光标记,其中,绿色荧光染料由7.3%的铜绿假单胞菌荧光素和92.7%的alexafluor488nhsester组成。
优选地,所述第一组探针或第二组探针采用红色荧光染料进行标记,所述红色荧光染料由藻红蛋白和alexafluor594nhsester(购自thermofisher公司)组成,其中,藻红蛋白的质量百分含量为5~10%。
优选地,所述红色荧光染料由6.4%(w/w)的藻红蛋白和93.6%(w/w)的alexafluor594nhsester组成。
在第三个方面,本发明提供了一种基因探针标记的方法,包括如下步骤:
(1)提供氨基标记的dna探针;
(2)用纳滤水溶解所述氨基标记的dna探针,再依次加入硼酸标记缓冲液和绿色荧光染料,在室温下避光反应6小时以上,即得;
其中,所述绿色荧光染料由铜绿假单胞菌荧光素和alexafluor488nhsester组成,绿色荧光染料中铜绿假单胞菌荧光素的质量百分含量为5~10%。
综上所述,本发明的有益效果为:
本发明的基因探针标记试剂盒采用铜绿假单胞菌荧光素对基因探针标记,可以减少试验操作过程中的非避光(光照条件下)操作对试验结果的影响,同时方便对检测样品的运输(不必全程避光运输);另一方面,采用含有铜绿假单胞菌荧光素的绿色荧光染料,杂交后探针上的荧光强度在光照条件下可以持续更长时间而不衰减,由此,阅片人可以有更多时间来分析fish杂交的检测结果,提升了基因重排检测结果的准确性,有利于获取待检者的准确检测报告,从而有助于医生制定合理有效的治疗策略。
附图说明
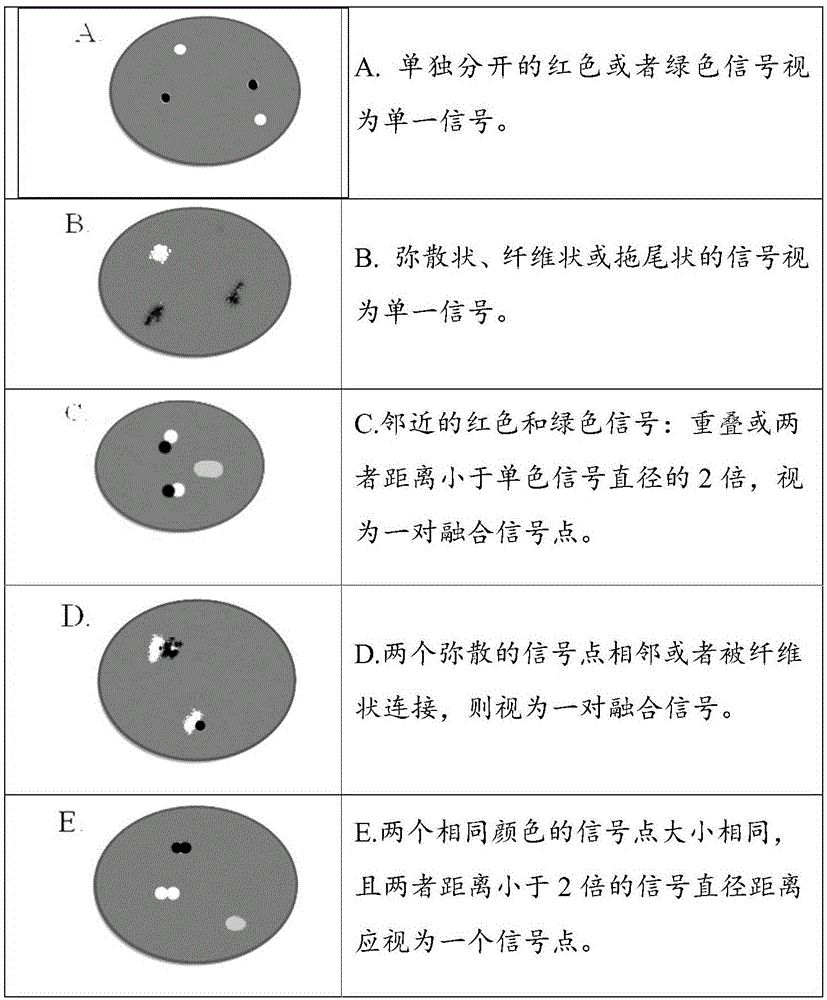
图1为实施例6中信号计数指南-典型信号模式图;
图2为实施例6中信号计数指南-典型阳性细胞信号模式图;
图3为实施例6中信号计数指南-典型阴性细胞信号模式图;
图4为实施例7中实验组20000lux光照处理不同时长后对阴性参考品的检测结果图;
图5为实施例7中实验组500lux光照处理不同时长后对阴性参考品的检测结果图;
图6为实施例7中对照组20000lux光照处理不同时长后对阴性参考品的检测结果图;
图7为实施例7中对照组500lux光照处理不同时长后对阴性参考品的检测结果图;
图8为实施例9中实验组和对照组探针检测样本的光漂白测试结果分析图。
具体实施方式
为更好的说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。如无特别说明,本申请中试剂浓度均为质量浓度。
实施例1
本发明的基因探针标记试剂盒的一种实施例,所述试剂盒包括绿色荧光染料的dmso溶液(浓度为200μg/15μl)、纳滤水和硼酸标记缓冲液(制备方法参见实施例4),绿色荧光染料由7.3%的铜绿假单胞菌荧光素和92.7%的alexafluor488nhsester组成。由此混合染料(铜绿假单胞菌荧光素和alexafluor488nhsester)标记后的探针可以提高探针的荧光强度、光照稳定性,使得信号更强,且不易淬灭。
实施例2
本发明的基因探针标记试剂盒的一种实施例,所述试剂盒包括绿色荧光染料的dmso溶液(浓度为200μg/15μl)、纳滤水和硼酸标记缓冲液(制备方法参见实施例4),绿色荧光染料由铜绿假单胞菌荧光素和alexafluor488nhsester组成,铜绿假单胞菌荧光素在绿色荧光染料中的质量百分含量为5%。
实施例3
本发明的基因探针标记试剂盒的一种实施例,所述试剂盒包括绿色荧光染料的dmso溶液(浓度为200μg/15μl)、纳滤水和硼酸标记缓冲液(制备方法参见实施例4),绿色荧光染料由铜绿假单胞菌荧光素和alexafluor488nhsester组成,铜绿假单胞菌荧光素在绿色荧光染料中的质量百分含量为10%。
实施例4
本发明的基因探针标记方法的一种实施例,包括如下步骤:
(1)提供氨基标记的dna探针100μg;
(2)用纳滤水10μl溶解所述氨基标记的dna探针,再依次加入硼酸标记缓冲液75μl和绿色荧光染料的dmso溶液15μl(浓度同实施例1),在室温下避光反应6小时以上(或者过夜反应),即得标记后的基因探针;
其中,硼酸标记缓冲液的配制方法为:取十水四硼酸钠1.9g溶解于50mlddh2o,ph值调至8.5,0.45μm滤器过滤,保存于-25℃至-18℃,备用;
绿色荧光染料的dmso溶液由铜绿假单胞菌荧光素和alexafluor488nhsester制成,取铜绿假单胞菌荧光素14.6μg,alexafluor488nhsester185.4μg溶解于15μldmso中,涡旋混匀,于暗处密封保存;
所述铜绿假单胞菌荧光素的提取制备方法,包括如下步骤:
(1)发酵培养基的配制方法:乳糖5g,蛋白胨10g,k2hpo45g,无菌水1000m1,ph6.2,每125m1分装于300ml三角瓶中,经高温蒸汽灭菌(1×105pa灭菌30min)后使用。
(2)铜绿假单胞菌的培养方法:挑取铜绿假单胞菌(atcc27853)培养的单菌落接种于发酵培养基中,在180r/min、25℃条件下摇床培养18~24h后,制作成种子液发酵,按每1ml种子液接种到装有125ml的发酵培养基中(三角瓶300ml)15-20瓶以扩大培养,25℃振荡培养(140r/min)60h,待用。
(3)铜绿假单胞菌(atcc27853)经液体发酵培养后,10000rpm(4℃)离心l0min,弃沉淀,得上清液,用氯仿萃取,以氯仿:甲醇(体积比为30:1)作洗脱剂,粗提物经硅胶柱色谱分离,可得到2种活性物质,分别显黄色和绿色,绿色物质经硅胶柱重复分离纯化、常压蒸发浓缩去除溶剂,得到1种绿色荧光素干燥样品,即铜绿假单胞菌荧光素,称重并于暗处密封保存。
实施例5
本发明的alk基因重排检测试剂盒的一种实施例,包括标记荧光染料的、针对断裂点上游的第一组探针和针对断裂点下游的第二组探针,其中,第一组探针或第二组探针采用实施例1基因探针标记试剂盒进行荧光标记,其中,第一组探针采用bac克隆rp11-798p1(还可以是bac克隆rp11-798p1、ctd-3216p10、ctd-2042b15中的一种或多种),第二组探针采用bac克隆rp11-119l19(还可以是bac克隆rp11-119l19、rp11-7d16、rp11-349e3中的一种或多种);对上述克隆分别提取质粒dna,纯化,氨基标记,最后进行荧光标记。
氨基标记的方法为常规核酸标记方法,包括但不限于随机引物法、切口平移法、pcr法等。其中,第一组探针采用实施例1的基因探针标记试剂盒以及实施例4的标记方法进行荧光标记;第二组探针采用红色荧光染料dmso溶液(浓度为200μg/15μl)进行标记,红色荧光染料由6.4%的藻红蛋白和93.6%的alexafluor594nhsester组成。本实施例的氨基标记、bac克隆提取和纯化采用本领域常规、通用方法即可,属于公知技术,为节省篇幅,在此省略具体实验步骤。
实施例6使用实施例5中alk基因重排检测试剂盒对临床样品的检测
利用实施例5的alk基因重排检测试剂盒对石蜡包埋组织切片进行检测,步骤如下:
一、溶液配制
胃蛋白酶缓冲液(0.1nhcl)的配制方法见表1。
表1胃蛋白酶缓冲液(0.1nhcl)的配制方法
洗涤缓冲液ⅰ的配制方法见表2。
表2洗涤缓冲液ⅰ的配制方法
洗涤缓冲液ⅱ的配制方法见表3。
表3洗涤缓冲液ⅱ的配制方法
二、样本预处理:
准备工作:开启烤片机(45℃-60℃);开启水浴锅(37±1℃);胃蛋白酶缓冲液置于37±1℃水浴锅预热,使用胃蛋白酶与预热后的胃蛋白酶缓冲液配制浓度为1.0mg/ml的胃蛋白酶工作液,工作液置于37±1℃水浴锅预热(预热至少1h)。
切片脱蜡:室温下将切片浸没在二甲苯中,脱蜡10min,更换新鲜的二甲苯重复脱蜡两次。随后将切片浸没在无水乙醇中5min,更换新鲜的无水乙醇重复一次。风干切片或置于烤片机上2-5min烘干切片。
切片预处理:将盛有超纯水的烧杯置于微波炉中加热,将切片放入沸腾的超纯水中处理25min,取出晾干。
胃蛋白酶处理:将预处理过的切片置于胃蛋白酶工作液中消化5-60min,期间每5min镜检1次(在明场下使用10×物镜观察),以大部分组织细胞分散为单个细胞为消化完成标准;消化完成后将切片浸没在超纯水中洗涤3min。置于烤片机上2-5min烘干切片。
三、fish检测
准备工作:探针平衡至室温,涡旋混匀后置于微量离心机中离心2-3s;开启并预热杂交仪,将杂交仪的湿条浸入蒸馏水中备用(至少浸泡2h),杂交时放入杂交仪;使用玻璃刀在切片反面圈出样本杂交区域。
脱水:将切片依次置于70%、85%、100%乙醇中脱水各1min。置于烤片机上2-5min烘干切片。
杂交(避光操作):在切片样本杂交区域加入10μlalk重排探针溶液(样本区域较大的样本可根据实际情况增加用量),盖上盖玻片,确保盖玻片下无气泡、探针均匀分布。使用封片胶覆盖盖玻片四周位置,形成闭合的密封圈。将切片放入已安装湿条的杂交仪中,设置杂交反应程序:85℃变性8min,42℃杂交过夜(14h~18h)。
杂交后洗涤(避光操作):开启水浴锅(76±1℃),将洗涤缓冲液ⅱ置于水浴锅预热。将杂交后的切片从杂交仪中取出,去除封片胶,置于室温的洗涤缓冲液ⅰ中5min,洗掉盖玻片,再置于76±1℃的洗涤缓冲液ⅱ中5min,期间可轻轻晃动切片1-3s;取出玻片并平衡至室温,浸入室温的洗涤液ⅰ中5min,取出玻片,室温晾干;
dapi复染(避光操作):在样本杂交区域加入10μl复染液,盖上盖玻片,室温避光5-10min后即可显微镜下观察荧光信号。dapi复染后的切片也可置于-25℃至-18℃避光保存(保存时间不超过72h),需要检测时取出切片平衡至室温后进行观察。
四、结果判定
一种alk基因重排检测试剂盒的结果判断标准为:
1)每例样本计数50个细胞,若阳性细胞数小于5个(5/50或<10%),该样本判定为阴性。
2)每例样本计数50个细胞,若阳性细胞数大于25个(25/50或>50%),该样本判定为阳性。
3)每例样本计数50个细胞,若阳性细胞数介于5-25个(10-50%),需另一阅片人另外计数50个细胞。汇总两位阅片人计数细胞数与阳性细胞数,即总计100个细胞中,若阳性细胞总数小于15个(<15%),该样本判定为阴性,若阳性细胞总数大于等于15个(≥15%),该样本判定为阳性。
显微镜下观察的荧光信号可能显现多种形态,按照图1的信号计数指南-典型信号模式)对信号进行质量判断和计数。
细胞的阳性与阴性判定:
移动显微镜视野,查找所有存在于细胞核内的信号。
(1)以下信号模式可判定为alk重排阳性细胞(详情参见图2:信号计数指南-典型阳性细胞信号模式图):
a.至少有一组分开的红色和绿色信号,且间距大于等于2倍信号点直径长度(无信号缺失);
b.单独出现一个红色信号而无对应绿色信号且另外存在一对红色/绿色信号(融合、分离皆可)。
(2)以下信号模式可判定为alk重排阴性细胞(详情见图3):
a.红色与绿色信号重叠(呈现橙黄色)、紧紧相邻或者分开但距离小于2倍信号点直径长度(无信号缺失);
b.单独出现绿色信号而无对应红色信号且另外存在一对红色/绿色信号(融合、分离皆可)。
实施例7采用实施例5的试剂盒标记后探针的光照稳定性测试
检测对象:考虑到试剂盒实际使用时的实验室环境,将试剂盒置于室温、不同光照条件下后进行光照稳定性试验;6份参考品,包括3份阴性参考品n、3份阳性参考品p,阴性参考品为alk重排阴性细胞—tpc-1细胞石蜡切片,阳性参考品为alk重排阳性细胞—h2228细胞石蜡切片;
取实施例5的试剂盒(实验组)与cytocell公司试剂盒(对照组)进行光照稳定性对照实验,两组试剂盒在光照处理前,各取7反应用量对6份参考品(每1份参考品检测理论使用1份反应量试剂,但考虑试剂黏稠度较高,多预留1反应用量以防试剂取用误差)进行检测,其余试剂去掉外包装,将装有各组分的试剂瓶在20000勒克斯(近阳光直射条件)光照强度下分别放置1h、2h、4h和8h时各批产品各取7反应量试剂对6份参考品进行检测;在500勒克斯(近实验室日常光照条件)光照强度下分别放置12h、24h、36h和48h时各取7反应对6份参考品进行检测。
检测方法:实验组参见实施例6的检测方法;对照组参见cytocell公司试剂盒产品说明书。
检测结果与分析:
不同光照条件下9个实验点的检测结果如下表4所示,各参考品在8个实验点(20000lux、8h这个实验点的结果:阅片人间重复性下降,不符合质量控制要求)均符合质量控制要求,此9个实验点的检测结果(阳性和阴性的判断标准参照实施例6)描述如下:
(1)阴性参考品(n1~3):
实验组alk基因重排阳性细胞比例均小于10%,结果均为阴性;同一类型参考品经不同阅片人阅片得出的样本检测结果一致;在20000勒克斯(lux)光照强度下放置8h时,检测的阅片人间重复性下降。
对照组alk基因重排阳性细胞比例均小于10%,结果均为阴性;同一类型参考品经不同阅片人阅片得出的样本检测结果一致;在500勒克斯光照强度下放置36h、20000勒克斯光照强度下放置4h时,检测的阅片人间的重复性下降。
(2)阳性参考品(p1~3):
实验组结果均为阳性,alk基因重排阳性细胞比例均大于20%;同一类型参考品经不同阅片人阅片得出的样本检测结果一致;在20000勒克斯光照强度下放置8h时,检测的阅片人间重复性下降。
对照组alk基因重排阳性细胞比例均大于20%;同一类型参考品经不同阅片人阅片得出的样本检测结果一致;在500勒克斯光照强度下放置36h、20000勒克斯光照强度下放置4h时,检测的阅片人间的重复性下降。
实验结果如图4~7所示,实验组在室温20000勒克斯光照条件下存放4h,或者在500勒克斯光照条件下存放48h后对阴性参考品进行即时检测,检测结果正常;而此时,对照组试剂的荧光信号强度减弱,分析灵敏度降低,信号判读难度加大,阅片人间的重复性下降。由此,表明本发明试剂盒与对照试剂盒相比,光稳定性,特别是日常光照条件下的稳定性具有显著的优势,在实际应用中减少了对同类产品需严格避光储存的局限,便于更广泛推广应用。
表4光照稳定性实验结果(阴/阳性参考品)
实施例8不同荧光标记染料对fish探针的光稳定性的影响
实验组(同实施例7)采用实施例5的alk基因重排检测试剂盒,对照组与实验组基本相同,仅荧光标记时采用的荧光标记染料不同,对照组使用的荧光染料为:红色染料中含有93.6%的alexafluor594nhsester,绿色染料中含有92.7%的alexafluor488nhsester,但未加入藻红蛋白和铜绿假单胞菌荧光素,藻红蛋白和铜绿假单胞菌荧光素由等质量双蒸水代替;探针标记的具体方法如表5所示。
表5fish探针标记方法
两组荧光标记后的探针分别对人外周血淋巴细胞中期相细胞片进行即时检测后,将两组细胞片同时置于对应波长的激发光(激发光波长与标记染料相对应,具体的,绿色染料的激发光波长为494±3nm,红色染料的激发光波长为590±3nm)下照射处理相同时间,比较两组细胞片的信号强度,结果显示实验组细胞片荧光信号不易淬灭,荧光染色细胞片可观察拍摄时间更长,激发光照下4h后荧光信号仍可识别;而对照组细胞片在激发光照下2h后荧光信号衰减严重,不易识别。
实施例9本发明的基因探针标记试剂盒的光漂白测试
取实施例5的试剂盒(实验组a)与cytocell公司试剂盒(对照组b)进行光漂白对照实验。两组试剂盒分别对2组石蜡组织样本连续切片进行fish检测,实验组参见实施例6的检测方法;对照组处理方法参见cytocell公司试剂盒产品说明书。
将荧光染色后的样本选取1个细胞分布均匀,荧光信号强的视野置于荧光显微镜下被不断地照射,每隔5min用冷ccd摄像机收集图像,分析计算之后每一次收集图形荧光信号与第一次收集图形荧光信号的比值。
检测结果如图8所示,通过分析每个时间点收集图形的荧光信号与第一次收集图形荧光信号的比值,发现使用本发明试剂盒探针标记后的样本与使用对照组市售试剂盒相比,荧光更稳定,抗淬灭能力更强。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 还没有人留言评论。精彩留言会获得点赞!