一种提高烟叶提取物中氧化酶酶活的提取方法与流程
本申请属于烟草代谢物技术领域,具体涉及一种提高烟叶提取物中氧化酶酶活的提取方法专利申请事宜。
背景技术:
烟草作为一种较为特殊的经济作物,其产量与品质直接关系到我国国民经济的健康发展。为了研究烟草基因功能,创制新的育种材料,对烟草代谢物进行深入研究和分析显然具有十分重要的意义。
sod是广泛存在于需氧生物细胞内的一族含金属辅助因子的酶,催化o2-的歧化反应,生成h2o和o2,而h2o2在过氧化氢酶(cat)和谷胱甘肽过氧化物酶(gsh—px)催化下转化为水而得以清除。因此,sod是生物体抗氧化胁迫的关键酶类,其活性决定了o2-和h2o2的浓度。烟叶生长发育过程中经常会遇到干旱、低温等环境胁迫,在这些胁迫条件下,烟苗内的内源性抗氧化剂的含量会发生显著下降,同时细胞膜透性增大,o2-大量产生,积累膜脂过氧化产物,并随环境胁迫时间的延长而增加。随着膜脂过氧化作用的加剧,活性氧生成与清除机制的失衡,烟苗的生长发育和烟叶品质会产生不可逆转的不良影响。
而过氧化物酶(peroxidase,pod)与细胞色素氧化酶是生物体内另外两种与氧化高度相关的生物酶,其中过氧化物酶(peroxidase,pod)能催化脂肪酸、芳香胺和酚类物质的氧化,是木质素合成的关键酶之一,还参与乙烯的生物合成和氧自由基的消除反应。同时,pod与植物的抗病性也有密切的关系。细胞色素氧化酶是一种高等生物呼吸链中的末端氧化酶,其负责催化的将电子从细胞色素c(cytc)传到o2的反应是能量代谢中的主要不可逆步骤,也是线粒体呼吸控制中的主要部位。
由于氧化酶类蛋白在植物生长发育过程的重要性,因此,对于生长过程中氧化酶类酶活的准确分析,对于植物生理生长研究以及植物新品种、新材料筛选和鉴定都具有重要意义。
现有技术中,植物蛋白(包括生物酶)的提取方法主要有两种:溶液法和沉淀法。其中沉淀法因其提取过程中采用了变性剂,会导致部分蛋白酶结构改变并失去活性,因此沉淀法并不适合烟草叶片全蛋白的提取。而在应用溶液法进行提取时,由于不同蛋白(生物酶)特性不同,因此具体提取所选择的提取液及提取工艺也往往缺乏可借鉴性,往往均需重新设计。而现有技术中尚未见到较好的提取氧化酶类提取方法报道。
技术实现要素:
本申请目的在于提供一种提高烟叶提取物中氧化酶酶活酶活提取方法,从而为烟草生长代谢研究奠定一定方法学基础。
本申请所采取的技术方案详述如下。
一种提高烟叶提取物中氧化酶酶活的提取方法,该方法针对新鲜烟叶中氧化酶的提取,所述氧化酶主要指:超氧化物歧化酶(sod)、过氧化物酶(peroxidase,pod)和细胞色素c氧化酶(cox);具体包括如下步骤:
(1)制备提取液,具体可采用裂解液ripa、neb或pbs;配方组成为:
裂解液ripa:tris-cl(ph8.0)、50mm,edta、1mm,sds、0.1%,nacl、150mm,np-40、1%,pmsf、1mm;
缓冲液neb:hepes(ph7.5)、20mm,kcl、40mm,edta、1mm,pmsf、1mm;
ph8.0的pbs:nacl、137mm,kcl、2.7mm,na2hpo49.5mm,nah2po4、0.5mm,pmsf、1mm;
ph7.2的pbs:nacl、137mm,kcl、2.7mm,na2hpo47.2mm,nah2po4、2.8mm,pmsf、1mm;
ph6.0的pbs:nacl、137mm,kcl、2.7mm,na2hpo41.2mm,nah2po4、8.8mm,pmsf、1mm;
(2)烟叶预处理
将栽培烟草k326(或者nc82)8-12叶期的新鲜烟叶,液氮速冻后,研磨成粉。
(3)溶液法提取
在步骤(2)研磨成粉烟叶样品中加入步骤(1)中制备的提取液(裂解液),震荡混匀后,冰上静置不少于1h;
具体用量方面,研磨成粉烟叶样品100mg,提取液(裂解液)用量为500μl-1ml;
静置完成后,5000~15000rpm离心不少于20min(离心速度具体例如为5000rpm、9000rpm或13000rpm等),保留上清液,即为含有较高氧化酶(超氧化物歧化酶(sod)、和/或过氧化物酶(peroxidase,pod)和/或细胞色素c氧化酶(cox))酶活的提取液;
进一步地,利用bca法可对上清液中蛋白浓度进行检测,可利用elisa法对上清液中氧化酶的活性进行检测。
现有技术中,针对所提取全蛋白中超氧化物歧化酶(sod)、过氧化物酶(pod)、细胞色素c氧化酶(cox)酶活进行分析测定时,由于所提取蛋白杂质较多,因而对于准确酶活测定造成了较大影响。本申请中,针对全蛋白提取方式做了部分优化,以期提高相应酶活效果活。
初步测定结果表明,经过相关提取工艺参数优化后,提取液中超氧化物歧化酶(sod)酶活得到了较好提高,可达3.7u/μg全蛋白,过氧化物酶(pod)酶活可达6.3×10-3u/μg全蛋白,而细胞色素c氧化酶(cox)酶活可达5.1×10-3u/μg全蛋白,较好达到了减少杂质蛋白干扰、提升氧化酶含量的目的。同时由于相关提取方法简单快速、耗时较短(仅1.5h左右),因此使得本申请具有较好的科研价值,可为sod、pod、cox活性分析及其它相关蛋白分析和研究奠定技术基础。
附图说明
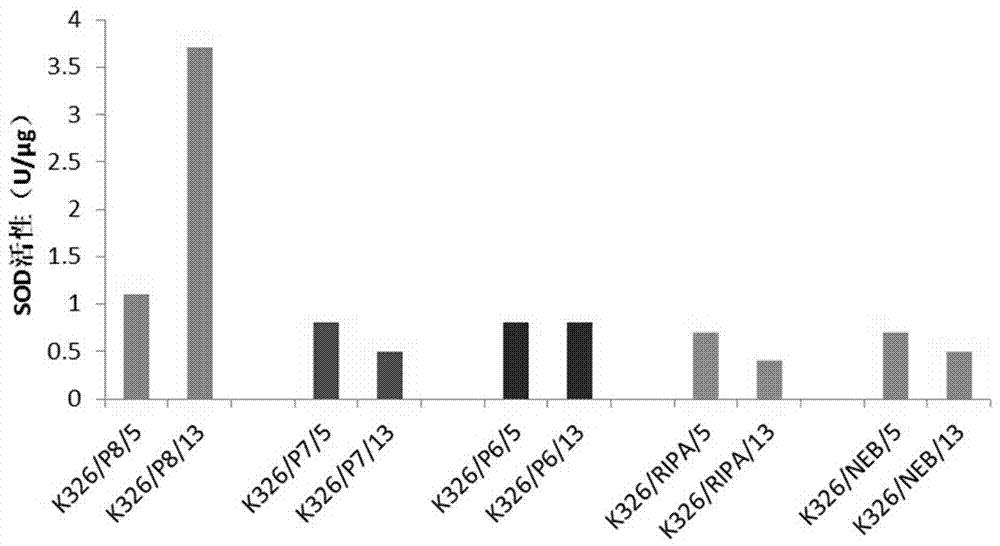
图1不同提取液不同离心速率的sod活性;
图2不同提取液比例的sod活性;
图3不同品种获得的sod活性;
图4不同提取液不同离心速率获得的pod活性;
图5不同提取液比例获得的pod活性;
图6不同品种获得的pod活性;
图7不同提取液获得的cox活性;
图8不同ph的pbs获得的cox活性;
图9不同提取液比例的cox活性;
图10不同烟草品种中pbs获得的cox活性;
各图中:k326、neb、ripa分别表示对应的裂解液,p6、p7、p8分别表示ph=6.0、7.2、8.0的pbs,数字5、13分别表示离心速度为5000、13000,1:5、1:10分别表示提取液比例。
具体实施方式
下面结合实施例对本申请做进一步的解释说明,在介绍具体实施例前,就下述实施例中涉及部分实验材料、实验方法等背景情况简要介绍说明如下。
实验材料:
栽培烟草k326和nc82,实验室培育至8-12叶期,采取新鲜烟叶。
实验方法:
1、bca法检测蛋白浓度时,具体参考如下操作步骤:
(1)取上清液,稀释10倍;根据样品数量,按50体积bca试剂a加1体积bca试剂b(50:1)配制bca工作液,充分混匀;
(2)设置空白孔、标准品孔和样品孔,每个样品三次重复,每空加入20μl蛋白提取液,200μlbca工作液;
(3)把酶标板放在振荡器上振荡30sec,37℃放置30分钟,然后在562nm下酶标仪检测,以蛋白含量(μg)为横坐标,吸光值为纵坐标,绘出标准曲线;
根据所测样品的吸光值,依据标准曲线获得相应的蛋白含量(μg),除以样品稀释液总体积(20μl),乘以样品稀释倍数即为样品实际浓度(单位:μg/μl);
2、elisa法检测酶活性时,参考如下步骤:
(1)室温平衡20min酶活性检测试剂;
(2)设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50μl;样本孔中加入待测样本50μl,空白孔不加;
除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(hrp)标记的检测抗体100μl,用封板膜封住反应孔,37℃水浴锅或恒温箱温育60min;
(3)弃去液体,吸水纸上拍干,每孔加满洗涤液(350μl),静置1min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次(也可用洗板机洗板);
每孔加入试剂盒中底物a、b各50μl,37℃避光孵育15min;
每孔加入终止液50μl,15min内,在450nm波长处测定各孔的od值;
以所测标准品的od值为横坐标,标准品的浓度值为纵坐标,绘制标准曲线,并得到直线回归方程,将样品的od值代入方程,计算出样品的浓度。
实施例1
本实施例针对提高烟叶提取物中超氧化物歧化酶(sod)酶活进行改进,具体步骤简要介绍如下。
(1)制备提取液,具体可采用裂解液ripa、neb或pbs;配方组成为:
裂解液ripa:tris-cl(ph8.0)、50mm,edta、1mm,sds、0.1%,nacl、150mm,np-40、1%,pmsf、1mm;
缓冲液neb:hepes(ph7.5)、20mm,kcl、40mm,edta、1mm,pmsf、1mm;
ph8.0的pbs:nacl、137mm,kcl、2.7mm,na2hpo49.5mm,nah2po4、0.5mm,pmsf、1mm;
ph7.2的pbs:nacl、137mm,kcl、2.7mm,na2hpo47.2mm,nah2po4、2.8mm,pmsf、1mm;
ph6.0的pbs:nacl、137mm,kcl、2.7mm,na2hpo41.2mm,nah2po4、8.8mm,pmsf、1mm;
(2)烟叶预处理
栽培烟草k326和nc82,实验室培育至8-12叶期,采集新鲜烟叶。液氮速冻后,研磨成粉。
(3)溶液法提取
在步骤(2)研磨成粉烟叶样品中加入步骤(1)中制备的提取液(裂解液),震荡混匀后,冰上静置不少于1h;
具体用量方面,研磨成粉烟叶样品100mg,提取液(裂解液)用量为500μl-1ml(具体为500μl或者1ml);
静置完成后,5000~15000rpm离心不少于20min(离心速度具体例如为5000rpm、9000rpm或13000rpm等),保留上清液,即为含有较高超氧化物歧化酶(sod)酶活的提取液;
进一步地,利用bca法对上清液中蛋白浓度进行检测,利用elisa法对上清液中sod的活性进行检测。
对不同提取液、不同ph的pbs、不同离心速度、不同提取液比例处理后上清液中sod活性进行检测,结果分别如图1、图2、图3所示。分析可以看出:采用pbs(ph8.0)处理时,高速离心参数(13000rpm)下获得酶活效果显然较高,也即高速离心情况下可以较好去除杂质蛋白对于酶活测定影响;在不同ph的pbs处理时,ph8.0的pbs提取时sod活性更高;在不同提取液用量比例处理时,1:10比例时,sod活性更高。而对于不同的栽培品种nc82,同样处理方法得到的sod的活性也较高。
总体而言,就sod酶活测定或提取而言,采用pbs(ph8.0)、提取液比例1:10、离心速率13000rpm,处理结果最优,主要原因在于,裂解处理后,高速离心情况下可以较好去除杂质蛋白对于酶活测定影响,而合适ph值也使sod的活性更好。
实施例2
本实施例以提高烟叶提取物中过氧化物酶(pod)酶活为例,进行具体改进,具体过程与实施例1类似,仅就部分操作参数做了适当调整。
对不同提取液、不同ph的pbs、不同离心速度、不同提取液比例处理后上清液中pod活性进行检测,结果分别如图4、图5、图6所示。分析可以看出:采用pbs(ph8.0)处理时,高速离心参数(13000rpm)下获得酶活效果显然较高,也即高速离心情况下可以较好去除杂质蛋白对于酶活测定影响;在不同ph的pbs处理时,ph8.0的pbs提取时pod活性更高;在不同提取液比例处理时,1:10比例时,pod活性更高。而对于不同的栽培品种nc82,同样处理方法得到的pod的活性也较高。
总体而言,就pod酶活测定或提取而言,采用pbs(ph8.0)、提取液比例1:10、离心速率13000rpm,处理结果最优,主要原因在于,裂解处理后,高速离心情况下可以较好去除杂质蛋白对于酶活测定影响,而合适ph值也使pod的活性更好。
实施例3
本实施例以提高烟叶提取物中细胞色素c氧化酶(cox)酶活为例,进行具体改进,具体过程与实施例1类似,仅就部分操作参数做了适当调整。
对不同提取液、不同ph的pbs、不同离心速度、不同提取液比例处理后上清液中cox活性进行检测,结果分别如图7、图8、图9、图10所示。分析可以看出:采用pbs(ph7.2)ripa和neb处理时,低速离心结果相对较好,分析认为,这主要是杂质蛋白之间的相互作用有一定抵消,减弱了对于cox酶活测定的影响,并且pbs的提取效果更好;在不同ph的pbs处理时,ph8.0的pbs提取时cox活性更高;在不同提取液比例处理时,1:10比例时,cox活性更高。而对于不同的栽培品种nc82,同样处理方法得到的cox的活性也较高。
总体而言,就cox酶活测定或提取而言,采用pbs(ph8.0)、提取液比例1:10、离心速率5000rpm,处理结果最优,主要原因在于,裂解处理后,杂质蛋白之间的相互作用有一定抵消,减弱了对于cox酶活测定,而合适ph值也使cox的活性更好。
- 还没有人留言评论。精彩留言会获得点赞!