一种体外筛选PCSK9抑制剂的方法与流程
本发明属于pcsk9抑制剂技术领域,具体涉及一种体外筛选pcsk9抑制剂的方法。
背景技术:
动脉粥样硬化是心血管系统疾病中最常见的疾病,也是危害人类健康的常见病。动脉粥样硬化的特点是受累动脉的病变从内膜开始,先后有多种病变合并存在,包括局部有脂质和复合糖类积聚、纤维组织增生和钙质沉着形成斑块,并有动脉中层的逐渐退变,继发性病变尚有斑块内出血、斑块破裂及局部血栓形成(称为粥样硬化-血栓形成,atherosclerosis-thrombosis)。由于在动脉内膜积聚的脂质外观呈黄色粥样,因此称为动脉粥样硬化。
pcsk9是kexin样前转化酶枯草杆菌蛋白酶家族的第9个成员,由692个氨基酸残基组成,主要表达于肝脏、肾脏以及小肠,并且作为一个分泌性蛋白存在于血液中。pcsk9主要在内质网合成,首先形成一个75kda的前体,其未成熟的前体包含一个n端信号肽序列、一个前结构域、一个催化结构域和一个富含半光氨酸的c端结构域。随后在内质网中pcsk9在其第152位残基处经历一次自动催化性裂解,形成一个14kda的前结构域片段和一个包含催化结构域和c端结构域的57kda成熟片段。裂解后的前结构域仍然以非共价键结合在催化结构域上,与成熟片段形成一个复合体,并作为一个分子伴侣与成熟片段一起离开内质网转运到高尔基体中,在高尔基体中经过乙酰化等一系列修饰后最终分泌到血液中。前结构域的结合可能发挥着抑制蛋白酶催化活性的作用,是pcsk9正确折叠并离开内质网所必需的。大多数前蛋白转化酶在离开内质网后会经历二次蛋白酶解加工作用,从而释放前结构域,暴露酶活性。而离开内质网后的pcsk9没有经历这种二次加工过程,因此pcsk9是唯一没有蛋白质底物的枯草杆菌蛋白酶样丝氨酸蛋白酶。肝脏是血液中pcsk9的主要来源。由于检测时使用的特异性抗体以及标准值的不同,人血浆中pcsk9浓度的平均值变化范围较大。
他汀类药物是目前应用最广的降脂药物,是预防和治疗动脉粥样硬化性心血管疾病的基石,然而他汀类药物的局限性日益显露,研发针对脂类代谢不同靶点的新型降脂药物成为热点之一,随着pcsk9的发现,pcsk9抑制剂这类新型降脂药受到极大的关注,为降脂治疗提供了更多的选择,为很多无法耐受他汀类药物及他汀治疗效果不佳的患者带来福音。
pcsk9具有强大的降低ldl-c的作用。安慰剂对照研究表明,pcsk9抑制剂能够使ldl-c水平较基线降低50%-70%。每2周给予evolocumab140mg皮下注射,能够使ldl-c从115mg/dl~124mg/dl降至39mg/dl~49mg/dl。除了ldl-c的减少,动脉粥样斑块负荷和动脉粥样硬化解剖也与心血管不良事件相关。研究发现,与安慰剂组相比,每月evolocumab420mg皮下注射,动脉粥样硬化体积百分比下降0.95%,差异有统计学意义,且64.3%的患者粥样斑块消退。而且evolocumab的不良反应少,发生比例非常低,尚未见重大不良事件。上述提到了他汀类药物的多项副作用,pcsk9抑制剂具有良好的安全性和耐受性。此外,gauss-3研究发现pcsk9抑制剂可以帮助降低他汀类药物的耐药性。而且,sler和odyssey两项试验都表明pcsk9抑制剂能够明显降低死亡、心肌梗死、缺血性中风等心脑血管事件。因此,筛选研发治疗动脉粥样硬化引起的心肌梗死、缺血性中风等心脑血管疾病的pcsk9抑制剂有重要意义。
传统的pcsk9抑制剂的初级筛选是通过检测待测化合物与pcsk9蛋白结合的强弱来反映抑制率强弱的,需要使用昂贵的分子互作设备,并且需要制备很高纯度的重组pcsk9蛋白,受外界因素的干扰较大,误差也较大,而本方法针对pcsk9/ldlr的路径,利用elisa的方法体外模拟了pcsk9与ldlr的作用过程,其中egf-ab蛋白是ldlr中与pcsk9作用的活性区域,然后通过光信号反应待测样品对pcsk9与egf-ab蛋白互作的影响强弱。该方法具有elisa通用的优点-成本低、效率高,普通酶标仪就可以进行检测。因此,本申请正是基于该原理设计了一种体外筛选pcsk9抑制剂的方法。
技术实现要素:
本发明基于分子水平设计了粗筛选pcsk9抑制剂的方法,效率高,成本低。
本发明的目的是提供一种体外筛选pcsk9抑制剂的方法,包括以下步骤:
s1,将含有egf-ab基因的质粒pgex-egfab导入大肠杆菌并表达egf-ab蛋白;
s2,提取并纯化带有gst标签的egf-ab蛋白;
s3,纯化后的egf-ab蛋白用dpbs稀释后铺板包被,置于4℃过夜或37℃中2h,pbst清洗;用5g/100ml脱脂奶粉进行封闭,置于37℃中2h,pbst清洗;加入带his标签的pcsk9与待测药物,同时设阴性对照,室温下孵育2h,pbst清洗;加入用pbst稀释后的一抗,室温下孵育2h,pbst清洗;加入用pbst稀释后的二抗,室温下孵育1h,pbst清洗;tmb显色,终止显色,450nm下读取od值;其中所述待测药物为待筛选的pcsk9抑制剂;
s4,计算待测药物的od均值,代入公式:(1-待测药物od均值/阴性对照od值)×100%,得抑制率,算出ic50,抑制率与待测药物浓度之间具有剂量效应即说明待测药物具有抑制pcsk9生物活性的效果。
优选地,上述s1中表达的过程为:已导入egf-ab基因的大肠杆菌培养至菌液od值为0.7,加入iptg并使之终浓度为1mmol/l,继续培养3h后收集菌体。
优选地,上述s2中提取并纯化egf-ab蛋白的过程为:裂解大肠杆菌并制备成悬液,加入pbs稳定ph至7.0-7.5,过谷胱甘肽蛋白纯化柱并用还原型谷胱甘肽洗脱,洗脱下的egf-ab蛋白保存于含10%甘油的pbs溶液。
优选地,上述铺板包被前egf-ab蛋白用dpbs稀释为20μg/ml,pcsk9浓度≤25μg/ml。
优选地,上述一抗用pbst稀释的比例为1:2000;二抗用pbst稀释的比例为1:5000。
优选地,上述tmb显色5-10min;选用2mol/l硫酸终止显色。
与现有技术相比,本发明提供的体外筛选pcsk9抑制剂的方法具有以下有益效果:
本发明基于分子水平设计了粗筛选pcsk9抑制剂的方法,针对pcsk9/ldlr的路径,利用elisa的方法体外模拟了pcsk9与ldlr的作用过程,其中egf-ab蛋白是ldlr中与pcsk9作用的活性区域,然后通过光信号反应待测样品对pcsk9与egf-ab蛋白互作的影响强弱,具有elisa通用的优点,成本低,效率高,普通酶标仪就可以进行检测。
附图说明
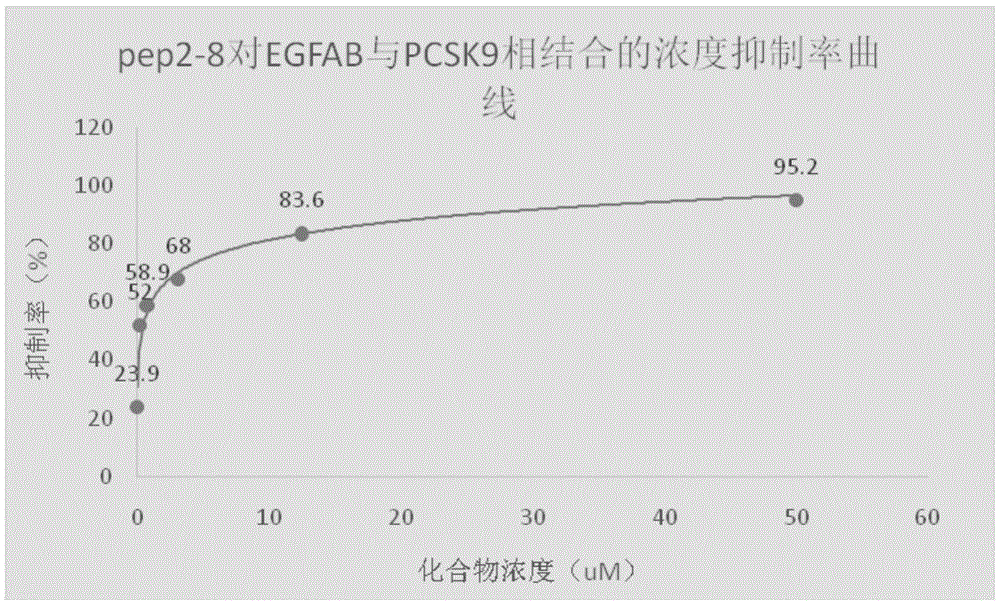
图1是实施例1中阳性抑制剂pep2-8的抑制率曲线图。
具体实施方式
下面结合具体实施例对本发明进行详细说明,但不应理解为本发明的限制。下列实施例中未注明具体条件的试验方法,通常按照常规条件操作,由于不涉及发明点,故不对其步骤进行详细描述。
本发明提供的一种体外筛选pcsk9抑制剂的方法,包括以下步骤:
s1,将含有egf-ab基因的质粒pgex-egfab导入大肠杆菌bl21并表达egf-ab蛋白;
s2,提取并纯化带有gst标签的egf-ab蛋白;
s3,纯化后的egf-ab蛋白用dpbs稀释后铺板包被,置于4℃过夜或37℃中2h,pbst清洗;用5g/100ml脱脂奶粉进行封闭,置于37℃中2h,pbst清洗;加入带his标签的pcsk9与待测药物,同时设阴性对照,室温下孵育2h,pbst清洗;加入用pbst稀释后的一抗,室温下孵育2h,pbst清洗;加入用pbst稀释后的二抗,室温下孵育1h,pbst清洗;tmb显色,终止显色,450nm下读取od值;其中所述待测药物为待筛选的pcsk9抑制剂;
s4,计算待测药物的od均值,代入公式:(1-待测药物od均值/阴性对照od值)×100%,得抑制率,算出ic50,抑制率与待测药物浓度之间具有剂量效应即说明待测药物具有抑制pcsk9生物活性的效果。
优选的,本发明提供的一种体外筛选pcsk9抑制剂的方法,具体包括以下实施例。
下述实施例中,所用实验试剂如下:(1)pbs缓冲液(配制方法:20x的pbs取50ml加入ddh2o定容至1l);(2)封闭液(5%脱脂奶粉,配制方法如下:称取2.5g脱脂奶粉置于50ml试管中,加tbst适量,摇匀,50ml量筒定容);(3)anti-6xhistag一抗(abcam,ab27025);(4)hrp二抗(vectorlabs,sa-5014);(5)tmb高效显色剂(索莱宝生物,pr1200);(6)终止液(2mol/l硫酸,配制方法如下:取浓硫酸109ml,用ddh2o定容至1l);(7)dpbs(hyclone,sh30028.02);(8)pbst(配制方法如下:500μl的tween20加入750ml的pbs,搅拌均匀,naoh调整ph在7.5左右,pbs定容至1l);(9)tween20(阿拉丁,t104863-500ml);(10)胰蛋白胨(oxoid,lp0042);(11)酵母提取物(oxoid,lp0021);(12)氯化钠(生工生物,a100241-0500);(13)琼脂(兰博利德,qz01),氨苄西林(inalco,1758-9314);(14)iptg(inalco,1758-1400);(15)细菌蛋白抽提试剂盒(康为世纪,cw0888m);(16)还原型谷胱甘肽(生工生物,a100399-0050);(17)ddh2o(milli-q制备);18)lb液体培养基(配制方法如下:10g胰蛋白胨、5g酵母提取物、10g氯化钠加入750ml的ddh2o中,调整ph7.2-7.4左右,ddh2o定容至1l。灭菌后50mg/ml的氨苄西林以1:1000比例加入混合液中,并使之终浓度为50μg/ml);(19)lb固体培养基(配制方法如下:1.5g的琼脂加入100ml的lb液体培养基中,灭菌后加入与液体相同体积的氨苄,铺平板);(20)pgex-egfab受赠于美国德克萨斯大学西南医学中心的johanndeisenhofer。
下述实施例中,所用实验器材如下:10kda超滤管(millipore,ufc901096),谷胱甘肽蛋白纯化柱(天地人和生物,s1001025),elisa用96孔板(corning,42592),摇床,恒温培养箱,4℃冰箱,-80℃冰箱,离心机,超净台,高压灭菌锅,分光光度计(thermofisher),platereader(perkinelmer)。
实施例1
一种体外筛选pcsk9抑制剂的方法,包括以下步骤:
s1,将含有egf-ab基因的质粒pgex-egfab导入大肠杆菌bl21并表达egf-ab蛋白;
用常规方法导入egf-ab基因的大肠杆菌bl21在超净台下接种完成后存放于37℃培养箱过夜;第二天挑取单菌群落接种于5ml的lb液体培养基中,37℃下以240rpm振荡过夜;第三天将菌液倒入500ml的lb培养基中,37℃下240rpm振荡培养,当分光光度计测定od值在0.7时,加入iptg,使得iptg在培养液里的终浓度为1mmol/l,再继续在37℃下240rpm振荡培养3小时。培养完成后5000g离心10min收集菌体,弃上清后,pbs清洗两次,存入-80℃冰箱备用。
s2,提取并纯化带有gst标签的egf-ab蛋白;
提取:采用试剂盒提取蛋白,每克菌体加入试剂盒中所配的20ml的bacterialproteinextractionreagent,每毫升菌液加入1μl的dnasei,2μl的lysozyme与10μl的proteaseinhibitorcocktail,裂解大肠杆菌并制备成悬液,并在室温下静置20min,其后15000g下离心5分钟,弃底物保留上清液。
纯化:用10kd的超滤管4000g离心10min,浓缩egf-ab蛋白液,加入pbs稳定ph至7.0-7.5;用pbs平衡谷胱甘肽蛋白纯化柱1h,以10倍柱体积加入egf-ab蛋白在过滤器中搅拌1h;用pbs冲洗柱子3-4次,每次5min。用还原型谷胱甘肽洗脱柱子洗脱5次,10ml/次,10min/次;将洗脱下的egf-ab蛋白用10kd超滤管超滤后加入含质量浓度10%甘油的pbs保存于-80℃冰箱。
s3,包括如下步骤:
纯化后的egf-ab蛋白用dpbs稀释20μg/ml,以100μl/孔包被于96孔板中(预留3孔不包被作为空白对照),置于4℃过夜(12-16h)或37℃中2h,弃液体拍干后以375μl/孔用pbst清洗振荡3min。
弃液体拍干,以375μl/孔加入5g/100ml脱脂奶粉进行封闭,37℃中孵育2h,以375μl/孔加入pbst清洗振荡3min,共两次(若当日不继续实验,则应清洗拍干后37度下干燥1小时,后封板保存于4度冰箱)。
用dmso将待测药物pep2-8分别配制50μmol/l,12.5μmol/l,3.13μmol/l,0.78μmol/l,0.2μmol/l,0.05μmol/l的梯度浓度,另设三个空白对照只加入等量的dmso,每个梯度浓度分别加入等量的pcsk9溶液,三个空白对照中一个加入等量pcsk9溶液作为阴性对照,另外两个空白对照只加入等量的ddh2o作为空白对照,室温(23-27℃)下孵育1h,每个梯度浓度溶液以100μl/孔的量加入上述96孔板中,3孔为一组,两组空白对照里一组应加入不含egf-ab蛋白包被孔,阴性对照组正常加入egf-ab蛋白包被孔,室温下(23-27℃)振荡孵育2h,弃液体拍干后,以375μl/孔的pbst,3min/次进行振荡清洗,共3次。
弃液体拍干后,以100μl/孔的量加入用pbst以1:2000稀释后的一抗,室温(23-27℃)振荡孵育2h,以375μl/孔的pbst,3min/次进行振荡清洗,共4次。
弃液体拍干后,以100μl/孔的量加入用pbst以1:5000稀释后的二抗,室温(23-27℃)振荡孵育1h,以375μl/孔的pbst,3min/次进行振荡清洗,共4次,弃液体拍干。
以100μl/孔的量加入tmb避光振荡显色5-10min,再以50μl/孔加入2mol/l的硫酸溶液终止显色,混匀后,用酶标仪在450nm下读取od值。
s4,计算待测药物的od均值,代入公式:(1-待测药物od均值/阴性对照od值)×100%,得抑制率,画出抑制率曲线,再算出ic50,抑制率与待测药物浓度之间具有剂量效应即说明待测药物具有抑制pcsk9生物活性的效果。od值的测试结果如下表1,pep2-8不同浓度的抑制率曲线如图1。
表1实施例1中od值的测试结果
实施例2
egf-ab蛋白与pcsk9蛋白优化浓度参数的探索:
由于egf-ab蛋白与pcsk9蛋白批次间可能存在不稳定差异,因此通过预实验确定egf-ab蛋白对适量pcsk9蛋白的稳定结合浓度:以dpbs为稀释液分别配置egf-ab蛋白浓度为40μg/ml,20μg/ml,10μg/ml,包被三组elisa板,另预留三孔不包被作为空白对照;pcsk9蛋白经ddh2o稀释分别设置400μg/ml,200μg/ml,100μg/ml,50μg/ml,25μg/ml,12.5μg/ml,0μg/ml的浓度梯度,然后分别加入三组包被板,每组每个浓度三孔重复,100μl/孔,之前预留的空白对照孔以100μl/孔加入ddh2o;一抗、二抗浓度暂采用说明书中建议的最低稀释倍数1:1000。经过测试egf-ab蛋白在20μg/ml时可排除批次间差异并稳定对25μg/ml及以下浓度的pcsk9蛋白取得较为适宜的测试数据(即显色时间5-10分钟,450nm下od值0.9-1.2之间),故egf-ab蛋白的最佳浓度为20μg/ml,且pcsk9浓度≤25μg/ml。
pcsk9蛋白浓度的再优化:由于pcsk9蛋白浓度可以进一步优化以及不同批次间pcsk9的稳定性差异,采用新一批次pcsk9蛋白测试前可对pcsk9蛋白浓度用量进行梯度测试。egf-ab蛋白以20μg/ml的浓度包被铺板(留三孔作为空白对照使用),pcsk9蛋白设置浓度梯度为25μg/ml,12.5μg/ml,6.25μg/ml,3.13μg/ml,1.63μg/ml,0.82μg/ml,0μg/ml,一抗稀释浓度为1:2000,二抗稀释浓度为1:5000。结果取即显色时间5-10min,450nm下od值0.9-1.2之间的pcsk9蛋白浓度作为测试浓度。
实施例3
一抗与二抗的稀释浓度优化:由于一抗二抗均采用进口试剂故优化稀释倍数以降低实验成本。①二抗优化实验:采用20μg/ml浓度的egf-ab蛋白铺板包被,依然预留一组空白孔作为对照,pcsk9依然采取前次实验的配置,但重复三组。一抗依然为1:1000稀释。二抗稀释浓度设置为1:1000,1:2000,1:5000分别对应三组的pcsk9。经测试一抗1:1000,二抗1:5000时仍可取得与前次实验无显著性差异的结果。②一抗优化实验:egf-ab蛋白与pcsk9均采用前次配置,一抗浓度设置为1:1000,1:2000,1:5000分别对应三组的pcsk9,二抗浓度采用前次确定的1:5000。经测试,一抗在1:2000,二抗在1:5000时仍可保持与优化前无显著性差异的结果。
需要说明的是,本发明中涉及数值范围时,应理解为每个数值范围的两个端点以及两个端点之间任何一个数值均可选用,由于采用的步骤方法与实施例相同,为了防止赘述,本发明描述了优选的实施例。尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例做出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 还没有人留言评论。精彩留言会获得点赞!