一种用于验证特定DNA片段拷贝数变异的引物设计方法、引物、试剂盒、方法和系统与流程
本发明涉及一种用于验证特定dna片段拷贝数变异的引物设计方法、引物、试剂盒、方法和系统。
背景技术:
:人类染色体有46条,其中常染色体有22对,是成对出现的,每对染色体中,一条来自于父方,一条母方,叫做同源染色体。染色体主要由dna和蛋白质组成,其中dna即脱氧核糖核酸序列(又称为核苷酸序列或碱基序列)决定着遗传信息。dna是一种长链聚合物,组成单位为四种脱氧核苷酸,即腺嘌呤脱氧核苷酸(damp)、胸腺嘧啶脱氧核苷酸(dtmp)、胞嘧啶脱氧核苷酸(dcmp)、鸟嘌呤脱氧核苷酸(dgmp)。决定生物的多样性的就是脱氧核苷酸中四种碱基,腺嘌呤(adenine,a),胸腺嘧啶(thymine,t),胞嘧啶(cytosine,c)和鸟嘌呤(guanine,g),dna序列通常用atcg四种碱基的序列来表示,称为碱基序列或核苷酸序列,a与t配对,c与g配对,正向是指5’端到3’端方向。基因变异是指基因组dna分子发生的可遗传的变异,根据变异涉及片段大小,可分为微小变异和拷贝数变异,其中拷贝数变异(copynumbervariations,cnvs)是指长度大于1kb的dna片段的缺失或重复变异。cnvs检测的方法有多种,比如染色体微阵列芯片技术(chromosomalmicroarray,cma)、单核苷酸基因分型技术、多重连接探针扩增技术(multiplexligation-dependentprobeamplification,mlpa)以及目前已经被临床研究广泛应用的高通量测序技术。对于像cma、高通量测序等检测到的cnvs,往往需要用其他方法进一步验证,常用的方法有mlpa、半定量qpcr等。其中qpcr是最常用的方法之一,但是,qpcr扩增长度要求严格,通常为80bp至150bp,当目的片段存在较高的同源性时,引物设计困难而极容易失败,进而验证失败。而mlpa是试剂公司开发的成品试剂,大多基因并没有相应探针。其中一种情形是,检测到一个杂合微小变异,同时,其附近又检测到一个杂合缺失cnv,此时,同源性很高时,通过qpcr往往很难验证cnv的存在状态。技术实现要素:本发明目的在于提供一种用于验证特定dna片段拷贝数变异的引物设计方法,基本该引物设计方法,本发明还提供了一种用于验证特定dna片段拷贝数变异的引物、试剂盒、方法和系统,以解决上述
背景技术:
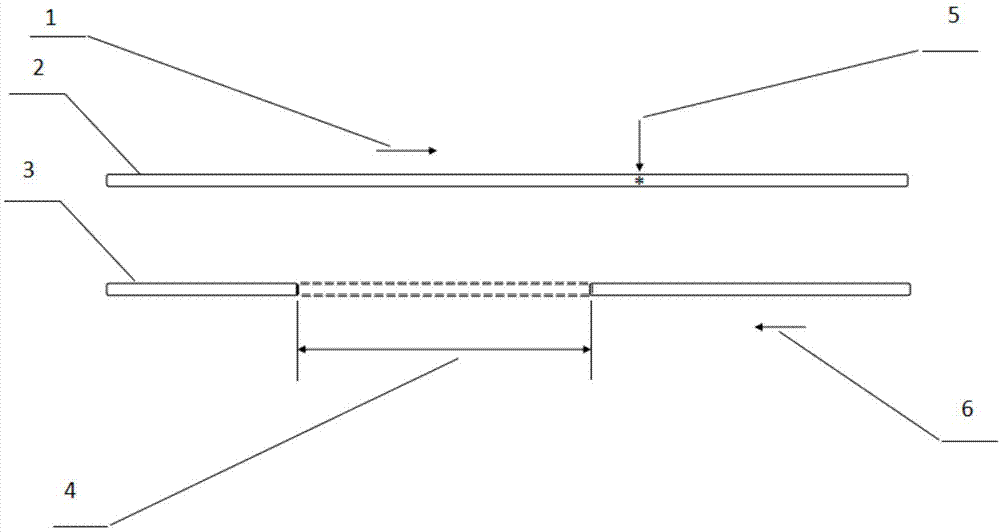
中提出的问题。为实现上述目的,所采取的技术方案:一种用于验证特定dna片段拷贝数变异的引物设计方法,所述引物设计方法包括以下步骤:针对已知存在杂合微小变异且可能存在杂合缺失拷贝数变异的待验证特定dna片段,设计至少一对用于检测所述杂合微小变异的引物,其中设计的引物对中的一条引物位于微小变异的上游或者下游,另一条引物位于待验证缺失拷贝数变异区域,设计的引物对为用于验证dna片段拷贝数变异的引物。杂合微小变异是指在同源染色体中的一条染色体上存在微小变异,而另一条染色体对应位置上不存在该微小变异。杂合缺失拷贝数变异是指在同源染色体中的一条染色体上存在缺失拷贝数变异,而另一条染色体对应位置上不存在该缺失拷贝数变异。设计的dna的引物是一小段单链dna,上游引物(即正向引物)是与dna正链(即有义链)互补的,下游引物(即反向引物)是与dna正链(即有义链)一致的,引物设计一般要求引物长度为15至30碱基,引物不能存在引物二聚体及发夹结构,引物要有特异性即dna序列的保守区等。本发明中,针对待验证的特定dna片段设计引物的方法为,设计的引物对中的一条引物位于微小变异的上游或者下游,另一条引物位于待验证cnv区域。具体来说,当cnv区域位于微小变异上游时,设计的引物对中的一条引物位于微小变异的下游,另一条引物位于待验证cnv区域;当cnv区域位于微小变异下游时,设计的引物对中的一条引物位于微小变异的上游,另一条引物位于待验证cnv区域;这样设计的其中一个好处是能扩增到微小变异,达到检测微小变异的目的。优选地,所述待验证特定dna片段中微小变异与缺失拷贝数变异区域的距离小于800bp。本发明待验证特定dna片段是通过现有技术检测出存在杂合微小变异以及可能存在杂合缺失拷贝数变异的dna片段。通常来讲,所述待验证特定dna片段是经高通量测序检测出存在杂合微小变异且可能存在杂合缺失拷贝数变异的dna片段。优选地,所述设计的引物对为二对,分别为巢式pcr扩增的外侧引物对和内侧引物对。本发明引物设计方法中融合巢式pcr技术可以避免同源性对验证的影响。优选地,所述待验证特定dna片段为cyp11b1基因,杂合微小变异位于cyp11b1基因第8号外显子c.1391_1393dup,所述杂合微小变异上游附近可能存在杂合缺失拷贝数变异。本发明提供了一种用于验证特定dna片段拷贝数变异的引物,所述引物是采用上述所述的引物设计方法设计得到的。优选地,所述引物由巢式pcr扩增的外侧引物对和内侧引物对组成:外侧引物对:上游引物f1:5’-tacttgggattgtgatgtg-3’(seqidno:1),下游引物r1:5’-aaaccacagcacccttgcatggcca-3’(seqidno:2);内侧引物对:上游引物f2:5’-taaacagcgtcacccagcag-3’(seqidno:3),下游引物r2:5’-cttagcctggcaaaccctgg-3’(seqidno:4)。本发明提供了一种用于验证特定dna片段拷贝数变异的试剂盒,所述试剂盒包括上述所述的引物。本发明提供了一种用于验证特定dna片段拷贝数变异的方法,所述方法包括如下步骤:(1)以包括已知存在杂合微小变异且可能存在杂合缺失拷贝数变异的待验证特定dna片段的dna样本为模板,采用上述所述的引物设计方法设计得到的引物进行扩增,将扩增得到的产物进行sanger测序;(2)将步骤(1)得到的sanger测序结果与正常人对照序列进行比对;比对后验证结果如下:若sanger测序结果显示所述待验证特定dna片段中的微小变异为纯合微小变异,则该待验证特定dna片段存在杂合缺失拷贝数变异,并且与微小变异位于不同的同源染色体上;若sanger测序结果显示所述待验证特定dna片段中的微小变异为杂合微小变异,则该待验证特定dna片段不存在缺失拷贝数变异;若sanger测序结果显示在所述待验证特定dna片段中未测到微小变异,则该待验证特定dna片段存在杂合缺失拷贝数变异,并且与微小变异位于同一同源染色体上。sanger法是根据核苷酸在某一固定的点开始,随机在某一个特定的碱基处终止,并且在每个碱基后面进行荧光标记,产生以a、t、c、g结束的四组不同长度的一系列核苷酸,然后在尿素变性的page胶上电泳进行检测,从而获得可见dna碱基序列的一种方法。优选地,所述待验证特定dna片段与所述dna样本中其他dna序列的同源性大于等于80%。更优选地,所述待验证特定dna片段与所述dna样本中其他dna序列的同源性大于等于90%。当所述待验证特定dna片段与所述dna样本中其他dna序列的同源性大于等于80%时,采用qpcr很难设计出合适的引物,尤其是当所述待验证特定dna片段与所述dna样本中其他dna序列的同源性大于等于90%时,更难设计出合适的qpcr引物。本发明提供了一种用于验证特定dna片段拷贝数变异的系统,所述系统包括基因扩增装置,所述基因扩增装置,用于扩增包括已知存在杂合微小变异且可能存在杂合缺失拷贝数变异的待验证特定dna片段的dna样本,所述扩增使用的引物为采用上述所述的引物设计方法设计得到的引物;基因测序装置,所述基因测序装置与所述基因扩增装置相连,并且用于对所述扩增的产物进行sanger测序,以便获得待验证特定dna片段中微小变异的sanger测序序列;比对装置,所述比对装置与所述基因组测序装置相连,所述比对装置内预存有正常人参考序列信息,所述比对装置用于将得到的sanger测序序列与所述正常人参考序列信息进行比对,基于比对结果来得到由sanger测序结果确定的微小变异情况,然后结合待待验证特定dna片段中存在杂合微小变异这个已知信息来验证待验证特定dna片段中杂合缺失拷贝数变异的情况;若sanger测序结果显示所述待验证特定dna片段中的微小变异为纯合微小变异,则该待验证特定dna片段存在杂合缺失拷贝数变异,并且与微小变异位于不同的同源染色体上;若sanger测序结果显示所述待验证特定dna片段中的微小变异为杂合微小变异,则该待验证特定dna片段不存在缺失拷贝数变异;若sanger测序结果显示在所述待验证特定dna片段中未测到微小变异,则该待验证特定dna片段存在杂合缺失拷贝数变异,并且与微小变异位于同一同源染色体上;以及结果输出装置,所述结果输出装置与所述比对装置相连,以便输出验证结果。有益效果:本发明提供了一种用于验证特定dna片段拷贝数变异的引物的引物设计方法,本发明还提供了一种用于验证特定dna片段拷贝数变异的引物、方法和系统,相比现有技术,本发明引物设计方法中设计引物的区域增加,不再局限于80bp至150bp,引物设计难度大大减小。本发明验证方法中测序结果非常直观,对缺失变异的判断比较方便。采用本发明的引物设计方法、验证引物、验证方法和验证系统可以避免同源性对验证的影响;采用本发明的验证方法和验证系统不仅可以确定cnv是否存在,还可以确定cnv与微小变异是否处于同一条染色体上。附图说明图1为本发明实施例1中针对特定dna片段拷贝数变异引物设计的示意图,图中:1、上游引物f2;2、同源染色体a;3、同源染色体b;4、待验证的缺失区域;5、杂合微小变异;6、下游引物r2;图2为本发明实施例1中上游引物f2测序结果图谱,图中:1、正常人参考序列;2、样本序列;3、微小变异c.1391_1393dup;图3为本发明实施例1中下游引物r2测序结果图谱,图中:1、正常人参考序列;2、样本序列;3、微小变异c.1391_1393dup。具体实施方式为更好的说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。实施例1我们通过高通量测序检测到一个杂合微小变异cyp11b1基因(参考转录本nm_000497.3)第8号外显子c.1391_1393dup,位于同源染色体a上,及上游附近一段核苷酸序列杂合缺失,缺失范围约为约37kb,位置是chr8:143956640-143994311,此片段包含cyp11b1基因第1-7号外显子,接下来针对该杂合缺失片段进行验证。尝试用qpcr设计引物,发现由于cyp11b1基因存在假基因cyp11b2,同源性很高,达90%以上,而qpcr要求高,扩增长度一般要求在80bp至150bp,很难设计出合适的引物,我们曾尝试在待检测的缺失区域设计几对qpcr引物;如:引物之一:上游引物5’-tggcaacaggagagacaggat-3’(seqidno:5),下游引物:5’-ggctccgtatcaaccagagaaa-3’(seqidno:6),引物之二:上游引物5’-tccaccgtccagctcatgt-3’(seqidno:7),下游引物:5’-gcctcaaagtgctccttcca-3’(seqidno:8),引物之三:上游引物5’-aggacgtggagaagctgcaa-3’(seqidno:9),下游引物:5’-tgcccacgatgttgtctgtag-3’(seqidno:10)。因这些引物及扩增区域位于存在同源序列的区域,对待测区域定量扩增时会有影响,均无法正确判断缺失的状态,qpcr实验失败。接下来,我们采取本发明的方法进行验证,过程描述如下:首先,在高通量测序检测的缺失区域及微小变异c.1391_1393dup下游设计引物:上游引物f1:5’-tacttgggattgtgatgtg-3’(seqidno:1)下游引物r1:5’-aaaccacagcacccttgcatggcca-3’(seqidno:2)利用该对引物,以原高通量测序检测的样本dna为模板,进行长pcr,得到产物p。其中,反应体系设置如表1:表1第一轮pcr反应体系试剂体积(μl)ddh2o12.52xphusiongreenhsiihfmastermix25正向引物f12.5反向引物r12.5dna模板4dmso(3%)1.5pcr反应程序设置如表2:表2第一轮pcr反应程序进行长pcr,可以避免高同源片段如假基因的干扰。然后,分别在高通量测序检测的缺失区域及微小变异c.1391_1393dup下游且在引物f1和引物r1的扩增区间设计引物,示意图如图1所示:上游引物f2:5’-taaacagcgtcacccagcag-3’(seqidno:3)下游引物r2:5’-cttagcctggcaaaccctgg-3’(seqidno:4)下游引物r2位于微小变异的下游,其中上游引物f2位于待验证cnv区域。利用该对引物,以长pcr产物p为模板进行pcr扩增,反应体系设置如表3:表3第二轮pcr反应体系反应条件如表4:表4第二轮pcr反应程序温度时间反应循环数98℃3min198℃10s3063℃30s172℃1min172℃5min125℃∞1随后,pcr产物进行sanger测序,测序引物为上游引物f2和下游引物r2,得到如图2和图3的结果:上游引物f2和下游引物r2的测序结果,样本序列和正常人参考序列比较,都显示微小变异c.1391_1393dup是纯合。最后,进行结果分析,如下:(1)若测到微小变异c.1391_1393dup是纯合:推测cnv(chr8:143956640-143994311)存在,并且与微小变异位于不同的同源染色体上。(2)若测到微小变异c.1391_1393dup是杂合:推测cnv并不存在。(3)未测到微小变异c.1391_1393dup,即只测到野生型:推测cnv存在,并且与微小变异位于同一同源染色体上。本实验所检测到结果属于第一种情况,即微小变异c.1391_1393dup是纯合,结合高通量测序微小变异c.1391_1393dup杂合,推测微小变异的另一条同源染色体片段即同源染色体b因存在缺失而未被扩增出来,故没有测序数据,因此,该sanger测序结果支持高通量测序检测的缺失变异。验证成功。本发明实施例中,所述引物f1和引物r1进行长pcr扩增可以避免同源序列的影响,同源性不高,如低于80%时,可以不进行长pcr,忽略此步骤。通过sanger测序法验证cnv,有效地减少了pcr引物设计的局限,同时,可以推测相邻微小变异与cnv是否处于同一条染色体上,对于常染色体隐性遗传病的解释可能会有一定的意义。相比来说,qpcr因设计要求高,且扩增长度较短,要求严格,引物设计难度高,而且实验稳定性相对较差。而在同源性较高的时,常很难设计出合适的引物,因此很难进行验证实验。由于qpcr是对待测区域扩增的半定量检测,无法得知缺失区域与微小变异的相对位置,即是否在同一条同源染色体上。最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。序列表<110>广州金域医学检验中心有限公司、广州金域医学检验集团股份有限公司<120>一种用于验证特定dna片段拷贝数变异的引物设计方法、引物、试剂盒、方法和系统<160>10<170>patentinversion3.3<210>1<211>19<212>dna<213>人工序列<400>1tacttgggattgtgatgtg19<210>2<211>25<212>dna<213>人工序列<400>2aaaccacagcacccttgcatggcca25<210>3<211>20<212>dna<213>人工序列<400>3taaacagcgtcacccagcag20<210>4<211>20<212>dna<213>人工序列<400>4cttagcctggcaaaccctgg20<210>5<211>21<212>dna<213>人工序列<400>5tggcaacaggagagacaggat21<210>6<211>22<212>dna<213>人工序列<400>6ggctccgtatcaaccagagaaa22<210>7<211>19<212>dna<213>人工序列<400>7tccaccgtccagctcatgt19<210>8<211>20<212>dna<213>人工序列<400>8gcctcaaagtgctccttcca20<210>9<211>20<212>dna<213>人工序列<400>9aggacgtggagaagctgcaa20<210>10<211>21<212>dna<213>人工序列<400>10tgcccacgatgttgtctgtag21当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1