应用微流控芯片制备海藻酸钙-脂肪脱细胞基质微载体的方法与流程
本发明属于组织工程生物支架微载体,具体涉及一种应用微流控芯片的海藻酸钙-脂肪脱细胞基质微载体的构建方法,可增加脂肪干细胞的黏附,是一种新型微载体。
背景技术:
软组织缺损是临床面临的常见难题。现有的皮瓣移植、脂肪填充、透明质酸填充等方法存在有创伤、填充物易吸收、炎症反应等缺点。组织工程的方法将种子细胞和生物支架材料结合后进行填充,可以很大程度避免这些问题,但目前常用的生物支架材料如壳聚糖、纤维蛋白、透明质酸,不具备促进干细胞黏附、增殖、分化的能力。
脂肪脱细胞基质是脂肪组织去掉细胞后剩余部分,主要成分包括胶原蛋白和vegf、gag等多种生长因子,可促进脂肪干细胞黏附、增殖、成脂分化。但是脂肪脱细胞基质为絮状结构,难以制备为载体。微流控芯片可以在微观尺度上操作液体,利用液体剪切力可制备大小成分均一的液滴;海藻酸钙是微流控技术制备微载体时常用的可降解材料,但其细胞亲和性欠佳,难以用于干细胞培养。
技术实现要素:
本发明的目的是提供一种应用微流控芯片制备海藻酸钙-脂肪脱细胞基质微载体的方法,该方法能够生产大小、成分均一的脱细胞基质微载体,可用于于脂肪干细胞培养。
本发明提供的技术方案:所述一种应用微流控芯片制备海藻酸钙-脂肪脱细胞基质微载体的方法,其特征在于具体步骤如下:
(1)脂肪脱细胞基质制备:
a.取人脂肪组织置于-80℃条件下冰冻20~40分钟,然后取出,在室温下静置至完全解冻,如此反复冻融3~5个循环后,将解冻后的脂肪组织用机械乳化法制备成纳米脂肪;
b.将步骤a中的纳米脂肪离心后去除最上层油和最下层水,取中间一层并加入pbs缓冲液洗涤后离心后去除缓冲液,用胰蛋白酶-edta消化液在37℃下浸泡16~24h后离心去除消化液,再加入异丙醇在37℃下浸泡48~60h后离心去除异丙醇,最后用pbs缓冲液重复洗涤3~5次,每次加入pbs缓冲液混匀洗涤后离心去除缓冲液;
c.将步骤b中浸泡洗涤后的纳米脂肪加入混合酶溶液在37℃下浸泡16~24h后离心去除混合酶溶液,并加入pbs缓冲液重复洗涤3~5次,每次加入pbs缓冲液混匀洗涤并离心去除缓冲液;其中所述混合酶溶是由以下比例的物质配制而成:55mmol/lna2hpo4、17mmol/lkh2po4、4.9mmol/lmgso4·7h2o、15000udnase、12.5mgrnase;
d.将步骤c中混合酶浸泡洗涤后的纳米脂肪再次加入异丙醇在37℃下浸泡6~10h后离心去除异丙醇,最后采用pbs缓冲液混匀洗涤后离心去除缓冲液得到脂肪脱细胞基质;
(2)可溶性脱细胞基质制备:将步骤(1)中制备的脂肪脱细胞基质采用重量体积比为0.3%的α-淀粉酶水溶液浸泡70~75h后,离心去除α-淀粉酶水溶液,再采用浓度为0.2mol/l的醋酸浸泡40~50h后,在温度为4℃、转速为11000转/分钟的条件下离心5分钟后取上清液即为可溶性脱细胞基质;其中,每100mg脱细胞基质加入1ml浓度为0.2mol/l的醋酸;
(3)制作毛细管微流控芯片:将内径100~400um和500~1000um的玻璃毛细管嵌套0.5~5cm,并将嵌套后的两根玻璃毛细管固定在载玻片上,其固定后内层毛细管两端及外层毛细管与内层毛细管嵌套一端均置于载玻片上,外层毛细管未嵌套一端伸出载玻片,并在内层毛细管未嵌套端以及外层毛细管与内层毛细管嵌套端分别倒扣加样枪枪头,加样枪头底部边缘与载玻片密封连接,且连接后其两个加样枪枪头倒扣区域分别形成一个与内层毛细管连通的第一密封腔和一个与外层毛细管连通的第二密封腔,制成微流控芯片;
(4)将步骤(2)中的制备的可溶性脱细胞基质与浓度1%w/v~5%w/v的海藻酸钠水溶液等体积混合置于注射器中,用软管连接到微流控芯片上与内层毛细管相连的枪头开口端;将span-80与纯正癸醇混合后的溶液,其中span-80的质量体积比为5%,置于注射器中,用软管连接到微流控芯片上与外层毛细管相连的枪头开口端;并调节流速使得脱细胞基质-海藻酸钠混合溶液与正癸醇溶液流速比为1:1~1:20,获得包裹有正癸醇的脱细胞基质-海藻酸钠液滴;
(5)将步骤(4)中获得的包裹有正癸醇的脱细胞基质-海藻酸钠液滴通入cacl2与纯正癸醇混合后得到的溶液,其中cacl2的质量体积比为1.5%。静置16~24h后,然后在500~800转/分钟的条件下离心,去除液体获得海藻酸钙-脂肪脱细胞基质微载体。
本发明较优的技术方案:所述步骤(1)中胰蛋白酶-edta消化液浸泡、异丙醇浸泡、混合酶溶液浸泡以及pbs缓冲液洗涤时,每种浸泡液和洗涤液分别与脂肪的体积质量比为1:1。
本发明较优的技术方案:所述步骤(1)中处理后得到脂肪脱细胞基质浸泡保存在温度为4℃、浓度为75%的酒精中。
本发明较优的技术方案:所述步骤(1)中b步骤的纳米脂肪是在室温、2000转/分钟下离心4~6min后吸去最上层油和最下层水吸去,取中间层加入pbs缓冲液混匀洗涤30min后在1500~2500转/分钟的转速下离心,吸去缓冲液。
本发明较优的技术方案:所述步骤(1)中b步骤中采用浓度为0.25%的胰蛋白酶-edta消化液浸泡,其浸泡后在500~2500转/分钟的条件下离心,吸去消化液;加入异丙醇浸泡后在1500~2500转/分钟的条件下离心,吸去异丙醇;每次加入pbs缓冲液混匀洗涤30min后,在1500-2500转/分钟的条件下离心,吸去缓冲液。
本发明较优的技术方案:用微流控芯片制备海藻酸钙-脂肪脱细胞基质微载体的方法,其特征在于:所述步骤(1)中c步骤加入混合酶溶液浸泡完成后在1500~2500转/分钟的转速下离心吸去混合酶溶液;每次加入pbs缓冲液混匀洗涤30min后,在1500~2500转/分钟的转速下离心吸去缓冲液。
本发明较优的技术方案:所述步骤(1)中d步骤中异丙醇浸泡后在1500-2500转/分钟的条件下离心,吸去异丙醇,再加入pbs缓冲液混匀洗涤30min后,在1500-2500转/分钟的条件下离心,吸去缓冲液。
本发明较优的技术方案:所述步骤(2)中脂肪脱细胞基质加入α-淀粉酶溶液浸泡后,在1500-2500转/分钟的条件下离心,吸去α-淀粉酶溶液;最后制备的可溶性脱细胞基质在4℃条件下保存。
本发明较优的技术方案:所述步骤(3)中嵌套后的两根玻璃毛细管沿与载玻片长轴平行方向采用环氧胶粘在载玻片上;所述加样枪枪头采用10ul的加样枪枪头,其底部边缘通过环氧胶与载玻片密封粘接。
本发明利用微流控芯片技术制备海藻酸钙-脂肪脱细胞基质微载体,能够生产成分均一的脱细胞基质微载体,其大小可通过调节微流控芯片毛细管的管径、或液体的流速控制;将海藻酸钙微载体与脂肪脱细胞基质结合,得到的微载体更利于细胞生长,可用于脂肪干细胞培养。
附图说明
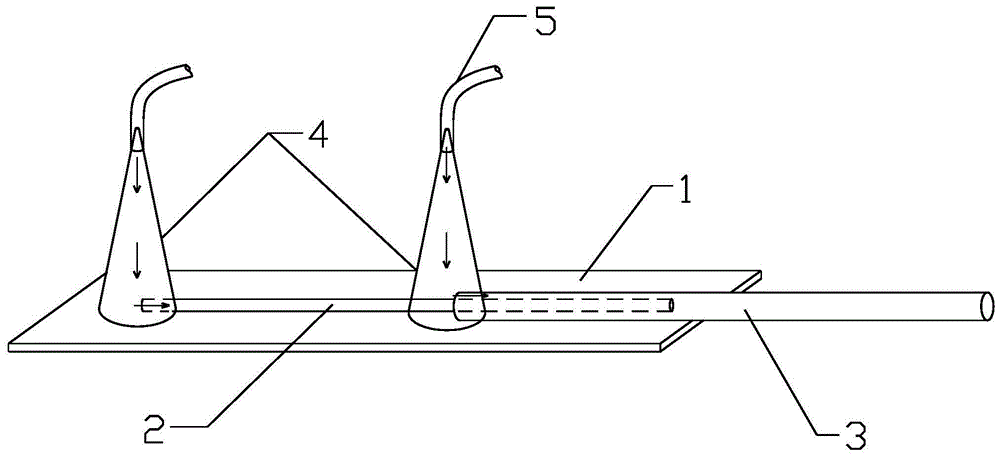
图1是本发明中微流控芯片的结构示意图;
图2是实施例中制备的脂肪脱细胞基质的大体观察图;
图3是实施例中制备的可溶性脱细胞基质大体观察图;
图4是实施例中制备的海藻酸钙-脂肪脱细胞基质微载体在光镜下的状态图。
图5是对照组海藻酸钙微载体种细胞7天后光镜图,箭头显示微载体表面细胞;
图6是海藻酸钙-脱细胞基质微载体种细胞7天后光镜图,箭头显示微载体表面细胞,可见较海藻酸钙微载体细胞更多;
图中:1—载玻片,2—内层毛细管,3—外层毛细管,4—加样枪枪头,5—橡胶软管。
具体实施方式
下面结合附图和实施例对本发明进一步说明。
以下实施例中的毛细管微流控芯片是按照以下方法制备而成:将内径100um和内径500um的玻璃毛细管嵌套3cm左右,然后通过环氧胶粘接载玻片1上,其固定后内层毛细管2两端及外层毛细管3与内层毛细管2嵌套一端均置于载玻片1上,外层毛细管3未嵌套一端伸出载玻片1,并在内层毛细管2未嵌套端以及外层毛细管3与内层毛细管2嵌套端分别倒扣10ul加样枪枪头4,加样抢枪头4底部边缘与载玻片1通过环氧胶密封粘接,且连接后其两个加样枪枪头4倒扣区域分别形成两个密封腔体,其中一个密封腔体与内层毛细管2开口端连通,另一个密封腔体与外层毛细管3的开口端密封连通,制成微流控芯片,其具体结构如图1所示。
实施例提供的一种应用微流控芯片制备海藻酸钙-脂肪脱细胞基质微载体的方法,其具体步骤如下:
(1)制备脂肪脱细胞基质:
a.抽脂得到人脂肪组织,并置于-80℃条件下冰冻30分钟,然后取出,在室温下静置至完全解冻,如此反复冻融3个循环后,将解冻的脂肪组织用机械乳化法制备纳米脂肪;
b.将步骤a中的纳米脂肪在室温、2000转/分钟的条件下离心5min,然后将最上层油和最下层水吸去,取中间一层,加入pbs缓冲液,混匀洗涤30min,并在2000转/分钟的条件下离心,吸去缓冲液,然后用胰蛋白酶-edta消化液(0.25%)在37℃下浸泡16h,2000转/分钟离心,吸去消化液,再加入异丙醇在37℃下浸泡480h,2000转/分钟离心,吸去异丙醇,最后加入pbs缓冲液,混匀洗涤30min,2000转/分钟离心,吸去缓冲液,重复洗涤3次;其中,所述胰蛋白酶-edta消化液、异丙醇和pbs缓冲液的用量至少为1ml溶液/1g脂肪;
c.将步骤b中浸泡洗涤后的纳米脂肪加入混合酶溶液在37℃下浸泡16h,2000转/分钟离心,吸去混合酶溶液,并加入pbs缓冲液重复洗涤3次,每次加入pbs缓冲液混匀洗涤30min,2000转/分钟离心,吸去缓冲液;其中所述混合酶溶是由以下比例的物质配制而成:55mmol/lna2hpo4、17mmol/lkh2po4、4.9mmol/lmgso4·7h2o、15000udnase、12.5mgrnase;所述混合酶溶液和每次洗涤的pbs缓冲液的用量为至少为1ml溶液/1g脂肪;
d.将步骤c中混合酶浸泡洗涤后的纳米脂肪再次加入异丙醇在37℃下浸泡8h,2000转/分钟离心,吸去异丙醇,最后采用pbs缓冲液混匀洗涤30min,2000转/分钟离心,吸去缓冲液得到脂肪脱细胞基质,所述异丙醇和pbs缓冲液的用量至少为1ml溶液/1g脂肪;得到的脂肪脱细胞基质其外观状态如图2所示,并将得到的脂肪脱细胞基质浸泡保存在4℃、75%酒精中;
(2)可溶性脱细胞基质制备:将步骤(1)中制备的脂肪脱细胞基质采用重量体积比为0.3%的α-淀粉酶水溶液浸泡5h后,2000转/分钟离心,吸去α-淀粉酶水溶液,再采用浓度为0.2mol/l的醋酸浸泡40~50h后,在温度为4℃、转速为11000转/分钟的条件下离心5分钟后取上清液即为可溶性脱细胞基质;其中,每100mg脱细胞基质加入1ml浓度为0.2mol/l的醋酸;所得到的可溶性脱细胞基质外观状态如图3所示,并将其在温度为4℃的条件下进行保存;
(3)将步骤(1)中的制备的可溶性脱细胞基质与浓度2%w/v的海藻酸钠溶液等体积混合置于注射器中,用橡胶软管5连接到微流控芯片上与内层毛细管2相连的取样枪枪头开口端;将含有5%w/vspan-80的正癸醇置于注射器中,用橡胶软管5连接到微流控芯片上与外层毛细管3相连的取样枪枪头开口端;调节流速使得脱细胞基质-海藻酸钠混合溶液与正癸醇溶液流速比为1:10,并获得包裹有正癸醇的脱细胞基质-海藻酸钠液滴;
(4)将步骤(3)中获得的包裹有正癸醇的脱细胞基质-海藻酸钠液滴通入含有1.5%w/vcacl2的正癸醇溶液,静置16h后,500转/分钟离心,吸去液体,获得海藻酸钙-脂肪脱细胞基质微载体。
将实施例中制备的海藻酸钙-脂肪脱细胞基质微载体在光学显微镜下观察,其显示图如图4所示。
对比试例:直接将浓度2%w/v的海藻酸钠溶液等体积混合置于注射器中,用橡胶软管5连接到微流控芯片上与内层毛细管2相连的取样枪枪头开口端;将含有5%w/vspan-80的正癸醇置于注射器中,用橡胶软管5连接到微流控芯片上与外层毛细管3相连的取样枪枪头开口端;调节流速使得海藻酸钠混合溶液与正癸醇溶液流速比为1:10,获得包裹有正癸醇的海藻酸钠液滴;并将包裹有正癸醇的海藻酸钠液滴通入含有1.5%w/vcacl2的正癸醇溶液,静置16h后,500转/分钟离心,吸去液体,获得海藻酸钙微载体。
分别在实施例中制备的海藻酸钙-脱细胞基质微载体和对比例中制备海藻酸钙微载体种脂肪间充质干细胞,然后将每20ul已种植细胞的微载体置于24孔板中1孔,加入1ml培养基,在37℃、5%co2培养箱种培养,每天更换培养基;第7天在光镜下观察,观察结果分别如图5和图6所示,其中图5是对照组海藻酸钙微载体种细胞7天后光镜图,箭头显示微载体表面细胞,比例尺100um,图6是海藻酸钙-脱细胞基质微载体种细胞7天后光镜图,箭头显示微载体表面细胞,可见较海藻酸钙微载体细胞更多,比例尺100um;从图5和图6可以看出,加入脱细胞基质后细胞较海藻酸钙微载体更多。
- 还没有人留言评论。精彩留言会获得点赞!