一种取代吲哚酮类衍生物的制备方法与流程
本发明属于有机合成技术领域,具体地说,涉及一种取代吲哚酮类衍生物的制备方法。
背景技术:
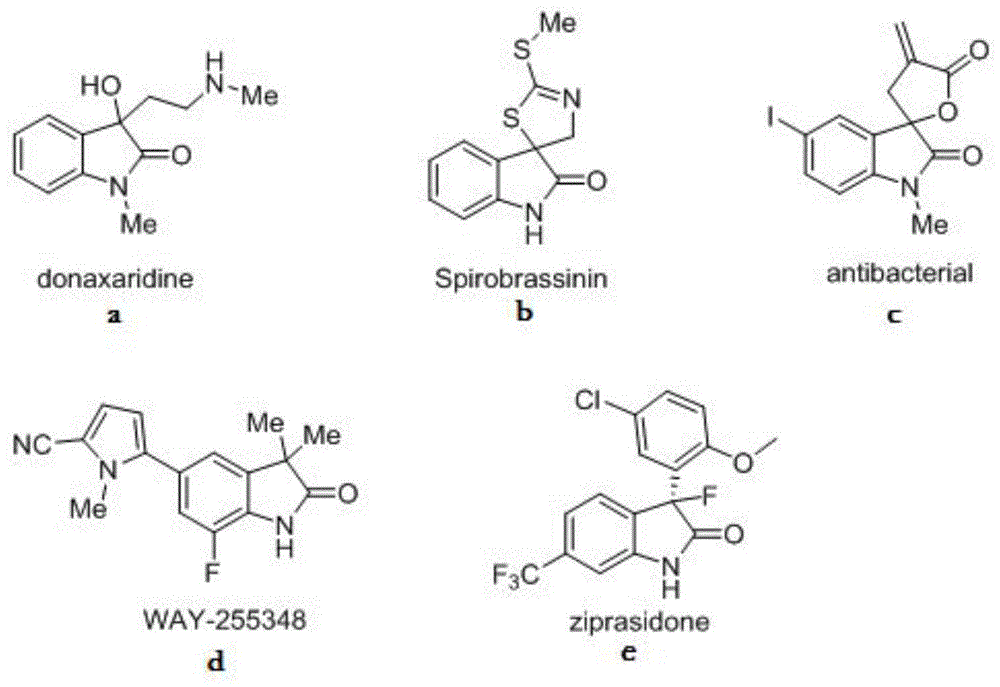
取代吲哚酮类化合物是一类重要的医药和新药研发中间体,含有这类核心结构的化合物广泛存在于天然产物、染料、抗肿瘤药物及神经抑制剂当中。因此具有很高的生物活性研究价值及药物研发等价值。例如文献j.nat.prod.,1997,60,1152-1154中首次报道天然产物donaxaridine的全合成过程,它是一种具有生物仿生活性的活性中间体,可用于天然药物的开发,其结构式如图1(a)所示。m.s.c.pedras等(m.s.c.pedras,m.hossain,m.g.sarwars.montaut.determinationoftheenantiomericpurityofthephytoalexinsspirobrassininsby1hnmrusingchiralsolvation[j].bioorganic&medicinalchemistryletters,2014,14(22),5469–5471)报道spirobrassinin是一种简单且廉价的植物抗毒素,其结构式如图1(b)所示。nedd.heindel等(nedd.heindel,johna.minatelli.synthesisandantibacterialandanticancerevaluationsofa-methylene-y-butyrolactones[j].journalofpharmaceuticalsciences,1981,70,84–86)报道了螺环内酯的外消旋混合物antibacterial作为抗肿瘤药候选药物,被证明对p-388淋巴细胞白血病和鼻咽癌具有较强治疗作用,其结构式如图1(c)所示。andrewfensome等人(andrewfensome,williamr.adams,andreal.adams,etc.design,synthesis,andsarofnewpyrrole-oxindoleprogesteronereceptormodulatorsleadingto5-(7-fluoro-3,3-dimethyl-2-oxo-2,3-dihydro-1h-indol-5-yl)-1-methyl-1h-pyrrole-2-carbonitrile(way-255348)[j].j.med.chem.,2008,51,1861–1873)介绍way-255348作为一种孕酮受体调节剂,并有希望作用于女性保健的新方向,比如避孕药,子宫肌瘤,子宫内膜异位症和某些乳腺癌,其结构式如图1(d)所示。williamm.greenberg等人(williamm.greenbergandlesliecitrome.ziprasidoneforschizophreniaandbipolardisorder:areviewoftheclinicaltrials[j].cnsdrug.reviews.,2007,13(2),137-177)报道了齐拉西酮(ziprasidone)的抗精神病作用,该药于2001年2月在美国获得批准成为第五种非典型抗精神病药,其结构式如图1(e)所示。
目前可以通过多种方法合成取代吲哚酮类衍生物。既可以通过芳基酰胺或n-芳基烯丙基酰胺在过渡金属催化下闭环得到,也可以通过选择性地将亲电试剂加入到靛红或靛红酮亚胺中获得,还可以在3位单取代吲哚酮的基础上继续在3位引入一个基团获得。下面对这些方法进行简要介绍。
(1)hsieh和其同事使用芳基酰胺在cui或cu2o催化下闭环可以较高收率得到3,3-二取代吲哚酮类衍生物(yu-hueijhan,ting-weikang,jen-chiehhsieh.efficientcopper-catalyzedintramolecularn-arylationforthesynthesisofoxindoles[j].tetrahedronletters,2013,54(9),1155–1159)。
egormikhailovichlarin及其同事以n-芳基烯丙基酰胺作为底物,同样在过渡金属催化下闭环也可得到相关3,3-二取代吲哚酮类衍生物(youngjinjang,egorm.larin,andmarklautens.rhodium-catalyzedenantioselectivereductivearylation:convenientaccessto3,3-disubstitutedoxindoles[j].angew.chem.,2017,56(39),11927-11930)。
这类方法的共同点是都需要预先在苯环上引入一个卤素等活性基团然后才能发生闭环反应,这就极大的限制了底物范围并提高了反应成本,因此在一定程度上限定了此类方法的应用。
(2)deecher及其同事报道了一种用碘甲烷作为亲电试剂直接在吲哚酮上进行双取代的方法(caseyc.mccomas,ant.vu,paigee.mahaney.bioorg,etal.synthesisandactivityof1-(3-amino-1-phenylpropyl)indolin-2-ones:anewclassofselectivenorepinephrinereuptakeinhibitors[j].bioorganic&medicinalchemistryletters,2008,18(18),4929–4931)。
这个反应需要使用较危险的试剂正丁基锂来进行,且反应收率中等,不利于此类目标产物的快速、放大制备。
jianzhou及其同事使用0.5-1mol%的difluorophos/hg(otf)2复合物催化烯丙基三甲基硅烷在靛红上的烯丙基化反应,获得具有较优异的对映选择性的目标产物(zhong-yancao,fengzhou,andjianzhou.developmentofsyntheticmethodologiesviacatalyticenantioselectivesynthesisof3,3-disubstitutedoxindolesacc.chem.res.,2018,51,1443-1454)。
这种方法是用复杂的汞催化反应进行,虽然收率较高(75-98%,78-92%ee),但汞催化剂难以制备且投料过程过于复杂。
(3)viswanathan及其同事在吲哚3位存在一个取代基的基础上,再在ncs和1,4-二甲基哌嗪作用下继续在3位引入3,3-二甲基烯丁基基团构建一类3,3-不对称双取代吲哚化合物(karthikeyanthandavamurthy,deeptisharma,suheelk.porwal,,etal.regioselectivecoperearrangementandprenyltransfersonindolescaffoldmimickingfungalandbacterialdimethylallyltryptophansynthasesj.org.chem.,2014,79(21),10049–10067)。
这类反应收率偏低同时存在底物有限的缺点,不适合取代吲哚酮类衍生物的制备。
以上文献中的方法所涉及的反应,虽然能实现取代吲哚酮类衍生物的合成,但多数存在需使用昂贵、复杂的配体,反应条件苛刻,区域选择性不高,收率受底物影响大等问题。鉴于取代吲哚酮类衍生物在医药化工领域的重要性,有必要进一步优化和发展新的方法。
技术实现要素:
有鉴于此,本发明针对上述的问题,提供了一种取代吲哚酮类衍生物的制备方法。
为了解决上述技术问题,本发明公开了一种取代吲哚酮类衍生物的制备方法,其合成路线如下:
其中,x选自o、s或n;
r1,r2,r3和r4各自独立地选自h、c1-6烷基、c1-6烷氧基、硝基、f、cl、br、i、苯基、硝基、羟基、酰基、烷酰基、芳酰基、氨基、或c1-6卤代烷基;
r5选自甲基、乙酰基、苯基、苄基及boc基团;
r6选自甲基、乙基、丙基、异丙基、丁基、异丁基、苯基及苄基;
包括以下步骤:
步骤1、氩气氛围下,将式(ii)和催化剂加入到双颈瓶中,依次加入溶剂及式(iii);将反应升温并进行反应;
步骤2、反应完毕,反应液用乙酸乙酯15ml×3萃取,乙酸乙酯层合并;
步骤3、饱和氯化钠溶液10ml×1洗涤,减压浓缩,硅胶柱层析得到纯净的目标产物(i)。
可选地,所述步骤1中的式(ii)与式(iii)的摩尔比为1:1.5~1:2.8。
可选地,所述溶剂选自二氯甲烷、四氢呋喃、甲醇、无水乙醇、1,4-二氧六环、n,n-二甲基甲酰胺、二甲基亚砜、甲苯、二甲苯、氯苯、乙腈、1,2-二氯乙烷、1,1,2,2-四氯乙烷、四氯化碳中的一种。
可选地,所述溶剂为二甲苯。
可选地,所述溶剂与式(ii)的体积摩尔比(ml/mol)为6:1-7:1。
可选地,所述催化剂选自三苯基膦、1,1’-(双苯基膦)二茂铁、1,2-(双苯基膦)乙烷、消旋1,2’-双苯基膦-1,1’-联萘、联萘酚磷酸酯、四苯基氯化鏻中的一种。
可选地,所述催化剂为三苯基膦。
可选地,所述催化剂用量为5-25mol%。
可选地,所述反应时间为20-28h,反应温度为50-60℃。
与现有技术相比,本发明可以获得包括以下技术效果:
1)本发明通过使用2,3-丁二烯酸酯作为亲电试剂,在三苯基膦催化剂催化下,实现对2-吲哚酮的3位进行双取代反应。
2)本发明所述方法具有原料易得、操作简便、区域选择性高、产物收率高等优点,可为相关结构单元的快速构建提供高效制备方法。
当然,实施本发明的任一产品并不一定需要同时达到以上所述的所有技术效果。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1是本发明背景技术中的化合物的结构式。
具体实施方式
以下将配合实施例来详细说明本发明的实施方式,藉此对本发明如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
现在详细描述本发明的某些实施方案,其实例由随附的结构式和化学反应式说明。本发明意图涵盖所有的替代、修改和等同技术方案,它们均包括在本发明权利要求定义的范围内。本领域技术人员应认识到,许多与本发明所述类似或等同的方法和材料均能够用于实践本发明。本发明绝不限于本发明所述的方法和材料。在所结合的文献、专利和类似材料的一篇或多篇与本申请不同或相矛盾的情况下(包括但不限于所定义的术语、术语应用、所描述的技术,等等),以本申请为准。
应进一步认识到,本发明的某些特征,为清楚可见,在多个独立的实施方案中进行了描述,但也可以在单个实施例中以组合形式提供。反之,本发明的各种特征,为简洁起见,在单个实施方案中进行了描述,但也可以单独或以任意适合的子组合提供。
本发明所使用的立体化学定义和规则一般遵循s.p.parker,ed.,mcgraw-hilldictionaryofchemicalterms(1984)mcgraw-hillbookcompany,newyork;andeliel,e.andwilen,s.,“stereochemistryoforganiccompounds”,johnwiley&sons,inc.,newyork,1994。
像本发明所描述的,本发明的化合物可以任选地被一个或多个取代基所取代,如上面的通式化合物,或者像实施例里面特殊的例子,子类,和本发明所包含的一类化合物。应了解“任选取代的”这个术语与“取代或未取代的”这个术语可以交换使用。术语“任选地”,“任选的”或“任选”是指随后所述的事件或状况可以但未必发生,并且该描述包括其中发生该事件或状况的情况,以及其中未发生该事件或状况的情况,术语“任选地”不论是否位于术语“取代的”之前,都表示所给结构中的一个或多个氢原子被具体取代基所取代。除非其他方面表明,一个任选的取代基团可以有一个取代基在基团各个可取代的位置进行取代。当所给出的结构式中不只一个位置能被选自具体基团的一个或多个取代基所取代,那么取代基可以相同或不同地在各个位置取代。其中所述的取代基可以是,但并不限于d、h、f、cl、br、i、n3、-cn、-oh、-no2、-nh2、c1-6烷基、c1-6烷氧基、苯基、硝基、酰基,烷酰基,芳酰基,c1-6烷氨基、或c1-6卤代烷基等等。
另外,需要说明的是,除非以其他方式明确指出,在本发明中所采用的描述方式“各…独立地为”与“…各自独立地为”和“…独立地为”可以互换,均应做广义理解,其既可以是指在不同基团中,相同符号之间所表达的具体选项之间互相不影响,也可以表示在相同的基团中,相同符号之间所表达的具体选项之间互相不影响。
本发明公开了一种取代吲哚酮类衍生物的制备方法,其合成路线如下:
其中,x选自o、s或n;
r1,r2,r3和r4各自独立地选自h、c1-6烷基、c1-6烷氧基、硝基、f、cl、br、i、苯基、硝基、羟基、酰基、烷酰基、芳酰基、氨基、或c1-6卤代烷基;
r5选自甲基、乙酰基、苯基、苄基及boc基团;
r6选自甲基、乙基、丙基、异丙基、丁基、异丁基、苯基及苄基;
包括以下步骤:
步骤1、氩气氛围下,将式(ii)和催化剂加入到双颈瓶中,依次加入溶剂及式(iii),其中,溶剂与式(ii)的体积摩尔比(ml/mol)为6:1-7:1,式(ii)与式(iii)的摩尔比为1:1.5~1:2.8;所述催化剂用量为5-25mol%,15mol%最优;将反应升温至50-60℃,反应20-28h;
其中,所述溶剂选自二氯甲烷、四氢呋喃、甲醇、无水乙醇、1,4-二氧六环、n,n-二甲基甲酰胺、二甲基亚砜、甲苯、二甲苯、氯苯、乙腈、1,2-二氯乙烷、1,1,2,2-四氯乙烷、四氯化碳等。以二甲苯最优。
所述催化剂选自三苯基膦、1,1’-(双苯基膦)二茂铁、1,2-(双苯基膦)乙烷、消旋1,2’-双苯基膦-1,1’-联萘、联萘酚磷酸酯、四苯基氯化鏻等,以三苯基膦最优。
步骤2、反应完毕,反应液用乙酸乙酯15ml×3萃取,乙酸乙酯层合并;
步骤3、饱和氯化钠溶液10ml×1洗涤,减压浓缩,硅胶柱层析得到纯净的目标产物(i)。
实施例1取代吲哚酮类衍生物3a的制备:
氩气氛围下,将1-甲基吲哚-2-酮(0.3mmol,44mg),三苯基膦(15mol%,11.8mg)加入到10ml双颈瓶中,依次加入2ml二甲苯及2,3-丁二烯酸乙酯(0.84mmol,98μl),将反应升温至55℃,反应24h。反应完毕,反应液用乙酸乙酯15ml×3萃取,乙酸乙酯层合并,饱和氯化钠溶液10ml×1洗涤。减压浓缩,硅胶柱层析得到纯净的目标产物。
经nmr,hrms(esi)证实为3,3-二取代吲哚酮类衍生物3a。产物收率为93%;1hnmr(600mhz,cdcl3)δ7.29(t,j=7.7hz,1h),7.18(d,j=7.2hz,1h),7.08(t,j=7.5hz,1h),6.83(d,j=7.8hz,1h),6.55–6.49(m,2h),5.77(d,j=15.5hz,2h),4.10(q,j=7.1hz,4h),3.18(s,3h),2.69(d,j=7.5hz,4h),1.22(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ177.60,165.84,143.41,141.71,129.59,128.78,125.31,123.33,122.92,108.57,60.32,51.67,39.41,26.29,14.19.
实施例2
氩气氛围下,将式1b(0.3mmol),三苯基膦(5mol%)加入到10ml双颈瓶中,依次加入1.8ml甲苯及2,3-丁二烯酸乙酯(0.45mmol),将反应升温至50℃,反应28h。反应完毕,反应液用乙酸乙酯15ml×3萃取,乙酸乙酯层合并,饱和氯化钠溶液10ml×1洗涤。减压浓缩,硅胶柱层析得到纯净的目标产物。
收率:91%;1hnmr(600mhz,cdcl3)δ7.02–6.98(m,1h),6.93(dd,j=7.7,2.5hz,1h),6.76(dd,j=8.5,4.1hz,1h),6.51-6.46(m,2h),5.78(d,j=15.5hz,2h),4.13–4.08(m,4h),3.17(s,3h),2.74-2.70(m,2h),2.68-2.64(m,2h),1.23(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ177.22,165.73,159.35(d,j=240hz),141.05,139.39(d,j=1.5hz),131.25(d,j=9hz),125.60,115.13(d,j=22.5hz),111.48(d,j=25.5hz),109.13(d,j=9hz),60.40,52.19,39.35,26.44,14.18.
实施例3
氩气氛围下,将1c(0.3mmol),三苯基膦(25mol%)加入到10ml双颈瓶中,依次加入2.1ml甲醇及2,3-丁二烯酸乙酯(0.84mmol),将反应升温至60℃,反应20h。反应完毕,反应液用乙酸乙酯15ml×3萃取,乙酸乙酯层合并,饱和氯化钠溶液10ml×1洗涤。减压浓缩,硅胶柱层析得到纯净的目标产物。
收率:85%;1hnmr(600mhz,cdcl3)δ7.28(dd,j=8.3,2.1hz,1h),7.16(d,j=2.0hz,1h),6.76(d,j=8.3hz,1h),6.50–6.45(m,2h),5.79(d,j=15.5hz,2h),4.13–4.08(m,4h),3.17(s,3h),2.74–2.70(m,2h),2.68–2.64(m,2h),1.23(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ177.05,165.71,142.03,140.95,131.35,128.84,128.34,125.65,123.70,109.51,60.40,52.00,39.36,26.40,14.17.
实施例4
用1d代替实例1中的1a,其他操作同实例1。
收率:86%;1hnmr(600mhz,cdcl3)δ7.43(dd,j=8.3,1.9hz,1h),7.30(d,j=1.9hz,1h),6.72(d,j=8.3hz,1h),6.50–6.44(m,2h),5.80(d,j=15.5hz,2h),4.11(q,j=7.1hz,4h),3.16(s,3h),2.74–2.70(m,2h),2.67–2.64(m,2h),1.23(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ176.94,165.73,142.53,140.94,131.76,131.74,126.43,125.67,115.62,110.02,60.42,51.97,39.38,26.38,14.19.
实施例5
用1e代替实例1中的1a,其他操作同实例1。
收率:73%;1hnmr(600mhz,cdcl3)δ7.62(dd,j=8.2,1.7hz,1h),7.46(d,j=1.6hz,1h),6.62(d,j=8.2hz,1h),6.49–6.44(m,2h),5.79(d,j=15.5hz,2h),4.14–4.09(m,4h),3.15(s,3h),2.73–2.69(m,2h),2.66–2.63(m,2h),1.24(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ176.78,165.75,143.22,140.98,137.72,132.08,131.97,125.67,110.60,85.43,60.42,51.80,39.38,26.33,14.21.
实施例6
用1f代替实例1中的1a,其他操作同实例1。
收率:75%;1hnmr(600mhz,cdcl3)δ7.08(d,j=7.9hz,1h),6.99(s,1h),6.72(d,j=7.9hz,1h),6.54-6.49(m,2h),5.78(d,j=15.5hz,2h),4.11(q,j=7.1hz,4h),3.16(s,3h),2.71–2.67(m,2h),2.67–2.64(m,2h),2.35(s,3h),1.23(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ177.52,165.91,141.91,141.03,132.44,129.61,129.07,125.16,124.04,108.28,60.30,51.72,39.47,26.29,21.25,14.19.
实施例7
用1g代替实例1中的1a,其他操作同实例1。
收率:81%;1hnmr(600mhz,cdcl3)δ6.82–6.77(m,2h),6.74(d,j=8.4hz,1h),6.53–6.48(m,2h),5.78(d,j=15.5hz,2h),4.10(q,j=7.1hz,4h),3.80(s,3h),3.16(s,3h),2.72–2.68(m,2h),2.67–2.64(m,2h),1.22(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ177.20,165.86,155.76,141.69,136.92,130.94,125.30,112.73,110.97,108.88,60.32,55.82,52.57,39.47,26.37,14.20.
实施例8
用1h代替实例1中的1a,其他操作同实例1。
收率:87%;1hnmr(600mhz,cdcl3)δ8.30(dd,j=8.6,2.3hz,1h),8.08(d,j=2.2hz,1h),6.93(d,j=8.6hz,1h),6.46–6.41(m,2h),5.79(d,j=15.5hz,2h),4.13–4.08(m,4h),3.26(s,3h),2.82–2.78(m,2h),2.76–2.72(m,2h),1.22(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ177.63,165.50,149.07,143.64,139.99,130.55,126.19,126.17,119.05,108.18,60.53,51.94,39.29,26.76,14.16.
实施例9
用1i代替实例1中的1a,其他操作同实例1。
收率:82%;1hnmr(600mhz,cdcl3)δ7.02(dd,j=4.8,1.9hz,1h),7.01(t,j=4.2hz,1h),6.96(dd,j=5.3,3.2hz,1h),6.52–6.47(m,2h),5.78(d,j=15.5hz,2h),4.11(q,j=7.1hz,4h),3.39(d,j=2.6hz,3h),2.73–2.69(m,2h),2.68–2.65(m,2h),1.23(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ177.20,165.76,147.91(d,j=243hz),141.15,132.53(d,j=1.5hz),130.11(d,j=9hz),125.61,123.53(d,j=6hz),119.15(d,j=3hz),116.86(d,j=18hz),60.41,52.10,39.55,28.75(d,j=6hz),14.19.
实施例10
用1j代替实例1中的1a,其他操作同实例1。
收率:86%;1hnmr(600mhz,cdcl3)δ7.21(d,j=8.1hz,1h),7.04(d,j=7.3hz,1h),6.99(t,j=7.7hz,1h),6.52–6.47(m,2h),5.77(d,j=15.5hz,2h),4.12(q,j=7.1hz,4h),3.54(s,3h),2.72–2.68(m,2h),2.66–2.63(m,2h),1.23(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ177.82,165.72,141.04,139.39,132.41,131.16,125.67,123.63,121.79,116.09,60.41,51.52,39.62,29.66,14.19.
实施例11
用1k代替实例1中的1a,其他操作同实例1。
收率:74%;1hnmr(600mhz,cdcl3)δ7.40(d,j=8.2hz,1h),7.08(d,j=7.3hz,1h),6.93(t,j=7.7hz,1h),6.53–6.48(m,2h),5.78(d,j=15.5hz,2h),4.12(q,j=7.1hz,4h),3.56(s,3h),2.72–2.68(m,2h),2.67–2.63(m,2h),1.24(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ178.03,165.73,141.04,140.84,134.50,132.75,125.70,124.01,122.35,103.01,60.43,51.48,39.64,29.91,14.21;hrmsm/z(esi)计算值c21h24brno5(m+h)+450.0916,实测值450.0915。
实施例12
用1l代替实例1中的1a,反应48h,其他操作同实例1。
收率:70%;1hnmr(600mhz,cdcl3)δ7.06(d,j=8.2hz,1h),6.57(dd,j=8.2,2.2hz,1h),6.55–6.50(m,2h),6.41(d,j=2.2hz,1h),5.77(d,j=15.5hz,2h),4.11(q,j=7.1hz,4h),3.83(s,3h),3.15(s,3h),2.66(d,j=7.6hz,4h),1.23(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ178.23,165.90,160.54,144.67,141.96,125.21,124.01,121.37,106.78,96.58,60.32,55.55,51.24,39.57,26.30,14.21.
实施例13
用1m代替实例1中的1a,其他操作同实例1。
收率:90%;1hnmr(600mhz,cdcl3)δ6.80(d,j=3.6hz,2h),6.53–6.48(m,2h),5.78(d,j=15.5hz,2h),4.11(q,j=7.1hz,4h),3.42(s,3h),2.69–2.66(m,2h),2.63–2.60(m,2h),2.50(s,3h),2.28(s,3h),1.23(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ178.23,165.98,142.12,138.79,133.02,132.21,130.31,125.04,121.75,119.80,60.28,51.10,39.85,29.54,20.91,18.91,14.21
实施例14
用1n代替实例1中的1a,其他操作同实例1。
收率:91%;1hnmr(600mhz,cdcl3)δ7.04–7.01(m,1h),6.69–6.66(m,1h),6.49–6.44(m,2h),5.78(d,j=15.5hz,2h),4.12(q,j=7.1hz,4h),3.16(d,j=11.5hz,3h),2.73–2.69(m,2h),2.66–2.62(m,2h),1.24(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ177.29,165.65,150.67(dd,j=247.5,15hz),146.83(dd,j=241.5,13.5hz),140.68,139.76(d,j=10.5hz),125.83,124.89(d,j=4.5hz),113.11(d,j=21hz),98.97(d,j=22.5hz),60.48,51.90,39.33,26.55,14.18.
实施例15
用1o代替实例1中的1a,其他操作同实例1。
收率:83%;1hnmr(600mhz,cdcl3)δ7.82(d,j=8.2hz,1h),7.33–7.30(m,1h),7.18(t,j=4.2hz,2h),6.59–6.54(m,2h),5.80(d,j=15.5hz,2h),4.11(q,j=7.1hz,4h),2.76–2.72(m,2h),2.71–2.68(m,2h),1.63(s,9h),1.23(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ176.48,165.68,148.84,140.90,139.35,129.01,128.43,125.90,124.79,123.17,115.52,84.71,60.40,52.11,40.08,28.07,14.18.
实施例16
用1p代替实例1中的1a,其他操作同实例1。
收率:93%;1hnmr(600mhz,cdcl3)δ7.34–7.29(m,1h),7.28–7.27(m,1h),7.23(d,j=7.2hz,1h),7.21(d,j=7.4hz,1h),7.18(d,j=6.5hz,2h),7.16(d,j=7.8hz,1h),7.06(t,j=7.5hz,1h),6.66(d,j=7.8hz,1h),6.58–6.53(m,2h),5.82(d,j=15.5hz,2h),4.90(s,2h),4.11(q,j=7.1hz,4h),2.80–2.73(m,4h),1.22(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ177.64,165.75,142.57,141.65,135.37,129.45,128.83,128.74,127.53,127.04,125.55,123.31,122.97,109.73,60.33,51.81,43.79,39.72,14.20.
实施例17
用1q代替实例1中的1a,其他操作同实例1。
收率:96%;1hnmr(400mhz,cdcl3)δ7.50(t,j=7.7hz,2h),7.40(t,j=7.5hz,1h),7.29(d,j=7.3hz,2h),7.27–7.26(m,1h),7.23–7.19(m,1h),7.12(t,j=7.1hz,1h),6.75(d,j=7.8hz,1h),6.65–6.60(m,2h),5.83(d,j=15.5hz,2h),4.15–4.09(m,4h),2.86–2.82(m,2h),2.80–2.76(m,2h),1.23(t,j=7.1hz,6h);13cnmr(100mhz,cdcl3)δ177.10,165.81,143.64,141.53,134.17,129.71,129.25,128.76,128.38,126.85,125.56,123.44,123.43,109.81,60.35,52.08,39.73,14.22.
实施例18
用1r代替实例1中的1a,其他操作同实例1。
收率:87%;1hnmr(600mhz,cdcl3)δ7.78(d,j=7.0hz,1h),7.67–7.65(m,1h),7.52–7.34(m,1h),7.22–7.21(m,1h),6.41–6.37(m,2h),5.80(d,j=15.4hz,2h),4.06–4.01(m,4h),3.37(s,2h),2.85(s,2h),2.55(s,3h),1.17(d,j=6.6hz,6h);13cnmr(150mhz,cdcl3)δ199.70,168.51,165.67,161.65,152.14,144.20,137.78,125.68,125.10,124.49,124.13,84.92,60.30,38.42,26.83,14.12。
实施例19
用1s代替实例1中的1a,其他操作同实例1。
收率:86%;1hnmr(600mhz,cdcl3)δ7.70(d,j=7.7hz,1h),7.62–7.59(m,1h),7.26(s,1h),7.13(d,j=7.4hz,1h),6.44–6.39(m,2h),5.81(d,j=15.5hz,2h),4.07–4.03(m,4h),3.16(s,2h),2.85–2.81(m,2h),1.63(s,9h),1.17(t,j=7.1hz,6h);13cnmr(150mhz,cdcl3)δ199.44,165.68,150.69,140.08,138.02,125.69,123.99,123.45,122.95,117.04,83.44,72.24,60.29,38.49,28.43,14.13。
实施例20
用1t代替实例1中的1a,其他操作同实例1。
收率:91%;1hnmr(600mhz,cdcl3)δ7.39–7.37(m,1h),7.36–7.35(m,2h),7.33–7.27(m,3h),7.24–7.23(m,1h),7.14–7.11(m,1h),6.91(d,j=7.8hz,1h),6.57–6.52(m,1h),5.80(d,j=15.5hz,1h),4.10(q,j=7.1hz,2h),3.21(s,3h),3.20–3.08(m,2h),1.21(t,j=7.1hz,3h);13cnmr(150mhz,cdcl3)δ177.46,165.91,143.69,142.56,138.79,130.87,128.74,128.71,127.67,126.99,125.24,122.81,108.60,60.27,55.82,40.25,26.53,14.20.
实施例21
用1b代替实例1中的1a,用2b代替实例1中的2a,其他操作同实例1。
收率:83%;1hnmr(600mhz,cdcl3)δ7.00(td,j=8.9,2.5hz,1h),6.93(dd,j=7.7,2.5hz,1h),6.76(dd,j=8.5,4.1hz,1h),6.52–6.47(m,2h),5.79(d,j=15.5hz,2h),3.65(s,6h),3.18(d,j=7.5hz,3h),2.74–2.70(m,2h),2.67–2.64(m,2h);13cnmr(150mhz,cdcl3)δ177.13,166.12,159.35(d,j=240hz),141.36,139.38,131.2(d,j=9hz),125.20,115.17(d,j=24hz),111.44(d,j=24hz),109.18(d,j=7.5hz),52.15,51.57,39.37,26.46.
实施例22
用1d代替实例1中的1a,用2b代替实例1中的2a,其他操作同实例1。
收率:86%;1hnmr(600mhz,cdcl3)δ7.44–7.42(m,1h),7.30(d,j=1.9hz,1h),6.72(d,j=8.3hz,1h),6.53–6.48(m,2h),5.80(d,j=15.5hz,2h),3.66(s,6h),3.16(s,3h),2.75–2.71(m,2h),2.68–2.64(m,2h);13cnmr(150mhz,cdcl3)δ176.84,166.12,142.51,141.23,131.80,131.69,126.36,125.25,115.64,110.05,51.94,51.58,39.42,26.40;计算值c19h20brno5(m+h)+422.0603,实测值422.0594。
实施例23
用1d代替实例1中的1a,用2c(4.5eq)代替实例1中的2a,反应48h,其他操作同实例1。
收率:84%;1hnmr(600mhz,cdcl3)δ7.44–7.42(m,1h),7.37–7.36(m,1h),7.35–7.34(m,5h),7.32–7.29(m,5h),6.69(d,j=8.3hz,1h),6.53–6.48(m,2h),5.85(d,j=15.5hz,2h),5.10(s,4h),3.12(s,3h),2.75–2.71(m,2h),2.68–2.64(m,2h);13cnmr(150mhz,cdcl3)δ176.83,165.45,142.54,141.66,135.87,131.81,131.61,128.58,128.25,128.10,126.43,125.33,115.66,110.02,66.20,52.01,39.39,26.36.
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!