基于液滴微流控技术的单细胞内miRNA高灵敏多组分同时检测方法和系统与流程
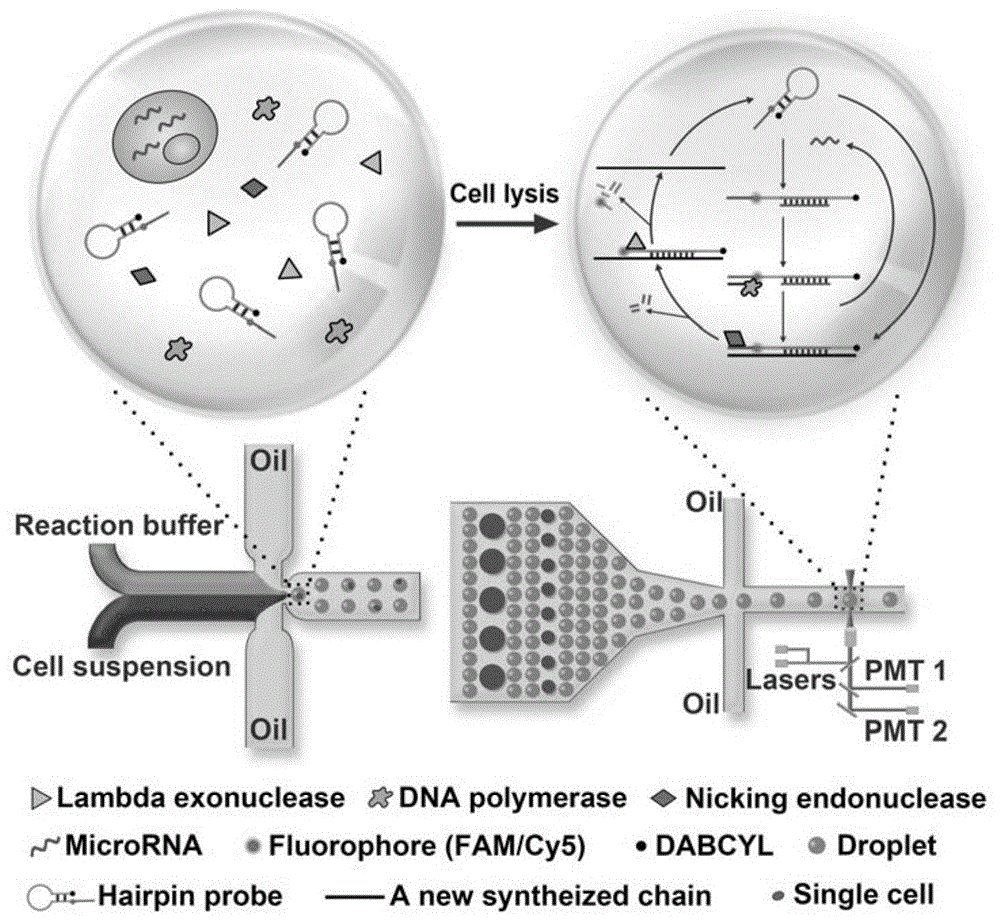
本发明属于生物检测和分子生物学技术领域,具体涉及基于液滴微流控技术的单细胞内mirna高灵敏多组分同时检测方法和系统。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
microrna(mirna)是一类细胞内生的、长度约为20-24个核苷酸的短链rna,其通过对蛋白编码基因mrna的调节发挥多种重要的生物作用,如细胞的生长、分化、凋亡和增殖等。mirna在细胞内的异常表达跟诸多疾病相关。尤其在肿瘤发生发展过程中,某些mirna异常表达,对肿瘤的发生、侵袭、转移起到了广泛的调控作用。另外,mirna的表达还具有明显的组织特异性,不同肿瘤类型以及同一肿瘤的不同分型都可能存在表达发生特异性变化的一种或几种mirna。目前,很多mirna已被认定为重要的肿瘤标志物,其表达变化已成为肿瘤诊断的指标之一。对几乎所有已知种类mirna的分析也已经表明,多种mirna表达分析可以用于肿瘤的分类。
近年,临床微创取样以及液体活检等技术的发展极大促进了肿瘤医学诊治的进步。对所获取的极少数细胞样品(如循环肿瘤细胞)的分子生物学分析是认识肿瘤和进行肿瘤诊断、预后的有效途径。然而目前常规生化分析方法都是基于大量细胞匀浆分析,制约了临床极少数细胞样品的检测分析。发展具备单细胞操控能力和高灵敏传感能力的单细胞分析方法可以有效的突破上述瓶颈,从而获取细胞内多种生物分子的信息。鉴于mirna表达与肿瘤进程、类型等的密切关联,发展高效的mirna的单细胞分析方法,将是解决上述问题的一个重要方面,相关结果将为肿瘤鉴定、分类或评价提供重要的参考。
肿瘤细胞数量少、细胞内mirna的表达量低、多为肿瘤相关表达下调且易被降解是微量细胞内mirna分析的样品特点,也为分析方法的建立提出了挑战。1、细胞浓度低、数量少,要求方法具有高通量的样品处理能力以及高效单细胞分析能力;2、针对mirna的低含量和易降解问题,要求方法具有高的检测灵敏度并具有有效的措施防止rna酶对mirna的降解;3、为了提高分析结果的准确性,正确解析mirna与肿瘤诊断、来源、分型等信息的关联,多种mirna表达的同时解析有助于更准确的肿瘤确认。随着mirna对生物学和临床医学价值的逐渐显现,具有高选择性、高灵敏度的细胞中mirna分析方法被不断的发展,目前关于mirna的检测方法大多是基于细胞匀浆的分析,这既不能适应微量细胞样品的处理和检测要求,也难以避免细胞破膜后mirna在环境中暴露导致的酶对其潜在的降解。虽然一些mirna检测方法的灵敏度可到单细胞甚至单分子水平,但是真正的mirna单细胞定量分析研究很少,有报道指出可以将单个细胞裂解液分散至2万个液滴后对其进行扩增,实现了mirna单细胞定量检测,但发明人发现,其中单细胞操控的困难导致了样品处理和单细胞分析的低通量,制约了对mirnas表达细胞异质性的研究,更限制了其在生物医学上的实际应用。
技术实现要素:
针对上述现有技术的不足,本发明提供一种用于单细胞内多种mirna高灵敏检测的方法和系统。利用本发明可以提高单细胞的分析效率并有效地减少环境中酶对mirna的降解,并且能够达到单分子的检测灵敏度,具有良好的实际应用之价值。
本发明是通过如下技术方案实现的:
本发明的第一个方面,提供一种单细胞内mirna多组分同时检测方法,所述方法包括:
--单细胞包裹:高通量制备油包水微液滴用于单细胞包裹,并实现细胞与外界环境的隔离,提高单细胞的分析效率并有效地减少环境中酶对mirna的降解,提高分析的准确性。
其中,所述高通量制备油包水微液滴的具体方法为:构建液滴生成芯片,所述液滴生成芯片包括水相进样口和油相进样口,所述水相进样口包括第一水相进样口和第二水相进样口;
其中第一水相进样口通入细胞悬浮液;第二水相进样口通入扩增反应液;从而实现在液滴生成的过程中同时实现细胞的包裹;
所述油相进样口通入hfe-7500;进一步优选通入含有0.2%pfpe-peg的hfe-7500;
所述水相进样口、油相进样口均与注射泵连接;当层流的两股水溶液在交叉点处遇到油相液流时,受到油相流体的剪切力,形成稳定生成的液滴。液滴的大小和生成速度与通道的尺寸、流体的流速密切相关。因此优选的,稳定油水流速分别为850μl/h和300μl/h时,可稳定生成直径为55-60μm的液滴,液滴的生成速度为800±50个/秒。
--信号放大:在液滴内构建一个mirna特异性引发的二次等温信号扩增反应;
所述信号放大具体方法为:
靶标mirna与灯标探针(hairpinprobe)的环状部分结合,引起其构型变化,从而使其颈部结构原来相邻的荧光基团(fam/cy5)和淬灭基团(dabcyl)分离,导致荧光恢复;
一个短链的dna引物与发卡探针打开的颈部结合,在dna聚合酶(dnapolymerase)的作用下,以打开发卡探针为模板进行扩增,形成双链杂交体,将原先结合的靶标mirna取代,取代下来的mirna则可以结合另外的灯标参与到下一个链取代反应。在此过程中,单个mirna可触发多个灯标信号的恢复,实现mirna的信号放大。
此外,生成的双链杂交体中原发卡探针链的5’端含有niking酶的作用位点,在其作用后,核酸外切酶可继续作用于发卡探针链将其降解,使得双链杂交体中另外一条新合成的链游离出来,这条单链包含与靶标mirna相同的序列,又可以与灯标结合引发下一循环的酶切反应,诱导灯标荧光信号的恢复,实现mirna信号的进一步放大。
所述单细胞内mirna多组分同时检测方法还包括荧光信号检测步骤;
具体的,所述荧光信号检测步骤包括:构建液滴检测芯片;通过微流控装置生成的液滴内的荧光信号由激光诱导荧光装置进行检测;
具体的,包裹单细胞的液滴生成后由液滴生成芯片液滴出样口连接的毛细管导入检测芯片入口,紧密排列的液滴被通入的油适当隔离,然后依次单个通过通道进行荧光检测,样品的荧光信号通过信号采集卡被收集。
本发明的第二个方面,提供一种单细胞内mirna多组分同时检测系统,所述系统至少包括液滴生成芯片、液滴检测芯片,所述液滴生成芯片与液滴检测芯片通过毛细管连接。
其中,所述液滴生成芯片包括水相进样口和油相进样口,所述水相进样口包括第一水相进样口和第二水相进样口;所述液滴生成芯片与液滴检测芯片通过毛细管连接。
其中第一水相进样口通入细胞悬浮液;第二水相进样口通入扩增反应液;从而实现在液滴生成的过程中同时实现细胞的包裹。
所述油相进样口与油相主通道相连,所述油相主通道分为第一油相通道与第二油相通道,所述第一油相通道与第二油相通道与水相主通道在交汇处呈“十”字型交叉。
所述液滴检测芯片包括液滴进样口和油相进样口,所述液滴进样口一端与毛细管连接通入液滴生成芯片制备得到的液滴,另一端连接液滴通道,随着液滴通道的延展,其宽度渐性缩小;
所述油相进样口与油相主通道相连,所述油相主通道分为第一油相通道与第二油相通道,所述第一油相通道与第二油相通道与液滴通道在交汇处呈“十”字型交叉。
本发明的第三个方面,提供上述检测方法和/或系统在检测单细胞内多组分mirna中的应用。
其中,所述mirna包括但不限于mirnalet-7a和mir-20。
本发明有益效果:与现有技术相比,本发明具有高效的细胞处理能力,能够捕获100个细胞/秒,检测13000个细胞/小时。液滴内的二次等温放大提高了扩增反应速率和检测灵敏度,使得能够分析单个细胞内多种表达下调的mirna。液滴内的隔离空间能有效地防止mirna的降解,保证检测的精确度,具有良好的实际应用之价值。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
图1是本发明的原理示意图;
图2是本发明实施例1的芯片结构示意图;其中图2a为液滴生成芯片;图2b为液滴检测芯片;其中,图2a中1为第一水相进样口,2为第二水相进样口,3为油相进样口,4为液滴出样口;图2b中5为液滴进样口,6为油相进样口。
图3是本发明实施例1中mirnalet-7a的荧光扩增信号随时间的变化情况系列图;其中,图3a为不同浓度条件下mirnalet-7a的荧光扩增信号随时间的变化情况;图3b反应时间为14min时不同浓度mirnalet-7a的荧光信号线性相关性曲线;图3c为不同浓度条件下的mirna20的荧光扩增信号随时间的变化情况;图3d为在反应时间为14min时,不同浓度mirna20的荧光信号线性相关性曲线;
图4是本发明实施例1的单个mcf-7细胞内mirna20和let-7a的荧光信号图;
图5是本发明实施例1中的四种肿瘤细胞系的单细胞mirna-20和let-7a表达图。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本发明使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
如前所述,单细胞操控的困难导致了样品处理和单细胞分析的低通量,制约了对mirnas表达细胞异质性的研究,更限制了其在生物医学上的实际应用。
有鉴于此,本发明的一个具体实施方式中,提供一种单细胞内mirna多组分同时检测方法,所述方法包括:
--单细胞包裹:高通量制备油包水微液滴用于单细胞包裹,并实现细胞与外界环境的隔离,提高单细胞的分析效率并有效地减少环境中酶对mirna的降解,提高分析的准确性。
本发明的又一具体实施方式中,所述高通量制备油包水微液滴的具体方法为:构建液滴生成芯片,所述液滴生成芯片包括水相进样口和油相进样口,所述水相进样口包括第一水相进样口和第二水相进样口;
本发明的又一具体实施方式中,其中第一水相进样口通入细胞悬浮液;第二水相进样口通入扩增反应液;从而实现在液滴生成的过程中同步实现细胞的包裹;同时触发第二阶段的信号放大过程;
本发明的又一具体实施方式中,所述油相进样口通入hfe-7500氟化液;进一步优选通入含有0.2%表面活性剂pfpe-peg的hfe-7500氟化液;采用上述油相液体,形成液滴更为稳定;
本发明的又一具体实施方式中,所述第一水相进样口与第一水相通道相连;所述第二水相进样口与第二水相通道相连;所述第一水相通道与第二水相通道宽度均为280-320μm(优选300μm),第一水相通道与第二水相通道交汇形成水相主通道,所述水相主通道宽度为380-420μm(优选400μm);层流的两股水溶液在水相主通道与油相进样口经油相主通道注入第一油相通道和第二油相通道的油相液流交汇,受到油相流体的剪切力,从而形成稳定生成的液滴。所述第一油相通道和第二油相通道的宽度为180-220μm(优选200μm)。
本发明的又一具体实施方式中,水相主通道与第一油相通道和第二油相通道在交汇处呈“十”字型交叉,水相主通道中的水溶液与油相液体分别从水平和垂直通道中流出,在“十”字型结构处形成油/水界面,受到油相流体的剪切力作用,形成稳定生成的液滴。
液滴的大小和生成速度与通道的尺寸、流体的流速相关。因此优选的,稳定油流速为850μl/h,稳定水流速为300μl/h时,可稳定生成直径为55-60μm的液滴,液滴的生成速度为800±50个/秒;从而实现高通量制备液滴过程;
--信号放大:在液滴内构建一个mirna特异性引发的二次等温信号扩增反应;
所述信号放大具体方法为:
靶标mirna与灯标探针(hairpinprobe)的环状部分结合,引起其构型变化,从而使其颈部结构原来相邻的荧光基团(fam/cy5)和淬灭基团(dabcyl)分离,导致荧光恢复;
一个短链的dna引物与发卡探针打开的颈部结合,在dna聚合酶(dnapolymerase)的作用下,以打开发卡探针为模板进行扩增,形成双链杂交体,将原先结合的靶标mirna取代,取代下来的mirna则可以结合另外的灯标参与到下一个链取代反应。在此过程中,单个mirna可触发多个灯标信号的恢复,实现mirna的信号放大。
此外,生成的双链杂交体中原发卡探针链的5’端含有切刻内切酶的作用位点,在其作用后,核酸外切酶可继续作用于发卡探针链将其降解,使得双链杂交体中另外一条新合成的链游离出来,这条单链包含与靶标mirna相同的序列,又可以与灯标结合引发下一循环的酶切反应,诱导灯标荧光信号的恢复,实现mirna信号的进一步放大。
本发明的又一具体实施方式中,待检mirna为mirnalet-7a和mir-20,所述mirnalet-7a核苷酸序列为ugagguaguagguuguauaguu(seqidno.1);
所述mir-20核苷酸序列为uaaagugcuuauagugcagguag(seqidno.4);
所述mirnalet-7a探针为:
aagctgaggtcttggacaaactatacaacctactacctcatgtccaaga(seqidno.5);
所述mir-20探针序列为:
aagctgaggtcttggacactacctgcactataagcactttatgtccaaga(seqidno.6);
所述引物为tcttggac(seqidno.7);
其中,斜体的aa和tc序列为硫代硫酸盐修饰,加粗的t和u序列分别修饰有fam(let-7aprobe/rna2)和cy5(mir-20probe)荧光基团,加粗的a序列为dabcyl修饰。
所述单细胞内mirna多组分同时检测方法还包括荧光信号检测步骤;
具体的,所述荧光信号检测步骤包括:构建液滴检测芯片;通过微流控装置生成的液滴内的荧光信号由激光诱导荧光装置进行检测;
本发明的又一具体实施方式中,所述荧光信号检测步骤包括:包裹单细胞的液滴生成后由生成芯片出口处连接的毛细管导入液滴检测芯片入口,紧密排列的液滴被通入的油隔离,然后依次单个通过通道进行荧光检测,样品的荧光信号通过信号采集卡被收集并读出。
本发明的又一具体实施方式中,激发波长分别为473nm、633nm,发射波长分别为519nm、670nm。
本发明的又一具体实施方式中,提供一种单细胞内mirna多组分同时检测系统,所述系统至少包括液滴生成芯片、液滴检测芯片,所述液滴生成芯片与液滴检测芯片通过毛细管连接。
本发明的又一具体实施方式中,所述液滴生成芯片和液滴检测芯片均包括微流控通道片层和载片层,所述微流控通道片层由聚二甲基硅氧烷(pdms)制成;所述载片层由玻璃制成;所述微流控通道片层高度为4-6mm(优选为5mm);
本发明的又一具体实施方式中,所述液滴生成芯片包括水相进样口和油相进样口,所述水相进样口包括第一水相进样口和第二水相进样口;
其中第一水相进样口通入细胞悬浮液;第二水相进样口通入扩增反应液;从而实现在液滴生成的过程中同时实现细胞的包裹。
所述油相进样口与油相主通道相连,所述油相主通道分为第一油相通道与第二油相通道,所述第一油相通道与第二油相通道与水相主通道在交汇处呈“十”字型交叉。
本发明的又一具体实施方式中,所述第一水相进样口与第一水相通道相连;所述第二水相进样口与第二水相通道相连;所述第一水相通道与第二水相通道宽度均为280-320μm(优选300μm),第一水相通道与第二水相通道交汇形成水相主通道,所述水相主通道宽度为380-420μm(优选400μm);层流的两股水溶液在水相主通道与经油相进样口经油相主通道注入第一油相通道和第二油相通道的油相液流交汇,受到油相流体的剪切力,从而形成稳定生成的液滴。优选的,水相主通道与第一油相通道和第二油相通道在交汇处呈“十”字型交叉,水相主通道中的水溶液与油相液体分别从水平和垂直通道中流出,在“十”字型结构处形成油/水界面,受到油相流体的剪切力作用,形成稳定生成的液滴,液滴继续沿液滴通道流动至液滴出样口。所述第一油相通道和第二油相通道的宽度为180-220μm(优选200μm)。
本发明的又一具体实施方式中,所述液滴检测芯片包括液滴进样口和油相进样口,所述液滴进样口一端可与毛细管连接液滴生成芯片的液滴出样口,使得液滴生成芯片制得液滴进入液滴检测芯片,所述液滴进样口另一端连接液滴通道,随着液滴通道的延展,其宽度渐性缩小;
所述油相进样口与油相主通道相连,所述油相主通道分为第一油相通道与第二油相通道,所述第一油相通道与第二油相通道与液滴通道在交汇处呈“十”字型交叉。所述油相进样口通入hfe-7500氟化液;进一步优选通入含有0.2%表面活性剂pfpe-peg的hfe-7500氟化液,此时油相液体作用在于隔离紧密排列的液滴,使得液滴能够依次单个有间隔地通过液滴通道进行荧光检测。
本发明的又一具体实施方式中,交汇处液滴通道宽度略大于液滴直径,即满足使得单个液滴通过管道,优选的,控制液滴通道宽度为60-80μm(优选为70μm),液滴流速50~70μl/h(优选为60μl/h);控制第一油相通道和第二油相通道宽度为60-80μm(优选为80μm),油相流速为80~100μl/h(优选为90μl/h),通过上述参数,更有利于液滴形成单个有间隔地通过液滴通道进而进行荧光检测。
本发明的又一具体实施方式中,提供上述检测方法和/或系统在检测单细胞内多组分mirna中的应用。
其中,所述细胞包括但不限于hel、k562、293和mcf-7。
所述mirna包括但不限于mirnalet-7a和mir-20。
以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。另外,实施例中未详细说明的分子生物学方法均为本领域常规的方法,具体操作可参看分子生物指南或产品说明书。
实施例1
利用微液滴生成与检测芯片及激光诱导荧光检测装置结合二次等温信号放大反应,即可进行单细胞内mirnas多组分同时高灵敏检测。
(i)液滴的生成与单细胞包裹
芯片系统中液滴生成芯片结构如图2a所示,进样口(1)和(2)为水相进样口。油相进样口(3)通入含有0.2%pfpe-peg的hfe-7500。四通道注射泵用于将油相和水相注入微流控芯片。水相进样口(1)与第一水相通道相连;水相进样口(2)与第二水相通道相连;第一水相通道与第二水相通道宽度均为300μm,第一水相通道与第二水相通道交汇形成水相主通道,水相主通道宽度为400μm;层流的两股水溶液在交汇点处遇到油相进样口(3)喷出流经第一油相通道(宽度为200μm)和第二油相通道(宽度为200μm)的油相液流时,受到油相流体的剪切力,形成稳定生成的液滴。液滴的大小和生成速度与通道的尺寸、流体的流速相关,在优化的稳定油水流速分别为850μl/h和300μl/h时,可稳定生成直径为55-60μm的液滴,液滴的生成速度为800±50个/秒,液滴生成后继续沿通道流动至液滴出样口(4)。
所述单细胞包裹过程,当进样口(1)和(2)分别通入细胞悬浮液和扩增反应液时,可以在液滴生成的过程中同时实现细胞的包裹。液滴中细胞个数符合泊松分布,用方程p(x=x)=e-λ[λx/x!]表示,其中x为液滴中的细胞数目,λ为平均每个液滴中细胞的数目,p(x=x)为含x个细胞的液滴在总液滴中所占的比例,即x个细胞的包裹概率。当细胞密度为1×106个/ml,液滴中不包裹细胞、包裹一个细胞、包裹两个细胞、包裹两个以上细胞的概率分别为90.48%、9.05%、0.45%、0.01%。在该细胞浓度下,单细胞的包裹速率达到80-150个/秒,说明方法具有高通量的单细胞包裹能力。
(ii)mirna的信号放大过程
扩增反应液为2×nebbuffer2溶液,包含有4μm的引物,0.7u/μl的bstdna聚合酶,0.6u/μl切刻内切酶,0.5u/μlλ外切酶,800μmdntps及0.12μl/μlca630裂解液。细胞悬液含有16%(v/v)optiprep密度梯度溶液,1μmmirna发卡探针的pbs缓冲液,以及密度为1×106个/ml的mcf-7细胞。油相及水相均通过四通道注射泵注入微流控装置。其中扩增反应液通入进样口(2),mcf-7细胞悬液通入进样口(1),0.2%pfpe-peg的hfe-7500油通入进样口(3)。生成液滴后,单细胞在ca630裂解液作用下被裂解,释放出mirna,扩增反应溶液在液滴内对目标mirnalet-7a及mirna20进行等温二次扩增。
所述等温二次扩增过程中(图1),靶标mirna首先与一个灯标探针(hairpinprobe)的环状部分结合,引起其构型变化,从而使其颈部结构原来相邻的荧光基团(fam/cy5)和淬灭基团(dabcyl)分离,导致荧光恢复。接下来,一个短链的dna引物与发卡探针打开的颈部结合,在dna聚合酶(dnapolymerase)的作用下,以打开发卡探针为模板进行扩增,形成双链杂交体,将原先结合的靶标mirna取代,取代下来的mirna则可以结合另外的灯标参与到下一个链取代反应。在此过程中,单个mirna可触发多个灯标信号的恢复,实现mirna的信号放大。此外,生成的双链杂交体中原发卡探针链的5’端含有niking酶的作用位点,在其作用后,核酸外切酶可继续作用于发卡探针链将其降解,使得双链杂交体中另外一条新合成的链游离出来,这条单链包含与靶标mirna相同的序列,又可以与灯标结合引发下一循环的酶切反应,诱导灯标荧光信号的恢复,实现mirna信号的进一步放大。本发明所需核酸序列如表1所示。
表1.所需核酸序列(5’-3’)
斜体的aa和tc序列为硫代硫酸盐修饰,加粗的t和u序列修饰有fam(let-7aprobe/rna2)和cy5(mir-20probe)荧光基团,加粗的a序列为dabcyl修饰。
(iii)荧光信号检测
所述液滴检测芯片结构如图2b所示。通过微流控装置生成的液滴内的荧光信号由激光诱导荧光装置进行检测。包裹单细胞的液滴生成后由生成芯片液滴出样口(4)处连接的毛细管导入检测芯片入口的液滴进样口(5),液滴进样口(5)另一端连接液滴通道,随着液滴通道的延展,其宽度渐性缩小;油相进样口(6)与油相主通道相连,油相主通道分为第一油相通道与第二油相通道,所述第一油相通道与第二油相通道与液滴通道在交汇处呈“十”字型交叉。所述油相进样口(6)通入含有0.2%表面活性剂pfpe-peg的hfe-7500氟化液,此时油相液体作用在于隔离紧密排列的液滴,使得液滴能够依次单个有间隔地通过液滴通道进行荧光检测。样品的荧光信号通过信号采集卡被收集并读出,激发波长分别为473nm、633nm,发射波长519nm、670nm。
首先在利用该方法检测了不同浓度mirna的荧光信号并绘制了标准曲线,如图3所示。选取14min时的荧光信号强度来获取在1pm-1nm范围内体系的荧光强度与mirna的浓度关联(图3b、d)。在此浓度范围内,14min扩增反应后,mirnalet-7a和mirna20扩增产物的荧光强度与浓度呈现良好的线性关系,其线性相关系数分别为0.98513和0.94945。
图4为单个mcf-7细胞中let-7a及mirna20的荧光信号。利用fam标记的mirnalet-7a的发卡探针和cy5标记的mirna20的发卡探针来特异性识别两种mirna,将两种识别探针、引物和其它扩增试剂同时加入反应扩增液中,当细胞被液滴包裹后,细胞释放的两种mirna分别被探针识别并进行二次等温信号扩增。两种mirna的荧光信号分别在488nm波长和633nm波长激发下被检测。let-7a和mirna-20在同一细胞内的表达可通过位于相同坐标的棒状荧光信号反映。每一个细胞内两者的绝对表达量可以通过上述标准曲线获得。
图5为四种肿瘤细胞系hel、k562、293和mcf-7内let-7a和mirna-20的单细胞表达图。采用该方法能够实现不同细胞内的mirnalet-7a及mirna20同时定量检测。
应注意的是,以上实例仅用于说明本发明的技术方案而非对其进行限制。尽管参照所给出的实例对本发明进行了详细说明,但是本领域的普通技术人员可根据需要对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
sequencelisting
<110>山东师范大学
<120>基于液滴微流控技术的单细胞内mirna高灵敏多组分同时检测方法和系统
<130>
<160>7
<170>patentinversion3.3
<210>1
<211>22
<212>rna
<213>人工合成
<400>1
ugagguaguagguuguauaguu22
<210>2
<211>22
<212>rna
<213>人工合成
<400>2
ugagguaguagguugugugguu22
<210>3
<211>22
<212>rna
<213>人工合成
<400>3
ugagguaguagguuguauaguu22
<210>4
<211>23
<212>rna
<213>人工合成
<400>4
uaaagugcuuauagugcagguag23
<210>5
<211>49
<212>dna
<213>人工合成
<400>5
aagctgaggtcttggacaaactatacaacctactacctcatgtccaaga49
<210>6
<211>50
<212>dna
<213>人工合成
<400>6
aagctgaggtcttggacactacctgcactataagcactttatgtccaaga50
<210>7
<211>8
<212>dna
<213>人工合成
<400>7
tcttggac8
- 还没有人留言评论。精彩留言会获得点赞!