一种利用人胚肾上皮细胞重组表达Lp-PLA2的工艺方法与流程
本发明属于生物技术领域,具体涉及一种利用人胚肾上皮细胞重组表达lp-pla2的工艺方法。
背景技术:
脂蛋白相关磷脂酶a2(lp-pla2),是由441个氨基酸组成的蛋白质,分子量为45kda,以活性形式存在于血液循环中。目前,大量的流行病学研究和临床前瞻性研究发现,血浆lp-pla2浓度或活性升高是心血管事件的独立危险因子,并且比传统危险因子对心血管病具有更强的预测能力。基于lp-pla2是心血管事件独立危险因素的这一研究结论,lp-pla2将成为抗as治疗的新靶点。二期临床试验证实,lp-pla2的选择性抑制剂darapladib,能阻止as斑块坏死核心容积扩展,降低斑块的易损性。早期研究中发现,paf具有极强的生物学活性,能促进血小板聚集、中性粒细胞和单核细胞趋化以及促进白三烯等大量炎症介质释放,而lp-pla2能水解paf使其失活,同时临床前研究试验结果表明:lp-pla2的抑制剂能够减弱炎症反应。因此,lp-pla2还可作为一种新的治疗靶点。2005年美国食品药物管理局已批准将脂蛋白相关磷脂酶a2作为心血管病及缺血性卒中的风险评价因素,与高血压、糖尿病、代谢综合征也有一定的关系。因此,脂蛋白相关磷脂酶a2越来越受到重视,近年来被广泛研究。
目前,用于表达重组lp-pla2蛋白系统包括原核表达,酵母表达,昆虫表达,哺乳动物细胞表达。其中,原核表达系统不具有翻译后修饰功能,表达出蛋白易形成包涵体,没有生物活性;而哺乳动物细胞表达系统可对lp-pla2蛋白进行接近天然的糖基化等修饰,能够满足制备抗体和研发诊断试剂的需求。
技术实现要素:
基于以上现有技术,本发明的目的在于提供一种利用人胚肾上皮细胞重组表达lp-pla2的工艺方法,主要解决现有表达系统表达重组lp-pla2蛋白低生物功能活性,以及哺乳动物细胞表达系统产量较低等问题。
为实现上述目的,本发明采用的技术方案如下:
1、一种利用人胚肾上皮细胞重组表达lp-pla2的工艺方法,包括以下步骤:
(1)对lp-pla2基因片段进行密码子优化;
(2)构建表达质粒:合成步骤(1)优化后基因片段,连接到表达载体上,获得lp-pla2表达质粒;
(3)将步骤(2)中表达质粒通过转染试剂介导,转染入人胚肾上皮细胞hek293中,进行细胞培养和lp-pla2蛋白瞬时表达;
(4)收集步骤(3)中分泌表达lp-pla2蛋白细胞培养基,进行分离纯化获得lp-pla2蛋白。
为了更好的实现本发明,进一步的,步骤(1)中密码子优化采用德泰生物最新开发的密码子优化软件maxcodontmoptimizationprogram(v13),优化后密码子适用于表达宿主细胞偏爱性。
为了更好的实现本发明,进一步的,步骤(2)中所述构建表达质粒,具体步骤包括:引物设计与合成,pcr获取lp-pla2基因片段,重组连接获取表达质粒。
为了更好的实现本发明,进一步的,步骤(2)中表达载体为德泰生物研发的适用于人胚肾上皮细胞特异性的表达载体。
为了更好的实现本发明,进一步的,步骤(3)中将表达质粒转染人胚肾上皮细胞转染方法为化学试剂法,具体步骤包括:种子细胞培养,形成质粒dna-转染试剂复合物,将所述复合物加入所述种子细胞中。
为了更好的实现本发明,进一步的,步骤(3)所述hek293细胞培养,采用无血清悬浮培养。
为了更好的实现本发明,进一步的,在步骤(3)细胞培养表达过程中通过补料优化提高lp-pla2蛋白的表达量,补料包括l-glutamine,胰酪蛋白胨,葡萄糖;
为了更好的实现本发明,进一步的,步骤(4)中分离纯化条为亲和层析,采用ni-idabeads分离提纯lp-pla2蛋白,具体步骤包括:离心收集分泌表达lp-pla2蛋白细胞培养基上清,上清进行预处理,ni-idabeads亲和纯化,梯度洗脱获取蛋白。
为了更好的实现本发明,进一步的,在步骤(3)细胞培养表达过程中补料条件为:转染后48h添加4-8mm/ll-glutamine,5-10mg/l胰酪蛋白胨,3-4mg/l葡萄糖。
有益效果
本发明的有益效果如下:
本发明利用德泰生物最新开发的密码子优化软件maxcodontmoptimizationprogram(v13)针对宿主人胚肾上皮细胞密码子偏好型对lp-pla2蛋白基因进行优化,及采用自主开发的适用于人胚肾上皮细胞的表达载体,合成了在人胚肾上皮细胞中具有高表达能力的表达质粒。采用无血清悬浮培养技术对宿主细胞进行培养解决了传统血清培养带来的动物源性污染,为下游蛋白纯化避免了外源引入的麻烦。同时通过对转染后细胞培养的补料添加,提高了细胞的生长密度和活力,从而提高lp-pla2蛋白的产量,与传统方法相比提高了30-50%。
本发明得到的lp-pla2蛋白与传统的原核表达系统表达的蛋白相比,由于蛋白修饰使其具有了更好的稳定性与生物功能活性,对其后续研究应用带来了更大的方便。
附图说明
图1pcr产物琼脂糖凝胶电泳图,lane1、2是pcr产物,lanem是dnamarker;
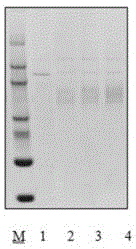
图2lp-pla2蛋白在人胚肾上皮细胞中表达sds-page鉴定,lanem:sds-pageproteinmarker,lane1:人胚肾上皮细胞分泌上清对照,lane2-4:lp-pla2蛋白在人胚肾上皮细胞中表达上清;
图3lp-pla2蛋白纯化图,lanem:sds-pageproteinmarker,lane1:离心后上清,lane2:蛋白表达上清同ni-ida孵育后流出液,lane3-12:lp-pla2蛋白洗脱组分。
具体实施方式
下面结合具体实施例对本发明作进一步详细说明。
实施例1lp-pla2表达质粒合成
(1)以人的lp-pla2氨基酸序列,采用德泰生物最新开发的密码子优化软件maxcodontmoptimizationprogram(v13)对lp-pla2基因片段进行密码子优化得到cdna序列,根据目标cdna序列合成引物,利用pcr技术融合得到全长序列;
(2)引物具体是:
primer1
agtttaaacggatctctagcgaattcccgccgccaccatggtgccccccaagctgcacgtgctgttttgcctg
primer2
gcctcgagcggccgctagcaagcttatcagtggtggtggtggtgatggttgtacttctcgatgccggagctgtt
(3)pcr反应体系:
(4)pcr反应条件:
(5)利用1%琼脂糖凝胶电泳鉴定pcr产物,用dna片段纯化试剂盒对pcr产物进行回收纯化,即获得重组人lp-pla2基因片段;
(6)所述重组连接实验,采用ecori-hindiii处理表达载体质粒,获得线性化载体质粒,重组反应体系:
(7)将重组连接产物进行转化及菌液涂布实验,37℃温育过夜,再进行摇菌培养和质粒提取,获得重组人lp-pla2表达质粒;
(8)将获得的重组人lp-pla2表达质粒进行测序,验证lp-pla2表达质粒基因序列正确。
实施例2人胚肾上皮细胞悬浮培养
(1)提前将水浴锅打开37℃;培养基提前在37℃预热,从液氮罐中取出冻存的人胚肾上皮细胞,把冻存细胞立即投入37℃水浴锅中,轻微摇动约1min使其快速融化,取出;
(2)将细胞转移到含10ml培养基的15ml离心管中,离心800rpm,5min。离心后的细胞去掉上清,取少许新鲜培养基重悬细胞,再转移到25mlflask中,加入新鲜培养基轻轻摇动,使细胞分散均匀,取细胞计数及活力检测,使密度控制在4*105cells/ml,活力>95%,置于培养箱中110rpm,37℃,5%co2培养;
(3)细胞培养2天,密度达到2.0×106cells/ml左右时对细胞进行传代,传代3次后进行转染实验。
实施例3人胚肾上皮细胞转染与表达培养
(1)转染前24h,将人胚肾上皮细胞悬浮培养接种密度为1*106cells/ml,接种体积为250ml置于培养箱中110rpm,37℃,5%co2培养,染当天使细胞密度在2*106cells/ml;
(2)dna-转染试剂混合物:向转染缓冲液中加入lp-pla2表达质粒和转染试剂,混匀,获得lp-pla2表达质粒-转染试剂混合物;
(3)步骤(2)中混合物加入步骤(1)待转染细胞中,放入培养箱中110rpm,37℃,5%co2培养;
(4)转染后48h添加终浓度6mm/ll-glutamine,5mg/l胰酪蛋白胨,4mg/l葡萄糖,放入培养箱中110rpm,37℃,5%co2继续培养;
(5)培养6天后,细胞活力将至约70%,收集细胞培养物,进行离心,获得分泌表达lp-pla2蛋白的培养基上清。
实施例4lp-pla2蛋白提取纯化
(1)上清液用0.22um膜过滤,将过滤后的上清液装入透析袋中,按透析体积为1:20在4℃环境下透析至缓冲液25mmtris,150mmnacl,ph8.0中2-3h,然后换液透析过夜;
(2)ni-ida填料装柱,柱床体积为5ml;
(3)用缓冲液25mmtris,150mmnacl,ph8.0平衡4个床体积,流速为1ml/min;
(4)将透析结束后的样品上样,流速为1ml/min;
(5)用缓冲液25mmtris,150mmnacl,ph8.0冲洗5个床体积,流速为1ml/min;
(6)用分别含50、100、500mm咪唑的缓冲液25mmtris,150mmnacl,ph8.0进行阶段洗脱,流速为2ml/min,收集各阶段洗脱峰,并取样采用sds-page检测分析洗脱lp-pla2蛋白样品;
(7)收集洗脱lp-pla2蛋白样品,并将其透析后用0.22um滤器过滤,测浓度定量。最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!