靶向肿瘤细胞表面PD-L1分子的抑制剂及其应用的制作方法
本发明涉及肿瘤免疫治疗领域,具体地说,涉及一种靶向肿瘤细胞表面pd-l1分子的抑制剂及其应用。
背景技术:
在机体的免疫调控中,各检查点分子发挥着复杂的免疫调节作用,这些分子种类繁多,常见的如pd-1、ctla-4、ido、tim3等。其中程序性死亡受体(pd-1)在目前临床研究中关注最多,且已在临床取得成功应用,极大地推动着肿瘤免疫治疗的进展。pd-1有两配体——程序性死亡配体1(pd-l1)与程序性死亡受体配体2(pd-l2),pd-l1或pd-l2与pd-1结合,受抗原受体信号转导使得pd-1胞质区两个酪氨酸信号基序磷酸化,从而激活下游信号途径,最终破坏t细胞的糖代谢及il-2等信号因子的产生,使得t细胞丧失免疫功能。在正常状态下,机体凭借pd-1/pd-l1/pd-l2信号通路的负性免疫调节作用防止免疫系统的过度激活以及保持系统对自身抗原的免疫耐受。但是该信号通路中的检查点蛋白过表达,就会产生针对t细胞受体(tcr)或者b细胞受体(bcr)交联的共抑制信号及促进免疫系统的病理性耐受。在肿瘤微环境中过表达pd-l1/pd-l2,均会导致免疫抑制效应的产生,从而使得该条件下的肿瘤细胞逃避免疫系统的监视,因此能够快速增殖、转移。
目前成功用于临床治疗的阻断pd-1/pd-l1/pd-l2信号通路的药物主要为抗体药物,如美国fda在2014年12月和9月分别批准上市的应用于晚期黑色素瘤的纳武单抗(nivolumab)和派姆单抗(pembrolizumab)。同时,由于检查点蛋白抑制剂本身并不针对特定的肿瘤细胞,而是针对肿瘤微环境中的t淋巴细胞,这使得pd-1/pd-l1/pd-l2检查点抑制剂的研究向着除黑色素瘤之外的其他实体瘤方向开展。如pd-1阻断剂纳武单抗与派姆单抗在2015年3月,被美国fda批准用于晚期或者转移性非小细胞肺癌的治疗。另外,在2016年,美国fda又批准上市了用于治疗特定类型膀胱癌的靶向pd-l1的阿特朱单抗(atezolizumab),另一pd-l1抑制剂durvalumab(medi-4736,astrazeneca/medimmune)由fda于2017年批准用于治疗pd-l1阳性转移性尿路上皮膀胱癌。目前罗氏制药又尝试将阿特朱单抗和durvalumab用于非小细胞肺癌的治疗,且已处于临床研究阶段。此外,用于膀胱转移性细胞癌或非小细胞肺癌的mpdl3280a与用于治疗非鳞非小细胞肺癌的bms-936558,以及其他单克隆抗体如amp-514与pidilizumab等均进入了临床研究阶段。
尽管靶向pd-1/pd-l1/pd-l2信号通路的单克隆抗体受到高度重视且突破性成果不断出现,但因其研发成本昂贵、运输和贮存条件要求苛刻,加上抗体药物自身稳定性差以及不能口服使得制剂类型受限等,使得最近几年来,不少研究者将靶向pd-1/pd-l1/pd-l2信号通路的抑制剂向着传统小分子药物领域拓展,检查点蛋白小分子抑制剂受到越来越多的关注。目前已经有针对pd-1/pd-l1/pd-l2信号通路的小分子抑制剂处于i期临床阶段,但至今仍未有任何一种小分子化合物被批准上市。
激酶抑制剂已经被广泛地应用于诸多癌症的治疗,目前已经有300多个激酶抑制剂被应用于临床或处于临床研究中。pd-1的配体pd-l1,在多种类型的肿瘤细胞中均有大量表达。因此,若能利用有效的筛选方案,从激酶抑制剂中筛选能够有效抑制肿瘤细胞表面pd-l1的化合物,不仅为靶向pd-1/pd-l1信号通路的小分子化合物的研发提供新的候选化合物,也因此为靶向该信号通路的免疫治疗手段提供了新的药理靶标,从而为肿瘤患者带来更加光明的治疗前景。
技术实现要素:
本发明的目的是提供一种靶向肿瘤细胞表面pd-l1分子的抑制剂及其应用。
为了实现本发明目的,第一方面,本发明提供一种靶向肿瘤细胞表面pd-l1分子的抑制剂或抑制剂药物组合物,所述抑制剂或抑制剂药物组合物的有效成分选自如式(1)~(5)所示的任一化合物:
优选地,有效成分为式(5)所示化合物。
第二方面,本发明提供靶向pd-1/pd-l1信号通路的抑制剂或抑制剂药物组合物,所述抑制剂或抑制剂药物组合物的有效成分选自如式(1)~(5)所示的任一化合物。优选有效成分为式(5)所示化合物。
第三方面,本发明提供所述抑制剂或抑制剂药物组合物的以下任一应用:
1)用于制备增强治疗肿瘤药物的靶向效果的药物;
2)用于制备增强抗肿瘤效果的药物;
3)用于制备增强对pd-l1位点的封闭效果的药物。
本发明所述的药物组合物中的组合药物序贯使用。
本发明所述肿瘤包括人纤维肉瘤、非小细胞肺癌、小细胞肺癌、淋巴瘤、慢性髓系粒细胞白血病、急性髓系粒细胞白血病、急性淋巴系粒细胞白血病、乳腺癌或黑色素瘤。
进一步地,所述抑制剂或抑制剂药物组合物与药学上可接受的辅料制备成药学上可接受的剂型。
本发明的目的还可以采用以下的技术措施来进一步实现。
本发明提供一种有效的直接针对肿瘤细胞膜表面的pd-l1表达的筛选方案,从而能够有效得筛选出抑制pd-l1表达的小分子化合物;进一步地,从已上市或处于临床阶段的研发成熟型激酶抑制剂中寻找能够抑制pd-l1表达的化合物,从而为靶向pd-1/pd-l1信号通路的提供新的候选化合物和新的药理靶标。
本发明利用美国li-cor公司生产的odyssey仪器,通过对细胞固定、打孔,所用抗体类型、抗体浓度、孵育方式及时间等各方面条件进行优化,建立了直接检测肿瘤细胞膜表面pd-l1表达程度的定量odysseyon/incellwesternblot筛选模型。在模型构建中,本发明首先选择了人肉纤维素瘤细胞——ht-1080细胞——建立筛选模型。该细胞在高表达pd-l1的同时,具有很好的细胞贴壁和繁殖生长能力,大大提高了筛选效率。其次,本发明首先在保持细胞膜完整的情况下,利用靶向pd-l1蛋白胞外区的抗体检测其表达,避免了因为细胞打孔对蛋白结构造成的影响,确保了检测结果的可靠性。最后,本发明以β-actin作为内参蛋白,结果以pd-l1蛋白荧光值与β-actin蛋白荧光值的比值呈现,在很大程度上减弱了因为细胞密度以及筛选药物毒性所造成的实验系统的影响,使得筛选结果的假阳性和假阴性大大降低。
本发明利用建立的筛选模型,对selleck公司的kinaseinhibitorlibrary(96-well)-z183593-100ul-l1200化合物库中的430个激酶抑制剂进行了筛选。在初筛以及后期复筛中,发现化合物cobimetinib(gdc-0973,rg7420)、at7519、lapatinib、ly2090314以及ku-60019[分别对应于式(1)~(5)]均能够明显下调ht-1080细胞膜表面pd-l1的表达。接着,本发明利用能够定量的odysseywesternblot实验,在ht-1080细胞和非小细胞肺癌——h-460细胞进行检测,结果表明上述5个化合物均能够下调全细胞中pd-l1的表达。之后本发明利用流式细胞术进行进一步的验证,发现化合物cobimetinib(gdc-0973,rg7420)、at7519、lapatinib、ly2090314以及ku-60019仍能够表现出很好地抑制pd-l1表达的活性。
考虑到本发明的筛选对象为已经上市或处于临床研究的激酶抑制剂,即该部分激酶抑制剂已经具备明确的结构和部分常见用途,本发明所得的能够抑制pd-l1表达的化合物cobimetinib(gdc-0973,rg7420)、at7519、lapatinib、ly2090314以及ku-60019,具有很大地发展为临床pd-l1小分子抑制剂的可能性。此外,上述5个化合物能够在两种不同的肿瘤细胞中均表现出很好的抑制活性,也说明其可针对多种肿瘤中pd-l1的表达。如前所述,抑制pd-l1的表达,就能阻断pd-1与pd-l1的结合,从而抑制肿瘤的免疫逃逸,因此该发明为肿瘤的治疗提供新的治疗方案。
本发明发现的候选化合物cobimetinib(gdc-0973,rg7420)、at7519、lapatinib、ly2090314以及ku-60019,分别为激酶mek,cdk,egfr,gsk-3和atm的抑制剂。本发明利用同一体系,将不同的激酶抑制剂进行检测,为pd-l1小分子抑制剂的研发提供了可靠的药理靶标,也为pd-1/pd-l1信号通路在肿瘤环境中的调控机理提供了研究依据。
借由上述技术方案,本发明至少具有下列优点及有益效果:
(一)本发明在筛选方案的确定上,利用美国li-cor公司生产的odyssey仪,成功建立了直接针对肿瘤细胞膜表面的pd-l1表达水平检测的odysseyon/incellwesternblot筛选体系。该体系中以β-actin蛋白的荧光值为内参,通过pd-l1蛋白与内参蛋白荧光值的比值呈现最终筛选结果,因此在筛选过程中排除了因细胞数量的差异以及筛选药物毒性造成的假阳性或假阴性筛选结果。
(二)本发明对象针对的是已经上市或处于临床研究的较为成熟的激酶抑制剂,并非全新的未知化合物库,从而提高了筛选所得结果能够用于临床药物研发的可能性。通过严谨的筛选,本发明发现化合物cobimetinib(gdc-0973,rg7420)、at7519、lapatinib、ly2090314以及ku-60019在低细胞毒性的条件下,能够在不同的细胞实验中均表现出很好地抑制pd-l1表达的效果,且这种抑制效果在两种不同类型的肿瘤细胞中均得到了验证。因此,这几种化合物(特别是ku-60019)有望发展成为临床上抑制pd-l1表达的小分子抑制剂,另外,其对应的激酶也成为研究pd-1/pd-l1信号通路的药理靶点。
附图说明
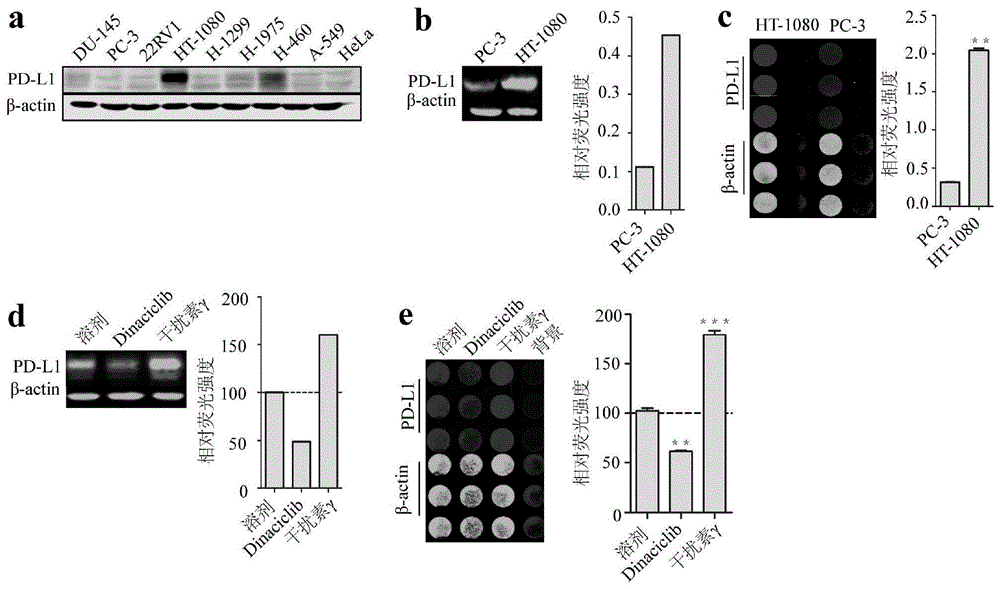
图1a为本发明实施例1中利用westernblot检测不同类型的肿瘤细胞pd-l1的表达水平;图1b为本发明实施例1中利用odysseywesternblot检测低表达pd-l1的pc-3细胞与高表达pd-l1的ht-1080细胞;图1c为用odysseyon/incellwesternblot检测pc-3与ht-1080的表达水平;图1d为用odysseywesternblot检测加入阳性药物——抑制型阳性药为dinaciclib,促进型阳性药为ifn-γ——后pd-l1的表达水平;图1e为用odysseyon/incellwesternblot检测加入阳性化合物之后pd-l1的表达水平。
图2a为本发明实施例2中激酶抑制剂筛选总散点图;图2b为化合物终浓度为10um的筛选总图;图2c为化合物终浓度为1um的筛选总图。
图3a为本发明实施例3中利用在ht-1080细胞中利用odysseywesternblot进行验证荧光灰度图;图3b为其对应的定量分析图。
图4a为本发明实施例4中利用在h-460细胞中利用odysseywesternblot进行验证荧光灰度图;图4b为其对应的定量分析图。
图5a为本发明实施例5中利用流式细胞术对筛选所得的21个化合物检测所得峰图;图5b为对应定量分析图。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
实施例1建立odysseyon/incellwesternblot模型用于高通量检测细胞膜表面pd-l1的表达水平
1、odysseywesternblot实验
将1.0×106个/ml的du-145,pc-3,22rv1,ht-1080,h-1299,h-1975,h-460,a-549以及hela细胞悬液,按照每孔2ml接种于6孔板中。du-145,22rv1及22rv1细胞所用培养基分别为含10%胎牛血清(fbs)的rpmi1640培养基;pc-3细胞所用培养基分别为含10%胎牛血清(fbs)的f-12k培养基;ht-1080细胞所用培养基分别为含10%胎牛血清(fbs)的mem培养基;a-549和hela细胞所用培养基分别为含10%胎牛血清(fbs)的dmem培养基;将细胞在37℃二氧化碳(5%co2)恒温培养箱培养。待细胞长至90%及以上时,将培养基吸出,每孔加入80μl的ripa裂解液,将裂解液转移至1.5mlep管中冰上裂解30分钟,每管加入20μl的5×蛋白上样缓冲液(loadingbuffer),100℃金属浴煮30分钟。sds-page凝胶电泳分离,odysseywesternblot检测pd-l1表达量。
图1a为本发明实施例1中利用westernblot检测不同类型的肿瘤细胞pd-l1的表达水平。试验结果显示,ht-1080在所测9种肿瘤细胞中,内源性pd-l1的表达水平最高。另外在培养细胞的过程中发现该细胞的贴壁能力好、生长繁殖速度快、培养条件简单,因此是筛选系统所选的典型细胞。
2、odysseyon/incellwesternblot实验
将1.0×105个/ml的ht-1080细胞和pc-3细胞悬液,按照每孔200ul接种于购自康宁公司的透明底黑边框的96孔板中,摇晃均匀之后将细胞在37℃二氧化碳恒温培养箱中培养24~48小时。ht-1080细胞所用培养基分别为含10%胎牛血清(fbs)的mem培养基,pc-3细胞所用培养基分别为含10%胎牛血清(fbs)的f-12k培养基。待细胞密度达90%以上至长满96孔板底部时,用移液器去除96孔中的培养液,每孔加200ulpbs于摇床上洗残留培养基5分钟。去除pbs之后,迅速加入150ul的新鲜固定缓冲液(3.7%的多聚甲醛)固定细胞,免摇动在室温条件下孵育20min。用移液器去除固定缓冲液,随后每孔加入200ul的pbs于摇床上清洗残留缓冲液15分钟,每5分钟换新鲜pbs一次。在彻底清除固定缓冲液之后,用移液器在每个孔内小心地从管壁加入150ulli-corodyssey封阻液,在摇床上缓慢摇动室温下孵育1.5小时。去除封闭液后加入pd-l1的抗体(ab205921,abcam),于4℃摇床孵育过夜。次日将过夜孵育的96孔板中的抗体回收,用pbs于摇床上清洗未结合抗体20分钟,每5分钟换新鲜pbs一次。随后于每孔加入200ul的triton洗脱缓冲液(10%tritonx-100),在室温放置20分钟。用移液器吸走洗脱缓冲液,加入β-actin抗体,于室温在摇床上孵育2小时。随后用pbs在摇床上清洗未结合抗体20分钟,每5分钟换新鲜pbs一次。将pbs吸彻底后与odyssey仪器扫描96孔板。
实验组设置了三组平行和一组系统对照,并进行了统计学分析,其中*<0.05,**p<0.01,***p<0.001是以每组的二甲基亚砜(dmso)组为参照。实验数据以
图1b为本发明实施例1中利用odysseywesternblot检测低表达pd-l1的pc-3细胞与高表达pd-l1的ht-1080细胞odysseyon/incellwesternblot实验。图1c为用odysseyon/incellwesternblot检测pc-3与ht-1080的表达水平。结合试验结果,表明相比于pc-3细胞,ht-1080细胞不管在全细胞裂解液水平,还是细胞膜水平,均能够高表达pd-l1蛋白。相比于odysseywesternblot实验,odysseyon/incellwesternblot实验拥有更好的数据重现度、更高通的筛选量、更灵敏的检测度和更好的线性等优势。
图1d为用odysseywesternblot检测加入阳性药物——抑制型阳性药为dinaciclib,促进型阳性药为ifn-γ——后pd-l1的表达水平。该试验前期处理方法与实施例1中odysseywesternblot实验完全相同,在培养细胞至80%时,每孔加入对应的药物2ul,接着培养24小时进行处理。后期的处理方法与实施例1中odysseywesternblot实验完全相同。
图1e为用odysseyon/incellwesternblot检测加入阳性化合物之后pd-l1的表达水平。该试验前期处理方法与实施例1中odysseyon/incellwesternblot实验完全相同,在培养细胞至80%时,每孔加入对应的药物1ul,接着培养24小时进行处理。后期的处理方法与实施例1(2)中完全相同。
将试验结果进行比对,odysseyon/incellwesternblot实验所具有的优势更加显著。因其特有的灵敏性以及高通量筛选的特性,使其成为本发明的首选药物筛选体系。
实施例2利用odysseyon/incellwesternblot筛选体系对430个激酶抑制剂筛选的结果
实验组设置了三组平行和一组系统对照,并进行了统计学分析,其中*<0.05,**p<0.01,***p<0.001是以每组的dmso组为参照。实验数据以
该试验前期处理方法与实施例1中odysseyon/incellwesternblot实验完全相同,在培养细胞至80%时,每孔加入对应的药物1ul,接着培养24小时进行处理。后期的处理方法与实施例1中odysseyon/incellwesternblot实验完全相同。图2a为本发明实施例2中激酶抑制剂筛选总散点图,即所有有效数据的结合。本发明按照筛选药物的浓度,共筛选了10um,1um,100nm和10nm四种工作浓度以确定所筛化合物的药理活性。图2b为化合物终浓度为10um的筛选总图;图2c为化合物终浓度为1um的筛选总图。试验结果显示,在本次筛选中,共有43个化合物和59个化合物分别在1um和10um的筛选浓度下,相比于空白对照组(dmso组)表现出20%以上抑制pd-l1表达的活性。
实施例3利用odysseywesternblot实验验证筛选所得化合物对ht-1080细胞中pd-l1在全细胞水平的抑制活性
在初筛和复筛的基础上,本发明从所得有抑制活性的化合物中继续筛选出28个化合物进行odysseywesternblot实验的验证,以检测全细胞水平pd-l1的表达水平的变化。实验组进行了三次独立实验,每次实验以每组的dmso组为参照。实验数据以
实验结果表明,在odysseywesternblot再次筛选的结果中,共有15个化合物表现出在细胞整体水平的pd-l1的抑制效果(图3,a和b)。
实施例4利用odysseywesternblot实验验证筛选所得化合物对h-460细胞中pd-l1在全细胞水平的抑制活性
在初筛、复筛以及ht-1080细胞odysseywesternblot实验验证的基础上,本发明将上述挑选所得的25个化合物在非小细胞肺癌细胞——h-460细胞中进行了odysseywesternblot实验的验证,以检测这些化合物对非小细胞肺癌全细胞水平pd-l1的表达水平的影响。实验组进行了两次独立实验,每次实验以每组的dmso组为参照。实验数据以
实验结果表明,由ht-1080细胞建立的odysseyon/incellwesternblot筛选体系筛选所得的化合物,在非小细胞肺癌细胞h-460中依旧表现出很好的抑制pd-l1表达的效果。特别是化合物cobimetinib(gdc-0973,rg7420)、at7519、lapatinib、ly2090314以及ku-60019,能够明显地抑制h-460细胞中pd-l1的表达(图4,a和b)。
实施例5利用流式细胞术检测筛选所得化合物对细胞膜表面pd-l1表达水平的影响
流式细胞术:将1.0×106个/ml的ht-1080细胞悬液,按照每孔2ml接种于6孔板中,将细胞在37℃二氧化碳恒温培养箱培养。ht-1080细胞所用培养基分别为含10%胎牛血清(fbs)的mem培养基。待细胞生长至80%左右时,每孔对应加入2ul的dmso与其他相应化合物,继续培养于恒温培养箱24小时。待细胞生长至90%到长满时,用每孔1ml的pbs清洗细胞表面,随后用0.25%的胰酶消化细胞至pbs中并使其呈单细胞悬液。将单细胞悬液计数并按照抗体孵育说明书取适量抗体,于冰上避光孵育pe直连的pd-l1抗体30分钟。随后用pbs清洗未结合抗体9分钟,每3分钟换一次新鲜的pbs。将准备好的流式检测细胞液于millipore公司的guavaeasycyte8ht流式细胞仪进行检测。实验组设置了三组平行和一组系统对照,并进行了统计学分析,其中*<0.05,**p<0.01,***p<0.001是以每组的dmso组为参照。实验数据以
图5a为本发明实施例5中利用流式细胞术对筛选所得的21个化合物检测所得峰图,图5b为对应的定量分析图。实验结果显示,结合图3、4中的odysseywesternblot实验,化合物cobimetinib(gdc-0973,rg7420)、at7519、lapatinib、ly2090314以及ku-60019显示出明显的抑制肿瘤细胞中pd-l1表达的活性。
本发明提供odysseyon/incellwesternblot体系在定量且高通检测肿瘤细胞膜表面pd-l1的表达水平中的应用,以及确定了化合物cobimetinib(gdc-0973,rg7420)、at7519、lapatinib、ly2090314和ku-60019抑制肿瘤细胞膜表面的pd-l1表达的作用,从而使其在pd-l1小分子抑制剂研发中的被应用。本发明通过建立odysseyon/incellwesternblot直接检测细胞膜pd-l1表达水平的筛选方法,测试了已经上市或者处于临床研究的430个激酶抑制剂对肿瘤细胞中pd-l1表达的抑制作用,发现化合物cobimetinib(gdc-0973,rg7420)、at7519、lapatinib、ly2090314和ku-60019对pd-l1表达具有明显的抑制作用,本发明在不同的细胞系以及利用不用的检测手段,均证实了相关技术方案的可行性。本发明发现的5个化合物,对应5中不同的激酶,也因此为肿瘤微环境中的pd-1/pd-l1信号通路的研究提供了新思路。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法