人心肌细胞分离试剂、培养基、分离方法和培养方法与流程
本发明涉及用于分离人心肌细胞的分离试剂和分离方法。本发明还涉及用于培养人心肌细胞的培养基和培养方法。
背景技术:
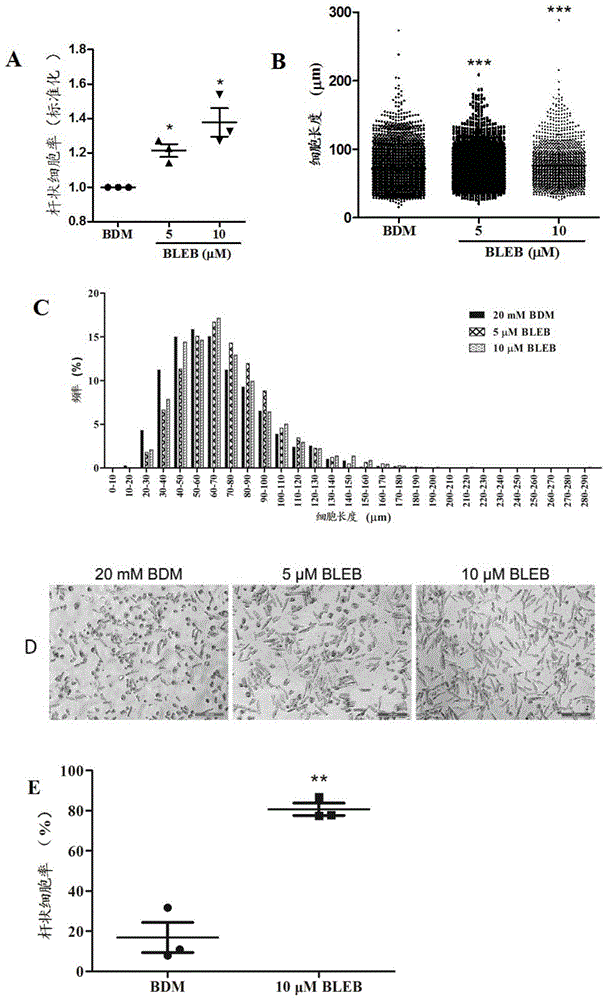
:心血管疾病导致的死亡占因病死亡总数的40%以上,高于肿瘤及其他疾病,是人类生命健康的最大杀手。因此,心血管疾病的防治对人类健康而言至关重要,针对心血管疾病防治的科学研究的重要性自然不言而喻。研究任何一种疾病的预防和治疗,都要有好的细胞模型。然而,不同于其他体细胞,心血管疾病的研究模型即心肌细胞本身具有运动性强、耗氧高的特点,这一特点决定了其分离与培养过程均需要消耗大量能量并且产生大量代谢产物,导致分离培养条件极难控制,也极难保证分离培养过程中的细胞存活率和纯度。这在很大程度上对心血管疾病的研究带来了局限性。此外,由于人的心肌细胞模型只能从人体受试者获取,其来源非常稀少且珍贵,现有的分离培养方法又不能保证存活率。因此人心肌细胞的供应远远不能满足临床研究的需要。目前研究中主要使用来自啮齿类动物(例如小鼠、大鼠)模型的心肌细胞。然而,人类和其他物种的心肌细胞间存在巨大的物种差异,该差异体现在转录组、蛋白组、表观遗传修饰、电生理等各个层面(非专利文献1~4),导致不同物种的心肌细胞培养方法和条件也存在巨大差异。尽管在其他细胞的培养中可以采用人类组织样本来消除物种差异,但由于现有细胞培养方法无法保证细胞纯度,导致实验结果中出现背景噪音大、或因无生物活性而无法用于功能学实验等不足,无法通过使用组织样本的方式将动物心肌细胞的实验结果类推到人类。现有技术中另外一种获得人心肌细胞的方法是人胚胎干细胞或诱导多能干细胞的定向分化,这一方法虽然部分地克服了上述障碍,但仍存在分化不完全、缺少表观遗传修饰等问题(非专利文献5、6),从而无法如实反映疾病真实状态,无法推动心血管疾病的研究工作。综上,现有技术虽然为人心肌细胞的获得提供了多种途径,但目前还没有任何一条途径能够以高存活率、高纯度获得人心肌细胞或其有效模拟物,这严重地阻碍了相关科研工作的开展,无法为临床上的疾病诊断和治疗提供研究基础。如前文所述,在现有技术中,尽管很早就有研究人员开始探索心肌细胞的分离并培养,但迄今为止还没有任何培养或分离人心肌细胞、特别是人原代心肌细胞(humanprimarycardiomyocyte,hpcm)的报道。在动物心肌细胞的培养中,目前主要使用2,3-丁二酮单肟(2,3-butanedionemonoxime,以下简称“bdm”)(非专利文献7、8)。bdm为骨骼肌肌球蛋白iiatp酶抑制剂,可以抑制骨骼肌和心肌细胞收缩。bdm作为化学磷酸酶,据推测是通过影响钙离子通道、瞬时外向钾通道、钠钙交换以及阻塞细胞间间隙连接通信等途径来影响细胞的收缩。有研究表明,成年小鼠、大鼠心肌细胞分离和培养时加入bdm能够明显提高活细胞数量,并延长体外培养时间。也有报道称bdm通过稳定细胞膜结构、维持细胞骨架稳定来增加糖酵解atp产物以及负向调节心肌收缩力,由此可以保护心肌细胞。(-)-blebbistatin(简称bleb)是一种已知的与bdm类似的肌球蛋白iiatp酶抑制剂,已知其可以用于抑制小鼠心肌细胞收缩。但与bdm不同的是,(-)-blebbistatin具有特异性抑制作用,不影响细胞粘附能力。(-)-blebbistatin可以抑制细胞收缩而不改变细胞内钙瞬变的形态。另外,在心血管生理学研究中,(-)-blebbistatin作为特异性的解偶联剂已经被广泛应用。除此之外,已知(-)-blebbistatin存在一些不利的化学特性,例如,对光不稳定、具有光毒性和细胞毒性、高荧光和低水溶性等,且(-)-blebbistatin的溶解度仅为10.9±0.9μm。正因为存在这些不利特性,研究人员对(-)-blebbistatin的应用存在偏见,迄今为止尚未有将(-)-blebbistatin用于人心肌细胞、特别是人原代心肌细胞分离或培养的报道。现有技术文献非专利文献1:stephanen.hatemandmartinmorad*jamess.k.sham,“speciesdifferencesintheactivityofthena(+)-ca2+exchangerinmammaliancardiacmyocytes”,journalofphysiology(1995).非专利文献2:k.w.linz*r.meyer*t,r.surges*,s.meinardus*,j.vees*,a.hoffmann*,0.windholz*andc.grohet,“rapidmodulationofl-typecalciumcurrentbyacutelyappliedoestrogensinisolatedcardiacmyocytesfromhuman,guinea-pigandrat”,experimentalphysiology(1998).非专利文献3:s.werfel,s.nothjunge,t.schwarzmayr,t.m.strom,t.meitinger,ands.engelhardt,“characterizationofcircularrnasinhuman,mouseandrathearts”,jmolcellcardiol,98(2016),103-7.非专利文献4:jr.williama.clark,richarda.chizzonite,alanw.everett,murrayrabinowitz,andradovanzak,“speciescorrelationsbetweencardiacisomyosins.acomparisonofelectrophoreticandimmunologicalproperties”,thejournalofbiologicaclchemistry(1981).非专利文献5:d.m.delaughter,a.g.bick,h.wakimoto,d.mckean,j.m.gorham,i.s.kathiriya,j.t.hinson,j.homsy,j.gray,w.pu,b.g.bruneau,j.g.seidman,andc.e.seidman,“single-cellresolutionoftemporalgeneexpressionduringheartdevelopment”,devcell,39(2016),480-90.非专利文献6:x.yang,l.pabon,andc.e.murry,“engineeringadolescence:maturationofhumanpluripotentstemcell-derivedcardiomyocytes”,circres,114(2014),511-23.非专利文献7:m.ackers-johnson,p.y.li,a.p.holmes,s.m.o’brien,d.pavlovic,andr.s.foo,“asimplified,langendorff-freemethodforconcomitantisolationofviablecardiacmyocytesandnonmyocytesfromtheadultmouseheart”,circres,119(2016),909-20.非专利文献8:e.j.sharpe,j.r.stclair,andc.proenza,“methodsfortheisolation,culture,andfunctionalcharacterizationofsinoatrialnodemyocytesfromadultmice”,jvisexp(2016).技术实现要素:本申请发明人考虑到临床上的实际需要,特别是心肌细胞在不同物种间存在巨大差异这一现实情况,为解决人心肌细胞的分离与培养这一课题,对人心肌细胞的分离和培养技术进行了深入研究并不断优化,从而发现了可以获得更真实地反映人心肌细胞状态、使更高临床转化率成为可能的技术效果的本发明技术方案。本发明目的是提供能够用于有效地分离及培养人心肌细胞的技术方案,包括分离试剂、培养基及分离和培养方法。通过采用本发明的技术方案,可以在培养中将细胞维持在最佳状态、保持细胞形态、存活率和纯度。本申请发明人进行了大量广泛而深入的研究,结果意外地发现(-)-blebbistatin可以在人心肌细胞的分离和培养中很好地维持人心肌细胞的形态和存活率,其对心肌细胞的分离和培养起到了关键作用。本申请发明人还发现,将(-)-blebbistatin与其他成分进行组合,在一定条件下实施分离和培养,能够很好地解决本发明所要解决的上述技术问题,从而完成了本发明。本发明的第一实施方式涉及人心肌细胞分离试剂,其含有(-)-blebbistatin,(-)-blebbistatin是由下述式(1)表示的化合物。在该实施方式中,所述分离试剂中还含有nacl、kcl、mgcl2·6h2o、nah2po4、4-羟乙基哌嗪乙磺酸、葡萄糖、β-氨基乙磺酸、肌酸、丙酮酸钠、以及青霉素和链霉素。在该实施方式中,(-)-blebbistatin的浓度可以为5~10μm,优选为10μm。本发明第二实施方式涉及人心肌细胞分离方法,其包括脱钙、消化和细胞收集步骤,在脱钙、消化和细胞收集步骤中使用前述心肌细胞分离试剂作为无钙液。本发明第三实施方式涉及人心肌细胞培养基,其含有(-)-blebbistatin或其衍生物para-aminoblebbistatin、和血清,(-)-blebbistatin是由下述式(1)表示的化合物,para-aminoblebbistatin是由下述式(2)表示的化合物。在该实施方式中,(-)-blebbistatin的浓度可以为2.5~20μm,优选为10μm,para-aminoblebbistatin的浓度为5~50μm。在该实施方式中,血清可以为胎牛血清(fbs)。在该实施方式中,血清浓度可以为5~20%,优选为10%。在该实施方式中,所述培养基中可以含有选自mem-4-羟乙基哌嗪乙磺酸-glutamax、m199-无谷氨酰胺、m199-4-羟乙基哌嗪乙磺酸-无谷氨酰胺、mem、mem-glutamax或dmem-高糖中的一种或多种,优选含有mem-4-羟乙基哌嗪乙磺酸-glutamax。在该实施方式中,所述培养基中不含2,3-丁二酮单肟(bdm)、n-苄基-对甲苯磺酰胺(bts)、myk-461、丙酮酸钠、胰岛素(insulin)、肌酸(creatine)、β-氨基乙磺酸(taurine)、l-左旋肉碱(l-carnitine)等生长因子,myk-461是由下述式(3)表示的化合物,本发明第四实施方式涉及人心肌细胞培养组合试剂盒,其包含:(1)前述人心肌细胞培养基;和(2)包被试剂,所述包被试剂包含基质胶(matrigel)或层粘连蛋白(laminin)。在该实施方式中,包被试剂中包含的层粘连蛋白的浓度为50~200μg/ml,优选为200μg/ml。本发明第五实施方式涉及人心肌细胞培养方法,其中使用前述人心肌细胞培养基作为培养基。在该实施方式中,在培养细胞之前使用包被试剂对培养板进行包被,所述包被试剂中包含基质胶或层粘连蛋白,其中层粘连蛋白的浓度为50~200μg/ml,优选为200μg/ml。本发明还涉及(-)-blebbistatin在用于制备前述人心肌细胞分离试剂或人心肌细胞培养基中的用途。需要说明的是,本说明书中记载的人心肌细胞优选为“人原代心肌细胞”。通过采用本发明的技术方案,能够在分离和培养过程中将人心肌细胞维持在最佳状态、保持细胞形态、存活率和纯度,由此可以为心血管疾病研究、临床转化、药物研发和个体化治疗提供坚实的基础。附图说明[图1]a是示出20mmbdm组、5μm和10μm(-)-blebbistatin组分离得到人心肌细胞杆状率的图,b和c是示出20mmbdm组、5μm和10μm(-)-blebbistatin组的人心肌细胞长度的图,d是分离后人心肌细胞的显微照片,e是20mmbdm和10μm(-)-blebbistatin组的人心肌细胞分离后分别使用含有20mmbdm和10μm(-)-blebbistatin的培养基培养5天后心肌细胞杆状率的图。[图2]a是示出不同浓度的(-)-blebbistatin对人心肌细胞杆状率影响的图,b是示出不同浓度的(-)-blebbistatin对人心肌细胞状态影响的图,c是示出不同浓度的para-aminoblebbistatin对人心肌细胞存活率影响的图。[图3]是示出不同包被试剂对人心肌细胞贴壁数量影响的图。[图4]是示出不同血清浓度对人心肌细胞平均杆状细胞率影响的图。[图5]是示出不同类型成品培养基对人心肌细胞存活率影响的图。[图6]是示出肌球蛋白抑制剂n-苄基-对甲苯磺酰胺(bts)及myk-461对人心肌细胞存活率影响的图。[图7]是示出(-)-blebbistatin组和加入picct组的人心肌细胞存活率的图。[图8]是示出本发明培养基与accit培养基对比结果的图。具体实施方式实施方式1:人心肌细胞分离试验心肌细胞分离过程一般包括组织转运及切片、脱钙、酶液消化和细胞收集。其中,无钙台式液(无钙液)为分离过程中使用的主要试剂,用于脱钙、酶液消化和细胞收集。本发明中按照文献(liangchenguang-ranguo,manrao,kaichen,jiang-pingsong*andsheng-shouhu*,“amodifiedmethodforisolationofhumancardiomyocytestomodelcardiacdiseases.”,journaloftranslationalmedicine(2018).)中记载的心肌细胞分离实验方案进行操作。具体步骤如下。将离体的左心耳立即置于器官保存液(威斯康星大学制造,美国)(约4℃)中,迅速转移至超净台内的60mm细胞培养皿中,加入器官保存液(约4℃),并将其放在提前预冷(-20℃冰箱)的冰盒上,用剪刀去除多余的脂肪并对其进行修剪,将组织粘在样本台上,使用切片机(莱卡vt1200s,德国)对组织进行切片(300μm),然后于超净台内手动剪碎。将剪碎的心耳分为三组,分别使用本发明无钙液对组织进行脱钙处理,共三次。在锥形瓶内加入15~20ml无钙液,脱钙三次,室温摇晃锥形瓶,分别在2min、3min后更换新鲜无钙液,第三次脱钙时间为4min,脱钙结束后将无钙液弃掉,分别加入由对应的无钙液配制的酶液1(37℃预热),锡箔纸包好瓶口后,在37℃的水浴摇床(bibbystuartsbs40,英国)中摇晃,随时观察酶液颜色的变化,由清澈逐渐变得浑浊。将酶液收集到15ml离心管内,锥形瓶中加入新鲜酶液1,继续在水浴锅中消化。将收集的酶液置于预冷的4℃离心机(eppendorfcentrifuge5804r,德国)中离心(100×g,1min),去上清,观察管底沉淀是否有心肌细胞,并判断杆状细胞所占比例。第二次消化同第一次。当沉淀中含有的心肌细胞杆状细胞率在70%以上时,将酶液1更换为由酶液1中使用的无钙液配制的酶液2,继续消化,此次开始收集浑浊酶液中的心肌细胞,采用的收集方法为,在离心(4℃,100×g,1min)后用3ml转运液重悬细胞。其中,无钙液使用分别含有5μm(-)-blebbistatin、10μm(-)-blebbistatin和20mmbdm的无钙液。无钙液及酶液1、2的组成如下表1~3所示。[表1]naoh调整ph值,ph=7.4[表2]溶剂:无钙台式液[表3]组分浓度胶原酶ii300u/mlcacl20.015mm溶剂:无钙台式液结果如图1所示。由图1a可知,将20mmbdm组分离获得的细胞杆状率标准化为1.0,5μm和10μm(-)-blebbistatin组获得的标准化杆状细胞率达到1.2~1.5(p<0.05),显著提高了人心肌细胞存活率。由图1b和图1c可知,5μm和10μm(-)-blebbistatin组分离得到的人心肌细胞的长度也明显长于20mmbdm组(p<0.05)。图1d是分离后的人心肌细胞的显微照片(莱卡,dmi4000b,10x),可知20mmbdm组的杆状细胞形态并没有很好地得到维持,视野中可见到大量球形细胞;而5μm和10μm(-)-blebbistatin组均可良好地维持人心肌细胞长杆状形态,10μm(-)-blebbistatin组的效果更优。上述结果表明,含有5~10μmblebbistatin的分离试剂的组均能够良好地在细胞分离中维持人心肌细胞形态并提高其杆状率。此外,为了观察两种成分无钙液(20mmbdm和10μm(-)-blebbistatin)分离得到的人心肌细胞在体外培养时细胞状态是否有所不同,我们对分离得到的人心肌细胞进行复钙。具体而言,人心肌细胞在无钙离子的环境中很难存活,本发明采用5步复钙法梯度恢复人心肌细胞的钙离子浓度。在细胞收集液中加入的cacl2(储备浓度30mm)的浓度梯度依次为0.08mm(5min)、0.25mm(5min)、0.5mm(5min)、1mm(5min)、1.8mm(15min)。20mmbdm组分离得到的人心肌细胞使用m199培养基,加入10%胎牛血清、100u/ml青霉素和100μg/ml链霉素及20mmbdm进行培养。10μm(-)-blebbistatin组分离得到的人心肌细胞使用m199培养基,加入10%胎牛血清、100u/ml青霉素和100μg/ml链霉素及10μm(-)-blebbistatin进行培养。具体而言,将细胞置于37℃培养箱(5%co2,相对饱和湿度为95%,thermoscientificheracellviosco2160i,美国)中,分别培养6天。其中,细胞收集液(表1~3)的组成如下表4所示。结果如图1e所示,10μm(-)-blebbistatin组的心肌细胞杆状率为80%以上,明显高于20mmbdm组(p<0.05)。这表明(-)-blebbistatin不仅在人心肌细胞分离中对细胞起保护作用,还有利于人心肌细胞的体外培养。[表4]组分含量无钙台式液36ml胎牛血清4ml实施方式2:人心肌细胞培养试验(1)不同浓度的(-)-blebbistatin和para-aminoblebbistatin对人心肌细胞杆状率的影响在m199中加入10%胎牛血清、100u/ml青霉素和100μg/ml链霉素,将由此得到的培养基作为基础培养基。实验分为9组,在基础培养基中分别加入0、2.5、5、10、20μm的(-)-blebbistatin和5μm、10μm、20μm、50μm的para-aminoblebbistatin。将分离得到的人心肌细胞分为9组,使用9种培养基将细胞铺于提前使用200μg层粘连蛋白包被的48孔细胞培养板,置于37℃细胞培养箱(5%co2,相对饱和湿度为95%)中培养7天,计算心肌细胞杆状率,结果如图2所示。由图2a可知,(-)-blebbistatin使用浓度与细胞杆状率显著相关,加入(-)-blebbistatin的各组杆状细胞率明显高于无(-)-blebbistatin组,有统计学差异(p<0.001)。由此可以确认2.5~20μm的(-)-blebbistatin可以显著提高心肌细胞存活率。另外,(-)-blebbistatin组的心肌细胞杆状率随浓度上升而提高。由图2b所示的心肌细胞培养图可知,培养1天后5μm和10μm(-)-blebbistatin组的心肌细胞状态明显好于0μm组。与此同时,我们发现与5μm(-)-blebbistatin组相比,10μm(-)-blebbistatin组更好地维持了心肌细胞长杆状形态。培养7天后结果更为明显,10μm(-)-blebbistatin组细胞边缘也逐渐变圆,但其形态及杆状细胞数明显好于0μm及5μm(-)-blebbistatin组。综合考虑(-)-blebbistatin对细胞活性的影响以及其水溶性和光敏性,可以确定10μm为培养心肌细胞的最佳(-)-blebbistatin浓度。此外,由图2c可知,10μm的para-aminoblebbistatin组与10μm的(-)-blebbistatin组无统计学差异,也即,两者对人心肌细胞存活率的影响大致为同等程度。而且,可以确认5~50μm的para-aminoblebbistatin(简称pab)可以显著提高心肌细胞存活率。(2)包被试剂对人心肌细胞贴壁数量的影响分别用层粘连蛋白(50μg/ml,200μg/ml,37℃培养箱孵育过夜,晾干),纤维结合蛋白(fibronectin,5μg/ml,50μg/ml,晾干),多聚-l-赖氨酸(poly-l-lysine,0.01%,室温孵育5min,晾干)和基质胶(37℃,30min)包被48孔培养板。培养基使用在m199中加入20mm的bdm、10%胎牛血清、100u/ml青霉素和100μg/ml链霉素而得到的培养基。将分离得到的心肌细胞铺于已包被的48孔培养板,培养72小时(h)后显微镜下拍照,每组取4个视野,求平均杆状细胞数,结果表示为均数±标准差。结果如图3所示,培养72小时后,观察到多聚-l-赖氨酸和纤维结合蛋白(5μg/ml,50μg/m1)组杆状细胞数量明显低于基质胶组、50μg/ml组及200μg/ml层粘连蛋白组,其中200μg/ml层粘连蛋白组杆状细胞数最高。这表明使用基质胶和层粘连蛋白可以让心肌细胞粘附生长。现有技术中作为包被试剂使用的层粘连蛋白的浓度通常为约10μg/ml,而本申请发明人发现在本发明中层粘连蛋白的浓度为50~200μg/ml时才能使心肌细胞有效贴壁。(3)血清浓度对人心肌细胞平均杆状细胞率的影响在m199中加入20mm的bdm、100u/ml青霉素和100μg/ml链霉素,然后分别加入不同浓度血清(0%、5%、10%和20%的胎牛血清),人心肌细胞铺于提前用200μg/ml的层粘连蛋白包被的48孔细胞培养板,置于37℃细胞培养箱(5%co2,相对饱和湿度为95%),培养5天。由图4可知,实验组平均杆状细胞率(杆状细胞占总细胞比例)明显高于对照组,结果有统计学差异(p<0.05)。但是,三种不同血清浓度实验组之间并无统计学差异(p>0.05),10%胎牛血清组的平均杆状细胞率略高于5%胎牛血清组和20%胎牛血清组。由此可以确定心肌细胞培养过程中适合血清浓度为5~20%,优选为10%。(4)不同类型的成品培养基对人心肌细胞存活率的影响选择了下述8种常用成品培养基,分别为mem(购自thermo公司)、mem-glutamax(购自thermo公司)、mem-glutamax-4-羟乙基哌嗪乙磺酸(购自thermo公司)、m199(购自sigma公司)、m199-无谷氨酰胺(购自thermo公司)、m199-4-羟乙基哌嗪乙磺酸-无谷氨酰胺(购自thermo公司)、dmem-高糖(购自thermo公司)以及dmem-低糖-丙酮酸钠(购自thermo公司)。8种不同成品培养基中分别加入20mm的bmd、100u/ml青霉素和100μg/ml链霉素。将分离得到的人心肌细胞铺于提前用200μg的层粘连蛋白包被的48孔细胞培养板,置于37℃细胞培养箱(5%co2,相对饱和湿度为95%),培养5天。结果如图5所示,mem-4-羟乙基哌嗪乙磺酸-谷氨酰胺组的活细胞率明显高于m199和dmem-低糖-丙酮酸钠组(p<0.05),但是与m199-无谷氨酰胺、m199-4-羟乙基哌嗪乙磺酸-无谷氨酰胺、mem、dmem-高糖组无明显差异,因此,mem-4-羟乙基哌嗪乙磺酸-谷氨酰胺、m199-无谷氨酰胺、m199-4-羟乙基哌嗪乙磺酸-无谷氨酰胺、mem、dmem-高糖均可以用于人心肌细胞培养。根据杆状率结果显示,选择细胞存活率最高的mem-4-羟乙基哌嗪乙磺酸-glutamax培养人心肌细胞。(5)肌球蛋白抑制剂n-苄基-对甲苯磺酰胺(bts)和myk-461对人心肌细胞存活率的影响为了探索除了bdm和(-)-blebbistatin以外是否存在其他对心肌细胞的杆状率有改善作用的肌球蛋白atp酶抑制剂,将(-)-blebbistatin、bts、myk-461对心肌细胞活性的影响进行了对比。针对分离的人心肌细胞,使用分别含有10μm(-)-blebbistatin、bts(浓度分别为5μm、10μm、20μm、30μm、40μm、50μm)、myk-461(浓度分别为0.5μm、1μm、2μm、5μm、10μm、20μm)的培养基,所述培养基中加入有10%胎牛血清、100u/ml青霉素和100μg/ml链霉素。结果如图6所示,不同浓度的bts和myk-461组中,杆状细胞百分比无明显差异,但均明显低于(-)-blebbistatin组(p<0.05)。这进一步说明了并不是所有肌球蛋白atp酶抑制剂都可以用于人心肌细胞的培养。(6)生长因子及代谢底物对人心肌细胞存活率的影响将生长因子及代谢底物丙酮酸钠(sodiumpyruvate)、胰岛素(insulin)、肌酸(creatine)、β-氨基乙磺酸(taurine)和l-左旋肉碱(l-carnitine)混合加入培养基中,简称picct。实验组根据基础培养基中加入不同浓度(-)-blebbistatin(0μm、5μm、10μm)分为三组,每组包括有无picct两个条件,用以探讨生长因子及代谢底物对人心肌细胞存活率的影响。于37℃细胞培养箱(5%co2,相对饱和湿度为95%)中培养7天后,计算校准心肌细胞存活率(第7天细胞存活率/第0天细胞存活率×100%)。在心肌细胞培养过程中,部分细胞失去原有的长杆状细胞形态,贴壁生长。如图7所示,与对应浓度的(-)-blebbistatin组相比,加入picct对存活率无明显影响。以上结果说明,(-)-blebbistatin对心肌细胞贴壁有抑制作用,picct并不影响心肌细胞存活率。(7)本发明培养基与accit培养基的对比使用文献(v.bistola,m.nikolopoulou,a.derventzi,a.kataki,n.sfyras,n.nikou,m.toutouza,p.toutouzas,c.stefanadis,andm.m.konstadoulakis.“long-termprimaryculturesofhumanadultatrialcardiacmyocytes:cellviability,structuralpropertiesandbnpsecretioninvitro”,intjcardiol,131(2008),113-22.)中记载的accit培养基(组分及含量如下述表5所示)和本发明培养基(在mem-4-羟乙基哌嗪乙磺酸-glutamax成品培养基中加入10μm(-)-blebbistatin、10%胎牛血清、100u/ml青霉素和100μg/ml链霉素而得到的培养基)分别对人心肌细胞培养6天,计算杆状细胞在全部细胞中所占的比例。结果如图8所示,本发明完全培养基组的杆状心肌细胞比例明显高于accit组,结果有统计学差异(p<0.05)。这进一步表明本发明培养基能够取得提高人心肌细胞存活率的优异效果。[表5]综上所述,本发明优选的人心肌细胞的培养条件为:使用基质胶(37℃,30min)或50-200μg/ml层粘连蛋白(37℃培养箱孵育过夜,晾干)提前包被培养板,使用在选自mem-4-羟乙基哌嗪乙磺酸-glutamax、m199-无谷氨酰胺、m199-4-羟乙基哌嗪乙磺酸-无谷氨酰胺、mem、mem-glutamax、dmem-高糖中的任一种成品培养基中加入10%~20%的胎牛血清、2.5~20μm(-)-blebbistatin、及100u/ml青霉素和100μg/ml链霉素而得到的培养基。以上结果表明,含有(-)-blebbistatin的本发明培养基不仅能够显著提高分离人心肌细胞时的存活率,还能显著提高人心肌细胞培养过程中的存活率。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1