一种寡核苷酸标记探针原位检测PDL1的试剂组与应用的制作方法
本发明涉及生物
技术领域:
,特别涉及一种寡核苷酸标记探针原位检测pdl1的试剂组与应用。
背景技术:
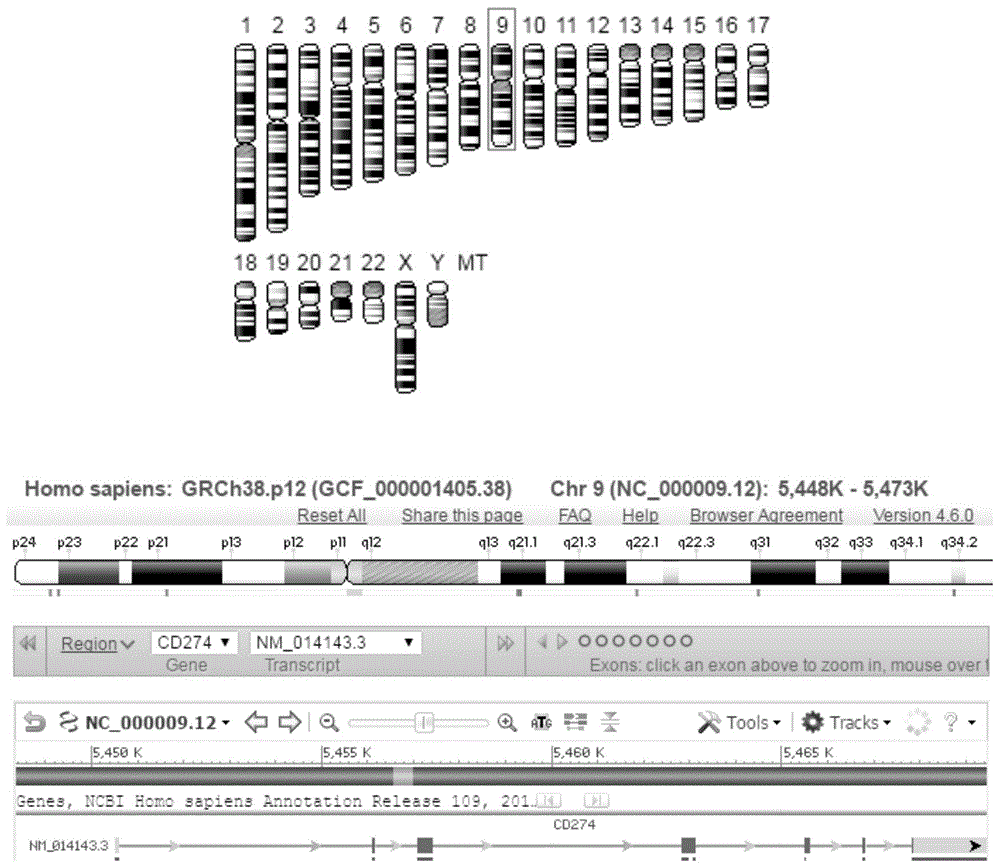
:随着个体化精准治疗的开展,更多研究者致力于调查个体对癌症产生的免疫反应,解除肿瘤细胞免疫逃避,使免疫系统主动对癌细胞发动免疫杀伤。程序性死亡配体1(pd-l1)也被称为白细胞分化抗原274(cd274)或b7同源物1(b7-h1),是一种由pd-l1基因编码一种免疫抑制受体配体,可选择性剪接形成多个转录变体。该蛋白是一种具有免疫球蛋白v样和c样结构域的i型跨膜蛋白。这种配体与其受体的相互作用抑制t细胞的活化和细胞因子的产生。主要由造血和非造血细胞(如t细胞和b细胞以及各种类型的肿瘤细胞)表达。在正常组织的感染或炎症过程中(例如怀孕、组织移植、自体免疫疾病,以及诸如肝炎等某些疾病),这种相互作用对于通过维持免疫反应的稳态来预防自身免疫性很重要。但在肿瘤微环境中,这种相互作用通过细胞毒性t细胞失活为肿瘤细胞提供免疫逃逸。这种基因在肿瘤细胞中的表达被认为是多种人类恶性肿瘤的预后因素,包括结肠癌、肺癌和肾细胞癌等肿瘤高度表达[velchetiv.programmeddeathligand-1expressioninnon-smallcelllungcancer.labinvest.2014;94(1):107–115.;omoris1,kenmotsuh1,abem2,watanaber3,suginot2,kobayashih1,nakashimak1,wakudak1,onoa1,tairat1,naitot1,murakamih1,ohdey4,endom5,akiyamay6,nakajimat2,takahashit7.changesinprogrammeddeathligand1expressioninnon-smallcelllungcancerpatientswhoreceivedanticancertreatments.intjclinoncol.2018dec;23(6):1052-1059.doi:10.1007/s10147-018-1305-4.epub2018jun15.]。近年来多位科学家发现,pd-l1在多种浸润性肿瘤细胞中高表达。当t细胞上的pd-1受体与信号蛋白pd-l1结合会使肿瘤细胞能够逃避自身免疫系统中免疫细胞攻击,一些阻断pd-1或pd-l1的药物能够重新激活免疫细胞对抗肿瘤。分析了196个肿瘤标本肾细胞癌患者发现肿瘤pd-l1高表达较低表达组肿瘤的风险率增加约4.5倍(riskratio4.53;95%confidenceinterval1.94-10.56;p<0.001.),与死亡风险增加也有关[thompsonrh,gillettmd,chevillejc,lohsecm,dongh,websterws,krejcikg,lobojr,senguptas,chenl,zinckeh,bluteml,stromese,leibovichbc,kwoned.costimulatoryb7-h1inrenalcellcarcinomapatients:indicatoroftumoraggressivenessandpotentialtherapeutictarget.procnatlacadsciusa2004;101(49):17174–9.]。卵巢癌患者pd-l1较高的表达,显示着较差的预后。pd-l1表达与上皮内cd8+t淋巴细胞计数呈负相关,提示肿瘤细胞pd-l1可能抑制抗肿瘤cd8+t细胞活性[hamanishij,mandaim,iwasakim,okazakit,tanakay,yamaguchik,higuchit,yagih,takakurak,minaton,honjot,fujiis.programmedcelldeath1ligand1andtumor-infiltratingcd8+tlymphocytesareprognosticfactorsofhumanovariancancer.procnatlacadsciusa2007;104(9):3360–5.]。原发性肝癌在我国和非洲地区呈现逐年增加的趋势,中山医院高强等研究人员通过组织芯片等高通量筛选方法发现pdl1表达丰度与肝癌预后、生存期以及复发率存在相关性,该基因可能是一个较好临床评估指标和药物作用靶点[qianggao,xiao-yingwang,shuang-jianqiu,etal.overexpressionofpd-l1significantlyassociateswithtumoraggressivenessandpostoperativerecurrenceinhumanhepatocellularcarcinomaclincancerres2009;15(3):971-979.]。许多pd-l1抑制剂正在开发的免疫治疗肿瘤,在临床试验中显示出良好的结果[velchetiv.programmeddeathligand-1expressioninnon-smallcelllungcancer.labinvest.2014;94(1):107–115.],通过阻断pd-1/pd-l1信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜力,有望实质性改善患者总生存期,其中包括avacta生命科学开发的pd-l1inhibitor和genentech、默沙东、百时美施贵宝、阿斯利康、罗氏等开发的抗pd-l1抗体或相关抑制剂,在某些病例中取得了较好的治疗效果,因此该领域有这最大临床检测与治疗潜力及价值[brahmerjr1,tykodiss,chowlq,hwuwj,topaliansl,hwup,drakecg,camacholh,kauhj,odunsik,pitothc,hamido,bhatias,martinsr,eatonk,chens,salaytm,alaparthys,grossojf,kormanaj,parkersm,agrawals,goldbergsm,pardolldm,guptaa,wiggintonjm.safetyandactivityofanti-pd-l1antibodyinpatientswithadvancedcancer.nengljmed.2012;366(26):2455-65.]。但是如何快速便捷确认相关组织肿瘤样品的pdl1表达分布是针对pd-1/pd-l1信号细胞免疫治疗的关键前提。荧光原位杂交技术(fluorescenceinsituhybridization),简称fish。荧光原位杂交(fish)基于传统的细胞遗传学和核酸杂交技术的结合,其基础是southernblot原理,以半抗原如生物素、地高辛间接标记或以荧光素直接标记的已知核酸分子为探针,探针和靶序列dna或rna变性后杂交,互补的异源单链核酸分子在适宜的温度和离子强度下退火形成稳定的异源双链结构,通过荧光标记的亲和素或抗地高辛抗体将半抗原显示出来,通过在荧光显微镜或共聚焦激光扫描仪下观察荧光信号,来确定与特异探针杂交后被染色的细胞或细胞器的形态和分布,或者是结合了荧光探针的dna区域或rna分子在染色体或其他细胞器中的定位。fish具有快速灵敏、特异性好的特点,可同时分析初步分析基因丰度并进行空间定位。目前最常使用fish的技术有如下几种:(1)寡核苷酸探针fish技术:最常用的寡核苷酸探针一般是15-45bp,短的探针易于结合到靶序列,但标记效果相对较弱,探针的标记有直接标记和间接标记两种。(2)核酸肽探针fish技术:核酸肽(peptidenucleicacid,pna),一种不带电荷的dna类似物,其主链骨架是由重复的n-(2-氨基乙基)甘氨酸以酰胺键聚合而成,碱基通过亚甲基连接到pna分子的主链上。pna/dna分子杂交结合力、专一性都很高,由于没有电荷排斥力,使其杂交形成双螺旋结构的热稳定性高;pna探针能够接近位于rrna高级结构域中的特异靶序列,极大地提高了pna-fish检测的灵敏性;pna探针一般长度为15bp,但由于靶向序列较短,可能会出现非特异结合。(3)多彩(multicolor)fish技术:近年来,很多学者致力于以不同染色的标记探针和荧光染料同时检测出多个靶序列的研究,最新的多彩fish技术可以同时用七种染色进行检测。由以上可见,人工寡核苷探针是以核苷酸为原料,通过dna合成仪合成,避免了真核细胞中存在的高度重复序列带来的不利影响。由于大多数寡核苷酸序列较短,组织穿透性极好。根椐目的基因的特异性序列设计的探针,特异性较强。pdl1与多种肿瘤的形成和免疫逃避有着密切关系,并且可以作为药物治疗的作用靶标,对于该基因的有效监测和监控,可以为临床诊断和预后提供积极参考与帮助。技术实现要素:本发明的目的是提供一种寡核苷酸标记探针原位检测pdl1的试剂组与应用。第一方面,本发明要求保护一种用于检测pdl1的探针组或探针。本发明所要求保护的用于检测pdl1的探针组或探针,其中所述探针组可由如下中的全部或部分组成;所述探针可为如下任一:(a1)pdl1探针1:seqidno.1所示的单链dna,或者将seqidno.1中的t替换为u后所得序列所示的单链rna;(a2)pdl1探针2:seqidno.2所示的单链dna,或者将seqidno.2中的t替换为u后所得序列所示的单链rna;(a3)pdl1探针3:seqidno.3所示的单链dna,或者将seqidno.3中的t替换为u后所得序列所示的单链rna;(a4)pdl1探针4:seqidno.4所示的单链dna,或者将seqidno.4中的t替换为u后所得序列所示的单链rna;(a5)pdl1探针5:seqidno.5所示的单链dna,或者将seqidno.5中的t替换为u后所得序列所示的单链rna;(a6)pdl1探针6:seqidno.6所示的单链dna,或者将seqidno.6中的t替换为u后所得序列所示的单链rna;(a7)pdl1探针7:seqidno.7所示的单链dna,或者将seqidno.7中的t替换为u后所得序列所示的单链rna;(a8)pdl1探针8:seqidno.8所示的单链dna,或者将seqidno.8中的t替换为u后所得序列所示的单链rna;(a9)pdl1探针9:seqidno.9所示的单链dna,或者将seqidno.9中的t替换为u后所得序列所示的单链rna;(a10)pdl1探针10:seqidno.10所示的单链dna,或者将seqidno.10中的t替换为u后所得序列所示的单链rna;(a11)pdl1探针11:seqidno.11所示的单链dna,或者将seqidno.11中的t替换为u后所得序列所示的单链rna;(a12)pdl1探针12:seqidno.12所示的单链dna,或者将seqidno.12中的t替换为u后所得序列所示的单链rna;(a13)pdl1探针13:seqidno.13所示的单链dna,或者将seqidno.13中的t替换为u后所得序列所示的单链rna;(a14)pdl1探针14:seqidno.14所示的单链dna,或者将seqidno.14中的t替换为u后所得序列所示的单链rna;(a15)pdl1探针15:seqidno.15所示的单链dna,或者将seqidno.15中的t替换为u后所得序列所示的单链rna;(a16)pdl1探针16:seqidno.16所示的单链dna,或者将seqidno.16中的t替换为u后所得序列所示的单链rna;(a17)pdl1探针17:seqidno.17所示的单链dna,或者将seqidno.17中的t替换为u后所得序列所示的单链rna;(a18)pdl1探针18:seqidno.18所示的单链dna,或者将seqidno.18中的t替换为u后所得序列所示的单链rna;(a19)pdl1探针19:seqidno.19所示的单链dna,或者将seqidno.19中的t替换为u后所得序列所示的单链rna;(a20)pdl1探针20:seqidno.20所示的单链dna,或者将seqidno.20中的t替换为u后所得序列所示的单链rna;(a21)pdl1探针21:seqidno.21所示的单链dna,或者将seqidno.21中的t替换为u后所得序列所示的单链rna;(a22)pdl1探针22:seqidno.22所示的单链dna,或者将seqidno.22中的t替换为u后所得序列所示的单链rna;(a23)pdl1探针23:seqidno.23所示的单链dna,或者将seqidno.23中的t替换为u后所得序列所示的单链rna;(a24)pdl1探针24:seqidno.24所示的单链dna,或者将seqidno.24中的t替换为u后所得序列所示的单链rna;(a25)pdl1探针25:seqidno.25所示的单链dna,或者将seqidno.25中的t替换为u后所得序列所示的单链rna;(a26)pdl1探针26:seqidno.26所示的单链dna,或者将seqidno.26中的t替换为u后所得序列所示的单链rna。第二方面,本发明要求保护用于检测pdl1的试剂盒。本发明所要求保护的用于检测pdl1的试剂盒,含有前文第一方面所述的探针组或探针,还含有阴性对照探针。所述阴性对照探针为seqidno.27所示的单链dna,或者将seqidno.27中的t替换为u后所得序列所示的单链rna。进一步地,所述试剂盒中还含有阳性对照探针;所述阳性对照探针为用于检测β-actin的探针组或用于检测β-actin的探针,所述用于检测β-actin的探针组可为如下中的全部或部分;所述用于检测β-actin的探针为如下任一:(b1)β-actin探针1:seqidno.28所示的单链dna,或者将seqidno.28中的t替换为u后所得序列所示的单链rna;(b2)β-actin探针2:seqidno.29所示的单链dna,或者将seqidno.29中的t替换为u后所得序列所示的单链rna;(b3)β-actin探针3:seqidno.30所示的单链dna,或者将seqidno.30中的t替换为u后所得序列所示的单链rna;(b4)β-actin探针4:seqidno.31所示的单链dna,或者将seqidno.31中的t替换为u后所得序列所示的单链rna;(b5)β-actin探针5:seqidno.32所示的单链dna,或者将seqidno.32中的t替换为u后所得序列所示的单链rna;(b6)β-actin探针6:seqidno.33所示的单链dna,或者将seqidno.33中的t替换为u后所得序列所示的单链rna;(b7)β-actin探针7:seqidno.34所示的单链dna,或者将seqidno.34中的t替换为u后所得序列所示的单链rna;(b8)β-actin探针8:seqidno.35所示的单链dna,或者将seqidno.35中的t替换为u后所得序列所示的单链rna;(b9)β-actin探针9:seqidno.36所示的单链dna,或者将seqidno.36中的t替换为u后所得序列所示的单链rna;(b10)β-actin探针10:seqidno.37所示的单链dna,或者将seqidno.37中的t替换为u后所得序列所示的单链rna。在前文第一方面和第二方面中,所述探针组和所述试剂盒中的所有探针的5'端和/或3'端均可经标签标记。进一步地,所述标签标记可选自如下:荧光标记(如异硫氰酸荧光素fitc,羧基荧光素fam,4甲-6羧罗丹明tamra,吲哚二羧菁cy3/cy5,四氯-6-羧基荧光素tet、六氯-6-甲基荧光素hex、四甲基异硫氰酸盐罗丹明tritc等)、生物素(biotin)标记、地高辛(digoxigenin)标记、氨基修饰(amine)、巯基修饰(thiol)、胆固醇修饰(cholesteroi)等半抗原报告分子标记。在前文第一方面和第二方面中,所述探针组和所述试剂盒中的所有探针的全部或部分中的1个或多个核苷酸经修饰。其中,所述多个核苷酸为“至少两个核苷酸,至多为组成该探针的全部核苷酸”。进一步地,所述修饰可选自如下:n-(2-氨基乙基)甘氨酸修饰、二羟基甲氧修饰,二羟基氟代修饰、硫代磷酸酯键修饰、锁核酸修饰(lockednucleicacid,lnaβ-d-呋喃核糖的2'-o、4’-c位通过缩水作用形成刚性的结构)、pna修饰(以中性的肽链酰胺2-氨基乙基甘氨酸键取代了dna中的戊糖磷酸二酯键骨架,其余的与dna相同)等。在本发明的具体实施方式中,所述用于检测pdl1的探针具体为所述pdl1探针2(seqidno.2),其5'端前3个和3'端后3个核苷酸均经硫代磷酸酯键修饰,且自5’末端开始第5、14和19位核苷酸均经锁核酸修饰。在本发明的具体实施方式中,所述用于检测pdl1的探针组具体由如下4个探针组成:(1)所述pdl1探针2(seqidno.2),其5'端前3个和3'端后3个核苷酸均经硫代磷酸酯键修饰,且自5’末端开始第5、14和19位核苷酸均经锁核酸修饰。(2)所述pdl1探针5(seqidno.5),其5'端前3个和3'端后3个核苷酸均经硫代磷酸酯键修饰,且自5’末端开始第5、13和19位核苷酸均经锁核酸修饰。(3)所述pdl1探针16(seqidno.16),其5'端前3个和3'端后3个核苷酸均经硫代磷酸酯键修饰,且自5’末端开始第4、11和22位核苷酸均经锁核酸修饰。(4)所述pdl1探针25(seqidno.25),其5'端前3个和3'端后3个核苷酸均经硫代磷酸酯键修饰,且自5’末端开始第5、12和23位核苷酸均经锁核酸修饰。在本发明的具体实施方式中,所述阴性对照探针具体为seqidno.27所示的单链dna,其5'端前3个和3'端后3个核苷酸均经硫代磷酸酯键修饰,且自5’末端开始第4和13位核苷酸均经锁核酸修饰。在本发明的具体实施方式中,所述用于检测β-actin的探针为所述β-actin探针7(seqidno.34),其5'端前3个和3'端后3个核苷酸均经硫代磷酸酯键修饰,且自5’末端开始第6、16和19位核苷酸均经锁核酸修饰。在本发明的具体实施方式中,所述用于检测β-actin的探针组具体由如下4个探针组成:(1)所述β-actin探针1(seqidno.28),其5'端前3个和3'端后3个核苷酸均经硫代磷酸酯键修饰,且自5’末端开始第7和16位核苷酸均经锁核酸修饰。(2)所述β-actin探针3(seqidno.30),其5'端前3个和3'端后3个核苷酸均经硫代磷酸酯键修饰,且自5’末端开始第9、19和25位核苷酸均经锁核酸修饰。(3)所述β-actin探针7(seqidno.34),其5'端前3个和3'端后3个核苷酸均经硫代磷酸酯键修饰,且自5’末端开始第6、16和19位核苷酸均经锁核酸修饰。(4)所述β-actin探针9(seqidno.36),其5'端前3个和3'端后3个核苷酸均经硫代磷酸酯键修饰,且自5’末端开始第8、14和19位核苷酸均经锁核酸修饰。在本发明的具体实施方式中,所用的各探针均5'端经荧光标记,标记的具体是cy3。在前文第二方面中,根据需要所述试剂盒中还可含有用于检测pdl1基因的引物对;所述用于检测pdl1基因的引物对为由seqidno.38和seqidno.39所示的两条单链dna组成的引物对。进一步地,所述试剂盒中还可含有用于检测内参基因hgapdh的引物对;所述用于检测内参基因hgapdh的引物对为由seqidno.40和seqidno.41所示的两条单链dna组成的引物对。上述两个引物对可用于通过qrt-pcr进一步复核探针所检测的pdl1基因表达趋势。第三方面,本发明还要求保护如下任一所示应用:(a1)前文第一方面所述的探针组在制备前文第二方面所述试剂盒中的应用。(a2)前文第一方面所述的探针组或前文第二方面所述试剂盒在对pdl1进行原位检测中的应用,或在制备用于对pdl1进行原位检测的产品中的应用。(a3)前文第一方面所述的探针组或前文第二方面所述试剂盒在对pdl1进行表达水平和/或分布情况检测中的应用,或在制备用于对pdl1进行表达水平和/或分布情况检测的产品中的应用。(a4)前文第一方面所述的探针组或前文第二方面所述试剂盒在协助判断肿瘤或参与其他细胞反应(如炎症反应等)的发生发展阶段和/或趋势中的应用,或在制备用于协助判断肿瘤或参与其他细胞反应(如炎症反应等)的发生发展阶段和/或趋势的产品中的应用。进一步地,所述对pdl1进行原位检测可为对肿瘤细胞或非肿瘤细胞中的pdl1进行原位检测;所述对pdl1进行表达水平和/或分布情况检测可为对肿瘤细胞或非肿瘤细胞中的pdl1进行表达水平和/或分布情况检测。其中,所述肿瘤细胞可为癌症细胞。在本发明的具体实施方式中,所述非肿瘤细胞具体为如下细胞:人正常肝脏细胞(如hl7702细胞)或人肾上皮细胞(如293t细胞);所述肿瘤细胞具体为人肝癌细胞(如huh7细胞或lm3细胞)。本发明结合fish探针的原位结合可视特点和广泛用途,开发能够快速检测临床样品癌细胞中pdl1相对表达水平与分布的寡核苷酸(fish探针法),并通过qrt-pcr进步复核其基因表达趋势,进步丰富临床相关应用与研究提供有效工具。附图说明图1为pdl1基因序列位置确定。图2为pdl1的3个转录本序列分析比对图。图3为hl7702细胞中pdl1基因的原位检测结果。图4为huh7细胞中pdl1基因的原位检测结果。图5为lm3细胞中pdl1基因的原位检测结果。图6为293t细胞中pdl1基因的原位检测结果。图7为rna提取质量检测结果。1为hl7702细胞;2为huh7细胞;3为lm3细胞;4为293t细胞。图8为实时荧光定量pcr检测pdl1的扩增曲线。a为样品hl7702.hgapdh/hpdl1扩增曲线;b为样品huh7.hgapdh/hpdl1扩增曲线;c为样品lm3.hgapdh/hpdl1扩增曲线;d为样品293t.hgapdh/hpdl1扩增曲线。a-d中,均左侧图为针对人源gapdh扩增曲线;右侧图为人源pdl1扩增曲线;图中各有3条曲线是三次重复检测。图9为实时荧光定量pcr检测pdl1的表达丰度的数据统计柱状图。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例1、寡核苷酸标记探针原位检测pdl1一、实验材料探针合成实验中用到相关碱基单体即对应的核糖核苷酸(a腺嘌呤、c是胞嘧啶、u尿嘧啶、g是鸟嘌呤)和脱氧核糖核苷酸(a腺嘌呤、t胸腺嘧啶、c胞嘧啶、g鸟嘌呤)。荧光标记(异硫氰酸荧光素fitc,羧基荧光素fam,4甲-6羧罗丹明tamra,吲哚二羧菁cy3/cy5,四氯-6-羧基荧光素tet、六氯-6-甲基荧光素hex、四甲基异硫氰酸盐罗丹明tritc);生物素(biotin);地高辛(digoxigenin);氨基修饰(amine);巯基修饰(thiol);胆固醇修饰(cholesteroi)等半抗原标记分子。以及以下修饰单体:n-(2-氨基乙基)甘氨酸修饰、二羟基甲氧修饰,二羟基氟代修饰、硫代磷酸酯键修饰、lna修饰、pna修饰原料均为苏州吉玛基因股份有限公司提供。hl7702细胞(人正常肝脏细胞)、huh7细胞(人肝癌细胞)、lm3细胞(人肝癌细胞)、293t细胞(人肾上皮细胞)(上海生科院细胞库),常规培养使用含10%胎牛血清(bi)的dmem培养基(corning)(含1.5mml-谷氨酸,100u/ml青霉素,100μg/ml链霉素)中,37℃5%co2饱和湿度培养箱中培养。trypsin-edtasolution(0.25%trypsin+0.53mmedta,hyclone)48孔板(corning)。固定液:4%多聚甲醛。实验过程中用到的buffera、b、c、d、e、f均为吉玛基因产品货号f03501的一个试剂盒中的试剂。探针应避光稀释并保存,且实验过程中加入探针后的操作应在避光条件下进行。dapi用pbs按照1:1000稀释,需避光保存和使用。二、实验步骤1、目的基因查找与探针设计依据官方基因信息,查找分析目的基因cd274(cd274cd274molecule[homosapiens(human)]geneid:29126,alsoknownasb7-h;b7h1;pdl1;pd-l1;pdcd1l1;pdcd1lg1)即pdl1基因在染色体基因组上分布,确定目的基因位于9号染色体上,将目的基因三个转录本序列进行比对分析,确定保守区域与非保守区域(图1和图2)。针对pdl1基因外显子区域设计26条寡合苷酸单链探针和一条阴性对照探针(表1)并分别进行序列比对,尽可能排除与基因组中其他基因,特别是外显子基因的非特异性匹配。另外,设计了10条针对β-actin基因的寡合苷酸单链探针作为检测时的阳性对照(表2)。表1用于检测pdl1的26条寡合苷酸单链探针注:pdl1-nc为阴性对照探针。表2用于检测pdl1的26条寡合苷酸单链探针2、靶点探针合成以上探针序列(表1和表2)由上海吉玛制药技术有限公司提供合成,可以是合成rna探针序列或dna探针序列,分别对应核糖核苷酸(a腺嘌呤、c是胞嘧啶、u尿嘧啶、g是鸟嘌呤)和脱氧核糖核苷酸(a腺嘌呤、t胸腺嘧啶、c胞嘧啶、g鸟嘌呤)。对以上序列分别可以进行5'端和/或3'端多种标签标记:如进行荧光标记(异硫氰酸荧光素fitc,羧基荧光素fam,4甲-6羧罗丹明tamra,吲哚二羧菁cy3/cy5,四氯-6-羧基荧光素tet、六氯-6-甲基荧光素hex、四甲基异硫氰酸盐罗丹明tritc);生物素(biotin);地高辛(digoxigenin);氨基修饰(amine);巯基修饰(thiol);胆固醇修饰(cholesteroi)等半抗原报告分子标记。对以上序列1个或多个碱基可以分别进行如下修饰:n-(2-氨基乙基)甘氨酸修饰、二羟基甲氧修饰,二羟基氟代修饰、硫代磷酸酯键修饰、锁核酸修饰(lockednucleicacid,简称lna,β-d-呋喃核糖的2'-o、4’-c位通过缩水作用形成刚性的结构)、pna修饰(以中性的肽链酰胺2-氨基乙基甘氨酸键取代了dna中的戊糖磷酸二酯键骨架,其余的与dna相同)。本实施例中具体选用如下探针进行下述步骤3实验:pdl1一条探针的实验组:5'-ctgc+ttgtccaga+tgact+tcggc-3',即基本序列为表1中的pdl1-2(seqidno.2)。其中,探针的5'端前3个和3'端后3个碱基均经硫代磷酸酯键修饰;加号后紧挨着的一个碱基经lna修饰,且5'端经荧光标记,标记的是cy3。pdl1多条探针的实验组,由如下探针组成:5'-ctgc+ttgtccaga+tgact+tcggc-3',即基本序列为表1中的pdl1-2(seqidno.2);5'-gcgt+tcagcaaa+tgccag+taggtc-3',即基本序列为表1中的pdl1-5(seqidno.5);5'-att+tggagga+tgtgccagagg+tagtt-3',即基本序列为表1中的pdl1-16(seqidno.16);5'-catt+tggagga+tgtgccagagg+tagtt-3',即基本序列为表1中的pdl1-25(seqidno.25)。在pdl1多条探针的实验组中,各探针的5'端前3个和3'端后3个碱基均经硫代磷酸酯键修饰;加号后紧挨着的一个碱基经lna修饰,且5'端均经荧光标记,标记的均是cy3。pdl1阴性对照探针组:5'-gtg+taacacgtc+tatacgccca-3',即基本序列为表1中的pdl1-nc(seqidno.27)。其中,探针的5'端前3个和3'端后3个碱基均经硫代磷酸酯键修饰;加号后紧挨着的一个碱基经lna修饰,且5'端经荧光标记,标记的是cy3。β-actin一条探针的实验组:5'-cctcc+tgagcgcaag+tac+tccgtgt-3',即基本序列为表2中的β-actin-7(seqidno.34)。其中,探针的5'端前3个和3'端后3个碱基均经硫代磷酸酯键修饰;加号后紧挨着的一个碱基经lna修饰,且5'端经荧光标记,标记的是cy3。β-actin多条探针的实验组,由如下探针组成:5'-acgcgg+tctcggcgg+tggtggcg-3',即基本序列为表2中的β-actin-1(seqidno.28);5'-tcacgccc+tgggaaggaa+aggaca+agaagc-3',即基本序列为表2中的β-actin-3(seqidno.30);5'-cctcc+tgagcgcaag+tac+tccgtgt-3',即基本序列为表2中的β-actin-7(seqidno.34);5'-tgagggc+aggact+tagct+tccacagca-3',即基本序列为表2中的β-actin-9(seqidno.36);在β-actin多条探针的实验组中,各探针的5'端前3个和3'端后3个碱基均经硫代磷酸酯键修饰;加号后紧挨着的一个碱基经lna修饰,且5'端均经荧光标记,标记的均是cy3。3、细胞爬片制备(实验过程中用到的buffera、b、c、d、e、f均为吉玛基因产品货号f03501的一个试剂盒)(1)按照3-5×103细胞/孔的密度将贴壁细胞(hl7702细胞、huh7细胞、lm3细胞、293t细胞)接种于48孔板(孔内提前放入已处理好的且大小合适的盖玻片)中(建议事先铺在confocal专用培养皿中),混匀后于37℃5%co2培养箱中培养过夜。(2)吸弃孔板中的培养基,pbs洗两次,每次5min。(3)吸弃pbs,每孔加入100μl4%多聚甲醛,室温固定15min。(4)吸弃4%多聚甲醛,每孔加入100μl0.1%(体积比)buffera(现用现配)室温处理细胞15min。(5)吸弃0.1%buffera,pbs洗两次,每次5min。(6)吸弃pbs,每孔加入100μl2×bufferc,37℃培养箱放置30min。(7)吸弃2×bufferc,每孔加入100μl70%乙醇,室温放置3min。(8)吸弃70%乙醇,每孔加入100μl85%乙醇,室温放置3min。(9)吸弃85%乙醇,每孔加入100μl无水乙醇,室温放置3min。(10)吸弃无水乙醇,室温干燥。(11)buffere提前在37℃水浴锅孵育2h。(12)探针稀释:可参看探针标签或报告单上所示参数:nmole/od260,例如:nmole/od260=4.17,则在每od探针干粉制品中加入41.7μl灭菌depc水,混匀后即得浓度约为100μm的储存液。(13)配制探针混合液:例:70μlbuffere,2μl探针(含有1条或多条探针混合),28μldepc水,终体积为100μl;(可先做预实验确定所需的探针浓度,即探针5μl~0.6μl,70μlbuffere,加depc水补足至100μl。)注:mix中各探针各加0.7μl。(14)每孔加入上述100μl探针混合液,73℃变性5min,37℃培养箱杂交孵育过夜12~16h。(15)杂交次日,将样本从37℃培养箱取出,吸弃探针混合液,每孔加入100μl0.1%(体积百分比)bufferf洗涤5min。(16)吸弃0.1%bufferf,每孔加入100μl的2×bufferc洗涤5min。(17)吸弃2×bufferc,每孔加入100μl的1×bufferc洗涤5min,吸弃洗涤液。(18)吸弃1×bufferc,每孔加入100μl稀释后的dapi工作液(即步骤一中的“dapi用pbs按照1:1000(体积比)稀释,需避光保存和使用”),避光染色20min,吸弃,加入100μlpbs,尽快于荧光显微镜(徕卡-sp8)下观察。三、实验结果hl7702细胞中pdl1基因的原位检测结果如图3所示。huh7细胞中pdl1基因的原位检测结果如图4所示。lm3细胞中pdl1基因的原位检测结果如图5所示。293t细胞中pdl1基因的原位检测结果如图6所示。由图3-图6所示结果,可见:pdl1表达丰度高的荧光fish探针显示信号强,不同的细胞pdl1表达丰度不一样,本发明所提供的pdl1探针针对pdl1表达情况可以初步显示其丰度与位置(结合如下步骤四结果)。四、pdl1基因表达验证通过实时荧光定量pcr的方法进步验证pdl1在各细胞(hl7702细胞、huh7细胞、lm3细胞、293t细胞)中的表达丰度。1、材料与方法荧光定量pcr分析(1)引物设计如表3所示。表3实时荧光定量pcr检测pdl1所用引物(2)试剂和仪器实时荧光定量通用试剂(cat#gmrs-001吉玛,上海)mx3000p实时荧光定量pcr仪(stratagene,u.s.)第一步:总rna提取(1)往收集完毕的细胞样品中加入1mlezol裂解液,漩涡震荡混匀。(2)加入0.2ml三氯甲烷,剧烈摇动10s,室温放置1分钟。(3)4℃,12,000g离心15min。(4)将上清水相转移至另一新的无rna酶离心管中,并加入等体积的100%乙醇。(5)吸取全部样品,加入带有2ml收集管的mini-spin离心柱。8,000g,室温离心15s,弃尽流穿液。(6)将剩余的样品转移至离心柱,重复第5步。(7)往离心柱中加入700μlwb,轻盖盖子,8,000g,室温离心15s,弃尽流穿液。(8)重复第7步,用500μlwb洗涤离心柱两次。(9)将离心柱转移至一新的无rna酶的1.5ml离心管中,往硅胶膜中央滴加50μldepc水,4℃,10,000g离心3min洗脱rna。第二步:逆转录反应体系逆转录反应体系如表4所示。表4逆转录反应体系组分终浓度用量2×逆转录缓冲液2×10μl逆转录引物(1μm)50nm1.2μl总rna—2μlmmlv逆转录酶(200u/μl)2u/μl0.2μldepc水to20μl第三步:逆转录程序42℃30min;85℃10min。第四步:实时荧光定量反应体系实时荧光定量反应体系如表5所示。表5实时荧光定量反应体系组分终浓度用量2×定量pcrmastermix1×10μl上游引物(20μm)0.08μm0.08μl下游引物(20μm)0.08μm0.08μlcdna模板—2μltaqdna聚合酶(2.5u/μl)0.05u/μl0.4μlddh2o加至20μl第五步:定量pcr反应程序95℃变性3分钟;95℃12秒,62℃,40秒,40个循环。2、结果(1)rna提取质量检测结果如表6和图7所示。表6rna提取质量检测结果样本id样本type260/280浓度(ng/μl)1.hl7702rna1.99356.62.huh7rna1.94320.43.lm3rna1.97298.74.293trna1.96315.6结果说明:(1)rna电泳28srrna、18srrna条带清晰可见,说明rna未降解;(2)od值测定a260/a280在1.9~2.2之间,说明rna未降解,提取过程中没有蛋白污染。(2)四种细胞的hgapdh/hpdl1扩增曲线如图8所示。结果说明:每个样品每个基因3个重复,精密度满足进一步分析要求.3、原始数据和相对定量计算结果如表7至表10以及图9所示。表7hl7702细胞扩增的原始数据和相对定量计算结果表8huh7细胞扩增的原始数据和相对定量计算结果表9lm3细胞扩增的原始数据和相对定量计算结果表10293t细胞扩增的原始数据和相对定量计算结果结果说明,实时荧光定量检测以上细胞中pdl1基因表达趋势结果与本发明中开发的pdl1寡核苷酸fish探针检测荧光丰度结果(步骤三所示)趋势较为一致。本实施例的实验证明,利用本发明的成套探针可成功标记细胞内或组织切片人类程序性死亡配体1(pd-l1)基因,可以方便、准确、快速地标记肿瘤细胞或非肿瘤细胞中标志基因pdl1的表达与分布,可用于协助判断肿瘤或参与其他细胞反应(如炎症反应等)的发生发展阶段与趋势。本发明的成套探针的稳定结合力及特异性高,非特异性背景信号低,具有很高的应用前景。<110>上海吉玛制药技术有限公司;苏州吉玛基因股份有限公司<120>一种寡核苷酸标记探针原位检测pdl1的试剂组与应用<130>gncln190658<160>41<170>patentinversion3.5<210>1<211>31<212>dna<213>artificialsequence<400>1aacggaagatgaatgtcagtgctacaccaag31<210>2<211>23<212>dna<213>artificialsequence<400>2ctgcttgtccagatgacttcggc23<210>3<211>26<212>dna<213>artificialsequence<400>3gttatcacaacagggtggttacagcg26<210>4<211>26<212>dna<213>artificialsequence<400>4gggtggttacagcgatgaaatgagat26<210>5<211>24<212>dna<213>artificialsequence<400>5gcgttcagcaaatgccagtaggtc24<210>6<211>25<212>dna<213>artificialsequence<400>6acagggtggttacagcgatgaaatg25<210>7<211>24<212>dna<213>artificialsequence<400>7gcgttcagcaaatgccagtaggtc24<210>8<211>22<212>dna<213>artificialsequence<400>8cgcttgtagtcggcaccaccat22<210>9<211>22<212>dna<213>artificialsequence<400>9tgctttcgccaggttccatttt22<210>10<211>23<212>dna<213>artificialsequence<400>10cattctcctcctctgctttcgcc23<210>11<211>19<212>dna<213>artificialsequence<400>11tgcaggcggacagaagcgc19<210>12<211>33<212>dna<213>artificialsequence<400>12aacggaagatgaatgtcagtgctacaccaaggc33<210>13<211>26<212>dna<213>artificialsequence<400>13ggaaccgtgacagtaaatgcgttcag26<210>14<211>22<212>dna<213>artificialsequence<400>14ggcattgagtggaggcaaaggg22<210>15<211>25<212>dna<213>artificialsequence<400>15cactgcttgtccagatgacttcggc25<210>16<211>26<212>dna<213>artificialsequence<400>16atttggaggatgtgccagaggtagtt26<210>17<211>29<212>dna<213>artificialsequence<400>17aacggaagatgaatgtcagtgctacacca29<210>18<211>28<212>dna<213>artificialsequence<400>18cctcgcatcatccttatgctatgacact28<210>19<211>30<212>dna<213>artificialsequence<400>19ctggtttgggcaagttacttaatctgtttg30<210>20<211>31<212>dna<213>artificialsequence<400>20ctcgcatcatccttatgctatgacactggac31<210>21<211>27<212>dna<213>artificialsequence<400>21catttggaggatgtgccagaggtagtt27<210>22<211>27<212>dna<213>artificialsequence<400>22cagggcatctgaatctcgaaacctcca27<210>23<211>25<212>dna<213>artificialsequence<400>23cccagaccacattggcctatttcct25<210>24<211>25<212>dna<213>artificialsequence<400>24cagggcatctgaatctcgaaacctc25<210>25<211>27<212>dna<213>artificialsequence<400>25catttggaggatgtgccagaggtagtt27<210>26<211>25<212>dna<213>artificialsequence<400>26ccacattggcctatttcctcctctt25<210>27<211>22<212>dna<213>artificialsequence<400>27gtgtaacacgtctatacgccca22<210>28<211>23<212>dna<213>artificialsequence<400>28acgcggtctcggcggtggtggcg23<210>29<211>31<212>dna<213>artificialsequence<400>29gggaaggaaaggacaagaagccctgagcacg31<210>30<211>30<212>dna<213>artificialsequence<400>30tcacgccctgggaaggaaaggacaagaagc30<210>31<211>30<212>dna<213>artificialsequence<400>31cgcctagaagcatttgcggtggacgatgga30<210>32<211>27<212>dna<213>artificialsequence<400>32tagcgggccactcacctgggtcatctt27<210>33<211>29<212>dna<213>artificialsequence<400>33gccaccagaagaggtagcgggccactcac29<210>34<211>25<212>dna<213>artificialsequence<400>34cctcctgagcgcaagtactccgtgt25<210>35<211>33<212>dna<213>artificialsequence<400>35cataggaatccttctgacccatgcccaccatca33<210>36<211>27<212>dna<213>artificialsequence<400>36tgagggcaggacttagcttccacagca27<210>37<211>29<212>dna<213>artificialsequence<400>37ccacatctgctggaaggtggacagcgagg29<210>38<211>25<212>dna<213>artificialsequence<400>38acaagcgaattactgtgaaagtcaa25<210>39<211>24<212>dna<213>artificialsequence<400>39agttcatgttcagaggtgactgga24<210>40<211>20<212>dna<213>artificialsequence<400>40tctctgctcctcctgttcga20<210>41<211>20<212>dna<213>artificialsequence<400>41gcgcccaatacgaccaaatc20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 带DNA分子探针的石墨烯微电极电化学检测传感器的制造方法与工艺
- 一种小型化时间分辨的激光泵浦X射线探测仪的制造方法与工艺
- 一种气冷高温稳态压力探针的制造方法与工艺
- 基于超磁致伸缩与石英摆线复合机理的隔微振装置的制造方法
- 纳米材料制备装置及纳米材料制备方法与流程
- 一种用于EB病毒荧光定量PCR检测的引物和探针组、及试剂盒的制造方法与工艺
- 一种用于鉴定川贝母及伪品的荧光PCR检测引物、探针组合物、试剂盒及检测方法与应用与流程
- 用于基因甲基化检测的引物和探针、采样方法、试剂盒与流程
- 一种基于荧光PCR检测ESR1基因突变的引物及探针的制造方法与工艺
- 转基因甜菜GTSB77品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程