可控自催化切割介导荧光恢复检测hAAG的传感器及方法与流程
本公开属于生物分析技术,涉及可控自催化切割介导荧光恢复检测haag的传感器及方法。
背景技术:
这里的陈述仅提供与本公开有关的背景信息,而不必然构成现有技术。
沃森-克里克碱基配对的dna双螺旋结构是生物体中重要的遗传密码。在现实中,由于杂环碱基(即a,t,g和c)含有大量的亲核或氧化活性位点,因此容易与细胞外和内源性产生的亲电子或活性氧反应产生大量dna烷基化和氧化损伤(例如3-烷基腺嘌呤,7-烷基鸟嘌呤,1-n2-乙烯鸟嘌呤,1-n6-乙烯基腺嘌呤,次黄嘌呤等)。最近研究表明,烷基化和氧化损伤可通过阻碍聚合酶而抑制dna复制或产生dna突变,最终导致癌症的发生。迄今为止,在人类细胞中,人烷基腺嘌呤dna糖基化酶(haag)是唯一能够特异性识别和切除多种dna烷基化和氧化损伤的糖基化酶,其功能的异常将导致烷基化dna损伤修复机制的失灵,从而引发多种人类疾病(如慢性炎症,克罗恩病和威尔森氏病)和癌症(如结肠癌,肝癌,肺癌,子宫颈癌,胶质母细胞瘤,淋巴瘤,黑色素瘤和白血病)。
据本公开发明人所知,到目前为止,开发的用于haag测定的方法仅有基于放射磷(γ-32p)标记dna底物的凝胶电泳法,基于辣根过氧化物酶偶联的免疫球蛋白介导的免疫印迹分析法,以及基于修复反应分子信标介导的单分子计数法。但是,经本公开发明人研究,这些方法具有放射性污染,耗时耗力的操作,严格的反应条件、低准确性以及需要昂贵的抗体和精密的仪器等缺点。
技术实现要素:
为了解决现有技术的不足,本公开的目的是提供可控自催化切割介导荧光恢复检测haag的传感器及方法,可用于高效、灵敏地检测人烷基腺嘌呤dna糖基化酶(haag)的活性。
为了实现上述目的,本公开的技术方案为:
一方面,一种基于可控自催化切割介导的荧光恢复检测haag的传感器,包括发夹探针1、发夹探针2、信号探针、人脱嘌呤/脱嘧啶核酸内切酶(ape1)和t7核酸外切酶;
发夹探针1为5'-oh末端凸出的茎环结构的dna,发夹探针1的5'-oh末端的茎修饰一个能够被haag识别的2'-脱氧肌苷(i),2'-脱氧肌苷位于距离环3个碱基的位点处,发夹探针1含有触发探针1,触发探针1为2'-脱氧肌苷至3'末端的dna序列,触发探针1含有能够和发夹探针2的第二dna序列互补的第一dna序列,第一dna序列为2'-脱氧肌苷和与2'-脱氧肌苷配对的碱基位点之间的dna序列;
发夹探针2为5'-oh末端凸出的茎环结构的dna,发夹探针2由触发探针2和第二dna序列组成,第二dna序列为5'-oh末端凸出的dna序列,触发探针2含有能够与信号探针互补的第三dna序列,第三dna序列的一部分位于茎上,第三dna序列的另一部分位于环上;
信号探针为单链dna,信号探针两端分别修饰荧光团和淬灭剂。
酶介导的循环信号扩增(cesa)是一种基于核酸酶,引入一个靶标能导致靶标依赖性核酸酶循环切割信号探针以输出放大的信号,本公开选择性地利用t7核酸外切酶来构建新的cesa系统,即基于可控自催化切割介导的荧光恢复,实现对haag活性的简便、高灵敏和高特异的检测。t7核酸外切酶(t7exonuclease)是一种独特的序列非依赖性核酸酶,它可以选择性地催化单核苷酸从5'-磷酰基(po4)或5'-羟基(oh)末端或双链dna(dsdna)的切口或缺口处起始消化,但不作用于单链dna(ssdna))。此外,t7核酸外切酶还可以沿5'到3'方向降解rna/dna杂交双链上的rna或dna,但不能降解双链或单链rna。更重要的是,t7核酸外切酶可以高分辨率地区分单碱基错配。
当在haag存在下,发夹探针1(hp1)在受损的2'-脱氧肌苷位点被特异性切割,从而导致发夹结构展开以产生dna双链体。构建在dna双链体中的触发探针1(trigger1)将通过粘性末端介导的链置换反应(tmsdr)与发夹探针2(hp2)部分杂交以诱导t7核酸外切酶催化hp2的第一次循环切割以释放触发探针2(trigger2)。触发探针2(trigger2)的第三dna序列与信号探针部分互补,进而诱导信号探针的第二次循环切割。通过两步循环自催化切割过程,从荧光团-淬灭剂荧光共振能量转移(fret)对中释放出大量的荧光分子,最终产生用于haag活性检测的显著增强的荧光信号,从而实现简单、快速和灵敏的检测。
另一方面,一种基于可控自催化切割介导的荧光恢复检测haag的方法,提供上述传感器;当haag存在时,haag与ape1在发夹探针1的2'-脱氧肌苷位点处特异性识别并切割发夹探针1,使得发夹探针1展开发夹结构,产生具有凸出的5'-oh和5'-drp末端的dsdna双链体i,dsdna双链体i中突出的5'-drp末端通过粘性末端介导的链置换反应,使触发探针1的第一dna序列与发夹探针2的第二dna序列杂交,形成具有凹陷的5'-oh末端的dsdna双链体ii,dsdna双链体ii作为t7核酸外切酶的底物,在t7核酸外切酶的作用下,使发夹探针2中凹陷的5'-oh末端特异性水解,释放触发探针1并同时释放出发夹探针2中的触发探针2,释放的触发探针1与过量的发夹探针2杂交,诱导t7核酸外切酶催化发夹探针hp2的第一次循环切割以释放多个触发探针2,触发探针2的第三dna序列与信号探针杂交,形成具有凹陷的5'-oh末端的dsdna双链体iii,dsdna双链体iii作为t7核酸外切酶的底物,从凹陷的5'-oh末端对信号探针进行连续消化,从而释放触发探针2和荧光团,释放的触发探针2与游离的信号探针杂交以诱导t7核酸外切酶催化第二次循环切割信号探针,从而释放出大量的荧光团,产生放大的荧光信号。
而当haag不存在情况下,不能识别发夹探针hp1中的2'-脱氧肌苷损伤位点,发夹探针hp1也不会被ape1切割。因此具有凸出的5'-oh末端的发夹探针hp1和hp2会阻碍t7核酸外切酶辅助的自催化再循环切割过程,无法产生增强的荧光信号。
第三方面,一种检测haag的试剂盒,包括上述传感器和缓冲溶液。
本公开的有益效果为:
1.本公开基于可控自催化切割介导的荧光恢复来高灵敏和高特异地检测人类烷基腺嘌呤dna糖基化酶活性,实现了荧光信号的两步放大,具有超高的灵敏度和较高的分辨率,本公开的检出限为4.9×10-6个单位每微升,灵敏度的检测范围为1×10-5~0.1个单位每微升的4个数量级,因此本公开可以高效、灵敏地检测人类烷基腺嘌呤dna糖基化酶的活性。
2.本公开利用dna修复系统的高精确性和t7核酸外切酶对单碱基错配的高分辨率,只有haag可以在2'-脱氧肌苷位点处特异性识别和切除发夹底物,从而诱导t7核酸外切酶辅助的自催化再循环荧光信号放大,较高的信噪比保证了本公开的高特异性。
3.本公开不需要繁琐的洗涤、转移、分离步骤,不涉及任何热循环,大大简化了检测程序。
附图说明
构成本公开的一部分的说明书附图用来提供对本公开的进一步理解,本公开的示意性实施例及其说明用于解释本公开,并不构成对本公开的不当限定。
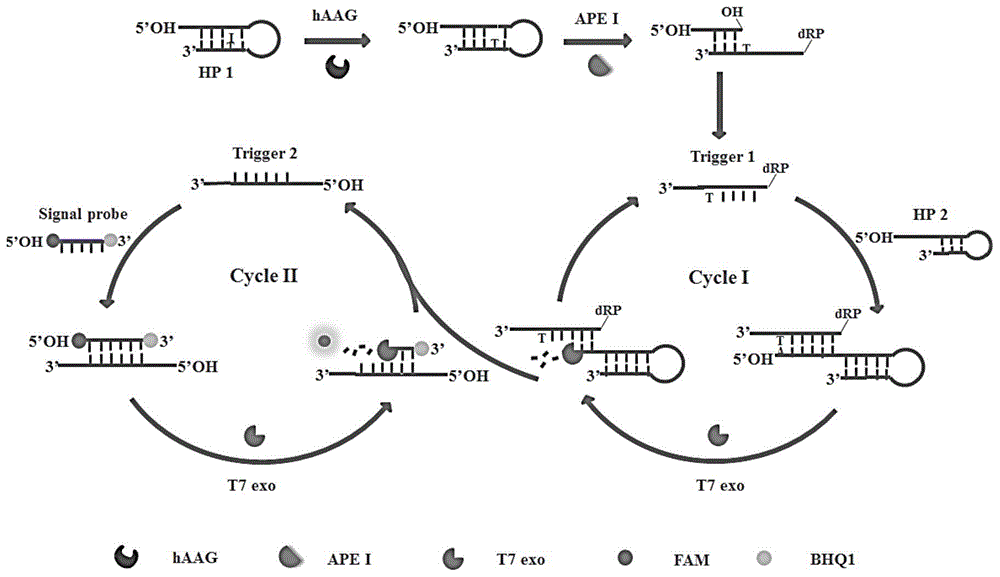
图1为本公开实施例1的原理图;
图2为实施例1原理验证的表征图,a为非变性聚丙烯酰胺凝胶电泳对在不同实验条件下haag引导的发夹底物切割反应产物的分析图,泳道m是dna标记(dnamarker),泳道1为合成的发夹探针hp1的裂解产物,泳道2为合成的触发探针1,泳道3为合成的发夹探针hp1,泳道4为在ape1+hp1存在下的反应产物,泳道5为在haag+ape1+hp1存在下的反应产物,b为用非变性聚丙烯酰胺凝胶电泳对t7核酸外切酶辅助自催化再循环切割反应产物的分析图,泳道m是dna标记(dnamarker),泳道1为在haag不存在下的反应产物,泳道2为合成的触发探针2,泳道3为在haag存在下的反应产物,该表征图中采用sybrgold作为荧光指示剂,haag和ape1的浓度分别为0.1个单位每微升和0.3个单位每微升;
图3为实施例1的灵敏度表征图,a为不同浓度(0、1×10-5u/μl、5×10-5u/μl、2.5×10-4u/μl、5×10-4u/μl、2.5×10-3u/μl、5×10-3u/μl、2.5×10-2u/μl、1×10-1u/μl)的haag的荧光光谱的变化曲线,b为荧光强度随haag浓度从1×10-5u/μl到0.1u/μl的变化曲线,图b插图为在1×10-5u/μl到0.1u/μl的范围内,荧光强度与haag浓度的对数之间的线性关系,误差棒表示三次独立实验的标准偏差。
图4为实施例1的特异性实验表征图,在对照(仅反应缓冲液),0.1g/lbsa,0.1g/ligg,0.1u/μlhogg1和0.1u/μlhaag存在下的荧光强度的变化柱状图,误差棒表示三次独立实验的标准偏差。
具体实施方式
应该指出,以下详细说明都是示例性的,旨在对本公开提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本公开所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本公开的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
本公开提出了可控自催化切割介导荧光恢复检测haag的传感器及方法,可用于高效、灵敏地检测人烷基腺嘌呤dna糖基化酶(haag)的活性。
本公开的一种典型实施方式,提供了一种基于可控自催化切割介导的荧光恢复检测haag的传感器,包括发夹探针1、发夹探针2、信号探针、人脱嘌呤/脱嘧啶核酸内切酶(ape1)和t7核酸外切酶;
发夹探针1为5'-oh末端凸出的茎环结构的dna,发夹探针1的5'-oh末端的茎修饰一个能够被haag识别的2'-脱氧肌苷(i),2'-脱氧肌苷位于距离环3个碱基的位点处,发夹探针1含有触发探针1,触发探针1为2'-脱氧肌苷至3'末端的dna序列,触发探针1含有能够和发夹探针2的第二dna序列互补的第一dna序列,第一dna序列为2'-脱氧肌苷和与2'-脱氧肌苷配对的碱基位点之间的dna序列;
发夹探针2为5'-oh末端凸出的茎环结构的dna,发夹探针2由触发探针2和第二dna序列组成,第二dna序列为5'-oh末端凸出的dna序列,触发探针2含有能够与信号探针互补的第三dna序列,第三dna序列的一部分位于茎上,第三dna序列的另一部分位于环上;
信号探针为单链dna,信号探针两端分别修饰荧光团和淬灭剂。
当在haag存在下,发夹探针1(hp1)在受损的2'-脱氧肌苷位点被特异性切割,从而导致发夹结构展开以产生dna双链体。构建在dna双链体中的触发探针1(trigger1)将通过粘性末端介导的链置换反应(tmsdr)与发夹探针2(hp2)部分杂交以诱导t7核酸外切酶催化hp2的第一次循环切割以释放触发探针2(trigger2)。触发探针2(trigger2)的第三dna序列与信号探针部分互补,进而诱导信号探针的第二次循环切割。通过两步循环自催化切割过程,从荧光团-淬灭剂荧光共振能量转移(fret)对中释放出大量的荧光分子,最终产生用于haag活性检测的显著增强的荧光信号。从而实现简单、快速和灵敏的检测。
该实施方式的一种或多种实施例中,所述荧光团和淬灭剂分别修饰在信号探针的5'末端和3'末端。
该实施方式的一种或多种实施例中,所述荧光团为fam,所述淬灭剂为bhq1。
该实施方式的一种或多种实施例中,发夹探针1的序列为:5'-gtagtgaggtaggttgtatigttgggttgaactatacaacctacc-3'(其中下划线碱基i为2'-脱氧肌苷)
发夹探针2的序列为:5'-tgtatagttcaacccgggacctaagagcattctacacctcttaggtccctgc-3'
信号探针的序列为:5'-aagaggtgta-3'。
本公开的另一种实施方式,提供了一种基于可控自催化切割介导的荧光恢复检测haag的方法,提供上述传感器;当haag存在时,haag与ape1在发夹探针1的2'-脱氧肌苷位点处特异性识别并切割发夹探针1,使得发夹探针1展开发夹结构,产生具有凸出的5'-oh和5'-drp末端的dsdna双链体i,dsdna双链体i中突出的5'-drp末端通过粘性末端介导的链置换反应,使触发探针1的第一dna序列与发夹探针2的第二dna序列杂交,形成具有凹陷的5'-oh末端的dsdna双链体ii,dsdna双链体ii作为t7核酸外切酶的底物,在t7核酸外切酶的作用下,使发夹探针2中凹陷的5'-oh末端特异性水解,释放触发探针1并同时释放出发夹探针2中的触发探针2,释放的触发探针1与过量的发夹探针2杂交,诱导t7核酸外切酶催化发夹探针hp2的第一次循环切割以释放多个触发探针2,触发探针2的第三dna序列与信号探针杂交,形成具有凹陷的5'-oh末端的dsdna双链体iii,dsdna双链体iii作为t7核酸外切酶的底物,从凹陷的5'-oh末端对信号探针进行连续消化,从而释放触发探针2和荧光团,释放的触发探针2与游离的信号探针杂交以诱导t7核酸外切酶催化第二次循环切割信号探针,从而释放出大量的荧光团,产生放大的荧光信号。
而当haag不存在情况下,不能识别发夹探针hp1中的2'-脱氧肌苷损伤位点,发夹探针hp1也不会被ape1切割。因此具有凸出的5'-oh末端的发夹探针hp1和hp2会阻碍t7核酸外切酶辅助的自催化再循环切割过程,无法产生增强的荧光信号。
该实施方式的一种或多种实施例中,其步骤为:
(1)将发夹探针1加入至含有haag、10×thermopol反应缓冲液、ape1、10×nebuffer4的第一溶液中加热孵育;
(2)将步骤(1)的物料添加至含有发夹探针2、信号探针、t7核酸外切酶、10×nebuffer4的第二溶液中进行孵育;
(3)对步骤(2)孵育后的物料进行荧光检测。
该系列实施例中,步骤(1)中孵育条件:温度为37±0.5℃,时间为60~90min。
该系列实施例中,步骤(1)的第一溶液中,ape1的浓度为0.3个单位每微升;每20微升第一溶液含有2微升10×thermopol反应缓冲液、2微升10×nebuffer4。
该系列实施例中,步骤(1)中,发夹探针1的溶液与第一溶液的体积比为1:9.5~10.5,发夹探针1的溶液中发夹探针1的浓度为1微摩尔每升。
该系列实施例中,步骤(2)中孵育条件:温度为25±0.5℃,时间为50~60min。
该系列实施例中,步骤(2)的第二溶液中,发夹探针2的浓度为250纳摩尔每升,信号探针的浓度为700纳摩尔每升,t7核酸外切酶的浓度为15个单位每20微升,每20微升第二溶液含有2微升10×nebuffer4。
该系列实施例中,步骤(2)中,步骤(1)的物料与第二溶液的体积比为1:4.5~5.5。
该系列实施例中,步骤(3)中,检测激发波长为491nm,发射波长为520nm。
为了使发夹探针1、2孵育成茎环结构,该实施方式的一种或多种实施例中,采用杂交缓冲液将单链发夹探针1和/或单链发夹探针2稀释,再加热至95℃孵育5min,然后冷却至室温,单链发夹探针1和/或单链发夹探针2形成茎环结构。
本公开的第三种实施方式,提供了一种检测haag的试剂盒,包括上述传感器和缓冲溶液。
本公开设计了两个发夹探针(即hp1和hp2),都具有突出的5'-oh末端,为了有效防止t7核酸外切酶的消化。在发夹探针hp1中,在茎上距离环3个碱基的位点处修饰一个2'-脱氧肌苷(i),该损伤位点可以被haag识别。信号探针是包含10nt的dna序列,分别在5'和3'末端修饰荧光团(fam)和淬灭剂(bhq1),其中fam的荧光通过荧光能量共振转移(fret)被bhq1淬灭。t7核酸外切酶是该cesa系统的“核心”,负责自催化循环信号放大的运行。本公开主要包括两个连续的反应步骤:(1)在haag和ape1存在下,特异性切割发夹探针hp1上的2'-脱氧肌苷位点,(2)t7核酸外切酶辅助的自催化循环信号放大。在haag存在下,它可以在2'-脱氧肌苷位点处特异性识别和切割发夹探针hp1,并展开发夹结构,同时产生具有凸出的5'-oh和5'-drp(脱氧核糖磷酸)末端的dsdna双链体(i)。dsdna双链体(i)中突出的5'-drp末端(即触发探针1)将通过粘性末端介导的链置换反应(tmsdr)与发夹探针hp2茎部分杂交,形成具有凹陷的5'-oh末端的dsdna双链体(ii)。这个新形成的dsdna双链体(ii)可以作为t7核酸外切酶的底物,然后从hp2中凹陷的5'-oh末端特异性水解,释放触发探针1并同时释放出hp2中的触发探针2。由于信号探针与触发探针2部分区域互补,释放的触发探针2将与信号探针杂交形成具有凹陷的5'-oh末端的dsdna双链体(iii),其可以再次作为t7核酸外切酶的底物,然后从凹陷的5'-oh末端对信号探针进行连续消化,最终dsdna双链体(iii)中的信号探针被选择性降解以释放fam分子,同时触发探针2保持完整而从dsdna(iii)中释放。在自催化切割过程中,由于发夹探针hp1和hp2中的5'-oh末端保持凸出状态,所以dsdna双链体中的触发探针1和触发探针2可免受t7核酸外切酶的切割。因此,释放的触发探针1可以与过量的发夹探针hp2部分杂交以诱导t7核酸外切酶催化发夹探针hp2的第一次循环切割以释放多个触发探针2,而释放的触发探针2可以与游离的信号探针杂交以诱导t7核酸外切酶催化第二次循环切割信号探针,释放出大量的fam分子。通过两步循环自催化切割过程,最终大量的荧光团分子(即fam)从信号探针中释放出来,产生显著放大的荧光信号。相反,在haag不存在情况下,发夹探针hp1不能被ape1在2'-脱氧肌苷位点处切割。因此具有凸出的5'-oh末端的发夹探针hp1和hp2可以阻碍t7核酸外切酶辅助的自催化再循环切割过程,导致无法检测到增强的荧光信号。利用体内dna修复机制的高精度,t7核酸外切酶催化单核苷酸水解的高特异,以及自催化再循环扩增反应的高效率,本公开的方法可用于简便、有效地检测haag活性。
为了使得本领域技术人员能够更加清楚地了解本公开的技术方案,以下将结合具体的实施例详细说明本公开的技术方案。
实施例1
dna修复控制t7核酸外切酶辅助的自催化循环信号放大:在进行扩增反应之前,用1×tris-edta缓冲溶液(10毫摩尔每升的三羟甲基氨基甲烷(tris),1毫摩尔每升的乙二胺四乙酸(edta),ph8.0)将所有合成的寡核苷酸溶解制备储备溶液,保存在-20摄氏度,然后用杂交缓冲液(1.5毫摩尔每升的氯化镁,10毫摩尔每升的三(羟甲基)氨基甲烷-盐酸(tris-hcl),ph8.0)将发夹探针(即hp1和hp2)稀释至1微摩尔每升,并在95摄氏度下孵育5分钟,然后缓慢冷却至室温以形成发夹结构。haag活性的测定包括两个连续的反应步骤。首先,将体积为2微升的hp1(1微摩尔每升)加入切除反应系统(20微升)中,包括haag,2微升10×thermopol反应缓冲液,0.3个单位每微升(u/μl)ape1,2微升10×nebuffer4,在37摄氏度温育60分钟。其次,将5微升上述切除产物加入到扩增反应系统(20微升)中,包括250纳摩尔每升hp2,700纳摩尔每升信号探针,15个单位的t7核酸外切酶,2微升10×nebuffer4,在25摄氏度下孵育50分钟,在避光的条件下以进行t7核酸外切酶辅助的自催化再循环扩增反应。
荧光测量和凝胶电泳分析:首先用超纯水将20微升扩增产物稀释至60微升,然后在491nm的激发波长下,通过hitachif-7000荧光分光光度计(东京,日本)在505-620nm的范围内扫描荧光光谱,记录520nm处的荧光强度以用于数据分析。为了分析切除产物和扩增产物,在室温110v恒定电压下,在1×tbe缓冲液(9纳摩尔每升tris-hcl,9毫摩尔每升硼酸,0.2毫摩尔每升edta,ph7.9)中进行12%非变性聚丙烯酰胺凝胶电泳(page)分析,以sybrgold作为荧光指示剂,电泳时间为45分钟,并用chemidocmp成像系统(hercules,california,u.s.a)分析。
发夹探针1的序列为:5'-gtagtgaggtaggttgtatigttgggttgaactatacaacctacc-3'(其中,碱基i为2'-脱氧肌苷),seqidno.1
发夹探针2的序列为:5'-tgtatagttcaacccgggacctaagagcattctacacctcttaggtccctgc-3',seqidno.2
信号探针的序列为:5'-aagaggtgta-3'(其中5'和3'末端分别修饰了荧光团fam和淬灭剂bhq1),seqidno.3
切割片段的序列为:5'-gtagtgaggtaggttgtat-3',seqidno.4
触发探针1的序列为:5'-gttgggttgaactatacaacctacc-3',seqidno.5
实验原理如图1所示,该实施例设计了两个发夹探针(即hp1和hp2)并且两者都有突出的5'-oh末端,在发夹探针hp1中,在茎上距离环3个碱基的位点处修饰一个2'-脱氧肌苷(i)损伤位点,该损伤位点可以被haag的识别。在haag存在下,它将在2'-脱氧肌苷(i)位点处特异性识别和切割发夹探针hp1,导致发夹结构展开,同时产生具有凸出的5'-oh和5'-drp末端的dsdna双链体(i)(形成的dsdna双链体(i)中具有突出的5'-drp末端一条链将部分与发夹探针hp2上的部分区域互补)。通过粘性末端介导的链置换反应(tmsdr),形成具有凹陷的5'-oh末端的dsdna双链体(ii)。这种新形成的dsdna双链体(ii)可以作为t7核酸外切酶的底物,然后从hp2中凹陷的5'-oh末端特异性水解,释放触发探针1并同时释放出hp2中的触发探针2。由于信号探针与触发探针2部分区域互补,释放的触发探针2将与信号探针杂交形成具有凹陷的5'-oh末端的dsdna双链体(iii),其可以再次作为t7核酸外切酶的底物,然后从凹陷的5'-oh末端连续消化信号探针,最终dsdna双链体(iii)中的信号探针被选择性降解以释放fam分子,同时触发探针2保持完整而从dsdna(iii)中释放。通过两步循环自催化裂解过程,最终从信号探针中释放出大量的荧光分子(即fam),产生显著放大的荧光信号。相反,在haag不存在情况下,不能识别发夹探针hp1中的2'-脱氧肌苷损伤位点,发夹探针hp1也不会被ape1切割。因此具有凸出的5'-oh末端的发夹探针hp1和hp2会阻碍t7核酸外切酶辅助的自催化再循环切割过程,无法产生增强的荧光信号。
原理的实验验证
为了验证本公开的可行性,本实施例选用非变性凝胶电泳来分析产物。如图2a所示,在ape1+hp1存在的情况下,仅观察到与单独发夹探针hp1(45nt)(图2a,泳道3)同一位置的一条带(图2a,泳道4),这表明无haag不能诱导发夹探针hp1的切割。在haag+ape1+hp1存在的情况下,检测到19nt和25nt的特征带(图2a,泳道5),这正是19nt裂解产物(图2a,泳道1)和25nt触发探针1(图2a,泳道2)的大小,证明haag可以特异性地切除2'-脱氧肌苷并诱导ape1介导的hp1切割以产生两个短dna片段(即19nt裂解产物和25nt触发探针1)。此外,为了研究t7核酸外切酶辅助的自催化再循环切割过程,取5μl上述切割产物(图2a,泳道4和5)加入到含有hp2,信号探针和t7核酸外切酶的20μl扩增反应系统中,进行自催化循环切割反应。在反应终止后,进一步使用非变性凝胶电泳来分析反应产物。如图2b所示,在不存在haag的情况下,仅检测到hp2的条带(52nt),这意味着没有发生切割反应(图2b,泳道1)。在存在haag的情况下,另一个特征带(25nt)被观察到(图2b,泳道3),它们与合成的触发探针1(25nt)的大小完全一致(图2b,泳道2)。实验结果表明25nt触发探针1(即haag和ape1催化的hp1的裂解产物)可以通过tmsdr与hp2部分杂交以启动t7核酸外切酶催化的hp2再循环切割以释放大量的触发探针2(25nt,图2b,泳道3)。因此,上述凝胶电泳实验(图2a和图2b)清楚地证明了haag和ape1可以催化发夹探针hp1在2'-脱氧肌苷位点处的切割以产生25nt触发探针1,其可以成功诱导随后的t7核酸外切酶辅助的自催化再循环hp2切割,释放触发探针1。更重要的是,在ape1+hp1(图2a,泳道4),haag+ape1+hp1(图2a,泳道5)和haag+ape1+t7核酸外切酶+hp1+hp2(图2b,泳道3)存在的情况下,没有显示额外的条带,证明dna修复控制的t7核酸外切酶辅助自催化再循环扩增的高特异性,无非特异性dna片段产生。高特异性可归因于这三个因素:(1)体内dna修复机制的高准确性,(2)haag催化的2'-脱氧肌苷切除的高特异性,和(3)t7核酸外切酶催化的单碱基错配的高分辨率。
灵敏度实验
在最佳实验条件下,评估本公开检测人类烷基腺嘌呤dna糖基化酶活性的灵敏度,本实施例对其进行不同浓度的分析测定,结果如图3所示。随着haag浓度从1×10-5u/μl增加到0.1u/μl,荧光强度相应增强,这表明荧光信号的增强高度依赖于haag的浓度。荧光强度与haag浓度的对数在一定浓度范围内呈现出良好的线性关系,线性回归方程式为f=5137.9+901.8log10c,相关系数为0.9942,其中f代表荧光强度,c代表haag浓度(u/μl),计算出检测限低至4.9×10-6u/μl。
特异性实验
为了证实本公开的良好选择性,本实施例对非特异性蛋白质(例如牛血清白蛋白(bsa)和免疫球蛋白g(igg)),8-氧鸟嘌呤-dna糖基化酶(hogg1))和haag的荧光强度进行了比较。如图4所示,在bsa、igg和hogg1以及反应缓冲液存在下仅观察到微弱的荧光信号。只有在haag存在情况下,可以检测到高的荧光信号。实验结果表明,只有haag可以在2'-脱氧肌苷位点特异性识别和切除发夹底物(即发夹探针hp1),以诱导t7核酸外切酶辅助的自催化再循环信号放大。因此,本公开可以抵抗其他蛋白的干扰,具有很好的特异性。
以上所述仅为本公开的优选实施例而已,并不用于限制本公开,对于本领域的技术人员来说,本公开可以有各种更改和变化。凡在本公开的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本公开的保护范围之内。
sequencelisting
<110>山东师范大学
<120>可控自催化切割介导荧光恢复检测haag的传感器及方法
<130>
<160>5
<170>patentinversion3.3
<210>1
<211>45
<212>dna
<213>人工序列
<400>1
gtagtgaggtaggttgtatigttgggttgaactatacaacctacc45
<210>2
<211>52
<212>dna
<213>人工序列
<400>2
tgtatagttcaacccgggacctaagagcattctacacctcttaggtccctgc52
<210>3
<211>10
<212>dna
<213>人工序列
<400>3
aagaggtgta10
<210>4
<211>19
<212>dna
<213>人工序列
<400>4
gtagtgaggtaggttgtat19
<210>5
<211>25
<212>dna
<213>人工序列
<400>5
gttgggttgaactatacaacctacc25
- 还没有人留言评论。精彩留言会获得点赞!