一种去除真菌中细菌污染的方法与流程
本发明属于微生物技术领域,特别是涉及一种去除真菌中细菌污染的方法。
背景技术:
在真菌培养过程中,包括食用真菌栽培、有益真菌菌株的保存、培养和利用以及病原真菌的分离、培养和研究等过程中,杂菌的污染无处不在,造成污染的常见微生物包括细菌、真菌、支原体和螨虫等。真菌如霉菌和酵母菌在培养条件下生长很快,它们所引起的污染很容易观察到,菌种也可根据它们在培养基上的菌落特征和显微观察的方法鉴定出来,而细菌污染存在一定的潜伏期,甚至在几代培养后才表现出来,故细菌的去除显得更为棘手和重要。
细菌性污染多为黏液状菌斑,主要由芽孢杆菌、大肠杆菌等细菌引起,根据细菌存在部位又分为表面细菌污染和内生细菌污染。表面细菌污染常在接种1~2天后表现出来,而内生细菌引起的污染,在刚接种时表现不明显,随着培养转接次数的增加,菌量逐渐累积,才在培养基上显现出来。当前,所用消除细菌染的方法主要是在培养基上使用抗生素,同时根据具体真菌菌种与细菌污染的生长速度进行分离和污染去除,都有一定效果。另外,也有报道称培养基中有机物的存在是污染产生的重要原因,故去除培养基有机物是减少污染的一条途径。虽然目前可以通过抗生素和减少有机物等一些方法减少污染,但是,对于一些细菌的去除,这些处理方法多多少少都有着各自的一些不足。
抗生素常作为预防污染作用而加入到培养基中,或者在己鉴定出细菌污染的情况下,用于抑制细菌生长或消灭细菌,但是,由于细菌和真菌种类的多样性,抗生素使用的种类和浓度变化很大。另外,抗生素制菌谱不一,尚没有一种抗生素对所有的细菌都有效,而且药效期短,抗生素一般不稳定,遇酸、碱或加热都易分解而失去活性,单一抗生素抑菌,易产生抗药性,一旦停止使用,污染率又显著上升,高浓度的抗生素会影响植物的生长。鉴于此,抗生素只能作为一种辅助防止污染的措施。当然,也有人为了抑菌效果更好会添加双抗,即抗革兰氏阳性菌和抗革兰氏阴性菌两种抗生素,但是,双抗的抑菌效果有时候并不明显。总结的说,抗生素对于细菌的抑制缺少稳定性和高效性。在培养基中减少有机物来抑制细菌的生长这一方法,在一定程度上也会对真菌或者我们所需要的菌株产生影响,所以这一方法并非优选。
由此可见,现在急需一种高效稳定的方法来抑制或去除细菌的生长,为减少生物实验中的细菌污染奠定更坚实的基础。
技术实现要素:
本发明的目的是针对目前缺乏高效稳定的细菌去除体系,受抗生素限制很大,且抑菌效果不明显,提供去除真菌中细菌污染的方法,尤其是固体培养基平板培养条件下真菌中细菌污染的去除。
为了达到上述的目的,本发明采取以下技术方案:
一种去除真菌中细菌污染的方法,包括以下步骤:
(1)将备好的真菌培养基高温灭菌后倒入无菌培养皿中,带培养基凝固后,在培养基平板上切割出一个以上小孔;
(2)挑取合适大小的样品置于切割出的小孔内;
(3)盖上无菌盖玻片,轻压盖玻片四周使其与培养基紧密接触,保证培养基和盖玻片之间不留有气泡;
(4)将步骤(3)得到的培养基放入恒温恒湿培养箱中培养;
(5)挑取盖玻片周围新长出的真菌菌丝,重新接种到新的真菌培养基上培养得到真菌菌落。
进一步地,在上述方法中,所述真菌包括稻瘟病菌、赤霉病菌(fusariumgraminearum)、炭疽病菌(colletotrichumgloeosporioides)、纹枯病菌(rhizoctoniasolani)或葡萄溃疡病病菌(botryosphaeriarhodina);优选的,所述稻瘟病菌包括guy-11、70-15、2539或th3。
进一步地,在上述方法中,所述细菌包括大肠杆菌(escherichiacoli)、农杆菌(agrobacteriumtumefaciens)或芽孢杆菌(bacillus)。
进一步地,在上述方法中,所述真菌培养基包括cm培养基、pda培养基、mea培养基或oa培养基。
进一步地,所述小孔是直径为3-5mm的圆形小孔或者边长为3-5mm的方形小孔。
进一步地,切割小孔的工具包括无菌牙签或打孔器。
进一步地,所述步骤(4)培养温度为25-28℃,培养湿度为30%-70%。
进一步地,所述步骤(4)培养天数根据真菌生长情况而定,优选的,培养7-10天。
本发明通过在培养基平板切割出小孔的操作,使得接种在小孔中并盖上盖玻片的真菌菌丝穿过小孔周围的培养基绕过盖玻片,在盖玻片边缘长出并逐渐扩展,而真菌中混有的细菌则无法穿过培养基,只能留在盖玻片和小孔形成的封闭空间中;接着,将盖玻片周围新长出的真菌用牙签接种到新的cm培养基上培养,通过这样的方式生长出来的真菌,细菌污染被很好的去除,各性状也明显优于初始菌株。
本发明具有以下技术特点:
1)本发明可以减少甚至避免抗生素的使用,摆脱传统方法所带来的认知,也避免了细菌耐药性的产生。
2)本发明细菌去除效果优、无反弹、适用性广;整个实验流程操作简单、工作量小、实验周期短,从初始菌株到纯化菌株只需10天左右。
附图说明
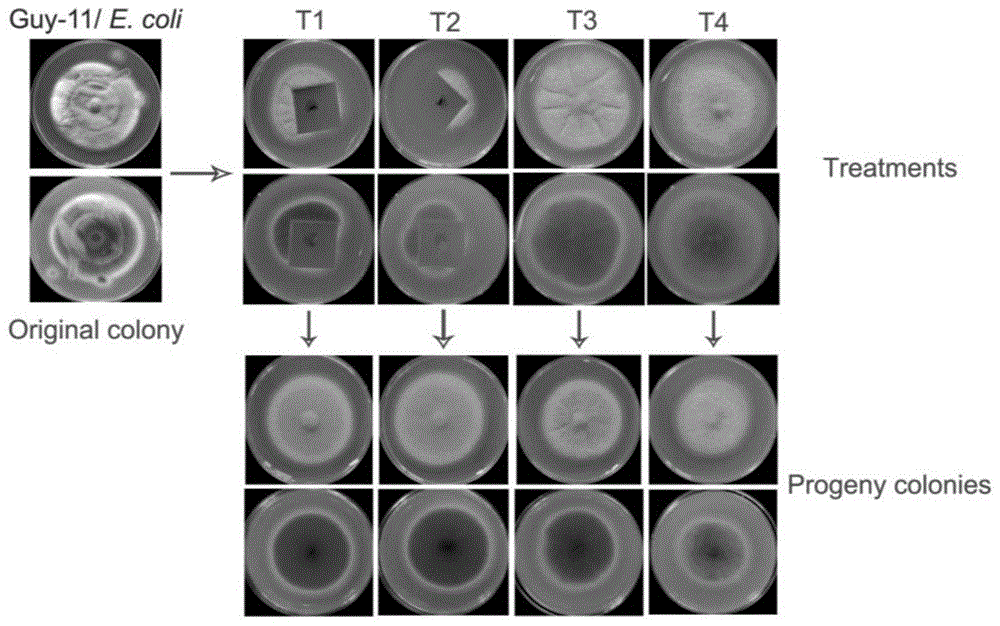
图1:稻瘟病菌magnaportheoryzae菌株guy-11中去除escherichiacoli(e.coli),其中:t1:不添加抗生素的cs法处理(antibiotic-freewithholes);t2:添加抗生素的培养基上的cs法处理(antibioticswithholes);t3:单纯用抗生素抑菌(antibioticswithoutholes);t4:不含抗生素培养基上的继代培养(antibiotic-freewithoutholes)。图上treatments为处理时培养基平板的正面和背面照片,progenycolonies为处理后的培养基平板的正面和背面照片。
图2:稻瘟病菌magnaportheoryzae菌株guy-11中去除农杆菌,其中:t1:不添加抗生素的cs法处理(antibiotic-freewithholes);t2:添加抗生素的培养基上的cs法处理(antibioticswithholes);t3:单纯用抗生素抑菌(antibioticswithoutholes);t4:不含抗生素培养基上的继代培养(antibiotic-freewithoutholes)。图上treatments为处理时培养基平板的正面照片,progenycolonies为处理后的培养基平板的正面和背面照片。
图3:稻瘟病菌magnaporthe菌株2539中去除农杆菌,其中:t1:不添加抗生素的cs法处理(antibiotic-freewithholes);t2:添加抗生素的培养基上的cs法处理(antibioticswithholes);t3:单纯用抗生素抑菌(antibioticswithoutholes);t4:不含抗生素培养基上的继代培养(antibiotic-freewithoutholes)。图上treatments为处理时培养基平板的正面照片,progenycolonies为处理后的培养基平板的正面照片。
图4:稻瘟病菌magnaportheoryzae菌株70-15中去除农杆菌,其中:t1:不添加抗生素的cs法处理(antibiotic-freewithholes);t2:添加抗生素的培养基上的cs法处理(antibioticswithholes);t3:单纯用抗生素抑菌(antibioticswithoutholes);t4:不含抗生素培养基上的继代培养(antibiotic-freewithoutholes)。图上treatments为处理时培养基平板的正面照片,progenycolonies为处理后的培养基平板的正面照片。
图5:稻瘟病菌magnaportheoryzae菌株th3中去除农杆菌,其中:t1:不添加抗生素的cs法处理(antibiotic-freewithholes);t2:添加抗生素的培养基上的cs法处理(antibioticswithholes);t3:单纯用抗生素抑菌(antibioticswithoutholes);t4:不含抗生素培养基上的继代培养(antibiotic-freewithoutholes)。图上treatments为处理时培养基平板的正面照片,progenycolonies为处理后的培养基平板的正面照片。
图6:赤霉病菌fusariumgraminearum中去除细菌bacteria,其中:t1:不添加抗生素的cs法处理(antibiotic-freewithholes);t2:添加抗生素的培养基上的cs法处理(antibioticswithholes);t3:单纯用抗生素抑菌(antibioticswithoutholes);t4:不含抗生素培养基上的继代培养(antibiotic-freewithoutholes)。图上treatments为处理时培养基平板的正面照片,progenycolonies为处理后的培养基平板的正面照片。
图7:炭疽菌colletotrichumgloeosporioides中去除细菌bacteria,其中:t1:不添加抗生素的cs法处理(antibiotic-freewithholes);t2:添加抗生素的培养基上的cs法处理(antibioticswithholes);t3:单纯用抗生素抑菌(antibioticswithoutholes);t4:不含抗生素培养基上的继代培养(antibiotic-freewithoutholes)。图上treatments为处理时培养基平板的正面照片,progenycolonies为处理后的培养基平板的正面照片。
图8:纹枯病菌rhizoctoniasolani中去除细菌bacteria,其中:t1:不添加抗生素的cs法处理(antibiotic-freewithholes);t2:添加抗生素的培养基上的cs法处理(antibioticswithholes);t3:单纯用抗生素抑菌(antibioticswithoutholes);t4:不含抗生素培养基上的继代培养(antibiotic-freewithoutholes)。图上treatments为处理时培养基平板的正面照片,progenycolonies为处理后的培养基平板的正面照片。
图9:葡萄溃疡病病菌botryosphaeriarhodina中去除细菌bacteria,其中:t1:不添加抗生素的cs法处理(antibiotic-freewithholes);t2:添加抗生素的培养基上的cs法处理(antibioticswithholes);t3:单纯用抗生素抑菌(antibioticswithoutholes);t4:不含抗生素培养基上的继代培养(antibiotic-freewithoutholes)。图上treatments为处理时培养基平板的正面照片,progenycolonies为处理后的培养基平板的正面照片。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例的技术方案进行清楚、完整的描述。显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于所描述的本发明的实施例,本领域普通技术人员在无需创造性劳动的前提下所获得的所有其他实施例,都属于本发明的保护范围。
除非另作定义,本公开所使用的技术术语或者科学术语应当为本发明所属领域内有一般技能的人士所理解的通常意义。
实施例1
供试材料:
水稻稻瘟病病原菌:稻瘟病菌(magnaportheoryzae)菌株采用由浙江省农业科学院植物保护与微生物研究所真菌病害室保存之菌种稻瘟病菌(magnaportheoryzae)guy-11。本实施例中的稻瘟病菌(magnaportheoryzae)guy-11被大肠杆菌(escherichiacoli,简称e.coli)污染。
具体按以下步骤进行:
(1)培养基的制备:根据稻瘟病菌在适用于真菌培养的培养基中生长速度的快慢,筛选了本方法用于去除真菌中细菌污染的cm培养基。其中,平皿培养的培养基(cm):为10g葡萄糖,2g蛋白胨,1g酵母提取物,1g酪蛋白氨基酸,50ml氮盐(20×nitratesalts;微量元素;维生素),琼脂18g,ddh2o定容到1000ml,1mnaoh溶液调节ph至6.5,121℃高压蒸汽灭菌15min而成。
(2)培养基的前期处理:将(1)中所得的培养基平皿用牙签或打孔器切割出一个3~5mm左右的方形或圆形小孔,并准备好灭过菌的盖玻片,待用。
(3)接种:将混有大肠杆菌的稻瘟病菌guy-11用牙签小心挑取适量至步骤(2)所切割出的小孔内。
(4)盖上玻片:接种后,用无菌镊子夹取已灭菌的盖玻片小心盖上,轻压盖玻片四周使其与培养基紧密接触,使得培养基和盖玻片之间不留有气泡。
(5)培养:将步骤(4)中经过处理的培养基放在28℃培养7天。
(6)查看真菌的生长情况。待盖玻片周围有菌丝长出后,用无菌牙签将新长出的真菌菌丝接种到新的cm培养基上培养,形成新的菌落即为细菌污染被去除的稻瘟病菌(magnaportheoryzae)guy-11菌株。
本发明约在7-10天内即可完成细菌的去除。接种在小孔中的稻瘟病菌guy-11菌丝穿过小孔在盖玻片边缘长出并逐渐扩展,而混有的大肠杆菌则无法穿过培养基而留在盖玻片和小孔形成的封闭空间中。将盖玻片周围新长出的稻瘟病菌guy-11菌丝用牙签重新接种到新的cm培养基上培养,通过这样的方式生长出来的菌落各性状明显优于初始菌株,很好起到了纯化的效果。具体如图1所示:t1和t2在效果上没有差别,处理后的稻瘟病菌guy-11菌株在培养基上生长良好,菌落饱满,色泽均一,产孢等性状恢复,得到很好的纯化。同时,t1相对t2节约了抗生素的使用。t3处理在使用抗生素压制后,细菌污染情况有所改善,但始终无法菌落完全纯化,性状也无法完全恢复。t4处理为在不含抗生素的培养基上单纯的继代培养,稻瘟病菌guy-11菌株的细菌污染情况无法改善,菌落生长速度,形态都受限,无法再用于科学研究和教学工作。对t1、t2、t3、t4处理后得到的稻瘟病菌guy-11菌株进行基因组dna提取,使用大肠杆菌特异的引物进行pcr检测。结果表明,t1和t2处理后,真菌中无法检测到大肠杆菌dna的片段。pcr检测结果进一步验证通过本发明的小孔隔绝法(cs法)可以有效去除稻瘟病菌guy-11菌株中的大肠杆菌。
实施例2,
选用被农杆菌污染的稻瘟病菌guy-11作为对象,其他同实施例1,对稻瘟病菌guy-11菌株进行农杆菌去除实验,实验结果如图2所示,t1和t2在效果上没有差别,稻瘟病菌guy-11在处理后得到纯化,在培养基上的生长速度、菌落性态、产孢等性状均得到恢复和改善。t1相对t2节约了抗生素的使用。t3处理后,有部分改善,但无法完全纯化真菌菌落。t4处理后,稻瘟病菌guy-11菌株的细菌污染和培养性状均无改善,无法再用于科学研究和教学工作。对t1、t2、t3、t4的菌株进行基因组dna提取,使用农杆菌特异的引物进行pcr检测。结果表明,t1和t2处理后,真菌中无法检测到农杆菌dna的片段。pcr检测结果进一步验证通过本发明的小孔隔绝法(cs法)可以有效去除稻瘟病菌guy-11菌株中的农杆菌。
实施例3:
选用被农杆菌污染的稻瘟病菌2539菌株作为对象,其他同实施例1,对稻瘟病菌2539菌株进行农杆菌去除实验。实验结果如图3所示,t1和t2在效果上没有差别,处理后的稻瘟病菌2539菌株在培养基上生长良好,菌落得到纯化,产孢等性状得到恢复。t3处理后,菌株有部分改善,但无法完全纯化真菌菌落。t4处理后,稻瘟病菌2539菌株的细菌污染和培养性状均无改善,无法再用于科学研究和教学工作。对t1、t2、t3、t4的菌株进行基因组dna提取,使用农杆菌特异的引物进行pcr检测。结果表明,t1和t2处理后,真菌中无法检测到农杆菌dna的片段。pcr检测结果进一步验证通过本发明的小孔隔绝法(cs法)可以有效去除稻瘟病菌2539菌株中的农杆菌。
实施例4:
选用被农杆菌污染的稻瘟病菌70-15菌株作为对象,其他同实施例1,对稻瘟病菌70-15菌株进行农杆菌去除实验。实验结果如图4所示,t1和t2在效果上没有差别,处理后的稻瘟病菌70-15菌株在培养基上生长良好,菌落得到纯化,产孢等性状得到恢复。t3处理后,菌株有部分改善,但无法完全纯化真菌菌落。t4处理后,稻瘟病菌70-15菌株的细菌污染和培养性状均无改善,无法再用于科学研究和教学工作。对t1、t2、t3、t4的菌株进行基因组dna提取,使用农杆菌特异的引物进行pcr检测。结果表明,t1和t2处理后,真菌中无法检测到农杆菌dna的片段。pcr检测结果进一步验证通过本发明的小孔隔绝法(cs法)可以有效去除稻瘟病菌70-15菌株中的农杆菌。
实施例5:
选用被农杆菌污染的稻瘟病菌th3菌株作为对象,其他同实施例1,对稻瘟病菌th3菌株进行农杆菌去除实验。实验结果如图5所示,t1和t2在效果上没有差别,处理后的稻瘟病菌th3菌株在培养基上生长良好,菌落得到纯化,产孢等性状得到恢复。t3处理后,菌株有部分改善,但无法完全纯化真菌菌落。t4处理后,稻瘟病菌th3菌株的细菌污染和培养性状均无改善,无法再用于科学研究和教学工作。对t1、t2、t3、t4的菌株进行基因组dna提取,使用农杆菌特异的引物进行pcr检测。结果表明,t1和t2处理后,真菌中无法检测到农杆菌dna的片段。pcr检测结果进一步验证通过本发明的小孔隔绝法(cs法)可以有效去除稻瘟病菌th3菌株中的农杆菌。
实施例6:
选用被细菌污染的赤霉病菌(fusariumgraminearum)作为对象,以pda为培养基,其他同实施例1,对赤霉病菌进行农杆菌去除实验,实验结果如图6所示,t1和t2在效果上没有差别,处理后的赤霉病菌在培养基上生长良好,菌落得到纯化,产孢等性状得到恢复。t3处理后,菌株有部分改善,但无法完全纯化真菌菌落。t4处理后,赤霉病菌的细菌污染和培养性状均无改善,无法再用于科学研究和教学工作。
实施例7:
选用被细菌污染的炭疽病菌(colletotrichumgloeosporioides)作为对象,以pda为培养基,其他同实施例1,对炭疽病菌进行农杆菌去除实验,实验结果如图7所示,t1和t2在效果上没有差别,处理后的炭疽病菌在培养基上生长良好,菌落得到纯化,产孢等性状得到恢复。t3处理后,菌株有部分改善,但无法完全纯化真菌菌落。t4处理后,炭疽病菌的细菌污染和培养性状均无改善,无法再用于科学研究和教学工作。
实施例8:
选用被细菌污染的纹枯病菌(rhizoctoniasolani)作为对象,以mea为培养基,其他同实施例1,对纹枯病菌进行农杆菌去除实验,实验结果如图8所示,t1和t2在效果上没有差别,处理后的纹枯病菌在培养基上生长良好,菌落得到纯化,产孢等性状得到恢复。t3处理后,菌株有部分改善,但无法完全纯化真菌菌落。t4处理后,纹枯病菌的细菌污染和培养性状均无改善,无法再用于科学研究和教学工作。
实施例9:
选用被细菌污染的葡萄溃疡病病菌(botryosphaeriarhodina)作为对象,以mea为培养基,其他同实施例1,对葡萄溃疡病病菌进行农杆菌去除实验,实验结果如图9所示,t1和t2在效果上没有差别,处理后的葡萄溃疡病病菌在培养基上生长良好,菌落得到纯化,产孢等性状得到恢复。t3处理后,菌株有部分改善,但无法完全纯化真菌菌落。t4处理后,葡萄溃疡病病菌的细菌污染和培养性状均无改善,无法再用于科学研究和教学工作。
对于所有参试的真菌,小孔隔绝法(cs法)的除菌效果远比抗生素好,整个实验操作简单,周期短,效果好,不易反复,而且不用抗生素节省了成本。而且本发明中,细菌是本发明人为添加的,实际中细菌污染的细菌含量多数情况下会小于这个添加的量,因此在应用实践中,细菌的去除效果都非常理想。在应用中,用本发明的方法进行过至少300次以上的细菌去除,包括不同的真菌种类和不同的细菌污染,有混生在真菌菌落中很难区分的细菌和用普通的抗生素方法很难去除的细菌。这些被污染的真菌所带有的细菌,大多数经过cs法处理1次便能去除,个别需要处理2次或3次,均可达到理想的除菌效果。去除细菌后的真菌菌株各培养性状都能恢复至正常,甚至优于原始的不带污染菌株。
目前,包括稻瘟病菌在内的植物病原真菌实验室继代培养过程中普遍存在着菌株退化、产孢量降低、致病性减弱等问题,产生这些问题的原因尚不清楚,可能和基因表达、翻译后修饰等过程有关。因此在研究中,需要长期保存原始菌株、尽量少继代、定期复壮等。以往的菌株复壮一般是重新接种到相应的寄主上,整个过程操作复杂,周期较长。本发明发现,cs处理后,除了污染被去掉了,真菌的其他性状,比如产孢量、黑色素、致病性等都有所改善,而抗生素处理很少有这样的效果产生。这其中的原因可能是在培养基的小孔中,真菌一方面在含有细菌的环境中,另一方面还要挣脱盖玻片的束缚,这样的情况下能顺利长出盖玻片的真菌各性状都是较好的。简单地说整个过程就是去除细菌的同时让真菌也进行简单地复壮,而cs法处理过程要比在寄主上进行菌株回接再分离要简单的多。
由于呼吸方式和运动性的不同,不同的细菌在培养基上和培养基内部生长和移动的能力也不同。理论上,厌氧细菌和具有鞭毛的细菌能够在固体培养基内部生长和扩展。本实验所用的两种细菌,大肠杆菌的代谢类型是异养兼性厌氧型,农杆菌是好氧型,二者都具有鞭毛。通过cs法,两者在不同的真菌菌株中都能被很好地去除,说明细菌的运动性一般不会对cs法的效果构成明显的影响。在应用中,及时的转接盖玻片周围新长出的菌丝,并尽量切取菌丝尖端。总之,本发明披露的cs法是一种上易操作、效果好、应用广的细菌去除方法。
以上实施例的说明只是用于帮助理解本发明方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!