一种用于构建细胞或组织病理模型的气体置换装置及其构建方法与流程
本发明属于生物医学技术领域。更具体地,涉及一种用于构建细胞或组织病理模型的气体置换装置及其构建方法。
背景技术:
将实验细胞或组织等放置在不同含量的氧气/二氧化碳/氮气环境中进行培养,是实验室模拟缺氧等病理环境的常用方法。目前,一般采用三气细胞培养箱(氧气、二氧化碳和氮气)进行气体交换。但是,因细胞培养箱体积大,需要不断充入气体来维持稳定的气体环境,而且实验细胞或组织造模时,需占用整个培养箱的空间资源,较为浪费。因此,开发结构简单、体积小巧、灵活组合的细胞或组织培养盒,对研究提供操作简便、经济环保的模拟缺氧等病理环境的方法具有重要意义。
目前,现有装置如国外进口的组合式细胞低氧培养罐(stemcelltechnologies,usa)虽然体积相对小巧,但具有价格高、订购周期长、零部件更新麻烦和无法灵活定制尺寸大小等缺陷和不足。另外,现有专利cn201520525373.0公开了一种低氧细胞胚胎等的培养装置,该装置采用低氧培养气袋进行气体置换和充气,然后用电热封口机对气袋口进行密封。该装置虽然能够模拟低氧细胞胚胎等的培养环境,对人无损且成本低;但是,该装置所采用的低氧培养气袋不可重复利用,气袋封口麻烦,且低氧培养气袋形状不能固定而不便放置多种培养器皿。因此,亟需研究开发一种结构简单、体积小巧、灵活组合、操作简便、经济环保、气体置换效率高、能够用于构建细胞或组织病理模型的装置。
技术实现要素:
本发明要解决的技术问题是克服现有能够模拟低氧细胞等培养环境的装置的缺陷和不足,提供一种用于构建细胞或组织病理模型的气体置换装置及其构建方法。
本发明的目的是提供一种用于构建细胞或组织病理模型的气体置换装置。
本发明另一目的是提供所述装置在构建细胞或组织病理模型中的应用。
本发明再一目的是提供一种构建细胞或组织病理模型的方法。
本发明上述目的通过以下技术方案实现:
本发明首先提供了一种用于构建细胞或组织病理模型的气体置换装置,包括气体置换部件和气体供给部件;所述气体置换部件包括培养盒、进气组件和出气组件;所述气体供给部件与进气组件通过气体导管相连接;所述培养盒由盒体和与其相配合的盒盖组成;所述进气组件由穿过盒盖的进气管和第一阀门组成;所述出气组件由穿过盒盖的出气管和第二阀门组成;所述进气管伸入盒体的管体长度短于出气管伸入盒体的管体长度。
优选地,所述气体供给部件包括依次连接的连接管、气体除菌过滤器、气体流量计、气体减压阀和混合气体瓶。
所述气体除菌过滤器用于对气体进行过滤除菌,保证细胞或组织在培养过程中的无菌状态。
所述气体流量计用于对气体的输入进行流量进行监测,控制气体流量。
优选地,所述气体导管套设于连接管上,以防止气体从连接管和气体导管的连接处溢出。
为了确保培养盒的气密性,优选地,所述盒体和盒盖间设置有密封组件;所述密封组件为设置在盒体和盒盖间的密封圈和密封卡扣装置。
更优选地,所述密封卡扣装置包括设置在盒盖边缘的卡扣固定条和设置在盒体上边缘的与卡扣固定条相适应的卡扣突出结构。
优选地,所述密封圈沿着盒盖的四周设置,以保证培养盒的气密性。
更优选地,所述密封圈为长方形密封圈。
为了防止气体从第一阀门和第二阀门与盒盖的连接处溢出,且保证培养盒内的气体平稳流通,优选地,所述第一阀门和第二阀门均包括依次固定密封连接的延伸接口、阀门开关、o型密封圈和螺母;所述进气管和出气管均由盒内管和盒外管组成,盒外管与延伸接口相连接,盒内管与螺母相连接;所述o型密封圈与盒盖相连接。
所述o型密封圈与盒盖相连接,以防止进气组件和出气组件与盒盖之间存在气体泄露的可能。
更优选地,所述o型密封圈与盒盖的下表面相连接。
所述盒外管、延伸接口、阀门开关、o型密封圈、螺母和盒内管之间形成密封的气体通路。
优选地,所述盒内管的外壁设置有与螺母相配合的螺纹结构。
优选地,所述连接管通过气体导管与进气管中的盒外管相连接。
为了在第一阀门和第二阀门的基础上,进一步保障培养盒的气密性,优选地,所述气体导管上设置有控制气体进出的开关装置。
更优选地,所述控制气体进出的开关装置为夹子。
为了方便操作,优选地,所述盒外管为软质材料管。
为了便于实验观察以及对培养盒进行酒精消毒和紫外消毒,以防细胞和组织发生污染,优选地,所述盒体和盒盖均为透明塑料材质。
为了便于操作和进一步增加该装置的气密性,优选地,所述气体导管、密封圈和o型密封圈均为橡胶材质。
所述装置在构建细胞或组织病理模型中的应用,也应在本发明的保护范围之内。
具体地,所述装置可用于细胞或组织在不同氧气/二氧化碳/氮气浓度条件下的培养、低氧或高氧病理模型的构建以及缺氧耐力的检测。
另外,本发明还提供了一种构建细胞或组织病理模型的方法,将细胞或组织放入盒体内,用盒盖将盒体密封好;将气体导管连接在连接管上,打开气体减压阀并松开设置于气体导管上的开关装置,打开第一阀门和第二阀门进行通气,调节气体流量计以控制气体流量;通气完成后,同时关闭第一阀门和第二阀门,依次关闭气体流量计和气体减压阀,并关闭设置于气体导管上的开关装置,松开气体导管和连接管的连接;将培养盒放入细胞组织培养箱中进行培养,之后取出培养盒,依次打开第二阀门和盒盖,取出细胞或组织,即可得到所述细胞或组织病理模型。
所述培养盒可根据实验需要设计不同的容量、尺寸和形状,并灵活搭配细胞或组织培养箱进行培养。例如,当培养盒的体积为1l时,设置气体流量为1lpm,通气5min,即可达到理想的气体置换效果。
所述培养盒中可根据实验需要放置不同规格的细胞培养瓶、细胞培养皿或细胞培养板。
本发明具有以下有益效果:
本发明提供了一种用于构建细胞或组织病理模型的气体置换装置及其构建方法。本发明首先提供了一种用于构建细胞或组织病理模型的气体置换装置,该装置可用于细胞或组织在不同氧气/二氧化碳/氮气浓度条件下的培养、低氧或高氧病理模型的构建以及缺氧耐力的检测,其操作简便,可根据实验需求,灵活搭配不同容量的培养盒,且培养盒可灵活搭配不同规格的细胞培养瓶或培养皿,有效地模拟低氧、高氧等病理环境,成功构建细胞或组织病理模型,有效避免污染、节约实验空间、减少气体和材料消耗;另外,该装置体积小巧,组合灵活,耐消毒除菌,无需昂贵零部件,成本低,各个部件均可重复使用,具有广泛的推广应用前景。
附图说明
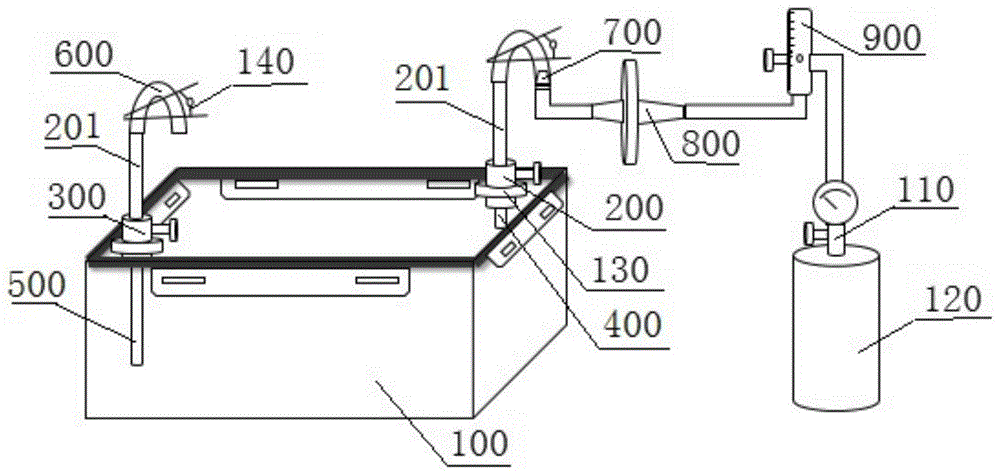
图1是用于构建细胞或组织病理模型的气体置换装置的结构示意图;附图标记:100-培养盒;200-第一阀门;300-第二阀门;400-进气管;500-出气管;600-气体导管;700-连接管;800-气体除菌过滤器;900-气体流量计;110-气体减压阀;120-混合气体瓶;130-o型密封圈;140-夹子;201-延伸接口。
图2是培养盒的结构示意图;附图标记:102-盒盖;103-密封圈;104-卡扣固定条。
图3是培养盒的结构示意图;附图标记:101-盒体。
图4是进气阀的结构示意图;附图标记:201-延伸接口;202-螺母;203-阀门开关;130-o型密封圈。
图5是缺糖缺氧造模后,神经瘤细胞neuron-2a和血管内皮细胞ea.hy926的形态变化结果图;其中,a)图是神经瘤细胞neuron-2a的形态变化结果图;b)图是血管内皮细胞ea.hy926的形态变化结果图。
图6是缺糖缺氧造模后,血管内皮细胞ea.hy926线粒体损伤状态结果图。
图7是缺糖缺氧造模后,血管内皮细胞ea.hy926凋亡情况结果图。
图8是缺糖缺氧造模后,血管内皮细胞ea.hy926溶酶体信号激活情况结果图;其中,a)图是细胞组织蛋白酶cathepsinb和泛素连接酶e6ap激活情况;b)图是a)图的z轴叠加共定位图。
具体实施方式
以下结合具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1一种用于构建细胞或组织病理模型的气体置换装置
如图1所示,本实施例提供了一种用于构建细胞或组织病理模型的气体置换装置,包括气体置换部件和气体供给部件;所述气体置换部件包括培养盒100、进气组件和出气组件;所述气体供给部件与进气组件通过气体导管600相连接;所述培养盒100由盒体101和与其相配合的盒盖102组成;所述进气组件由穿过盒盖102的进气管400和第一阀门200组成;所述出气组件由穿过盒盖102的出气管500和第二阀门300组成;所述进气管400伸入盒体101的管体长度短于出气管500伸入盒体101的管体长度。
本实施例中,所述气体供给部件包括依次连接的连接管700、气体除菌过滤器800、气体流量计900、气体减压阀110和混合气体瓶120。
本实施例中,所述气体导管600套设于连接管700上,以防止气体从连接管700和气体导管600的连接处溢出。
为了确保培养盒100的气密性,本实施例中,所述盒体101和盒盖102间设置有密封组件;所述密封组件为设置在盒体101和盒盖102间的密封圈103和密封卡扣装置;所述密封卡扣装置包括设置在盒盖102边缘的卡扣固定条104和设置在盒体101上边缘的与卡扣固定条104相适应的卡扣突出结构。
本实施例中,所述密封圈103沿着盒盖102的四周设置,以保证培养盒100的气密性。
本实施例中,所述密封圈103为长方形密封圈。
为了防止气体从第一阀门200和第二阀门300与盒盖102的连接处溢出,且保证培养盒100内的气体平稳流通,本实施例中,所述第一阀门200和第二阀门300均包括依次固定密封连接的延伸接口201、阀门开关203、o型密封圈130和螺母202;所述进气管400和出气管500均由盒内管和盒外管组成,盒外管与延伸接口201相连接,盒内管与螺母202相连接;所述o型密封圈130与盒盖102相连接。
本实施例中,所述o型密封圈130与盒盖102的下表面相连接,以防止进气组件和出气组件与盒盖102之间存在气体泄露的可能。
本实施例中,所述盒外管、延伸接口201、阀门开关203、o型密封圈130、螺母202和盒内管之间形成密封的气体通路。
本实施例中,所述盒内管的外壁设置有与螺母202相配合的螺纹结构。
本实施例中,所述连接管700通过气体导管600与进气管400中的盒外管相连接。
为了在第一阀门200和第二阀门300的基础上,进一步保障培养盒100的气密性,本实施例中,所述气体导管600上设置有控制气体进出的夹子140。
为了方便操作,本实施例中,所述盒外管为软质材料管。
为了便于实验观察以及对培养盒100进行酒精消毒和紫外消毒,以防细胞和组织发生污染,本实施例中,所述盒体101和盒盖102均为透明塑料材质。
为了便于操作和进一步增加该装置的气密性,本实施例中,所述气体导管600、密封圈103和o型密封圈130均为橡胶材质。
实施例2一种构建细胞或组织病理模型的方法
一种构建细胞或组织病理模型的方法,将细胞或组织放入容纳盒101内,用密封盖102将容纳盒101密封好;将气体导管600套接在连接管700上,打开气体减压阀110并松开夹子140,打开进气阀200和出气阀300进行通气,调节气体流量计900以控制气体流量;通气完成后,同时关闭进气阀200和出气阀300,依次关闭气体流量计900和气体减压阀110,并用夹子140夹闭气体导管600,松开气体导管600和连接管700的套接;将培养盒100放入细胞组织培养箱中进行培养,之后取出培养盒100,依次打开出气阀300和密封盖102,取出细胞或组织,即可得到所述细胞或组织病理模型。
本实施例中,所述培养盒100的体积为1l,设置气体流量为1lpm,通气5min。
实施例1得到的用于构建细胞或组织病理模型的气体置换装置可用于细胞或组织在不同氧气/二氧化碳/氮气浓度条件下的培养、低氧或高氧病理模型的构建以及缺氧耐力的检测。具体的实验方法和实验结果如下:
应用例1神经瘤细胞和血管内皮细胞缺糖缺氧病理模型的建立及其细胞形态变化
1、实验方法
分别将神经瘤细胞neuron-2a和血管内皮细胞ea.hy926接种于t25细胞培养瓶中,放入细胞培养箱中进行常规培养贴壁24小时后,用无糖培养基置换常规高糖细胞培养基,进行缺糖缺氧(oxygenglucosedeprivation,ogd)造模,具体的方法为:
首先取出细胞培养瓶,在超净台中将原培养液吸出,用无糖培养基hbss(nacl8.00g/l,kcl0.20g/l,cacl20.14g/l,mgso4.7h2o0.20g/l,na2hpo4.h2o0.06g/l,kh2po40.06g/l,nahco30.35g/l)清洗细胞3次,随后加入hbss进行无糖条件下培养;然后将细胞放入实施例1得到的用于构建细胞或组织病理模型的气体置换装置的培养盒中,按照实施例2的操作步骤,采用5%co2+95%n2预混合气体进行培养盒的气体置换,使细胞处于缺氧环境中,即可进行细胞缺糖缺氧造模;其中,神经瘤细胞neuron-2a进行ogd处理3小时(ogd3h组),血管内皮细胞ea.hy926进行ogd处理6小时(ogd6h组),未进行细胞缺糖缺氧造模的神经瘤细胞neuron-2a和血管内皮细胞ea.hy926作为对照(con组)。缺糖缺氧造模结束后,显微镜下分别观察神经瘤细胞neuron-2a和血管内皮细胞ea.hy926的形态变化并拍照记录。
2、实验结果
缺糖缺氧造模后,神经瘤细胞neuron-2a和血管内皮细胞ea.hy926的形态变化结果如图5所示,其中,a)图是神经瘤细胞neuron-2a的形态变化结果图可以看出,相较于con组的神经瘤细胞neuron-2a铺展、形态饱满,神经瘤细胞neuron-2a进行ogd处理3小时后,细胞的胞体部分发生明显的皱缩、且出现拉丝状伪足;b)图是血管内皮细胞ea.hy926的形态变化结果图,可以看出,相较于con组的血管内皮细胞ea.hy926成梭状、立体饱满地贴壁铺展,血管内皮细胞ea.hy926进行ogd处理6小时后,细胞形态变得扁平,丝状伪足明显。以上结果表明,应用本发明的用于构建细胞或组织病理模型的气体置换装置进行缺糖缺氧造模后,细胞均发生形态损伤,证明本发明的装置可有效模拟密闭缺氧状态。
应用例2血管内皮细胞缺糖缺氧病理模型的建立及其细胞线粒体损伤状态
mtt法是检测细胞线粒体损伤的重要手段,其工作原理为正常情况下细胞线粒体琥珀酸脱氢酶作用使mtt沉积并形成“针状结晶”;当细胞线粒体发生病理性损伤后,“针状结晶”无法有效形成。线粒体损伤是细胞缺氧缺糖造模损伤的重要环节,因此,本实施例以线粒体损伤作为细胞缺氧缺糖效果的指标之一。具体的实验方法和实验结果如下:
1、实验方法
将血管内皮细胞ea.hy926接种于96孔板中,放入细胞培养箱中进行常规培养贴壁24小时后,放入实施例1得到的用于构建细胞或组织病理模型的气体置换装置的培养盒中,按照实施例2的操作步骤将血管内皮细胞ea.hy926进行ogd处理6小时(ogd6h组)和12小时(ogd12h组),未进行细胞缺糖缺氧造模的血管内皮细胞ea.hy926作为对照(con组)。缺糖缺氧造模结束后,加入mtt溶液(5mg/ml储存液,20ul/孔),放入37℃细胞培养箱中孵育4h,进行显微镜下观察“针状结晶”。
2、实验结果
缺糖缺氧造模后,血管内皮细胞ea.hy926线粒体损伤状态结果如图6所示,可以看出,相较于con组血管内皮细胞ea.hy926的胞体周围有明显的针状结晶形成,血管内皮细胞ea.hy926进行ogd处理6小时后,针状晶体没有形成,只有颗粒状的紫色沉淀;血管内皮细胞ea.hy926进行ogd处理12小时后,紫色沉淀进一步减少。以上结果表明,应用本发明的用于构建细胞或组织病理模型的气体置换装置进行缺糖缺氧造模后,使得血管内皮细胞线粒体损伤,且随着ogd处理时间的延长,血管内皮细胞线粒体损伤呈现时间依赖性。
应用例3血管内皮细胞缺糖缺氧病理模型的建立及其细胞凋亡情况
1、实验方法
将血管内皮细胞ea.hy926接种于t25培养瓶中,待其长至90%融合度后,放入实施例1得到的用于构建细胞或组织病理模型的气体置换装置的培养盒中,按照实施例2的操作步骤将血管内皮细胞ea.hy926进行缺氧或者缺糖处理6小时(共分为4组:正常组、缺糖组、缺氧组、缺糖缺氧组)。处理结束后,收集血管内皮细胞ea.hy926样本提取蛋白进行免疫印迹分析,考察内质网损伤标志蛋白(calnexin蛋白)和细胞凋亡损伤标志蛋白(parp-1蛋白)的表达变化。
2、实验结果
缺糖缺氧造模后,血管内皮细胞ea.hy926凋亡情况结果如图7所示,可以看出,相较于正常组,缺氧组和缺糖缺氧组细胞calnexin蛋白表达下降;缺糖组、缺氧组和缺糖缺氧组均导致了细胞parp-1蛋白发生切割出现小分子量条带,提示血管内皮细胞ea.hy926发生凋亡损伤。以上结果表明,应用本发明的用于构建细胞或组织病理模型的气体置换装置进行缺糖缺氧造模后,细胞发生凋亡。
应用例4血管内皮细胞缺糖缺氧病理模型的建立及其溶酶体信号激活情况
1、实验方法
将血管内皮细胞ea.hy926接种于经多聚赖氨酸处理过的玻片上,待其长至80%融合度后,放入实施例1得到的用于构建细胞或组织病理模型的气体置换装置的培养盒中,按照实施例2的操作步骤将血管内皮细胞ea.hy926进行ogd处理6小时。随后用4%pfa溶液固定血管内皮细胞ea.hy926样本,用于细胞免疫荧光染色。血管内皮细胞ea.hy926样本经血清封闭、一抗孵育(自噬-溶酶体激活标志蛋白组织蛋白酶cathepsinb抗体和泛素连接酶e6ap抗体)、荧光二抗孵育、dapi染色、封片处理后,采用荧光显微镜进行成像拍照。
2、实验结果
缺糖缺氧造模后,血管内皮细胞ea.hy926溶酶体信号激活情况结果如图8所示,其中,a)图是细胞组织蛋白酶cathepsinb和泛素连接酶e6ap激活情况,可以看出,经ogd处理后,血管内皮细胞ea.hy926浆中cathepsinb抗体表达显著性升高,e6ap抗体也显著性上升;b)图是a)图的z轴叠加共定位图,可以看出,e6ap抗体与cathepsinb抗体有较好的共定位表达,参与溶酶体信号激活。以上结果表明,应用本发明的用于构建细胞或组织病理模型的气体置换装置进行缺糖缺氧造模,血管内皮细胞经缺糖缺氧损伤诱导后溶酶体信号被激活。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!