真皮鞘杯细胞(DSCC)的鉴定方法、和用于再生毛囊的组合物的评价方法与流程
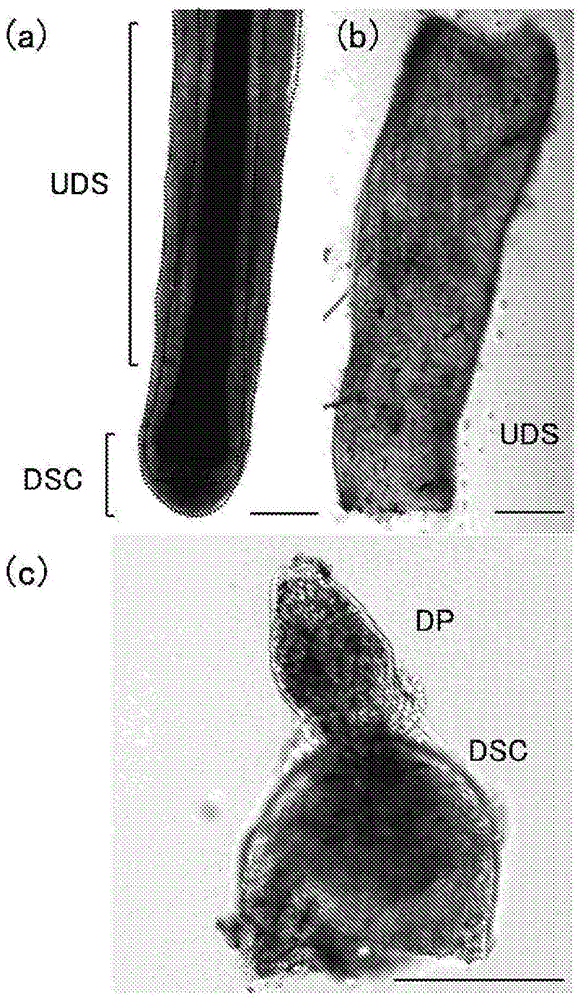
本发明涉及毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的鉴定方法。另外,本发明涉及含有毛囊来源的细胞群的用于再生毛囊的组合物的评价方法。
背景技术:
:毛发由存在于皮肤的毛囊产生。毛囊是包围毛发的组织层,由外胚层来源的毛母(毛母细胞)、内毛根鞘、外毛根鞘,中胚层来源的真皮鞘、毛乳头等构成。包围毛乳头的毛母细胞被由毛乳头供给的营养、蛋白质诱导而反复分裂、角质化,从而形成毛发。由于毛发的发育出现问题而产生头发稀疏、脱发症。头发稀疏、脱发症分为早秃(早老性脱发)、斑秃、静止期脱发症等,发生率最高的是早秃。早秃在男性中主要是由于雄性激素的影响而引起的,也称为男性型脱发症。头发一边重复由生长期、退化期和静止期组成的头发生长周期一边长新头发。男性型脱发症是由在该头发生长周期中生长期变短、细且短的毛发的比例增加而引起的症状。现在,作为早秃的治疗,主要使用外用剂米诺地尔、口服药非那雄胺。这些治疗法均被确认了有效性、安全性,但未必对全部早秃有效。此外,作为早秃的治疗,实施了自身植发术。自身植发术是将从颞区、枕区采集的包含发根的毛发移植到自己的脱发部的手术方法。然而,该手术方法是将自己的毛发移植到别的地方的手术方法,因此并不增加毛发的总量。近年来,开发了针对各种疾病的再生医疗技术,在毛发再生领域也研究开发了新的技术。例如,提示了毛囊中位于毛囊的最外层的真皮鞘、特别是位于毛球部的底部的真皮鞘杯(dermalsheathcupcell:dsc)具有高的毛囊诱导能力,报告了在移植有dscc的实验中确认了毛发生长(非专利文献1、2)。另外,还显示dscc是在毛发生长中具有重要作用的毛乳头(真皮乳头,dermalpapilla:dp)细胞的前体细胞,dscc受到关注(非专利文献3)。现有技术文献非专利文献非专利文献1:jahodaca.,etal.,inductionofhairgrowthbyimplantationofcultureddermalpapillacells.nature1984;311:560-562.非专利文献2:mcelweekj.,etal.,culturedperibulbardermalsheathcellscaninducehairfollicledevelopmentandcontributetothedermalsheathanddermalpapilla.j.invest.dermatol.2003;121:1267-1275.非专利文献3:rahmaniw.,etal.,hairfollicledermalstemcellsregeneratethedermalsheath,repopulatethedermalpapilla,andmodulatehairtype.dev.cell.2014dec.8;31(5):543-58.技术实现要素:发明要解决的课题虽然在毛发再生领域持续开发使用毛囊来源的细胞群的治疗法,但对于具有毛囊的诱导能力的真皮鞘杯细胞,目前只有通过目视采集毛球部周围底部的细胞的方法,并不知晓特异的标志物。另外,不能评价采集的细胞中以何种程度混入了真皮鞘杯细胞以外的细胞。另外,不能评价将采集的真皮鞘杯细胞体外(invitro)培养之后,维持其性质的细胞以何种程度残存。因此,本发明的目的在于搞清楚在毛囊来源的细胞群、特别是真皮鞘杯细胞中特异性地表达的标志物基因,并且提供以该基因的表达水平为指标的鉴定真皮鞘杯细胞的方法。另外,本发明的目的在于提供含有毛囊来源的细胞群的用于再生毛囊的组合物的评价方法。用于解决课题的手段本发明者们进行了深入研究,结果发现了在真皮鞘杯细胞中表达的基因,从而完成了本发明。即,本发明包含以下发明。[1]毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的鉴定方法,其特征在于,以grem2基因的表达水平作为指标。[2]根据[1]所述的方法,其特征在于,进一步以选自aspn基因、mmp11基因、ptger3基因、rbp4基因、tle4基因、grem1基因、dcn基因、pdgfrl基因、ackr1基因、hapln1基因、dcd基因、scgb1d2基因、acta2基因、plin4基因、dok6基因、enpp4基因、il15基因、ccdc80基因、tnxb基因、fbln2基因、dlec1基因、lrrc17基因、znf791基因、cnih3基因、prr15l基因、dcaf4基因、gyltl1b基因、loc142937基因、bpifc基因、ano2基因、ifi44l基因和pcsk7基因中的1种以上基因的表达水平作为指标。[3]根据[1]或[2]所述的方法,所述毛囊来源的细胞群是体外(invitro)培养的毛囊来源的细胞群。[4]根据[3]所述的方法,所述毛囊来源的细胞群是传代了1次以上的毛囊来源的细胞群。[5]用于再生毛囊的组合物的评价方法,所述组合物含有毛囊来源的细胞群,该方法的特征在于,以grem2基因的表达水平作为指标,确定所述毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的比例和/或活性。[6]根据[5]所述的方法,其特征在于,进一步以选自aspn基因、mmp11基因、ptger3基因、rbp4基因、tle4基因、grem1基因、dcn基因、pdgfrl基因、ackr1基因、hapln1基因、dcd基因、scgb1d2基因、acta2基因、plin4基因、dok6基因、enpp4基因、il15基因、ccdc80基因、tnxb基因、fbln2基因、dlec1基因、lrrc17基因、znf791基因、cnih3基因、prr15l基因、dcaf4基因、gyltl1b基因、loc142937基因、bpifc基因、ano2基因、ifi44l基因和pcsk7基因中的1种以上基因的表达水平作为指标。[7]根据[5]或[6]所述的方法,所述毛囊来源的细胞群是体外(invitro)培养的毛囊来源的细胞群。[8]根据[7]所述的方法,所述毛囊来源的细胞群是传代了1次以上的毛囊来源的细胞群。[9]毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的鉴定方法,其特征在于,以aspn基因的表达水平作为指标。[10]根据[9]所述的方法,其特征在于,进一步以选自grem2基因、mmp11基因、ptger3基因、rbp4基因、tle4基因、grem1基因、dcn基因、pdgfrl基因、ackr1基因、hapln1基因、dcd基因、scgb1d2基因、acta2基因、plin4基因、dok6基因、enpp4基因、il15基因、ccdc80基因、tnxb基因、fbln2基因、dlec1基因、lrrc17基因、znf791基因、cnih3基因、prr15l基因、dcaf4基因、gyltl1b基因、loc142937基因、bpifc基因、ano2基因、ifi44l基因和pcsk7基因中的1种以上基因的表达水平作为指标。[11]根据[9]或[10]所述的方法,所述毛囊来源的细胞群是体外(invitro)培养的毛囊来源的细胞群。[12]根据[11]所述的方法,所述毛囊来源的细胞群是传代了1次以上的毛囊来源的细胞群、。[13]用于再生毛囊的组合物的评价方法,该组合物含有毛囊来源的细胞群,该方法的特征在于,以aspn基因的表达水平作为指标,确定所述毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的比例和/或活性。[14]根据[13]所述的方法,其特征在于,进一步以选自grem2基因、mmp11基因、ptger3基因、rbp4基因、tle4基因、grem1基因、dcn基因、pdgfrl基因、ackr1基因、hapln1基因、dcd基因、scgb1d2基因、acta2基因、plin4基因、dok6基因、enpp4基因、il15基因、ccdc80基因、tnxb基因、fbln2基因、dlec1基因、lrrc17基因、znf791基因、cnih3基因、prr15l基因、dcaf4基因、gyltl1b基因、loc142937基因、bpifc基因、ano2基因、ifi44l基因和pcsk7基因中的1种以上基因的表达水平作为指标。[15]根据[13]或[14]所述的方法,所述毛囊来源的细胞群是体外(invitro)培养的毛囊来源的细胞群。[16]根据[15]所述的方法,所述毛囊来源的细胞群是传代了1次以上的毛囊来源的细胞群。[17]毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的鉴定方法,其特征在于,以mmp11基因的表达水平作为指标。[18]根据[17]所述的方法,其特征在于,进一步以选自grem2基因、aspn基因、ptger3基因、rbp4基因、tle4基因、grem1基因、dcn基因、pdgfrl基因、ackr1基因、hapln1基因、dcd基因、scgb1d2基因、acta2基因、plin4基因、dok6基因、enpp4基因、il15基因、ccdc80基因、tnxb基因、fbln2基因、dlec1基因、lrrc17基因、znf791基因、cnih3基因、prr15l基因、dcaf4基因、gyltl1b基因、loc142937基因、bpifc基因、ano2基因、ifi44l基因和pcsk7基因中的1种以上基因的表达水平作为指标。[19]根据[17]或[18]所述的方法,所述毛囊来源的细胞群是体外(invitro)培养的毛囊来源的细胞群。[20]根据[19]所述的方法,所述毛囊来源的细胞群是传代了1次以上的毛囊来源的细胞群。[21]用于再生毛囊的组合物的评价方法,所述组合物含有毛囊来源的细胞群,该方法的特征在于,以mmp11基因的表达水平作为指标,确定所述毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的比例和/或活性。[22]根据[21]所述的方法,其特征在于,进一步以选自grem2基因、aspn基因、ptger3基因、rbp4基因、tle4基因、grem1基因、dcn基因、pdgfrl基因、ackr1基因、hapln1基因、dcd基因、scgb1d2基因、acta2基因、plin4基因、dok6基因、enpp4基因、il15基因、ccdc80基因、tnxb基因、fbln2基因、dlec1基因、lrrc17基因、znf791基因、cnih3基因、prr15l基因、dcaf4基因、gyltl1b基因、loc142937基因、bpifc基因、ano2基因、ifi44l基因和pcsk7基因中的1种以上基因的表达水平作为指标。[23]根据[21]或[22]所述的方法,所述毛囊来源的细胞群是体外(invitro)培养的毛囊来源的细胞群。[24]根据[23]所述的方法,所述毛囊来源的细胞群是传代了1次以上的毛囊来源的细胞群。[25]毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的鉴定方法,其特征在于,以ptger3基因的表达水平作为指标。[26]根据[25]所述的方法,其特征在于,进一步以选自grem2基因、aspn基因、mmp11基因、rbp4基因、tle4基因、grem1基因、dcn基因、pdgfrl基因、ackr1基因、hapln1基因、dcd基因、scgb1d2基因、acta2基因、plin4基因、dok6基因、enpp4基因、il15基因、ccdc80基因、tnxb基因、fbln2基因、dlec1基因、lrrc17基因、znf791基因、cnih3基因、prr15l基因、dcaf4基因、gyltl1b基因、loc142937基因、bpifc基因、ano2基因、ifi44l基因和pcsk7基因中的1种以上基因的表达水平作为指标。[27]根据[25]或[26]所述的方法,所述毛囊来源的细胞群是体外(invitro)培养的毛囊来源的细胞群。[28]根据[27]所述的方法,所述毛囊来源的细胞群是传代了1次以上的毛囊来源的细胞群。[29]用于再生毛囊的组合物的评价方法,所述组合物含有毛囊来源的细胞群,该方法的特征在于,以ptger3基因的表达水平作为指标,确定所述毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的比例和/或活性。[30]根据[29]所述的方法,其特征在于,进一步以选自grem2基因、aspn基因、mmp11基因、rbp4基因、tle4基因、grem1基因、dcn基因、pdgfrl基因、ackr1基因、hapln1基因、dcd基因、scgb1d2基因、acta2基因、plin4基因、dok6基因、enpp4基因、il15基因、ccdc80基因、tnxb基因、fbln2基因、dlec1基因、lrrc17基因、znf791基因、cnih3基因、prr15l基因、dcaf4基因、gyltl1b基因、loc142937基因、bpifc基因、ano2基因、ifi44l基因和pcsk7基因中的1种以上基因的表达水平作为指标。[31]根据[29]或[30]所述的方法,所述毛囊来源的细胞群是体外(invitro)培养的毛囊来源的细胞群。[32]根据[31]所述的方法,所述毛囊来源的细胞群是传代了1次以上的毛囊来源的细胞群。[33]毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的鉴定方法,其特征在于,以rbp4基因的表达水平作为指标。[34]根据[33]所述的方法,其特征在于,进一步以选自grem2基因、aspn基因、mmp11基因、ptger3基因、tle4基因、grem1基因、dcn基因、pdgfrl基因、ackr1基因、hapln1基因、dcd基因、scgb1d2基因、acta2基因、plin4基因、dok6基因、enpp4基因、il15基因、ccdc80基因、tnxb基因、fbln2基因、dlec1基因、lrrc17基因、znf791基因、cnih3基因、prr15l基因、dcaf4基因、gyltl1b基因、loc142937基因、bpifc基因、ano2基因、ifi44l基因和pcsk7基因中的1种以上基因的表达水平作为指标。[35]根据[33]或[34]所述的方法,所述毛囊来源的细胞群是体外(invitro)培养的毛囊来源的细胞群。[36]根据[35]所述的方法,所述毛囊来源的细胞群是传代了1次以上的毛囊来源的细胞群。[37]用于再生毛囊的组合物的评价方法,所述组合物含有毛囊来源的细胞群,该方法的特征在于,以rbp4基因的表达水平作为指标,确定所述毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的比例和/或活性。[38]根据根据[37]所述的方法,其特征在于,进一步以选自grem2基因、aspn基因、mmp11基因、ptger3基因、tle4基因、grem1基因、dcn基因、pdgfrl基因、ackr1基因、hapln1基因、dcd基因、scgb1d2基因、acta2基因、plin4基因、dok6基因、enpp4基因、il15基因、ccdc80基因、tnxb基因、fbln2基因、dlec1基因、lrrc17基因、znf791基因、cnih3基因、prr15l基因、dcaf4基因、gyltl1b基因、loc142937基因、bpifc基因、ano2基因、ifi44l基因和pcsk7基因中的1种以上基因的表达水平作为指标。[39]根据[37]或[38]所述的方法,所述毛囊来源的细胞群是体外(invitro)培养的毛囊来源的细胞群。[40]根据[39]所述的方法,所述毛囊来源的细胞群是传代了1次以上的毛囊来源的细胞群。[41]毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的鉴定方法,其特征在于,以tle4基因的表达水平作为指标。[42]根据[41]所述的方法,其特征在于,进一步以选自grem2基因、aspn基因、mmp11基因、ptger3基因、rbp4基因、grem1基因、dcn基因、pdgfrl基因、ackr1基因、hapln1基因、dcd基因、scgb1d2基因、acta2基因、plin4基因、dok6基因、enpp4基因、il15基因、ccdc80基因、tnxb基因、fbln2基因、dlec1基因、lrrc17基因、znf791基因、cnih3基因、prr15l基因、dcaf4基因、gyltl1b基因、loc142937基因、bpifc基因、ano2基因、ifi44l基因和pcsk7基因中的1种以上基因的表达水平作为指标。[43]根据[41]或[42]所述的方法,所述毛囊来源的细胞群是体外(invitro)培养的毛囊来源的细胞群。[44]根据[43]所述的方法,所述毛囊来源的细胞群是传代了1次以上的毛囊来源的细胞群。[45]用于再生毛囊的组合物的评价方法,所述组合物含有毛囊来源的细胞群,该方法的特征在于,以tle4基因的表达水平作为指标,确定所述毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的比例和/或活性。[46]根据[45]所述的方法,其特征在于,进一步以选自grem2基因、aspn基因、mmp11基因、ptger3基因、rbp4基因、grem1基因、dcn基因、pdgfrl基因、ackr1基因、hapln1基因、dcd基因、scgb1d2基因、acta2基因、plin4基因、dok6基因、enpp4基因、il15基因、ccdc80基因、tnxb基因、fbln2基因、dlec1基因、lrrc17基因、znf791基因、cnih3基因、prr15l基因、dcaf4基因、gyltl1b基因、loc142937基因、bpifc基因、ano2基因、ifi44l基因和pcsk7基因中的1种以上基因的表达水平作为指标。[47]根据[45]或[46]所述的方法,所述毛囊来源的细胞群是体外(invitro)培养的毛囊来源的细胞群。[48]根据[47]所述的方法,所述毛囊来源的细胞群是传代了1次以上的毛囊来源的细胞群。发明的效果根据本发明,能够识别毛囊来源的细胞群中所含的真皮鞘杯细胞,能够评价含有毛囊来源的细胞群的用于再生毛囊的组合物的品质。另外,即使在将分离的真皮鞘杯细胞体外(invitro)培养使其增殖之后,也能够评价真皮鞘杯细胞是否残存,能够选择毛囊诱导能力高的用于再生毛囊的组合物。附图说明图1是显示毛囊(fairfollicle:hf)亚单元的图。(a)hf全体。(b)切开的上部真皮鞘(upperdermalsheath:uds)。(c)切开、翻转的分离前的真皮鞘杯(dermalsheathcup:dsc)和毛乳头(真皮毛乳头,dermalpapilla:dp)。比例尺=200μm。图2是显示主成分分析之后的微阵列结果的近似性的坐标图。从不同视角的三维的视角。x轴:主成分(pc)1(32.34%的分散填补);y轴:pc2(22.83%的分散填补);z轴:pc3(20.43%的分散填补)。黑的符号:个人(id)1;白的符号:id2;斜线的符号:id3。三角:dsc、方:dp、圆:uds。图3:在真皮鞘杯(dsc)中不同地表达的基因。将归一化后的dsc识别基因的表达水平分别在3人中与毛乳头(dp)和上部真皮鞘(uds)进行了比较。图4是显示通过定量pcr分析而得的真皮鞘杯(dsc)和毛乳头(dp)中的grem2的表达水平的坐标图。显示以gapdh的表达量作为100%时的相对值。图5是显示人毛囊中的grem2的表达的表现的图。显示原位(insitu)杂交的结果。(a)grem2探针,(b)(a)的放大图,(c)无探针。红:原位(insitu)信号,蓝:利用hechst33342的核染色。比例尺:(a):100μm,(b)和(c):50μm。图6是显示人毛囊中的grem2和grem1的表达的图。显示原位(insitu)杂交的结果。(a)grem2探针,(b)grem1探针,(c)无探针。上行:仅原位(insitu)信号,中行:原位(insitu)信号和核,下行:dsc部分的放大图。红:原位(insitu)信号,蓝:利用hechst33342的核染色。比例尺:100μm。图7是显示dsc识别基因的调节控制及其细胞内定位的推定图。图8是显示真皮鞘杯(dsc)的培养前后的dsc识别基因的表达量的变化的图。从完整的dsc、和约30天体外(invitro)培养后的dsc回收总rna,通过定量pcr进行分析。用gapdh的表达量进行归一化,显示以完整的dsc的基因表达量作为100%时的、培养之后的dsc的相对基因表达量。图9是(a)将真皮鞘杯(dsc)、毛乳头(dp)、上部真皮鞘(uds)培养后传代第1代的各细胞中的grem2的表达水平通过定量pcr进行分析而得的坐标图。显示以相对于dsc细胞中的gapdh的表达量的grem2的表达量作为100%时的相对值的2次实验的平均值。(b)用以dsc细胞的值为1时的比显示将真皮鞘杯(dsc)、毛乳头(dp)、上部真皮鞘(uds)培养后传代第1代的各细胞中的集落形成能力。具体实施方式以下,对于用于实施本发明的方式进行说明,但本发明的技术的范围不仅限于下述方式。将毛发的皮肤内部最深部的膨胀部分称为毛球部(hairbulb),将位于毛球部的中央部的由间充质细胞形成的部分称为毛乳头(真皮乳头,dermalpapilla)。毛乳头中钻入了毛细血管、神经,摄取来自食物的营养、氧,掌管毛发的产生、生长。在与毛乳头相接的地方有毛母细胞(hairmatrixcell),毛发在该部位产生。即毛母细胞通过从钻入毛乳头的毛细血管摄取营养、氧,反复分裂,从而形成毛发。本说明书中,“毛囊(hairfollicle:hf)”是指包含作为上皮细胞的毛母(毛母细胞)、内毛根鞘、外毛根鞘、作为间充质细胞的真皮鞘、毛乳头、和黑色素细胞等的、包围毛发的组织层。本发明中使用的组织或细胞可以是任意动物来源,优选为脊椎动物来源,更优选为哺乳动物来源,最优选为人来源。本说明书中,“真皮鞘(dermalsheath:ds)”是由包围毛囊的最外层的一层或数层真皮性细胞层(波形蛋白阳性)形成的组织,包含平滑肌型α肌动蛋白(α-sma)阳性细胞。真皮鞘在毛球部的最下端与毛乳头相连。如后所述,本说明书中,真皮鞘包含真皮鞘杯和上部真皮鞘层。本说明书中,“真皮鞘杯(dermalsheathcup:dsc)”是真皮鞘的一部分,是指位于毛球部的底部的组织(参照图1)。“真皮鞘杯细胞(dermalsheathcupcell:dscc)”是构成真皮鞘杯的细胞。真皮鞘杯细胞已知是毛乳头细胞的前体细胞,已知通过将真皮鞘杯细胞移植到皮肤,能够在移植部位诱导出毛囊。即,如果能够在毛囊来源的细胞群或含有毛囊来源的细胞群的用于再生毛囊的组合物中,选择真皮鞘杯细胞的比例高和/或其活性高的毛囊来源的细胞群或组合物,则能够提供毛囊诱导能力更高的毛囊来源的细胞群或含有毛囊来源的细胞群的用于再生毛囊的组合物。本说明书中,“上部真皮鞘(upperdermalsheath:uds)”是指真皮鞘中除了上述真皮鞘杯的部分以外的组织。本说明书中,“毛囊来源的细胞群”是指包含上述构成毛囊的细胞的细胞群。另外,本说明书中,“包含毛囊来源的细胞群的用于再生毛囊的组合物”是指除了毛囊来源的细胞群之外,还含有例如能够生物相容的物质的组合物。能够生物相容的物质可以是例如,水、生理盐水、磷酸缓冲液、细胞培养用培养基、生物相容性水凝胶(脱乙酰壳多糖凝胶、胶原蛋白凝胶、明胶、肽凝胶、层粘连蛋白凝胶和纤维蛋白凝胶等)等,但不限于这些。本发明者们进行了深入研究,结果发现了在真皮鞘杯细胞(dscc)中特异性地表达的基因。即,本发明中使用的用于识别真皮鞘杯细胞的基因或识别标志物包含以下表1所列举的基因表1基因名基因简称登记号asporinaspnnm_017680gremlin2,danfamilybmpantagonistgrem2nm_022469matrixmetallopeptidase11(stromelysin3)mmp11nm_005940prostaglandinereceptor3(subtypeep3)ptger3nm_198714,nm_198717retinolbindingprotein4,plasmarbp4nm_006744transducin-likeenhancerofsplit4tle4nm_007005其中,本发明中使用的表1和表2(后述)所述的基因的具体序列可以从genebank(http://www.ncbi.nlm.nih.gov/)获得。本发明中使用的基因的具体序列不限于通过表1和表2所述的登记号获得的序列,还包含例如,与上述表1或表2所特定的核苷酸序列70%以上、75%以上、80%以上、85%以上、90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上、99%以上同一的序列、它们的剪接突变体等。另外,其基因的来源可以是任意动物来源,优选为脊椎动物来源,更优选为哺乳动物来源,最优选为人来源。在一实施方式中,本发明包含以下方式。毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的鉴定方法,其特征在于,以grem2基因的表达水平作为指标。另外,在一实施方式中,本发明包含以下方式。毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的鉴定方法,其特征在于,以aspn基因的表达水平作为指标。另外,在一实施方式中,本发明包含以下方式。毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的鉴定方法,其特征在于,以mmp11基因的表达水平作为指标。另外,在一实施方式中,本发明包含以下方式。毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的鉴定方法,其特征在于,以ptger3基因的表达水平作为指标。另外,在一实施方式中,本发明包含以下方式。毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的鉴定方法,其特征在于,以rbp4基因的表达水平作为指标。另外,在一实施方式中,本发明包含以下方式。毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的鉴定方法,其特征在于,以tle4基因的表达水平作为指标。通过在毛囊来源的细胞群中测到上述基因的表达水平,能够鉴定毛囊来源的细胞群所包含的真皮鞘杯细胞(dscc)。另外,通过在毛囊来源的细胞群中测到上述基因的表达水平,能够预测毛囊来源的细胞群所具有的毛囊诱导效果。在一实施方式中,本发明包含以下方式。用于再生毛囊的组合物的评价方法,所述组合物含有毛囊来源的细胞群,该方法的特征在于,以grem1基因的表达水平作为指标,确定所述毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的比例和/或活性。另外,在一实施方式中,本发明包含以下方式。用于再生毛囊的组合物的评价方法,所述组合物含有毛囊来源的细胞群,该方法的特征在于,以aspn基因的表达水平作为指标,确定所述毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的比例和/或活性。另外,在一实施方式中,本发明包含以下方式。用于再生毛囊的组合物的评价方法,所述组合物含有毛囊来源的细胞群,该方法的特征在于,以mmp11基因的表达水平作为指标,确定所述毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的比例和/或活性。另外,在一实施方式中,本发明包含以下方式。用于再生毛囊的组合物的评价方法,所述组合物含有毛囊来源的细胞群,该方法的特征在于,以ptger3基因的表达水平作为指标,确定所述毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的比例和/或活性。另外,在一实施方式中,本发明包含以下方式。用于再生毛囊的组合物的评价方法,所述组合物含有毛囊来源的细胞群,该方法的特征在于,以rbp4基因的表达水平作为指标,确定所述毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的比例和/或活性。另外,在一实施方式中,本发明包含以下方式。用于再生毛囊的组合物的评价方法,所述组合物含有毛囊来源的细胞群,该方法的特征在于,以tle4基因的表达水平作为指标,确定所述毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的比例和/或活性。在含有毛囊来源的细胞群的用于再生毛囊的组合物中,通过以上述基因的表达水平作为指标,确定毛囊来源的细胞群中的真皮鞘杯细胞(dscc)的比例和/或活性,能够评价毛囊来源的细胞群所包含的真皮鞘杯细胞的相对的量或活性,其结果能够预测由真皮鞘杯细胞带来的毛囊诱导效果。在其他方式中,本发明的上述任意方法可以是进一步以选自grem2基因、aspn基因、mmp11基因、ptger3基因、rbp4基因和tle4基因中的1种以上基因的表达水平作为指标的方法。通过组合真皮鞘杯细胞特异的这些基因,能够更正确地评价毛囊来源的细胞群或含有毛囊来源的细胞群的用于再生毛囊的组合物中所包含的真皮鞘杯细胞。进而,在其他方式中,本发明可以是除了上述工序之外进一步以选自以下表2中所包含的基因(grem1基因、dcn基因、pdgfrl基因、ackr1基因、hapln1基因、dcd基因、scgb1d2基因、acta2基因、plin4基因、dok6基因、enpp4基因、il15基因、ccdc80基因、tnxb基因、fbln2基因、dlec1基因、lrrc17基因、znf791基因、cnih3基因、prr15l基因、dcaf4基因、gyltl1b基因、loc142937基因、bpifc基因、ano2基因、ifi44l基因和pcsk7基因)中的1种以上基因的表达水平作为指标的方法。表2本说明书中,“基因的表达水平”是指能够通过检测、测定由任意的基因转录的转录产物、或以该转录产物作为模板翻译的翻译产物来确定的水平。转录产物是指例如,以基因的dna作为模板转录的rna链、即通过rna聚合酶合成的rna链、和转录后在细胞内修饰后的rna链。作为转录产物中所包含的rna链,例如为信使rna(mrna)。这些rna链也包含转录后在细胞内被加工后的rna链。翻译产物是指例如,以由基因转录而得的转录产物作为模板翻译的多肽链、即通过核糖体合成的多肽链、及该多肽链通过折叠而形成的蛋白质。翻译产物也包含多肽链或蛋白质的片段。基因的表达水平可以通过使用公知的方法来测定。例如,在为了测定基因的表达水平而测定基因的转录产物的情况下,可以参考目的的基因的序列来设计适当的探针,使用这些探针通过使用定量pcr法(qpcr法)、原位(insitu)杂交法、rna印记(northernblot)法、dna微阵列法等的方法来测定。另外,例如,在为了测定基因的表达水平而测定基因的翻译产物的情况下,可以使用检测由目的的基因翻译的蛋白质的抗体,通过例如,蛋白质印记(westernblot)法、流式细胞仪法(facs法)、elisa法等来测定。在一实施方式中,基因的表达水平可以利用任意持家基因的表达水平进行归一化(标准化)从而进行比较。作为能够用于比较的持家基因,可列举例如,gapdh(甘油醛-3-磷酸脱氢酶,glyceraldehyde-3-phosphatedehydrogenase)、β-肌动蛋白、β2-微球蛋白、hprt1(次黄嘌呤磷酸核糖基转移酶,hypoxanthinephosphoribosyltransferase1)等。通过与本发明中使用的上述的基因同样的方法,能够测定持家基因的表达水平,利用该持家基因的表达水平进行归一化(标准化),从而能够在不同样品之间进行比较。在一实施方式中,“以基因的表达水平作为指标”可以是,在毛囊来源的细胞群中,检测表达规定的水平以上(例如,阴性对照的样品的信号以上)的基因的细胞的比例。由此,能够评价毛囊来源的细胞群所包含的真皮鞘杯细胞的比例。在一实施方式中,“以基因的表达水平作为指标”可以是,在毛囊来源的细胞群全体中,检测任意的基因的表达水平,与其他样品的同一的基因的表达水平进行比较。由此,能够作为毛囊来源的细胞群全体,评价真皮鞘杯细胞中表达的基因是高表达还是低表达。在一实施方式中,“真皮鞘杯细胞(dscc)的活性”是在真皮鞘杯细胞中表达的上述的基因的表达水平。通过在不同样品之间比较上述的基因的表达水平,能够比较毛囊来源的细胞群所包含的真皮鞘杯细胞的相对的活性。在一实施方式中,本发明可以使用体外(invitro)培养而得的毛囊来源的细胞群。由此,能够评价毛囊来源的细胞群所包含的真皮鞘杯细胞在培养的前后其比例或其性质是否变化。另外,在其他方式中,本发明可以使用传代了1次以上的毛囊来源的细胞群。关于将毛囊来源的细胞群在体外(invitro)培养、传代的方法采用公知的方法即可,不限定。实施例:以下,基于实施例更详细地说明本发明,但这些不对本发明造成任何限定。<实施例1>1.方法1-1.毛囊亚单元的制备从2例受到母斑细胞母斑、和1例受到脂肪瘤的切除的30~70岁的3名女性获得包含头皮的毛囊(hairfollicle:hf)的皮肤片。样品避开肿瘤巢、从切除的皮肤的边缘采集。参考mcelweekj.,etal.(参考文献1)和niiyamas.,etal.(参考文献2),在立体显微镜下从分离出的完整hf显微解剖hf的间充质亚单元(图1)。简单来说,对于hf,将与毛球区域相邻的地方用钳子把持,使用针将毛球横切地切断,从而切开。使用钳子和针使毛球的真皮鞘杯(dermalsheathcup:dsc)翻转,除去残余的上皮来源的组织,使毛乳头(真皮乳头,dermalpapilla:dp)露出。将dp横切切断而从dsc分离。上部真皮鞘(upperdermalsheath:uds)通过一边将hf的近位端用别的钳子保持一边用钳子从外毛根鞘剥下,从而分离。1-2.总rna的制备将各个亚单元集中起来,在1ml的isogen(ニッポン·ジーン社、富山、日本)中溶解,按照制造商的指示进行rna提取。沉淀后,rna的品质使用agilentbioanalyzer2100(agilenttechnologies、paloalto、ca、usa)由核糖体rna比(28s/18s)来评价。将具有6.5~8.3的rnaintegritynumber(rna完整性数,rin)的样品用于微阵列分析。1-3.微阵列分析微阵列分析按照制造商的指示(agilenttechnologies)实施。10ng的总rna在oligo(dt)引物、affinityscript逆转录酶、t7rna聚合酶和经cy3色素标记的ctp存在下,使用lowinputquickamplabelingkit(agilenttechnologies)进行体内(invivo)逆转录及其之后的转录,转换成荧光标记crna。将所得的600ng的标记crna片段化,使其与agilentsureprintg3humange8x60k微阵列(g4851a、agilenttechnologies)杂交,用agilent双激光微阵列扫描仪(g2565aa)扫描。信号强度使用featureextractionsoftware包11.0.1.1(agilenttechnologies)进行定量。为了进行统计分析,将数据用genespringgx13.0软件(agilenttechnologies)进行处理。微阵列数据按照关于微阵列实验的最小限信息(miame)指南记载,委托geneexpressionomnibus(geo)数据库(受托号gse95219;http://www.ncbi.nlm.nih.gov/geo)保管。1-4.原位(insitu)杂交为了将细胞内中的grem2和grem1的定位可视化,使用石蜡包埋组织切片进行原位(insitu)杂交。按照viewrna(商标)ishtissue1-plexassay试剂盒(thermofisherscientificinc.、waltham、ma、usa)的制造商手册,基于高度特异的枝状dna信号扩增技术,使用grem2或grem1特异的6型探针。使用fastred底物检测信号,接着观察荧光。核的染色使用hoechst33342(thermofischerscientificinc.)实施。1-5.定量pcr(qpcr)使用nucleospinrnaxs(takarabioinc.、滋贺、日本),按照附带的说明书从各样品提取总rna,接着使用cellampwholetranscriptomeamplificationkit(realtime)ver.2(takarabioinc.、滋贺、日本)制备cdna。qpcr使用lightcycler(注册商标)faststartdnamasterplussybrgreeni和lightcycler(rochemolecularsystems,inc、pleasanton),按照附带的说明书实施。2.结果2-1.hf的各亚单元显示不同的基因图谱。分析所分离的完整的hf亚单元(dsc、dp、uds)的基因表达图谱(图1)。将由3名分别的供体得到的、通过显微解剖而得的hf亚单元的总rna进行微阵列分析,鉴定hf亚单元特异的、能够识别的基因。将对于2个以上的个体数据不可靠的、或被打上与背景相等的标签的微阵列探针排除在外。其结果以25342个探针作为了分析对象。为了鉴定完整的hf亚单元特异的、能够识别的基因,进一步选择对至少1个hf成分信号强度为50以上的18905个探针进行分析。首先,实施主成分分析(pca),分析总微阵列数据集的相关性。同一个体来源的3个hf亚单元的位置沿着pc1维度密切相关。另一方面,清楚了不同个体来源的同一亚单元的位置沿着pc3维度弱相关(图2)。考虑到它们的个体内差异,在各个个体内进行了比较。以dsc对dp、dsc对uds、和uds对dp进行比较,截止值为1.5倍。清楚了虽然个体内也实质上有差异,但通过pca,3名个体之间不仅dsc,dp和uds图谱也有类似点。2-2.dsc和dp识别基因的提取将在全部3名中共同表达增强或表达抑制的基因的数示于表3。表3其结果在dsc对dp中,鉴定到表达增强的基因63个。其中,除去在uds也表达增强的基因、和5个没有被赋予特征的探针,作为dsc识别基因得到了32个基因(表4)。表42-3.dsc识别基因的特征在上述dsc识别基因列表中,包含以前被报告在真皮鞘(ds)中表达的actin,alpha2,smoothmuscle(alpha-smoothmuscleactin)、prostaglandinereceptor3和matrixmetallopeptidase11(参考文献3~5)。该列表中还包含7个细胞外基质成分:decorin、fibulin2、coiled-coildomaincontaining80、tenascinxb、asporin、hyaluronanandproteoglycanlinkprotein1和matrixmetallopeptidase11,该分类阶元在基因本体分析中,有意义地占大多数。dsc识别基因多数与dp相比,不仅在dsc,而且在uds中也高表达(图3)。其中,6个基因:asporin、danfamilybmpantagonistgremlin2(grem2)、matrixmetallopeptidase11、prostaglandinereceptor3、retinolbindingprotein4和transducin-likeenhancerofsplit4(tle4)在dsc中更高特异性地表达,相对于uds表达增强至少1.5倍(表5)。表52-4.grem2是完整的dsc识别基因。6个dsc特异的基因在与dp和uds两者比较的情况下,在dsc中实质地表达增强。于是,将这些基因中针对grem2的定量pcr在完整的dp和dsc组织中实施。其结果确认了,在与dp比较的情况下,明显dsc特异性地表达增强约10倍以上(图4)。为了进一步确认组织中的grem2基因的特异性表达,进行了原位(insitu)杂交。其结果能够确认在毛囊的毛球中的dsc区域中grem2表达,显示了grem2表达在完整的毛囊中是dsc特异的(图5)。另外,对于作为相同grem家族的grem1,也同样地进行了原位(insitu)杂交,确认了hf中的表达(图6)。2-5.利用生物信息学(insilico)分析来鉴定dsc识别基因的上游调节因子评价表达变化的上游调节因子的分析结果与已报告的文献一致,鉴定了tgf-b1作为dsc识别的9个基因的推定调节因子(图7)。5个基因是参与wnt途径的,其中的一个tle4是作为wnt途径中广为人知的核心成分的groucho家族的成员。作为2个bmp信号拮抗剂的grem1和grem2也还在dsc中表达增强。图7显示dsc识别因子的推定的调节网络和细胞内定位,提示了tgf-b1调节针对dsc特征的细胞外基质成分。<实施例2>将通过与实施例1同样的方法分离的dsc使用amniomax培养基(thermofisher)在37℃、5%co2的条件下、体外(invitro)培养约30天。从培养之前的完整的dsc、和培养之后的dsc回收总rna,与上述1-5.同样地实施qpcr。用gapdh的表达量进行归一化,以完整的dsc的基因表达量为100%时的、培养之后的dsc的基因表达量变成如图8那样。<实施例3>grem2是培养而得的dsc细胞的识别基因,与细胞的集落形成活性相关。将通过与实施例1同样的方法分离的dsc、dp、uds使用amniomax培养基(thermofisher)在37℃、5%co2的条件下、体外(invitro)培养,从传代第1代的各细胞回收总rna,与上述1-5.同样地实施qpcr。将以相对于dsc细胞中的gapdh的表达量的grem2的表达量为100%时的相对的值示于图9(a)。其结果确认了,在dsc细胞中,grem2的表达增强。培养而得的细胞的集落形成能力通过如下方法评价:将1000个细胞接种在10cm平皿中,用amniomax培养基进行培养,数出12天后形成的集落数。其结果确认了,dsc细胞具有高的集落形成活性(图9(b))。<参考文献>1.mcelweekj,kisslings,wenzele,hutha,hoffmannr.culturedperibulbardermalsheathcellscaninducehairfollicledevelopmentandcontributetothedermalsheathanddermalpapilla.jinvestdermatol2003;121:1267-1275.2.niiyamas,happler,hoffmannr.thefeasibilityofquantitativeanalysisofandrogenmetabolismbyuseofsingledermalpapillaefromhumanhairfollicles.expdermatol2001;10:124-127.3.jahodaca,reynoldsaj,chaponnierc,foresterjc,gabbianig.smoothmusclealpha-actinisamarkerforhairfollicledermisinvivoandinvitro.jcellsci1991;99:627-636.4.ishimatsu-tsujiy,moroo,kishimotoj.expressionprofilingandcellularlocalizationofgenesassociatedwiththehaircycleinducedbywaxdepilation.jinvestdermatol2005;125:410-420.5.colombel,micheletjf,bernardba.prostanoidreceptorsinanagenhumanhairfollicles.expdermatol2008;17:63-72.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1