免疫调节性化合物的制作方法
相关申请本申请依据35u.s.c.§119(e),主张2018年6月29日申请的美国临时申请号:62/692,176的优先权,其内容已以全文引用的方式并入本文中。政府授权条款本发明是由政府的国家卫生研究所(nationalinstitutesofhealth)依据授权编号r01ca214608赞助。政府拥有本发明某些权利。
背景技术:
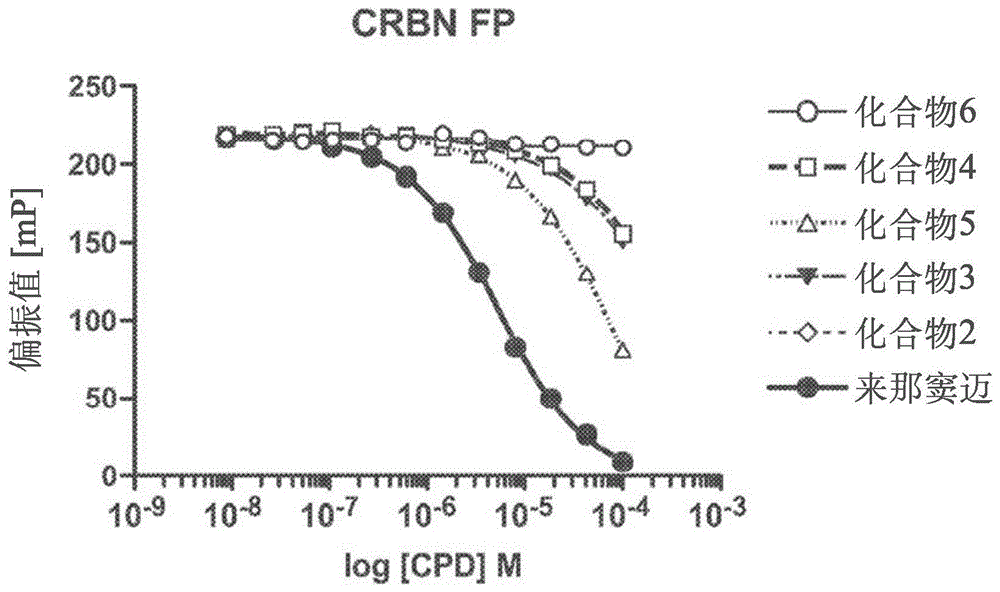
:编码小脑蛋白(crbn)的基因最早是在研究与记忆及学习有关的基因过程中发现;该基因依据其在脑组织发育中推断的角色及因为其特别表达在海马回区域中,命名为crbn,是与记忆及学习过程相关。higgins等人,neurol.63(10):1927-31(2004)。小脑蛋白为一种442个氨基酸的多功能蛋白质,位在人类脑部及其他组织的细胞质、核及周边膜(wada等人,biochem.&biophys.res.comm.477:388-94(2016))。其会与dna损伤-结合性蛋白质-1(ddb1)、cullin4(cul4a及cul4b)、及cullins1的调节剂(roc1)交互作用,形成功能性e3泛素黏接酶复合物,称为crl4crbne3泛素黏接酶复合物。作为此复合物中一部分的小脑蛋白的角色包括靶向蛋白质,通过泛素-蛋白酶体途径进行蛋白质分解(降解)。参见例如:chang等人,int.j.biochem.mol.biol.2(3):287-94(2011)。小脑蛋白与正常细胞及肿瘤细胞的代谢与增生紧密相关。一方面,其存在可以确保离子通道的正常代谢功能及正常生理功能,其等对维持细胞生长及增生很重要。另一方面,小脑蛋白也涉及许多疾病的发生,如:癌症。一般参见shi等人,j.immunol.res.articleid9130608(2017)。免疫调节性药物(「imid」)为一种衍生自沙利窦迈(thalidomide)的新抗癌药,fda已核准该药物用于治疗多发性骨髓瘤。除了沙利窦迈本身,另有两种沙利窦迈类似物:来那窦迈(lenalidomide)及泊马窦迈(pomalidomide),已由fda核准(并已分别以及的名称上市)用于治疗多发性骨髓瘤(及其他疾病)。从其命名法可知imid的首先得知性质之一为其免疫调节能力,包括细胞激素调节作用及t细胞共同刺激作用(schafer等人,j.pharmacol.&exper.ther.305:1222-32(2003)),造成t细胞中产生介白素-2。后来,imid显示对很多种免疫细胞具有多效性,包括活化天然杀手(nk)细胞及抑制b细胞与及单核细胞(corral等人,j.immunol.163:380-6(1999))。已知小脑蛋白为imid的常见主要标靶。例如:已有报告指出,当使用来那窦迈及泊马窦迈治疗时,t细胞会因应而招募ikaros转录因子家族成员:ikaros与aiolos(分别由基因ikaros家族锌指蛋白质1(ikzf1)及ikzf3编码)作为crl4crbn的蛋白质受质,结果会加强产生il-2及其他调节t细胞功能的细胞激素。参见gandhi等人,br.j.hematol.164:811-21(2014)。也有报告指出,来那窦迈,但非泊马窦迈,会诱发蛋白质激酶(酪蛋白激酶1α(ck1α))降解,而发现与5q-缺失相关性骨髓造血不良症候群有关的ck1α单套缺陷。参见等人,nature523:183-8(2015)。结构试验已显示,这些imid结合在小脑蛋白表面上表浅的疏水性口袋中,且该结合是由同时出现在沙利窦迈、来那窦迈及泊马窦迈中的戊二酰亚氨环所介导。最近,已开发一种称为「小脑蛋白调节剂」的crbn-结合性化合物。例如:cc-122是一种名为「多效性途径修饰剂」的新化学物质,会在试管内、活体内、及患者内的弥漫性大b细胞淋巴瘤(dlbcl)及t细胞中,结合小脑蛋白及促进aiolos及ikaros降解,造成细胞自主性及免疫刺激性两种效应。参见hagner等人,blood126(6):779-89(2016)。cc-885是另一种新的小脑蛋白调节剂,已有报告指出其具有远比沙利窦迈、来那窦迈及泊马窦迈更广的抗癌活性。cc-885是由小脑蛋白-依赖性泛素化及转译中止因子谷胱甘肽s-转移酶π基因1(gstp1)的降解所介导。参见matyskiela等人,nature535:252-7(2016)。探讨小脑蛋白作为疾病治疗的介导剂也已发展出杂-双功能性protac(靶向蛋白质分解的嵌合体(proteolysistargetingchimera)),其招募本身即为疾病介导剂的标靶蛋白质(例如:含溴功能域的蛋白质4(brd4))至crl4crbne3泛素黏接酶,造成标靶蛋白质降解。参见例如:lu等人,cellcancerbiol.22(6):755-63(2015)。技术实现要素:本发明第一项实施方式是有关一种具有式(i)所表示结构式的化合物:其中a表示a1、a2、a3、a4或a5:其中x及x1独立表示c或n,限制条件为x及x1其中之一表示n;其中若x1表示n,则r1不存在,及若x1表示c,则r1表示h,或连同r2与其等所键结的其他原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基);r2表示h、卤基、羟基、任选经取代的c1-c4烷氧基、1-苯甲基-4-哌啶氧基、任选经取代的5-或6-元碳环基、任选经取代的5-或6-元杂环基、任选经取代的芳基(其在本文中的定义涵括芳烷基与芳烷氧基)、任选经取代的杂芳基(其在本文中的定义涵括杂芳烷基与杂芳烷氧基)、或nr6r7,其中各r6及r7独立表示h或取代基(例如:任选经取代的氨(例如:nh2)、任选经取代的c1-c4烷基、任选经取代的c1-c4烷氧基、任选经取代的芳基、任选经取代的杂芳基),或r2连同r1与其等所键结的其他原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基);若x表示n,则r3不存在,及若x表示c,则r3独立表示h、卤基、任选经取代的氨(例如:nh2)、羟基、任选经取代的c1-c4烷氧基、1-苯甲基-4-哌啶氧基、任选经取代的5-或6-元碳环基、任选经取代的5-或6-元杂环基、任选经取代的芳基、任选经取代的杂芳基、或nr6r7,或其中r2与r3,或r3与r4,连同其等所键结的原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基);r4及r5各独立表示h、卤基、任选经取代的氨(例如:nh2)、羟基、任选经取代的c1-c4烷氧基、1-苯甲基-4-哌啶氧基、任选经取代的5-或6-元碳环基、任选经取代的5-或6-元杂环基、任选经取代的芳基、任选经取代的杂芳基、或nr6r7,或其中r4与r5,连同其等所键结的原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基);其中r8表示h、任选经取代的c1-c4烷基、任选经取代的氨(例如:nh2)、任选经取代的c1-c4烷氧基、或任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基),及r9表示h、卤基(例如:cl或f)、任选经取代的c1-c4烷基、任选经取代的氨(例如:nh2)、羟基、任选经取代的c1-c4烷氧基、或任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基);其中r10表示h、任选经取代的c1-c4烷基、任选经取代的氨(例如:nh2)、任选经取代的c1-c4烷氧基、任选经取代的芳基、或任选经取代的杂芳基,及r11、r12、r13、r14、及r15各独立表示h、卤基、羟基、任选经取代的c1-c4烷氧基、任选经取代的芳基(其在本文中的定义涵括芳烷基与芳烷氧基)、任选经取代的杂芳基(其在本文中的定义涵括杂芳烷基与杂芳烷氧基)、或nr6r7,其中各r6及r7独立表示h或取代基(例如:任选经取代的氨(例如:nh2)、任选经取代的c1-c4烷基、任选经取代的c1-c4烷氧基、任选经取代的芳基、任选经取代的杂芳基),或r11连同r12与其等所键结的其他原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基),或r12连同r13与其等所键结的其他原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基),或r13连同r14与其等所键结的其他原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基),或r14连同r15与其等所键结的其他原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基);其中r16、r17、r18及r19独立表示h或取代基(例如:任选经取代的氨(例如:nh2)、羟基、任选经取代的c1-c4烷基、任选经取代的c1-c4烷氧基、任选经取代的芳基、任选经取代的杂芳基)或其中r16及r17连同其等所键结的原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)、任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基),或其中r17及r18连同其等所键结的原子共同形成任选经取代的5-或6-元碳环基(例如:苯基)、任选经取代的5-或6-元杂环基(例如:5-或6-元杂芳基),或其中r18及r19连同其等所键结的原子共同形成任选经取代的5-或6-元碳环基(例如:苯基)、或任选经取代的5-或6-元杂环基(例如:5-或6-元杂芳基);或其中r20、r21、r22及r23独立表示h或取代基(例如:任选经取代的氨(例如:nh2)、羟基、任选经取代的c1-c4烷基、任选经取代的c1-c4烷氧基、任选经取代的芳基、任选经取代的杂芳基),或其中r20及r21连同其等所键结的原子共同形成任选经取代的5-或6-元杂环基,或其中r21及r22连同其等所键结的原子共同形成任选经取代的5-或6-元碳环基(例如:苯基)、任选经取代的5-或6-元杂环基(例如:5-或6-元杂芳基),或其中r22及r23连同其等所键结的原子共同形成任选经取代的5-或6-元碳环基(例如:苯基)、或任选经取代的5-或6-元杂环基(例如:5-或6-元杂芳基);或其医药上可接受的盐或立体异构物。在有些实施例中,其中a为a1,并非所有r2、r3、r4、及r5均表示h。有些实施例中,如:当x表示n时,所有r1、r2、r4及r5均表示h。有些实施例中,如:当x1表示n时,所有r2、r3、r4及r5均表示h。有些实施例中,r2、r3、r4、及r5其中之一表示经取代的苯甲氧基基(例如:4-[[4(氧甲基)苯基]甲基]吗啉)或卤基(例如:cl)。在有些实施例中,其中a为a2,r8为h或甲基,及r9为h、羟基、nh2或卤基(例如:cl)。在有些实施例中,其中a为a3,r10为h或甲基,及r11及r12连同其等所键结的原子共同形成任选经取代的5-元杂环基。有些实施例中,r2、r3、r4、及r5其中之一表示经c5-c6杂环取代的苯甲基或1-苯甲基-4-哌啶氧基。在有些实施例中,其中a为a4,r16及r17连同其等所键结的原子共同形成任选经取代的苯基。有些实施例中,r17及r18连同其等所键结的原子共同形成任选经取代的苯基。有些实施例中,r18及r19连同其等所键结的原子共同形成任选经取代的苯基。有些实施例中,苯基是未经取代。在有些实施例中,其中a为a5,r20为h、甲基、苯基或苯甲基,及r21、r22、及r23为h。本发明另一实施方式是有关一种药物组合物,其包括医疗有效量的式(i)化合物或其医药上可接受的盐或立体异构物,及医药上可接受的载剂。本发明再一实施方式是有关一种制造式(i)化合物或其医药上可接受的盐或立体异构物的方法。本发明再一实施方式是有关一种治疗涉及异常(例如:失调)蛋白质活性的疾病或病症的方法,其是对有此需要的个体投与医疗有效量的式(i)化合物或其医药上可接受的盐或立体异构物。本发明化合物没有同时出现在沙利窦迈、来那窦迈、及泊马窦迈中的吡咯啶-2-酮或吡咯啶-2,5-二酮环。本申请者已惊人且意外地发现,即使没有吡咯啶-2-酮或吡咯啶-2,5-二酮环,本发明化合物仍对小脑蛋白具有亲和性,且如同免疫调节性医疗剂,具有小脑蛋白调节活性及功能。在不希望受到任何特定操作理论的限制下,本申请者相信该化合物会与小脑蛋白结合,至少部分归因于吡啶环的nh基团与n原子之间的分子内氢键。也不希望受到任何特定操作理论的限制下,本申请者相信本发明化合物通过组合抗增生及免疫调节效应,而具有其医疗(例如:抗癌)效应或效益。特定言之,相信该化合物与小脑蛋白的结合会赋与针对crl4crbne3泛素黏接酶不同受质特异性。此多样的受质特异性实质上扩大潜在标靶的型态与数量,因此提供广大医疗用途范围。例如:除了ikzf1、与ikzf3、与ck1α的表达产物以外,本发明化合物也可间接靶向小脑蛋白-依赖性泛素化及降解的不同受质的宿主。这些受质可包括例如:序列相似家族83成员f(fam83f)、含dtw功能域1(dtwd1)、ikzf2、ikzf4、ikzf5、锌指蛋白质91同系物(zfp91)、zfp62、zfp36环指蛋白质样(zfp36l2)、环指蛋白质166(rnf166)、ras-相关蛋白质rab-28(rab28)、谷胱甘肽s-转移酶π1(gstp1)、gspt2、粒线体转入内膜转移蛋白子单位(mitochondrialimportinnermembranetranslocasesubunit)tim10(timm10)、gdnf诱发锌指蛋白质1(gzf1)、早期生长反应1(egr1)、癌症的过甲基化1(hic1)、hic2、胰岛素瘤-相关蛋白质2(insm2)、奇跳相关转录因子2(odd-skippedrelatedtransciptionfactor2)(osr2)、蛋白质聚溴-1(pb1)、pr功能域锌指蛋白质15(prd15)、婆罗双树样转录因数1(spaltliketranscriptionfactor1)(sall1)、sall3、sall4、wiz、含锌指及btb功能域的蛋白质17(zbt17)、zbtb39、zbt41、zbt49、zbt7a、zbt7b、zbtb2、与k蛋白质交互作用的锌指蛋白质1(zik1)、锌指蛋白质3(znf3)、znf217、znf276、znf316、znf324b、znf335、znf397、znf407、znf408、znf462、znf483、snf517、znf526、znf581、znf587、znf589、znf618、znf644、znf646、znf653、zn6f54、znf692、znf724、znf771、znf782、znf784、znf814、含锌指及scan功能域10(zsc10)、zsc22、zc827、及具有ufm1-特异性肽酶功能域的锌指(zufsp)。在被目前任一代imid直接靶向的意义上,这些标靶中有些不一定「可以成为药物」。因此本发明化合物的进一步优点是有关靶向小脑蛋白的降解剂,因为其等具有大的弹性连接基,可以挑战药物动力学。附图说明图1a为出示各种不同本发明免疫调节性化合物(本发明化合物2-6)相较于对照组(来那窦迈)的小脑蛋白结合性(以偏振值mp表示)的图。图1b为出示各种不同本发明免疫调节性化合物(本发明化合物23、24及26)相较于对照组(来那窦迈)的小脑蛋白结合性(以偏振值mp表示)的图。具体实施方式除非另有其他说明,否则本文所采用所有技术与科学术语均与本领域技术人员在本文主题所属技艺中所了解的意义相同。除非另有相反说明,否则本说明书及附录的申请专利范围所采用下列术语具有所指示的定义,以协助了解本发明。本说明书及附录的申请专利范围中所采用单数型「一(a)」、「一(an)」、及「该」包括复数型,除非另有其他说明。因此例如:提及的「组合物」包括两种或更多种这些组合物的混合物,提及的「抑制剂」包括两种或更多种这些抑制剂的混合物,及类似物。除非另有其他说明,否则术语「约」意指术语「约」所修饰特定数值的10%内(例如:在5%、2%或1%内)。连接词「包含」是与「包括」、「含有」或「特征在于」为同义字,为涵括性或开放性,没有排除额外的未列举的元素或方法步骤。反之,连接词「由...组成」不包括申请专利范围中没有指明的任何元素、步骤或成份。连接词「基本上由...组成」使申请专利范围限制在指定材料或步骤「及彼等不会实质影响本发明所主张的基本及新颖特征」者。在本发明化合物方面及用于进一步说明本发明化合物的程度上,下列术语适用于下列定义。本文所采用术语「脂族的」是指非环状烃基,包括分支及未分支的烷基、烯基、或炔基。本文所采用术语「烷基」是指饱和的直链或分支链单价烃基。一项实施例中,烷基为c1-c18基团。其他实施例中,烷基为c0-c6、c0-c5、c-0-c3、c1-c12、c1-c8、c1-c6、c1-c5、c1-c4或c1-c3基团(其中c0烷基是指一个键结)。烷基实施例包括甲基、乙基、1-丙基、2-丙基、异丙基、1-丁基、2-甲基-1-丙基、2-丁基、2-甲基-2-丙基、1-戊基、正戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲基-2-丁基、3-甲基-1-丁基、2-甲基-1-丁基、1-己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、2-甲基-3-戊基、2,3-二甲基-2-丁基、3,3-二甲基-2-丁基、庚基、辛基、壬基、癸基、十一烷基及十二烷基。有些实施例中,烷基为c1-c3烷基。有些实施例中,烷基为c1-c2烷基。本文所采用术语「伸烷基」是指连接其余分子与基团的直链或分支的二价烃链,其仅由碳与氢组成,不包含不饱和,且具有1至12个碳原子,例如:亚甲基、伸乙基、伸丙基、伸正丁基,及类似物。伸烷基链可以通过单键附接其余分子及通过单键附接基团。有些实施例中,伸烷基包含1至8个碳原子(c1-c8伸烷基)。其他实施例中,伸烷基包含1至5个碳原子(c1-c5伸烷基)。其他实施例中,伸烷基包含1至4个碳原子(c1-c4伸烷基)。其他实施例中,伸烷基包含1至3个碳原子(c1-c3伸烷基)。其他实施例中,伸烷基包含1至2个碳原子(c1-c2伸烷基)。其他实施例中,伸烷基包含1个碳原子(c1伸烷基)。本文所采用术语「卤烷基」是指如本文定义的烷基经一或多个(例如:1、2、3、或4个)卤基取代。本文所采用术语「烯基」是指具有至少一个碳-碳双键的直链或分支链单价烃基。烯基包括具有「顺式」与「反式」或「e」与「z」取向的基团。一项实施例中,烯基为c2-c18基团。其他实施例中,烯基为c2-c12、c2-c10、c2-c8、c2-c6或c2-c3基团。其实施例包括乙烯基(或vinyl)、丙-1-烯基、丙-2-烯基、2-甲基丙-1-烯基、丁-1-烯基、丁-2-烯基、丁-3-烯基、丁-1,3-二烯基、2-甲基丁-1,3-二烯、己-1-烯基、己-2-烯基、己-3-烯基、己-4-烯基及己-1,3-二烯基。本文所采用术语「炔基」是指具有至少一个碳-碳参键的直链或分支的单价烃基。一项实施例中,炔基为c2-c18基团。其他实施例中,炔基为c2-c12、c2-c10、c2-c8、c2-c6或c2-c3。其实施例包括乙炔基、丙-1-炔基、丙-2-炔基、丁-1-炔基、丁-2-炔基及丁-3-炔基。本文所采用术语「醛」是由式—c(o)h表示。术语「c(o)」及c=o在本文中可交换使用。本文所采用术语「烷氧基」或「烷氧」是指如上述定义的烷基,其具有附接的氧基。表示性烷氧基包括甲氧基、乙氧基、丙基氧、第三丁氧基,及类似物。「醚」为两个烃利用氧共价连接。因此,使烷基形成醚的烷基上的取代基为或类似烷氧基,如:可由-o-烷基、-o-烯基、及-o-炔基其中之一表示。本文所采用术语「卤素」(或「卤」或「卤化物」)是指氟、氯、溴、或碘。本文所采用术语「羧酸」是由式—c(o)oh表示,及「羧酸根」是由式—c(o)o-表示。本文所采用术语「酯」是由式—oc(o)z1或—c(o)oz1表示,其中z1可为烷基、卤化烷基、烯基、炔基、芳基、杂芳基、环烷基、环烯基、杂环烷基、或杂环烯基,其等均如本文说明。本文所采用术语「醚」是由式z1oz2表示,其中z1及z2可独立为烷基、卤化烷基、烯基、炔基、芳基、杂芳基、环烷基、环烯基、杂环烷基、或杂环烯基,其等均如本文说明。本文所采用术语「酮」是由式z1c(o)z2表示,其中a1及a2独立表示烷基、卤化烷基、烯基、炔基、芳基、杂芳基、环烷基、环烯基、杂环烷基、或杂环烯基,其等均如本文说明。本文所采用术语「磺酰基」是指硫-氧代基,由式--s(o)2z1表示,其中z1可为氢、烷基、卤化烷基、烯基、炔基、芳基、杂芳基、环烷基、环烯基、杂环烷基、或杂环烯基,其等均如本文说明。本文所采用术语「磺酰基氨基」(或「磺酰氨基」)是由式--s(o)2nh2表示。本文所采用术语「硫醇」是由式—sh表示。本文所采用术语「环状基团」单独使用或作为较大部分体中一部分时,广义指包含饱和、部分饱和或芳香环系统的任何基团,例如:碳环(环烷基、环烯基)、杂环(杂环烷基、杂环烯基)、芳基与杂芳基。环状基团可具有一或多个(例如:稠合)环系统。因此,例如:环状基团可包含一或多个碳环、杂环、芳基或杂芳基。本文所采用术语「碳环」(也称为「碳环基」)单独使用或作为较大部分体(例如:烷碳环基)中一部分时,是指包含具有3至20个碳原子的饱和、部分不饱和、或芳香环系统的基团。术语碳环基包括单-、二-、三-、稠合、桥连、及螺-环系统,及其组合。一项实施例中,碳环基包括3至15个碳原子(c3-c15)。一项实施例中,碳环基包括3至12个碳原子(c3-c12)。另一项实施例中,碳环基包括c3-c8、c3-c10或c5-c10。另一项实施例中,呈单环的碳环基包括c3-c8、c3-c6或c5-c6。有些实施例中,呈双环的碳环基包括c7-c12。另一项实施例中,呈螺环系统的碳环基包括c5-c12。单环状碳环基的表示性实施例包括环丙基、环丁基、环戊基、1-环戊-1-烯基、1-环戊-2-烯基、1-环戊-3-烯基、环己基、全氘环己基、1-环己-1-烯基、1-环己-2-烯基、1-环己-3-烯基、环己二烯基、环庚基、环辛基、环壬基、环癸基、环十一烷基、苯基、及环十二烷基;具有7至12个环原子的双环状碳环基包括[4,3]、[4,4]、[4,5]、[5,5]、[5,6]或[6,6]环系统,如,例如:双环[2.2.1]庚烷、双环[2.2.2]辛烷、萘、及双环[3.2.2]壬烷。螺碳环基的表示性实施例包括螺[2.2]戊烷、螺[2.3]己烷、螺[2.4]庚烷、螺[2.5]辛烷及螺[4.5]癸烷。术语碳环基包括如本文定义的芳基环系统。术语碳环基也包括环烷基环(例如:饱和或部分不饱和单-、双-、或螺-碳环)。术语碳环基也包括与一或多个(例如:1、2或3个)不同环状基团(例如:芳基或杂环)稠合的碳环,其中基团或附接点在碳环上。因此术语碳环也涵括碳环基烷基,其在本文中用于指如式--rc-碳环基的基团,其中rc为伸烷基链。术语碳环也涵括碳环基烷氧基,其在本文中用于指通过式--o--rc-碳环基的氧原子键结的基团,其中rc为伸烷基链。本文所采用术语「杂环基」单独使用或作为较大部分体中一部分时,是指包含饱和、部分不饱和或芳香环系统的「碳环基」,其中一或多个(例如:1、2、3、或4)个碳原子已被杂原子(例如:o、n、n(o)、s、s(o)、或s(o)2)置换。术语杂环基包括单-、二-、三-、稠合、桥连、及螺环系统,及其组合。有些实施例中,杂环基是指3至15元杂环基环系统。有些实施例中,杂环基是指3至12元杂环基环系统。有些实施例中,杂环基是指饱和环系统、如:3至12元饱和杂环基环系统。有些实施例中,杂环基系指杂芳基环系统,如:5至14元杂芳基环系统。术语杂环基也包括c3-c8杂环烷基,其为包含3-8个碳及一或多个(1、2、3或4个)杂原子的饱和或部分不饱和单-、双-、或螺-环系统。有些实施例中,杂环基包括3至12个环原子,且包括单环、双环、三环及螺环系统,其中环原子为碳,及1至5个环原子为杂原子,如:氮、硫或氧。有些实施例中,杂环基包括具有一或多个选自氮、硫或氧中杂原子的3-至7-元单环。有些实施例中,杂环基包括具有一或多个选自氮、硫或氧中杂原子的4-至6-元单环。有些实施例中,杂环基包括3-元单环。有些实施例中,杂环基包括4-元单环。有些实施例中,杂环基包括5至6元单环。有些实施例中,杂环基包括0至3个双键。上述任一项实施例中,杂环基包括1、2、3或4个杂原子。任何氮或硫杂原子均可任选氧化(例如:no、so、so2),及任何氮杂原子均可任选四级化(例如:[nr4]+cl-、[nr4]+oh-)。杂环基的表示性实施例包括氧杂环丙烷基、氮杂环丙烷基、硫杂环丙烷基、氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、1,2-二硫杂环丁烷基、1,3-二硫杂环丁烷基、吡咯啶基、二氢-1h-吡咯基、二氢呋喃基、四氢哌喃基、二氢噻吩基、四氢噻吩基、咪唑啶基、哌啶基、哌嗪基、吗啉基、硫吗啉基、1,1-二氧代-硫吗啉基、二氢哌喃基、四氢哌喃基、六氢硫哌喃基、六氢嘧啶基、恶嗪烷基、噻嗪烷基、硫杂环己烷基、高碳哌嗪基、高碳哌啶基、氮杂环庚烷基、氧杂环庚烷基、硫杂环庚烷基、氧氮杂环庚烯基、氧氮杂环庚烷基、二氮杂环庚烷基、1,4-二氮杂环庚烷基基、二氮杂环庚烯基、硫氮杂环庚烯基、硫氮杂环庚烷基、四氢硫哌喃基、恶唑啶基、噻唑啶基、异噻唑啶基、1,1-二氧代异噻唑啶酮基、恶唑啶酮基、咪唑啶酮基、4,5,6,7-四氢[2h]吲唑基、四氢苯并咪唑基、4,5,6,7-四氢苯并[d]咪唑基、1,6-二氢咪唑并[4,5-d]吡咯并[2,3-b]吡啶基、噻嗪基、恶嗪基、噻二嗪基、恶二嗪基、二噻嗪基、二恶嗪基、恶噻嗪基、噻三嗪基、恶三嗪基、二噻二嗪基、咪唑啉基、二氢嘧啶基、四氢嘧啶基、1-吡咯啉基、2-吡咯啉基、3-吡咯啉基、吲哚啉基、噻哌喃基、2h-哌喃基、4h-哌喃基、二氧杂环己烷基、1,3-二氧杂环戊烷基、吡唑啉基、吡唑啶基、二硫杂环己烷基、二硫杂环戊烷基、嘧啶酮基、嘧啶二酮基、嘧啶-2,4-二酮基、哌嗪酮基、哌嗪二酮基、吡唑啶基咪唑啉基、3-氮杂双环[3.1.0]己基、3,6-重氮双环[3.1.1]庚基、6-氮杂双环[3.1.1]庚基、3-氮杂双环[3.1.1]庚基、3-氮杂双环[4.1.0]庚基、氮杂双环[2.2.2]己基、2-氮杂双环[3.2.1]辛基、8-氮杂双环[3.2.1]辛基、2-氮杂双环[2.2.2]辛基、8-氮杂双环[2.2.2]辛基、7-氧杂双环[2.2.1]庚烷、氮杂螺[3.5]壬基、氮杂螺[2.5]辛基、氮杂螺[4.5]癸基、1-氮杂螺[4.5]癸烷-2-酮基、氮杂螺[5.5]十一烷基、四氢吲哚基、八氢吲哚基、四氢异吲哚基、四氢吲唑基、1,1-二氧代六氢硫喃基。包含一个硫或氧原子及1至3个氮原子的5-元杂环基实施例为噻唑基,包括噻唑-2-基及噻唑-2-基n-氧化物;噻二唑基,包括1,3,4-噻二唑-5-基及1,2,4-噻二唑-5-基;恶唑基,例如:恶唑-2-基;及恶二唑基,如:1,3,4-恶二唑-5-基、1,2,4-恶二唑-5-基。包含2至4个氮原子的5-元环杂环基实施例包括咪唑基,如:咪唑-2-基;三唑基,如:1,3,4-三唑-5-基;1,2,3-三唑-5-基、1,2,4-三唑-5-基;及四唑基,如:1h-四唑-5-基。苯并稠合的5-元杂环基的表示性实施例为苯并恶唑-2-基、苯并噻唑-2-基及苯并咪唑-2-基。6-元杂环基实施例包含1至3个氮原子及可任选包含一个硫或氧原子,例如:吡啶基,如:吡啶-2-基、吡啶-3-基、及吡啶-4-基;嘧啶基,如:嘧啶-2-基及嘧啶-4-基;三嗪基,如:1,3,4-三嗪-2-基及1,3,5-三嗪-4-基;嗒嗪基,特定言之,嗒嗪-3-基;及吡嗪基。吡啶n-氧化物及嗒嗪n-氧化物及吡啶基、嘧啶-2-基、嘧啶-4-基、嗒嗪基与1,3,4-三嗪-2-基为其他杂环基实施例。有些实施例中,杂环基包括与一或多个(例如:1、2或3个)不同环状基团(例如:碳环或杂环)稠合的杂环,其中该基团或附接点在杂环上,及有些实施例中,其中附接点为含在杂环中的杂原子。因此,术语杂环涵括n-杂环基,其在本文中用于指包含至少一个氮的杂环基,且其中杂环基与其余分子的附接点是通过杂环基中的氮原子。n-杂环基的表示性实施例包括1-吗啉基、1-哌啶基、1-哌嗪基、1-吡咯啶基、吡唑啶基、咪唑啉基及咪唑啶基。术语杂环也涵括c-杂环基,其在本文中用于指包含至少一个杂原子的杂环基,且其中杂环基与其余分子的附接点是通过杂环基中的碳原子。c-杂环基的表示性实施例包括2-吗啉基、2-或3-或4-哌啶基、2-哌嗪基、及2-或3-吡咯啶基。术语杂环也涵括如上文揭示的杂环基烷基,其是指如式--rc-杂环基的基团,其中rc为伸烷基链。术语杂环也涵括杂环基烷氧基,其在本文中用于指通过式--o--rc-杂环基的氧原子键结的基团,其中rc为伸烷基链。本文所采用术语「芳基」单独使用或作为较大部分体中一部分(例如:「芳烷基」,其中烷基上末端碳原子为附接点(例如:苯甲基),「芳烷氧基」,其中氧原子为附接点,或「芳氧烷基」,其中附接点在芳基上)时,是指包括单环、双环或三环状的碳环系统的基团,其包括稠合环,其中系统中至少一个环为芳香族的。有些实施例中,芳烷氧基为苯氧基。术语「芳基」可以与术语「芳基环」交换使用。一项实施例中,芳基包括具有6至18个碳原子的基团。另一项实施例中,芳基包括具有6至10个碳原子的基团。芳基实施例包括苯基、萘基蒽基、联苯基、菲基、稠四苯基、1,2,3,4-四氢萘基、1h-茚基、2,3-二氢-1h-茚基,及类似物,其可经取代或独立经一或多个本文说明的取代基取代。特定芳基为苯基。有些实施例中,芳基包括与一或多个(例如:1、2或3个)不同环状基团(例如:碳环或杂环)稠合的芳基环,其中该基团或附接点在芳基环上。因此,术语芳基涵括上文揭示的芳烷基,是指如式--rc-芳基的基团,其中rc为伸烷基链,如:亚甲基或伸乙基。有些实施例中,芳烷基为任选经取代的苯甲基。术语芳基也涵括芳烷氧基,在本文中用于指通过式--o—rc--芳基的氧原子键结的基团,其中rc为伸烷基链,如:亚甲基或伸乙基。本文所采用术语「杂芳基」单独使用或作为较大部分体中一部分(例如:「杂芳基烷基」(也称「杂芳烷基」)或「杂芳基烷氧基」(也称为「杂芳烷氧基」)时,是指具有5至14个环原子的单环、双环或三环状环系统,其中至少一个环为芳香族的,且包含至少一个杂原子。一项实施例中,杂芳基包括4至6元单环芳香基,其中一个或多个环原子为独立可任选经取代的氮、硫或氧。另一项实施例中,杂芳基包括5至6元单环芳香基,其中一个或多个环原子为氮、硫或氧。杂芳基的表示性实施例包括噻吩基、呋喃基、咪唑基、吡唑基、噻唑基、异噻唑基、恶唑基、异恶基、三唑基、噻二唑基、恶二唑基、四唑基、噻三唑基、恶三唑基、吡啶基、嘧啶基、吡嗪基、嗒嗪基、三嗪基、四嗪基、四唑并[1,5-b]嗒嗪基、嘌呤基、苯并恶唑基、苯并呋喃基、苯并噻唑基、苯并噻二唑基、苯并三唑基、苯并咪唑基、吲哚基、1,3-噻唑-2-基、1,3,4-三唑-5-基、1,3-恶唑-2-基、1,3,4-恶二唑-5-基、1,2,4-恶二唑-5-基、1,3,4-噻二唑-5-基、1h-四唑-5-基、1,2,3-三唑-5-基、及吡啶-2-基n-氧化物。术语「杂芳基」也包括与一或多个环状(例如:碳环基或杂环基)环稠合的杂芳基,其中该基团或附接点在杂芳基环上。其无限制实施例包括吲哚基、异吲哚基、苯并噻吩基、苯并呋喃基、二苯并呋喃基、吲唑基、苯并咪唑基、苯并噻唑基、喹啉基、异喹啉基、噌啉基、酞嗪基、喹唑啉基、喹喔啉基、4h-喹啉嗪基、咔唑基、吖啶基、吩嗪基、吩噻嗪基、吩恶嗪基、四氢喹啉基、四氢异喹啉基及吡啶并[2,3-b]-1,4-恶嗪-3(4h)-酮。杂芳基可能为单-、双-或三环状。有些实施例中,杂芳基包括与一或多个(例如:1、2或3个)不同环状基团(例如:碳环或杂环)稠合的杂芳基环,其中该基团或附接点在杂芳基环上,及有些实施例中,其中附接点为含在杂环中的杂原子。因此,术语杂芳基涵括n-杂芳基,其于本文中用于指如上述定义的杂芳基,其包含至少一个氮及其中杂芳基与其余分子的附接点是通过杂芳基中的氮原子。术语杂芳基也涵括c-杂芳基,其于本文中用于指如上述定义的杂芳基,及其中杂芳基与其余分子的附接点是通过杂芳基中的碳原子。术语杂芳基也涵括如上述定义的杂芳基烷基,是指如式--rc-杂芳基的基团,其中rc为如上述定义的伸烷基链。术语杂芳基也涵括杂芳烷氧基(或杂芳基烷氧基),其在本文中用于指通过式--o--rc-杂芳基的氧原子键结的基团,其中rc为如上述定义的伸烷基。本文所述任何基团可经取代或未经取代。本文所采用术语「经取代」广义指所有容许的取代基,但其限制条件为这些取代是依据被取代的原子及及取代基容许的价数,且取代结果为产生稳定的化合物,也即不会发生自发性转化如:重组、环化、消除,等等的化合物。表示性取代基包括卤素、羟基、及呈直链、分支或环状结构的包含任何碳原子数的任何其他有机基团,例如:1至14个碳原子,且其可包括一或多个(例如:1、2、3、或4个)杂原子,如:氧、硫、及氮。因此取代基的表示性实施例可包括烷基、经取代的烷基、烷氧基、经取代的烷氧基、烯基、经取代的烯基、炔基、经取代的炔基、环基、经取代的环基、碳环、经取代的碳环、杂环、经取代的杂环、芳基(例如:苯甲基及苯基)、经取代的芳基(例如:经取代的苯甲基或苯基)、杂芳基、经取代的杂芳基、芳烷基、经取代的芳烷基、卤基、羟基、芳基氧、经取代的芳基氧、烷基硫、经取代的烷基硫、芳基硫、经取代的芳基硫、氰基、羰基、经取代的羰基、羧基、经取代的羧基、氨基(例如:nh2)、经取代的氨基、酰氨基、经取代的酰氨基、吗啉基、磺酰基、经取代的磺酰基、氨基酸、及肽基。广义上,本发明是有关一种具有由式(i)表示结构的化合物:其中a表示a1、a2、a3、a4或a5;其中x及x1独立表示c或n,限制条件为x及x1其中之一表示n;其中若x1表示n,则r1不存在,及若x1表示c,则r1表示h,或连同r2与其等所键结的其他原子共同形成任选经取代的5-或6-元碳环基(例如:可任选为苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基);r2表示h、卤基、羟基、任选经取代的c1-c4烷氧基、1-苯甲基-4-哌啶氧基、任选经取代的5-或6-元碳环基、任选经取代的5-或6-元杂环基、任选经取代的芳基(其在本文中的定义涵括芳烷基与芳烷氧基)、任选经取代的杂芳基(其在本文中的定义涵括杂芳烷基与杂芳烷氧基)、或nr6r7,其中各r6及r7独立表示h或取代基(例如:任选经取代的氨(例如:nh2)、任选经取代的c1-c4烷基、任选经取代的c1-c4烷氧基、任选经取代的芳基、任选经取代的杂芳基),或r2连同r1与其等所键结的其他原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基);若x表示n,则r3不存在,及若x表示c,则r3独立表示h、卤基、羟基、任选经取代的氨(例如:nh2)、任选经取代的c1-c4烷氧基、1-苯甲基-4-哌啶氧基、任选经取代的5-或6-元碳环基、任选经取代的5-或6-元杂环基、任选经取代的芳基、任选经取代的杂芳基、或nr6r7,或其中r2与r3,或r3与r4,连同其等所键结的原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基);r4及r5各独立表示h、卤基、羟基、任选经取代的氨(例如:nh2)、任选经取代的c1-c4烷氧基、1-苯甲基-4-哌啶氧基、任选经取代的5-或6-元碳环基、任选经取代的5-或6-元杂环基、任选经取代的芳基、任选经取代的杂芳基、或nr6r7,或其中r4与r5,连同其等所键结的原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基);其中r8表示h、任选经取代的c1-c4烷基、任选经取代的氨(例如:nh2)、任选经取代的c1-c4烷氧基、任选经取代的芳基、或任选经取代的杂芳基,及r9表示h、卤基(例如:cl或f)、羟基、任选经取代的c1-c4烷基、任选经取代的氨(例如:nh2)、任选经取代的c1-c4烷氧基、任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)、或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基);其中r10表示h、任选经取代的c1-c4烷基、任选经取代的氨(例如:nh2)、任选经取代的c1-c4烷氧基、任选经取代的芳基、或任选经取代的杂芳基,及r11、r12、r13、r14、及r15各独立表示h、卤基、羟基、任选经取代的c1-c4烷氧基、任选经取代的芳基(其在本文中的定义涵括芳烷基与芳烷氧基)、任选经取代的杂芳基(其在本文中的定义涵括杂芳烷基与杂芳烷氧基)、或nr6r7,其中各r6及r7独立表示h或取代基(例如:任选经取代的氨(例如:nh2)、任选经取代的c1-c4烷基、任选经取代的c1-c4烷氧基、任选经取代的芳基、任选经取代的杂芳基),或r11连同r12与其等所键结的其他原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基),或r12连同r13与其等所键结的其他原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基),或r13连同r14与其等所键结的其他原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基),或r14连同r15与其等所键结的其他原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)或任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基);其中r16、r17、r18及r19独立表示h或取代基(例如:任选经取代的氨(例如:nh2)、羟基、任选经取代的c1-c4烷基、任选经取代的c1-c4烷氧基、任选经取代的芳基、任选经取代的杂芳基),或其中r16及r17连同其等所键结的原子共同形成任选经取代的5-或6-元碳环基(例如:任选经取代的苯基)、任选经取代的5-或6-元杂环基(例如:任选经取代的5-或6-元杂芳基),或其中r17及r18连同其等所键结的原子共同形成任选经取代的5-或6-元碳环基(例如:苯基)、任选经取代的5-或6-元杂环基(例如:5-或6-元杂芳基),或其中r18及r19连同其等所键结的原子共同形成任选经取代的5-或6-元碳环基(例如:苯基)、或任选经取代的5-或6-元杂环基(例如:5-或6-元杂芳基);或其中r20、r21、r22及r23独立表示h或取代基(例如:任选经取代的氨(例如:nh2)、羟基、任选经取代的c1-c4烷基、任选经取代的c1-c4烷氧基、任选经取代的芳基、任选经取代的杂芳基),或其中r20及r21连同其等所键结的原子共同形成任选经取代的5-或6-元杂环基,或其中r21及r22连同其等所键结的原子共同形成任选经取代的5-或6-元碳环基(例如:苯基)、任选经取代的5-或6-元杂环基(例如:5-或6-元杂芳基),或其中r22及r23连同其等所键结的原子共同形成任选经取代的5-或6-元碳环基(例如:苯基)、或任选经取代的5-或6-元杂环基(例如:5-或6-元杂芳基);或其医药上可接受的盐或立体异构物。在有些实施例中,其中a为a1,并非所有r2、r3、r4、及r5均表示h。有些实施例中,如:当x表示n时,所有r1、r2、r4及r5表示h。有些实施例中,如:当x1表示n时,所有r2、r3、r4及r5表示h。有些实施例中,r2、r3、r4、及r5其中之一表示经取代的苯甲氧基基(例如:4-[[4(氧甲基)苯基]甲基]吗啉)、或卤基(例如:cl)。有些实施例中,r1及r2连同其等所键结的原子共同形成任选经取代的6-元杂芳基,如:吡啶基。在有些实施例中,其中a为a2,r8为h或甲基,及r9为h、羟基、nh2或卤基(例如:cl)。在有些实施例中,其中a为a3,r10为h或甲基,及r11及r12连同其等所键结的原子共同形成任选经取代的5-元杂环基。在有些实施例中,其中a为a4,r16及r17连同其等所键结的原子共同形成任选经取代的6-元芳基环。有些实施例中,r17及r18连同其等所键结的原子共同形成任选经取代的6-元芳基环。有些实施例中,r18及r19连同其等所键结的原子共同形成任选经取代的6-元芳基环。有些实施例中,由r16与r17,或由r17与r18,或由r18与r19形成的芳基为苯基。有些实施例中,6-元芳基是未经取代。在有些实施例中,其中a为a5,r20为h、甲基、苯基或苯甲基,及r21、r22、与r23为h。在有些实施例中,其中a为a1,x为c,及x1为n,式(i)化合物是由式(ia)表示:或其医药上可接受的盐或立体异构物。在有些实施例中,其中a为a1,x为c,及x1为n,r2、r3、r4、与r5其中之一表示经c5-c6杂环取代的苯甲基或1-苯甲基-4-哌啶氧基。在有些实施例中,其中a为a1,及x与x1均为c,及式(i)化合物是由式(ib)表示:或其医药上可接受的盐或立体异构物。在有些实施例中,其中a为a1,及x与x1均为n,及式i化合物是由式(ic)表示:或其医药上可接受的盐或立体异构物。有些实施例中,本发明式(i)化合物是由下列结构式表示:及或其医药上可接受的盐或立体异构物。本发明化合物可呈游离酸或游离碱型、或其医药上可接受的盐型。本文所采用术语「医药上可接受」是指一种不会破坏该化合物的生物活性或性质,且相当无毒性的材料,也即该材料可以投与个体,不会引发不期望的生物效应(如:眩晕或胃部不适)或与包含该材料的组合物中任何组份发生有害的交互作用。术语「医药上可接受的盐」是指由本发明化合物与合适酸或碱反应得到的产物。本发明化合物的医药上可接受的盐实施例包括彼等衍生自合适无机碱者,如:li、na、k、ca、mg、fe、cu、al、zn及mn盐类。医药上可接受的无毒性酸加成盐实施例为由氨基与无机酸形成的盐类,如:盐酸盐、氢溴酸盐、氢碘酸盐、硝酸盐、硫酸盐、硫酸氢盐、磷酸盐、异烟酸盐、乙酸盐、乳酸盐、水杨酸盐、柠檬酸盐、酒石酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡糖酸盐、葡糖二酸盐、糖酸盐、甲酸盐、苯甲酸盐、麸氨酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、4-甲基苯磺酸盐或对甲苯磺酸盐、及类似物。某些本发明化合物可与各种不同有机碱形成医药上可接受的盐,如:离氨酸、精氨酸、胍、二乙醇氨或二甲双胍(metformin)。有些实施例中,式(i)化合物为同位素衍生物,其中其具有至少一个取代原子的所需同位素,其含量超过天然同位素的丰度,也即富集。一项实施例中,该化合物包括氘或多个氘原子。被较重同位素(如:氘,也即2h)取代,可以因提高代谢稳定性,而产生某些医疗优点剂,例如:延长活体内半衰期或降低剂量需求,因此有利于某些环境。本发明化合物可能具有至少一个对掌性中心,因此可能呈立体异构物型,本文所采用立体异构物涵括个别化合物的所有异构物,其等的差异仅在原子的空间排列上。术语「立体异构物」包括化合物的镜像异构物(对映异构物,包括化合物的(r-)或(s-)组态)、镜像异构物的混合物(对映异构性的物理性混合物,及消旋物或消旋混合物)、化合物的几何(顺式/反式或e/z、r/s)异构物、及具有超过一个彼此不呈镜像的对掌性中心的化合物的异构物(非对映异构物)。化合物的对掌性中心可能进行活体内差向异构化;因此针对这些化合物,投与呈其(r-)型的化合物即视为等同投与呈其(s-)型的化合物。因此,本发明化合物可以制备及使用个别异构物型式,且实质上没有其他异构物的型式,或呈各种不同异构物的混合物型式,例如:立体异构物的消旋混合物型式。此外,本发明化合物涵括使用具有相同活性型态的化合物的n-氧化物、结晶型(也称为多晶型)、活性代谢物、互变异构物、及未溶剂化及与医药上可接受的溶剂(如:水、乙醇、及类似物)的溶剂化型。本文所提供接合物的溶剂化型也视为本文的揭示内容。合成方法另一项实施方式中,本发明是有关一种制造式(i)化合物或其医药上可接受的盐或立体异构物的方法。广义上,本发明化合物或其医药上可接受的盐或立体异构物均可采用适用于制备化学上相关化合物的任何已知制法制备。本发明化合物将可由各种不同操作实施例中所说明的相关合成反应图中进一步了解,其等说明可制备本发明化合物的无限制性实施例。药物组合物本发明另一实施方式是有关一种药物组合物,其包括医疗有效量的式(i)化合物或其医药上可接受的盐或立体异构物,及医药上可接受的载剂。相关领域已知,术语「医药上可接受的载剂」是指适合投与本发明化合物给哺乳动物的医药上可接受的材料、组合物或媒剂。合适载剂可包括例如:液体(包括水性与非水性,等等,及其组合)、固体、囊封材料、气体、及其组合(例如:半固体),及气体,其功能在于从一个器官或身体的一部分携带或转运化合物到另一个器官或身体的一部分。载剂为「可接受」的意义在于其在生理上对调配物中其他成份呈惰性且可以相容,并对个体或患者无害。依调配物型态而定,组合物可包括一或多种医药上可接受的赋形剂。广义上,式(i)化合物可依据惯用的医药操作,如:惯用的混合、溶解、造粒、制作糖衣、细磨、乳化、包埋、囊封及压缩制程,调配成指定组合物型态(参见例如:remington:thescienceandpracticeofpharmacy(第20版),a.r.gennaro,lippincottwilliams&wilkins编辑,2000;及encyclopediaofpharmaceuticaltechnology,eds.j.swarbrickandj.c.boylan,1988-1999,marceldekker,newyork)。调配物型态依投药模式而,可包括经肠式(例如:经口、颊、舌下及直肠)、非经肠式(例如:皮下(s.c.)、静脉内(i.v.)、肌内(i.m.)、及胸骨内注射、或输注技术、眼内、动脉内、髓内、鞘内、脑室内、穿皮式、皮内、阴道内、腹膜内、黏膜、鼻、气管内滴注、支气管滴注、及吸入)及局部表面(例如:穿皮式)。通常,最适当的投药途径将随各种不同因素决定,包括例如:药剂性质(例如:其在胃肠环境中的稳定性)、及/或个体的条件(例如:该个体是否可以耐受经口投药)。例如:非经肠式(例如:静脉内)投药法也有利于可以相当快速投药的化合物,如:在单剂处理及/或急性病症的情况下。有些实施例中,组合物是调配成经口或静脉内投药(例如:全身性静脉内注射)。因此,本发明化合物可调配成固体组合物(例如:粉剂、锭剂、匀散性粒剂、胶囊、药包、及栓剂)、液体组合物(例如:其中化合物已溶解的溶液、其中化合物的固体粒子已匀散的悬浮液、乳液、及包含微脂粒、胶束或奈米粒子的溶液、糖浆及酏剂);半固体组合物(例如:凝胶、悬浮液及乳霜);及气体(例如:气雾组合物的推进剂)。化合物也可调配成快速、立即或延长释放。经口投药的固体剂型包括胶囊、锭剂、丸剂、粉剂、及粒剂。这些固体剂型中,由活性化合物与载剂(如:柠檬酸钠或磷酸二钙)及额外载剂或赋形剂混合,如:a)填料或补充剂,如:淀粉、乳糖、蔗糖、葡萄糖、甘露糖醇、及硅酸,b)结合剂,如,例如:甲基纤维素、微晶纤维素、羟基丙基甲基纤维素、羧甲基纤维素、羧基甲基钠纤维素、藻酸盐、明胶、聚乙烯吡咯啶酮、蔗糖、及金合欢胶,c)保湿剂,如:甘油,d)崩解剂,如:交联聚合物(例如:交联聚乙烯吡咯啶酮(交聚维酮(crospovidone))、交联羧甲基钠纤维素(croscarmellosesodium)、淀粉乙醇酸钠、洋菜、碳酸钙、马铃署或树薯淀粉、藻酸、某些硅酸盐、及碳酸钠,e)延缓溶解剂,如:石蜡,f)促进吸收剂,如:四级铵化合物,g)湿化剂,如,例如:黥蜡醇及甘油单硬脂酸酯,h)吸收剂,如:高岭土及膨土,及i)润滑剂,如:滑石、硬脂酸钙、硬脂酸镁、固态聚乙二醇、月桂基硫酸钠、及其混合物。以胶囊、锭剂、及丸剂为例,剂型也可包括缓冲剂。在使用诸如:乳糖或奶糖及高分子量聚乙二醇及类似物的赋形剂的软式及硬式填充胶囊中,也可使用类似型态的固体组合物作为填料。锭剂、糖衣锭、胶囊、丸剂、与粒剂的固体剂型可以制备包衣及包壳,如:肠溶性包衣及其他包衣。其等可以进一步包含不透明剂。有些实施例中,本发明化合物可以调配成硬式或软式明胶囊。可使用的表示性赋形剂包括预糊化淀粉、硬脂酸镁、甘露糖醇、硬脂基富马酸钠、无水乳糖、微晶纤维素及交联羧甲基纤维素钠。明胶壳可包括明胶、二氧化钛、氧化铁及着色剂。经口投药的液体剂型包括溶液、悬浮液、乳液’微乳液、糖浆、及酏剂。除了化合物以外,相关领域常用的液体剂型可包含水性或非水性载剂(依化合物溶解度而定),如,例如:水或其他溶剂、溶解剂及乳化剂,如:乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苯甲基酯、丙二醇、1,3-丁二醇、二甲基甲酰氨、油类(特定言之,棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油、及芝麻油)、甘油、四氢糠醇、聚乙二醇、及山梨糖醇酐的脂肪酸酯、及其混合物。经口组合物也可包括诸如:湿化剂、悬浮剂、着色剂、甜味剂、调味剂、及香料的赋形剂。注射制剂可包括无菌水溶液或油性悬浮液。其等可使用合适匀散剂或湿化剂及悬浮剂,依据标准技术调配。无菌注射制剂也可为含于无毒性的非经肠式可接受的稀释剂或溶剂中的无菌注射用溶液、悬浮液、或乳液,例如:呈1,3-丁二醇溶液。可接受的媒剂及溶剂中,可使用水、林格氏溶液(ringer'ssolution)、u.s.p.及等渗性氯化钠溶液。此外,常使用固定油类作为溶剂或悬浮介质。基于此目的,可采用任何温和的固定油,包括合成性单酸-或二酸甘油酯。此外,注射制剂中可使用诸如:油酸的脂肪酸。注射用调配物可经过杀菌,例如:通过除菌滤网过滤,或添加杀菌剂,其可呈无菌固体组合物型式,在使用前先溶解或匀散于无菌水或其他无菌注射介质中。可利用水溶性差的液体悬浮液或结晶或非晶形材料,减慢吸收性,以延长化合物的效力。也可由化合物悬浮在油性媒剂中,延长非经肠式投与的调配物中的化合物吸收。某些实施例中,式(i)化合物可局部投药,而非全身投药,例如:直接注射接合物至器官中,经常呈储积式制剂或持续释放式调配物。明确实施例中,长效性调配物的投药法为植入(例如:皮下或肌内)或肌内注射。储积型注射剂的制法为由化合物在生物可降解聚合物(例如:聚丙交酯-聚乙醇酸酯、聚(正酸酯)及聚(酸酐)中形成微胶囊母质。化合物的释放速率可以通过改变化合物对聚合物的比例及所使用特定聚合物的性质来控制。也可制备储积式注射用调配物,其是由化合物包埋在可与体组织相容的微脂粒或微乳液中。此外,其他实施例中,化合物是于靶向药物传递系统中传递,例如:含在包覆器官特异性抗体的微脂粒中。这些实施例中,由微脂粒靶向该器官并被选择性吸收。本发明化合物可调配成经颊或舌下投药,其实施例包括锭剂、含锭及凝胶。化合物可调配成供吸入投药。适合吸入投药的各种不同型式包括气雾剂、喷雾或粉剂。药物组合物可从加压罐或雾化器,使用合适推进剂(例如:二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其他合适气体),呈气雾喷洒型式传递。有些实施例中,加压气雾剂的剂量单位可利用传递定量的阀门决定。有些实施例中,可调配包括明胶的胶囊及卡管,例如:用于吸药器或吹药器,其中包含化合物与合适粉末基质(如:乳糖或淀粉)的粉末混合物。双特异性式(i)化合物可调配成供局部表面投药,其用于本文中指施用调配物至表皮进行皮内投药。这些组合物型态通常呈油膏、糊剂、乳霜、洗液、凝胶、溶液及喷雾。适用于调配局部表面投药用组合物的载剂的表示性实施例包括溶剂(例如:醇类、多元醇、水)、乳霜、洗液、油膏、油类、贴布、微脂粒、粉剂、乳液、微乳液、及缓冲溶液(例如:低张性或缓冲生理盐水)。例如:乳霜可使用饱和或不饱和脂肪酸调配,如:硬脂酸、棕榈酸、油酸、棕榈-油酸、鲸蜡醇或油醇。乳霜也可包含非离子性界面活性剂,如:聚氧-40-硬脂酸酯。有些实施例中,局部表面用调配物也可包括赋形剂,其实施例为渗透加强剂。这些制剂可以转运医药活性化合物通过角质层,进入表皮或真皮,优选是很少或没有全身性吸收。已评估许多种不同化合物可以有效加强药物通过皮肤的渗透速率。参见例如:percutaneouspenetrationenhancers,maibachh.i.及smithh.e.(编辑),crcpress,inc.,bocaraton,fla.(1995),其分析各种不同皮肤渗透加强剂的用法及试验,及buyuktimkin等人,chemicalmeansoftransdermaldrugpermeationenhancementintransdermalandtopicaldrugdeliverysystems,gosht.k.,pfisterw.r.,yums.i.(编辑),interpharmpressinc.,buffalogrove,ill.(1997)。渗透加强剂的表示性实施例包括三酸甘油酯(例如:大豆油)、芦荟组合物(例如:芦荟凝胶)、乙醇、异丙醇、辛酰基苯基聚乙二醇、油酸、聚乙二醇400、丙二醇、n-癸基甲基亚砜、脂肪酸酯(例如:肉荳蔻酸异丙基酯、月桂酸甲基酯、单油酸甘油酯、及单油酸丙二醇酯)、及n-甲基吡咯啶酮。可包括在局部表面用及其他型态调配物(只要可以相容即可)的赋形剂的表示性实施例包括防腐剂、抗氧化剂、湿润剂、软化剂、缓冲剂、溶解剂、皮肤保护剂、及界面活性剂。合适防腐剂包括醇类、四级氨类、有机酸类、对羟基苯甲酸酯类(paraben)、及苯酚类。合适抗氧化剂包括抗坏血酸及其酯类、亚硫酸氢钠、丁基化羟基甲苯、丁基化羟基苯甲醚、生育酚、及螯合剂,如:edta与柠檬酸。合适湿润剂包括甘油、山梨糖醇、聚乙二醇、尿素、及丙二醇。合适缓冲剂包括柠檬酸、盐酸、及乳酸缓冲剂。合适溶解剂包括四级铵氯化物、环糊精、苯甲酸苯甲酯、卵磷脂、及聚山梨酸酯。合适的皮肤保护剂包括维他命e油、尿囊素、二甲基硅酮、甘油、凡士林、及氧化锌。穿皮式调配物通常使用穿皮传递装置及穿皮式传递贴布,其中化合物是在亲脂性乳液或缓冲水溶液中调配,可溶解及/或匀散在聚合物或胶黏剂中。贴布的构造可以为连续式、脉冲式、或依需要传递药剂。化合物的穿皮式传递可以利用离子导入式贴布达成。穿皮式贴布可以控制化合物的传递,其中利用控制速率的薄膜或由化合物包埋在聚合物基质或凝胶中,减慢吸收速率。可利用吸收加强剂来增加吸收,其实施例包括促进通过皮肤的可吸收性医药上可接受的溶剂。眼用调配物包括滴眼剂。供直肠投药的调配物包括灌肠剂、直肠用凝胶、直肠用泡沫剂、直肠用气雾剂、及滞留性灌肠剂,其可包含常用栓剂基质,如:可可奶油或其他甘油酯,及合成性聚合物,如:聚乙烯吡咯啶酮、peg、及类似物。供直肠或阴道投药的组合物也可调配成栓剂,其制法为混合化合物与合适的无刺激性载剂及赋形剂,如:可可奶油、脂肪酸甘油酯的混合物、聚乙二醇、栓剂基质、及其组合,其等均在环境温度下呈固态,但在体温下呈液态,因此会在直肠或阴道腔内融化,并释出化合物。剂量本文所采用术语「医疗有效量」是指式(i)化合物或其医药上可接受的盐或立体异构物可以有效产生所需医疗反应时的用量。因此术语「医疗有效量」包括式(i)化合物或其医药上可接受的盐或立体异构物在投药时可以在接受治疗的个体中对所治疗疾病或病症诱发正向改变,或足以阻止该疾病或病症发展或演进,或在某些程度上缓和该疾病或病症的一或多种症状时,或仅单纯杀死或抑制罹病(例如:癌症)细胞的生长的用量。化合物的总日剂量及其用法可以依据标准医学操作法决定,例如:由参与的医师采用完整的医学判断来决定。针对任何特定个体的明确医疗有效量将依据各种不同因素而定,包括所治疗疾病或病症及其严重性(例如:其现况);所采用明确化合物的活性;所采用明确组合物;个体的体重、一般健康、性别、及膳食;投药时间、投药途径、及该明确化合物的排泄速率;治疗时间期;与所采用明确化合物组合或并用的药物;及医学领域上习知的类似因素(参见例如:goodman与gilman的「thepharmacologicalbasisoftherapeutics」,第10版,a.gilman,j.hardman与l.limbird编辑,mcgraw-hillpress,155-173,2001)。本发明化合物的有效剂量范围很广。有些实施例中,总日剂量(例如:成人)范围可在约0.001至约1600mg、0.01至约1600mg、0.01至约500mg、约0.01至约100mg、约0.5至约100mg、每日1至约100至400mg、每日约1至约50mg、及每日约5至约40mg,其他实施例为每日约10至约30mg。可以依据每日投与化合物的次数调配个别剂量,以包含所需剂量。例如:可以调配胶囊为包含约1至约200mg的化合物(例如:1、2、2.5、3、4、5、10、15、20、25、50、100、150、及200mg)。有些实施例中,可以依据每日投与化合物的次数调配个别剂量,以包含所需剂量。使用方法有些实施方式中,本发明化合物适用于治疗特征在于可被小脑蛋白靶向降解的蛋白质出现异常(例如:功能障碍或失调)或由该蛋白质所介导的疾病及病症,该蛋白质参与该疾病或病症的起始、一或多种症状或标记物的表征、严重性或演进),及其中标靶蛋白质的降解可以赋与医疗效益。该疾病或病症可称为特征在于异常蛋白质活性(例如:突变型蛋白质的表达,或野生型蛋白质的含量相对于无病变状态提高)或由该异常蛋白质活性所介导。这些疾病的特征也在于与蛋白质的排除特别相关/敏感,此时是由蛋白酶体降解,同时其本身不一定会突变或过度表达。个体的「疾病」通常指其中个体的健康状况无法维持稳衡,及其中若疾病无法缓解,则个体的健康会持续恶化。反之,个体的「病症」是其中个体的健康状况可以维持稳衡,但其中个体的健康状况会比没有该病症时更不利。若未治疗,病症不一定会造成动物健康状况进一步下降。本文所采用术语「个体」(或「患者」)包括动物界中容易罹患或正罹患所指示疾病或病症的所有成员。有些实施例中,个体为哺乳动物,例如:人类或非人类哺乳动物。该等方法也适用于宠物动物,如:狗与猫,及牲畜,如:牛、马、绵羊、山羊、猪,及其他家畜与野生动物。「需要」根据本发明治疗的个体可能「罹患或疑似罹患」特定疾病或病症,可能经过阳性诊断或存在够多数量的风险因子或够多数量症兆或症状或组合,因此医学专业人士得以诊断或怀疑该个体罹患该疾病或病症。因此,罹患或疑似罹患特定疾病或病症的个体不一定为两个独立的族群。有些实施例中,式(i)化合物适用于治疗特征在于由选自下列各物所组成群组中的蛋白质或由该等蛋白质介导的细胞增生性疾病及病症:酪蛋白激酶1α(ck1α)-、序列相似家族83成员f(fam83f)-、含dtw功能域1(dtwd1)-、锌指蛋白质91同系物(zfp91)-、zfp62-、zfp36环指蛋白质样(zfp36l2)-、环指蛋白质166(rnf166)-、ikaros家族锌指蛋白质1(ikzf1)-、ikzf2-、ikzf3-、ikzf4-、ikzf5-、ras-相关蛋白质rab-28(rab28)-、谷胱甘肽s-转移酶π1(gstp1)-、gspt2-、粒线体转入内膜转移蛋白子单位tim10(timm10)-、gdnf诱导性锌指蛋白质1(gzf1)-、早期生长反应1(egr1)-、癌症的过甲基化1(hic1)-、hic2-、胰岛素瘤-相关蛋白质2(insm2)-、奇跳相关转录因子2(odd-skippedrelatedtransciptionfactor2)(osr2)-、蛋白质聚溴-1(pb1)-、pr功能域锌指蛋白质15(prd15)-、婆罗双树样转录因子1(spaltliketranscriptionfactor1)(sall1)-、sall3-、sall4-、wiz-、含锌指及btb功能域蛋白质17(zbt17)-、zbt41-、zbt49-、zbt7a-、zbt7b-、zbtb2-、zbtb39-、与k蛋白质交互作用的锌指蛋白质1(zik1)-、锌指蛋白质3(znf3)-、znf217-、znf276-、znf316-、znf324b-、znf335-、znf397-、znf407-、znf408-、znf462-、znf483-、snf517-、znf526-、znf581-、znf587-、znf589-、znf618-、znf644-、znf646-、znf653-、znf654-、znf692-、znf724-、znf771-、znf782-、znf784-、znf814-、含锌指及scan功能域10(zsc10)-、zsc22-、zc827-、或具有ufm1-特异性肽酶功能域的锌指(zufsp)。如上文所揭示,相信这些蛋白质可以与小脑蛋白及式(i)化合物之间形成的复合物结合。有些实施例中,式(i)化合物适用于治疗细胞增生性疾病及病症(例如:癌症或良性新生赘瘤)。本文所采用术语「细胞增生性疾病或病症」是指特征在于细胞生长失调或异常或二者的病症,包括非癌性病症、癌变前病症、及癌症。适用于本发明化合物治疗的非癌性(例如:细胞增生)疾病或病症型态实施例包括炎性疾病及病症、自体免疫疾病、神经变性疾病、心脏疾病、病毒疾病、慢性及急性肾脏疾病或损伤、代谢疾病、及过敏性与遗传性疾病。明确的非癌性疾病及病症的表示性实施例包括类风湿关节炎、圆秃、淋巴细胞增生性病症、自体免疫血液病症(例如:溶血性贫血、再生障碍性贫血、少汗性外胚层发育不良症、纯红血球再生不良及特发性血小板减少症)、胆囊炎、肢端肥大症、类风湿脊椎炎、骨关节炎、痛风、硬皮症、败血症、败血性休克、泪腺炎、cryopyrin相关周期性症候群(cryopyrin-associatedperiodicsyndrome)(caps)、内毒素性休克、子宫内膜炎、格兰阴性败血症、干性角膜结膜炎、中毒性休克症候群、气喘、成人呼吸窘迫症候群、慢性阻塞性肺疾病、慢性肺发炎、慢性移植物排斥、化脓性汗腺炎、发炎性肠道疾病、克隆氏症(crohn’sdisease)、贝塞特氏症候群(ssyndrome)、全身性红斑性狼疮、肾丝球肾炎、多发性硬化症、幼发型糖尿病、自体免疫性葡萄膜视网膜炎、自体免疫性脉管炎、甲状腺炎、爱迪生氏症(addison’sdisease)、扁平苔藓、阑尾炎、大水疱性天疱疮样病、寻常型天疱疮、落叶型天疱疮、肿瘤伴生性天疱疮、重症肌无力、免疫球蛋白a肾病变、自体免疫性甲状腺炎或桥本氏症(hashimoto’sdisease)、修格兰氏症候群(sjogren’ssyndrome)、白斑、韦格纳氏肉芽肿(wegenergranulomatosis)、肉芽肿性睪丸炎、自体免疫卵巢炎、类肉瘤、风湿性心脏炎、僵直性脊椎炎、葛瑞夫兹病(grave’sdisease)、自体免疫血小板减少性紫癜、干癣、干癣性关节炎、湿疹、疱疹样皮炎、溃疡性结肠炎、胰脏纤维化、肝炎、肝纤维化、cd14介导的败血症、非-cd14介导的败血症、急性及慢性肾病、大肠激躁症、发热、血管再狭窄、脑性疟疾、子宫颈炎、中风及缺血性伤害、神经创伤、急性及慢性疼痛、过敏性鼻炎、过敏性结膜炎、慢性心脏衰竭、充血性心脏衰竭、急性冠状动脉症候群、恶病质、疟疾、麻疯病、利什曼原虫症(leishmaniasis)、莱姆病(lymedisease)、莱特氏症候群(reiter’ssyndrome)、急性滑膜炎、肌肉变性、黏液囊炎、肌腱炎、肌腱滑膜炎、椎间盘突出、破裂、或脱垂症候群、骨硬化症、鼻窦炎、血栓形成、硅肺、肺脏类肉瘤症、骨质再吸收症(如:骨质疏松症)、移植物对抗宿主反应、纤维肌痛、aids及其他病毒疾病(如:带状疱疹(herpeszoster)、单纯疱疹i或ii、流感病毒及巨细胞病毒)、i及ii型糖尿病、肥胖、胰岛素抗性及糖尿病性视网膜病变、22q11.2缺失症候群、天使症候群(angelmansyndrome)、卡纳万病(canavandisease)、乳糜泻、恰克-马利-杜斯氏症(charcot-marie-toothdisease)、色盲、猫叫症候群(criduchat)、唐氏症候群、囊状纤维化、裘馨氏肌肉失养症(duchennemusculardystrophy)、血友病、克林那费尔特症候群(klinefleter’ssyndrome)、神经纤维瘤症候群、苯酮尿症、普瑞德-威利症候群(prader-willisyndrome)、婴儿猝死症、镰状细胞症、戴-萨克斯症(tay-sachsdisease)、透纳氏症候群(turnersyndrome)、尿素循环障碍、海洋性贫血、中耳炎、胰脏炎、腮腺炎、心包膜炎、腹膜炎、咽头炎、胸膜炎、静脉炎、肺炎、囊状纤维化、葡萄膜炎、多发性肌炎、直肠炎、间质性肺炎、皮肌炎、动脉硬化、肌萎缩性侧索硬化症、无社会性、免疫反应、静脉曲张病、阴道炎(包括慢性重复性念珠球菌阴道炎)、抑郁症、及婴儿猝死症。其他实施例中,该方法是有关治疗罹患癌症的个体。广义上,本发明化合物可以有效治疗癌瘤(实体肿瘤,包括原发性与转移性肿瘤二者)、肉瘤、黑色素瘤、及血液癌症(影响血液的癌症,包括淋巴球、骨髓及/或淋巴结),包括白血病、淋巴瘤及多发性骨髓瘤。包括成人肿瘤/癌症及幼儿肿瘤/癌症。该等癌症可能为已血管化,或尚未实质血管化、或非血管化的肿瘤。癌症的表示性实施例包括肾上腺皮质癌瘤、aids-相关癌症(例如:卡波西氏(kaposi’s)及aids-相关淋巴瘤)、阑尾癌、儿童癌症(例如:儿童小脑星细胞瘤、儿童大脑星细胞瘤)、基底细胞癌瘤、皮肤癌(非黑色素瘤)、胆囊癌、肝外胆管癌、肝内胆管癌症、膀胱癌、泌尿膀胱癌、脑癌(例如:胶质瘤及胶质母细胞瘤,如:脑干胶质瘤、小脑星细胞瘤、大脑星细胞瘤/恶性胶质瘤、室管膜瘤、神经管胚细胞瘤、小脑幕上原始性神经外胚细胞瘤、视神经路径及下视丘胶质瘤)、乳房癌、支气管腺瘤/类癌症、类癌性肿瘤、神经系统癌症(例如:中枢神经系统癌症、中枢神经系统淋巴瘤)、子宫颈癌、慢性骨髓增生性病症、结肠直肠癌症(例如:结肠癌、直肠癌)、淋巴球性新生赘瘤、蕈状肉芽肿、西扎利症候群(sezarysyndrome)、子宫内膜癌、食道癌、颅外胚芽细胞瘤、性腺外生殖细胞瘤、肝外胆管癌症、眼部癌症、眼内黑色素瘤、视网膜母细胞瘤、膀胱癌、胃肠癌(例如:胃癌、小肠癌、胃肠的类癌性肿瘤、胃肠基质肿瘤(gist))、胆道癌瘤、生殖细胞瘤、卵巢生殖细胞瘤、妊娠性滋养层母细胞瘤胶质瘤、头与颈癌症、神经内分泌肿瘤、何杰金氏淋巴瘤(hodgkin’slymphoma)、安阿伯(annarbor)第iii期及第iv期儿童非何杰金氏淋巴瘤、ros1-阳性难治性非何杰金氏淋巴瘤、白血病、淋巴瘤、多发性骨髓瘤、下咽癌、眼内黑色素瘤、眼部癌症、胰岛细胞肿瘤(内分泌胰脏)、肾癌(例如:威尔姆氏肿瘤(wilm’stumor)、肾细胞癌瘤)、肝脏癌、肺脏癌(例如:非小细胞肺癌及小细胞肺癌)、alk-阳性退行性大细胞淋巴瘤、alk-阳性晚期恶性实体新生赘瘤、华氏巨球蛋白血症(waldenstrom’smacroglobulinema)、黑色素瘤、眼内(眼部)黑色素瘤、默克细胞(merkelcell)癌瘤、间皮瘤、原发部位不明的转移性鳞状细胞颈部癌症、多发性内分泌新生赘瘤(men)、骨髓造血不良症候群、骨髓造血不良/骨髓增生性疾病、鼻咽癌、神经母细胞瘤、口部癌症(例如:口癌、唇癌、口腔癌、舌癌、口咽癌、咽喉(throat)癌、喉部(laryngeal)癌)、卵巢癌(例如:卵巢上皮癌、卵巢生殖细胞瘤、卵巢低恶性度肿瘤)、胰脏癌、胰岛细胞胰脏癌、副鼻窦及鼻腔癌症、副甲状腺癌、阴茎癌、咽部癌、嗜铬细胞瘤、松果体母细胞瘤、转移性退行性甲状腺癌、未分化甲状腺癌、乳突状甲状腺癌、垂体瘤、浆细胞新生赘瘤/多发性骨髓瘤、胸膜肺母细胞瘤、摄护腺癌、视网膜母细胞瘤横纹肌肉瘤、唾液腺癌、子宫癌(例如:子宫内膜癌、子宫肉瘤、子宫体癌)、鳞状细胞癌瘤、睪丸癌、胸腺瘤、胸腺癌瘤、甲状腺癌、幼年性黄色肉芽肿瘤、肾盂及输尿管及其他泌尿器官的移行上皮细胞癌、尿道癌、妊娠性滋养层母细胞瘤、阴道癌、外阴癌、肝母细胞瘤、横纹肌瘤、及威尔姆氏肿瘤(wilmstumor)。可使用本发明化合物治疗的肉瘤包括软组织及骨癌类二者,其等的表示性实施例包括骨肉瘤或骨源性肉瘤(骨)(例如:欧文氏肉瘤(ewing’ssarcomas))、软骨肉瘤(软骨)、平滑肌肉瘤(平滑肌)、横纹肌肉瘤(骨骼肌)、间皮肉瘤或间皮瘤(体腔的黏膜层)、纤维肉瘤(纤维组织)、血管肉瘤或血管内皮瘤(血管)、脂肪肉瘤(脂肪组织)、胶质瘤或星细胞瘤(出现在脑部的神经源性结递组织)、黏液肉瘤(原始胚胎结递组织)、间质或中胚叶混合瘤(混合结递组织型)、及组织细胞肉瘤(免疫癌症)。有些实施例中,本发明方法适用于治疗罹患血液系统、肝脏(肝细胞)、脑部、肺脏、结肠直肠(例如:结肠)、胰脏、摄护腺、皮肤、卵巢、乳房、皮肤(例如:黑色素瘤)、及子宫内膜的细胞增生性疾病或病症的个体。本文所采用「血液系统的细胞增生性疾病或病症」包括淋巴瘤、白血病、骨髓性新生赘瘤、肥大细胞新生赘瘤、骨髓化生不良、良性单株伽玛球蛋白病变、淋巴瘤样丘疹病、真性多红血球症、慢性骨髓细胞性白血病、原因不明的骨髓性化生、及原发性血小板增多症。血液癌症的表示性实施例因而可包括多发性骨髓瘤、淋巴瘤(包括t-细胞淋巴瘤、何杰金氏淋巴瘤(hodgkin’slymphoma)、非何杰金氏淋巴瘤(non-hodgkin’slymphoma)(弥漫性大b细胞淋巴瘤(dlbcl)、滤泡淋巴瘤(fl)、急性骨髓性白血病(aml)、急性前骨髓细胞性白血病(apl)、套细胞淋巴瘤(mcl)及alk+退行性大细胞淋巴瘤)(例如:b-细胞非何杰金氏淋巴瘤,其是选自:弥漫性大b细胞淋巴瘤(例如:生发中心b-细胞样弥漫性大b-细胞淋巴瘤或活化b-细胞样弥漫性大b-细胞淋巴瘤)、勃奇氏淋巴瘤(burkitt’slymphoma)/白血病、套细胞淋巴瘤、纵膈腔(胸腺)大b-细胞淋巴瘤、滤泡淋巴瘤、边缘区淋巴瘤、淋巴浆细胞淋巴瘤/华氏巨球蛋白血症(waldenstrommacroglobulinemia)、难治性b-细胞非何杰金氏淋巴瘤、及复发性b-细胞非何杰金氏淋巴瘤)、儿童淋巴瘤、及源于淋巴球及皮肤的淋巴瘤(例如:小淋巴球性淋巴瘤)、白血病(包括儿童白血病、毛细胞白血病、急性淋巴球性白血病、急性骨髓细胞性白血病、急性骨髓性白血病(例如:急性单核细胞白血病)、慢性淋巴球性白血病、小淋巴球性白血病、慢性骨髓细胞性白血病、慢性骨髓性白血病、及肥大细胞白血病)、骨髓性新生赘瘤及肥大细胞新生赘瘤。本文所采用「肝脏的细胞增生性疾病或病症」包括所有影响肝脏的细胞增生性病症型式。肝脏的细胞增生性病症可包括肝脏癌(例如:肝细胞癌瘤、肝内胆管癌瘤及肝母细胞瘤)、肝脏的癌前或癌变前病症、肝脏的良性生长物或病灶、及肝脏的恶性生长物或病灶、及肝脏以外的其他身体组织与器官的转移性病灶。肝脏的细胞增生性病症可包括肝脏的增殖性肥大、化生、及发育不良。本文所采用「脑部的细胞增生性疾病或病症」包括所有影响脑部的细胞增生性病症型式。脑部的细胞增生性病症可包括脑癌(例如:胶质瘤及胶质母细胞瘤)、脑部的癌前或癌变前病症、脑部的良性生长物或病灶、及脑部的恶性生长物或病灶、及脑部以外的其他身体组织与器官的转移性病灶。脑部的细胞增生性病症可包括脑部的增殖性肥大、化生、及发育不良。本文所采用「肺脏的细胞增生性疾病或病症」包括所有影响肺脏细胞的细胞增生性病症型式。肺脏的细胞增生性病症包括肺脏癌、肺脏的癌前或癌变前病症、肺脏的良性生长物或病灶、及肺脏以外的其他身体组织与器官的转移性病灶。肺脏癌包括肺脏的所有癌症型式,例如:恶性肺脏新生赘瘤、原位癌瘤、典型类癌肿瘤、及非典型类癌肿瘤。肺脏癌包括小细胞肺癌(「slcl」)、非小细胞肺癌(「nsclc」)、鳞状细胞癌瘤、腺癌瘤、小细胞癌瘤、大细胞癌瘤、鳞状细胞癌瘤及间皮瘤。肺脏癌可包括「瘢痕癌瘤」、支气管肺泡癌瘤、巨细胞癌瘤、梭型细胞癌瘤、及大细胞神经内分泌癌瘤。肺脏癌也包括具有组织与超微结构异质性(例如:混合细胞型态)的肺脏新生赘瘤。本文所采用「结肠的细胞增生性疾病或病症」包括所有影响结肠细胞的细胞增生性病症型式,包括结肠癌症、结肠的癌前或癌变前病症、结肠的腺瘤性瘜肉及结肠的异时性病灶。结肠癌包括阵发性及遗传性结肠癌、恶性结肠新生赘瘤、原位癌瘤、典型类癌肿瘤、及非典型类癌肿瘤、腺癌瘤、鳞状细胞癌瘤、及鳞状细胞癌瘤。结肠癌可能与遗传性症候群有关,如:遗传性非瘜肉性结肠直肠癌、家族性腺瘤性瘜肉症、myh相关的瘜肉症、加德娜症候群(gardner’ssyndrome)、珀茨-杰格斯症候群(peutz-jegherssyndrome)、杜克氏症候群(turcot’ssyndrome)及幼年型瘜肉症。结肠的细胞增生性病症的特征可在结肠的增殖性肥大、化生、或发育不良。本文所采用「胰脏细胞增生性疾病或病症」包括所有影响胰脏细胞的细胞增生性病症型式。胰脏的细胞增生性病症可包括胰脏癌、胰脏的癌前或癌变前病症、胰脏的增殖性肥大、及胰脏的发育不良、胰脏的良性生长物或病灶、及胰脏的恶性生长物或病灶、及胰脏以外的其他身体组织与器官的转移性病灶。胰脏癌包括胰脏的所有癌症型式,包括胰管腺癌瘤、腺鳞状细胞癌瘤、多态性巨细胞癌瘤、黏液性腺癌瘤、类蚀骨巨细胞癌瘤、黏液性囊状腺癌瘤、腺泡癌瘤、未分类大细胞癌瘤、小细胞癌瘤、胰脏母细胞瘤、乳突状新生赘瘤、黏液性囊状腺瘤、乳突状囊状新生赘瘤、及浆液性囊状腺瘤、及具有组织与超微结构异质性(例如:混合细胞型态)的胰脏新生赘瘤。本文所采用「摄护腺的细胞增生性疾病或病症」包括所有影响摄护腺的细胞增生性病症型式。摄护腺的细胞增生性病症可包括摄护腺癌、摄护腺的癌前或癌变前病症、摄护腺的良性生长物或病灶、及摄护腺的恶性生长物或病灶,及摄护腺以外的其他身体组织与器官的转移性病灶。摄护腺的细胞增生性病症可包括摄护腺的增殖性肥大、化生、及发育不良。本文所采用「卵巢的细胞增生性疾病或病症」包括所有影响卵巢细胞的细胞增生性病症型式。卵巢的细胞增生性病症可包括卵巢的癌前或癌变前病症、卵巢的良性生长物或病灶、卵巢癌、及卵巢以外的其他身体组织与器官的转移性病灶。本文所采用「乳房的细胞增生性疾病或病症」包括所有影响乳房细胞的细胞增生性病症型式。乳房的细胞增生性病症可包括乳癌、乳房的癌前或癌变前病症、乳房的良性生长物或病灶、及乳房以外的其他身体组织与器官的转移性病灶。本文所采用「皮肤的细胞增生性疾病或病症」包括所有影响皮肤细胞的细胞增生性病症型式。皮肤的细胞增生性病症可包括皮肤的癌前或癌变前病症、皮肤的良性生长物或病灶、黑色素瘤、皮肤的恶性黑色素瘤或其他恶性生长物或病灶、及皮肤以外的其他身体组织与器官的转移性病灶。皮肤的细胞增生性病症可包括皮肤的增殖性肥大、化生、及发育不良。本文所采用「子宫内膜的细胞增生性疾病或病症」包括所有影响子宫内膜的细胞增生性病症型式。子宫内膜的细胞增生性病症可包括子宫内膜癌、子宫内膜的癌前或癌变前病症、子宫内膜的良性生长物或病灶、及子宫内膜的恶性生长物或病灶、及子宫内膜以外的其他身体组织与器官的转移性病灶。子宫内膜的细胞增生性病症可包括子宫内膜的增殖性肥大、化生、及发育不良。本发明化合物可呈单一疗法或利用组合疗法投与患者,例如:癌症患者,并作为第一线疗法或成为对第一线疗法没有反应的患者的追加疗法。疗法可为「第一线」,也即过去未曾接受抗癌治疗疗程的患者的初始疗法,其是单独或组合其他治疗;或「第二线」,是治疗过去曾接受抗癌治疗疗程的患者,其是单独或组合其他治疗;或呈「第三线」、「第四线」,等等治疗,其是单独或组合其他治疗。疗法也可提供给过去曾接受治疗且已部分成功,但对特定治疗无法耐受的患者。疗法也可呈辅助疗法提供,也即防止目前没有可检测的疾病或已手术排除肿瘤后的患者的癌症复发。因此,有些实施例中,化合物可投与已接受另一种疗法的患者,如:化疗法、放射免疫疗法、手术疗法、免疫疗法、放射疗法、标靶疗法、或其任何组合。本发明方法可以依单一剂量或多重剂量(例如:1、2、3、4、5、6、7、8、10、15、20个、或更多个剂量)投与本发明化合物或其药物组合物给患者。例如:投药频率可为从一天一次至约每8周一次的范围。有些实施例中,投药频率可为约一天一次持续1、2、3、4、5、或6周的范围,及在其他实施例中,28天周期包括每天投药持续3周(21天)。组合疗法式(i)化合物可以组合使用至少一种其他活性剂,例如:抗癌制剂或疗程,以治疗疾病及病症。术语「组合」在本文中意指该等制剂是共同投与,包括同一个或分开的剂型,实质上同时投与,或依序投与,例如:作为同一个治疗疗程的一部分或采用连续治疗疗程投与。因此,若依序投与时,在开始投与第二化合物时,有些例子中,仍可在治疗部位检测到这两种化合物中的第一化合物的有效浓度。可以决定顺序与时间间隔,使其等可以共同作用(例如:以协同作用提供高于其等以其他方式投与时的效益)。例如:医疗剂可以同时间投与或依任何顺序在不同时间点投与;然而,若不在同时间投与时,其等可在充份接近的时间投与,以便可能以协同方式提供所需医疗效益。因此,该术语不限于在精准的相同时间投与活性剂。有些实施例中,治疗疗程可包括组合投与式(i)化合物与一或多种已知用于治疗疾病或病症(例如:癌症)的外加医疗剂。该外加抗癌医疗剂的剂量可以与已知或建议剂量相同或甚至更低。参见hardman等人编辑,goodman&gilman'sthepharmacologicalbasisoftherapeutics,第10版,mcgraw-hill,newyork,2001;physician'sdeskreference,第60版,2006。可以与本发明化合物组合使用的抗癌剂是相关领域已知的。参见例如:美国专利案9,101,622(其中第5.2章节)及美国专利案9,345,705b2(其中第12至18段)。外加活性剂及治疗疗程的表示性实施例包括放射疗法、化疗(例如:有丝分裂抑制剂、血管新生抑制剂、抗激素、自噬抑制剂、烷基化剂、嵌入抗生素、生长因子抑制剂、抗雄激素、讯号转导途径抑制剂、抗微管剂、铂配位复合物、hdac抑制剂、蛋白酶体抑制剂、及拓朴异构酶抑制剂)、免疫调节剂、医疗性抗体(例如:单价及双价抗体)及car-t疗法。有些实施例中,本发明化合物及外加(例如:抗癌)医疗剂的投药可以分隔5分钟以内、分隔30分钟以内、分隔1小时以内、分隔约1小时、分隔约1至约2小时、分隔约2小时至约3小时、分隔约3小时至约4小时、分隔约4小时至约5小时、分隔约5小时至约6小时、分隔约6小时至约7小时、分隔约7小时至约8小时、分隔约8小时至约9小时、分隔约9小时至约10小时、分隔约10小时至约11小时、分隔约11小时至约12小时、分隔约12小时至18小时、分隔18小时至24小时、分隔24小时至36小时、分隔36小时至48小时、分隔48小时至52小时、分隔52小时至60小时、分隔60小时至72小时、分隔72小时至84小时、分隔84小时至96小时、或分隔96小时至120小时。可在相同患者访诊时投与两种或更多种医疗剂。有些实施例中,本发明化合物及外加制剂或医疗剂(例如:抗癌医疗剂)可以循环投药。循环疗法涉及投与一种抗癌医疗剂一段时间,接着投与第二抗癌医疗剂一段时间,并重复此连续投药法,也即循环,以降低对一或两种抗癌医疗剂发展出抗性、避免或降低一或两种抗癌医疗剂的副作用、及/或改进疗法的效力。癌症治疗内容之一项实施例中,循环疗法涉及投与第一抗癌医疗剂一段时间,接着投与第二抗癌医疗剂一段时间,可任选接着投与第三抗癌医疗剂一段时间,及依此类推,并重复此连续投药法,也即循环,以降低对其中一种抗癌医疗剂发展出抗性、避免或降低其中一种抗癌医疗剂的副作用、及/或改进抗癌医疗剂的效力。医药试剂盒本组合物可组合成试剂盒或医药系统。根据本发明此实施方式的试剂盒或医药系统包括载体或包装,如:盒子、纸箱、管子、或类似物,其中在紧密空间中包含一或多个容器,如:小瓶、小管、安瓿、或瓶子,其中包含式(i)化合物或包含医疗有效量的式(i)化合物及医药上可接受的载剂的药物组合物。本发明试剂盒或医药系统也可包括指示使用该化合物及组合物的印刷说明书。本发明这些及其他实施方式将可由下列实施例进一步了解,该等实施例是说明本发明某些特定实施例,但不限制其范围,该范围是如申请专利范围所定义。实施例实施例1:6-(苯甲氧基)-n-(2,6-二氧代哌啶-3-基)吡啶甲酰氨(1)的合成法在40-ml小瓶中,取6-羟基吡啶-2-羧酸(370mg,2.7mmol)溶于n,n-二甲基甲酰氨(dmf)(0.3m)。添加碳酸铯(2.6g,8.0mmol,3.0当量)后,添加苯甲基溴(475μl,4.0mmol,1.5当量)。反应混合物于室温(rt)下搅拌一夜。使用1mhcl中止反应,及使用etoac3x萃取。收集有机层,使用水3x、盐水洗涤,经na2so4脱水,过滤,及经旋转蒸发法浓缩,产生粗制的受苯甲基保护的吡啶甲酸(int-1),定量,其未进一步纯化即使用。在8-ml小瓶中,取粗制的受苯甲基保护的吡啶甲酸(int-1)(100mg,0.44mmol)溶于dmf(1.5ml,0.3m)。依序添加二异丙基乙基氨(230μl,1.3mmol,3.0当量)及1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐(hatu)(182mg,0.48mmol,1.1当量)、及氨基戊二酰亚氨(3)(79mg,0.48mmol,1.1当量)。反应混合物于45℃搅拌2天。冷却至室温时,反应混合物使用ch2cl2稀释,使用饱和aq.nh4cl、饱和aq.nahco3、水、及盐水洗涤。收集有机层,经na2so4脱水,过滤,及经旋转蒸发法浓缩。经硅石快速层析法纯化(0–80%etoac/ch2cl2),产生部分纯化的吡啶甲酰氨化合物1。进一步经hplc,然后经硅石快速层析法纯化(0-20%1.5nnh3的meoh/ch2cl2溶液),产生化合物1(72mg,48%)的白色固体。1hnmr(500mhz,dmso-d6)δ10.92(s,1h),8.90(dd,j=8.4,3.1hz,1h),7.90(td,j=7.9,2.8hz,1h),7.66(dd,j=7.3,2.8hz,1h),7.52(dd,j=7.8,2.2hz,2h),7.39(td,j=7.5,2.2hz,2h),7.36–7.27(m,1h),7.09(dd,j=8.3,2.9hz,1h),5.59–5.36(m,2h),4.92–4.67(m,1h),2.83(tdd,j=17.0,5.5,2.7hz,1h),2.55(dt,j=17.0,3.9hz,1h),2.25(qt,j=13.1,3.7hz,1h),2.07–1.96(m,1h).lc-msm/z(relint):(pos)339.9([m+h]+.实施例2:n-(2,6-二氧代哌啶-3-基)吡啶甲酰氨(2)的合成法在8-ml小瓶中,取吡啶甲酸(115mg,0.93mmol)溶于dmf(0.5m)。依序添加二异丙基乙基氨(487μl,2.8mmol,3.0equiv)及hatu(389mg,1.02mmol,1.1当量)、及氨基戊二酰亚氨(168mg,1.02mmol,1.1当量)。反应混合物于45℃搅拌一夜。当冷却至室温时,反应混合物使用ch2cl2稀释,使用饱和.aq.nh4cl、饱和aq.nahco3、水、及盐水洗涤。收集有机层,经na2so4脱水,过滤,及经旋转蒸发法浓缩。经硅石快速层析法纯化(0至80%etoac/ch2cl2,然后0–20%meoh/ch2cl2),产生部分纯化的吡啶甲酰氨2。进一步经过hplc纯化,然后经硅石快速层析法纯化(0至20%1.5nnh3的meoh/ch2cl2溶液),产生化合物2(95mg,44%)的白色固体。1hnmr(500mhz,dmso-d6)δ10.87(s,1h),9.08(d,j=8.4hz,1h),8.68(dt,j=4.7,1.3hz,1h),8.16–7.91(m,2h),7.64(ddd,j=7.3,4.8,1.3hz,1h),4.80(ddd,j=13.2,8.3,5.4hz,1h),2.81(ddd,j=17.3,13.7,5.5hz,1h),2.54(m,j=3.8hz,1h),2.22(qd,j=12.9,4.5hz,1h),2.01(dtd,j=12.9,5.4,2.5hz,1h).lc-msm/z(relint):(pos)233.0([m+h]+.实施例3:6-氨基-n-(2,6-二氧代哌啶-3-基)吡啶甲酰氨(3)的合成法在8-ml小瓶中,取6-氨基吡啶-2-羧酸(125mg,0.91mmol)溶于ch2cl2(0.3m)。依序添加二异丙基乙基氨(477μl,2.7mmol,3.0当量)及丙基膦酸酐(t3p,≥50wt%,1.1mmol,1.2当量)、及氨基戊二酰亚氨(180mg,1.1mmol,1.2当量)。反应混合物于45℃搅拌一夜。当冷却至室温时,反应混合物加水稀释,及使用ch2cl23x萃取。收集有机层,经na2so4脱水,过滤,及经旋转蒸发法浓缩。经hplc纯化,产生化合物3(70mg,31%)。lc-msm/z(relint):(pos)249.0([m+h]+.实施例4:4-氯-n-(2,6-二氧代哌啶-3-基)吡啶甲酰氨(4)在8-ml小瓶中,取4-氯吡啶-2-羧酸(199mg,1.27mmol)溶于ch2cl2(0.3m)。依序添加二异丙基乙基氨(286μl,1.65mmol,1.3当量)及丙基膦酸酐(t3p,≥50wt%,1.52mmol,1.2当量)、及氨基戊二酰亚氨(250mg,1.52mmol,1.2当量)。反应混合物于室温搅拌3h。反应混合物加水稀释,及使用ch2cl23x萃取。收集有机层,经na2so4脱水,过滤,及经旋转蒸发法浓缩。经硅石快速层析法纯化(0–20%meoh/ch2cl2),产生化合物4(200mg,59%)。1hnmr(500mhz,dmso-d6)δ10.88(s,1h),9.16(d,j=8.5hz,1h),8.67(d,j=5.2hz,1h),8.06(d,j=2.1hz,1h),7.81(dd,j=5.2,2.1hz,1h),4.80(ddd,j=13.2,8.5,5.3hz,1h),2.81(ddd,j=17.3,13.8,5.5hz,1h),2.56–2.51(m,1h),2.22(qd,j=13.0,4.5hz,1h),2.00(dtd,j=12.9,5.5,2.5hz,1h).lc-msm/z(relint):(pos)267.9([m+h]+.实施例5:2-(苯甲基氨基)-n-(2,6-二氧代哌啶-3-基)嘧啶-4-羧酰氨(5)在含氯嘧啶(19mg,0.071mmol)的二恶烷(0.05m)溶液中添加苯甲基氨(7.8μl,0.071mmol,1.0当量)。反应于80℃搅拌2h。当冷却至室温时,反应混合物使用1nnaoh稀释,及使用ch2cl23x萃取。收集有机层,经na2so4脱水,过滤,及经旋转蒸发法浓缩。经hplc纯化,产生化合物5(11mg,45%)。1hnmr(500mhz,dmso-d6)δ10.93(s,1h),8.51(d,j=4.8hz,1h),7.38(m,2h),7.30(t,j=7.6hz,2h),7.25–7.16(m,1h),7.09(d,j=4.8hz,1h),4.76(ddd,j=13.0,8.2,5.4hz,1h),4.61(m,2h),2.80(ddd,j=17.3,13.7,5.5hz,1h),2.54(m,j=5.1hz,1h),2.25–2.08(m,1h),2.07–1.96(m,1h).lc-msm/z(relint):(pos)340.0([m+h]+.实施例6:n-(2,6-二氧代哌啶-3-基)-6-甲氧基吡啶甲酰氨(6)的合成法在8-ml小瓶中,取6-氟吡啶甲酸(1.5g,10.9mmol)溶于ch2cl2(0.5m)。依序添加二异丙基乙基氨(5.7ml,32.6mmol,3.0当量)及丙基膦酸酐(t3p,≥50wt%,13mmol,1.2当量)、及氨基戊二酰亚氨(2.14g,13mmol,1.2当量)。反应混合物于回流下搅拌一夜。当冷却至室温时,反应混合物加水稀释,及使用ch2cl23x萃取。收集有机层,经na2so4脱水,过滤,及经旋转蒸发法浓缩。经硅石快速层析法纯化(0至80%etoac/ch2cl2,然后0至20%meoh/ch2cl2),产生化合物int-2(755mg,28%)。在含氟吡啶int-2(37mg,0.27mmol)的meoh(0.3m)溶液中,添加10nnaoh(500μl)。于80℃搅拌反应2h。当冷却至室温时,反应混合物使用饱和aq.nh4cl稀释,及使用ch2cl23x萃取。收集有机层,经na2so4脱水,过滤,及经旋转蒸发法浓缩。经硅石快速层析法纯化(0至80%etoac/ch2cl2,然后0至20%meoh/ch2cl2),产生化合物6(41mg,59%)。lc-msm/z(relint):(pos)263.0([m+h]+.实施例7:2-(苯甲氧基)-n-(2,6-二氧代哌啶-3-基)嘧啶-4-羧酰氨(7)的合成法在20-ml小瓶中,取2-氯嘧啶-4-羧酸(430mg,2.7mmol)溶于ch2cl2(0.3m)中。依序添加二异丙基乙基氨(1.42ml,8.1mmol,3.0当量)及丙基膦酸酐(t3p,≥50wt%,3.3mmol,1.2当量)、及氨基戊二酰亚氨(536mg,3.3mmol,1.2当量)。反应混合物于室温搅拌一夜。反应混合物加水稀释,及使用ch2cl23x萃取。收集有机层,经na2so4脱水,过滤,及经旋转蒸发法浓缩。经硅石快速层析法纯化(0至80%etoac/ch2cl2),产生亚酰氨int-3(719mg,99%)。在含氯嘧啶int-3(94mg,0.35mmol)的二恶烷(0.35m)溶液中添加苯甲醇(181μl,1.74mmol,5.0当量)及碳酸钾(241mg,1.74mmol,5.0当量)。于80℃搅拌反应一夜。当冷却至室温时,反应混合物使用饱和aq.nh4cl稀释,及使用ch2cl23x萃取。收集有机层,使用水洗涤,经na2so4脱水,过滤,及经旋转蒸发法浓缩。经hplc纯化,产生化合物7(45mg,38%)。1hnmr(500mhz,dmso-d6)δ10.93(s,1h),8.51(d,j=4.8hz,1h),7.38(m,2h),7.30(t,j=7.6hz,2h),7.21(t,j=7.2hz,1h),7.09(d,j=4.8hz,1h),4.76(ddd,j=13.1,8.2,5.4hz,1h),4.61(m,1h),2.80(ddd,j=17.3,13.7,5.6hz,1h),2.57–2.52(m,1h),2.24–2.10(m,1h),2.08–2.00(m,1h).lc-msm/z(relint):(pos)339.9([m+h]+.实施例8:n-(2,6-二氧代哌啶-3-基)喹啉-8-羧酰氨(8)的合成法在8-ml小瓶中,取喹啉-8-羧酸(210mg,1.2mmol)溶于ch2cl2(0.4m)。依序添加二异丙基乙基氨(630ml,3.6mmol,3.0当量)及丙基膦酸酐(t3p,≥50wt%,1.5mmol,1.2当量)、及氨基戊二酰亚氨(2.14g,1.5mmol,1.2当量)。反应混合物于回流下搅拌5h。当冷却至室温时,反应混合物加水稀释,及使用ch2cl23x萃取。收集有机层,经na2so4脱水,过滤,及经旋转蒸发法浓缩。经硅石快速层析法纯化(0–80%etoac/ch2cl2,然后0–20%meoh/ch2cl2),产生化合物8(105mg,31%)。1hnmr(500mhz,dmso-d6)δ11.55(d,j=7.1hz,1h),10.94(s,1h),9.04(dd,j=4.2,1.6hz,1h),8.64(dd,j=7.3,1.6hz,1h),8.60(dd,j=8.3,1.5hz,1h),8.25(dd,j=8.2,1.2hz,1h),7.79(t,j=7.7hz,1h),7.71(dd,j=8.3,4.3hz,1h),4.92(ddd,j=12.4,7.1,5.3hz,1h),2.83(ddd,j=17.4,13.6,5.5hz,1h),2.58(dt,j=17.3,3.5hz,1h),2.29(dtd,j=13.1,5.4,2.3hz,1h),2.16(qd,j=12.9,4.4hz,1h).lc-msm/z(relint):(pos)283.9([m+h]+.实施例9:n-(2,6-二氧代哌啶-3-基)-1,2,3,4-四氢喹啉-8-羧酰氨(9)的合成法在8-ml小瓶中,取1,2,3,4-四氢喹啉-8-羧酸(45mg,0.25mmol)溶于ch2cl2(0.25m)。依序添加二异丙基乙基氨(132μl,0.76mmol,3.0当量)及丙基膦酸酐(t3p,≥50wt%,1.2mmol,1.2当量)、及氨基戊二酰亚氨(50mg,0.30mmol,1.2当量)。反应混合物于回流下搅拌12h。当冷却至室温时,反应混合物加水稀释,及使用ch2cl23x萃取。收集有机层,经na2so4脱水,过滤,及经旋转蒸发法浓缩。经硅石快速层析法纯化(0–80%etoac/ch2cl2,然后0–20%meoh/ch2cl2),产生化合物9(24mg,33%)。lc-msm/z(relint):(pos)288.1([m+h]+).实施例10:n-(2,6-二氧代哌啶-3-基)-5-((4-(吗啉基甲基)苯甲基)氧)吡啶甲酰氨(11)的合成法4-(4-(氯甲基)苯甲基)吗啉(int-4)取含(4-(吗啉基甲基)苯基)甲醇(1g,4.83mmol,1.0eq)、socl2(2ml)的二氯甲烷(8ml)溶液于室温搅拌3h。薄层层析法(tlc)显示反应已达到完成。反应混合物加水稀释,及使用etoac萃取。合并的有机层使用水、naoh水溶液(1n)及盐水洗涤,干燥,及经旋转蒸发法浓缩,产生化合物int-4(1g,92%)的灰白色固体。esi-ms(ei+,m/z):226.1.5-((4-(吗啉基甲基)苯甲基)氧)吡啶甲酸甲基酯(int-5)取含化合物int-4(741mg,3.27mmol,1.0eq)、5-羟基吡啶甲酸甲基酯(500mg,3.27mmol)、及k2co3(900mg,6.54mmol,1.0eq)的dmf(6ml)溶液于70℃搅拌16h。tlc显示反应已达到完成。添加h2o(10ml),混合物使用etoac(2×20ml)萃取。合并的有机层使用水(20ml)及盐水(20ml)洗涤,经na2so4脱水及经旋转蒸发法浓缩。残质经管柱层析法纯化(二氯甲烷/meoh:40/1),产生化合物int-5(960mg,86%)的白色固体。1hnmr(400mhz,dmso-d6):δ8.44(d,j=2.8hz,1h),8.04(d,j=8.7hz,1h),7.59(dd,j=8.8,2.9hz,1h),7.43(d,j=8.0hz,2h),7.34(d,j=8.0hz,2h),5.25(s,2h),3.84(s,3h),3.59–3.53(m,4h),3.46(s,2h),2.39–2.30(m,4h).esi-ms(ei+,m/z):343.2.5-((4-(吗啉基甲基)苯甲基)氧)吡啶甲酸(int-6)在含化合物int-5(500mg,1.46mmol)的meoh(2ml)及h2o(1ml)混合物中添加lioh.h2o(122mg,2.92mmol,2.0eq)。反应混合物于室温搅拌3h。粗制混合物经旋转蒸发法浓缩,及使用hcl水溶液(1m)调整ph至3~4。所得悬浮液过滤,固体干燥,产生化合物int-6(430mg,89.6%)的白色固体。n-(2,6-二氧代哌啶-3-基)-5-((4-(吗啉基甲基)苯甲基)氧)吡啶甲酰氨(11)添加hatu(408mg,1.8mmol,1.2eq)至0~5℃的含化合物int-6(500mg,1.5mmol,1.0eq)、3-氨基哌啶-2,6-二酮盐酸盐(300mg,1.8mmol,1.2eq)及diea(348mg,3.0mmol,2.0eq)的dmf(2ml)混合物中。让所得混合物回升至室温,及搅拌1h。添加水,及使用etoac(2×15ml)萃取混合物。合并的有机层使用水(15ml)及盐水(15ml)洗涤,经na2so4脱水及经旋转蒸发法浓缩。残质经制备性-hplc纯化,产生化合物11(80mg,12%)的白色固体。1hnmr(400mhz,dmso-d6):δ10.85(s,1h),10.02(s,1h),8.87(d,j=8.4hz,1h),8.41(d,j=2.8hz,1h),8.03(d,j=8.8hz,1h),7.64(dd,j=3.2,8.8hz,1h),7.60(d,j=8.0hz,2h),7.54(d,j=8.0hz,2h),5.33(s,2h),4.72-4.79(m,1h),4.36(s,2h),3.96(d,j=13.0hz,2h),3.68–3.56(m,2h),3.26(m,2h),3.13(m,2h),2.75-2.84(m,1h),2.53-2.58(m,1h),2.111-2.11(m,1h),2.04–1.96(m,1h).esi-ms(ei+,m/z):439.25.实施例11:n-(2,6-二氧代哌啶-3-基)-2-氧代-1,2-二氢吡啶-3-羧酰氨(19)的合成法添加1-乙基-3-(3-二甲基氨基丙基)碳化二亚氨(edci)(1g,5.4mmol,1.5eq)及羟基苯并三唑(hobt)(729mg,5.4mmol,1.5eq)至0~5℃的含2-氧代-1,2-二氢吡啶-3-羧酸(500mg,3.6mmol,1.0eq)、3-氨基哌啶-2,6-二酮盐酸盐(506mg,3.9mmol,1.1eq)及二异丙基乙基氨(diea)(1161mg,9.0mmol,2.5eq)的dmf(6ml)混合物中。让所得混合物回升至室温,及搅拌16h。添加水,水层使用etoac(2×50ml)萃取。合并的有机层使用h2o及盐水洗涤,及经na2so4脱水。采用旋转蒸发法排除溶剂,残质经制备性-hplc纯化,产生产物(19)(23mg)的黄色固体。1hnmr(400mhz,dmso-d6)δ2.04(td,j=4.4,12.8hz,1h),2.52-2.54(m,1h),2.13-2.19(m,1h),2.71–2.80(m,1h),4.72-4.78(m,1h),6.49(t,j=6.4hz,1h),7.73(td,j=2.0,6.4hz,1h),8.35(dd,j=2.4,7.2hz,1h),10.19(d,j=7.2hz,1h),10.87(s,1h),12.53(s,1h).esi-ms(ei+,m/z):250.15.实施例12:n-(2,6-二氧代哌啶-3-基)-1-甲基-2-氧代-1,2-二氫吡啶-3-羧醯氨(20)的合成法1-甲基-2-氧代-1,2-二氢吡啶-3-羧酸甲基酯(int-7)分批添加nah(313mg,13.1mmol)至0℃的含2-氧代-1,2-二氢吡啶-3-羧酸甲基酯(1g,6.5mmol)的dmf(8ml)溶液中,反应混合物于0℃搅拌0.5h。于0℃滴加mei(1.8g,13.1mmol)。所得混合物于室温搅拌5h。tlc显示反应已达到完成。反应混合物分溶于乙酸乙酯与水之间。合并的有机层使用水及盐水洗涤,经na2so4脱水及经旋转蒸发法浓缩,产生化合物int-7(500mg,50%)的黄色固体。esi-ms(ei+,m/z):168.15.1-甲基-2-氧代-1,2-二氢吡啶-3-羧酸(int-8)取含化合物int-7(500mg,3.0mmol)的meoh(1ml)、thf(3ml)及h2o(1ml)溶液,使用lioh(251mg,6.0mmol)处理,混合物于室温搅拌4h。混合物经旋转蒸发法浓缩,残质使用水(5ml)稀释。调整混合物的ph至2,所得悬浮液过滤。取固体干燥,产生化合物int-8(200mg,43%)的白色固体。esi-ms(ei+,m/z):154.15.n-(2,6-二氧代哌啶-3-基)-1-甲基-2-氧代-1,2-二氢吡啶-3-羧酰氨(20)于0℃,在含化合物int-8(200mg,1.3mmol)的dmf(5ml)溶液中添加3-氨基哌啶-2,6-二酮(297mg,1.3mmol)及diea(387mg,1.3mmol)。于0℃,慢慢添加hatu(456mg,1.8mmol)。让反应回升至室温,及搅拌6h。混合物过滤,及单离的固体使用dmf(5ml)研磨。所得悬浮液过滤,及取滤饼干燥,产生产物(20)(50mg)的白色固体。1hnmr(400mhz,dmso-d6)δ10.89(s,1h),10.25(d,j=7.2hz,1h),8.33(dd,j=2.4,7.2hz,1h),8.08(dd,j=2.8,6.8hz,1h),6.52(t,j=7.2hz,1h),4.72-4.78(m,1h),3.57(s,3h),2.74-2.81(m,1h),2.52-2.55(m,1h),2.14-2.21(m,1h),1.96-2.05(m,1h).esi-ms(ei+,m/z):264.20.实施例13:n-(2,6-二氧代哌啶-3-基)-2-氧代-1-苯基-1,2-二氢吡啶-3-羧酰氨(21)的合成法2-氧代-1-苯基-1,2-二氢吡啶-3-羧酸甲基酯(int-9)取含2-氧代-1,2-二氢吡啶-3-羧酸甲基酯(1.53g,10mmol)、苯基二羟硼酸(3.6g,30mmol)、分子筛(2.8g,12mmol)及cu(oac)2(3.6g,20mmol)的dcm(60ml)混合物,使用吡啶(2.4ml,30mmol)处理。混合物于室温搅拌12h。tlc显示反应已达到完成。反应混合物通过寅氏盐垫过滤,及滤液经旋转蒸发法浓缩,产生化合物int-9(1.8g,78%)的黄色固体。esi-ms(ei+,m/z):230.15.2-氧代-1-苯基-1,2-二氢吡啶-3-羧酸(int-10)取含化合物int-9(800mg,3.5mmol)的meoh(2ml)、thf(6ml)及h2o(2ml)溶液,使用lioh·h2o(293mg,7.0mmol)处理,混合物于室温搅拌4h。混合物随后减压浓缩,使用水(8ml)稀释残质。调整混合物的ph至2,所得悬浮液过滤。单离的固体干燥,产生化合物int-10(650mg,86%)的黄色固体。esi-ms(ei+,m/z):216.10.n-(2,6-二氧代哌啶-3-基)-2-氧代-1-苯基-1,2-二氢吡啶-3-羧酰氨(21)于0℃,在含化合物int-10(450mg,2.1mmol)的dmf(5ml)溶液中添加3-氨基哌啶-2,6-二酮(413mg,2.5mmol)及diea(542mg,4.2mmol)。然后于0℃,慢慢添加hatu(951mg,2.5mmol)。让反应回升至室温,及搅拌10h。混合物过滤,及单离的固体使用dmf(10ml)研磨。所得混合物过滤,及取滤饼干燥,产生产物(21)(300mg,43%)的白色固体。1hnmr(400mhz,dmso-d6)δ10.89(s,1h),10.06(d,j=7.2hz,1h),8.465(dd,j=2.0,7.2hz,1h),8.03(dd,j=1.6,6.4hz,1h),7.46–7.58(m,5h),6.627(t,j=6.8hz,1h),4.72-4.78(m,1h),2.72-2.80(m,1h),2.48-2.54(m,1h),2.14-2.20(m,1h),1.93-2.04(m,1h).esi-ms(ei+,m/z):326.15.实施例14:1-苯甲基-n-(2,6-二氧代哌啶-3-基)-2-氧代-1,2-二氢吡啶-3-羧酰氨(22)的合成法1-苯甲基-2-氧代-1,2-二氢吡啶-3-羧酸甲基酯(int-11)取含2-甲氧基烟酸甲基酯(2g,11.9mmol)的bnbr(2.6g,15.2mmol)溶液加热至120℃20h。tlc显示反应已达到完成。采用旋转蒸发法排除溶剂。残质经管柱层析法纯化(己烷/乙酸乙酯:3/1),产生化合物int-11(1.6g,54.8%)的黄色固体。esi-ms(ei+,m/z):244.1.1-苯甲基-2-氧代-1,2-二氢吡啶-3-羧酸(int-12)在含化合物int-11(500mg,2.05mmol)的meoh(1ml)与h2o(1ml)混合物中添加lioh·h2o(172mg,4.10mmol,2.0eq),混合物于室温搅拌4h。混合物真空浓缩,及使用hcl水溶液(1m)调整ph至3~4。所得悬浮液过滤,及单离的固体干燥,产生化合物int-12(460mg,97.6%)的白色固体。esi-ms(ei+,m/z):230.1.1-苯甲基-n-(2,6-二氧代哌啶-3-基)-2-氧代-1,2-二氢吡啶-3-羧酰氨(22)于0~5℃,添加hatu(988mg,2.6mmol,1.2eq)至含化合物int-12(460mg,2.1mmol,1.0eq)、3-氨基哌啶-2,6-二酮盐酸盐(429mg,2.6mmol,1.2eq)及diea(703mg,5.5mmol,2.5eq)的dmf(2ml)混合物中。让所得混合物回升至室温,及搅拌3h。添加水,所得悬浮液过滤。滤饼使用h2o洗涤,及干燥,产生化合物22(578mg,78.1%)的灰白色粉末。1hnmr(400mhz,dmso-d6):δ10.89(s,1h),10.13(d,j=6.8hz,1h),8.37(d,j=6.8hz,1h),8.25(d,j=6.4hz,1h),7.33–7.39(m,2h),7.21-7.32(m,3h),6.59(t,j=6.8hz,1h),5.20–5.30(m,2h),4.70-4.77(m,1h),2.70–2.80(m,1h),2.48–2.52(m,1h),2.11–2.19(m,1h),2.01(qd,j=4.0,12.8hz,1h).esi-ms(ei+,m/z):340.15.实施例15:5-氨基-n-(2,6-二氧代哌啶-3-基)喹啉-8-羧醯氨(23)的合成法8-甲基-5-硝基喹啉(int-13)取含8-甲基喹啉(5.0g,34.92mmol)的浓h2so4(18ml)溶液于0℃搅拌约30分钟。然后慢慢添加kno3(4.4g,43.65mmol)至反应混合物中。让反应回升至室温,及搅拌5h。tlc显示反应已达到完成。反应混合物使用naoh水溶液(2n)碱化至ph9。所得混合物使用乙酸乙酯萃取。合并的有机层使用水及盐水洗涤,经na2so4脱水,及减压浓缩,产生化合物int-13(5.7g,86.8%)的黄色固体。1hnmr(400mhz,cdcl3):δ2.90(s,1h),7.62-7.66(m,2h),8.31(d,j=8.0hz,1h),9.03-9.06(m,2h).esi-ms(ei+,m/z):189.10.5-硝基喹啉-8-羧酸(int-14)取含化合物int-13(1.5g,7.97mmol)的浓h2so4(12ml)溶液于0℃搅拌约30分钟。然后慢慢添加k2cr2o7(9.38g,31.88mmol)至反应混合物中。让反应回升至室温,及搅拌1小时。tlc显示反应已达到完成。反应混合物使用naoh水溶液(2n)碱化至ph9后,使用hoac酸化至ph3,然后使用乙酸乙酯萃取。合并的有机层使用水及盐水洗涤,经na2so4脱水,及减压浓缩,产生化合物int-14(540mg,31.1%)的黄色固体。1hnmr(400mhz,cdcl3):δ7.89(q,j=4.0hz,1h),8.50(d,j=8.0hz,1h),8.93(d,j=8.0hz,1h),9.09(d,j=6.8hz,1h),9.20(d,j=8.4hz,1h).esi-ms(ei+,m/z):219.05.n-(2,6-二氧代哌啶-3-基)-5-硝基喹啉-8-羧酰氨(int-15)在含化合物int-14(540mg,2.47mmol)及3-氨基哌啶-2,6-二酮盐酸盐(487mg,2.96mmol)的dmf(5ml)溶液中添加diea(957mg,7.41mmol),及混合物于0℃搅拌30分钟。然后慢慢添加hobt(400mg,2.96mmol)及edci(567mg,2.96mmol)至反应混合物中。让反应回升至室温,及搅拌2h。tlc显示反应已达到完成。反应混合物分溶于乙酸乙酯与水之间。合并的有机层使用水及盐水洗涤,经na2so4脱水,及减压浓缩,产生化合物int-15(300mg,37.0%)的灰色固体。1hnmr(400mhz,cdcl3):δ2.15-2.30(m,2h),2.56-2.61(m,2h),2.80-2.89(m,2h),2.90-2.96(m,1h),4.88-4.96(m,1h),7.92(q,j=4.0hz,1h),8.52(dd,j=8.0hz,1h),8.58(d,j=8.4hz,1h),8.92(dd,j=1.6,8.8hz,1h),9.174(dd,j=1.6,8.0hz,1h),10.93-10.96(m,1h).esi-ms(ei+,m/z):329.10.5-氨基-n-(2,6-二氧代哌啶-3-基)喹啉-8-羧酰氨(23)在含化合物int-15(300mg,0.914mmol)的meoh(3ml)溶液中添加10%pd/c(200mg)。反应混合物于室温及氢气氛下搅拌一夜。tlc显示反应已达到完成。反应混合物通过硅藻土过滤,及滤液减压浓缩,产生粗产物(200mg)。粗产物经制备性-hplc纯化,产生化合物23(30mg,11%)的橙色固体。1hnmr(400mhz,dmso-d6):δ2.10-2.20(m,2h),2.58-2.61(m,2h),2.76-2.85(m,1h),4.79-4.86(m,1h),6.83(d,j=6.0hz,1h),7.65(br,1h),8.39(d,j=6.0hz,2h),9.00(br,2h),10.90(s,1h).esi-ms(ei+,m/z):299.15.实施例16:4-氨基-n-(2,6-二氧代哌啶-3-基)喹啉-8-羧酰氨(24)的合成法4-氯喹啉-8-羧酸甲基酯(int-16)取含4-羟基喹啉-8-羧酸甲基酯(800mg,3.9mmol)及pocl3(906mg,5.9mmol)的二氯乙烷(10ml)溶液于90℃搅拌3h。tlc显示反应已达到完成。减压蒸发溶剂,残质经硅胶管柱层析法纯化(石油醚/乙酸乙酯:2/1),产生化合物int-16(760mg,88%)的黄色固体。esi-ms(ei+,m/z):222.05.4-迭氮基喹啉-8-羧酸甲基酯(int-17)取含化合物i-16(630mg,2.85mmol)、nan3(241mg,3.70mmol)的dmf(5ml)溶液于80℃搅拌一夜。混合物加水稀释,及使用乙酸乙酯萃取。合并的有机层使用水及盐水洗涤,经na2so4脱水,及减压浓缩,产生化合物int-17(600mg,92%)的黄色固体。esi-ms(ei+,m/z):229.10.4-迭氮基喹啉-8-羧酸(int-18)取含化合物int-17(300mg,1.3mmol)及naoh(105mg,2.6mmol)的thf(3ml)、meoh(1ml)与h2o(1ml)混合物溶液于室温搅拌6h。混合物减压浓缩,残质使用水(4ml)稀释。调整混合物的ph至3~4,所得悬浮液过滤。固体干燥,产生化合物int-18(250mg,89%)的白色固体。esi-ms(ei+,m/z):215.05.4-迭氮基-n-(2,6-二氧代哌啶-3-基)喹啉-8-羧酰氨(i-19)于0℃,取hatu(646mg,1.7mmol)慢慢分批加至含化合物i-18(250mg,1.2mmol)、3-氨基哌啶-2,6-二酮(275mg,1.7mmol)及diea(61mg,2.8mmol)的dmf(5ml)溶液中。于室温搅拌反应10h。添加水,水层使用etoac(2×50ml)萃取。合并的有机层使用h2o及盐水洗涤,及经na2so4脱水。减压排除溶剂,残质经管柱层析法纯化(二氯甲烷/甲醇:30/1),产生化合物i-19(300mg)的黄色固体。esi-ms(ei+,m/z):325.10.4-氨基-n-(2,6-二氧代哌啶-3-基)喹啉-8-羧酰氨(24)在含化合物i-19(300mg,1.2mmol)的meoh(7ml)溶液中添加10%pd/c(60mg)。反应混合物于室温与氢气氛下搅拌12h。tlc显示反应已达到完成。反应混合物通过硅藻土过滤,及滤液减压浓缩,产生粗产物(200mg)。粗产物经制备性-hplc纯化,产生产物(24)(25mg,7%,两个步骤)的黄色固体。1hnmr(400mhz,dmso-d6)δ13.490(s,1h),10.99(s,1h),9.49(d,j=8.0hz,1h),9.14(d,j=26.8hz,2h),8.64(d,j=8.4hz,1h),8.43(d,j=6.4hz,2h),7.83(t,j=7.6hz,1h),6.87(d,j=6.8hz,1h),4.83-4.90(m,1h),2.80-2.89(m,1h),2.58-2.63(m,1h),2.161-2.27(m,1h),2.04–2.07(m,1h).esi-ms(ei+,m/z):299.10.实施例17:3-氨基-n-(2,6-二氧代哌啶-3-基)喹啉-8-羧酰氨(25)的合成法1-(迭氮基甲基)-2-溴苯(int-20)取含1-溴甲基-2-溴苯(3g,12mmol)、迭氮化钠(1.56g,24mmol)的dmf(30ml)混合物于25℃搅拌20h。混合物倒至水(50ml)中,及使用乙酸乙酯(30mlx2)萃取。合并的有机层使用水及盐水洗涤,经na2so4脱水,及减压浓缩,得到化合物int-20(2.4g,94%)的油状物。8-溴喹啉-3-羧酸乙基酯(int-21)于室温,在含化合物int-20(2.4g,11.4mmol,1.0eq)的甲苯(260ml)溶液中添加tfoh(1.1ml,11.4mmol,1.0eq)。搅拌反应混合物,直到n2气泡停止释出为止。然后添加3-乙氧基羧酸乙基酯(3.3g,22.8mmol,2.0eq)至反应混合物中,搅拌反应3h。添加饱和nahco3水溶液中止反应。所得混合物使用etoac(2×100ml)萃取。合并的有机层使用水(100ml)及盐水(100ml)洗涤,经na2so4脱水,过滤,及减压浓缩。残质未经进一步纯化即用于下一个步骤。粗产物于etoac(260ml)中,经2,3-二氯-5,6-二氰基-1,4-苯醌(ddq)(2.58g,6.0mmol,1.0eq)处理,及搅拌5min。减压排除溶剂,得到粗产物,经管柱层析法纯化(己烷/乙酸乙酯:0/1),产生化合物int-21(600mg,18.9%)的白色固体。8-溴喹啉-3-羧酸(int-22)添加naoh水溶液(2n,2ml)至含化合物int-21(558mg,2.0mmol)的meoh(4ml)混合物中。所得混合物于室温搅拌2h。混合物减压浓缩,残质使用水(4ml)稀释。调整混合物的ph至2,所得悬浮液过滤。所得固体干燥,产生化合物int-22(300mg,60%)的黄色固体。(8-溴喹啉-3-基)氨甲酸苯甲基酯(int-23)取含化合物int-22(168mg,0.66mmol)、bnoh(108mg,1.0mmol)、二苯基磷酰基迭氮化物(dppa)(275mg,1.0mmol)、及三乙基氨(tea)(101mg,1.0mmol)的甲苯(5ml)溶液于100℃及n2气氛下搅拌4h。减压蒸发溶剂。残质使用水及etoac(2×10ml)萃取。合并的有机层使用水(10ml)及盐水(10ml)洗涤,经na2so4脱水,及过滤。滤液减压浓缩,产生化合物int-23(200mg)的黄色固体。esi-ms(ei+,m/z):357.0,359.0.3-(((苯甲氧基)羰基)氨基)喹啉-8-羧酸甲基酯(int-24)取含化合物int-23(410mg,1.15mmol)、pd(dppf)cl2(84mg,0.12mmol)、及tea(232mg,2.3mmol)的meoh(10ml)溶液于60℃与co气氛下搅拌16h。溶液过滤,滤液真空浓缩,残质经管柱层析法纯化(二氯甲烷/meoh:10/1),产生化合物int-24(223mg,57%,两个步骤)的固体。1hnmr(400mhz,dmso-d6):δ10.39(s,1h),8.90(d,j=2.4hz,1h),8.55(s,1h),8.07(d,j=8.4hz,1h),7.78(d,j=6.8hz,1h),7.60(t,j=7.6hz,1h),7.47(d,j=7.4hz,2h),7.40(dt,j=7.2,14.8hz,3h),7.30-7.32(m,2h),5.23(s,2h),3.90(s,3h).esi-ms(ei+,m/z):337.15.3-(((苯甲氧基)羰基)氨基)喹啉-8-羧酸(int-25)在含化合物int-24(223mg,0.66mmol)的thf(2ml)与h2o(2ml)混合物中添加lioh·h2o(56mg,1.32mmol,2.0eq),混合物于室温下搅拌4h。混合物真空浓缩,及使用hcl水溶液(1m)调整ph至4。所得悬浮液过滤,所得固体干燥,产生化合物int-25(200mg,93.5%)的白色固体。esi-ms(ei+,m/z):323.10.(8-((2,6-二氧代哌啶-3-基)氨甲酰基)喹啉-3-基)氨甲酸苯甲基酯(int-26)添加hatu(258mg,0.68mmol,1.0eq)至0~5℃的含化合物int-25(220mg,0.68mmol,1.0eq)、3-氨基哌啶-2,6-二酮盐酸盐(110mg,0.68mmol,1.0eq)及diea(175mg,1.36mmol,2.0eq)的dmf(5ml)混合物中。让所得混合物回升至室温3h。添加水至反应混合物中,所得悬浮液过滤。滤饼使用h2o洗涤,及干燥,产生化合物int-26(202mg,70.6%)的灰白色固体。1hnmr(400mhz,dmso-d6):δ11.29(d,j=7.6hz,1h),10.93(s,1h),10.48(s,1h),9.00(d,j=2.8hz,1h),8.67(d,j=2.8hz,1h),8.45(dd,j=1.2,7.2hz,1h),8.16(dd,j=1.6,8.4hz,1h),7.71(t,j=8.0hz,1h),7.49(dd,j=8.1,1.5hz,2h),7.40–7.47(m,2h),7.32–7.39(m,1h),5.25(s,2h),4.87-4.93(m,1h),2.77-2.87(m,1h),2.53–2.60(m,1h),2.22–2.30(m,1h),2.09–2.28(m,1h).esi-ms(ei+,m/z):433.20.3-氨基-n-(2,6-二氧代哌啶-3-基)喹啉-8-羧酰氨(25)取含化合物int-26(60mg,0.14mmol)的hbr(3ml)溶液于室温搅拌16小时。tlc显示反应已达到完成。在反应混合物中添加nahco3水溶液,调整ph至9。混合物使用etoac(2×10ml)萃取,合并的有机层使用水(10ml)及盐水(10ml)洗涤,经na2so4脱水,及真空浓缩。残质采用制备性tlc纯化(二氯甲烷/meoh:15/1),产生产物(25)(30mg,72.6%)的灰白色固体。1hnmr(400mhz,dmso-d6):δ11.51(d,j=6.8hz,1h),10.93(s,1h),8.54(d,j=2.4hz,1h),8.20(d,j=7.2hz,1h),7.85(d,j=8.4hz,1h),7.52(t,j=7.6hz,1h),7.32(d,j=2.4hz,1h),5.90(s,2h),4.83-4.89(m,1h),2.77-2.86(m,1h),2.53-2.58(m,1h),2.22–2.31(m,1h),2.14-2.19(m,1h).esi-ms(ei+,m/z):299.15.实施例18:n-(2,6-二氧代哌啶-3-基)-4-羥基喹啉-8-羧醯氨(26)的合成法2-(((2,2-二甲基-4,6-二氧代-1,3-二氧杂环己烷-5-亚基)甲基)氨基)苯甲酸甲基酯(int-27)取含2-氨基苯甲酸甲基酯(3.0g,20.83mmol)及2,2-二甲基-1,3-二氧杂环己烷-4,6-二酮(6.3g,41.67mmol)的正甲酸三乙酯(18.5g,124.98mmol)溶液于80℃搅拌约4h。tlc显示反应已达到完成。反应混合物冷却至室温,及通过硅藻土过滤。回收的固体使用乙醚洗涤及干燥,产生化合物int-27(5.8g,91%)。1hnmr(400mhz,cdcl3):δ1.75(s,6h),4.03(s,3h),7.27-7.31(m,1h),7.52(d,j=8.4hz,1h),7.61-7.66(m,1h),8.13(dd,j=1.2,8.0hz,1h),8.75(d,j=14.0hz,1h),13.18(d,j=14.0hz,1h).esi-ms(ei-,m/z):304.10.4-羟基喹啉-8-羧酸甲基酯(int-28)取含化合物int-27(3.0g,9.83mmol)的ph2o(30ml)溶液于255℃及氮气氛下搅拌1.5h。tlc显示反应已达到完成。反应混合物冷却至室温,及采用管柱层析法纯化(二氯甲烷/甲醇:30/1),产生化合物int-28(1.90g,95%)。1hnmr(400mhz,cdcl3):δ3.99(s,3h),6.34(d,j=7.6hz,1h),7.35(t,j=8.0hz,1h),7.68(t,j=6.8hz,1h),8.37(d,j=7.6hz,1h),8.63(d,j=8.0hz,1h),11.69(s,1h).esi-ms(ei+,m/z):204.10.4-羟基喹啉-8-羧酸(int-29)取含化合物int-28(508mg,2.50mmol)的meoh(6ml)溶液于室温搅拌约30分钟。添加naoh水溶液(2n,3ml)至反应混合物中。让反应回升至室温,及搅拌3小时。tlc显示反应已达到完成。反应混合物减压浓缩,残质使用hcl水溶液(1n)酸化至ph3。所得悬浮液过滤,及单离的固体使用水洗涤。取滤饼干燥,产生化合物int-29(390mg,82.5%)的灰色固体。esi-ms(ei-,m/z):188.15.n-(2,6-二氧代哌啶-3-基)-4-羟基喹啉-8-羧酰氨(26)在含化合物int-29(200mg,1.06mmol)及3-氨基哌啶-2,6-二酮盐酸盐(209mg,1.27mmol)的3mldmf混合物中添加diea(411mg,3.18mmol)。反应混合物于0℃搅拌30分钟。慢慢添加hobt(172mg,1.27mmol)及edci(243mg,1.27mmol)至反应混合物中后,让反应回升至室温。随后混合物搅拌3h。tlc显示反应已达到完成。反应混合物加水稀释,及使用etoac(2×30ml)萃取。合并的有机层使用水及盐水洗涤,经na2so4脱水,及减压浓缩。残质经制备性-hplc纯化,产生化合物(26)(20mg)的橙色固体。1hnmr(400mhz,dmsod6):δ2.02-2.09(m,1h),2.15-2.26(m,1h),2.57-2.61(m,1h),2.79-2.88(m,1h),4.81-4.87(m,1h),6.20(d,j=7.6hz,1h),7.47(t,j=8.0hz,1h),8.04(d,j=7.2hz,1h),8.19(d,j=6.8hz,1h),8.34(dd,j=1.2,8.0hz,1h),9.27(s,1h),10.96(s,1h),12.20(s,1h).esi-ms(ei+,m/z):300.10.实施例19:1-(5-氨基吡啶-2-基)-3-(2,6-二氧代哌啶-3-基)脲(27)的合成法1-(2,6-二氧代哌啶-3-基)-3-(5-硝基吡啶-2-基)脲(int-30)在0℃的含三光气(2.1g,7.1mmol,1.0eq)的二氯甲烷(25ml)搅拌溶液中添加5-硝基吡啶-2-氨(2g,14.3mmol,2.0eq)及et3n(2ml,14.3mmol,2.0eq)。混合物于室温搅拌6h。tlc显示反应已达到完成。反应混合物真空浓缩,残质未进一步纯化即用于下一个步骤。粗产物溶于甲苯(15ml)及3-氨基哌啶-2,6-二酮盐酸盐(1.16g,7.1mmol,1.0eq)中后,添加et3n(3ml,21.3mmol,3eq)。所得混合物于110℃与n2气氛下搅拌16h。减压排除溶剂,残质使用水及盐水洗涤,及使用etoac研磨。所得悬浮液过滤,及固体干燥,产生化合物int-30(1.8g,42%)的黑色固体。esi-ms(ei+,m/z):294.15.1-(5-氨基吡啶-2-基)-3-(2,6-二氧代哌啶-3-基)脲(27)取含化合物int-30(100mg,0.34mmol)的meoh(5ml)溶液使用10%pd/c(15mg)处理。混合物于室温及氢气氛下搅拌16h。采用lc-ms确认反应已完成。反应混合物通过硅藻土过滤,及滤液减压浓缩。所得残质经制备性-hplc纯化,产生产物(27)(23mg,26%)。1hnmr(400mhz,d2o):δ7.28-7.86(m,2h),7.26-7.32(m,1h),4.73(dd,j=6.0,12.4hz,1h),2.83-2.90(m,2h),2.23-2.32(m,2h).esi-ms(ei+,m/z):264.15.实施例20:1-(2,6-二氧代哌啶-3-基)-3-(5-羥基吡啶-2-基)脲(28)的合成法1-(5-(苯甲氧基)吡啶-2-基)-3-(2,6-二氧代哌啶-3-基)脲(int-31)在0℃的含三光气(296mg,1.0mmol,1.0eq)的二氯甲烷(4ml)搅拌溶液中添加5-(苯甲氧基)吡啶-2-氨(400mg,2.0mmol,2.0eq)及et3n(202mg,2.0mmol,2.0eq)。混合物于室温搅拌2小时。tlc显示反应已达到完成。反应混合物真空浓缩,残质未进一步纯化即用于下一个步骤。粗产物溶于甲苯(15ml)。加至含3-氨基哌啶-2,6-二酮盐酸盐(328mg,2.0mmol,1.0eq)与et3n(606mg,6.0mmol,3.0eq)的混合物中。所得混合物于120℃及n2气氛下搅拌16小时。减压蒸发溶剂,残质使用水及盐水洗涤,及使用etoac研磨。取观察到的悬浮液过滤,所得固体干燥,产生化合物int-31(370mg,70.6%)的白色固体。1hnmr(400mhz,dmso-d6):δ10.84(s,1h),9.20(s,1h),8.21(br,1h),7.96(d,j=2.8hz,1h),7.30–7.49(m,7h),5.12(s,2h),4.47–4.58(m,1h),2.69-2.78(m,1h),2.51-2.54(m,1h),2.09–2.13(m,1h),1.90-2.03(m,1h).esi-ms(ei+,m/z):355.20.1-(2,6-二氧代哌啶-3-基)-3-(5-羟基吡啶-2-基)脲(28)取含化合物int-31(200mg,0.56mmol)的dmf(10ml)溶液,使用10%pd/c(20mg)处理。混合物于室温及氢气氛下搅拌16h。采用lc-ms确认反应已完成。反应混合物通过硅藻土过滤,及滤液减压浓缩。残质经制备性-hplc纯化,产生化合物28(70mg,46.9%)。1hnmr(400mhz,dmso-d6):δ10.83(s,1h),9.42(s,1h),9.06(s,1h),8.30(br,1h),7.74(d,j=2.8hz,1h),7.24(d,j=8.8hz,1h),7.16(dd,j=2.8,8.8hz,1h),4.48–4.56(m,1h),2.68-2.78(m,1h),2.51–2.54(m,1h),2.07–2.15(m,1h),1.92-2.03(m1h).esi-ms(ei+,m/z):265.12.实施例21:1-(2,6-二氧代哌啶-3-基)-3-(吲哚啉-7-基)脲(29)的合成法7-硝基-1h-吲哚-1-羧酸第三丁基酯(int-32)在0℃的含7-硝基-1h-吲哚-1-羧酸第三丁基酯(5g,30.8mmol)的dcm(40ml)溶液中分批添加4-二甲基氨基吡啶(dmap)(76mg,0.62mmol)及boc2o(7.4g,33.9mmol)。反应混合物于室温搅拌3.5h。tlc显示反应已达到完成。减压排除溶剂,残质经管柱层析法纯化(石油醚/乙酸乙酯:10/1),产生化合物int-32(7.6g,94%)的黄色固体。1hnmr(400mhz,dmso-d6):δ1.54(s,9h),6.94(d,j=3.6hz,1h),7.44(t,j=7.6hz,1h),7.83-7.87(m,2h),8.02(d,j=7.6hz,1h).7-氨基吲哚啉-1-羧酸第三丁基酯(int-33)取含化合物int-32(2.62g,10mmol)的meoh(15ml)混合物,使用10%pd/c(450mg)处理。混合物于室温及氢气氛下搅拌20h。采用tlc确认反应已完成。反应混合物通过硅藻土过滤,及滤液减压浓缩。滤液减压浓缩,产生产物(int-33)(2g,85%)。esi-ms(ei+,m/z):235.151.7-(3-(2,6-二氧代哌啶-3-基)脲基)吲哚啉-1-羧酸第三丁基酯(int-34)在0℃的含三光气(698mg,2.35mmol)的dcm(8ml)溶液中,分批添加化合物int-33(1.1g,4.7mmol)及et3n(0.7ml,4.7mmol)。让反应混合物回升至室温,及搅拌4h。减压排除溶剂。添加含3-氨基哌啶-2,6-二酮盐酸盐(774mg,4.7mmol)及et3n(2ml,14.1mmol,3.0eq)的甲苯(10ml)混合物,所得混合物加热至120℃一夜。减压排除溶剂,残质使用etoac(25ml)及水(25ml)稀释。混合物搅拌2h后,过滤。单离的固体干燥,产生化合物int-34(1.5g,82%)的灰色固体。esi-ms(ei+,m/z):389.15.1-(2,6-二氧代哌啶-3-基)-3-(吲哚啉-7-基)脲(29)在含化合物int-34(300mg,0.77mmol)的dcm(4ml)溶液中添加三氟乙酸(tfa)(2ml)。混合物于室温搅拌1.5h后,于减压下排除溶剂。粗产物(200mg)经制备性-hplc纯化,产生化合物29(60mg,27%)的黄色固体。1hnmr(400mhz,dmso-d6):δ1.96-2.04(m,1h),2.07-2.13(,1h),2.53-2.55(m,1h),2.69-2.78(m,1h),3.14(t,j=8.0hz,2h),3.63(t,j=7.6hz,2h),4.43-4.50(m,1h),7.07-7.14(m,3h),7.18-7.22(m,1h),9.07-9.18(m,1h),10.90(s,1h).esi-ms(ei+,m/z):289.15。实施例22:n-(2,6-二氧代哌啶-3-基)吲哚啉-7-羧酰氨(30)的合成法吲哚啉-7-羧酸甲基酯(int-35)取含1h-吲哚-7-羧酸甲基酯(1.75g,10.0mmol)及bh3nme3(2.92g,40mmol)的1,4-二恶烷(10ml)溶液,使用浓hcl(2ml)处理。反应混合物于110℃搅拌0.5h,然后冷却至室温。添加hcl(10ml,6m),混合物于110℃搅拌15min。lc-ms显示反应已达到完成。反应混合物冷却至室温,及使用naoh水溶液(4m)调整反应混合物的ph至8。所得混合物使用etoac(3×50ml)萃取,及合并的有机层经na2so4脱水,及减压浓缩。粗产物经管柱层析法纯化(己烷/乙酸乙酯:50/1),产生化合物int-35(1.35g,76%)的白色固体。esi-ms(ei+,m/z):178.15.1-苯甲基吲哚啉-7-羧酸甲基酯(int-36)取含化合物int-35(950mg,5.36mmol)及(溴甲基)苯(1835mg,10.73mmol)的dmf(12ml)混合物,使用k2co3(1481mg,10.73mmol)处理,混合物于室温搅拌4h。加水后,混合物使用乙酸乙酯萃取。合并的有机层使用水及盐水洗涤,经na2so4脱水,及减压浓缩。粗产物经管柱层析法纯化(己烷/乙酸乙酯:100/1),产生化合物int-36(1.24g,86.7%)的无色油状物。esi-ms(ei+,m/z):268.15.1-苯甲基吲哚啉-7-羧酸(int-37)添加naoh水溶液(2m,4ml)至含化合物int-36(1.0g,3.74mmol)的meoh(15ml)溶液中。所得混合物于室温搅拌一夜。反应混合物浓缩。残质使用水(15ml)稀释。调整混合物的ph至2。所得混合物使用乙酸乙酯萃取。合并的有机层经na2so4脱水,及减压浓缩,产生化合物int-37(700mg,74%)的黄色固体。esi-ms(ei+,m/z):254.15.1-苯甲基-n-(2,6-二氧代哌啶-3-基)吲哚啉-7-羧酰氨(int-38)添加hatu(1.26g,3.32mmol,1.2eq)至0℃的含化合物int-37(700mg,2.76mmol,1.0eq)、3-氨基哌啶-2,6-二酮盐酸盐(546mg,3.32mmol,1.2eq)及diea(1070mg,8.30mmol,3.0eq)的dmf(15ml)混合物中。让所得混合物回升至室温,及搅拌3h。添加水,及水层使用etoac(3×50ml)萃取。合并的有机层使用水及盐水洗涤,经na2so4脱水。减压排除溶剂,残质经管柱层析法纯化(二氯甲烷/甲醇:50/1),产生化合物int-38(730mg,73%)的黄色固体。esi-ms(ei+,m/z):364.15.n-(2,6-二氧代哌啶-3-基)吲哚啉-7-羧酰氨(30)取含化合物int-38(600mg,1.65mmol)的meoh(15ml)溶液,使用10%pd/c(70mg)处理,混合物于室温与氢气氛搅拌3h。tlc显示反应已达到完成。反应混合物通过硅藻土过滤,及滤液减压浓缩。残质使用二氯甲烷/甲醇混合物(v/v:10/1,22ml)研磨,及于室温搅拌30min。混合物过滤,取所得固体干燥,产生产物(30)(280mg,62.0%)的白色固体。1hnmr(400mhz,dmso-d6):δ10.80(s,1h),8.39(d,j=8.4hz,1h),7.39(d,j=8.0hz,1h),7.12(d,j=6.8hz,1h),6.55(s,1h),6.50(t,j=7.6hz,1h),4.67-4.73(m,1h),3.55(t,j=8.4hz,2h),2.93(t,j=8.4hz,2h),2.73-2.82(m,1h),2.52-2.56(m,1h),2.07-2.18(m,1h),1.92-1.97(m,1h).esi-ms(ei+,m/z):274.10.实施例23:n-(2,6-二氧代哌啶-3-基)-1h-苯并[d]咪唑-4-羧醯氨(31)的合成法2,3-二氨基苯甲酸甲基酯(int-39)取含2-氨基-3-硝基苯甲酸甲基酯(2g,10.2mmol)的meoh(15ml)溶液,使用10%pd/c(200mg)处理,及反应混合物于室温与氢气氛下搅拌3h。tlc显示反应已达到完成。反应混合物通过硅藻土过滤,及滤液减压浓缩,产生化合物int-39(1.6g,94%)的黄色固体,其未进一步纯化即用于下一个步骤。esi-ms(ei+,m/z):167.1.1h-苯并[d]咪唑-4-羧酸甲基酯(int-40)取含化合物int-39(1.6g,9.64mmol)的正甲酸三甲基酯(24ml)混合物,使用p-tsoh(91g,0.5mmol,0.05eq)处理,混合物于n2下加热至回流2h。混合物冷却至室温,及过滤。滤饼使用一些et2o洗涤,及干燥,产生化合物int-40(1.3g,76.6%)的黄色油状物。1hnmr(400mhz,cdcl3):δ3.94(s,3h),2.45(s,3h),7.32(t,j=8hz,2h)7.85(t,j=7.6hz,2h),7.96(d,j=8.0hz,2h),8.32(s,1h),12.58(br,1h).esi-ms(ei+,m/z):177.1.1-苯甲基-1h-苯并[d]咪唑-4-羧酸甲基酯(int-41)取含bnbr(1.11g,6.6mmol)的dmf(1.5ml)溶液滴加至0~5℃的含化合物int-40(880mg,5mmol)的dmf(10ml)溶液中。让反应回升至室温,及搅拌15h。混合物分溶于乙酸乙酯与水之间。有机相使用水及盐水洗涤,经na2so4脱水,及减压浓缩。粗产物经管柱层析法纯化(己烷/乙酸乙酯:3/1),产生化合物int-41(600mg,45%)的黄色固体。1hnmr(400mhz,cdcl3):δ3.74(s,3h),5.75(s,2h),6.93-6.95(m,2h),7.20-7.24(m,3h),7.28(t,j=8.0hz,1h),7.71(dd,j=0.8,8.0hz,1h),8.00(dd,j=0.8,8.0hz,1h),8.07(s,1h).esi-ms(ei+,m/z):267.15.1-苯甲基-1h-苯并[d]咪唑-4-羧酸(int-42)添加naoh水溶液(2n,3ml)至含化合物int-41(600mg,2.25mmol)的meoh(8ml)混合物中。所得混合物于室温搅拌2h。混合物减压浓缩,残质使用水(4ml)稀释。调整混合物的ph至2,所得悬浮液过滤。取固体干燥,产生化合物int-42(320mg,53%)的黄色固体。1hnmr(400mhz,dmso-d6):δ5.84(s,2h),6.93-6.95(m,2h),6/95-6.97(m,2h),7.20-7.29(m,4h),7.28(t,j=8.0hz,1h),7.66(dd,j=0.8,7.6hz,1h),7.91(dd,j=0.8,8.0hz,1h),8.54(s,1h).esi-ms(ei+,m/z):253.1.1-苯甲基-n-(2,6-二氧代哌啶-3-基)-1h-苯并[d]咪唑-4-羧酰氨(int-43)添加edci(210mg,1.1mmol,1.2eq)及hobt(149mg,1.1mmol,1.2eq)至0~5℃的含化合物int-42(230mg,0.91mmol,1.0eq)、3-氨基哌啶-2,6-二酮盐酸盐(181mg,1.1mmol,1.2eq)及diea(353mg,2.73mmol,3.0eq)的dmf(8ml)混合物中。让所得混合物回升至室温,及搅拌2h。添加水,水层使用etoac(2×50ml)萃取。合并的有机层使用h2o及盐水洗涤,及经na2so4脱水。减压排除溶剂,残质经管柱层析法纯化(二氯甲烷/甲醇:30/1),产生化合物int-43(310mg)的黄色粉末。1hnmr(400mhz,dmso-d6):δ2.06-2.17(m,1h),2.24-2.27(m,1h),2.54-2.59(m,1h),2.78-2.87(m,1h),4.88-4.95(m,1h),5.61(s,2h),7.28-7.39(m,5h),7.78(d,j=8.4hz,1h),7.91(d,j=7.6hz,1h),8.72(s,1h),10.18(d,j=7.2hz,1h),10.93(s,1h).esi-ms(ei+,m/z):363.15.n-(2,6-二氧代哌啶-3-基)-1h-苯并[d]咪唑-4-羧酰氨(31)取含化合物int-43(310mg,0.82mol)的meoh(7ml)溶液使用10%pd/c(60mg)处理,反应混合物于室温及氢气氛下搅拌5h。tlc显示反应已达到完成。反应混合物通过硅藻土过滤,及滤液减压浓缩,产生粗产物(200mg),其经制备性-hplc纯化,产生产物(31)(30mg,12%,两个步骤)的黄色固体。1hnmr(400mhz,dmso-d6):δ2.15-2.24(m,2h),2.55-2.60(m,1h),2.79-2.87(m,1h),4.83-4.90(m,1h),7.54(t,j=8.4hz,1h),7.93(d,j=8.4hz,1h),8.01(d,j=7.2hz,1h),9.04(s,1h),9.75(br,1h),10.95(s,1h).esi-ms(ei+,m/z):273.15.实施例24:n-(2,6-二氧代哌啶-3-基)-6-((4-(吗啉基甲基)苯甲基)氧)吡啶甲酰氨(32)的合成法4-(吗啉基甲基)苯甲酸甲基酯(int-44)在0℃的含4-(溴甲基)苯甲酸甲基酯(10g,42.6mmol,1.0eq)、k2co3(10.22g,74.12mmol,1.7eq)的ch3cn(95ml)溶液中添加吗啉(4.16g,48mmol,1.0eq)。反应混合物于室温搅拌3h。tlc显示反应已达到完成。反应混合物通过硅藻土过滤,及滤液减压浓缩,产生化合物int-44(9g,87%)的无色油状物。esi-ms(ei+,m/z):236.1.(4-(吗啉基甲基)苯基)甲醇(int-45)在0℃的含化合物int-44(9g,38.3mmol,1.0eq)的thf(45ml)溶液中添加lialh4(2.9g,76.6mmol,2.0eq),混合物于室温搅拌2h。tlc显示反应已达到完成。混合物冷却至0℃,及使用h2o(2.9ml)、15%naoh水溶液中止反应。添加mgso4,混合物通过硅藻土过滤。滤饼使用etoac(50ml)洗涤,及滤液减压浓缩,产生化合物int-45(6.76g,85%)的白色固体。6-((4-(吗啉基甲基)苯甲基)氧)吡啶甲酸甲基酯(int-46)取含化合物int-45(1.5g,7.24mmol,1.0eq)、6-氯吡啶甲酸甲基酯(1.24g,7.24mmol,1.0eq)、及t-buok(810mg,7.96mmol,1.1eq)的二恶烷(5ml)溶液加热至100℃3h。tlc显示反应已达到完成。减压蒸发溶剂,残质经管柱层析法纯化(己烷/乙酸乙酯30/1),产生int-46(500mg)的黄色油状物。1hnmr(400mhz,cdcl3):δ7.63–7.77(m,2h),7.46(d,j=78.0hz,2h),7.34(d,j=8.0hz,2h),6.97(d,j=7.8,1h),5.44(s,2h),3.97(s,3h),3.70(t,j=4.8hz,4h),3.50(s,2h),2.44(t,j=4.8hz,4h).6-((4-(吗啉基甲基)苯甲基)氧)吡啶甲酸(int-47)在含化合物int-46(500mg,1.46mmol)的meoh(2ml)与h2o(1ml)混合物中添加lioh·h2o(122mg,2.92mmol,2.0eq),混合物于室温搅拌4h。混合物真空浓缩,及使用hcl水溶液(1m)调整ph至3~4。所得悬浮液过滤,取固体干燥,产生化合物int-47(450mg,94%)的白色固体。esi-ms(ei+,m/z):329.2.n-(2,6-二氧代哌啶-3-基)-6-((4-(吗啉基甲基)苯甲基)氧)吡啶甲酰氨(32)添加hatu(136mg,0.36mmol,1.0eq)至0~5℃的含化合物int-47(100mg,0.36mmol,1.0eq)、3-氨基哌啶-2,6-二酮盐酸盐(60mg,0.36mmol,1.0eq)及diea(116mg,0.9mmol,3.0eq)的dmf(2ml)混合物中。让所得混合物回升至室温1h。添加水,混合物使用etoac(2×20ml)萃取。合并的有机层使用水(20ml)及盐水(20ml)洗涤,经na2so4脱水,及减压浓缩。所得残质经制备性-hplc纯化,产生化合物32(72mg,54%)。1hnmr(400mhz,dmso-d6):δ10.93(s,1h),10.32(s,1h),8.89(d,j=8.4hz,1h),7.91(t,j=8.0hz,1h),7.66(d,j=7.2hz,1h),7.63(d,j=8.0hz,2h),7.54(d,j=7.6hz,2h),7.09(d,j=8.4hz,1h),5.51–5.61(m,2h),4.78-4.83(m,1h),4.33(s,2h),3.94(d,j=12.8hz,2h),3.66(t,j=12.0hz,2h),3.24(d,j=12.8hz,2h),3.10(m,2h),2.79-2.89(m,1h),2.58(m,1h),2.19-2.30(m,1h),1.98-2.06(m,1h).esi-ms(ei+,m/z):439.25.实施例25:来那窦迈置换分析法在atto565-来那窦迈置换分法中的化合物是使用d300edigitaldispenser(hp)数字型分注器分配在已标准化成1%dmso的384-孔微量盘(corning,4514)中的10nmatto565-来那窦迈、100nmddb1δb-crbn、50mmtrisph7.5、200mmnacl、0.1%f-68溶液(sigma)中。滴定的化合物于室温培养60min。采用fs微量盘式分析仪(bmglabtech),以120s循环监测偏极化萤光的变化历时1h。采用来自两次独立重复试验(n=2)的数据,使用graphpadprism7的可变斜率公式来估算ic50值。由上述条件下的40nm探针kd依据nikolovska-coleska等人,analyticalbiochemistry332(2):261-273(2004)在竞争模式中说明的公式,使用游离浓度计算ki。结果以ic50及对应ki值表示,示于下表1。以化合物2、3、4、5、6及作为对照物的来那窦迈置换萤光探针的结果示于图1a。来那窦迈及化合物5的ic50值(以[μm]表示)示于表2。表1.来那窦迈置换分析法表2.化合物5及来那窦迈的ic50值(以[μm]表示)化合物ic50(μm)化合物5113.5来那窦迈5.19如图1a所示,本发明化合物3、4、及5在偏极化萤光分析法中,相较于来那窦迈对照物,显示与crbn的中度结合活性(来那窦迈ic50=5.19μm,示于表2)。如表1及图1b,化合物23的ic50结果为2.9μm,比来那窦迈(是fda核准的crbn结合剂)(表2中ic505.19μm)显著改善。化合物24是极接近化合物23的类似物,显示类似来那窦迈的结合亲合性(表2中ic507.7μm)。此外,化合物24的喹啉中4-nh2被取代成化合物26中的4-oh,使得在100μm的探针置换法中的结合亲和性从7.7μm显著弱化50%,分别示于表1及图1b。所有专利公开案及非专利公开案均指示本领域技术人员的技术范围。所有这些公开案是以引用的方式并入本文,该引用的程度就如同已明确及个别地指出各个公开案的全文以引用的方式并入一般。虽然本文的本发明已参考特定实施例说明,但据了解,这些实施例仅示例本发明的原理及应用。因此应了解,可在不脱离由附录的申请专利范围所界定的精神及范围下,在示例性实施例及其他安排中作出许多修饰。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1