包含无有机溶剂和去污剂的转染活性囊泡的组合物和系统以及与之相关的方法
相关申请的交叉引用
本申请要求共同未决的、2018年10月9日提交的美国临时专利申请序列号62/743,116的权益,该申请通过引用整体并入本文。
背景技术:
科学研究和医学治疗的重要领域之一是希望选择性地和有效地将rna、dna、其他核酸和/或蛋白质货物(cargo)递送至靶位点,例如特定靶细胞。出于多种原因,这可能是有帮助的,包括改善患者治疗(例如基因治疗)以及用于治疗癌症和其他病况。例如,基因治疗可能能够用于大脑和整个中枢神经系统以治疗人类可能遭受的一些典型的可怕的神经系统病症,例如阿尔茨海默病、帕金森病、亨廷顿病、额颞叶痴呆、肌萎缩侧索硬化、脊髓性肌萎缩等。目前的基因治疗方法在其广泛应用的同时存在几个问题,特别是对于人类患者而言,例如因为需要将治疗性核酸携带到患者体内的包装的重复施用和毒性。当前本文所述的组合物、方法等有助于解决一个或多个这些问题或其他此类问题。
关于将dna和其他核酸递送到靶位点(例如脑中的患病细胞)的更科学的讨论,用于这种递送的现有方法包括脂质颗粒,在一些情况下被称为脂质纳米颗粒(“lnp”)或脂质体。术语脂质纳米颗粒或“lnp”用于描述在约中性ph下的脂基颗粒,其通常含有核酸并具有电子致密核。脂质体,也称为囊泡,是具有单个双层和水性核心的脂基结构。lnp形成的典型已知方法是在初始囊泡形成时将特定货物装载到囊泡。这些方法进一步使用专门仪器、有机溶剂和/或去污剂,需要大量材料并包括数天的处理时间,所有这些都严重阻碍了实用性、可及性和治疗可用性。
lnp和其他脂质颗粒通常包含可电离的阳离子脂质、一种或多种磷脂、胆固醇(chol)和聚乙二醇-脂质(peg-脂质)(maurer,wong等人,2001;semple,klimuk等人,2001;semple,akinc等人,2010;belliveau,huft等人,2012;leung,hafez等人,2012;suhr,coelho等人,2015)。(本文列出了讨论某些系统、设备、方法和其他信息的各种参考文献;无论参考文献在本申请中可能出现的位置,所有这些参考文献都通过引用整体并入本文并包括其所有教导和公开内容。本文对参考文献的引用并不是对这些参考文献构成本申请现有技术的承认。)lnp组合物的示例是比例为50/10/38.5/1.5mol%的可电离阳离子脂质、磷脂、胆固醇和聚乙二醇(peg)-脂质(分别)的组合。已表明该组合物在静脉内施用后显示出有效的肝细胞基因沉默(sirna)或表达(mrna)(semple,akinc等人,2010;jayaraman,ansell等人,2012;pardi,tuyishime等人,2015;suhr,coelho等人,2015)。其他人已经描述了由比例为50/10/38.5/1.5摩尔%的可电离的阳离子脂质、磷脂、胆固醇和聚乙二醇(peg)-脂质组成的lnp组合物,作为培养物中的原代神经元细胞的sirna递送以及用于递送至脑(rungta,choi等人,2013)。
lnp制剂可以通过快速混合溶解在乙醇中的脂质组分和由核酸货物组成的酸性水相来产生(jeffs,palmer等人,2005;belliveau,huft等人,2012;leung,hafez等人,2012)。已建立的用于lnp制备快速混合方法包括通过交错的鲱骨状微混合器(staggeredherringbonemicromixer,shm)进行微流体混合(belliveau,huft等人,2012;rungta,choi等人,2013;leung,tam等人,2015),或者用专用泵进行的t-接合(t-junction)混合(jeffs,palmer等人,2005)或者更为过时的乙醇/去污剂-去稳定的装载预制囊泡的方法(wheeler,palmer等人,1999;tam,monck等人,2000;maurer,wong等人,2001;semple,klimuk等人,2001)。在所有三种方法中,需要乙醇溶液(或去污剂)以提供足够的膜流动性以进行脂质重组和包封,并且在shm和t-接合技术的情况下,在乙醇溶液稀释进入水相时也发生了颗粒形成(belliveau,huft等人,2012;zhigaltsev,belliveau等人,2012;zhigaltsev,tam等人,2016)。然而,由于有机溶剂和酸性ph,所得悬浮液不是“即用”的,并因此所得悬浮液需要大量的下游处理。就材料成本和时间而言,这些方法对于在体外应用的实验室规模或直接施用的治疗水平上实现转染活性制剂来说具有明显障碍。
仍然存在对以无毒方式有效地将核酸和蛋白质货物递送到哺乳动物细胞中的转染试剂的需求,包括用于培养的哺乳动物原代细胞(通常,原代细胞是未转化的、直接从靶组织获得的非永生化细胞)。虽然使用原代细胞的重要性及其优于使用细胞系的优点已被充分了解,但转染此类细胞遇到的困难几乎已完全排除了将它们用于需要选择性基因敲低的任何类型的发现或验证研究。此外,向个性化医疗的发展正在推动在原代患者细胞中进行功能基因组筛选和验证,从而增加了对这些难以转染的细胞类型的稳健且无毒的转染方法的需求。
本发明的系统和方法等提供了解决这些困难中的一个或多个和/或提供其他优点的解决方案。
技术实现要素:
本文所述的系统、组合物、装置和方法等提供了本文通常称为转染活性囊泡(tcv)的脂基囊泡,将其配置为安全且有效地递送蛋白质、核糖核蛋白(rnp)、rna、dna和其他核酸货物以及其他所选货物到靶细胞中。安全性和效率之一和两者都是部分地通过从tcv装载过程(即将所选货物插入tcv)、tcv储存过程和/或tcv递送过程中消除去稳定剂(例如有机溶剂(例如乙醇)和去污剂(例如十二烷基硫酸钠))来实现的。因此,tcv保持在不含去稳定剂的溶液中的,例如作为不含去稳定剂的悬浮液。
如本文所使用的tcv是一种脂质体或其他脂基囊泡,并且是在没有去稳定剂和内部没有所选货物的情况下产生和/或储存的。这种tcv的一个优点是在不存在去稳定剂的情况下它们可以储存在溶液中或作为悬浮液储存,并且可以在不存在去稳定剂的情况下包封所选货物,并且可以在不存在去稳定剂的情况下将此类所选货物递送到靶细胞中。所选货物是指rnp、rna、dna、蛋白质等,其对用含有所选货物的tcv转染的靶细胞和/或目标患者产生所需作用。因此,除非上下文另有清楚说明,否则本文所述的tcv缺少最终所选货物,并且在某些实施方案中除了环境溶液等之外是空的。将此类tcv配置成在不使用有机溶剂或其他去稳定剂的情况下安全有效地将核酸和蛋白质货物等递送到哺乳动物细胞中。
tcv递送方法可包括用所选货物转染哺乳动物细胞(例如原代细胞)。货物还可包含与蛋白质复合的核酸,例如核糖核蛋白(rnp)。在一些实施方案中,本文所述的系统、组合物、装置和方法等可提供空的tcv或装载的tcv。
在一些方面,本文所述的系统、组合物、装置和方法等提供了不含此前需要将货物包封(或装载)到脂质囊泡或脂质体中和/或储存这些囊泡的有机溶剂和其他去稳定剂的转染活性囊泡(tcv)。本文所述的组合物、方法等可在不使用专门仪器的情况下使用或进行,例如可通过将含有空tcv的悬浮液与各种类型的所选货物经移液管往复运动轻轻混合来装载本文的预制tcv。本文所述的组合物、方法等可特别适用于“台式装载”,并且可与少量或大量所选货物材料一起使用。此外,单批空tcv可并行地台式装载多种不同的所选货物。
在一些实施方案中,本文所述的系统、组合物、装置和方法等提供了无有机溶剂和无去污剂的空tcv。如果已经使用乙醇或去污剂或其他去稳定剂来形成tcv,则通过透析或其他合适的方法将其除去以提供无有机溶剂、无去污剂的tcv组合物。可以使用轻轻混合(例如在移液管中重复手动往复运动tcv-生成流体)、shm、t-接合混合或挤出方法或者根据需要的其他tcv混合方法来装载tcv。
一方面,脂基tcv由可电离的阳离子脂质、磷脂、胆固醇和peg-脂质的混合物组成,并且包含tcv的组合物不含有机溶剂和/或去污剂,在其正常用法中使用这种术语来表示基本上不存在此类有机溶剂和去污剂,使得有机溶剂和/或去污剂不会引起明显的有害影响,尽管组合物中可能保留少量痕量。
在一些方面,可电离的阳离子脂质包含tcv的脂质组分的20-50%。一方面,空的脂基tcv含有比例为20/30/10/39/1mol%的dodma/dope/dspc/chol/peg-脂质的脂质组分。另一方面,空的脂基tcv含有比例为20/30/10/40mol%的dodma/dope/dspc/chol的脂质组分。另一方面,空的脂基tcv含有比例为50/10/39/1mol%的dodma/dspc/chol/peg-脂质的脂质组分。另一方面,空的脂基tcv含有比例为50/10/39/1mol%的dodma/dope/dspc/chol的脂质组分。还可根据需要使用其他各种组分。在某些方面,可电离的阳离子脂质的比例降低了。例如,可电离的阳离子脂质的比例可以是约10mol%、20mol%、30mol%、40mol%、50mol%或60mol%。
一方面,根据需要将空的脂基tcv与核酸型所选货物混合5秒、10秒、15秒、20秒、30秒、45秒、1分钟或2分钟,例如10-30秒。然后可将无有机溶剂、无去污剂的tcv储存在无有机溶剂、无去污剂的环境中和/或再次在无有机溶剂、无去污剂的环境中施用到靶细胞(例如哺乳动物细胞)。
在一些方面,核酸型所选货物可以是双链dna、单链dna、rna、小干扰rna、短发夹rna、信使rna、互补dna、微rna、质粒dna或其组合。在一些方面,核酸型所选货物可以包含合成的或化学修饰的寡核苷酸,例如以改善所选货物的稳定性。所选货物可以是与核酸复合的蛋白质(pna)。蛋白质型所选货物可以是参与基因编辑的蛋白质或用作细胞标记的报道分子的蛋白质(例如荧光标记等)。在一些实施方案中,与核酸复合的基于蛋白质的所选货物是核糖核蛋白。
在一些方面,本发明的系统、装置和方法等提供了将所选货物包封到脂基转染活性囊泡(tcv)中的方法,其包括:
-提供包含脂基tcv的水基溶液,所述水基溶液可不含去稳定剂;
以及,
-在合适的条件下将所述所选货物混合到溶液中足够长的时间使得所选货物包封在脂基tcv内以提供脂基tcv包封的所选货物,其中所述混合是在不存在有机溶剂或去污剂的情况下进行的。
去稳定剂可以是有机溶剂或去污剂中的至少一种。有机溶剂可以是例如甲醇、异丙醇、四氢呋喃(thf)、二甲基亚砜(dmso)、二甲基甲酰胺(dmf)或乙腈(acn)。去污剂可以是例如十二烷基硫酸钠(sds)。去稳定剂可以是温度。水基溶液可以是25mm至100mm的乙酸盐缓冲液。
脂基tcv在包封之前可以是空的,并且所述方法还可包括:
-在基本上不含溶剂和去污剂的水基溶液中获得脂基tcv包封的所选货物。
脂基tcv可包含阳离子脂质,例如可电离的阳离子脂质。脂基tcv可包含约20mol%至50mol%的阳离子脂质。可电离的阳离子脂质可包含1,2-二油烯基氧基(dioleyloxy)-3-二甲基氨基-丙烷(dodma)。脂基tcv可包含1,2-二油烯基氧基-3-二甲基氨基-丙烷(dodma)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)和1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)的混合物。所述混合物还可包含聚乙二醇(peg)或胆固醇中的至少一种。
脂基tcv可包含约20/30/10/39/1mol%的dodma/dope/dspc/chol/peg-脂质的混合物,可包含约20/30/10/40mol%的dodma/dope/dspc/chol的混合物,约50/10/40mol%的dodma/dspc/chol的混合物,约50/10/39/1mol%的dodma/dspc/chol/peg-脂质的混合物,或者约50/10/39/1mol%的dodma/dspc/chol/peg的混合物。
所选货物可以是核酸,例如经修饰的核酸。经修饰的核酸可包含例如2’-o-甲基化(2’-o-me)、硫代磷酸酯或吗啉基核酸、锁核酸中的至少一种。核酸可以是脱氧核糖核酸(dna)。dna可包含双链dna、单链dna、互补dna(cdna)或质粒dna。核酸可包含核糖核酸(rna)。rna可包含小干扰rna(sirna)、短发夹rna、信使rna(mrna)、微rna(mirna)。所选货物可包含蛋白质。蛋白质可以是核糖核蛋白(rnp)的一部分,其可以是功能性核糖核蛋白。rnp可包含cas9蛋白或指导rna中的至少一种、cas9蛋白和指导rna两者、或者包含cas9蛋白和指导rna以及单链dna(ssdna)。
货物可包含酶、核酸酶和内切核酸酶或者引物中的至少一种。货物可包含锌指核酸酶(zfn)、talen、cas9、cas10、cas11、cas12或cpf1中的至少一种。货物可包含酶、核酸酶和内切核酸酶或者引物中的至少一种。货物可包含编码核酸酶或抗原的mrna。
所述方法还可包括将脂基tcv与所选货物混合,所选货物可以是核酸,其以每微摩尔阳离子脂质约0.022-0.058mg所选货物的比例存在。所述方法还可包括将脂基tcv与所选货物混合,所选货物可以是核酸,其以每微摩尔阳离子脂质约0.029-0.116mg所选货物的比例存在。脂基tcv和所选货物可以以约467摩尔比的脂基tcv:所选货物进行混合。所选货物可以是核糖核蛋白(rnp)。脂基tcv和所选货物可以以约400至1200摩尔比的脂基tcv:所选货物进行混合。脂基tcv和所选货物可以以约473至1173摩尔比的脂基tcv:所选货物进行混合。脂基tcv和所选货物可以以高达约3000至5000摩尔比的脂基tcv:所选货物进行混合。
脂基tcv和所选货物可在约室温下混合约10至15秒,或约10至30秒。混合可以使用交错的鲱骨状微混合或t-接合混合进行。混合可通过移液管中的往复运动进行。
在一些方面,本发明的系统、装置和方法等提供了在水基溶液中包含脂基转染活性囊泡(tcv)的组合物。所述组合物可不含去稳定剂(有机溶剂和去污剂)。所述组合物和/或脂基tcv还可如“发明内容”、“附图”和“发明详述”或者“权利要求书”中所讨论的那样进行配置。本发明的系统、装置和方法等提供了在水基溶液中包含脂基转染活性囊泡(tcv)包封的所选货物的组合物,其基本上不含去稳定剂(例如有机溶剂和去污剂)。如本文所讨论的,脂基tcv包封所选货物。
本发明的系统、装置和方法等还提供了转染方法,所述方法包括如本文所讨论的用脂基转染活性囊泡(tcv)包封的所选货物转染靶细胞。靶细胞可以是哺乳动物细胞,例如哺乳动物原代细胞、哺乳动物原代神经元细胞、培养的哺乳动物细胞或者来自哺乳动物患者的细胞。
本文所述的方法可在实验室中进行,例如用于台式装载。所述方法可在工厂中进行以产生商业数量的转染细胞。所述方法可作为体内程序、医疗程序、治疗程序或基因治疗程序的一部分进行。所述方法可作为治疗阿尔茨海默病、帕金森病、亨廷顿病、额颞叶痴呆、肌萎缩侧索硬化或脊髓性肌萎缩的一部分进行。所述方法还可包括将脂基tcv包封的所选货物递送至患者的脑部。
在一些其他方面,本发明的系统、装置和方法等提供了包含本文的组合物的试剂盒。组合物可以在容器中并且试剂盒可包含组合物的使用说明书。说明书可根据本文的任何方法指导组合物的使用。所述容器可配置成向哺乳动物施用至少一剂组合物,所述试剂盒还包含至少一个包含施用说明书的标签。
在一些方面,本发明的系统、装置和方法等提供了本文的分离和纯化的组合物,用于制备抑制、预防或治疗患者(其可以是哺乳动物)疾病或病况的药物。
这些方面和其他方面、特征和实施方案均在本申请中阐述了,包括以下发明详述和附图。除非另有明确说明,否则所有实施方案、方面、特征等都可以任何期望的方式混合和匹配、组合和排列。另外,本文列出了讨论某些系统、设备、方法和其他信息的各种参考文献,包括在“相关申请的交叉引用”中;所有这些参考文献均通过引用整体并入本文并包括其所有教导和公开内容,不管参考文献在本申请中的可能出现的位置。
附图简述
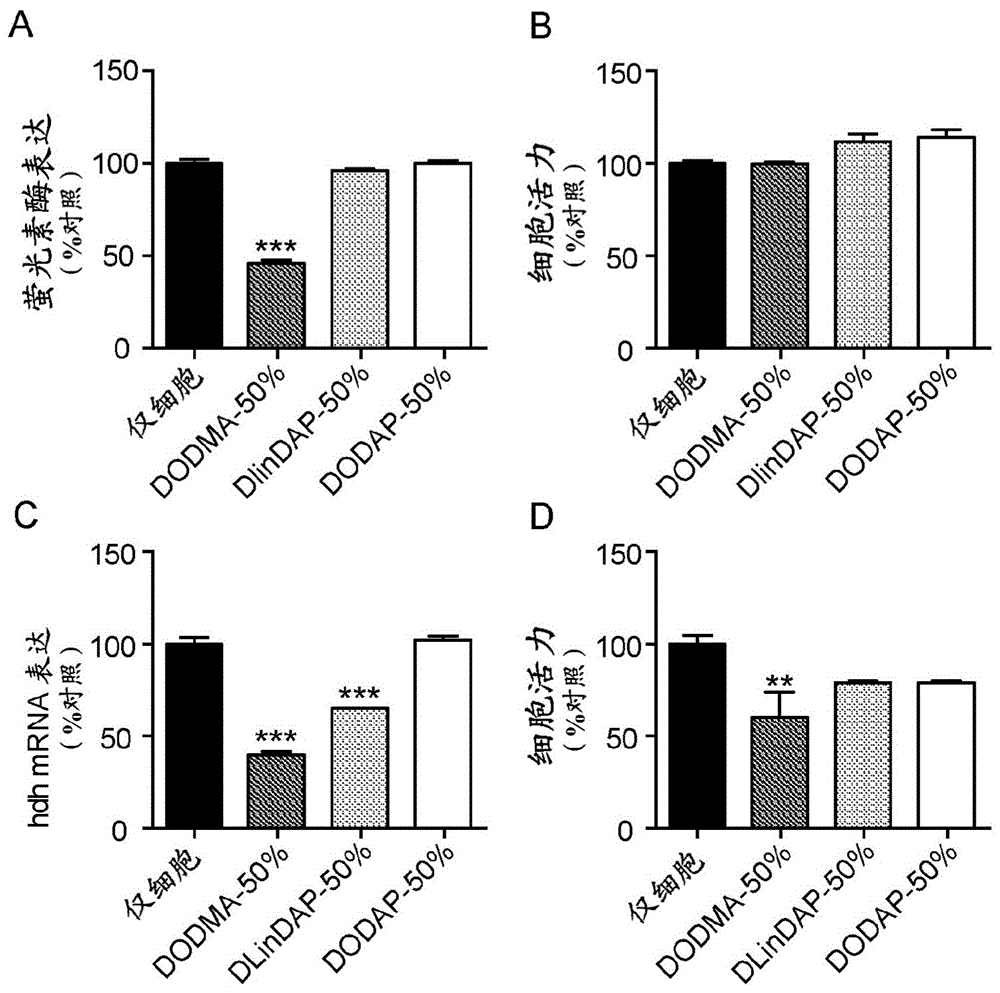
图1a-1d。根据本文的方法产生的转染活性囊泡(tcv)在永生化细胞和原代神经元中显示出敲低。(a)用由50%可电离的阳离子脂质组成的无有机溶剂、无去污剂的tcv转染后,hek-luc细胞中的相对萤光素酶表达。(b)相对对照(仅细胞)孔的百分比的来自(a)中呈现的相同转染组的细胞活力。(c)无有机溶剂、无去污剂的tcv介导的sirna所选货物转染到神经元后,原代皮质神经元中hdhmrna的相对表达。靶向hdh的sirna和tcv是使用1(a)中呈现的相同的组的可电离的阳离子脂质产生的。(d)使用无有机溶剂、无去污剂的tcv递送脱靶(萤光素酶)sirna在原代皮质神经元中的等同转染组的mtt还原法测量的细胞活力。对于hek-luc细胞,每种条件n=4,对于原代神经元,每种条件n=3孔。数据代表平均值±sem。与对照(仅细胞)条件相比,对每种条件进行单向anova后,通过bonforroni事后分析,*p<0.05,**p<0.01,***p<0.001。
图2a-2d。无有机溶剂、无去污剂的tcv的效力并不取决于用于产生空tcv的混合方法。(a)用由50%可电离脂质组成并通过t-接合混合(dodma-50%)或挤出(dodma-50%-x)而形成的tcv进行转染后,hek-luc细胞中的相对萤光素酶表达。(b)相对对照(仅细胞)孔的百分比的来自(a)中呈现的相同转染组的细胞活力。(c)使用2(a)中呈现的相同tcv组,在无有机溶剂、无去污剂的tcv介导的靶向hdh的sirna转染后,原代皮质神经元中hdhmrna的相对表达。(d)使用无有机溶剂、无去污剂的tcv递送脱靶(萤光素酶)sirna在原代皮质神经元中的等同转染组的mtt还原法测量的细胞活力。对于hek-luc细胞,每种条件n=4,对于原代神经元,每种条件n=3孔。数据代表平均值±sem。与对照(仅细胞)条件相比,对每种条件进行单向anova后,通过bonforroni事后分析,*p<0.05,**p<0.01,***p<0.001。
图3a-3d。含有减少量的可电离脂质的无有机溶剂、无去污剂的空tcv促进了有效的sirna递送,同时毒性降低。(a)用由20%或50%的可电离脂质1,2-二油烯基氧基-3-二甲基氨基-丙烷(dodma)组成的tcv转染后,hek-luc细胞中的相对萤光素酶表达。(b)相对对照(仅细胞)孔的百分比的来自(a)中呈现的相同转染组的细胞活力。(c)使用3(a)中呈现的相同tcv组,在无有机溶剂、无去污剂的tcv介导的靶向hdh的sirna转染后,原代皮质神经元中hdhmrna的相对表达。(d)使用无有机溶剂、无去污剂的tcv递送脱靶(萤光素酶)sirna在原代皮质神经元中的等同转染组的mtt还原法测量的细胞活力。对于hek-luc细胞,每种条件n=4,对于原代神经元,每种条件n=3孔。数据代表平均值±sem。与对照(仅细胞)条件相比,对每种条件进行单向anova后,通过bonforroni事后分析,*p<0.05,**p<0.01,***p<0.001。
图4a,4b。将dope掺入无有机溶剂、无去污剂的空tcv中不会改变tcv形态。在(a)20/30/10/39/1mol%的dodma/dope/dspc/chol/peg-脂质(dope=1,2-二油酰基-sn-甘油-3-磷酸乙醇胺);dspc=1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱;peg=聚乙二醇)和(b)dodma/dspc/chol/peg-脂质(50/10/39/1mol%)的tcv上进行cryo-tem分析。比例尺=100nm。
图5。本文的无有机溶剂、无去污剂的空tcv可用于递送功能性核糖核蛋白(rnp)。用cas9rnp和单链寡脱氧核苷酸(ssodn)修复模板转染hek293细胞,两者均通过根据本文所述的方法产生的无有机溶剂、无去污剂的tcv递送。cas9蛋白与靶向grn基因的指导复合。转染后48小时从细胞中提取dna。pcr用于特异性检测野生型(wt)grn等位基因或者仅当同源介导的修复(hdr)将递送的ssodn掺入由cas9产生的dna双链断裂时才存在的突变grn等位基因。突变grn等位基因可在tcv介导的cas9rmp递送后被检测到,但不存在于对照(ctrl)细胞中。
图6。位于原代神经元内的cas9的显微照片。如本文所讨论的,经由无有机溶剂、无去污剂的tcv递送的rnp可使用针对cas9蛋白的荧光抗体检测,以红色显示。未经处理的对照没有这样的红色荧光信号。蓝色信号=核酸(dapi染色),绿色信号=鬼笔环肽(f-肌动蛋白染色)。
图7。显示经由台式装载rnp到空的无有机溶剂、无去污剂的tcv中递送的rnp在hek细胞中的转录敲低图。用靶向萤光素酶的cas9rnp转染hek293细胞。台式装载式(dodma/dope/dspc/chol(20/30/10/40))的tcv。当通过qpcr测量时,与对照(图中的“对照”)相比,hek细胞中萤光素酶mrna的相对水平显示出显著敲低。每组n=3。数据代表平均值±sem。通过student’st-检验p=0.0018。
图8。显示经由台式装载rnp到空的无有机溶剂、无去污剂的tcv中递送的rnp在hek细胞中的蛋白质敲低图。用靶向萤光素酶的cas9rnp转染hek293细胞。台式装载式(dodma/dope/dspc/chol(20/30/10/40))的tcv。当通过one-glo测量时,与对照(图中的“对照”)相比,hek细胞中萤光素酶蛋白的相对水平显示出显著敲低。每组n=3。数据代表平均值±sem。通过student’st-检验p=0.0003。
图9。显示经由台式装载rnp到空的无有机溶剂、无去污剂的tcv中递送的rnp在原代皮质神经元中的转录敲低图。用靶向人亨廷顿蛋白(htt)的cas9rnp转染原代皮质神经元。台式装载式(dodma/dope/dspc/chol(20/30/10/40))的tcv。当通过qpcr测量时,与对照(图中的“gluc”)相比,原代神经元中httmrna的相对水平显示出显著敲低。每组n=3。数据代表平均值±sem。通过student’st-检验p=0.0039。
图10。显示经由无有机溶剂、无去污剂的tcv递送的mrna在hek细胞中的mrna表达图。经由无有机溶剂、无去污剂的tcv(dodma/dope/dspc/chol(20/30/10/40))以不同比例(低=0.029mgmrna/μmol脂质,中=0.058mgmrna/μmol脂质,高=0.116mgmrna/μmol脂质)将萤光素酶mrna递送至hek细胞中。与对照相比,所有比例均显示出显著表达,最低比例显示出最高表达。通过one-glo+tox试剂盒(promega)测量mrna表达,每个条件n=3。
图11。显示经由无有机溶剂、无去污剂的tcv递送的mrna在原代皮质神经元中的mrna表达图。经由无有机溶剂、无去污剂的tcv(dodma/dope/dspc/chol(20/30/10/40))以不同剂量将萤光素酶mrna递送至原代皮质神经元中。与对照相比,所有剂量均显示出显著表达。通过one-glo+tox试剂盒(promega)测量mrna表达,每种条件n=3。
图12。显示无有机溶剂、无去污剂的tcv中的rnp在hek细胞中的细胞活力图。经由无有机溶剂、无去污剂的tcv(dodma/dope/dspc/chol(20/30/10/40))或使用rnaimax(图中的“rmax”;thermofisherscientific)递送rnp到hek细胞中进行细胞毒性评估。与rnaimax相比,无有机溶剂、无去污剂的tcv毒性显著降低,p=0.0002。使用one-glo+tox试剂盒(promega)评估毒性,每组n=3。
图13。显示台式装载到空的无有机溶剂、无去污剂的tcv中的sirna的原代神经元中的细胞活力的显微照片。经由无有机溶剂、无去污剂的tcv(dodma/dope/dspc/chol/peg-脂质(20/30/10/39/1))或使用商购可得的mirustko系统(mirusbio)递送sirna到原代神经元中进行细胞毒性评估。如显微照片所示,与mirustko系统相比,通过台式装载到空的无有机溶剂、无去污剂的tcv中进行递送的sirna毒性显著降低。
图14。显示无有机溶剂、无去污剂的tcv在hek细胞中的敲低图。经由以50%(“d-50%”,通过t-接合混合制备)、50%(“d-50%ex”,通过挤出制备)dodma水平的无有机溶剂、无去污剂的tcv和经由商购可得的mirustko系统(mirusbio)递送sirna。当前的50%dodma制剂显示出约50%的敲低,然而,mirustko系统表现更差。
发明详述
本文所述的系统、组合物、装置和方法等提供了本文通常称为转染活性囊泡(tcv)的脂基囊泡,其被配置成安全且有效地将dna和其他核酸型所选货物递送到靶细胞中。安全性和效率之一和两者都是部分地通过从tcv装载和储存过程(即将所选货物插入tcv)和/或tcv递送过程中消除去稳定剂(例如,有机溶剂(例如乙醇)和去污剂(例如十二烷基硫酸钠))来实现的。tcv递送过程可包括用所选货物转染哺乳动物细胞(例如原代细胞)。所选货物还可包含与蛋白质复合的核酸,例如核糖核蛋白(rnp)。
在一些实施方案中,本文所述的系统、组合物、装置和方法等提供了无有机溶剂和无去污剂的空的脂基tcv。装载的tcv可以使用轻轻混合(例如在移液管中重复手动往复运动tcv-生成流体)、shm、t-接合混合或挤出方法或者根据需要的其他tcv混合方法来形成。
一方面,脂基tcv由可电离的阳离子脂质、磷脂、胆固醇和peg-脂质的混合物组成,并且包含tcv的组合物不含有机溶剂和/或去污剂。
如本文所讨论的无有机溶剂、无去污剂的tcv可用于治疗合适的疾病和病况,例如通过基因治疗。如本文所讨论的无有机溶剂、无去污剂的tcv改善了rna、dna和rnp基因治疗产物向人类患者的递送。无有机溶剂、无去污剂的tcv有效地将基因治疗(包括但不限于mrna、sirna和rnp)产物递送至脑细胞或其他靶细胞。许多人类病症的根本原因是所需蛋白质的功能丧失或突变蛋白质的毒性功能获得。使用本文的无有机溶剂、无去污剂的tcv,这些问题都是可处理的、甚至是可逆的。
这样的治疗的一些示例包括用于治疗神经病症(一些阿尔茨海默病、帕金森病、亨廷顿病、额颞叶痴呆、肌萎缩侧索硬化、脊髓性肌萎缩等的病例)的中枢神经系统的基因治疗。
如本文所讨论的无有机溶剂、无去污剂的tcv也可遗传性“敲低”突变基因/基因产物,例如通过靶向的安全递送sirna或rnp、用mrna进行基因替代疗法或用rnp介导的基因编辑校正因果天然dna突变。可以以这种方式靶向的人类疾病的两个具体示例是亨廷顿病(hd)和额颞叶痴呆(ftd)。
亨廷顿病是一种进行性的不可治愈的神经退行性疾病,其具有显性遗传模式。亨廷顿(htt)基因中扩增的cag核苷酸重复序列是造成这种疾病的原因。由突变htt基因编码的亨廷顿蛋白(htt)含有扩增的聚谷氨酰胺重复序列,其赋予了基因产物毒性功能获得。降低突变亨廷顿蛋白的脑水平是目前正在追求的减缓或阻止hd疾病进展的主要治疗策略,并且可使用本文所讨论的无有机溶剂、无去污剂的tcv来实现和改善。用装载有靶向htt表达的sirna或用设计用于降低亨廷顿蛋白表达或毒性的rnp所选货物的tcv将是hd的有效疗法。额颞叶痴呆有许多原因,但是蛋白质颗粒蛋白前体(progranulin)(潜在的脑存活因子)的丧失是一个被详细描述的原因。本文所讨论的无有机溶剂、无去污剂的tcv可递送设计用于表达颗粒蛋白前体或校正引起颗粒蛋白前体丧失的潜在dna突变的颗粒蛋白前体mrna或rnp(分别)将增加颗粒蛋白前体的脑水平并且将是ftd的有效疗法。用表达颗粒蛋白前体mrna的tcv增加颗粒蛋白前体也可以是许多常见神经疾病(例如阿尔茨海默病、帕金森病和肌萎缩侧索硬化)的神经保护策略。
材料和方法的示例
材料
1,2-二油烯基氧基-3-二甲基氨基-丙烷(dodma)购自caymanchemical(annarbor,mi)。1,2-二油酰基-3-二甲基铵-丙烷(dodap)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)和1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)购自avantipolarlipids(alabaster,al)。胆固醇购自sigmaaldrich(st.louis,mo)。peg-dmg按之前所述进行合成(akinc,zumbuehl等人,2008)。所有脂质均保存为乙醇储备液。靶向萤火虫萤光素酶的sirna(siluc)(basha,ordobadi等人,2016)购自integrateddnatechnologies(coralville,ia)。针对鼠hdh的sirna购自ambion(
转染活性囊泡(tcv)的制备
将脂质组分(可电离的阳离子脂质、磷脂、胆固醇和peg-脂质)以适当的比例溶解在乙醇中,以达到20-35mm总脂质的终浓度。制备含有25mm乙酸钠ph4缓冲液的水相。使用两种已建立的纳米颗粒制备技术将两种溶液组合:快速混合和挤出。
快速混合:
将含有脂质的有机相通过t-接合混合器以20ml/min的最终流速、1:3的有机:水相(v/v)比与水相混合,该混合器被制造成满足peeklowpressureteeassembly规格(1/16",0.02通孔,部件号#p-712)(jeffs,palmer等人,2005;kulkarni,tam等人,2017;kulkarni,darjuan等人,2018)。将所得悬浮液用1000倍体积的25mm乙酸钠ph4缓冲液透析以除去乙醇。
挤出:
将脂质溶解在乙醇中至终浓度为35mm。如别处所述(maurer,wong等人,2001),通过向乙醇溶液中快速添加25mm乙酸钠ph4以达到30%乙醇(v/v)的终浓度来形成颗粒。将所得纳米颗粒悬浮液在环境温度下通过2×80nm聚碳酸酯膜挤出三次。挤出后,将颗粒进行缓冲液交换以除去乙醇。
转染活性囊泡(tcv)的分析
通过使用t-胆固醇测定试剂盒(wakochemicals,mountainview,ca)测定胆固醇含量并如别处所述(chen,tam等人,2014)外推总脂质浓度来确定脂质浓度。如前所述(chen,tam等人,2014;leung,tam等人,2015),使用ribogreen测定法确定核酸包封。
低温透射电子显微镜
如前所述进行cryo-tem(kulkarni,darjuan等人,2018)。简而言之,使用amicon离心浓缩单元(10kdanwco)将tcv浓缩至约20mg/ml的总脂质浓度。将少量(3-5ul)的材料施加到辉光放电的铜载网上,并使用feimarkivvitrobot(hillsboro,or)快速冷冻。将载网储存在液氮下直至成像。所有成像均使用以低剂量模式在200kv下操作的feitecnaig2仪器进行。使用feieagle4kccd底部安装的检测仪捕获图像。所有样品制备和成像均在ubcbioimagingfacility(vancouver,bc)上进行。
细胞培养和试剂:
所有基础细胞培养基和b27神经元补充剂购自gibco(thermofisher,waltham,ma)。hank’s平衡盐溶液(hbss)、青霉素-链霉素、l-谷氨酰胺和胰蛋白酶溶液获自hyclone(logan,ut)。将hek293细胞接种在来自corning(corning,ny)的透明底部白壁平板上。将原代皮质细胞接种到用聚-d-赖氨酸(sigma,st.louis,mo)包被的组织培养物处理的平板(fisher)上。潮霉素b获自invitrogen(carlsbad,ca)。重组apoe4获自peprotech(rockyhill,nj)。
为测量hek293细胞中的细胞活力和萤光素酶水平,使用来自promega(madison,wi)的one-glo+tox试剂盒。通过来自sigma(st.louis,mo)的mtt体外毒理学试剂盒测量原代神经元中的细胞活力。
hek293细胞中的萤光素酶报告基因:
先前已经描述了具有稳定整合的萤光素酶报告基因构建体的hek293细胞系(hek-luc细胞)的产生(desouza,islam等人,2016)。将细胞维持在37℃、95%空气、5%co2湿润气氛下的补充有10%胎牛血清、2mml-谷氨酰胺和125μg/ml潮霉素b的dmem高葡萄糖中。将细胞以12,000-20,000个细胞/孔的密度接种在白壁96-孔板中。
原代细胞培养:
皮质培养物是从胚胎期e17.5c57bl/6j和fvb.yac128小鼠中制备的。简而言之,在冰冷的hbss中解剖皮质,并使用0.05%胰蛋白酶(hyclone)溶液在37℃下消化组织10分钟。然后通过5ml移液管研磨皮质5次,并增加额外的5-7次的200μl移液管尖端研磨。通过在800rpm下离心5分钟沉淀细胞,用hbss洗涤,然后重悬于补充有b27、2mml-谷氨酰胺(hyclone)和1%青霉素/链霉素(hyclone)的温热neurobasal培养基中。将皮质神经元培养物以1.5×105个细胞/孔的密度接种到聚-d赖氨酸包被的24-孔板上。将细胞维持在37℃、95%空气、5%co2的湿润气氛中。
转染:
将所有试剂在工作台上混合。将含有50%阳离子脂质的空tcv与sirna以0.058mgsirna/微摩尔脂质的比例混合。将含有20%阳离子脂质的tcv以0.022mgsirna/微摩尔脂质的比例混合。通过移液管将tcv悬浮液与sirna短暂混合,并在室温下温育10分钟。
转染前24小时将hek293细胞铺板。添加完全dmem培养基到tcv:sirna混合物中至终浓度为3.3μg/mlsirna,转染时进行培养基全更换。
转染前,原代神经元细胞在体外生长7天。将含有2-6μg/ml的重组apoe4的完全neurobasal培养基添加到tcv:sirna悬浮液中,每孔更换一半培养基。
萤光素酶测定:
转染后48至72小时,根据制造商的说明使用one-glo+tox试剂盒(promega)测定hek293细胞的细胞活力和发光。简而言之,向每个孔中添加活细胞试剂,并将细胞在37℃温育30分钟。在酶标仪(polarstaromega酶标仪,bmglabtech)上于400nm激发下测定平板,并在510nm的发射波长下进行读取。然后添加one-glo试剂,并将平板在室温下温育3分钟。通过同一酶标仪的透镜的光输出来测量发光。数值以%对照表示,并且代表每个条件n=4孔。
mtt测定:
在24孔板中转染72小时后,通过mtt测定法测定原代皮质神经元的细胞活力。将mtt试剂(3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四氮唑溴盐,或mtt)在hbss中重构至终浓度为5mg/ml,并以10%v/v添加到每个孔中。将细胞在37℃温育4小时。去除培养基,并向每个孔中加入250μl增溶溶液。在570nm处测量吸光度。数值以%对照表示并且代表每个条件n=3孔。
定量rt-pcr
将贴壁的原代皮质细胞在无菌pbs中洗涤一次,然后将其在含有1%2-巯基乙醇的600μl裂解缓冲液中从平板上刮下并立即在-80℃冷冻。随后根据制造商的说明使用purelinkrnamini试剂盒(invitrogen)提取总rna。根据制造商的说明使用superscriptvilo试剂盒(invitrogen)进行所有样品的逆转录,使用250ηg总rna作为cdna合成的输入,并使用5ηg稀释的rna进行定量pcr反应。使用标准曲线方法完成hdhmrna水平的定量,其中在单独的孔中扩增靶mrna和对照基因,使用fastsybr(appliedbiosystems)进行并在step-oneabi系统(appliedbiosystems)上实施。每个样品一式两份运行。将每个孔中mrna的相对量计算为hdhmrna与对照基因csnk2a2之间的比率。数值以%对照表示并且代表每个条件n=3孔。
核糖核蛋白(rnp)复合材料和制剂
用于rnp制剂的所有材料(包括指导rna(grna)、tracrrna、单链寡脱氧核苷酸(ssodn)和重组cas9蛋白)均获自idt(sanjose,ca)。idt(sanjose,ca)提供了用于靶向萤光素酶的grna序列。靶向人颗粒蛋白前体(grn)的grna序列与该基因的外显子5结合。用于同源介导的修复(hdr)的ssodn序列经工程改造以将4bp缺失引入grn的外显子5中。
根据制造商的说明书进行rnp组装。简而言之,通过在95℃下将等摩尔比的crrna:tracrrna(例如1μmtracrrna与1μmgrna)温育5分钟来形成指导rna(grna)复合物。然后使混合物在室温下冷却20-30分钟。随后通过以等摩尔比将grna双链体与cas9蛋白混合并使混合物在使用前在室温下静置5分钟来形成rnp。
用核酸转染哺乳动物细胞:
将本文所讨论的空的无有机溶剂、无去污剂的tcv以及用于比较的商购可得的试剂在工作台上与所选货物混合。将tcv与核酸型所选货物以每微摩尔脂质0.01-0.2mg核酸的各种比例进行混合。通过移液管将tcv悬浮液与sirna短暂混合,并在室温下温育10分钟。
转染前24小时将hek293细胞铺板。添加完全dmem培养基到tcv:核酸混合物中至终浓度为0.33-3.3μg/mlsirna或0.1-1μg/mlmrna,在转染时进行培养基全更换。转染前,原代神经元细胞在体外生长7天。将含有2-6μg/ml重组apoe4的完全neurobasal培养基添加到tcv:核酸悬浮液中,每孔更换一半培养基。
按照制造商的说明用mirustransit-tko处理细胞。简而言之,将mirustransit-tko以5μlmirus/100μl无血清培养基的浓度添加到无血清培养基中。然后将sirna加入管中,用移液管轻轻混合,并在室温下温育15-30分钟。然后将溶液转移到细胞上,mirus的终浓度为5μl/1ml完全培养基。sirna的终浓度为25nm。
用rnp转染哺乳动物细胞:
将0.5-20mmtcv和0.5-20μmrnp以467-5000摩尔比合并,并使其在室温下温育10分钟。单独将1-10μm的ssodn溶液与tcv合并,并将该混合物在室温下温育5-15分钟。在一些情况下,在添加tcv之前将等摩尔量的ssodn添加到rnp复合物溶液中。
合并含有rnp的tcv和ssodn混合物,并添加完全培养基至终浓度各为10-200nm的rnp和ssodn。在24小时前铺板的hek细胞上进行全培养基更换。转染前,原代神经元细胞在体外生长5-7天。将含有2-6μg/ml重组apoe4的完全neurobasal培养基添加到tcv:rnp混合物中,以及每孔更换一半培养基。
按照制造商的说明用lipofectaminernaimax试剂处理细胞。简而言之,制备rnp复合物并将其添加到无血清培养基和rnaimax的混合物中,在室温下温育5分钟,并添加到铺板的细胞中。
pcr检测同源介导的修复
使用对野生型(wt)或突变grn等位基因具有特异性的正向引物和通用反向引物进行聚合酶链式反应(pcr),以从经转染的hek293培养物中提取的基因组dna中扩增grn外显子5。根据制造商的说明使用mytaq(bioline,usa)进行pcr。通过在用sybrsafe染色的1.5%琼脂糖凝胶上的凝胶电泳分离pcr产物,并在uv光下成像。
免疫细胞化学
使用3-4%多聚甲醛溶液将细胞固定15分钟。将细胞在含有0.1%triton-x的pbs(pbst)中透化15分钟。将细胞与含有1:1000抗cas9(invitrogen)抗体混合物的pbst在4℃温育过夜。用pbs洗涤细胞三次,并与alexafluor594荧光二抗(invitrogen)和鬼笔环肽-ifluor488cytopainter抗体(abcam)各自的1:1000混合物在室温下温育1小时,再次洗涤并与含有dapi的溶液温育5分钟以可视化细胞核。
统计
所有统计学比较均以单因素方差分析(anova)与bonferroni事后分析进行,以比较个体平均值与对照处理细胞并对多重比较进行校正(prism6,graphpadsoftwareinc.)。在仅有两组的情况下,使用student’st-检验来比较个体平均值。p-值小于0.05被认为是显著的。
结果相关的实施例
实施例1:空的转染活性囊泡(tcv)在无有机溶剂的情况下有效地包封核酸
通过t-接合或shm混合产生的空tcv制剂显示出大约85%或更高的包封效率。我们首先测试了由可电离的阳离子脂质组成的tcv在无有机溶剂或去污剂的帮助下包封核酸的能力,其跨越观察到的体内基因沉默效力的范围(dodma>>dlindap>dodap)(“dlindap”是1,2-二亚油酰基(dilineoyl)-3-二甲基铵-丙烷)。值得注意的是,在不存在任一种的情况下,由可电离脂质/dspc/chol/peg-脂质(50/10/39/1mol%)组成的制剂在ph4下以0.058mgsirna/微摩尔脂质的比例混合并随后用pbs中和后实现了几乎完全的sirna包封(>85%)(表1)。确定包封的测定法是基于脂质组分从核酸中排除rna结合染料。因此,包封被认为是以超瞬时方式从外部培养基中螯合rna(即稳定的包封)。尽管在生产过程中缺少有机溶剂或去污剂,但获得的tcv制剂令人惊讶地显示出与其他地方报道的使用有机溶剂的快速混合技术所生成的lnp-sirna相似的包封效率(belliveau,huft等人,2012;chen,tam等人,2014;leung,tam等人,2015;chen,tam等人,2016)。
表1:不同tcv制剂的核酸包封效率。
实施例2:无有机溶剂、无去污剂的空tcv中的sirna在永生化细胞和原代神经元中显示出强力的敲除
能包封核酸并随后以无毒方式递送核酸的能力代表了两个单独的障碍。在确定上面讨论的无有机溶剂/无去污剂脂基tcv有效地包封核酸后,在两种情况下测试了它们沉默基因的能力及其对细胞活力的影响,如图1a-1d所示。首先,使用台式装载将无有机溶剂、无去污剂的空tcv与siluc混合,并用于处理hek-luc细胞。令人惊讶的是,基于dodma的tcv显示了约50%的敲低,比dlindap和dodap表现更好,后两者未显示出敲低的迹象(图1a)。与未经处理的细胞相比,所有制剂均未显示由细胞活力测量的毒性(图1b)。其次,针对原代小鼠皮质神经元中的hdh基因测试了tcv递送sirna的功效和毒性。dodma-tcv再次(图1c)显示了约50%的基因敲低功效,而dlindaptcv显示了更低的敲低,dodap-tcv则与未处理细胞无差异。应该注意,原代神经元非常容易受到有害转染试剂(例如目前商购可得的那些试剂)的毒性影响。图13凸显了对活力影响的差异。
实施例3:多种混合方法可产生有效的无有机溶剂、无去污剂的空tcv
为了确定制备方法中混合方面的作用以及要达到图1所示效力的所得粒径,通过t-接合混合和挤出两种方法制备了含有可电离脂质(例如dodma)的无有机溶剂、无去污剂的脂基空tcv。如图2a所示,在将sirna台式装载到空tcv中后,使用这两种方法在hek-luc细胞中均显著敲低萤光素酶。通过t-接合或挤出产生的颗粒所处理的细胞在活力方面没有显著差异(图2b)。接下来,用相同的无溶剂、无去污剂的脂基tcv制剂处理原代皮质神经元,并确定了这两种方法所产生的颗粒具有相似的效力(图2c)和相似的细胞活力(图2d)。相反,原代培养物中的现有转染方法的毒性(图13)偏离了无毒但有效的制剂的目标。
实施例4:含有减少量的可电离脂质的无有机溶剂、无去污剂的空tcv促进了毒性降低的有效sirna递送
目前用于临床制剂(参见patisiran)的已建立的脂质组合物包括大量可电离的阳离子脂质(50mol%)(jayaraman,ansell等人,2012;suhr,coelho等人,2015)。尽管如此高的量能够改善达到体内50%基因沉默的有效剂量(ed50)(jayaraman,ansell等人,2012),但施用后脂质代谢物的持续存在(maier,jayaraman等人,2013;sabnis,kumarasinghe等人,2018)和与这些分子相关的毒性使得制剂在高剂量方案和重复施用中(或对敏感细胞类型)具有毒性。当前的组合物、tcv等可由可生物降解或促进消除的材料组成。因此,当前的组合物、tcv等降低了维持转染效力的毒性成分的量。
测试了由dodma/dope/dspc/chol/peg-脂质(分别为20/30/10/39/1mol%)组成的制剂在hek-luc细胞中沉默萤光素酶的转染能力。观察到40%的萤光素酶表达敲低(图3a),而没有显著毒性(图3b)。接下来,我们测试了与含50mol%可电离脂质的dodma-tcv相比,含20mol%可电离脂质的tcv将sirna递送至原代神经元的能力。所有制剂均显示~60%的hdh敲低(图3c),而通过t-接合混合所产生的dodma制剂显示了显著改善的细胞活力(图3c)。
实施例5:掺入dope不会改变无有机溶剂、无去污剂的空tcv形态
改善核酸递送载体中hii相形成的潜力可能是促进内体中膜融合的重要因素(hafez,maurer等人,2001)。在本方法中,能够采用hii相的两种示例性脂质是dope(单独)和dodma(当质子化并与阴离子脂质结合时)。为了确定在无有机溶剂、无去污剂的tcv中掺入dope是否会导致过早形成hii相,对20mol%的dodma-tcv和由50mol%的dodma组成的相同制剂进行了cryo-tem。所得结构(图4a、4b)可视化为双层结构,没有hii相的迹象。
其他人先前的工作表明,无论sirna含量如何,核心lnp制剂中都存在hii-样的内部结构(leung,hafez等人,2012;leung,tam等人,2015)。虽已证明lnp-sirna不包含此类结构,而是将sirna固定在紧密排列的脂质层之间(kulkarni,darjuan等人,2018),从而使整个颗粒呈现多层状或洋葱状形态。在不存在sirna的情况下,lnp制剂采取了含有油相脂质的电子致密核。因此,本文的实施例证明tcv形态与lnp系统显著不同,但仍具有高效转染效力。
实施例6:无有机溶剂、无去污剂的空tcv可用于递送功能性核糖核蛋白(rnp)。
如图5所示,本文还测试了无有机溶剂、无去污剂的空tcv将与核酸复合的蛋白质型所选货物递送到哺乳动物细胞中的能力。简言之,组装由重组cas9蛋白和靶向颗粒蛋白前体基因第5外显子的指导rna组成的核糖核蛋白复合物,并以467:1的摩尔比(tcv:rnp复合物)与通过台式装载(dodma/dope/dspc/chol/(分别为20/30/10/40mol%)的空tcv组合。另外,将设计用于在颗粒蛋白前体基因的第5外显子中引入4bp缺失的单链寡核苷酸以4275:1的摩尔比(tcv:核酸)与tcv混合。将含有各自所选货物的两种tcv制剂合并以达到10nmrnp和10nmssodn的终浓度,然后将其添加到hek细胞中。48小时后,使用野生型或突变型等位基因特异性正向引物,采用pcr来确定颗粒蛋白前体基因靶点是否发生了同源介导的修复。如图5所示,暴露于含有核糖核蛋白复合物和ssodn每一种的tcv组合的细胞导致了经由同源介导的修复插入4bp缺失(图5的第二泳道,标记为突变体),而未经处理的对照细胞在颗粒蛋白前体基因的第5外显子处未导致任何遗传改变(图5的第三和第四泳道)。
实施例7:用于递送功能性核糖核蛋白(rnp)的无有机溶剂、无去污剂的空tcv的更多示例。
使用如上所讨论的方法,使用无有机溶剂、无去污剂的空tcv来递送功能性核糖核蛋白(rnp)。
图6提供了位于原代神经元内的cas9的显微照片。如本文所讨论的,通过无有机溶剂、无去污剂的tcv递送的rnp可在原代神经元内作为荧光信号被观察到;未经处理的对照组没有这样的荧光信号。更具体地说,原代神经元细胞的免疫细胞化学显示了cas9蛋白(红色)在源自小鼠的皮质神经元的细胞核(蓝色)内定位。细胞也被鬼笔环肽染色(绿色)以显示细胞形态。
图7提供了经由无有机溶剂、无去污剂的tcv递送的rnp在hek细胞中显示基因敲低的图。与对照(图中的“对照”)相比,经由无有机溶剂、无去污剂的tcv递送到hek细胞中的rnp显示了萤光素酶转录物的显著敲低。图8提供了经由无有机溶剂、无去污剂的tcv递送的rnp在hek细胞中显示蛋白质敲低的图。与对照(图中的“对照”)相比,经由无有机溶剂、无去污剂的tcv递送到hek细胞中的rnp显示了萤光素酶蛋白的显著敲低,p=0.0003。
图9提供了经由无有机溶剂、无去污剂的tcv递送的rnp在原代神经元中显示基因敲低的图。通过定量实时pcr(qrt-pcr)测定,经由无有机溶剂、无去污剂的tcv递送到原代皮质神经元中的rnp显示了显著的mrna敲低,p=0.0039。
转向对这些图的一些进一步讨论,图7和图8显示,经由台式装载本文的空tcv所递送的rnp显示了在hek细胞中的报告基因萤光素酶的强力敲低。这通过测量萤光素酶产量(功能蛋白)以及经由qrt-pcr测量的萤光素酶mrna的mrna水平得到证实。同样的rnp递送方法也被用于破坏源自fvb.yac128小鼠的皮质神经元中亨廷顿基因的表达(图9),所述小鼠表达携带疾病突变的全长人类亨廷顿基因。在用tcv:rnp混合物温育72小时后,使用qrt-pcr定量原代皮质神经元中亨廷顿基因的mrna水平。
实施例8:经由无有机溶剂、无去污剂的tcv递送mrna的示例
使用如上所讨论的方法,台式装载无有机溶剂、无去污剂的空tcv用于递送mrna。
图10提供了显示经由无有机溶剂、无去污剂的tcv递送的mrna在hek细胞中的表达的图。经由无有机溶剂、无去污剂的tcv(dodma/dope/dspc/chol(20/30/10/40))将mrna以不同比例递送到hek细胞中,低=0.029mgmrna/微摩尔脂质,中=0.058mgmrna/微摩尔脂质,高=0.116mgmrna/微摩尔脂质。与对照相比,所有比例均显示出显著表达,最低比例显示出最高表达。
图11提供了显示经由台式装载无有机溶剂、无去污剂的空tcv而递送的mrna在原代皮质神经元中的表达的图。经由无有机溶剂、无去污剂的tcv(dodma/dope/dspc/chol(20/30/10/40))以不同剂量将mrna递送到原代皮质神经元中。与对照相比,所有剂量均显示出显著表达。
转向对这些图的一些进一步讨论,图10证明了台式装载如本文所讨论的无有机溶剂、无去污剂的空tcv可用于将编码功能蛋白的mrna递送到细胞中。简而言之,使用移液管将编码萤火虫萤光素酶mrna的mrna与无有机溶剂、无去污剂的tcv在0.029-0.116mg核酸:1微摩尔脂质比例的范围内轻轻混合。在添加完全培养基之前,将该混合物在室温下温育5-20分钟,然后转移到含有hek细胞(参见图10)或原代皮质神经元(图11)的孔中。按照制造商的说明,使用promega的one-glo萤光素酶测定试剂盒测量萤光素酶产量。结果表明,在一系列所选货物:tcv浓度和剂量下,在这些细胞类型中均有萤光素酶蛋白的产生。
实施例9:无有机溶剂、无去污剂的tcv与市售产品的比较
使用如上所讨论的方法,台式装载无有机溶剂、无去污剂的空tcv用于将sirna或rnp递送到hek细胞或原代神经元中,然后与使用商购可得的系统的等同转染进行比较。本文所述的无有机溶剂、无去污剂的tcv优于商购可得的系统。
图12提供了显示无有机溶剂、无去污剂的tcv在hek细胞中的细胞活力的图。经由无有机溶剂、无去污剂的tcv(dodma/dope/dspc/chol(20/30/10/40))或使用rnaimax(图中的“rmax”;thermofisherscientific)将rnp递送到hek细胞中进行细胞毒性评估。与rnaimax相比,无有机溶剂、无去污剂的tcv毒性显著降低,p=0.0002。
图13提供了显示台式装载sirna至无有机溶剂、无去污剂的空tcv中的在原代神经元中的细胞活力的显微照片。经由无有机溶剂、无去污剂的tcv(dodma/dope/dspc/chol/peg-脂质(20/30/10/39/1))或使用商购可得的mirustko系统(mirusbio)将sirna递送到原代神经元中用于细胞毒性评估。如显微照片所示,与mirustko系统相比,无有机溶剂、无去污剂的tcv毒性显著降低。
图14提供了显示无有机溶剂、无去污剂的tcv在hek细胞中的敲低的图。经由以50%(“d-50%”,通过t-接合混合制备)、50%(“d-50%ex”,通过挤出制备)dodma水平的无有机溶剂、无去污剂的tcv和经由商购可得的mirustko系统(mirusbio)递送sirna。当前的50%dodma制剂显示出约50%的敲低,而mirustko系统表现显著更差。
转向对这些图的一些进一步讨论,图12表明将sirna台式装载到如本文所讨论的无有机溶剂、无去污剂的空tcv中,在源自小鼠的原代神经元细胞和hek细胞系中均具有低毒特性和有效的表达敲低。为处理原代皮质神经元,将tcv与sirna以约0.022-0.058mg核酸:1微摩尔脂质的比例混合,并转移到含有原代神经元细胞的孔中。图13中的光学显微照片均以相同的放大倍数拍摄,其显示在对照和经tcv处理的孔中,细胞保持健康、突起完整且死细胞数量非常少。在mirustransit-tko处理的孔中,细胞看起来相当不健康、细胞突起破裂且小的、凝聚的(死的)细胞数量增加。
对于图12,用lipofectaminernaimax和含有rnp所选货物的tcv处理hek细胞。用终浓度为5-50nm的rnp和tcv或rnaimax试剂处理hek细胞。使用promegaone-glo+tox试剂盒评估细胞活力,并与未经处理的对照细胞进行比较。与对照和经tcv处理的孔两者相比,用rnaimax处理的hek培养物显示出总体健康显著下降。
图14表明与商购可得的产品miruslt-tko相比,本文所讨论的无有机溶剂、无去污剂的空tcv的台式装载在递送sirna所选货物中的有效性。将tcv与靶向萤光素酶基因的sirna以约0.022-0.058mg核酸:1微摩尔脂质的比例在室温下温育5-10分钟。按照制造商的说明用miruslt-tko处理hek细胞。在处理时,将孔内的培养基全部替换为含有sirna:tcv或sirna:miruslt-tko混合物的新鲜生长培养基。处理72小时后,使用promegaone-glo+tox试剂盒测定hek细胞的细胞活力和萤光素酶产量,并将所有细胞与未经处理的对照孔进行比较。
参考文献
akinc,a.,a.zumbuehl等人,(2008)."acombinatoriallibraryoflipid-likematerialsfordeliveryofrnaitherapeutics."natbiotechnol26(5):561-569.
basha,g.,m.ordobadi等人,(2016)."lipidnanoparticledeliveryofsirnatoosteocytesleadstoeffectivesilencingofsostandinhibitionofsclerostininvivo."molthernucleicacids5(9):e363.
belliveau,n.m.,j.huft等人,(2012)."microfluidicsynthesisofhighlypotentlimit-sizelipidnanoparticlesforinvivodeliveryofsirna."molthernucleicacids1:e37.
chen,s.,y.y.tam等人,(2014)."developmentoflipidnanoparticleformulationsofsirnaforhepatocytegenesilencingfollowingsubcutaneousadministration."jcontrolrelease196:106-112.
chen,s.,y.y.tam等人,(2016)."influenceofparticlesizeontheinvivopotencyoflipidnanoparticleformulationsofsirna."jcontrolrelease.
desouza,r.a.,s.a.islam等人,(2016)."dnamethylationprofilinginhumanhuntington'sdiseasebrain."hummolgenet25(10):2013-2030.
digiacomo,l.,s.palchetti等人,(2018)."cationiclipid/dnacomplexesmanufacturedbymicrofluidicsandbulkself-assemblyexhibitdifferenttransfectionbehavior."biochembiophysrescommun503(2):508-512.
hafez,i.m.,n.maurer等人,(2001)."onthemechanismwherebycationiclipidspromoteintracellulardeliveryofpolynucleicacids."genether8(15):1188-1196.
jayaraman,m.,s.m.ansell等人,(2012)."maximizingthepotencyofsirnalipidnanoparticlesforhepaticgenesilencinginvivo."angewchemintedengl51(34):8529-8533.
jeffs,l.b.,l.r.palmer等人,(2005)."ascalable,extrusion-freemethodforefficientliposomalencapsulationofplasmiddna."pharmres22(3):362-372.
kulkarni,j.a.,m.m.darjuan等人,(2018)."ontheformationandmorphologyoflipidnanoparticlescontainingionizablecationiclipidsandsirna."acsnano12(5):4787-4795.
kulkarni,j.a.,y.y.c.tam等人,(2017)."rapidsynthesisoflipidnanoparticlescontaininghydrophobicinorganicnanoparticles."nanoscale.
leung,a.k.,i.m.hafez等人,(2012)."lipidnanoparticlescontainingsirnasynthesizedbymicrofluidicmixingexhibitanelectron-densenanostructuredcore."jphyschemcnanomaterinterfaces116(34):18440-18450.
leung,a.k.,y.y.tam等人,(2015)."microfluidicmixing:ageneralmethodforencapsulatingmacromoleculesinlipidnanoparticlesystems."jphyschemb119(28):8698-8706.
lin,p.j.,y.y.tam等人,(2013)."influenceofcationiclipidcompositiononuptakeandintracellularprocessingoflipidnanoparticleformulationsofsirna."nanomedicine9(2):233-246.
maier,m.a.,m.jayaraman等人,(2013)."biodegradablelipidsenablingrapidlyeliminatedlipidnanoparticlesforsystemicdeliveryofrnaitherapeutics."molther21(8):1570-1578.
maurer,n.,k.f.wong等人,(2001)."spontaneousentrapmentofpolynucleotidesuponelectrostaticinteractionwithethanol-destabilizedcationicliposomes."biophysj80(5):2310-2326.
palchetti,s.,d.pozzi等人,(2017)."manipulationoflipoplexconcentrationatthecellsurfacebooststransfectionefficiencyinhard-to-transfectcells."nanomedicine13(2):681-691.
pardi,n.,s.tuyishime等人,(2015)."expressionkineticsofnucleoside-modifiedmrnadeliveredinlipidnanoparticlestomicebyvariousroutes."jcontrolrelease217:345-351.
pozzi,d.,c.marchini等人,(2012)."transfectionefficiencyboostofcholesterol-containinglipoplexes."biochimbiophysacta9(43):22.
rungta,r.l.,h.b.choi等人,(2013)."lipidnanoparticledeliveryofsirnatosilenceneuronalgeneexpressioninthebrain."molthernucleicacids3(2):65.
sabnis,s.,e.s.kumarasinghe等人,(2018)."anovelaminolipidseriesformrnadelivery:improvedendosomalescapeandsustainedpharmacologyandsafetyinnon-humanprimates."molther26(6):1509-1519.
scherphof,g.和h.morselt(1984)."onthesize-dependentdisintegrationofsmallunilamellarphosphatidylcholinevesiclesinratplasma.evidenceofcompletelossofvesiclestructure."biochemj221(2):423-429.
semple,s.c.,a.akinc等人,(2010)."rationaldesignofcationiclipidsforsirnadelivery."natbiotechnol28(2):172-176.
semple,s.c.,s.k.klimuk等人,(2001)."efficientencapsulationofantisenseoligonucleotidesinlipidvesiclesusingionizableaminolipids:formationofnovelsmallmultilamellarvesiclestructures."biochimicaetbiophysicaacta(bba)-biomembranes1510(1):152-166.
suhr,o.b.,t.coelho等人,(2015)."efficacyandsafetyofpatisiranforfamilialamyloidoticpolyneuropathy:aphaseiimulti-dosestudy."orphanetjournalofrarediseases10(1):109.
tam,p.,m.monck等人,(2000)."stabilizedplasmid-lipidparticlesforsystemicgenetherapy."genetherapy7:1867.
wang,y.,l.miao等人,(2015)."deliveryofoligonucleotideswithlipidnanoparticles."advdrugdelivrev87:68-80.
wheeler,j.j.,l.palmer等人,(1999)."stabilizedplasmid-lipidparticles:constructionandcharacterization."genether6(2):271-281.
zhigaltsev,i.v.,n.belliveau等人,(2012)."bottom-updesignandsynthesisoflimitsizelipidnanoparticlesystemswithaqueousandtriglyceridecoresusingmillisecondmicrofluidicmixing."langmuir28(7):3633-3640.
zhigaltsev,i.v.,y.k.tam等人,(2016)."productionoflimitsizenanoliposomalsystemswithpotentialutilityasultra-smalldrugdeliveryagents."jliposomeres26(2):96-102.
除非上下文或定义另有清楚指示,否则本文中使用的所有术语均按照其一般含义使用。此外,除非另有明确说明,本说明书中“或”的使用包括“和”,反之亦然。非限制性术语不应解释为限制性术语,除非另有明确说明或者上下文清楚指示(例如“包括”、“具有”和“包含”通常都表示“包括但不限于”)。权利要求书中所包括的单数形式(例如,“a”、“an”和“the”)均包括复数指代,除非另有明确说明或者上下文另有清楚指示。
除非另有说明,否则本文用于修饰实施方案一个或多个特征的条件或关系特征的形容词(例如“基本上”和“约”)都表示该条件或特征被限定在对执行所预期应用的实施方案而言可接受的容许范围内。
本发明的装置、系统和方法等的范围包括手段加功能和步骤加功能概念两者。然而,除非在权利要求中具体列举“手段”一词,否则权利要求不得被解释为表示“手段加功能”关系,而在权利要求中具体列举“手段”一词的情况下要将权利要求解释为表示“手段加功能”关系。类似地,除非在权利要求中具体列举“步骤”一词,否则权利要求不得被解释为表示“步骤加功能”关系,而在权利要求中具体列举“步骤”一词的情况下要将权利要求解释为表示“步骤加功能”关系。
综上所述,应当理解的是,尽管为了说明的目的,本文已讨论了具体实施方案,但是可以在不偏离本文讨论的精神和范围的情况下进行各种修改。因此,系统和方法等包括本文所述的主题的修改以及所有排列和组合,且不限于所附权利要求或者在本文的讨论和附图中具有充分支持的其他权利要求。
- 还没有人留言评论。精彩留言会获得点赞!