用于治疗HBV的环状磺酰胺化合物的制作方法
相关申请
本申请要求于2018年9月5日提交的美国临时申请号62/727,278的优先权和利益,其全部内容通过引用并入本文。
背景技术:
乙型肝炎(hbv)引起病毒性肝炎,其可进一步导致慢性肝病并增加肝硬化和肝癌(肝细胞癌)的风险。在全世界范围内,大约20亿人已感染了hbv,约3.6亿人是慢性感染的,且每年hbv感染导致超过50万人的死亡。hbv可通过体液传播:母婴传播、性传播和通过血液制品传播。hbv阳性母亲所生的孩子也可能被感染,除非在出生时注射疫苗。
所述肝炎病毒颗粒由布满表面蛋白(hbsag)的脂质包裹物组成,所述表面蛋白围绕该病毒核心。所述核心由120个核心蛋白(cp)二聚体构成的蛋白质外壳或衣壳所组成,所述核心本身含有该松环dna(rcdna)病毒基因组以及病毒和宿主蛋白。在被感染的细胞中,所述基因组被发现为宿主细胞核中的共价闭环dna(cccdna)。所述cccdna是病毒rna的模板并因此是病毒蛋白的模板。在细胞质中,cp聚集在全长病毒rna的复合物(所谓的前基因组rna或pgrna)和病毒聚合酶(p)周围。组装后,p在该衣壳范围内将所述pgrna反向转录成rcdna,从而生成dna-填充的病毒核心。
目前,慢性hbv主要用核苷酸类似物(例如恩替卡韦)治疗,当患者保持治疗时,所述类似物抑制病毒,但无法消除感染,即使是经过许多年的治疗。一旦患者开始服用核苷酸类似物,大多数患者必须持续服用或面临病毒复发引起的致命性免疫响应的可能性的危险。此外,核苷酸疗法可能导致抗病毒药物耐受的出现。
fda唯一批准的替代核苷酸类似物的是用干扰素α或聚乙二醇干扰素α的治疗。不幸的是,干扰素α的不良事件发生率和概况可能会导致耐受性差,且许多患者不能完成治疗。此外,仅有一小部分的患者被认为适合干扰素疗法,因为仅有一小部分患者可能对干扰素疗法的疗程具有持续的临床响应。因此,基于干扰素的疗法仅用于所有选出进行治疗的确诊患者中的一小部分。
因此,目前hbv治疗的范围从姑息疗法到观察等待(watchfulwaiting)。核苷酸类似物抑制病毒产生、治疗症状、但保留完整的感染。干扰素α具有严重的副作用且在患者中耐受性差,并且由于有限的治疗策略仅在一小部分的患者中成功。明确持续地需要针对hbv感染的更有效的治疗。
技术实现要素:
本发明部分提供环状磺酰胺化合物及其药物组合物,其可用于破坏hbv核心蛋白组装,以及治疗hbv感染的方法。
在一方面,本发明提供式i化合物或其药学上可接受的盐:
其中变量描述于发明详述。
在另一方面,本发明提供药物组合物,其包含式i的化合物或其药学上可接受的盐,以及药学上可接受的赋形剂。
在另一方面,本发明提供在有此需要的受试者中治疗hbv感染的方法,包括:向该受试者给药治疗有效量的式i化合物,或其药学上可接受的盐。
在另一方面,本发明提供在有此需要的受试者中治疗hbv感染的方法,包括:向该受试者给药包含治疗有效量的式i化合物或其药学上可接受的盐,以及药学上可接受的赋形剂的药物组合物。
附图说明
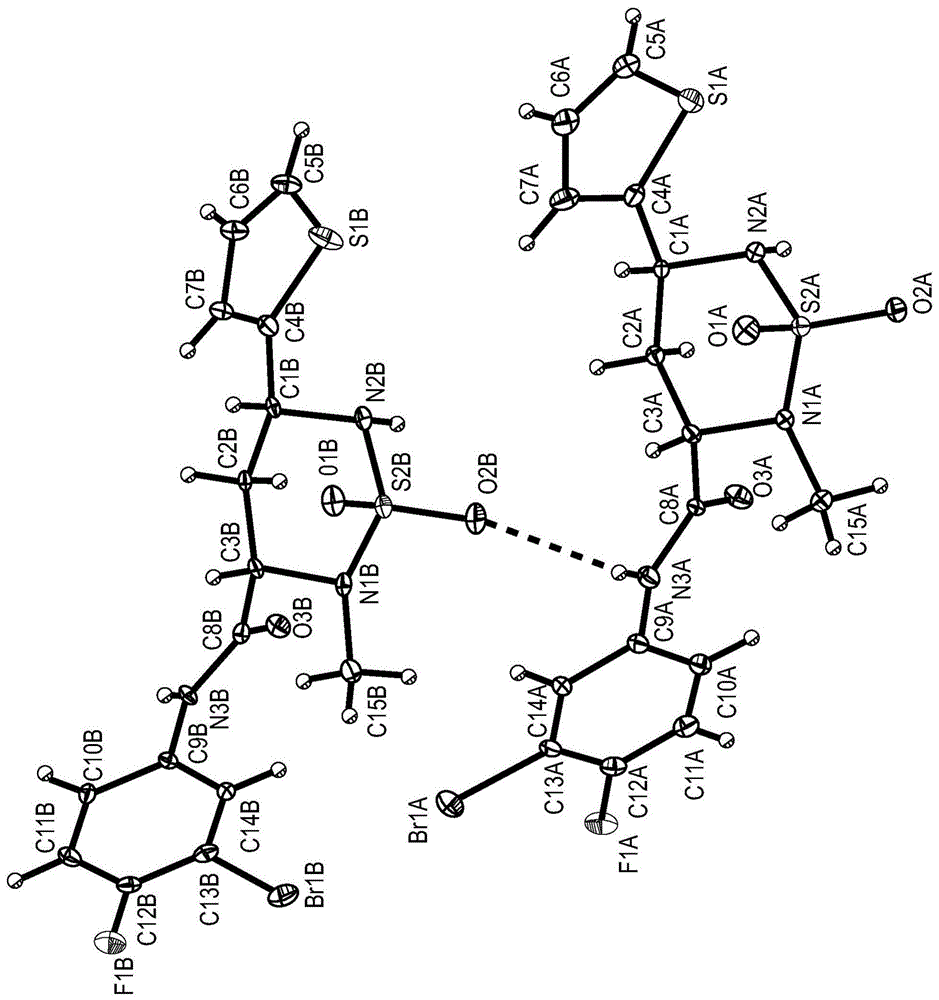
图1是如本文所述的hbv-csu-016-异构体-i的晶体结构。
发明详述
本发明的特征和其他细节现将更加具体地描述。在本发明进一步描述之前,说明书、实施例和所附权利要求中所用的具体术语汇总在此处。这些定义应在本公开其余部分和本领域技术人员所理解的基础上进行阅读。除非另有定义,否则本文中使用的所有技术和科学术语具有与本领域普通技术人员通常理解的相同含义。
定义
本文所用的术语“烯基”是指具有至少一个碳-碳双键的不饱和直链或支链烃。示例性的烯基包括但不限于具有2-6个碳原子的直链或支链基团,其在本文中称为c2-6烯基。示例性烯基包括但不限于乙烯基、烯丙基、丁烯基、戊烯基等。
本文所用的术语“烷氧基”是指连接至氧的直链或支链烷基(即烷基-o-)。示例性烷氧基包括但不限于具有1-6或1-4个碳原子的烷氧基,其在本文中分别称为c1-6烷氧基和c1-4烷氧基。示例性烷氧基包括但不限于甲氧基、乙氧基、异丙氧基等。
本文所用的术语“烷氧基烷基”是指被烷氧基取代的烷基(即烷氧基-烷基-或烷基-o-烷基-)。实例包括但不限于ch3ch2och2-、ch3och2ch2-和ch3och2-。
本文所用的术语“烷基”是指饱和直链或支链烃。示例性烷基包括但不限于具有1-6或1-4个碳原子的直链或支链烃,其在本文中分别称为c1-6烷基和c1-4烷基。示例性烷基包括但不限于甲基、乙基、正丙基、异丙基、2-甲基-1-丁基、3-甲基-2-丁基、2-甲基-1-戊基、3-甲基-1-戊基、4-甲基-1-戊基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、2,2-二甲基-1-丁基、3,3-二甲基-1-丁基、2-乙基-1-丁基、正丁基、异丁基、叔丁基、正戊基、异戊基、新戊基、正己基等。
本文所用的术语“炔基”是指具有至少一个碳-碳三键的不饱和直链或支链烃。示例性炔基包括但不限于具有2-6个碳原子的直链或支链基团,其在本文中称为c2-6炔基。示例性炔基包括但不限于乙炔基、丙炔基、丁炔基、戊炔基、己炔基、甲基丙炔基等。
本文所用的术语“羰基”是指双自由基-c(o)-。
本文所用的术语“氰基”是指基团-cn。
本文所用的术语“环烷基”是指具有例如3-6个碳的饱和单环烃基(在本文中称为c3-6环烷基)或具有例如8-12个碳的双环烃环结构(在本文中称为c8-12环烷基)。对于双环环烷基,两个环可通过相同或不同的碳连接。示例性单环环烷基包括但不限于环己基、环戊基、环戊烯基、环丁基和环丙基。示例性双环环烷基包括但不限于螺[2.5]辛烷基、螺[3.5]壬烷基、双环[2.2.2]辛烷基、双环[4.1.0]庚烷基、八氢并环戊二烯基(octahydropentalenyl)、双环[4.2.0]辛烷基、双环[1.1.1]戊烷基、双环[2.2.1]庚烷基和双环[2.2.2]辛烷基。
本文所用的术语“环烯基”是指具有例如3-7个碳的部分不饱和的单环烃基(在本文中称为c4-7环烯基)或具有例如8-12个碳的双环烃环结构(在本文中称为双环c8-12环烯基)。对于双环环烯基:1)一个或两个环可含有一个或多个双键,且2)两个环可通过相同或不同的环碳连接。示例性单环环烯基包括但不限于环丙烯基、环丁烯基、环戊烯基、环己烯基和环庚烯基。示例性双环环烯基包括但不限于螺[2.5]辛-5-烯基、螺[2.5]辛-4-烯基、螺[3.5]壬-5-烯基、螺[3.5]壬-6-烯基、双环[4.1.0]庚-3-烯基、双环[4.1.0]庚-2-烯基和双环[2.2.2]辛-2-烯基。
本文所用的术语“碳环基”是指通过将苯环稠合至c3-6环烷基、c4-7环烯基、4-7元单环杂环烷基或4-7元单环杂环烯基环所形成的双环系统。在可能的情况下,这些环可以通过碳或氮连接至相邻的基团。杂环基(heterocyclyl)的实例包括但不限于2,3-二氢-1h-茚基、1,2,3,4-四氢化萘、异色满基和1h-茚基和2h-喹啉基。
本文所用的术语“卤代”或“卤素”是指f、cl、br或i。
本文所用的术语“卤代烷基”是指被一个或多个卤素原子取代的烷基。例如,卤代c1-6烷基是指被一个或多个卤素原子取代的具有1-6个碳原子的直链或支链烷基。实例包括但不限于-ch2f、-chcl2、-cf3、-ch2cf3、-cf2ch3、-ccl2cf3和-cf2cf3。
本文所用的术语“卤代烷氧基”是指取代有一个或多个卤素原子的烷氧基。实例包括但不限于ccl3o-、cf3o-、cf3ch2o-和cf3cf2o-。
本文所用的术语“杂芳基”是指含有一个或多个独立选择的杂原子(例如一至四个杂原子,例如氮、氧和硫)的单环芳族5-6元环体系或双环芳族8-12元环体系。如果可能,所述杂芳基环可通过碳或氮连接至相邻基团。5-6元单环杂芳基的实例包括但不限于:呋喃基、噻吩基(thiophenyl,也称为噻吩基)、吡咯基、噻唑基、噁唑基、异噻唑基、异噁唑基、咪唑基、吡唑基、1h-1,2,3-三唑基、2h-1,2,3-三唑基、1,2,4-三唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、1,3,5-三嗪基、1,2,4-三嗪基、1,2,3-三嗪基、1,2,4-噁二唑基、1,3,4-噁二唑基、1,2,5-噁二唑基、1,2,4-噻二唑基、1,3,4-噻二唑基、1,2,5-噻二唑基和四唑基。8-12元双环杂芳基的实例包括但不限于:苯并呋喃基、异苯并呋喃基、苯并[b]噻吩基、苯并[c]噻吩基、吲哚基、异吲哚基、苯并[d]异噁唑基、苯并[c]异噁唑基、苯并[d]噁唑基、苯并[d]异噻唑基、苯并[c]异噻唑基、苯并[d]噻唑基、吲唑基、苯并[d]咪唑基、苯并[d]咪唑基和苯并[d][1,2,3]三唑基。
术语“杂环烷基”是指含有一个或多个独立选择的杂原子(例如氮、氧和硫,包含其氧化状态:s、s(o)和so2)的饱和单环3-7元环系统或双环8-12元环系统。如果可能,“杂环烷基”环可通过碳或氮连接至相邻基团。4-7元单环“杂环烷基”的实例包括但不限于氮杂环丙基、氧杂环丙基、硫杂环丙基1,1-二氧化物、氧杂环丁基、氮杂环丁基、硫杂环丁基1,1-二氧化物、吡咯烷基、四氢呋喃基、哌啶基、四氢-2h-吡喃基、吗啉基、硫吗啉基和哌嗪基。双环8-12元杂环烷基的实例包括但不限于1,4-二氧杂螺[4.5]癸烷基和1,5-二氧杂螺[5.5]十一烷基。
术语“杂环烯基”是指含有一个、两个或三个独立选择的杂原子(例如氮、氧和硫,包含其氧化状态:s、s(o)或s(o)2)的部分不饱和的单环3-7元环系统或双环8-12元环系统。如果可能,杂环烯基环可通过碳或氮连接至相邻基团。对于双环杂环烯基:1)一个或两个环可含有一个或多个双键,且2)两个环可通过相同或不同环原子进行连接。4-7元单环杂环烯基的实例包括但不限于2,3-二氢-1h-吡咯基、2,5-二氢-1h-吡咯基、4,5-二氢-1h-吡唑基、2,3-二氢-1h-吡唑基、4,5-二氢-1h-咪唑基、2,3-二氢-1h-咪唑基、2,3-二氢噻吩基、2,5-二氢噻吩基、4,5-二氢噻唑基、2,3-二氢噻唑基、4,5-二氢异噻唑基、2,3-二氢异噻唑基、2,3-二氢呋喃基、2,5-二氢呋喃基、4,5-二氢噁唑基、2,3-二氢噁唑基、4,5-二氢异噁唑基、2,3-二氢异噁唑基、3,4-二氢吡啶基、2,3-二氢吡啶基、2,3,4,5-四氢吡啶基、1,6-二氢哒嗪基、4,5-二氢哒嗪基、3,4,5,6-四氢哒嗪基、4,5-二氢嘧啶基、1,2,5,6-四氢嘧啶基、1,2-二氢嘧啶基、1,2-二氢吡嗪基、2,3-二氢吡嗪基、1,2,3,6-四氢吡嗪基、4h-1,4-噁嗪基、3,4-二氢-2h-1,4-噁嗪基、4h-1,4-噻嗪基和3,4-二氢-2h-1,4-噻嗪基。8-12元杂环烷基的实例包括但不限于6,7-二氢吲哚基、4,5-二氢吲哚基、7,8-二氢咪唑并[1,2-a]吡啶基、5,6-二氢咪唑并[1,2-a]吡啶基、4,5-二氢苯并[d]咪唑基、6,7-二氢-1h-吲唑基、4,5-二氢-1h-吲唑基、4,5-二氢吡唑并[1,5-a]吡啶基和6,7-二氢吡唑并[1,5-a]吡啶基。
本文所用的术语“杂环基”是指通过将单环芳族5-6元杂芳基环稠合至c3-6环烷基、c4-7环烯基、4-7元单环杂环烷基或4-7元单环杂环烯基环形成的双环系统。如果可能,该环可通过碳或氮连接至相邻基团。杂环基的实例包括但不限于6,7,8,9-四氢-5h-[1,2,4]三唑并[4,3-a]氮杂
本文所用的术语“羟基(hydroxy和hydroxyl)是指基团-oh。
本文所用的术语“羟基烷基”是指取代有一个或多个羟基的烷基。实例包括但不限于hoch2-、hoch2ch2-、ch3ch(oh)ch2-和hoch2ch(oh)ch2-。
本文所用的术语“羟基烷氧基”是指取代有一个或多个羟基的烷氧基。实例包括但不限于hoch2o-、hoch2ch2o-、ch3ch(oh)ch2o-和hoch2ch(oh)ch2o-。
本文所用的术语“rarbn-c1-6烷基-”是指被如本文所定义的rarbn-基团取代的烷基。实例包括但不限于nh2ch2-、nh(ch3)ch2-、n(ch3)2ch2ch2-和ch3ch(nh2)ch2-。
本文所用的术语“rarbn-c1-6烷氧基”是指被如本文所定义的一个或多个rarbn-基团取代的烷氧基。实例包括但不限于nh2ch2-、nh(ch3)ch2o-、n(ch3)2ch2ch2o-和ch3ch(nh2)ch2o-。
本文所用的术语“氧代基”是指基团=o。
如本文中所使用,在使用浮动连接点和/或浮动取代基展示双环时(例如如在
术语“个体”、“患者”或“受试者”可互换使用,并包括任何动物,包括哺乳动物,优选小鼠、大鼠、其他啮齿动物、兔子、狗、猫、猪、牛、羊、马或灵长类,且最优选是人类。本公开的化合物或药物组合物可以给药于哺乳动物,例如人,但是也可以给药于其他需要兽医治疗的哺乳动物,例如家畜(例如狗、猫等),农场动物(例如牛、绵羊、猪、马等)和实验动物(例如大鼠、小鼠、豚鼠等)。在本公开的方法中治疗的哺乳动物理想地是其中需要治疗hbv感染的哺乳动物。
术语“调节”包括拮抗作用(例如抑制)、激动作用、部分拮抗作用和/或部分激动作用。
术语“药学上可接受的”包括视需要在给药于动物或人类时不产生不良、过敏或其他不利反应的分子实体和组合物。对于人类给药,制剂应满足如由fda生物制剂标准办公室(fdaofficeofbiologicsstandards)所要求的无菌性、热原性和一般安全性与纯度标准。
本文所用的术语“药学上可接受的载体”或“药学上可接受的赋形剂”是指与药物给药相容的任何和所有溶剂、分散介质、包衣、等渗和吸收延迟剂等。此类用于药物活性物质的介质和试剂的用途是本领域众所周知的。用于医药活性物质之该等介质和试剂之使用在业内已众所周知。该组合物也可含有其他活性化合物以提供补充、附加或增强的治疗功能。
本文所用的术语“药物组合物”是指包含至少一种本文所公开的化合物与一种或多种药学上可接受的赋形剂一起配制的组合物。
本文所用的术语“药学上可接受的盐”是指可存在于组合物中所用化合物中的酸性或碱性基团的盐。本发明组合物中所包含的天然碱性化合物能够与众多种无机和有机酸形成各种盐。可用于制备该碱性化合物的药学上可接受的酸加成盐的酸是形成无毒酸加成盐(即含有药理学上可接受的阴离子的盐)的那些,该无毒酸加成盐包括但不限于苹果酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐、乙酸盐、乳酸盐、水杨酸盐、柠檬酸盐、酒石酸盐、油酸盐、单宁酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡萄糖酸盐、葡糖醛酸盐、蔗糖酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐和双羟萘酸盐(即,1,1'-亚甲基-双-(2-羟基-3-萘甲酸盐))。本质上为酸性的包含在本发明组合物中的化合物能够与各种药理学上可接受的阳离子形成碱式盐。这种盐的实例包括碱金属或碱土金属盐,特别是钙、镁、钠、锂、锌、钾和铁盐。本发明组合物中包括的包含碱性或酸性部分的化合物也可以与各种氨基酸形成药学上可接受的盐。本公开的化合物可以同时包含酸性和碱性基团;例如,一个氨基和一个羧酸基。在这种情况下,该化合物可以以酸加成盐、两性离子或碱式盐存在。
本文所用的术语“治疗有效量”或“有效量”是指将使组织、系统或动物(例如哺乳动物或人类)引发研究者、兽医、医师或其他临床医师正寻求的生物或医学反应的目标化合物的量。以治疗有效量施用本发明的化合物或药物组合物以治疗疾病。或者,化合物的治疗有效量是达成期望治疗和/或防治效果所需的量。
术语“治疗”包含通过破坏hbv核心蛋白组装而产生的任何影响,例如减轻、减少、调节或消除,从而导致疾病的改善。“破坏”包括抑制hbv病毒组装和感染。
本公开化合物可含有一个或多个手性中心,且因此以立体异构体存在。当术语“立体异构体”在本文中使用时,其由所有的对映异构体或非对映异构体组成。这些化合物可用符号“(+)”、“(-)”、“r”或“s”指定,其取决于立体碳原子周围的取代基的构型,但是本领域技术人员将理解,结构可隐含地表示手性中心。本发明包括这些化合物及其混合物的各种立体异构体。对映异构体或非对映异构体的混合物在命名法中可指定为“(±)”,但是本领域技术人员将理解结构可隐含地表示手性中心。
本公开化合物可含有一个或多个双键,并因此由于碳-碳双键周围的取代基的排列而以几何异构体存在。符号
本公开的化合物可含有碳环或杂环,并因此由于该环周围的取代基的排列而以几何异构体存在。碳环或杂环周围取代基的排列被指定为“z”或“e”构型,其中术语“z”和“e”按照iupac标准使用。除非另有说明,否则描绘碳环或杂环的结构包括“z”和“e”异构体。碳环或杂环周围的取代基也可被称为“顺式”或“反式”,其中术语“顺式”表示取代基在该环平面的同一侧而术语“反式”表示取代基在该环平面的相对侧。其中取代基既在该环平面同一侧也在该环平面相对侧排列的化合物的混合物被指定为“顺式/反式”。
本发明化合物的单一对映异构体和非对映异构体可由含有不对称或手性中心的市售可得的起始原料进行合成性制备或通过制备外消旋混合物然后用本领域技术人员熟知的拆分方法进行制备。这些拆分方法通过以下举例说明:(1)对映异构体混合物与手性助剂的连接、通过重结晶或色谱法对所得非对映异构体混合物的分离以及光学纯的产物从助剂中的释放,(2)采用光学活性拆分剂的盐形成,(3)光学对映异构体混合物在手性液相色谱柱上的直接分离,或(4)使用立体选择性的化学或酶试剂的动力学拆分。外消旋混合物还可通过公知方法(例如手性液相色谱法或将所述化合物在手性溶剂中结晶)被拆分成它们的组分对映异构体。立体选择性合成、其中单一反应物在形成新的立体中心的过程中或在预先存在的一个立体异构体的转化过程中形成立体异构体的不等混合物的化学或酶反应,是本领域熟知的。立体选择性合成既包括对映选择性转换也包括非对映选择性转换,且可能涉及手性助剂的使用。例如,参见carreira和kvaerno,classicsinstereoselectivesynthesis,wiley-vch:weinheim,2009。
本文公开的化合物可以含药学上可接受的溶剂(例如水、乙醇等)的溶剂合物以及非溶剂合物形式存在,且预期本发明包括溶剂合物和非溶剂合物形式。在一个实施方案中,所述化合物是无定形的。在一个实施方案中,所述化合物是单一多晶型物。在另一实施方案中,所述化合物是多晶型物的混合物。在另一实施方案中,所述化合物为结晶形式。
本发明还包括同位素标记的本发明化合物,其与本文所提及的那些是相同的,除了一个或多个原子被具有与自然界中常见的原子质量或质量数不同的原子质量或质量数的原子所替代。可掺入本发明化合物的同位素的实例包括氢、碳、氮、氧、磷、硫、氟和氯的同位素,分别例如2h、3h、13c、14c、15n、18o、17o、31p、32p、35s、18f和36cl。例如,本发明化合物可具有一个或多个被氘替代的h原子。
一些同位素标记的公开化合物(例如,用3h和14c标记的那些)被用于化合物和/或底物组织分布测定。氚化的(即,3h)和碳-14(即,14c)同位素由于它们易于制备和检测,因此是特别优选的。此外,用较重的同位素例如氘(即,2h)取代可由于较大的代谢稳定性(例如,增加的体内半衰期或降低的剂量需求)而提供一些治疗益处并因此在一些情况下可能是优选的。同位素标记的本发明化合物通常可通过以下与本文实施例所公开的那些类似的步骤进行制备,其用同位素标记的试剂取代非同位素标记的试剂。
术语“前药”是指在体内转化以产生公开的化合物或该化合物的药学上可接受的盐、水合物或溶剂合物的化合物。转化可以通过各种机制(例如通过酯酶、酰胺酶、磷酸酶、氧化和/或还原代谢)在各种位置(例如在肠腔中或在肠道、血液或肝脏通过时)发生。前药在本领域中是众所周知的(例如,参见rautio,kumpulainen等人,naturereviewsdrugdiscovery2008,7,255)。
i.环状磺酰胺化合物
在一方面,本发明提供式i化合物或其药学上可接受的盐:
其中:
r1为苯基、萘基或杂芳基,其中:所述苯基、萘基或杂芳基任选取代有1、2或3个独立选择的r32基团;
r2为氢或c1-6烷基;
r3为任选取代有1、2或3个独立地选自r32、r34和r7a的取代基的苯基;
r7a为苯基或杂芳基,其中:所述苯基或杂芳基任选取代有1、2或3个独立选择的r32基团;
r4为氢或任选取代有1、2或3个独立选自以下的取代基的c1-6烷基:卤素、-oh、-cn、-s(o)q-c1-6烷基、-nrarb、-nrc-s(o)t-c1-6烷基、-s(o)t-nrarb、c2-6烯基、c2-6炔基、卤代c1-6烷基、c1-6烷氧基、卤代c1-6烷氧基、-c(o)nrarb、-c(o)-c1-6烷基、甲酰基、-c(o)oh、-c(o)o-c1-6烷基、苄氧基、c1-4烷氧基苯基、吡咯烷基、吗啉基、四氢呋喃基和三唑基;
r5为氢或任选取代有1、2或3个独立选自以下的取代基的c1-6烷基:卤素、-oh、c1-6烷氧基、-nrarb和rarbn-c1-6烷基;
r6为氢或c1-6烷基;
r32为卤素、-oh、-cn、-no2、氧代基、肼基、甲酰基、叠氮基、甲硅烷基、甲硅烷氧基、-s(o)q-c1-6烷基、-nrarb、-nrc-s(o)t-c1-6烷基、-s(o)t-nrarb、c1-6烷基、c2-6烯基、c2-6炔基、c3-6环烷基、卤代c1-6烷基、羟基c1-6烷基、rarbn-c1-6烷基-、c1-6烷氧基、卤代c1-6烷氧基、羟基c1-6烷氧基-、rarbn-c1-6烷氧基-、c1-6烷氧基c1-6烷基、-c(o)nrarb、-c(o)-c1-6烷基、-c(o)oh或-c(o)o-c1-6烷基;
r34为氢或c1-4烷基;
ra和rb在每次出现独立地选自:氢和c1-6烷基;或
ra和rb可与ra和rb相连的氮一起形成:
rc在每次出现独立地选自:氢和c1-6烷基;
在每次出现,q独立地为0、1或2;
在每次出现,t独立地为1或2;和
w为0、1或2。
在另一方面,本发明提供式i化合物或其药学上可接受的盐:
其中:
r1为苯基、萘基或杂芳基,其中:所述苯基、萘基或杂芳基任选取代有1、2或3个独立选择的r32基团;
r2为氢或c1-6烷基;
r3为苯基或5-6元单环杂芳基,其中:所述苯基或5-6元单环杂芳基任选取代有1、2或3个独立地选自r32、r34和-l-r7a的取代基;
l为键或c1-6亚烷基;
r7a为苯基、杂芳基、环烷基、杂环烷基或杂环烯基,其中:所述苯基、杂芳基、环烷基、杂环烷基或杂环烯基任选取代有1、2或3个独立选择的r32基团;
r4为氢或任选取代有1、2或3个独立选自以下的取代基的c1-6烷基:卤素、-oh、-cn、-s(o)q-c1-6烷基、-nrarb、-nrc-s(o)t-c1-6烷基、-s(o)t-nrarb、c2-6烯基、c2-6炔基、卤代c1-6烷基、c1-6烷氧基、卤代c1-6烷氧基、-c(o)nrarb、-c(o)-c1-6烷基、甲酰基、-c(o)oh、-c(o)o-c1-6烷基、苄氧基、c1-4烷氧基苯基、吡咯烷基、吗啉基、四氢呋喃基和三唑基;
r5为氢或任选取代有1、2或3个独立选自以下的取代基的c1-6烷基:卤素、-oh、c1-6烷氧基、-nrarb和rarbn-c1-6烷基;
r6为氢或c1-6烷基;
r32为卤素、-oh、-cn、-no2、氧代基、肼基、甲酰基、叠氮基、甲硅烷基、甲硅烷氧基、-s(o)q-c1-6烷基、-nrarb、-nrc-s(o)t-c1-6烷基、-s(o)t-nrarb、c1-6烷基、c2-6烯基、c2-6炔基、c3-6环烷基、卤代c1-6烷基、羟基c1-6烷基、rarbn-c1-6烷基-、c1-6烷氧基、卤代c1-6烷氧基、羟基c1-6烷氧基-、rarbn-c1-6烷氧基-、c1-6烷氧基c1-6烷基、-c(o)nrarb、-c(o)-c1-6烷基、-c(o)oh或-c(o)o-c1-6烷基;
r34为氢或c1-4烷基;
ra和rb在每次出现独立地选自:氢和c1-6烷基;或
ra和rb可与ra和rb相连的氮一起形成:
rc在每次出现独立地选自:氢和c1-6烷基;
在每次出现,q独立地为0、1或2;
在每次出现,t独立地为1或2;和
w为0、1或2。
在另一方面,本发明提供式i化合物或其药学上可接受的盐:
其中:
r1为苯基、萘基或杂芳基,其中:所述苯基、萘基或杂芳基任选取代有1、2或3个独立选择的r32基团;
r2为氢或c1-6烷基;
r3为5-6元单环杂芳基或8-12元双环杂芳基,其选自:
r4为氢或任选取代有1、2或3个独立选自以下的取代基的c1-6烷基:卤素、-oh、-cn、-s(o)q-c1-6烷基、-nrarb、-nrc-s(o)t-c1-6烷基、-s(o)t-nrarb、c2-6烯基、c2-6炔基、卤代c1-6烷基、c1-6烷氧基、卤代c1-6烷氧基、-c(o)nrarb、-c(o)-c1-6烷基、甲酰基、-c(o)oh、-c(o)o-c1-6烷基、苄氧基、c1-4烷氧基苯基、吡咯烷基、吗啉基、四氢呋喃基和三唑基;
r5为氢或任选取代有1、2或3个独立选自以下的取代基的c1-6烷基:卤素、-oh、c1-6烷氧基、-nrarb和rarbn-c1-6烷基;
r6为氢或c1-6烷基;
r7a为苯基或杂芳基,其中:所述苯基或杂芳基任选取代有1、2或3个独立选择的r32基团;
r32为卤素、-oh、-cn、-no2、氧代基、肼基、甲酰基、叠氮基、甲硅烷基、甲硅烷氧基、-s(o)q-c1-6烷基、-nrarb、-nrc-s(o)t-c1-6烷基、-s(o)t-nrarb、c1-6烷基、c2-6烯基、c2-6炔基、c3-6环烷基、卤代c1-6烷基、羟基c1-6烷基、rarbn-c1-6烷基-、c1-6烷氧基、卤代c1-6烷氧基、羟基c1-6烷氧基-、rarbn-c1-6烷氧基-、c1-6烷氧基c1-6烷基、-c(o)nrarb、-c(o)-c1-6烷基、-c(o)oh或-c(o)o-c1-6烷基;
r33在每次出现独立地选自:r32和r7a;
r34为氢或c1-4烷基;
ra和rb在每次出现独立地选自:氢和c1-6烷基;或
ra和rb可与ra和rb相连的氮一起形成:
rc在每次出现独立地选自:氢和c1-6烷基;
在每次出现,q独立地为0、1或2;
在每次出现,t独立地为1或2;
r为0、1或2;和
r2为0、1、2或3;和
w为0、1或2。
在另一方面,本发明提供式i化合物或其药学上可接受的盐:
其中:
r1为苯基、萘基或杂芳基,其中:所述苯基、萘基或杂芳基任选取代有1、2或3个独立选择的r32基团;
r2为氢或c1-6烷基;
r3为c8-12环烷基、c8-12环烯基、碳环基、杂环烷基、杂环烯基或杂环基,其中:所述c8-12环烷基、c8-12环烯基、碳环基、杂环烷基、杂环烯基或杂环基任选取代有1、2或3个独立地选自r32、r34和r7a的取代基;
r7a为苯基或杂芳基,其中:所述苯基或杂芳基任选取代有1、2或3个独立选择的r32基团;
r4为氢或任选取代有1、2或3个独立选自以下的取代基的c1-6烷基:卤素、-oh、-cn、-s(o)q-c1-6烷基、-nrarb、-nrc-s(o)t-c1-6烷基、-s(o)t-nrarb、c2-6烯基、c2-6炔基、卤代c1-6烷基、c1-6烷氧基、卤代c1-6烷氧基、-c(o)nrarb、-c(o)-c1-6烷基、甲酰基、-c(o)oh、-c(o)o-c1-6烷基、苄氧基、c1-4烷氧基苯基、吡咯烷基、吗啉基、四氢呋喃基和三唑基;
r5为氢或任选取代有1、2或3个独立选自以下的取代基的c1-6烷基:卤素、-oh、c1-6烷氧基、-nrarb和rarbn-c1-6烷基;
r6为氢或c1-6烷基;
r32为卤素、-oh、-cn、-no2、氧代基、肼基、甲酰基、叠氮基、甲硅烷基、甲硅烷氧基、-s(o)q-c1-6烷基、-nrarb、-nrc-s(o)t-c1-6烷基、-s(o)t-nrarb、c1-6烷基、c2-6烯基、c2-6炔基、c3-6环烷基、卤代c1-6烷基、羟基c1-6烷基、rarbn-c1-6烷基-、c1-6烷氧基、卤代c1-6烷氧基、羟基c1-6烷氧基-、rarbn-c1-6烷氧基-、c1-6烷氧基c1-6烷基、-c(o)nrarb、-c(o)-c1-6烷基、-c(o)oh或-c(o)o-c1-6烷基;
r34为氢或c1-4烷基;
ra和rb在每次出现独立地选自:氢和c1-6烷基;或
ra和rb可与ra和rb相连的氮一起形成:
rc在每次出现独立地选自:氢和c1-6烷基;
在每次出现,q独立地为0、1或2;
在每次出现,t独立地为1或2;和
w为0、1或2。
在某些实施方案中,所述式i化合物为式ii或iii化合物或其药学上可接受的盐:
在某些实施方案中,所述式i化合物为式ii化合物或其药学上可接受的盐:
在某些实施方案中,所述式i化合物为式iii化合物或其药学上可接受的盐:
在某些实施方案中,所述式i化合物为式iv或v化合物或其药学上可接受的盐:
在某些实施方案中,所述式i化合物为式iv化合物或其药学上可接受的盐:
在某些实施方案中,所述式i化合物为式v化合物或其药学上可接受的盐:
在某些实施方案中,w为0。
在某些实施方案中,w为1。
在某些实施方案中,w为2。
在某些实施方案中,r1为任选取代有1、2或3个独立选择的r32基团的苯基。
在某些实施方案中,r1为
r32在每次出现独立地选自:氢、卤素、氰基、c1-6烷基和c1-6卤代烷基;和
r2为0、1、2或3。
在某些实施方案中,r1为
在某些实施方案中,r1为
在某些实施方案中,r1为任选取代有1、2或3个独立选择的r32基团的杂芳基。
在某些实施方案中,r1为任选取代有1、2或3个独立选择的r32基团的5-6元单环杂芳基。
在某些实施方案中,r1为任选取代有1、2或3个独立选择的r32基团的5-6元单环杂芳基;其中:
所述5-6元单环杂芳基选自:呋喃基、噻吩基、吡咯基、噻唑基、噁唑基、异噻唑基、异噁唑基、咪唑基、吡唑基、1h-1,2,3-三唑基、2h-1,2,3-三唑基、1,2,4-三唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、1,3,5-三嗪基、1,2,4-三嗪基、1,2,3-三嗪基、1,2,4-噁二唑基、1,3,4-噁二唑基、1,2,5-噁二唑基、1,2,4-噻二唑基、1,3,4-噻二唑基和1,2,5-噻二唑基。
在某些实施方案中,r1为任选取代有1、2或3个独立选自以下的取代基的吡啶基:卤素、氰基、c1-6烷基和c1-6卤代烷基。
在某些实施方案中,r1为任选取代有1、2或3个独立选择的r32基团的8-12元双环杂芳基。
在某些实施方案中,r1为任选取代有1、2或3个独立选择的r32基团的8-12元双环杂芳基,其中:
所述8-12元双环杂芳基选自:苯并呋喃基、异苯并呋喃基、苯并[b]噻吩基、苯并[c]噻吩基、吲哚基、异吲哚基、苯并[d]异噁唑基、苯并[c]异噁唑基、苯并[d]噁唑基、苯并[d]异噻唑基、苯并[c]异噻唑基、苯并[d]噻唑基、吲唑基、苯并[d]咪唑基、苯并[d]咪唑基和苯并[d][1,2,3]三唑基。
在某些实施方案中,r2为氢或甲基。
在某些实施方案中,r2为氢。
在某些实施方案中,r3为c8-12环烷基、c8-12环烯基或碳环基,其中:所述c8-12环烷基、c8-12环烯基或碳环基任选取代有1、2或3个独立地选自r32、r34和r7a的取代基。
在某些实施方案中,r3为任选取代有1、2或3个独立地选自r32、r34和r7a的取代基的c8-12环烷基。
在某些实施方案中,r3为任选取代有1、2或3个独立地选自r32、r34和r7a的取代基的c8-12环烯基。
在某些实施方案中,r3为任选取代有1、2或3个独立地选自r32、r34和r7a的取代基的碳环基。
在某些实施方案中,r3为任选取代有1、2或3个独立地选自r32、r34和r7a的取代基的杂环烷基。
在某些实施方案中,r3为杂环烷基、杂环烷基或杂环基,其中:所述杂环烷基、杂环烷基或杂环基任选取代有1、2或3个独立地选自r32、r34和r7a的取代基。
在某些实施方案中,r3为任选取代有1、2或3个独立地选自r32、r34和r7a的取代基的4-7元单环杂环烷基,其中:
所述4-7元单环杂环烷基选自:氮杂环丙基、氧杂环丙基、硫杂环丙基1,1-二氧化物、氧杂环丁基、氮杂环丁基、硫杂环丁基1,1-二氧化物、吡咯烷基、四氢呋喃基、哌啶基、四氢-2h-吡喃基、吗啉基、硫吗啉基和哌嗪基。
在某些实施方案中,r3为任选取代有1、2或3个独立地选自r32、r34和r7a的取代基的杂环烯基。
在某些实施方案中,r3为任选取代有1、2或3个独立地选自r32、r34和r7a的取代基的杂环基。
在某些实施方案中,r7a为任选取代有1、2或3个独立选择的r32基团的苯基。
在某些实施方案中,r7a为任选取代有1、2或3个独立选择的r32基团的杂芳基。
在某些实施方案中,r7a为任选取代有1、2或3个独立选择的r32基团的5-6元单环杂芳基。
在某些实施方案中,r4为氢、c1-6烷基、c2-6烯基或c2-6炔基,其中:所述c1-4烷基、c2-6烯基或c2-6炔基任选取代有羟基、氰基、c1-4烷氧基、卤代c1-4烷氧基、甲磺酰基、二乙基氨基、羧基、氨基甲酰基、苄氧基、甲酰基、甲氧基苯基、吡咯烷基、吗啉基、四氢呋喃基或三唑基。
在某些实施方案中,r4为氢或任选取代有c1-6烷氧基、-nrarb、c2-6烯基、-oh、-cooh或c1-6卤代烷氧基的c1-6烷基。
在某些实施方案中,r4为任选取代有c1-6烷氧基、-nrarb、c2-6烯基、-oh、-cooh或c1-6卤代烷氧基的c1-6烷基。
在某些实施方案中,r4为-ch2ch2och3。
在某些实施方案中,r4为甲基。
在某些实施方案中,r5为氢、c1-4烷基、c1-4烷氧基或rarbn-c1-4烷基-。
在某些实施方案中,r5为氢、甲基、甲氧基甲基-、甲氧基乙基-或二甲基氨基乙基-。
在某些实施方案中,r5为氢或甲基。
在某些实施方案中,r5为氢。
在某些实施方案中,r6为氢或c1-6烷基。
在某些实施方案中,r6为氢。
在某些实施方案中,r2和r6为氢。
在某些实施方案中,r2和r6为氢,且w为2。
在某些实施方案中,r2、r5和r6为氢。
在某些实施方案中,r2、r5和r6为氢,且w为2。
在某些实施方案中,r2、r5和r6为氢,且r4为甲基。
在某些实施方案中,r2、r5和r6为氢,r4为甲基,且w为2。
在某些实施方案中,r1为3-氯-4-氟苯基,r2为氢,且r6为氢。
在某些实施方案中,r1为3-氯-4-氟苯基,r2为氢,r6为氢,且w为2。
在某些实施方案中,r1为3-氯-4-氟苯基,r2为氢,r5为氢,且r6为氢。
在某些实施方案中,r1为3-氯-4-氟苯基,r2为氢,r5为氢,r6为氢,且w为2。
在某些实施方案中,r1为3-氯-4-氟苯基,r2为氢,r5为氢,r6为氢,且r4为甲基。
在某些实施方案中,r1为3-氯-4-氟苯基,r2为氢,r5为氢,r6为氢,r4为甲基,且w为2。
应理解上述以及本公开的其他地方的所有化学允许的实施方案组合,被设想为本发明进一步的实施方案。
ii.药物组合物和试剂盒
在另一方面,本发明提供药物组合物,其包含式i化合物或其药学上可接受的盐,以及药学上可接受的赋形剂。特别是,本发明提供药物组合物,其包含与一种或多种药学上可接受的载体一起配制的如本文所公开的化合物。这些制剂包括那些适用于经口、经直肠、局部、经颊、胃肠外(如,皮下、肌内、皮内或静脉内)、经直肠、经阴道或气雾剂施用的制剂,尽管在任何给定的情况下大部分适合形式的施用将取决于正在治疗的病症的程度和严重性,以及正在使用的具体化合物的性质。例如,可以将公开的组合物配制为单位剂量,和/或可以配制成用于口服或皮下给药。
在另一方面,本发明提供药物组合物,其包含表3、4、5、6或7的化合物或其药学上可接受的盐和/或立体异构体。
本发明的示例性药物组合物可以药物制剂的形式使用,例如以固体、半固体或液体形式,所述药物制剂含有与适于外部、肠内或肠胃外施用的有机或无机载体或赋形剂混合的作为活性成分的一种或多种本发明化合物。例如,可以将所述活性成分与通常无毒、药学上可接受的载体混合用于片剂、小糖丸、胶囊、栓剂、溶液、乳剂、混悬剂、以及适合于使用的任何其它形式。活性目标化合物以足以对疾病过程或状况产生所需作用的量包含在所述药物组合物中。
为了制备固体组合物(例如片剂),可以将主要活性成分与药物载体(如,常规压片成分例如玉米淀粉、乳糖、蔗糖、山梨糖醇、滑石、硬脂酸、硬脂酸镁、磷酸氢钙或树胶)和其它药用稀释剂(如水)混合以形成含有本发明化合物或其无毒的药学上可接受的盐的均匀混合物的固体预配制组合物。当提及这些均匀的预配制组合物时,意指所述活性成分被均匀地分散于整个组合物以使得可以容易地将所述组合物细分成同样有效的单位剂型(例如片剂、丸剂和胶囊)。
在用于经口给药的固体剂型(胶囊、片剂、丸剂、糖锭剂、粉剂、颗粒剂等)中,将所述目标组合物与一种或多种药学上可接受的载体(例如柠檬酸钠或磷酸二钙)和/或以下中的任何一种进行混合:(1)填充剂或增量剂(extenders),例如淀粉、乳糖、蔗糖、葡萄糖、甘露醇和/或硅酸;(2)粘合剂,例如,如羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、蔗糖和/或阿拉伯胶;(3)保湿剂,例如甘油;(4)崩解剂,例如琼脂、碳酸钙、马铃薯或木薯淀粉、藻酸、某些硅酸盐及碳酸钠;(5)溶液缓凝剂,例如石蜡;(6)吸收促进剂,例如季铵化合物;(7)润湿剂,例如,例如鲸蜡醇和单硬脂酸甘油酯;(8)吸收剂,例如高岭土和膨润土;(9)润滑剂,例如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、月桂基硫酸钠及其混合物;以及(10)着色剂。在胶囊、片剂及丸剂的情况下,所述组合物还可以包含缓冲剂。在使用赋形剂例如乳糖或奶糖(milksugars)以及高分子量聚乙二醇等的软填充和硬填充的明胶胶囊中还可以采用类似类型的固体组合物作为填充剂。
可以任选地与一种或多种辅助成分通过压制或模制来制备片剂。可以使用粘合剂(例如,明胶或羟丙基甲基纤维素)、润滑剂、惰性稀释剂、防腐剂、崩解剂(例如,淀粉乙醇酸钠或交联羧甲基纤维素钠)、表面活性剂或分散剂来制备压制片。可以通过在适合的机器中模制用惰性液体稀释剂湿润的所述目标组合物的混合物来制备模制片。可以任选地用包衣和壳(例如肠溶包衣和药物配制领域熟知的其它包衣)来刻痕或制备片剂和其它固体剂型(例如糖锭剂、胶囊、丸剂和颗粒剂)。
用于吸入或吹入的组合物包括药学上可接受的含水或有机溶剂或其混合物中的溶液和混悬液,以及粉末。用于口服给药的液体剂型包括药学上可接受的乳剂、微乳剂、溶液、混悬剂、糖浆和酏剂。除目标组合物外,该液体剂型可以含有本领域通常使用的惰性稀释剂,例如如水或其它溶剂、增溶剂和乳化剂,例如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苄酯、丙二醇、1,3-丁二醇、油类(具体来说,棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢糠醇、聚乙二醇和脱水山梨糖醇脂肪酸酯、环糊精及其混合物。
除目标目标组合物之外,混悬剂还可含有助悬剂,例如乙氧基化异硬脂醇、聚氧乙烯山梨醇和脱水山梨糖醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂和黄芪胶及其混合物。
用于经直肠或经阴道给药的制剂可以作为栓剂存在,其可以通过将目标组合物与一种或多种适合的无刺激性赋形剂或载体(包括例如可可脂、聚乙二醇、栓剂蜡或水杨酸酯)混合来制备,并且所述栓剂在室温下是固体,但在体温下是液体并因此在体腔中将会熔化并且释放所述活性剂。
用于经皮给药目标组合物的剂型包括粉剂、喷雾剂、软膏剂、糊剂、乳膏剂、洗剂、凝胶剂、溶液、贴剂和吸入剂。可以在无菌条件下将所述活性成分与药学上可接受的载体以及可能必需的任何防腐剂、缓冲剂或推进剂进行混合。
除目标组合物之外,所述软膏剂、糊剂、乳膏剂和凝胶剂可以包含赋形剂,例如动物和蔬菜脂肪、油、蜡、石蜡、淀粉、黄芪胶、纤维素衍生物、聚乙二醇、硅酮、膨润土、硅酸、滑石和氧化锌或其混合物。
除目标组合物之外,粉剂和喷雾剂可以包含赋形剂如乳糖、滑石、硅酸、氢氧化铝、硅酸钙和聚酰胺粉末、或这些物质的混合物。喷雾剂可以额外地包含常规推进剂,例如氯氟烃和挥发性未取代的烃(例如丁烷或丙烷)。
本发明的组合物和化合物可以替代地通过气溶胶施用。这可以通过制备含有所述化合物的含水气溶胶、脂质体制剂或固体颗粒来完成。可以使用无水混悬液(例如,碳氟化合物推进剂)。可以使用声波雾化器,这是因为它们可以使药剂暴露于剪切最小化,所述剪切可以引起目标组合物中所含化合物的降解。一般来说,含水气溶胶是通过将目标组合物的水溶液或混悬液与常规药学上可接受的载体和稳定剂配制在一起来制得。载体和稳定剂根据特定目标组合物的需要而变化,但通常包括非离子表面活性剂(吐温类(tweens)、普朗尼克(pluronics)或聚乙二醇)、无毒蛋白质例如血清白蛋白、脱水山梨醇酯、油酸、卵磷脂、氨基酸例如甘氨酸、缓冲剂、盐、糖或糖醇。气溶胶通常由等渗溶液制得。
适用于胃肠外给药的本发明药物组合物包括目标组合物与以下的一种或多种的组合:药学上可接受的无菌等渗水性或非水性溶液、分散液、混悬液或乳液、或在使用之前即可被重构成无菌可注射溶液或分散液的无菌粉末,它们可以含有抗氧化剂、缓冲剂、抑菌剂、使所述制剂与预期的接受者的血液等渗的溶质,或助悬剂或增稠剂。
本发明药物组合物中可采用的适合的水性和非水性载体的实例包括水、乙醇、多元醇(例如甘油、丙二醇、聚乙二醇等)、及其适合的混合物、植物油(例如橄榄油)以及可注射的有机酯(例如油酸乙酯)和环糊精。例如,可以通过使用包衣材料(例如卵磷脂),在分散液的情况下通过维持所需的粒度以及通过使用表面活性剂来维持适当的流动性。
在另一方面,本发明提供肠内药物制剂,其包括公开的化合物和肠溶物质;以及其药学上可接受的载体或赋形剂。肠溶物质是指基本上不溶于胃的酸性环境,并且在特定ph下主要溶于肠液的聚合物。小肠是胃和大肠之间胃肠道(消化道)的一部分,并且所述小肠包括十二指肠、空肠和回肠。十二指肠的ph值为约5.5,空肠的ph值为约6.5,且回肠末端的ph值为约7.5。因此,肠溶物质是不可溶解的,例如,直到ph值为约5.0、约5.2、约5.4、约5.6、约5.8、约6.0、约6.2、约6.4、约6.6、约6.8、约7.0、约7.2、约7.4、约7.6、约7.8、约8.0、约8.2、约8.4、约8.6、约8.8、约9.0、约9.2、约9.4、约9.6、约9.8或约10.0。示例性肠溶物质包括醋酸邻苯二甲酸纤维素(cap)、羟丙基甲基纤维素邻苯二甲酸酯(hpmcp)、聚醋酸乙烯邻苯二甲酸酯(pvap)、醋酸羟丙基甲基纤维素琥珀酸酯(hpmcas)、乙酸-1,2,4-苯三酸纤维素、羟丙基甲基纤维素琥珀酸酯、醋酸琥珀酸纤维素、醋酸六氢邻苯二甲酸纤维素(celluloseacetatehexahydrophthalate)、丙酸邻苯二甲酸纤维素、醋酸马来酸纤维素、醋酸丁酸纤维素、醋酸丙酸纤维素、甲基甲基丙烯酸和甲基丙烯酸甲酯的共聚物、丙烯酸甲酯、甲基丙烯酸甲酯和甲基丙烯酸的共聚物、甲基乙烯基醚和马来酸酐的共聚物(gantrezes系列)、甲基丙烯酸乙酯-甲基丙烯酸甲酯-乙基丙烯酸氯三甲基铵共聚物(chlorotrimethylammoniumethylacrylatecopolymer)、天然树脂例如玉蜀黍蛋白、虫胶和柯巴脂(copalcollophorium)以及若干可商购的肠溶分散系统(例如,eudragitl30d55、eudragitfs30d、eudragitl100、eudragits100、kollicoatemm30d、estacryl30d、coateric和aquateric)。上述每种物质的溶解度是已知的,或者在体外很容易确定。上文是可行物质的列表,但受益于本公开的本领域的技术人员应认识到,所述列表并不全面并且还存在满足本发明目标的其它肠溶物质。
有利地,本发明还提供例如供需要hbv感染治疗的消费者使用的试剂盒。这些试剂盒包括例如上文所述那些剂型的合适剂型和描述使用这些剂型来介导、减少或预防hbv感染的方法的说明书。说明书可以指导消费者或医务人员根据本领域技术人员已知的施用模式来施用该剂型。这些试剂盒可以有利地以单个试剂盒单元或多个试剂盒单元进行包装并且出售。这种试剂盒的实例为所谓的泡罩包装。泡罩包装在包装工业中是熟知的并且广泛用于包装药物单位剂型(片剂、胶囊等)。泡罩包装通常由以优选透明塑性材料的箔覆盖的相对硬质材料薄片构成。在包装过程中,在塑料箔中会形成凹槽。凹槽具有待包装的片剂或胶囊的尺寸和形状。接着,将片剂或胶囊放置在所述凹槽中,并且相对硬质材料的薄片在与形成凹槽的方向相反的箔一侧封住所述塑料箔。因此,片剂或胶囊被密封在塑料箔与薄片之间的凹槽中。优选地,薄片的强度使得可以通过以下方式将片剂或胶囊从泡罩包装中去除:手动施加压力于凹槽处,从而在凹槽位置处的薄片中形成开口。然后可以通过所述开口将片剂或胶囊去除。
可能需要在试剂盒上提供记忆辅助,例如以片剂或胶囊旁边的数字的形式,其中数字对应于应摄入如此指定片剂或胶囊的给药方案的天数。这种记忆辅助的另一个实例是印刷在卡片上的日历,例如,如下“第一周、周一、周二,...”等、“第二周、周一、周二,...”等。记忆辅助的其它变型将变得显而易见。“日剂量”可以是在给定日服用的单个片剂或胶囊或若干丸剂或胶囊。同时,第一化合物的日剂量可以由一个片剂或胶囊组成,而第二化合物的日剂量可以由若干片剂或胶囊组成,反之亦然。记忆辅助应反映这些内容。
iii.方法
在另一方面,提供了在有此需要的患者中治疗乙型肝炎感染的方法,其包括向受试者或患者给药有效量的所公开化合物,和/或给药第一公开化合物和任选地另一种不同的公开化合物。在另一实施方案中,提供了在有此需要的患者中治疗乙型肝炎感染的方法,其包括向所述受试者或患者给药治疗上有效量的公开的药物组合物或以下药物组合物,其包含一种所公开的化合物或两种或多种公开化合物和药学上可接受的赋形剂。
对于根据这方面的使用,预期适当的剂量根据例如,所采用的具体化合物、给药方式和待治疗感染的性质和严重性以及待治疗的具体感染而变化,且在治疗医生的权限范围内。通常,指定的给药剂量可在约0.1至约1000μg/kg体重的范围内。在一些情况下,所述化合物的给药剂量可小于400μg/kg体重。在其他情况下,所述给药剂量可小于200μg/kg体重。还在其他情况下,所述给药剂量可在约0.1至约100μg/kg体重的范围内。所述剂量可以每日一次或以多达例如每日四次的分开剂量或以持续释放的形式进行方便地施用。
本公开化合物可通过任意常规途径进行给药,具体地:经肠、局部、口服、经鼻,例如以片剂或胶囊的形式,通过栓剂或胃肠外,例如以可注射溶剂或混悬液的形式,用于静脉内、肌内、皮下或腹膜内注射。合适的制剂和药物组合物将包含使用一种或多种生理学可接受的载体或赋形剂以及任意已知和市售可得的和目前临床情况所采用的那些,以常规方式进行配制的那些。因此,所述化合物可被配制用于口服、含服、局部、胃肠外、直肠或经皮给药或被配制成适用于吸入或吹入(经口或经鼻)的形式。
对于口服给药,药物组合物可以采取例如,片剂或胶囊的形式,其通过常规方式,用药学上可接受的赋形剂进行制备,所述赋形剂例如粘合剂(例如预胶化玉米淀粉、聚乙烯基吡咯烷酮或羟基丙基甲基纤维素);填充剂(例如乳糖、微晶纤维素或磷酸氢钙);润滑剂(例如硬脂酸镁、滑石或二氧化硅);崩解剂(例如马铃薯淀粉或淀粉羟乙酸钠);或润湿剂(例如月桂基硫酸钠)。片剂可通过本领域熟知的方法进行包衣。用于口服给药的液体制剂可采用,例如,溶液、糖浆或混悬液的形式,或它们可作为干燥产物的形式呈现,使用前用水或其他合适的媒介物进行重构。这种液体制剂可通过常规方式,用药学上可接受的添加剂例如助悬剂(例如山梨糖醇糖浆、纤维素衍生物或氢化可食用脂肪);乳化剂(例如卵磷脂或阿拉伯胶);非水媒介物(例如杏仁油、油酯、乙醇或分馏植物油);和防腐剂(例如对羟基苯甲酸甲基酯或对羟基苯甲酸丙基酯或山梨酸)进行制备。视情况而定,制剂也可含有缓冲盐、调味剂、着色剂和甜味剂。
用于口服给药的制剂也可被适当地配制,以在延长的时间内提供控制释放或持续释放活性化合物。对于含服给药,所述组合物可采用以本领域技术人员已知的常规方式配制的片剂或锭剂形式。
所公开化合物也可被配制用于通过注射(例如推注或连续输注)进行胃肠外给药。用于注射的制剂可以单位剂型(例如安瓿或多剂量容器)存在,其添加有防腐剂。所述组合物可采用如在油性或水性媒介物中的混悬液、溶液或乳液的形式且可含有添加剂,例如助悬剂、稳定剂和/或分散剂。或者,所述化合物可为粉末形式,其用于在使用前与合适的媒介物(例如无菌无热原水)进行重构。化合物还可被配制用于作为栓剂或保留灌肠剂进行直肠给药,例如含有常规栓剂基质如可可脂或其他甘油酯的栓剂或保留灌肠剂。
本文还考虑了包括第二活性剂或施用第二活性剂的方法和组合物。例如,除了被hbv感染之外,受试者或患者还可以具有与hbv感染相关的合并症,即与hbv感染有关、被其加重或加剧的疾病和其他不良健康状况。本文考虑了公开的化合物与至少一种其他药剂的组合,该药剂先前已显示可治疗这些hbv感染相关病症。
在一些情况下,所公开化合物可作为与一种或多种抗病毒药物联合的组合疗法的一部分进行给药。所述抗病毒药物的实例包括核苷类似物、干扰素α和其他组装效应器,例如杂芳基二氢嘧啶(hap),例如4-(2-氯-4-氟苯基)-6-甲基-2-(吡啶-2-基)-1,4-二氢嘧啶-5-甲酸甲酯(hap-1)。例如,本文提供了治疗患有乙型肝炎感染的患者的方法,其包括向患者给药第一量的所公开化合物和第二量的抗病毒药物或其他抗hbv试剂,例如第二量的选自以下的第二化合物:hbv衣壳组装启动子(例如gls4、bay41-4109、at-130、dvr-23(例如,如下所描绘),
nvr3-778、nvr1221(通过代码示出);和n890(如下所描绘):
其他cpam,例如在以下引入本文作为参考的专利申请中所公开的那些:wo2014037480、wo2014184328、wo2013006394、wo2014089296、wo2014106019、wo2013102655、wo2014184350、wo2014184365、wo2014161888、wo2014131847、wo2014033176、wo2014033167和wo2014033170;干扰病毒聚合酶的核苷类似物,例如恩替卡韦(博路定)、拉米夫定(epivir-hbv)、替比夫定(tyzeka,sebivo)、阿德福韦酯(贺维力)、替诺福韦(韦瑞德)、替诺福韦艾拉酚胺富马酸盐(tenofoviralafenamidefumarate)(taf)、替诺福韦(tenofavir)的前药(例如agx-1009)、l-fmau(克来夫定)、lb80380(besifovir)和:
病毒进入抑制剂,例如myrcludexb及相关的脂肽衍生物;hbsag分泌抑制剂,例如rep9ac’及相关的基于核酸的两亲聚合物,如下所描绘的hbf-0529(pbhbv-001)、pbhbv-2-15:
和如下所描绘的bm601:
核衣壳形成或完整性的干扰剂,例如nz-4/w28f:
cccdna形成抑制剂:例如bsbi-25、ccc-0346、ccc-0975(如下所描绘):
hbc定向transbodies,例如在wangy等人,transbodyagainsthepatitisbviruscoreproteininhibitshepatitisbvirusreplicationinvitro,int.immunopharmacol(2014)中所述的那些,位于//dx.doi.org/10.1016/j.intimp.2015.01.028;抗病毒核心蛋白突变体(例如cp183-v124w及相关的突变体,如在wo/2013/010069、wo2014/074906中所述的那些,其各自引入本文作为参考);hbx-相互作用抑制剂,例如靶向hbvrna的rnai、反义和基于核酸的聚合物,例如,rnai(例如aln-hbv、arc-520、tkm-hbv、ddrnai)、反义基因(isis-hbv)或基于核酸的聚合物:(rep2139-ca);免疫刺激剂,例如干扰素α2a(罗扰素)、introna(干扰素α2b)、派罗欣(聚乙二醇干扰素α2a)、聚乙二醇ifn2b、ifnλ1a和pegifnλ1a、wellferon、罗扰素、干复津、淋巴毒素β受体激动剂,例如cbe11和bs1;非干扰素免疫增强剂,例如胸腺素α-1(日达仙)和白细胞介素-7(cyt107);tlr-7/9激动剂如gs-9620、cyt003、瑞喹莫德(resiquimod);亲环素抑制剂,例如nvp018;ocb-030;scy-635;阿拉泊韦;nim811及相关的环孢菌素类似物;疫苗,例如gs-4774、tg1050、核心抗原疫苗;smac模拟物,例如birinapant和其他iap-拮抗剂;表观遗传调节剂(epigeneticmodulator),例如kmt抑制剂(ezh1/2、g9a、setd7、suv39抑制剂)、prmt抑制剂、hdac抑制剂、sirt激动剂、hat抑制剂、wd拮抗剂(例如oicr-9429)、parp抑制剂、ape抑制剂、dnmt抑制剂、lsd1抑制剂、jmjdhdm抑制剂和溴结构域拮抗剂;激酶抑制剂,例如tkb1拮抗剂、plk1抑制剂、srpk抑制剂、cdk2抑制剂、atm&atr激酶抑制剂;sting激动剂;利巴韦林;n-乙酰基半胱氨酸;nov-205(bam205);硝唑尼特(alinia)、替唑尼特;sb9200小分子核酸杂交物(smnh);dv-601;阿比朵尔;fxr激动剂(例如gw4064和fexaramin);抗体、治疗性蛋白、基因治疗和针对病毒成分或与宿主蛋白相互作用的生物制品。
在一些实施方案中,本发明提供了在有此需要的患者中治疗乙型肝炎感染的方法,其包括给药选自所公开的化合物中的任一个的第一化合物,和一种或者多种其它hbv药剂,所述其它hbv药剂各自选自hbv衣壳组装启动子、hbf病毒聚合酶干扰核苷、病毒进入抑制剂、hbsag分泌抑制剂、核衣壳形成的破坏剂、cccdna形成抑制剂、抗病毒核心蛋白突变体、hbc定向transbodies、靶向hbvrna的rnai、免疫刺激剂、tlr-7/9激动剂、亲环素抑制剂、hbv疫苗、smac模拟剂、表观遗传调节剂、激酶抑制剂和sting激动剂。在一些实施方案中,本发明提供了在有此需要的患者中治疗乙型肝炎感染的方法,其包括给药一定量的公开的化合物,并给药另一种hbv衣壳组装启动子。
在一些实施方案中,所述第一量和第二量一起包含药学上有效量。所述第一量、第二量或这二者可以与作为单一疗法所给药的各化合物的有效量相同、可以比作为单一疗法所给药的各化合物的有效量更多或比作为单一疗法所给药的各化合物的有效量更少。治疗上有效量的所公开化合物和抗病毒药物可共同给药至所述受试者,即以任意给定顺序且通过相同或不同的给药途径,同时或分开地给药至所述受试者。在一些情况下,在开始给药所述抗病毒药物前例如一天或数天或数周开始首次给药所公开化合物可能是有利的。此外,额外的药物可与上述组合疗法联合给药。
在另一实施方案中,所公开化合物可与检测部分例如荧光团部分(该部分可例如一旦结合至病毒和/或一旦经光子激发,便会再次发射一定的光频率)缀合(例如,直接或通过分子连接基共价连接至所公开化合物的游离碳、氮(例如氨基基团)或氧(例如活性酯))。预期的荧光团包括
iv.实施例
本文所述化合物可基于本文所含教导和本领域已知的合成步骤,以各种方式进行制备。在下文所述的合成方法的描述中,应理解除非另外提及,所有建议的反应条件,包括溶剂、反应气氛、反应温度、试验的持续时间和后处理步骤的选择,可被选择为用于该反应的标准条件。有机合成领域技术人员应理解,该分子各部分上存在的官能团应与所建议的试剂和反应相容。与反应条件不相容的取代基对于本领域技术人员将是显而易见的,并因此指明了替代方法。用于实施例的起始原料是市售可得的或通过标准方法由已知的物质容易地制备。
本文中鉴定为“中间体”的化合物中的至少一些被认为是本发明化合物。
缩写:
dcm二氯甲烷
etoac乙酸乙酯
meoh甲醇
dmso二甲基亚砜
nmon-甲基吗啉n-氧化物
lihmds双(三甲基甲硅烷基)氨基锂
p-tsa对甲苯磺酸
dmfn,n-二甲基甲酰胺
thf四氢呋喃
tlc薄层色谱法
lcms液相色谱–质谱分析
hplc高效液相色谱法
合成方法
可以基于本文包含的教导和本领域已知的合成方法,通过各种方法制备本文所述的化合物。合成方案中所示的变量与权利要求或说明书的其余部分中的变量不同,并且不应与它们混淆。在下面描述的合成方法的描述中,应该理解除非另有说明,否则所有建议的反应条件(包括溶剂的选择、反应气氛、反应温度、实验持续时间和后处理步骤)都可以选择为该反应的标准条件。有机合成领域的技术人员应理解,存在于分子各个部分上的官能团应与所建议的试剂和反应相容。与反应条件不相容的取代基对于本领域技术人员将是显而易见的,因此指出了替代方法。实施例的起始原料可以商购获得,或者可以通过标准方法容易地由已知物质制备。
以下方案说明了可用于制备本发明化合物的方法。在方案i中,适当取代的甲基酮(i-1)可以与草酸的双酯(i-2)在合适的碱(例如etona、t-buok、lihmds或lda)存在下反应形成二酮酯i-3。相应的2h-1,2,6-噻二嗪,1,1-二氧化物衍生物i-4的合成可以通过类似于bioorganic&medicinalchemistryletters,(2007),7,7480中所述的那些,在酸性(例如hcl)条件下,将中间体i-2与磺酰胺(sulfuricdiamide)(h4n2o2s)缩合来完成。该中间体可以在mitsunobu反应条件(mitsunobu,o.等人bulletinofthechemicalsocietyofjapan,(1967).40,935)下与适当的醇(r4oh)或在碱(例如naoh、koh、k2co3、nah、lihmds、nahmds)的存在下与烷基卤化物(r4x,其中x=i、br或cl)反应,以选择性地形成中间体i-5。中间体i-5可以通过多种不同途径进入最终产物(i-9)。在这些途径之一中,在水解条件(例如naoh或et3n/h2o)下处理中间体i-5以形成羧酸i-6。该中间体可以用还原剂例如nabh4处理以形成i-8。或者,可以使用ni、pd、pt、ru、rh或ir基催化剂和h2或供氢试剂(例如n2h4、h2n2、二氢萘、二氢蒽、异丙醇、甲酸、h2o等)通过i-6的氢化来形成i-8。此后,使用形成酰胺键的试剂(例如dcc、pybop、pybrop、tdbtu、hatu)和碱(et3n、ipr2net)将i-8与适当的胺(r1r2nh)偶联,得到最终产物。在另一种途径中,可以使用适当的胺(r1r2nh)和介导酯-酰胺交换的试剂例如me3al,将酯i-5直接转化为酰胺i-7。可以使用类似于将i-6转化为i-8所述的方法,将中间体i-7还原以形成最终产物i-9。
本领域技术人员将理解,3,5-二取代的1,2,6-噻二嗪烷1,1-二氧化物i-9可以两种不同的构型异构体形式(称为顺式或反式)存在,这取决于在3-位和5-位的取代基分别位于环的相同面上还是相反面上。在本发明中,可以通过i-6的还原或氢化反应形成i-8或通过i-7的还原形成i-9选择性地生成3,5-顺式立体异构体。
方案i
本领域技术人员将理解,i-9的顺式异构体可以作为对映异构体3r,5s和3s,5r的混合物存在。根据方案ii中所示的方法,单个对映异构体可以由外消旋体i-8生成或由外消旋体i-9分离。在一种方法中,可以使用手性色谱法或使用对映异构体纯的手性胺进行选择性成盐和结晶来拆分中间体i-8。然后可以将纯化的对映异构体ii-1a和ii-1b分别转化为相应的酰胺ii-2a和ii-2b。或者,可以将外消旋体i-8转化为外消旋体i-9,然后可以使用手性色谱法将外消旋体i-9分离成其单独的对映异构体ii-2a和ii-2b。该分离的对映异构体基于它们从手性柱上洗脱的顺序而被称为异构体i和异构体ii,而与绝对立体化学无关。该第一个洗脱的异构体被指定为异构体i,且第二个称为异构体ii。
方案ii
方案iii说明了由前手性中间体i-7直接合成对映异构体ii-2a或ii-2b。例如,这可以通过不对称转移氢化来完成,如accountsofchemicalresearch(1997)30,97或angewandtechemieinternationaledition(1998)12,41中所述。
方案iii
可以使用方案iv中所示的方法合成本发明的某些化合物。在此方案中,可以使用在方案i中合成i-7所描述的方法将iv-1转化为iv-8。中间体iv-8含有溴原子,该溴原子可在钯、镍、铜、铂、铁或钴催化下与适当的y-x(x=h、卤化物zn、mg、b(oh)2、b(oz)2、snz3或siz3(z=烷基或芳基))反应进行置换而形成外消旋体iv-9(kamben.等人chemicalsocietyreviews(2011)40,4937.phapale,v.b.和cardena,d.j.chemicalsocietyreviews(2009),38,1598.)。如方案ii中所述,可以将化合物iv-9分离为其单独的对映异构体iv-10a和iv-10b。
方案iv
方案v解释说明19-异构体i和19-异构体ii的合成。可以在碱性条件下将化合物v-1皂化,以生成羧酸v-2。然后可以通过手性色谱法分离19-异构体i和19-异构体ii。
方案v
方案vi解释说明了用于合成本发明某些化合物的另一种方法。在第一步中,中间体iv-8可通过与频哪醇二硼烷(pinacoldiborane)进行钯催化的偶联反应转化为相应的硼酸酯vi-1。然后可以使用类似于方案iv中所述的反应条件,将中间体vi-1用作与适当取代的反应物y-x(x=卤化物、otf)的偶联配体,以制备vi-2。
方案vi
在方案vii中,在钯、镍或铜基催化剂存在下,用胺(rarbnh)处理中间体iv-8可以得到化合物vii-1(ruiz-castillo,p.和buchwald,s.l.chemicalreviews(2016),116,12564)。
方案vii
方案viii解释说明了高级中间体(advancedintermediate)viii-7的制备。中间体viii-6可以使用方案i中所述的方法合成。然后可以用合适的氧化剂例如kmno4处理中间体viii-6,以形成羧酸viii-7。
方案viii
可以根据方案ix中提供的方法合成本发明的某些化合物。在方案ix中,可以使用方案i中所述的方法合成高级中间体ix-6。然后可以在钯、镍、铜、铂、铁或钴的催化下,用适当的y-x(x=h、卤化物-zn、-mg、-b(oh)2、-b(oz)2、-snz3或-siz3(z=烷基或芳基))置换ix-6的溴原子,得到ix-7。可以通过在标准酰胺键形成条件下将ix-7与r1r2nh偶联来形成中间体ix-8。可以使用me3sih/tfa还原该中间体的呋喃环,或使用h2、pd/c氢化该中间体的呋喃环,以生成ix-9。
方案ix
如方案x至xiv所示,中间体viii-7可直接或通过初始修饰间接使用,以合成广泛的5-元环杂芳基。在方案x中,中间体viii-7可以在标准条件下酯化以提供甲酯x-1。此后,可以通过在高温下用肼处理x-1来合成相应的酰肼x-2。与x-3反应形成三唑类似物x-4。本领域技术人员将理解,可以使用各种方案将viii-7的羧酸基团直接或间接转化为三唑环。实例包括在castendo,g.m.j.org.chem.,(2011)76,1177;bechara,w.s.org.lett.(2015),17,1184和nakka,m.synthesis(2015),47,517中描述的那些。
方案x
方案xi说明了x-2与适当取代的异氰酸酯(ynco)形成中间体xi-1的反应。可以使用类似于gauther,d.r.organicletters(2015),17,1353中所述的条件,将该中间体转化为相应的产物xi-2。
方案xi
也可以由中间体x-2获得1,3,4-噁二唑例如xii-2。一种方法是用适当活化的羧酸(ycocl或((yco)2o)处理x-2以形成xii-1。然后,可以通过用burgess试剂(n-(三乙基铵磺酰基)氨基甲酸甲酯)处理xii-1来形成1,3,4-噁二唑环。在另一种方法中,在pocl3存在下,在升高的温度下中间体x-2与羧酸(ycooh)反应生成xii-2。1,3,4-噁二唑也可以使用kumar,d.synlett(2014),25,1137和yu,w.j.org.chem.(2013),78,10337中描述的方法容易地获得。
方案xii
1,2,4-噁二唑的合成如方案xiii所示。根据该方法,将中间体viii-7转化为相应的乙基-酯xiii-1,其用于形成酰胺xiii-2。然后使用三氟乙酸酐和三乙胺将酰胺转化为xiii-3。加成羟基胺提供xiii-4,在吡啶存在下,在升高的温度下,通过用适当的酰氯(ycocl)处理,可将xiii-4转化为xiii-5。可以使用其他途径合成xiii-5的噁二唑基团,包括augustine,j.k.thejournaloforganicchemistry(2009),74,5640。
方案xiii
方案xiv说明了将羧酸viii-7转化为相应的咪唑衍生物xiv-2的方法。在第一步中,将viii-7与适当取代的氨基酮偶联以形成中间体xiv-1。通过在合适的胺(znh2)和乙酸的存在下在高温下加热xiv-1可以形成xiv-2的咪唑环。通过在合适的胺(znh2)和乙酸的存在下在高温下加热xiv-1可形成xiv-2的咪唑环。
方案xiv
在方案xv中,中间体xv-4的合成可以通过将氨基酮xv-3与viii-7偶联来完成。然后可以用lawesson试剂(五硫化磷)处理中间体xv-4,得到噻唑xv-5。
方案xv
可以根据方案xvi中说明的方法合成本发明的某些化合物。由酮xvi-1开始,中间体xvi-10可以根据方案i中所述的方法合成。xvi-10的boc保护基可通过酸处理(三氟乙酸、hcl等)除去以提供xvi-11。然后可以通过用合适的烷基化剂r-x(x=卤化物、ots、oms或otf)和碱处理xvi-11来制备最终产物xvi-12。
方案xvi
手性分离的方法
化合物的单个对映异构体的分离可以使用以下一种或多种色谱方法,如下所述的分离方法a、分离方法b和分离方法c来完成。在以下实施例中,第一个洗脱的化合物称为异构体i,而第二个洗脱的化合物称为异构体ii。
分离方法a
柱:ymcchiralamylose-sa,250mmx20mm,5微米
流动相:
a:正己烷+0.1%dea
b:dcm:meoh(1:1)
等度(isocratic):30-90%b
流速:18ml/min
分离方法b
柱:diacelchiralpack-ia,250mmx20mm,5微米
流动相:
a:正己烷+0.1%dea
b:dcm:meoh(1:1)
梯度:保持50%b直至4分钟,然后在5分钟时100%b并保持15分钟
流速:18ml/min
分离方法c
柱:chiralpack-ia,250mmx30mm,5微米
流动相:
a:正己烷+0.1%dea
b:dcm:meoh(1:1)
等度:30-90%b
流速:30ml/min
手性纯度测定
化合物的手性纯度水平的分析可以使用下述一种或多种色谱方法手性纯度法a、手性纯度法b和手性纯度c来评估。
手性纯度法a
柱:ymcchiralamylose-sa,250mmx4.6mm,5微米
流动相:
a:正己烷+0.1%dea
b:dcm:meoh(1:1)
等度:30-90%b
流速:1ml/min
手性纯度法b
柱:ymcchiralartcellulose-sc,250mmx4.6mm,5微米
流动相:
a:正己烷+0.1%dea
b:dcm:meoh(1:1)
等度:30-90%b
流速:1ml/min
手性纯度法c
柱:chiralpack-ia,250mmx4.6mm,5微米
流动相:
a:正己烷+0.1%dea
b:dcm:meoh(1:1)
等度:30-90%b
流速:30ml/min
通用合成方法
方法a
在氩气气氛下,于-78℃下,向搅拌下的无水thf(10体积/克甲基酮)中的1当量甲基酮(i-1)溶液中加入六甲基二硅基氨基锂(1m的thf溶液,1.3当量)。将该混合物搅拌1小时,然后滴加溶解在无水thf(5体积/克草酸二甲酯)中的草酸二甲酯(1.5当量),并将所得反应混合物在室温搅拌过夜。完成后,将混合物在减压下浓缩。用水稀释该残余物,并通过过滤收集所得物。该固体用乙酸乙酯洗涤,然后用乙醚洗涤,并在减压下干燥。该生成的二酮酯(i-3)无需进一步纯化即可用于下一步骤。
方法b
在可密封的管中,将搅拌下的1当量的2,4-二酮酯i-3和1当量的磺酰胺(sulfuricdiamide)在meoh(10体积/克2,4-二酮酯)中的溶液在0℃下用hcl气体吹扫2小时。将该管密封,并将反应在80℃下搅拌24小时。完成后,将反应混合物冷却至0℃,并将所得沉淀的固体过滤,用水、冷的甲醇洗涤,然后真空干燥,得到2h-1,2,6-噻二嗪1,1-二氧化物,i-4。
方法c
在装有回流冷凝器的圆底烧瓶中,将2,4-二酮酯i-3(1当量)和磺酰胺(1当量)溶于4n的hcl甲醇溶液(10体积/克i-3)中。将得到的反应混合物在60℃下搅拌16小时,然后冷却至0℃,以形成沉淀。过滤沉淀的固体,用水然后用乙醚洗涤,真空干燥,得到2h-1,2,6-噻二嗪1,1-二氧化物,i-4。
方法d
在ar气氛下,于0℃下,向搅拌下的无水dmf(8体积/克2h-1,2,6-噻二嗪1,1-二氧化物,i-4)中的2h-1,2,6-噻二嗪1,1-二氧化物,i-4(1当量)溶液中加入nah(60%w/w在矿物油中,1.5当量),并将所得混合物在0℃下搅拌45分钟。缓慢加入mei(1.1当量),并将所得反应混合物在室温搅拌12小时。完成后,将反应混合物用冰冷的水稀释;得到固体,将其通过过滤收集。将固体用乙醚洗涤,并真空干燥,经硅胶柱色谱法后得到2-甲基-2h-1,2,6-噻二嗪1,1-二氧化物,i-5。
方法e
在ar气氛下,于0℃下,向搅拌下的无水thf(4体积/克2h-1,2,6-噻二嗪1,1-二氧化物,i-4)中的2h-1,2,6-噻二嗪1,1-二氧化物,i-4(1当量)溶液中加入三苯基膦(2当量)和甲醇(10当量)。将该溶液在0℃下搅拌15分钟。向该溶液中加入偶氮二甲酸二乙酯或偶氮二甲酸二异丙酯(2当量),并将得到的反应混合物在室温搅拌16小时。完成后,将反应混合物在真空下浓缩,并将所得残余物溶于乙醚中。将悬浮液搅拌30分钟,并通过过滤分离固体。将该固体在甲醇中搅拌30分钟,过滤并真空干燥,得到2-甲基-2h-1,2,6-噻二嗪1,1-二氧化物,i-5。该中间体可以通过柱色谱法进一步纯化。
方法f
在ar气氛下,于0℃下,向搅拌下的二氯甲烷或甲苯中的hn1r2(3当量)溶液中加入alme3(2m的甲苯溶液,3当量),并将反应混合物在0℃下搅拌10分钟。使反应温热至室温,并继续搅拌1小时。在0℃和ar气氛下,向该溶液中加入2-甲基-2h-1,2,6-噻二嗪1,1-二氧化物,i-5(1当量)。将所得混合物加热至回流并搅拌过夜。完成后,将反应混合物冷却至0℃,然后通过加入1nhcl缓慢淬灭。将该混合物用二氯甲烷萃取,收集合并的有机层,用无水硫酸钠干燥并真空浓缩。将该粗制的化合物经硅胶柱色谱法纯化,然后用乙醚研磨,得到中间体i-7。
方法g
在0℃下,向1:1ch3cn:h2o(10体积/克2-甲基-2h-1,2,6-噻二嗪1,1-二氧化物,i-5)中的2-甲基-2h-1,2,6-噻二嗪1,1-二氧化物,i-5(1当量)溶液中加入三乙胺(5当量),搅拌所得反应混合物直至观察到澄清溶液(4-6小时)。完成后,将混合物减压浓缩,所得残余物用6nhcl处理,然后用乙酸乙酯萃取。将合并的有机层经无水硫酸钠干燥,过滤并减压浓缩,得到羧酸i-6,将其与乙醚一起研磨后用于下一步。在0℃下,向搅拌下的ch2cl2或dmf(10体积/克i-6)中的羧酸i-6(1当量)溶液中加入二异丙基乙胺(2当量)。搅拌15分钟后,加入1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓-3-氧化物六氟磷酸盐(2当量),继续搅拌15分钟,然后加入hnr1r2(1.2当量)。然后将反应混合物在室温搅拌过夜。完成后,将反应混合物用冰冷的水稀释,并用ch2cl2萃取。将合并的有机层经无水硫酸钠干燥,并减压浓缩,得到粗产物。将粗制的化合物溶于甲醇(10体积/克粗制的产物)中,搅拌15分钟,过滤并减压干燥,得到所需的化合物i-7。
方法h
在ar气氛下,于0℃下,向搅拌下的etoh/meoh中的化合物中间体i-7(1当量)溶液中加入nabh4(2当量),并将该反应在室温下搅拌1-2小时。完成后,将反应混合物真空浓缩,所得残余物用水稀释并用乙酸乙酯萃取。收集合并的有机层,用无水硫酸钠干燥,过滤,真空浓缩,并通过硅胶柱色谱法纯化,得到i-9。
方法i
将溴取代的化合物(1当量)、硼酸/硼酸酯(1当量)在1,4-二噁烷中的溶液和2.5当量2m磷酸钾溶液的混合物用ar吹扫15分钟,然后加入四(三苯基膦)合钯(0.06当量),并将该反应在90℃下搅拌过夜。完成后,将反应混合物通过硅藻土过滤并蒸发至干。将残余物溶于乙酸乙酯中,用水然后用盐水洗涤,然后用无水硫酸钠干燥,并在减压下除去溶剂。将该粗产物通过柱色谱法或制备型hplc纯化,得到iv-9。
方法j
将5-(3-溴苯基)-n-(3-氯-4-氟苯基)-2-甲基-2h-1,2,6-噻二嗪-3-甲酰胺1,1-二氧化物(1当量)、hnrarb(1.2eq)在dmso(10体积/克5-(3-溴苯基)-n-(3-氯-4-氟苯基)-2-甲基-2h-1,2,6-噻二嗪-3-甲酰胺1,1-二氧化物)中的溶液、k3po4(3eq)、cui(0.2eq)和l-脯氨酸(0.4eq)的混合物用ar吹扫15分钟。然后将反应混合物在80℃下搅拌过夜。完成后,将反应混合物真空浓缩,将所得残余物用水稀释并用乙酸乙酯萃取。收集合并的有机层,用无水硫酸钠干燥,过滤,真空浓缩,并通过硅胶柱色谱法纯化,得到vii-1。
中间体1–6
表1中的化合物是根据标题为“方法”栏中列出的方法合成的。
表1.
中间体7-8
使用方法f,由5-(3-溴苯基)-2-甲基-2h-1,2,6-噻二嗪-3-甲酸甲酯1,1-二氧化物和甲醇合成表2中的中间体7。通过外消旋中间体7的手性分离将中间体8和9进行分离。
表2.
中间体10
n-(3-氯-4-氟苯基)-2-甲基-5-(3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)-1,2,6-噻二嗪烷-3-甲酰胺1,1-二氧化物.向5-(3-溴苯基)-n-(3-氯-4-氟苯基)-2-甲基-2h-1,2,6-噻二嗪-3-甲酰胺1,1-二氧化物(3g,6.29mmol)和双(频哪醇合)二硼(1.91g,7.54mmol)在1,4-二噁烷(30ml)中的混合物中加入乙酸钾(1.82g,18.87mmol),并将混合物用ar吹扫15分钟。向其中添加[1,1′-双(二苯基膦基)二茂铁]二氯化钯(ii)ch2cl2络合物,pdcl2(dppf)-ch2cl2,(0.506g,0.629mmol),将反应混合物在90℃下搅拌过夜。完成后,将反应混合物通过硅藻土垫过滤并蒸发至干。将残余物用水稀释并用乙酸乙酯萃取。将合并的有机层经无水硫酸钠干燥,并减压浓缩,得到2.12克标题化合物,将其用戊烷和乙醚研磨后用于下一步。
实施例的立体化学:
根据hbv-csu-016异构体i的晶体结构测定,指定所有其他组对映异构体的绝对立体化学。在每种情况下,该对立体异构体中的一种具有明显更高的活性,并被指定与hbv-csu-016-异构体-i具有相同的绝对立体化学(3s,5r)。
方案xii中说明了hbv-csu-016异构体i的合成。高级中间体(advancedintermediate)xii-6是使用上面提供的和方案中列出的一般合成方法合成的。通过手性色谱法分离hbv-csu-016异构体i。
方案xii
中间体xii-2
2,4-二氧代-4-(噻吩-2-基)丁酸甲酯.tlc:10%meoh/dcm(rf:0.1);1hnmr(dmso-d6,400mhz):δ7.68(d,j=5.2hz,1h),7.61(d,j=4.4hz,1h),7.10(t,j=5.2hz,1h),6.34(s,1h),3.69(s,3h);lcms计算值c9h8o4s:212.01;观测值:212.95(m+1).
中间体xii-3
5-(噻吩-2-基)-2h-1,2,6-噻二嗪-3-甲酸甲酯1,1-二氧化物.tlc:20%meoh/dcm(rf:0.1);1hnmr(dmso-d6,400mhz):δ11.50(br.s,1h),8.06(d,j=4.0hz,1h),7.93(d,j=5.2hz,1h),7.23(t,j=4.0hz,1h),6.99(s,1h),3.87(s,3h);lcms计算值c9h8n2o4s2:271.99;lcms观测值:272.85(m+1).
中间体xii-4
2-甲基-5-(噻吩-2-基)-2h-1,2,6-噻二嗪-3-甲酸甲酯1,1-二氧化物.tlc:40%etoac/己烷(rf:0.4);1hnmr(dmso-d6,400mhz):δ8.23(d,j=4.0hz,1h),8.10(d,j=4.8hz,1h),7.32-7.30(m,2h),3.94(s,3h),3.50(s,3h);lcms计算值c10h10n2o4s2:286.01;lcms观测值:286.94(m+1).
中间体xii-5
n-(3-溴-4-氟苯基)-2-甲基-5-(噻吩-2-基)-2h-1,2,6-噻二嗪-3-甲酰胺1,1-二氧化物.1h-nmr(dmso-d6,400mhz):δ11.29(s,1h),8.25(d,j=3.6hz,1h),8.11-8.09(m,2h),7.71-7.67(m,1h),7.47(t,j=8.0hz,1h),7.34-7.32(m,1h),7.19(s,1h),3.45(s,3h).lcms计算值c15h11brfn3o3s2:442.94;lcms观测值:445.65(m+2)
中间体xii-6
n-(3-溴-4-氟苯基)-2-甲基-5-(噻吩-2-基)-1,2,6-噻二嗪烷-3-甲酰胺1,1-二氧化物.1h-nmr(dmso-d6,400mhz):δ10.55(s,1h),8.10(dd,j=6.4,2.6hz,1h),7.71-7.54(m,2h),7.52(d,j=5.3hz,1h),7.37(t,j=8.8hz,1h),7.15-7.14(m,1h),7.03-7.01(m,1h),4.85-4.74(m,1h),4.30(dd,j=11.7,3.0hz,1h),2.61(s,3h),2.29-2.08(m,2h).lcms计算值c15h15brfn3o3s2:446.97;lcms观测值:449.90(m+1)
hbv-csu-016异构体i
(3s,5r)-n-(3-溴-4-氟苯基)-2-甲基-5-(噻吩-2-基)-1,2,6-噻二嗪烷-3-甲酰胺1,1-二氧化物.1h-nmr(dmso-d6,400mhz):δ10.55(s,1h),8.09-8.06(m,1h),7.68-7.66(m,1h),7.62-7.58(m,1h),7.51-7.49(m,1h),7.36(t,j=8.8hz,1h),7.14-7.13(m,1h),7.02-7.00(m,1h),4.80-4.76(m,1h),4.29-4.25(m,1h),2.60(s,3h),2.31-2.08(m,2h).lcms计算值c15h15brfn3o3s2:446.97;lcms观测值:449.90(m+1)
hbv-csu-016异构体i的单晶x射线结构
hbv-csu-016-异构体-i的晶体结构如图1所示。位移椭圆体以30%的概率水平绘制,h原子显示为任意半径的小球体。虚线表示氢键。hbv-csu-016-异构体-i的晶体数据和结构精修如下:
使用platon计算机应用程序指定每个手性中心的绝对立体化学,如a.l.spek在j.appl.cryst.36,7-13,2003中所述。指定的手性中心是:
c(1a)手性:r
c(1b)手性:r
c(3a)手性:s
c(3b)手性:s
基于该晶体结构的确定,指定了所有其他组对映异构体的绝对立体化学。在每种情况下,该对立体异构体中的仅一种具有显著的活性,且该活性异构体被指定与hbv-csu-016-异构体-i具有相同的立体化学。
实施例1
n-(3-氯-4-氟苯基)-5-(呋喃-2-基)-2-甲基-1,2,6-噻二嗪烷-3-甲酰胺1,1-二氧化物.通过方法h由n-(3-氯-4-氟苯基)-5-(呋喃-2-基)-2-甲基-2h-1,2,6-噻二嗪-3-甲酰胺1,1-二氧化物(中间体7)合成标题化合物,得到5.7g(70.54%,产率)的白色固体产物。tlc:50%etoac/己烷(rf:0.7);1hnmr(dmso-d6,400mhz):δ10.55(s,1h),7.97(dd,j=6.9,2.6hz,1h),7.66(s,1h),7.63-7.51(m,2h),7.40(t,j=9.1hz,1h),6.46-6.45(m,2h),4.65-4.64(m,1h),4.30-4.26(m,1h),2.60(s,3h),2.23-2.02(m,2h);lcms计算值c15h15clfn3o4s;387.05.实测值:387.90(m+1).
中间体11
顺式-5-((3-氯-4-氟苯基)氨基甲酰基)-6-甲基-1,2,6-噻二嗪烷-3-甲酸1,1-二氧化物向搅拌下的n-(3-氯-4-氟苯基)-5-(呋喃-2-基)-2-甲基-1,2,6-噻二嗪烷-3-甲酰胺1,1-二氧化物(5.6g,14.43mmol)的丙酮:水(1:1,200ml)溶液中缓慢地加入kmno4(15.96g,101.01mmol)(观察到放热),并将混合物在60℃加热3小时。此后,将反应混合物冷却至环境温度,并添加异丙醇(100ml)。将该混合物搅拌18小时,然后通过硅藻土垫过滤,并用异丙醇洗涤。蒸发滤液,将残余物溶于1nnaoh中,溶液用乙醚洗涤。用1nhcl酸化该碱性层,并加入固体nacl。将得到的悬浮液用乙酸乙酯萃取。收集有机萃取物,用无水硫酸钠干燥并真空浓缩。该固体用ch2cl2洗涤并真空干燥,得到3克标题化合物(57.03%),为白色固体。1hnmr(400mhz,dmso-d6):δ13.00(br.s,1h),10.52(s,1h),7.95(dd,j=6.8,2.4hz,1h),7.57-7.52(m,1h),7.41-7.36(m,2h),4.25-4.21(m,1h),4.15-4.10(m,1h),2.55(s,3h),2.07-2.03(m,1h),1.96-1.86(m,1h).lcms计算值c12h13clfn3o5s;365.02.实测值;366(m+1.)
实施例2-18
表3中的化合物是使用方法i中所述的方法,由5-(3-溴苯基)-n-(3-氯-4-氟苯基)-2-甲基-1,2,6-噻二嗪烷-3-甲酰胺1,1-二氧化物(中间体7)和容易获得的硼酸或硼酸酯合成。使用手性分离方法从外消旋母体中分离出异构体i和ii。或者,可以使用方法i由中间体8和中间体9直接合成异构体i和ii。
表3.
实施例19
表4中的化合物是通过将3'-(5-((3-氯-4-氟苯基)氨基甲酰基)-6-甲基-1,1-二氧代-1,2,6-噻二嗪烷-3-基)-[1,1'-联苯]-3-甲酸甲酯的甲酯皂化,然后进行手性分离而合成的,从而得到异构体i和异构体ii。
表4.
实施例20-22
表5中的化合物是使用方法i中所述的方法,由n-(3-氯-4-氟苯基)-2-甲基-5-(3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)-1,2,6-噻二嗪烷-3-甲酰胺1,1-二氧化物(中间体10)和容易获得的溴取代的衍生物合成。
表5.
实施例23-27
表6中的化合物是使用方法j中所述的方法,由5-(3-溴苯基)-n-(3-氯-4-氟苯基)-2-甲基-1,2,6-噻二嗪烷-3-甲酰胺1,1-二氧化物(中间体7)和容易获得的含胺杂环或杂芳基反应物合成的。使用手性分离方法由外消旋母体化合物分离出异构体i和ii。或者,可以使用方法j由中间体8和中间体9直接合成异构体i和ii。
表6.
实施例28-39
使用上述方法合成表7中的化合物。
表7.
生物学方法
测量测试化合物对hepad38细胞产生病毒的活性的测定
将在具有生长培养基(dmem/f12(1:1)(hyclone,目录号:sh30023.02)、1xpen/strep(invitrogen,目录号:15140-122)、10%fbs(tissueculturebiologics,目录号:101)、250μg/mlg418(alfaaesar,目录号:j62671)、1μg/ml四环素(teknova,目录号:t3320))的t-150烧瓶(corning,目录号:430825)中生长的hepad38细胞用0.25%胰蛋白酶-edta(invitrogen,目录号:25200-056)分离。然后向混合物加入无四环素的处理培养基(15mldmem/f12(1:1),1xpen/step,具有2%fbs,tet-系统批准(clontech,目录号:631106),转移至50ml锥形管(falcon,目录号:21008-918),并以1300rpm旋转5分钟。然后将沉淀的细胞用50ml1xdpbs(invitrogen,目录号:14190-136)重悬/洗涤2次,并用50ml处理培养基重悬/洗涤两次。然后将hepad38细胞重悬于10ml处理培养基中,注射并计数。然后以50,000个细胞/孔接种96孔透明底部tc板的孔(corning,目录号:3904),该细胞在180μl处理培养基中,并加入20μl作为对照的10%dmso(sigma,目录号:d4540),或测试化合物在10%dmso的处理培养基溶液中的10x溶液,使最终化合物的浓度从10μm开始,并将板在5%co2培养箱中于37℃培养5天。
随后,通过hbv核心序列的定量pcr(qpcr)测定病毒载量生产。制备pcr反应混合物,其包含正向引物hbv-f5'-ctgtgccttgggtggcttt-3’(idtdna)、反向引物hbv-r5'-aaggaaagaagtcagaaggcaaaa-3'(idtdna)、荧光taqmantm探针hbv-探针5′-fam/agctccaaa/zen/ttctttataagggtcgatgtc/3iabkfq-3′(idtdna)、10μl/孔
表8给出了降低病毒载量的ec50值,分为以下范围:a表示ec50<1μm;b表示ec501-5μm;c表示5<ec50<10μm。
表8.
通过引用并入
本文提及的所有出版物和专利,包括下面列出的那些项目,出于所有目的全部引入本文作为参考,就如同每个单独的出版物或专利通过参考被明确和单独地并入本文。在冲突的情况下,以本申请,包括本文的任何定义为准。
等效内容
虽然已经讨论了本发明的具体实施方案,但是上述说明书是说明性的而非限制性的。本领域技术人员在阅读完本发明后将理解本发明的许多变化。本发明的全部范围应通过参考权利要求书、连同它们等效内容的全部范围,以及说明书、连同这种变化进行确定。
除非另外提及,在说明书和权利要求中所用的表示成分的量、反应条件等的所有数值应理解为在所有情况下用术语“约”进行修饰。因此,除非有相反地指示,在本说明书和所附权利要求中所提及的数值参数是近似值,其可根据本发明寻求获得的所需性质而变化。
- 还没有人留言评论。精彩留言会获得点赞!