一种用于直接分化多能性干细胞来源间充质干细胞的培养基、用其制备间充质干细胞的方法以及由此制备的间充质干细胞与流程
本发明涉及一种直接分化多能性干细胞,例如胚胎干细胞来源间充质干细胞的培养基、用其制备间充质干细胞的方法、由此制备的间充质干细胞以及包括其的细胞治疗剂。
背景技术:
作为使用人胚胎干细胞制备间充质干细胞的现有技术,有一种在形成胚状体后处理tgf-β抑制剂14天的制备方法。tgf-β抑制剂的处理是为了通过抑制胚状体的内胚层系细胞分化来容易确保中胚层系细胞而实施的。另外,通常在用人胚胎干细胞制备间充质干细胞时使用的tgf-β抑制剂中,sb431542的处理量为10μm以上。在tgf-β抑制剂中,用1μm以上的sb431542处理具有抑制内胚层系分化所需的转录因子的活性并增加中胚层系分化所需的转录因子的活性的作用。另外,在不经过胚状体的直接分化方法中,也存在通过用tgf-β抑制剂之一的sb431542处理诱导分化的情况,但据报道,在大多数情况下,在10μm以上的高浓度下需要11天以上的药物处理期间。因此,根据现有报道的方法制备的间充质干细胞需要长时间才可以表现出高含量的中胚层特性。此外,即使形成大小和形状均一的胚状体以使用,由于构成胚状体的内部和外部的细胞中微环境的差异,所处理药物的效果也可能不均匀,因此可以存在会影响分化效率和分化细胞性质的技术不稳定性问题。
据此,尽管其是基于细胞的增殖现象制备的生物学治疗剂,但其制备过程中并未采取任何预防或补充措施来防止可能由增殖现象引起的细胞衰老和突变的风险,因此需要解决该问题的技术方案。
技术实现要素:
技术问题
本发明一方面提供一种用于诱导多能性干细胞分化为间充质干细胞的培养基组合物,其包括dna修复剂(dnarepairagent)和rock(rho-associated,coiled-coilcontainingproteinkinase)抑制剂。
本发明另一方面提供一种dna修复剂(dnarepairagent)和rock(rho-associated,coiled-coilcontainingproteinkinase)抑制剂在制备用于诱导多能性干细胞分化为间充质干细胞的培养基组合物中的用途。
本发明另一方面还提供一种多能性干细胞来源间充质干细胞的制备方法,其包括:培养已分离的多能性干细胞;以及将所述培养的多能性干细胞在含有dna修复剂(dnarepairagent)和rock(rho-associated,coiled-coilcontainingproteinkinase)抑制剂的培养基中培养以诱导分化为间充质干细胞。
本发明另一方面还提供一种在dna修复剂(dnarepairagent)和rock(rho-associated,coiled-coilcontainingproteinkinase)抑制剂的存在下诱导分化的多能性干细胞来源间充质干细胞。
本发明另一方面还提供一种细胞治疗剂,其包括所述多能性干细胞来源间充质干细胞。
本发明另一方面还提供一种所述多能性干细胞来源间充质干细胞在制备细胞治疗剂中的用途。
本发明另一方面还提供一种疾病的治疗方法,所述方法包括:将所述多能性干细胞来源间充质干细胞施用于个体。
技术方案
本发明一方面提供一种用于诱导多能性干细胞分化为间充质干细胞的培养基组合物,其包括dna修复剂(dnarepairagent)和rock(rho-associated,coiled-coilcontainingproteinkinase)抑制剂。
本发明另一方面提供一种dna修复剂(dnarepairagent)和rock(rho-associated,coiled-coilcontainingproteinkinase)抑制剂在制备用于诱导多能性干细胞分化为间充质干细胞的培养基组合物中的用途。
在本说明书中,“多能性干细胞”是指可以自我更新(具有在保持未分化状态下通过多个细胞分裂周期的能力)并表现出一种以上的多分化能(分化为至少一种专门细胞的性能)的细胞。间充质干细胞(msc,mesenchymalstemcell)为一种多分化能干细胞,其具有分化成各种中胚层细胞或如神经细胞的外胚层细胞的能力,所述中胚层细胞包括骨骼、软骨、脂肪和肌肉细胞。所述多能性干细胞为核移植人多能性干细胞(nt-hpsc)、孤雌生殖体来源多能性干细胞(pn-hpsc)、诱导多能性干细胞(ipsc)或胚胎干细胞(esc)。
在本发明中,“体细胞”是指除生殖细胞或其前体以外的体内任何组织细胞。
本文所用的“成熟”是指由向最终分化的细胞类型引导的协调的生化步骤组成的过程。
本文所用的“分化”是指细胞适应特定形式或功能。
本文所用的“分化的细胞”包括以其原始形式不具有多能性的任何体细胞,如本文所定义。因此,术语“分化的细胞”还包括部分分化的细胞,例如多分化能细胞,或使用本文所述的任何组合物和方法产生的稳定的非多能性部分重编程或部分分化的细胞。在一些实施方案中,分化的细胞为稳定的中间细胞,例如非多能性、部分重编程的细胞。应注意,将许多原代细胞置于培养物中可导致完全分化特性受到一些损失。因而,简单地培养此类分化的或体细胞不会使得这些细胞变成非分化的细胞(例如,未分化细胞)或多能性细胞。分化的细胞(包括稳定的非多能性部分重编程的细胞中间体)向全能性的转变需要超过导致在置于培养物中时分化的特性部分丧失的刺激的重编程刺激。与亲本细胞相比,重编程的、在一些实施方案中部分重编程的细胞还具有经受延长的传代培养的能力而不丧失生长潜力的特性,所述亲本细胞通常具有较低的发育潜能,仅能在培养物中进行有限数量的分裂。在一些实施方案中,术语“分化的细胞”还指由特化程度较低的细胞类型(即,发育潜能增加)(例如,未分化细胞或重编程的细胞)的细胞(其中,细胞经受细胞内分化过程)衍生出的特化程度较高的细胞类型(即,发育潜能减少)的细胞。具体地,在本说明书中,其可以选自造血干细胞、肌肉细胞、心肌细胞、肝细胞、软骨细胞、上皮细胞、泌尿系统细胞、脂肪细胞、肾细胞、血管细胞、视网膜细胞、间充质干细胞(msc)和神经元细胞。
根据一具体实施例,所述dna修复剂可以为增加rad51活性的物质(rad51激活剂)。所述rad51激活剂可以为3-[(苄基氨基)磺酰基]-4-溴-n-(4-溴苯基)苯甲酰胺(3-[(benzylamino)sulfonyl]-4-bromo-n-(4-bromophenyl)benzamide)或4-溴-n-(4-溴苯基)-3-[[(苯基甲基)氨基]磺酰基]-苯甲酰胺(4-bromo-n-(4-bromophenyl)-3-[[(phenylmethyl)amino]sulfonyl]-benzamide)。所述dna修复剂可以以5μm至25μm、5μm至20μm、6μm至18μm、8μm至15μm或8μm至12μm的浓度包括。rad51激活剂可以具有通过保持具修复受损dna的功能的rad51蛋白与ssdna(singlestranddna)或dsdna(doublestranddna)的结合稳定性来增加rad51蛋白的活性以维持dna修复效果的功能。因此,不受特定理论的限制,通过处理从多能性干细胞分化为中胚层干细胞的rad51激活剂,可以延迟由于细胞增殖和重复传代而引起的突变概率以及细胞衰老的发生时间以制备具有遗传安全性的细胞治疗剂。
根据一具体实施例,所述rock抑制剂可以为选自法舒地尔(fasudil)、利帕舒地尔(ripasudil)、4-((r)-1-氨乙基)-n-(吡啶-4-基)环己甲酰胺(4-((r)-1-aminoethyl)-n-(pyridin-4-yl)cyclohexanecarboxamide)、4-(1-氨乙基)-n-(1h-吡咯并(2,3-b)吡啶-4-基)环己甲酰胺二盐酸盐(4-(1-aminoethyl)-n-(1h-pyrrolo(2,3-b)pyridin-4-yl)cyclohexanecarboxamidedihydrochloride)、n-(6-氟-1h-吲唑-5-基)-1,4,5,6-四氢-2-甲基-6-氧代-4-[4-(三氟甲基)苯基]-3-吡啶甲酰胺(n-(6-fluoro-1h-indazol-5-yl)-1,4,5,6-tetrahydro-2-methyl-6-oxo-4-[4-
(trifluoromethyl)phenyl]-3-pyridinecarboxamide),以及1-(3-羟基苄基)-3-[4-(吡啶-4-基)噻唑-2-基]脲(1-(3-hydroxybenzyl)-3-[4-(pyridin-4-yl)thiazol-2-yl]urea)、2-甲基-1-[(4-甲基-5-异喹啉基)磺酰基]-六氢-1h-1,4-二氮杂卓二盐酸盐(2-methyl-1-[(4-methyl-5-isoquinolinyl)sulfonyl]-hexahydro-1h-1,4-diazepinedihydrochloride)、n-[2-[2-(二甲氨基)乙氧基]-4-(1h-吡唑-4-基)苯基-2,3-二氢-1,4-苯并二噁烷-2-甲酰胺二盐酸盐(n-[2-[2-(dimethylamino)ethoxy]-4-(1h-pyrazol-4-yl)phenyl-2,3-dihydro-1,4-benzodioxin-2-carboxamidedihydrochloride])、2-氟-n-[[4-(1h-吡咯并[2,3-b]吡啶-4-基)苯基]甲基]苯甲胺二盐酸盐(2-fluoro-n-[[4-(1h-pyrrolo[2,3-b]pyridin-4-yl)phenyl]methyl]benzenemethanaminedihydrochloride)、n-[3-[[2-(4-氨基-1,2,5-恶二唑-3-基)-1-乙基-1h-咪唑并[4,5-c]吡啶-6-基]氧]苯基]-4-[2-(4-吗啉基)乙氧基]苯甲酰胺(n-[3-[[2-(4-amino-1,2,5-oxadiazol-3-yl)-1-ethyl-1h-imidazo[4,5-c]pyridin-6-yl]oxy]phenyl]-4-[2-(4-morpholinyl)ethoxy]benzamide)、(3s)-1-[[2-(4-氨基-1,2,5-恶二唑-3-基)-1-乙基-1h-咪唑并[4,5-c]吡啶-7-基]羰基]-3-吡咯烷胺二盐酸盐((3s)-1-[[2-(4-amino-1,2,5-oxadiazol-3-yl)-1-ethyl-1h-imidazo[4,5-c]pyridin-7-yl]carbonyl]-3-pyrrolidinaminedihydrochloride)、n-[(1s)-2-羟基-1-苯基乙基]-n'-[4-(4-吡啶基)苯基]-脲(n-[(1s)-2-hydroxy-1-phenylethyl]-n'-[4-(4-pyridinyl)phenyl]-urea)、氮杂吲哚-1(azaindole-1),以及水仙环素(narciclasine)中的任何一种。所述rock抑制剂可以以5μm至25μm、5μm至20μm、6μm至18μm、8μm至15μm或8μm至12μm的浓度包括。rock抑制剂在细胞治疗剂开发中的功能可以为在分子生物学上活性rho蛋白诱导的中间丝(intermediatefilament)断裂效果、肌动蛋白-膜连接(actin-membranelinkage)效果、胞凋亡机制激活效果以及同时抑制可由重复传代引起的细胞衰老相关标志物p16和p21表达的诱导的功能。基于这些功能,rock抑制剂具有抑制由于细胞分化过程中可能发生的快速物质代谢变化而引起的细胞应激增加以及延迟细胞衰老效果。因此,不受特定理论的限制,通过重新调整rock抑制剂的适当处理量和处理时间,可以提高分化为中胚层干细胞的稳定性和效率。
在另一具体实施例中,所述培养基组合物可以进一步包括tgf-β抑制剂。所述tgf-β抑制剂为可以选自4-{4-[3-(吡啶-2-基)-1h-吡唑-4-基]-吡啶-2-yl}-n-(四氢-2h-吡喃-4-基)苯甲酰胺水合物(4-{4-[3-(pyridin-2-yl)-1h-pyrazol-4-yl]-pyridin-2-yl}-n-(tetrahydro-2h-pyran-4-yl)benzamidehydrate)、4-[3-(2-吡啶基)-1h-吡唑-4-基]-喹啉(4-[3-(2-pyridinyl)-1h-pyrazol-4-yl]-quinoline)、2-[3-(6-甲基-2-吡啶基)-1h-吡唑-4-基]-1,5-萘啶(2-[3-(6-methyl-2-pyridinyl)-1h-pyrazol-4-yl]-1,5-naphthyridine)、4-(5-苯并[1,3]二氧杂环戊烯-5-基-4-吡啶-2-基-1h-咪唑-2-基)-苯甲酰胺水合物(4-(5-benzol[1,3]dioxol-5-yl-4-pyridin-2-yl-1h-imidazol-2-yl)-benzamidehydrate)、4-[4-(1,3-苯并二氧杂环戊烯-5-基)-5-(2-吡啶基)-1h-咪唑-2-基]-苯甲酰胺水合物(4-[4-(1,3-benzodioxol-5-yl)-5-(2-pyridinyl)-1h-imidazol-2-yl]-benzamidehydrate),以及4-[4-(3,4-亚甲二氧苯基)-5-(2-吡啶烷基)-1h-咪唑-2-基]-苯甲酰胺水合物(4-[4-(3,4-methylenedioxyphenyl)-5-(2-pyridyl)-1h-imidazol-2-yl]-benzamidehydrate)、3-(6-甲基-2-吡啶基)-n-苯基-4-(4-喹啉基)-1h-吡唑-1-硫代甲酯胺(3-(6-methyl-2-pyridinyl)-n-phenyl-4-(4-quinolinyl)-1h-pyrazole-1-carbothioamide)、2-(3-(6-甲基吡啶-2-基)-1h-吡唑-4-基)-1,5-萘啶(2-(3-(6-methylpyridine-2-yl)-1h-pyrazol-4-yl)-1,5-naphthyridine)、4-[3-(2-吡啶基)-1h-吡唑-4-基]-喹啉(4-[3-(2-pyridinyl)-1h-pyrazol-4-yl]-quinoline)、2-[4-(1,3-苯并二氧杂环戊烯-5-基)-2-(1,1-二甲基乙基)-1h-咪唑-5-yl]-6-甲基-吡啶(2-[4-(1,3-benzodioxol-5-yl)-2-(1,1-dimethylethyl)-1h-imidazol-5-yl]-6-methyl-pyridine)、2-(5-氯-2-氟苯基)-4-[(4-吡啶烷基)氨基]蝶啶(2-(5-chloro-2-fluorophenyl)-4-[(4-pyridyl)amino]pteridine)、6-[2-叔丁基-5-(6-甲基-吡啶-2-基)-1h-咪唑-4-基]-喹喔啉(6-[2-tert-butyl-5-(6-methyl-pyridin-2-yl)-1h-imidazol-4-yl]-quinoxaline)、4-{4-[3-(吡啶-2-基)-1h-吡唑-4-基]-吡啶-2-yl}-n-(四氢-2h-吡喃-4-基)苯甲酰胺水合物(4-{4-[3-(pyridin-2-yl)-1h-pyrazol-4-yl]-pyridin-2-yl}-n-(tetrahydro-2h-pyran-4-yl)benzamidehydrate)、4-[2-氟-5-[3-(6-甲基-2-吡啶基)-1h-吡唑-4-基]苯基]-1h-吡唑-1-乙醇(4-[2-fluoro-5-[3-(6-methyl-2-pyridinyl)-1h-pyrazol-4-yl]phenyl]-1h-pyrazole-1-ethanol)、3-[[5-(6-甲基-2-吡啶基)-4-(6-喹噁啉基)-1h-咪唑-2-基]甲基]苯甲酰胺(3-[[5-(6-methyl-2-pyridinyl)-4-(6-quinoxalinyl)-1h-imidazol-2-yl]methyl]benzamide)中的任何一种。所述tgf-β抑制剂可以以0.2μm至2.0μm、0.2μm至1.6μm、0.4μm至1.6μm、0.6μm至1.4μm、0.8μm至1.2μm或0.6μm至1.0μm的浓度处理。根据一具体实施例,当使用所述培养基组合物时,通过使用明显低于现有已报道的tgf-β抑制剂的治疗浓度的低浓度的tgf-β抑制剂,可以减少由高浓度的tgf-β抑制剂引起的副作用,并且即使使用低浓度的tgf-β抑制剂,也具有可获得高产率的中胚层干细胞的效果。
所述培养基可以为选自最小必需培养基(mem,minimalessentialmedium)、杜尔贝科改良伊格尔培养基(dmem,dulbeccomodifiedeaglemedium)、罗斯威尔帕克纪念研究所培养基(rpmi,roswellparkmemorialinstitutemedium)、角朊细胞无血清培养基(k-sfm,keratinocyteserumfreemedium)、伊思考夫改良杜尔贝科培养基(imdm、iscove'smodifieddulbecco'smedium)、f12和dmem/f12中的培养基。
另外,培养基可以包括等渗液中的中性缓冲液(例如磷酸盐和/或高浓度碳酸氢盐)和蛋白质营养素(例如血清,例如fbs(fetalbovineserum)、fcs(fetalcalfserum)、马血清、血清替代物、白蛋白或必需氨基酸和非必需氨基酸,例如谷氨酰胺、l-谷氨酰胺)。进一步地,可以包括脂质(脂肪酸、胆固醇、血清的hdl或ldl提取物)和在大多数此类保存液培养基中发现的其他成分(例如转铁蛋白、核苷或核苷酸、丙酮酸盐、以任何离子化形式或盐的糖源,例如葡萄糖,糖皮质激素,例如氢化可的松和/或还原剂,例如β-巯基乙醇)。
此外,为了防止细胞彼此粘附、粘附至容器壁或形成太大的束,培养基中包括抗结团剂(anti-clumpingagent),例如由invitrogen出售的(cat#0010057ae)可以是有益的。
其中,其可以包括以下至少一种其他添加剂:
干细胞因子(scf、steel因子)、使c-试剂盒二聚化的其他配体或抗体、以及相同信号路径的其他激活剂;其他酪氨酸激酶相关受体,例如用于血小板衍化生长因子(pdgf,platelet-derivedgrowthfactor)、巨噬细胞集落刺激因子、flt-3配体和血管内皮生长因子(vegf,vascularendothelialgrowthfactor)的受体的配体;增加环状amp浓度的因子,例如佛司可林(forskolin);诱导gp130的因子,例如lif或抑瘤素-m(oncostatin-m);造血生长因子,例如血小板生成素(tpo,thrombopoietin);变性生长因子,例如tgfβ1;神经营养素,例如cntf;抗生素,例如庆大霉素(gentamicin)、青霉素、链霉素。
除了所述成分以外,根据一具体实施例的培养基组合物可以进一步包括选自fbs(fetalbovineserum)、n-乙酰-l-半胱氨酸(nac,n-acetyl-l-cysteine)、非必需氨基酸(neaa,non-essentialaminoacid)、成纤维细胞增殖因子(bfgf)、胰岛素或胰岛素样因子、氢化可的松、地塞米松、碱性成纤维生长因子(bfgf,basicfibroblastgrowthfactor),硫酸乙酰肝素(heparansulfate)、2-巯基乙醇(2-mercaptoethanol)以及表皮生长因子(egf,epidermalgrowthfactor)中的至少一种成分。
根据一具体实施例的所述培养基组合物可以用于诱导多能性干细胞分化为间充质干细胞。具体地,所述培养基组合物可以在将培养后的多能性干细胞分化为间充质干细胞之后(例如,tgf-β抑制剂的处理),并在将所述中胚层细胞成熟分化为间充质干细胞之前使用。因此,所述培养基组合物可以在间充质干细胞的成熟分化之前用于未成熟间充质干细胞(中胚层细胞)的预处理。
另外,根据一具体实施例的所述培养基组合物可以为直接诱导分化培养基组合物。
本文所用的术语“直接分化(directdifferentiation)”是指在将多能性干细胞分化为间充质干细胞时,不形成胚状体,也不经过成血管细胞(hamangioblast),而以经过具有造血干细胞性质的未成熟间充质干细胞的形式分化为最终间充质干细胞。
本发明另一方面还提供一种多能性干细胞来源间充质干细胞的制备方法,其包括:培养已分离的多能性干细胞;以及将所述培养的多能性干细胞在含有dna修复剂(dnarepairagent)和rock(rho-associated,coiled-coilcontainingproteinkinase)抑制剂的培养基中培养以诱导分化为间充质干细胞。
具体地,所述方法可以包括:培养分离的多能干细胞;培养已分离的多能性干细胞;将所述培养的多能性干细胞分化为中胚层细胞(例如,在tgf-β抑制剂存在的情况下);将所述中胚层细胞在含有dna修复剂(dnarepairagent)和rock(rho-associated,coiled-coilcontainingproteinkinase)抑制剂的培养基中培养以诱导分化为间充质干细胞(可与“在培养基中培养以进行预处理的步骤”或“在培养基中培养以制备未成熟间充质干细胞的步骤”互换使用);将所述诱导分化的间充质干细胞在间充质干细胞成熟培养基中培养;和/或对所述成熟培养基中培养的间充质干细胞进行传代培养。
在另一具体实施例中,所述方法可以基本上不包括胚状体形成步骤。
所述培养已分离的多能性干细胞的步骤可以在支持细胞不存在的情况下进行。另外,所述培养的步骤可以为在涂覆有细胞粘附功能增强剂(例如,ctscellstarttm)的培养容器中培养。所述培养可以在干细胞培养液(例如,mtesrtm)中进行,并且可以进行约1天至10天,或3天至10天。
所述分化为中胚层细胞的步骤可以在tgf-β抑制剂存在的情况下进行。根据一具体实施例,所述步骤可以包括:将含有tgf-β抑制剂的培养基培养为1天至8天、2天至7天、2天至6天或2天至4天。当所述培养保持至少7天时,可以发生细胞的衰老,或者可以出现细胞的形态学(morphology)特征的变形,或者可以降低细胞的增殖力。在所述细胞衰老、形态学特征或增殖力的方面,所述培养可以进行2天至6天。所述培养基可以为选自最小必需培养基(mem,minimalessentialmedium)、杜尔贝科改良伊格尔培养基(dmem,dulbeccomodifiedeaglemedium)、罗斯威尔帕克纪念研究所培养基(rpmi,roswellparkmemorialinstitutemedium)、角朊细胞无血清培养基(k-sfm,keratinocyteserumfreemedium)、伊思考夫改良杜尔贝科培养基(imdm、iscove'smodifieddulbecco'smedium)、f12和dmem/f12中的培养基。另外,对于培养基,可以进一步包括在本说明书所述的其他成分。
将所述中胚层细胞在含有dna修复剂(dnarepairagent)和rock(rho-associated,coiled-coilcontainingproteinkinase)抑制剂的培养基中培养以诱导分化为间充质干细胞的步骤可以指间充质干细胞的成熟分化之前的预处理步骤或诱导分化为未成熟间充质干细胞的步骤。所述培养基如上所述。所述培养可以包括:在dna修复剂、roc抑制剂和/或含有tgf-β抑制剂的培养基中诱导分化1天至4天或1天至2天。在所述诱导分化为间充质干细胞的步骤中,所述间充质干细胞可以为未成熟间充质干细胞。因此,根据一具体实施例的方法可以经过所述未成熟间充质干细胞制备间充质干细胞。具体地,根据一具体实施例的方法可以经过未成熟间充质干细胞而不经过成血管细胞来制备间充质干细胞。确认了相对于作为成血管细胞(hemangioblast)的标志物vegfr2,所述未成熟间充质干细胞表达为细胞群的10%或更少,由此可见,根据一具体实施例的方法不经过成血管细胞。
将所述诱导分化的间充质干细胞在间充质干细胞成熟培养基中培养的步骤可以包括:间充质干细胞用胰蛋白酶(胰蛋白酶/edta溶液)处理以对其进行单细胞化;在间充质干细胞成熟培养基中培养;对所述成熟培养基中培养的细胞进行离心分离;和/或对所述成熟培养基中培养的间充质干细胞进行传代培养。在所述成熟培养基中培养的步骤可以进行1天至15天、1天至12天或4天至12天。另外,所述成熟培养基可以为选自最小必需培养基(mem,minimalessentialmedium)、杜尔贝科改良伊格尔培养基(dmem,dulbeccomodifiedeaglemedium)、罗斯威尔帕克纪念研究所培养基(rpmi,roswellparkmemorialinstitutemedium)、角朊细胞无血清培养基(k-sfm,keratinocyteserumfreemedium)、伊思考夫改良杜尔贝科培养基(imdm、iscove'smodifieddulbecco'smedium)、f12和dmem/f12中的培养基。另外,对于培养基,可以进一步包括在本说明书所述的其他成分。在所述离心分离后,可以对通过离心分离而获得的细胞进行传代培养。所述传代培养可以在与所述成熟培养基类似或相同的培养基中进行。另外,所述传代培养可以在胰蛋白酶(例如胰蛋白酶/edta溶液)存在的情况下以单细胞化的方式进行。另外,所述传代培养可以在涂覆有细胞粘附功能增强剂的培养容器中进行。在本说明书中,“传代培养”可以是指为了连续长时间健康地培养细胞,通过定期将细胞的一部分转移到新的培养容器后更换培养基来连续继代培养细胞的方法。由于随着在空间有限的培养容器中细胞数量的增加,经过一定时间后,增殖营养物质的消耗或污染物的积累导致细胞自然死亡,因此传代培养被用作增加健康细胞数量的一种方式,通常一次更换培养基或将细胞组进行分割以培养称为1代(1passage)。传代培养的方法可以不受限制地使用本领域已知的任何方法,例如可以通过机械分离或酶分离来进行。所述传代培养可以进行1代至20代、3代至20代、3代至15代。另外,所述传代培养可以包括:去除已脱落的非中胚层干细胞,并分离出中胚层干细胞。通过这种传代培养,可以制备最终间充质干细胞。
本发明另一方面提供一种根据所述方法制备的间充质干细胞。
根据一具体实施例,所述间充质干细胞可以为在dna修复剂(dnarepairagent)和rock(rho-associated,coiled-coilcontainingproteinkinase)抑制剂的存在下诱导分化的多能性干细胞来源间充质干细胞。
相对于在细胞表面表达的细胞标志物,本文提供的多能性干细胞来源间充质干细胞可以表达至少约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或约99%的cd29、cd44、cd90或cd105阳性表面标志物,并且可以表达约至少70%以下、至少60%以下、至少50%以下、至少40%以下、至少30%以下、至少20%以下、至少10%以下、至少5%以下或至少1%以下的tra-160、cd34或vefgr2阴性标志物。本文所用的术语“阳性”与干细胞标记有关,可以是指与以该标记为参照的其他非干细胞相比,该标记以更大的量或以更高的浓度存在。即,对细胞而言,由于在细胞内部或表面都存在标记,因此如果该标记可用于将该细胞与一种或多种其他细胞类型区分开,则该细胞对该标记呈阳性。另外,这可以意味着该细胞以大于背景值的信号,例如足以从细胞测量装置发射信号的量具有该标记。例如,可以用对cd29具有特异性的抗体可检测地标记细胞,并且如果来自该抗体的信号可检测地大于对照组(例如,背景值),则该细胞为“cd29+”。本文所用的术语“阴性”是指即使使用对特定细胞表面标记具有特异性的抗体,与背景值相比也无法检测到该标记。例如,如果不能使用对cd34具有特异性的抗体来可检测低标记细胞,该细胞为“cd34-”。
所述免疫学特性可以通过本发明所属领域中已知的常规方法来确定。例如,可以使用诸如流式细胞分析、免疫组织化学染色或rt-pcr等的各种方法。
另外,所述间充质干细胞可以具有选自造血干细胞、肌细胞、心肌细胞、肝细胞、软骨细胞、上皮细胞、泌尿系统细胞、肾细胞、血管细胞、视网膜细胞和神经元细胞中的至少一种分化能。
本发明另一方面还提供一种根据所述方法制备的间充质干细胞群。
本发明另一方面提供一种包括根据所述方法制备的间充质干细胞、其细胞群或其培养液作为有效成分的细胞治疗剂、药物组合物或制剂。
本发明另一方面还提供一种根据所述方法制备的间充质干细胞、其细胞群或其培养液在制备细胞治疗剂、药物组合物或制剂中的用途。
本发明另一方面还提供一种疾病的治疗方法,所述方法包括:将有效量的根据所述方法制备的间充质干细胞、其细胞群或其培养液施用于个体。
根据一具体实施例的间充质干细胞的制备方法可以比现有报道的方法更短的时间内作为细胞治疗剂提供。因此,对所述细胞治疗剂或药物组合物进行传代培养至少3代以上,例如,3代至10代,并且为了应用于细胞治疗剂,可以从多能性干细胞诱导分化并培养20天至40天、22天至38天、25天至35天。应用于所述细胞治疗剂的培养期可以是指从多能性干细胞(第0天)到细胞治疗剂可应用时间点所需的分化时间。
本发明另一方面还提供一种包括间充质干细胞的细胞治疗剂的制备方法,其包括:对根据所述方法制备的间充质干细胞进行传代培养。
所述传代培养进行至少3代以上,例如3代至10代,其可以包括应用于细胞治疗剂的从多能性干细胞(第0天)的诱导分化和培养期间为20天至40天。
另外,例如,本发明另一方面还提供一种用于治疗或预防炎性疾病、缺血性疾病和/或神经退行性疾病的药物组合物,其包括根据所述方法制备的间充质干细胞、其细胞群或其培养液作为有效成分。
另外,例如,本发明另一方面还提供一种根据所述方法制备的间充质干细胞、其细胞群或其培养液在制备用于治疗或预防炎性疾病、缺血性疾病和/或神经退行性疾病的药物组合物的用途。
此外,本发明另一方面还提供一种用于治疗或预防炎性疾病、缺血性疾病和/或神经退行性疾病的治疗方法,其包括:将有效量的根据所述方法制备的间充质干细胞、其细胞群或其培养液施用于需要其的个体。
根据所述方法制备的间充质干细胞如上所述。
所述疾病的实例可以包括炎性疾病、缺血性疾病和/或神经退行性疾病。所述炎性疾病的实例可以包括支气管炎、胃炎、动脉硬化、关节炎、炎症性肠病(ibd,inflammatoryboweldisease)、肝炎、胆囊炎、真菌感染症、胃溃疡、哮喘、特应性皮炎、腱炎或肾炎。所述缺血性疾病的实例可以包括缺血性卒中、心肌梗塞、缺血性心脏病、缺血性脑疾病、缺血性心力衰竭、缺血性肠炎、缺血性血管疾病、缺血性眼病、缺血性视网膜疾病、缺血性青光眼、缺血性肾衰竭或下肢缺血性疾病。
所述神经退行性疾病的实例可以包括脊髓损伤、多发性硬化、阿尔茨海默病(alzheimer'sdisease)、额颞叶性痴呆(frontotemporaldementia)、进行性核上性麻痹(progressivesupranuclearpalsy)、皮质基底节变性(corticobasaldegeneration)、匹克氏痴呆(pick'sdisease)或拳击员痴呆(dp,dementiapugilistica)。
基于间充质干细胞为准,根据一具体实施例的细胞治疗剂或药物组合物的剂量可以为1.0×103至1.0×1010个细胞/kg(体重)或个体,或1.0×107至1.0×108个细胞/kg(重量)或个体。然而,可以根据各种因素来不同地确定剂量,例如配制方法、施用方式、患者的年龄、体重、性别、病理状况、食物、施用时间、施用途径、排泄速度和反应敏感性等,并且考虑到这些因素,本领域技术人员可以适当地调整剂量。施用次数可以为一次或在临床可接受的副作用范围内两次以上,并且对于给药部位,也可以施用于一个或两个以上的部位。对于除人类以外的动物,每公斤或每个体施用与人类相同的剂量,或者,例如可以根据目标动物与人体器官(心脏等)的体积比(例如,平均值)来施用从所述剂量换算的量。作为根据一具体实施例的治疗的目标动物,例如可以包括人类和用于其他目的的哺乳动物,具体而言,人、猴、小鼠、大鼠、兔子、羊、小、狗、马、猪等。
根据一具体实施例的细胞治疗剂或药物组合物可以包括所述间充质干细胞和药学上可接受的载体和/或添加物作为有效成分。例如,可以包括灭菌水、生理盐水、常规缓冲液(磷酸、柠檬酸、其他有机酸等)、稳定剂、盐、抗氧化剂(抗坏血酸等)、表面活性剂、悬浮液、等渗剂或保存剂等。为了局部施用,还优选将其与如生物聚合物(biopolymer)等的有机物质、如羟基磷灰石等的无机物、具体地,胶原基质、聚乳酸聚合物或共聚物、聚乙二醇聚合物或共聚物以及其化学衍生物等结合。当根据一具体实施例的细胞治疗剂或药物组合物制备成适合于注射的剂型时,细胞群体可以溶解在药学上可接受的载体中或冷冻成已溶解的溶解溶液状态。
根据一具体实施例的间充质干细胞可用于各种类型的治疗方案,所述治疗方案通过人体的组织或器官所需的细胞群,例如干细胞或来源细胞群的植入、移植注入来实现增强、治疗、替换。所述多能性干细胞来源间充质干细胞可以通过替代或增强原来组织来形成新的或改变的组织,或与生物学组织或结构结合。
如果需要,根据施用方法或机型,根据一具体实施例的细胞治疗剂或药物组合物可以适当地包括悬浮剂、溶解助剂、稳定剂、等渗剂、保存剂、吸附抑制剂、表面活性剂、稀释剂、赋形剂、ph调节剂、无痛化剂、缓冲剂、还原剂、抗氧化剂等。包括所述实例的适用于本发明的药学上可接受的载体和制剂在文献(remington'spharmaceuticalsciences,19thed.,1995)中有详细描述。
根据本领域技术人员可容易进行的方法,根据一具体实施例的细胞治疗剂或药物组合物可以通过与药学上可接受的载体和/或赋形剂配制并以单位剂量形式或以装入多剂量容器中的方式来制备。此时,机型可以为油性或水性介质中的溶液、悬浮液或乳化液的形式,或者可以为粉末、颗粒、片剂或胶囊的形式。另外,细胞治疗剂可以配制为注射剂型。在这种情况下,可以使用已知的用于制剂的常规成分,并且可以以常规方法配制。
有益效果
根据根据一方面的培养基组合物和方法,不仅可以在短时间内以高产率制备间充质干细胞,而且由于没有胚状体形状的步骤,因此制备工艺简单,并且可以获得具有均质性的细胞,从而具有可以在比现有方法更短的时间内提供细胞治疗剂的效果。
附图说明
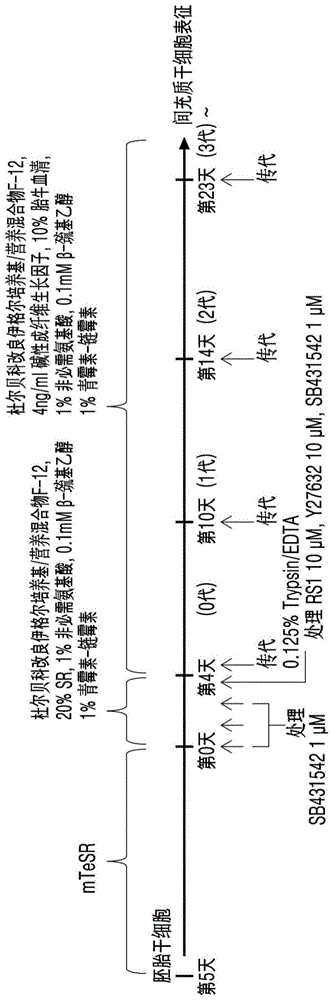
图1为将根据一具体实施例的人胚胎干细胞直接分化为间充质干细胞的方法的示意图。
图2为根据一具体实施例的人胚胎干细胞来源间充质干细胞的细胞形态学特性的照片。
图3为根据比较例的通过胚状体形成系统的人胚胎干细胞来源间充质干细胞的细胞形态学特性的照片。
图4为将根据一具体实施例的人胚胎干细胞来源间充质干细胞的细胞产率(直接分化+sb431542+rs1+y27632)与使用胚状体形成系统的人胚胎干细胞来源间充质干细胞的细胞产率(经过胚状体分化+sb431542)进行比较的图表。
图5为将利用根据一具体实施例的人胚胎干细胞来源间充质干细胞(直接分化+(sb431542+rs1+y27632))作为细胞治疗剂所需的分化期与利用胚状体形成系统的人胚胎干细胞来源间充质干细胞(胚状体+sb431542)进行比较的图表。
图6为使用流式细胞分析方法分析根据一具体实施例的培养30天(4代)的人胚胎干细胞来源间充质干细胞的细胞表面表达标志物的结果图。
图7为使用流式细胞分析方法分析根据一具体实施例的培养4天的人胚胎干细胞来源间充质干细胞的细胞表面表达标志物的结果图。
图8为根据一具体实施例的培养30天(4代)的人胚胎干细胞来源间充质干细胞与培养4天的人胚胎干细胞来源间充质干细胞的细胞表面表达标志物的比较图表。
图9为根据一具体实施例的人胚胎干细胞来源间充质干细胞的细胞分化能的图表。
图10为根据一具体实施例的人胚胎干细胞来源间充质干细胞的细胞形式特性与单独使用dna修复剂和rock抑制剂处理的人胚胎干细胞来源间充质干细胞的细胞形式特性的比较图。
具体实施方式
本发明将参考实施例以详细描述下文。然而,这些实施例是为了描述本发明,本发明的范围不限于这些实施例。
实施例1、人胚胎干细胞向间充质干细胞的直接分化
1.1.人胚胎干细胞的培养
为了在没有支持细胞的情况下培养人胚胎干细胞,如下进行。
具体地,将作为仅由人类来源成分组成的细胞粘附功能增强剂ctscellstarttm在2.0cm2表面积的4孔组织培养皿(tissueculturedish)中于4℃下以160μl/孔的浓度处理24小时。此后,在室温下从组织培养皿(tissueculturedish)中除去剩余的ctscellstarttm,然后将作为胚胎干细胞培养液的mtesrtm(stemcells,美国)培养液以500μl/孔的浓度置于组织培养皿,然后在37℃下放置于,5%co2的培养箱。
接下来,使用微尖端(micro-tip,axygen,美国)的机械传代方法(mechanicalsub-passage),将在支持细胞上增殖的人胚胎干细胞(cha-hesnt18,cha大学)破碎成小块(smallclumps),并且将其以15至20块/孔(clumps/well)分配到置于培养箱中的所述组织培养皿中。然后,每天用500μl/孔的新胚胎干细胞培养液(mtesrtm)替换,持续5天,在没有支持细胞的情况下增殖人胚胎干细胞。
1.2.人胚胎干细胞向中胚层细胞的分化诱导
在所述实施例1.1中,为了将在没有支持细胞的情况下增殖的人胚胎干细胞分化为中胚层细胞,对tgf-β抑制剂进行了处理。
具体地,将tgf-β抑制剂(sb431542)以1mm的原液浓度溶解在dmso(二甲基亚砜(dimethylsulfoxide),sigma,美国)中后,将其在胚胎干细胞分化液(dmem/f12,20%(v/v)sr,1%(v/v)neaa,0.1mmβ-巯基乙醇,1%(v/v)青霉素-链霉素)中稀释至1μm的终浓度。然后,将所述实施例1.1中增殖培养5天的人胚胎干细胞在含有sb431542的所述胚胎干细胞分化液中处理4天(第0天、第1天、第2天),以分化为中胚层细胞。
1.3.中胚层细胞的预处理
在所述实施例1.2中胚胎干细胞分化液处理的第3天(第3天)更换培养基,并再培养一天。具体地,培养基用含有rad51促进剂(rs1)10μm、rock抑制剂(y27632)10μm和tgf-β抑制剂(sb431542)1μm的分化培养基替代,以预处理中胚层细胞。
1.4.向间充质干细胞的分化诱导
将所述实施例1.3中预处理的中胚层细胞的成分分化为间充质干细胞,并进行传代培养以获得中胚层干细胞。
具体地,在分化的第4天(day)除去所有培养基后,将细胞用混合有1%(v/v)青霉素-链霉素的pbs洗涤。然后,在室温下用0.125%胰蛋白酶处理以进行单细胞化后,用间充质干细胞成熟培养基(dmem/f1,10%(v/v)fbs,4ng/mlbfgf,1%(v/v)neaa,0.1mmβ-巯基乙醇,1%(v/v)青霉素-链霉素)进行中和,然后将其以1,000rpm离心分离5分钟。接下来,将通过离心分离所获得的细胞都分配到预先涂有ctscellstarttm的1孔/12孔培养皿,然后每当细胞密度(confluency)达到80-90%时,按照12孔培养皿(0代)→6孔培养皿(1代)→t-25烧瓶(2代)→t-75烧瓶(3代)的顺序,在室温下处理0.05%胰蛋白酶以进行单细胞化,以这种方式持续传代培养。在此过程中,脱落非中胚层干细胞,而获得中胚层干细胞。
根据一具体实施例的间充质干细胞的制备方法如图1所示。
比较例1、通过胚状体形成系统制备间充质干细胞
作为对照组,通过胚状体形成系统从人胚胎干细胞制备间充质干细胞。通过胚状体形成系统的间充质干细胞如下制备。
具体地,将人胚胎干细胞系以集落形式在预先准备的mef饲养细胞上以7.5×104细胞/孔(0.1%涂有明胶的培养皿,4孔)的浓度进行共培养。为了形成eb,在解剖显微镜下,使用灭菌的尖端将所述hesc机械分为几组(2个至4个clumpform),将其在添加有20%ksr(敲除血清替代物(knockout-serumreplacement),invitrogen)的dmem/f12(dulbecco'smodifiedeaglemedium,nutrientmixturef-12)培养基的60mm培养皿上培养5天。形成eb后,在20%ksr+dmem/f12培养基(eb培养液:从hesc培养溶液中仅排除bfgf的培养液)中培养1天,然后向所述eb培养液添加1umtgf-beta抑制剂(sb431542)以培养2周(13天),并且培养基每两天更换一次。然后,转移到涂有0.1%明胶(30分钟,空气干燥)的6孔板中,以使每孔具有5个到7个eb的密度,并且在添加有10%fbs和1%p/s(青霉素-链霉素,invitrogen)的dmem(低葡萄糖,5.5mmd-葡萄糖(1g/l))中培养16天。培养48小时后,确认了eb粘附和从eb延伸出来的细胞,并且肝细胞每周更换两次。16天后,用tryple溶液(invitrogen,每孔500ultryple,培养2分钟)分离出从eb中长出的细胞,转移到涂有0.1%明胶的75t烧瓶中,并在添加有10%fbs和1%p/s的dmem(低葡萄糖,5.5mmd-葡萄糖(1g/l))中培养。第二天,每当到达,在添加有10%fbs和1%p/s的dmem(低葡萄糖,5.5mmd-葡萄糖(1g/l))和作为msc增殖培养基的10%fbs、1%p/s、1%neaa(非必需氨基酸,invitrogen)和0.1%β-巯基乙醇(invitrogen)中用0.05%trypsin-edta(每75t烧瓶1.5ml,培养2分钟)进行传代培养,以这种方式制备间充质干细胞。
比较例2、通过单独处理dna修复剂(dnarepairagent)制备间充质干细胞
以与所述实施例1相同的方法制备间充质干细胞,不同之处仅在于在所述实施例1.3中未使用rock抑制剂,并处理rad51促进剂(rs1)10μm和tgf-β抑制剂(sb431542)1μm。
比较例3、通过单独处理rock抑制剂制备间充质干细胞
以与所述实施例1相同的方法制备间充质干细胞,不同之处仅在于在所述实施例1.3中未使用dna修复剂,并处理rock抑制剂(y27632)10μm和tgf-β抑制剂(sb431542)1μm。
实验例、人胚胎干细胞来源间充质干细胞的特性分析
1、细胞形态学特性分析
为了分析所述实施例1和比较例1中获得的间充质干细胞的细胞形态学特性,在相差显微镜(phase-contrastmicroscope,nikonte-2000)下,通过形成对间充质干细胞具有特异性的细胞增殖形式(涡流状)来确认其是否增殖,其结果分别示于图2和图3。
图2为根据一具体实施例的人胚胎干细胞来源间充质干细胞的细胞形态学特性的照片。
图3为根据比较例的通过胚状体形成系统的人胚胎干细胞来源间充质干细胞的细胞形态学特性的照片。
如图2所示,可以确认根据一具体实施例的制备方法制备的人胚胎干细胞来源间充质干细胞从分化后约10天开始形成类似于成人组织来源间充质干细胞的涡流状(spindle-likeshape)细胞并逐渐增殖,当分化达到约第24天时,大多数细胞具有间充质干细胞类型。与此相反,如图3所示,可以确认使用现有报道的胚状体形成系统的人胚胎干细胞来源间充质干细胞在第40天形成涡流状以增殖。
这意味着根据根据一具体实施例的方法可以在比现有报道的方法更快的时间内确保表现出高纯度的对间充质干细胞具有特异性的形态的细胞。
2、细胞产率分析
为了分析根据所述实施例1的方法的细胞产率,确认了增殖细胞的数量。具体地,在所述实施例1和对比例1的间充质干细胞的制备过程中,在用胰蛋白酶进行单细胞化的步骤中,用0.4%(v/v)台盼蓝(trypanblue)溶液染色细胞。此后,使用血球计数器分析所获得的细胞的存活细胞数,其结果如图4所示。
另外,从所述实施例2.1的细胞形态学观点,可以用作根据一具体实施例的方法制备的人胚胎干细胞来源间充质干细胞的细胞治疗剂的应用时间点是从表现出涡流状的增殖特征的3代或更多传代开始,所述涡流状为对间充质干细胞具有特异性的细胞增殖类型。据此,还以与所述相同的方法分析了用于细胞治疗的热胚胎干细胞来源间充质干细胞系的分化所需的时间,其结果如图5所示。
图4为将根据一具体实施例的人胚胎干细胞来源间充质干细胞的细胞产率(直接分化+sb431542+rs1+y27632)与使用胚状体形成系统的人胚胎干细胞来源间充质干细胞的细胞产率(胚状体+sb431542)进行比较的图表。
图5为将利用根据一具体实施例的人胚胎干细胞来源间充质干细胞(直接分化+(sb431542+rs1+y27632))作为细胞治疗剂所需的分化期与利用胚状体形成系统的人胚胎干细胞来源间充质干细胞(胚状体+sb431542)进行比较的图表。
如图4可见,与现有报道的方法相比,根据一具体实施例的人胚胎干细胞来源间充质干细胞的制备方法可以在更短时间内获得大量细胞。
另外,如图5可见,与现有报道的胚状体形成系统相比,根据一具体实施例的方法将可作为细胞治疗剂应用的分化时间缩短了约1.5倍至2倍。
3、表面表达标志物分析
为了进行在所述实施例1中制备的人胚胎干细胞来源间充质干细胞的表面标志物表达分析,进行了流式细胞分析。
具体地,将所述人胚胎干细胞来源间充质干细胞培养物(培养第30天(4代))用含有1%(v/v)青霉素-链霉素的pbs洗涤,然后使用胰蛋白酶(0.05%,trypsin/edta,gibco,美国)进行单细胞化。然后,在室温下用冷的4%甲醛溶液固定30分钟后,用含有0.2%(v/v)fbs的pbs洗涤4次。此后,将apc或pe标记的抗体在含有0.2%fbs的pbs中稀释至最终浓度5-15ug,并且将其在室温下的黑暗的地方处理30分钟。接下来,使用含有0.2%(v/v)fbs的pbs洗涤4次后,使用流式细胞分析确认表达程度。作为抗体,使用了未分化细胞标记物tra-1-60(藻红蛋白(pe)-共轭的小鼠抗人tra-1-60,cat.560193,bdpharmingentm)、造血干细胞标记物cd34(别藻蓝素(apc)-共轭的小鼠抗人cd34,cat.555824,bdpharmingentm)、成血管细胞标记物vegfr2(apc-共轭的小鼠抗人vegfr2,cat.bdpharmingentm)、间充质干细胞标记物cd29(apc-共轭的小鼠抗人cd29,cat.559883,bdpharmingentm)、cd44(apc-共轭的小鼠抗人cd44,cat.559942,bdpharmingentm)、cd90(apc-共轭的小鼠抗人cd90,cat.561971,bdpharmingentm)和cd105(apc-共轭的小鼠抗人cd105,cat.562408,bdpharmingentm)的抗体。
所述流式细胞分析结果如图6所示。
此外,为了确认根据一具体实施例的方法是否在不经过成血管细胞的情况下进行分化,通过流式细胞分析了培养第4天(实施例1.3)的细胞表面标志物的表达,其结果如图7所示。
另外,比较了所示培养第30天(4代)和培养第4天的细胞表面标志物表达的分析结果,其结果如图8所示。
图6为使用流式细胞分析方法分析根据一具体实施例的培养30天(4代)的人胚胎干细胞来源间充质干细胞的细胞表面表达标志物的结果图。
图7为使用流式细胞分析方法分析根据一具体实施例的培养4天的人胚胎干细胞来源间充质干细胞的细胞表面表达标志物的结果图。
图8为根据一具体实施例的培养30天(4代)的人胚胎干细胞来源间充质干细胞与培养4天的人胚胎干细胞来源间充质干细胞的细胞表面表达标志物的比较图表。
如图6所示,确认了是否表达根据一具体实施例的人胚胎干细胞来源间充质干细胞的未分化细胞标志物(pluripotentmarker)tra-1-60、造血干细胞标志物(hematopoieticstemcellmarker)cd34和间充质干细胞标志物(mesenchymalstemcellmaekers)cd29、cd44、cd90和cd105,结果可见,未分化细胞标志因子tra-1-60未表达,而间充质干细胞标志物以较高的比例表达(cd29,99.70%;cd44,99.45%;cd90,87.15%;cd105,96.60%)。因此,可以确认根据一具体实施例的方法诱导的人胚胎干细胞来源间充质干细胞为具有高中胚层性质的细胞。
另外,如图7所示,分析了分化第4天的细胞表面标志物,结果可见,造血干细胞标志物cd34的表达率非常高(cd34,69.65%),而成血管细胞(hemangioblast)标志物vegfr2几乎未表达(vegfr2,0.70%)。
此外,如将所述图6和图7的结果总结示于图8可见,在分化第30天(4代),间充质干细胞标志物以高比例表达,在分化第4天,造血干细胞标志物cd34以高比例表达,而成血管细胞(hemangioblast)标志物vegfr2以低比例表达。
上述结果表明,根据一具体实施例的人胚胎干细胞来源间充质干细胞的制备方法以经过具有造血干细胞性质的未成熟间充质干细胞,而不经过成血管细胞的形式进行。
4、细胞分化能分析
确认了所述实施例1中制备的人胚胎干细胞来源间充质干细胞的脂肪细胞、骨细胞和软骨细胞的分化能。
具体地,根据制造商的说明,分别使用脂肪细胞分化诱导剂(
图9为根据一具体实施例的人胚胎干细胞来源间充质干细胞的细胞分化能的图表。
如图9所示,当诱导分化为脂肪细胞时,确认了脂质滴(lipiddroplet)的形状,其中细胞内脂质成分被脂质特异性染色液油红o染成红色。当诱导分化为骨细胞时,确认了在细胞内蓄积的钙被茜素红溶液呈深橙色的形式。当诱导分化为软骨细胞时,确认了软骨细胞的细胞外基质(matrix)材料被软骨细胞特异性染色液阿利新蓝染成蓝色。所述结果可见,根据一具体实施例制备的间充质干细胞可以分化为脂肪细胞、骨细胞和软骨细胞,因此其具有多分化能。
5、根据单独物质处理的细胞形态差异的按时间分析
为了分析根据单独用dna修复剂和rock抑制剂处理的每个时期的细胞形态差异,以与所述实验例1相同的方法分析所述实施例1、比较例2和比较例3细胞的细胞形态。作为对照组(control),不使用dna修复剂和rock抑制剂,而使用使用tgf-β抑制剂sb431542单独处理的,其结果如图10所示。
图10为根据一具体实施例的人胚胎干细胞来源间充质干细胞的细胞形式特性与单独使用dna修复剂和rock抑制剂处理的人胚胎干细胞来源间充质干细胞的细胞形式特性的比较图。
如图10可见,在所有组均观察到涡流状的间充质干细胞增殖形态,其中,根据一具体实施例的间充质干细胞(sb431542+rs1+y27632)最先显示出间充质干细胞形态并显示出高产率。另外可见,当处理sb431542+y27632或sb431542+rs1时,在约30天以上的时间内实现向间充质干细胞的均匀增殖,并且在单独使用sb431542处理的对照组中,在第23天观察到大细胞的增殖,但到第30天几乎消失,并出现了与其他组相似的间充质干细胞形态的细胞,然而其均匀性差。
从以上结果可以看出,根据一具体实施例的间充质干细胞的制备方法,不仅可以在短时间内以高产率制备间充质干细胞,而且由于没有胚状体形状的步骤,因此制备工艺简单,并且可以获得具有均质性的细胞,从而可以在比现有方法更短的时间内提供细胞治疗剂。
- 还没有人留言评论。精彩留言会获得点赞!