用于CRISPR的靶标无关的向导RNA的制作方法
本发明涉及一种使用用于sgrna引导的核酸结合蛋白的合成的单一向导rna(sgrna)获得靶标多核苷酸的富集群体的方法,以及涉及一种获得用于sgrna引导的核酸结合蛋白的靶标无关的合成的单一向导rna(sgrna)的库的方法。还提供了一种通过本发明的方法可获得的靶标多核苷酸和sgrna。进一步设想了一种包含通过本发明的方法可获得的sgrna的库的试剂盒,以及通过本发明的方法可获得的sgrna的库的用途。
背景技术:
下一代测序(ngs)是遗传学和分子研究的主要驱动力,尤其包括在癌症医学领域中的现代诊断。该技术为研究dna或rna样品提供了强有力的方法。已经开发出新的和改进的方法和协议以支持各种应用,包括分析遗传变异和样品特异性差异。为了改进这种方法,已经开发出了旨在通过聚焦于特定序列、转录本、基因或基因组子区域或通过消除不需要的序列来靶向富集测序文库的方法。
靶向富集在许多情况下可能有用,例如需要分析整个基因组的特定部分的情况。完整外显子组(所有转录序列)的有效测序是此方法的典型示例。进一步的实例包括特定转录本的富集,突变热点的富集或干扰核酸物种的排除。
当前用于靶向富集的技术包括(i)杂交捕获,其中源自输入样品的核酸链在溶液中或在固相支持物上和与靶向目标区域互补的dna片段特异性杂交,这样就可以从物理上捕获并分离出目标序列;(ii)选择性环化或分子反转探针(mip),其中通过间隙填充和连接化学以高度特异性方式形成了包括靶标区域序列的单链dna环,创建具有常见dna元件的结构,然后将其用于选择性扩增靶向的目标区域;和(iii)聚合酶链反应(pcr)扩增,其中通过并行进行多重长距离pcr、有限数量的标准多重pcr或扩增非常大数量短片段的高度多重pcr,将pcr导向靶向的目标区域(mertesetal.,2011,briefingsinfunctionalgenomics,10,6,374-386)。
最近,将crispr/cas技术用于靶向富集目的,特别是为了从测序文库中去除不需要的序列。
crispr/cas技术是一种新型且非常通用的基因组和表观基因组编辑工具,其基于重新利用crispr/cas(聚簇的规则穿插的短回文重复序列/cas)细菌免疫系统(congetal,2013,science,339,819–824)。当cas核酸酶与称为单一向导rna(sgrna)的短rna寡核苷酸复合时,可在特定sgrna互补位置诱导双链断裂(dsb)。
crispr/cas系统还被重新用作可编程的限制性内切酶,以非常精确和定制的方式指导切割(leeetal.,2015,nucleicacidsres.,43,1–9)。
因此,已经开发出使用crispr/cas的方法,该方法在称为通过杂交耗尽大量序列(dash)的过程中选择性地耗尽过剩序列。dash用于通过指导靶向切割并阻止进一步扩增和测序去除靶标,例如从mrna-seq中去除核糖体rna(rrna)和从癌症样品中去除野生型kras背景序列(guetal.,2016.genomebiol.,17,41)。根据guetal.,在转座子介导的片段化之后但在随后的扩增步骤(这取决于片段两端是否存在衔接子序列)之前使用dash,能够防止靶标序列的扩增(线粒体rrna),从而确保它们不出现在最终测序文库中。
但是,这种富集方法适用于仅从测序文库中去除特定物种,而所有其他序列仍保留在文库中。因此,需要一种精简的、对成本和资源敏感的富集和测序方法,其可以有效降低测序文库的复杂性,从而降低测序深度并减少了要处理的数据量。
技术实现要素:
本发明满足了这一需求,并提供了一种获得靶标多核苷酸的富集群体的方法,该方法包含:(i)提供起始寡核苷酸的库,其用于制备用于sgrna引导的核酸结合蛋白的合成的单一向导rna合成的单一向导rna(sgrna)的库,其中所述起始寡核苷酸包含启动子节段、作为靶标特异性序列的随机节段和结合节段,该结合节段与支架序列的至少一部分互补以与sgrna引导的核酸结合蛋白相互作用;(ii)提供一种或多种正义和/或反义链捕捉子(catcher)寡核苷酸,其与靶标特异性序列的至少一部分互补,包含能够结合同源相互作用子的标签;(iii)使所述起始寡核苷酸的库与所述一种或多种正义和/或反义链捕捉子寡核苷酸杂交;(iv)通过使所述标签与同源相互作用子(cognateinteractor)(优选位于磁珠或适合的表面上)结合,从所述起始寡核苷酸的库中去除起始寡核苷酸与正义链捕捉子寡核苷酸的复合物和/或起始寡核苷酸与反义链捕捉子寡核苷酸的复合物,由此获得减少的起始寡核苷酸的库;(v)使用在步骤(iv)中获得的所述减少的起始寡核苷酸的库制备sgrna的库;(vi)使用在步骤(v)中获得的sgrna的库,以sgrna引导的核酸结合蛋白切割从测试样品获得的多核苷酸的混合物;和(vii)从在步骤(vi)中获得的所述多核苷酸的混合物,尺寸选择未切割的靶标多核苷酸。通过提供能够结合所述序列的sgrna的库,所述方法有利地可以去除所有靶标无关的序列。由此,极大降低了测序文库的复杂性,并且在该文库上执行测序操作(尤其是下一代测序(ngs))所需的测序深度要低得多,这显著地降低了测序成本以及后续的数据管理和数据处理成本。
在进一步方面,本发明涉及一种获得用于sgrna引导的核酸结合蛋白的靶标无关的合成的单一向导rna(sgrna)的库的方法,包含:(i)提供起始寡核苷酸的库,用于制备用于sgrna引导的核酸结合蛋白的合成的单一向导rna合成的单一向导rna(sgrna)的库,其中所述起始寡核苷酸包含启动子节段、作为靶标特异性序列的随机节段和结合节段,该结合节段与支架序列的至少一部分互补以与所述sgrna引导的核酸结合蛋白相互作用;(ii)提供一种或多种正义和/或反义链捕捉子寡核苷酸,其与所述靶标特异性序列的至少一部分互补,包含能够结合同源相互作用子的标签;(iii)使所述起始寡核苷酸的库与所述一种或多种正义和/或反义链捕捉子寡核苷酸杂交;(iv)通过使所述标签与同源相互作用子(优选位于磁珠或适合的表面上)结合,从所述起始寡核苷酸的库除去起始寡核苷酸和正义链捕捉子寡核苷酸的复合物和/或起始寡核苷酸和反义链捕捉子寡核苷酸的复合物,由此获得减少的起始寡核苷酸的库;和(v)使用在步骤(iv)中获得的所述减少的起始寡核苷酸的库,制备靶标无关的sgrna的库。
在本发明优选的实施方式中,sgrna引导的核酸结合蛋白是dna结合性cas蛋白。
在特别优选的实施方式中,所述dna结合性cas蛋白是cas9蛋白家族的成员,优选cas9蛋白或其衍生物。
在进一步的实施方式中,所述随机节段包含约10至30个随机核苷酸。优选所述随机节段包含约20个随机核苷酸。
在又另一实施方式中,所述捕捉子寡核苷酸包含约10至30个核苷酸。优选所述捕捉子寡核苷酸包含20个核苷酸。
在本发明进一步的实施方式中,能够结合同源相互作用子的标签是生物素并且所述同源相互作用子是链霉亲和素。
在本发明的另一实施方式中,如上所述的步骤(iii)至(iv)重复1、2、3、4、5或更多次。
在本发明的另一实施方式中,所述靶标多核苷酸代表基因、基因的一个或多个外显子、基因间区域、非转录调节区域和/或开放阅读框或它们的子部分;或一组不同的基因、一组不同基因的一个或多个外显子、一组基因间区域、一组非转录调控区域和/或一组开放阅读框或它们的子部分,或先前提供的元件的任何组合。
在又另一实施方式中,本发明涉及上述的任何方法,其中在方法步骤(iii)至(iv)的每一重复期间,使用代表一种或多种不同基因、外显子或开放阅读框的一种或多种捕捉子寡核苷酸。
在进一步的实施方式中,如上所述的从测试样品获得的多核苷酸混合物包含基因组dna和/或cdna分子,其大小可选地调节至预定值。
在本发明的又另一优选实施方式中,如上所述获得靶标多核苷酸的富集群体的方法另外地包括作为步骤(viii)的对所述经尺寸选择的未切割的靶标多核苷酸进行测序的步骤。
在进一步方面,本发明涉及一种通过如上所述获得靶标多核苷酸的富集群体的方法可获得的靶标多核苷酸。本发明进一步涉及一种sgrna的库,其是通过如上所述获得用于sgrna引导的核酸结合蛋白的靶标无关的合成的单一向导rna(sgrna)的库的方法可获得的。
在另一方面,本发明涉及一种试剂盒,其包含:sgrna的库,是通过如上所述获得用于sgrna引导的核酸结合蛋白的靶标无关的合成的单一向导rna(sgrna)的库的方法可获得的;和sgrna引导的核酸结合蛋白。优选所述sgrna引导的核酸结合蛋白是cas9蛋白或其衍生物。
在最后方面,本发明涉及sgrna的库用于在基于cas9的核酸内切酶测定中从多核苷酸的混合物去除靶标无关的多核苷酸的用途,所述sgrna的库是通过如上所述获得用于sgrna引导的核酸结合蛋白的靶标无关的合成的单一向导rna(sgrna)的库的方法可获得的。
应当理解的是,在不脱离本发明的范围的情况下,上述特征和下面将要说明的特征不仅可以以所示的相应组合来使用,而且可以以其他组合或单独地使用。
附图说明
图1示出了根据本发明一个实施方式的用于获得靶标无关的合成的单一向导rna(sgrna)的库的步骤的示意图。
图2描绘了待根据本发明一个实施方式使用的靶标特异性sgrna的制备步骤。
具体实施方式
尽管将针对特定实施方式来描述本发明,但是该描述不应被理解为限制性的。
在详细描述本发明的示例性实施方式之前,给出对于理解本发明重要的定义。
除非上下文另外明确指出,在本说明书和所附权利要求书中所使用的单数形式的“一个(a)”和“一种(an)”也包括各自的复数。
在本发明的上下文中,术语“约”和“大约”表示本领域技术人员可以理解的准确度区间,以仍然确保所讨论特征的技术效果。该术语通常表示与所指示数值的偏差为±20%,优选为±15%,更优选为±10%,且甚至更优选为±5%。
应当理解的是,术语“包含”并非限制性的。为了本发明的目的,术语“由……组成”或“基本上由……组成”被认为是术语“包含”的优选实施方式。如果在下文中,组被定义为包含至少一定数量的实施方式,则这意味着还涵盖优选地仅由这些实施方式组成的组。
另外,在说明书和权利要求书中的术语“(i)”、“(ii)”、“(iii)”或“(a)”、“(b)”、“(c)”、“(d)”或“第一”、“第二”、“第三”等用于区分相似的要素,而不一定是用于描述次序或时间顺序。
应当理解的是,这样使用的术语在适当的情况下是可以互换的,并且本文描述的本发明的实施方式能够以不同于本文描述或说明的其他顺序进行操作。如果这些术语涉及方法、程序或用途的步骤,所述步骤之间没有时间或时间间隔的连贯性,即所述步骤可以同时执行,或者此类步骤之间可能存在数秒、数分钟、数小时、数天、数周等的时间间隔,除非另有说明。
应当理解的是,本发明不限于本文描述的特定方法、协议等,因为它们可以变化。还应当理解的是,本文使用的术语仅是为了描述特定实施方式的目的,并不旨在限制本发明的范围,本发明的范围仅由所附权利要求书来限制。
附图应被认为是示意性表示,并且附图中示出的要素不一定按比例示出。相反,示出各要素以便它们的功能和通用目的对于本领域技术人员而言变得显而易见。
除非另有定义,否则本文中使用的所有技术和科学术语具有与本领域普通技术人员通常理解的相同含义。
如上所述,在一方面,本发明涉及一种获得靶标多核苷酸的富集群体的方法,包含:(i)提供起始寡核苷酸的库,其用于制备合成的单一向导rna(sgrna)的库,该合成的单一向导rna(sgrna)的库用于sgrna引导的核酸结合蛋白,其中所述起始寡核苷酸包含启动子节段、作为靶标特异性序列的随机节段和结合节段,该结合节段与支架序列的至少一部分互补以与所述sgrna引导的核酸结合蛋白相互作用;(ii)提供一种或多种正义和/或反义链捕捉子寡核苷酸,其与靶标特异性序列的至少一部分互补,包含能够结合同源相互作用子的标签;(iii)使所述起始寡核苷酸的库与所述一种或多种正义和/或反义链捕捉子寡核苷酸杂交;(iv)通过使所述标签与同源相互作用子结合,所述同源相互作用子优选位于磁珠或适合的表面上,从所述起始寡核苷酸的库中除去起始寡核苷酸和正义链捕捉子寡核苷酸的复合物和/或起始寡核苷酸和反义链捕捉子寡核苷酸的复合物,由此获得减少的起始寡核苷酸的库;(v)使用在步骤(iv)中获得的所述减少的起始寡核苷酸的库,制备sgrna的库;(vi)使用在步骤(v)中获得的sgrna的库,用sgrna引导的核酸结合蛋白的混合物裂解从测试样品获得的多核苷酸;和(vii)从在步骤(vi)中获得的所述多核苷酸混合物,尺寸选择未切割的靶标多核苷酸。
如本文所用,术语“靶标多核苷酸”涉及任何目标核酸分子,其适用于分子分析。优选地,所述靶标多核苷酸是dna或cdna分子。在本发明的具体实施方式中,所述靶标多核苷酸代表基因、基因的一个或多个外显子、基因间区域、非转录调控区域和/或开放阅读框或它们的子部分。在进一步的实施方式中,所述靶标多核苷酸也可以是一组不同的基因、一组不同基因的一个或多个外显子、一组基因间区域、一组非转录调控区域和/或一组开放阅读框或它们的子部分。进一步优选的是先前提及元件的组合。靶标多核苷酸的形式和含量通常由本发明方法中使用的捕捉子寡核苷酸的含量、序列和数量来反映。
在本发明的第一步中,提供了一种用于制备用于sgrna引导的核酸结合蛋白的合成的单一向导rna(sgrna)的起始寡核苷酸的库。
通常,所述方法基于crispr/cas系统的使用。如本文所用,术语“crispr/cas系统”涉及一种特异性切割和修饰核酸的生化方法,也称为基因组编辑。例如,通常可以使用crispr/cas系统插入、移除或关闭基因组中的基因,也可以改变基因或核酸分子中的核苷酸。crispr/cas系统的构思和活性步骤的作用与rna干扰具有多种相似之处,因为约18至20个核苷酸的短rna片段在两种细菌防御机制中介导与靶标的结合。在crsipr/cas系统中,通常rna引导的核酸结合蛋白(例如cas蛋白)结合某些rna序列作为核糖核蛋白。例如,cas核酸内切酶(例如cas9、cas5、csn1或csx12或其衍生物)可以结合称为crrna重复的某些rna序列,并且在这些序列的附近切割dna。不希望受理论的束缚,可以认为crrna重复序列形成二级rna结构,然后被核酸结合蛋白(例如cas)结合,从而改变其蛋白折叠,使靶标dna被rna结合。另外,靶标dna中须要存在pam基序(即原间隔子相邻基序)以激活核酸结合蛋白(例如cas)。通常在pam基序之前的三个核苷酸处切割dna。通常在crrna重复序列之后是与结合靶标dna的序列,即crrna间隔子;这两个序列,即crrna重复基序和靶标结合节段通常都标记为“crrna”。crrna(靶标结合节段)的第二部分是具有可变衔接子功能的crrna-间隔子序列。它与靶标dna互补,并与所述靶标dna结合。还需要另外的rna,tracrrna或反式crisprrna。tracrrna与crrna部分互补,因此它们彼此结合。tracrrna通常与前体crrna结合,形成rna双螺旋并被rnaseiii转化为活性形式。这些性质允许结合至dna,并通过结合位点附近的核酸结合蛋白(例如cas)的核酸内切酶功能进行切割。
如本文所用,术语“起始寡核苷酸”涉及短核酸分子或核酸寡聚体。其长度可根据具体应用、靶向方法、所涉生物的遗传背景等而异。典型地,通常,起始寡核苷酸的长度为约40至250个核苷酸,例如40、45、50、55、60、65、100、150、200或250个核苷酸或所述值之间的任何值。优优所述寡核苷酸的长度为55个寡核苷酸。优选所述起始寡核苷酸为单链dna分子。在替代的实施方式中,还设想了将rna、pna、can、hna、lna或ana分子或其混合物作为起始寡核苷酸。本文所用的术语“pna”涉及肽核酸,即类似于dna或rna的人工合成的聚合物。pna主链通常由通过肽键连接的重复n-(2-氨基乙基)-甘氨酸单元组成。各种嘌呤和嘧啶碱基通过亚甲基羰基键连接至主链。本文所用的术语“cna”涉及环戊烷核酸,即包含例如2'-脱氧卡巴鸟嘌呤核苷的核酸分子。术语“hna”涉及己糖醇核酸,即由标准核碱基和磷酸化的1,5-脱水己糖醇骨架构建的dna类似物。本文所用的术语“lna”涉及锁核酸。通常,锁核酸是经修饰的,因此是不可访问的rna核苷酸。lna核苷酸的核糖部分可以用连接2'和4'碳的另外的桥进行修饰。这样的桥将核糖锁定在3'-末端结构构象中。锁定的核糖构象可增强碱基堆叠和骨架预组织。假定这增加了热稳定性,即寡核苷酸的解链温度。如本文所用,术语“ana”涉及阿拉伯核酸或其衍生物。在本发明的上下文中,优选的ana衍生物是2'-脱氧-2'-氟-β-d-阿拉伯核苷(2'f-ana)。
通常以液体(例如水)溶液的形式提供寡核苷酸。所述溶液可以包含缓冲液或由合适的缓冲液组成,缓冲液例如杂交缓冲液,例如包含ssc、nacl、磷酸钠、sds、te和/或mgcl2。
如本文所用的“用于制备合成的单一向导rna(sgrna)的起始寡核苷酸的库”涉及一组寡核苷酸,其提供了制备合成的单一向导rna(sgrna)的库所需的特征。在本上下文中,如本文所用的术语“合成的单一向导rna(sgrna)”或“单一向导rna(sgrna)”涉及如上所述crispr/cas系统的crrna和tracrrna序列的人工或合成组合。典型地,所述sgrna包含可用于引导针对结合位点的dna结合蛋白的靶标特异性序列。如jineketal.,2012,science,337,816-821中所描述的,crrna和tracrrna可以结合到功能性物种中(sgrna),这满足了如上所述的两种活性(crrna和tracrrna)。例如,crrna-sp2的核苷酸1-42、crrna-sp2的核苷酸1-36或crrna-sp2的核苷酸1-32可以与tracrrna的核苷酸4-89组合。获得sgrna的其他选择可以来源于nowaketal.,2016,nucleicacidsresearch,44,20,9555–9564。例如,可以提供包含不同形式的上部茎结构的sgrna,或者其中间隔子序列从标准20个核苷酸差异截短至14或15个核苷酸的sgrna。进一步设想的变体包括从下部茎中去除推定的rnapiii终止子序列的那些变体。还设想了其中上部茎被延伸以增加sgrna稳定性并且增加其与sgrna引导的核酸结合蛋白(例如cas蛋白)的组装的变体。根据本发明进一步的实施方式,sgrna的序列和形式可以根据sgrna引导的核酸结合蛋白(例如cas蛋白)的形式或身份而变化。因此,取决于所述sgrna引导的核酸结合蛋白的来源,可以使用序列元件的不同组合。本发明还设想了在此背景下的任何未来发展,并且包括超越可从jinkeetal.,2012或nowaketal.,2016导出信息的sgrna-核酸结合蛋白相互作用的任何修饰或改善。在具体的实施方式中,要使用的sgrna可以具有seqidno:1至3中任一个的序列。特别优选的是使用化脓性链球菌sgrna,例如,如在市售试剂盒中所使用的,如newenglandbiolabsinc.提供的engensgrna合成试剂盒。还设想了来自其他商业供应商的类似sgrna形式,或单独制备的sgrna。如果与来自化脓性链球菌(s.pyogenes)的同源核酸结合蛋白一起使用,则此类sgrna可以衍生自seqidno:1的序列。替代地,如果与来自金黄色葡萄球菌(staphylococcusaureus)的同源核酸结合蛋白一起使用,则sgrna可以衍生自seqidno:2的序列。在另一个替代方案中,如果与来自嗜热链球菌(streptococcusthermophilus)的同源核酸结合蛋白一起使用,则sgrna可以衍生自seqidno:3的序列。
通常,制备合成的单一向导rna(sgrna)所需的特征包含为生成适合用于crispr/cas系统的sgrna分子所需要的所有元素,如上所述。因此,这些特征包括存在启动子节段;存在作为靶标特异性序列的随机节段,其用作具有匹配序列的潜在结合或杂交相互作用子的互补序列;和存在与支架序列的至少一部分互补的结合元件,用于与sgrna引导的核酸结合蛋白相互作用。可以以任何适合的顺序提供所述特征。优选所述顺序为从5’至3’:(i)启动子节段,(ii)随机节段和(iii)用于支架序列的结合元件。所述寡核苷酸组的成员根据随机节段的序列而不同。
如本文所用,“启动子节段”涉及能够启动rna转录的任何合适的启动子结构。优选启动子是在体外条件下运行的启动子。在进一步的实施方式中,启动子可以是组成型启动子或可调节的启动子。合适的启动子的一个实例是t7rna聚合酶启动子。在替代性实施方式中,启动子可以是u6rna聚合酶iii启动子、iii型rna聚合酶iii启动子h1、或巨细胞病毒启动子(cmv),优选最小cmv启动子。所述启动子节段可以伴随有或另外地包含其他元件,如间隔子元件、引导元件等。例如,启动子节段间隔子序列的上游可优选包含1或2个鸟嘌呤残基。启动子节段的其他细节可以来源于适合的文献源,如milliganetal.,1987,nucleicacidsresearch,15,21,8783-8798或nowaketal.,2016,nucleicacidsresearch,44,20,9555-9564。
如本文所用的“随机节段”涉及包含随机碱基序列的核酸延伸(stretch),其典型地涵盖覆盖延伸范围内的所有序列可能性,包括单核苷酸延伸,如poly-t、poly-a、poly-g、poly-c。在某些实施方式中,大多数或一定量的可能核苷酸组合或序列可以由随机节段来表示,例如例如99%、95%、90%、85%、80%、75%、70%或或更少或者上述值之间的任何值。在优选的实施方式中,所述随机节段包含约10至30个随机核苷酸,例如10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸。特别优选的是所述随机节段包含约20个核苷酸。
寡核苷酸的“库”可以具有任何合适的大小。典型地,库的大小取决于随机节段的长度,因此更长的序列意味着更大的寡核苷酸库,更长的节段比更短的节段需要更多不同的寡核苷酸来覆盖所有可能的序列变异。因此,寡核苷酸库可以包含具有随机碱基序列的节段,即没有预定义的序列,因此在所述节段中包含所有可能的核苷酸组合或序列。
在具体的实施方式中,某些随机节段可以被过多表达,而其他可能不足表达。这种过多表达或不足表示可以被有意控制,例如根据需要、样品中已知或预期的序列组成或在样品制备期间使用的分离或消除技术的添加,例如长度排阻等。例如,可能有利地是为在测试样品中更频繁存在的核酸物种(如rdna序列、重复序列等)提供更高表示的靶标特异性序列。
在进一步的实施方式中,寡核苷酸库可包含单一特定核苷酸组合或序列的一次或多次表示。例如,如上定义的随机节段中每个可能的核苷酸组合或序列可以在寡核苷酸库中表示1次、2次、3次、4次、5次、10次、50次、100次、1000次或更频繁。
术语“与支架序列的至少一部分互补的结合元件,用于与sgrna引导的核酸结合蛋白相互作用”涉及一种核酸节段,其包含的序列与含有组合在sgrna中(优选如上文所述)的crrna和tracrrna功能的寡核苷酸互补,包含crrna重复基序和rna双螺旋形成元件。如本文所用,术语“支架序列”涉及与如上定义的sgrna引导的核酸结合蛋白(例如cas蛋白)结合以及相互作用通常所需要的所述结构基序。通过在单独的寡核苷酸中提供所述支架功能,在起始寡核苷酸的库(优选根据本发明的减少的起始寡核苷酸的库)与所述支架序列之间的杂交步骤以及随后的dna延伸,导到在一个实体中包含启动子节段、作为靶标特异性序列的随机节段和所述sgrna支架官能度的双链模板分子。图2示意性地获得在一个实体中包含启动子节段、作为靶标特异性序列的随机节段和所述sgrna支架官能度的所述双链模板分子的过程,以及在所述模板分子的基础上产生sgrna分子的后续步骤。
如本文所用,术语“互补的”是指在相反的核酸链中存在匹配的碱基对。例如,对于正义链中的核苷酸或碱基a,与核苷酸或碱基t互补或反义链结合,反之亦然;同样地,对于正义链中的核苷酸或碱基g,与核苷酸或碱基c互补或反义链结合,反之亦然。在本发明的某些实施方式中,可以通过在正义和/或反义链中存在单个或多个非互补碱基或核苷酸延伸的可能性来改变这种完全或完美互补的方案。因此,为了落入一对正义和反义链的概念之内,两条链可以是完全互补的或可以仅是部分互补的,例如在两条链的所有核苷酸之前或在本文定义的具体节段中的所有核苷酸之间,显示出约80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或100%的互补性。非互补碱基可包含核苷酸a、t、g、c中的一种,即显示出例如a和g、或t和c之间的不匹配,或者可以包含任何修饰的核苷碱基,包括例如wipo标准st.25中所述的修饰碱基。此外,本发明还设想了不同核酸分子之间的互补性,例如dna链与rna链之间、dna链与pna链之间、dna链与cna链之间等。优选本文定义的链或节段之间的互补性为完全的或100%的互补性。
如本文所用,术语“与支架序列的至少一部分互补”是指结合节段与包含所述支架序列的寡核苷酸具有互补重叠。所述重叠例如可以为5、7、10、12、15、18、20、22、25、28或30个核苷酸的重叠,或上述值之间的任何值。还设想了更长的重叠。优选在5至20个核苷酸范围内的短重叠。所述重叠的长度可以根据杂交效率进一步调整。所述重叠典型地在起始寡核苷酸的3'末端和包含支架序列的寡核苷酸的5'末端。在所述重叠内,互补碱基之间的匹配或互补性优选为100%。在替代性实施方式中,所述匹配小于100%,例如99%、95%、90%、85%或小于85%。
在第二步骤中,提供一种或多种正义和/或反义链捕捉子寡核苷酸。如本文所用的术语“正义链捕捉子寡核苷酸”涉及一种具有确定长度的寡核苷酸,其设计成与上述起始寡核苷酸的库中相应的寡核苷酸杂交并从而与之结合或将其捕获,即包含相应的反义链(3'至5'方向)。典型地,正义捕捉子寡核苷酸的序列对应于多核苷酸的5'至3'序列,或优选多核苷酸的一部分,其应被富集或者应被包含在靶标多核苷酸的富集群体中。
如本文所用的术语“反义链捕捉子寡核苷酸”涉及一种具有确定长度的寡核苷酸,其设计成与上述起始寡核苷酸的库中的相应寡核苷酸杂交并从而与其结合或将其捕获,即包含相应的正义链(5'至3'方向)。典型地,正义捕捉子寡核苷酸的序列对应于多核苷酸的3'至5'序列,或优选多核苷酸的一部分,其应被富集或者应被包含在靶标多核苷酸的富集群体中。
例如,捕捉子寡核苷酸与靶标多核苷酸或包含本文定义的靶标特异性序列的多核苷酸互补,例如覆盖基因、基因的一个或多个外显子、基因间区域、非转录调控区域和/或开放阅读框或它们的子部分,或者在进一步的实施方式中,覆盖一组不同的基团、一组不同基因的一个或多个外显子、一组基因间区域、一组非转录调控区域和/或一组开放阅读框或它们的子部分,以及前述元件的组合。优选捕捉子寡核苷酸的组覆盖一组基因,等。
在一个实施方式中,可以一起或同时提供两种捕捉子寡核苷酸形式(正义和反义)。如果一起或同时提供两种捕捉子寡核苷酸形式,它们以空间分离的方式提供,以避免正义和反义延伸之间的杂交。替代地,它们可以以固定的且因此在空间上分离的形式提供,从而可以排除正义和反义形式之间的杂交。在替代的实施方式中,首先提供正义或反义捕捉子寡核苷酸。在这种情况下,本发明设想不使用另一种捕捉子寡核苷酸,或者替代地随后使用另一种捕捉子寡核苷酸。在后一种情形下,所述方法可以包含另外的步骤:(iv-a)根据先前使用的正义或反义链捕捉子,提供一种或多种反义或正义链捕捉子寡核苷酸,即如果在如上定义的步骤(ii)和(iii)中使用正义链捕捉子寡核苷酸,则在步骤(iv-a)中可以使用反义链捕捉子寡核苷酸;或反之亦然,如果如上定义的步骤(ii)和(iii)中使用反义链捕捉子寡核苷酸,则在步骤(iv-a)中可以使用反义链捕捉子寡核苷酸,其中所述捕捉子寡核苷酸与所述靶标特异性序列的至少一部分互补,包含能够结合同源相互作用子的标签;(iv-b)使如在步骤(iv)中获得的减少的起始寡核苷酸的库与所述正义或反义链捕捉子寡核苷酸杂交;(iv-c)通过使所述标签与同源相互作用子结合,所述同源相互作用子优选位于磁珠或适合的表面上,从所述减少的起始寡核苷酸的库中除去起始寡核苷酸与正义或反义链捕捉子寡核苷酸的复合物,由此获得进一步减少的起始寡核苷酸的库。优选地,所述步骤将在如上定义的步骤(iv)之后执行。
优选在所述捕捉子寡核苷酸与如本文所定义的起始寡核苷酸中提供的靶标特异性序列的至少一部分之间进行杂交。这些分子之间的结合能够有效地从起始寡核苷酸的库中去除具有互补序列的起始寡核苷酸。
优选地,所述捕捉子寡核苷酸包含约10至30个核苷酸,例如10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸。还设想了更长的捕捉子寡核苷酸。特别优选所述捕捉子寡核苷酸包含20个核苷酸。所述捕捉子寡核苷酸可以进一步包含另外的元件,如间隔子元件、条码序列等。优选所述捕捉子寡核苷酸是单链dna分子。还设想了将rna、pna、can、hna、lna或ana分子或其混合物作为捕捉子寡核苷酸。
在具体的实施方式中,提供了一组捕捉子寡核苷酸,其中所述组以连续方式覆盖基因、外显子、基因间区域、开放阅读框或它们的子部分。术语“连续”是指当合并时所述捕捉子寡核苷酸覆盖所述基因、外显子、基因间区域、开放阅读框或它们的子部分的整个序列而没有重叠,或者在进一步的实施方式中,在每个拼接片之间具有2、3、4、5、6、7、8、9、10、15或20或更多个核苷酸的重叠。
根据捕捉子寡核苷酸的具体特征,所述捕捉子寡核苷酸包含能够结合同源相互作用子的标签。所述相互作用子-标签结合可以有利地用来将所述捕捉子寡核苷酸与包含互补靶标序列的任何结合或相关起始寡核苷酸一起从所述起始寡核苷库中拉出。适合的标签和相互作用子的实例是捕捉子寡核苷酸上的生物素标签与在适合表面(例如反应容器的表面)或磁珠上提供的链霉亲和素相互作用子等。进一步的实例包括结合至捕捉子寡核苷酸的磁珠和吸引所述磁珠的磁力分离器,例如附接在表面上。还设想了其中将捕捉子寡核苷酸固定在表面或固相上的实施方式。此种固定例如可以为柱的形式。固相可以具有任何合适的形式或结构,例如由琼脂糖凝胶组成。这可以使如上定义的起始寡核苷酸通过所述表面或固相或在所述表面或固相上运行,从而使其与捕集手寡核苷酸结合,并由此将其从库中去除。在某些实施方式中,这种活动可以重复一次或多次。
在后续步骤中,将所述起始寡核苷酸的库与所述一种或多种正义和/或反义链捕捉子寡核苷酸杂交。杂交通常在液体溶液中进行,例如包含如上定义的合适缓冲液的水溶液。可以根据技术人员已知的任何合适的温度、离子浓度和/或ph参数进行杂交。例如,可以在使得所述起始核苷酸与所述正义链捕捉子寡核苷酸中的大多数(优选全部)互补碱基对之间发生互补碱基配对的温度和/或溶液ph和/或离子浓度下,进行所述杂交。例如,可以通过将温度设定为仅允许完全(即100%)互补结合的值,来避免非特异性结合或杂交反应。在替代实施方式中,可以将温度设定为允许约99%、98%、95%、90%、85%或80%的互补碱基进行互补结合的值。
在本发明的获得靶标多核苷酸的富集群体的方法的另外的步骤中,从所述起始寡核苷酸的库中去除起始寡核苷酸和正义链捕捉子寡核苷酸的复合物和/或起始寡核苷酸和反义链捕捉子寡核苷酸的复合物。该去除优选通过使所述标签与同源相互作用子结合,所述同源相互作用子优选位于磁珠或适合的表面上来引发。例如,通过引入包含链霉亲和素的球,可以将生物素标签与所述标签相关联。杂交的起始寡核苷酸(即包含与所述正义链捕捉子寡核苷酸的序列匹配的靶标序列的那些寡核苷酸)也间接地结合到所述磁珠。随后,可以从溶液中去除带有相关核酸的磁珠。例如,所述磁珠可以是通过磁力去除的磁珠。还设想了不同的去除选项,例如离心或过滤。替代地,去除可以通过磁珠–磁力相互作用来实现。在此种情景下,捕捉子寡核苷酸连接至磁珠。在与匹配的起始寡核苷酸杂交后,施加磁力,可以从溶液中移除捕捉子寡核苷酸和起始寡核苷酸之间的复合物,例如朝向磁性区。
在进行了上述步骤之后,减少了所述起始寡核苷酸的库,即与正义链和/或反义链捕捉子寡核苷酸的序列互补的起始寡核苷酸不再存在于所述库中或它们的存在被减少。如本文所用,术语“减少的存在”是指与正义链和/或反义链捕捉子寡核苷酸的序列互补的起始寡核苷酸的数目减少了5倍、10倍、20倍、30倍、40倍、50倍、100倍。
在具体实施方式中,先前的步骤(iii)和(iv),即使起始寡核苷酸的库与所述一种或多种正义和/或反义链捕捉子寡核苷酸杂交的步骤以及如上定义的去除起始寡核苷酸的复合物的步骤,可以重复一次或多次。例如,这些步骤可以重复1、2、3、4、5或更多次。在某些实施方式中,所述重复可以与减少的起始寡核苷酸的库的扩增步骤(例如通过pcr)相关。因此,每个起始寡核苷酸上可以存在合适的引物结合位点,并用于扩增。扩增可以优选地用pfudna聚合酶或其他具有高保真度的热稳定dna聚合酶和相应系统进行。每次重复可结合洗涤步骤和/或质量控制步骤。例如,可以通过实时pcr确定减少的库中某些元件的存在。典型地,使用新的捕捉子寡核苷酸或新的捕捉子寡核苷酸组进行每次重复。在进一步的实施方式中,可以使用不同的捕捉子寡核苷酸或不同组的捕捉子寡核苷酸过行每次重复。例如,差异可以是整个靶标序列的不同部分,例如基因或基因组序列的相邻序列部分(如果所述基因被数个相邻或连续或部分重叠的捕捉子寡核苷酸所覆盖)。
在优选的实施方式中,在方法步骤(iii)至(iv)的每次重复期间,使用表示一种或多种基因、外因子或开放阅读框(orf)的一种或多种正义链和/或反义链捕捉子寡核苷酸。例如,如果多于一种基因、外显子或orf被所述捕捉子寡核苷酸覆盖,可以使用另一基因相关的、外显子相关的或orf相关的捕捉子寡核苷酸进行步骤(iii)和(iv)的每次重复。在进一步的实施方式中,要在步骤(iii)至(iv)的重复期间使用的捕捉子寡核苷酸可以覆盖2、3、4、5或更多种基因、外显子或orf。
在进一步的步骤中,使用在步骤(iv)中获得的所述减少的起始寡核苷酸的库产生sgrna的库。此步骤通常可以如图2所示进行。通常,将包含组合在sgrna中的crrna和tracrrna功能的单链寡核苷酸(优选为dna分子)(优选如上所述,包含crrna重复基序和rna双螺旋形成元件)通过如上文所定义的存在于所述起始寡核苷酸中的结合元件与步骤(iv)中获得的起始寡核苷酸杂交。随后,可以通过dna延伸反应填充杂合复合物的单链部分。该反应优选用dna聚合酶(例如t4dna聚合酶或klenow酶)进行。
在某些实施方式中,可以例如通过pcr,将所得的在一个实施中包含启动子节段、作为靶标特异性序列的随机节段和所述sgrna支架官能度的双链模板分子进行扩增。随后,可以通过上文定义的启动子节段将模板转录成rna分子,产生可用于crispr/cas活动的靶标特异性sgrna。
在具体的实施方式中,根据商业协议并基于商业试剂盒(例如,由newenglandbiolabs提供的商业试剂盒,如engensgrna合成试剂盒)获得sgrna的库。还设想了其他商业供应商提供的类似sgrna形式。
因此,在进一步的方面,本发明涉及一种获得用于sgrna引导的核酸结合蛋白的此类靶标无关的合成的单一向导rna(sgrna)的库。该方法基本上包含如本文定义的步骤(i)至(v)。在替代方面,本发明设想了提供一种减少的起始寡核苷酸的库,基本上包含如上文定义的步骤(i)至(iv)。
在某些实施方式中,可以存储、修饰和/或纯化步骤(v)之后获得的sgrna,以允许适当的进一步使用。例如,可以去除可能存在的5'磷酸残基,例如通过使用碱性磷酸酶。可以根据本领域技术人员已知的任何适合的协议进行sgrna的纯化,例如使用旋转柱去除蛋白质、盐和核苷酸。在某些实施方式中,还设想了在进一步使用之前对sgrna进行质量检查,例如通过在260nm下的uv光吸光度。
在根据本发明的获得靶标多核苷酸的富集群体的方法另外的步骤中,使用如上定义的在步骤(v)中获得的sgrna的库,以sgrna引导的核酸结合蛋白切割从测试样品中获得的多核苷酸混合物。
如本文所用,术语“测试样品”涉及通过本领域技术人员已知的合适方法从受试者获得的任何生物材料。在本发明上下文中使用的样品应优选以临床上可接受的方式采集,更优选以保存核酸的方式采集。生物样品可以包括人体组织和/或液体,例如血液或血液成分,例如血清或血浆、汗液、痰或唾液、精液和尿液,以及粪便或粪便样品。另外,所述生物样品可以含有来源于上皮细胞的细胞提取物或包括上皮细胞的细胞群,优选为赘生性上皮细胞或源自疑为赘生性组织的上皮细胞。特别优选的是癌组织或包含癌细胞的样品。替代地,所述生物样品可以来自环境,例如来自土壤、湖泊、河流等,或来自动物源。在某些实施方式中,细胞可用作多核苷酸的主要来源。因此,如果需要,可以从获得的人体组织和体液中纯化细胞,然后进一步处理以获得多核苷酸。在某些实施方式中,可以汇集样品,特别是在初始处理之后。本发明优选地设想了非汇集样品的用途。在本发明的特定实施方式中,还可以将生物样品的内容物提供给特定的预富集步骤。例如,可以使用对细胞膜或某些细胞类型的细胞器具有特异性的配体与样品接触,例如使用磁性颗粒功能化。被磁性颗粒浓缩的物质可随后用于提取多核苷酸。在本发明进一步的实施方式中,可以获取和/或使用活检或切除样品。此样品可以包含细胞或细胞裂解物。另外,可以通过流体或流体样品(例如血液、尿液、汗水等)的过滤过程来富集细胞,例如肿瘤细胞。该过滤过程也可以与基于如上文所述的基于配体特异性的预富集步骤组合。
如本文所用,术语“多核苷酸的混合物”涉及源自如上所述的样品的核酸。待根据本发明使用的多核苷酸优选是dna分子或cdna分子。cdna分子可以根据任何合适的方法获得,例如通过反转录获得。dna分子可以是基因组dna或其衍生物。还设想了dna文库的使用。
在优选的实施方式中,从测试样品中获得的多核苷酸混合物包含基因组dna和/或cdna分子,可选地将其大小调整至预定值。例如,多核苷酸的混合物可包含基因组dna或cdna分子,其根据技术人员已知的任何合适方案被剪切或片段化。这些方法包括限制消化、自适应聚焦声学剪切(afa)或covaris剪切、雾化力的使用、超声处理、点汇剪切或使用法式压剪程序。优选使用声学剪切,特别是covaris剪切。在可选的实施方式中,可以将获得的多核苷酸的大小调节至预定范围。示例性范围为约2kb至2.5kb、2.5kb至3kb、或3kb至3.5kb等、5kb至6kb、10kb至12kb等。多核苷酸的大小以及任何可选的调节可取决于如本文所述的靶标序列长度。
根据如上所述的crsipr/cas方法进行使用步骤(v)中获得的sgrna的库以sgrna引导的核酸结合蛋白(例如核酸酶,如cas)的裂解。通常,将如上所定义的多核苷酸的混合物加入到反应溶液中,该反应溶液包含合适浓度的上述sgrna、适合的反应缓冲液或适合浓度的sgrna引导的核酸结合蛋白。反应可以在合适的温度下温育。随后,在某些实施方式中,可以通过添加蛋白酶(例如蛋白酶k)来终止反应,或者优选通过例如在65℃下进行热变性步骤来终止反应。
在具体的实施方式中,还可以根据商业协议并且基于商业试剂盒(如例如由newenglandbiolabs提供的商业试剂盒,例如engencas9nls,一种化脓性链球菌(s.pyogenes)体外消化试剂盒)来进行所述裂解。还设想了来自其他商业供应商的类似消化协议。
在本发明的获得靶标多核苷酸的富集群体的方法的最后一步中,进行尺寸选择,这可以从步骤(vi)中获得的裂解多核苷酸中分离出未切割的靶标多核苷酸。通常,由于使用随机靶标序列用于sgrna制备,因此用crsipr/cas系统裂解包含匹配的随机序列的多核苷酸分子。包含靶标特异性序列的、未被sgrna的库中的sgrna识别的多核苷酸分子由于已经通过使用如上所述的捕捉子寡核苷酸杂交而被去除,因此这些分子将不会被裂解且由此具有较大的尺寸。可以使用任何适合的方法进行尺寸选择。例如,可以使用琼脂糖凝胶法或聚丙烯酰胺凝胶法或基于磁珠的方法。在优选的替代实施方式中,磁珠可用于去除短片段。
获得的靶标多核苷酸,即,包含靶标特异性序列的多核苷酸随后可以纯化、存储和/或用于另外的活动。
在本发明的具体实施方式中,使用所述多核苷酸进行的一个另外的活动是对所述获得的靶标多核苷酸进行测序。如本文所用,术语“测序”涉及技术人员已知的任何合适的测序方法。优选地,可以使用下一代序列(ngs)或第二代测序技术,其通常是以高度并行方式进行的大规模并行测序方法。例如,可以在如roche454、gsflxtitanium、illumina、lifetechnologiesionproton、oxfordnanoporetechnologies、solexa、solid或helicosbiosciencesheliscopesystems等平台上根据并行测序方法进行测序。
在某些实施方式中,测序还可以包括多核苷酸的另外的制备、测序以及后续的成像和初始数据分析步骤。
例如,制备步骤可以包括将多核苷酸随机分成较小的尺寸,并生成测序模板,例如片段模板。可以将空间分离的模板例如附着或固定在固体表面上,从而允许同时进行测序反应。在典型的实例中,产生核酸片段的文库,并将含有通用引物位点的衔接子连接至片段的末端。随后,将片段变性成单链并被磁珠捕获。扩增后,大量模板可以附着或固定在聚丙烯酰胺凝胶中,或化学交联到涂有氨基的玻璃表面上,或沉积在各个滴定板上。替代地,可以采用固相扩增。在这种方法中,通常将正向和反向引物连接到固体支持物上。扩增片段的表面密度由引物与支持物上模板的比率定义。该方法可以产生数百万个空间分离的模板簇,这些模板簇可以与通用测序引物杂交,以进行大规模平行测序反应。进一步合适的选择包括多重置换扩增方法。合适的测序方法包括但不限于illumina的循环可逆终止(crt)或合成测序(sbs),连接测序(sbl),单分子加成(焦磷酸测序)或实时测序。使用crt方法的示例平台是illumina/solexa和helicoscope。示例性sbl平台包括life/apg/solid支持寡核苷酸连接检测。示例性焦磷酸测序平台是roche/454。示例性实时测序平台包括pacificbiosciences平台和life/visi-gen平台。获得大量并行核酸序列数据的其他测序方法包括纳米孔测序、杂交测序、基于纳米晶体管阵列的测序、基于扫描隧道显微镜(stm)的测序或基于纳米线分子传感器的测序。关于测序方法的更多细节是技术人员已知的,或者可以从合适的文献来源获得,如goodwinetal.,2016,naturereviewsgenetics,17,333-351;vandijketal.,2014,trendsingenetics,9,418-426或fengetal.,2015,genomicsproteomicsbioinformatics,13,4-16。
在进一步方面,本发明涉及一种通过上文定义的获得靶标多核苷酸的富集群体的方法来可获得的靶标多核苷酸。因此,靶标多核苷酸可与非靶标多核苷酸以混合物存在,例如大小可分级的状态。因此,通过从如文所述的非靶标多核苷酸中分离出靶标多核苷酸,可以获得纯净部分的靶标多核苷酸。类似地,靶标多核苷酸可以以分离的形式存在于凝胶中,例如琼脂糖凝胶或聚丙烯酰胺凝胶,因此可以用本领域技术人员已知的合适方法从中提取出来。可以根据任何适合的方法纯化、存储或修饰所获得的靶标多核苷酸。可以以任何合适的缓冲液或液体的形式提供靶标多核苷酸,或者可以干燥或冻干的形式提供。
在进一步的方面,本发明涉及一种用于sgrna引导的核酸结合蛋白(例如cas9)的靶标无关的合成的单一向导rna(sgrna)的库,其是根据本发明的方法获得的。因此,所述库可以提供为rna分子。优选地是,所述rna已经进行纯化和/或清洁。其可以以任何合适的缓冲液或液体的形式提供,也可以以干燥或冻干的形式提供。在替代的实施方式中,sgrna的库提供为根据本发明所述的减少的起始寡核苷酸的库。在进一步的示例中,其可以提供为起始寡核苷酸与上述含有寡核苷酸的支架序列的混合物。
在进一步的方面,本发明涉及一种试剂盒,其包含sgrna的库和sgrna引导的核酸结合蛋白,所述sgrna的库是通过所述获得用于sgrna引导的核酸结合蛋白的靶标无关的合成的单一向导rna(sgrna)的库的方法可获得的。所述试剂盒优选用于富集靶标多核苷酸的群。如上文所定义的方法的特征也适用于本发明的试剂盒。例如,所述试剂盒可以包含在本发明的一个或多个步骤中定义的试剂和组分。例如,所述试剂盒可以包含用于裂解使用sgrna引导的核酸结合蛋白从测试样品获得的多核苷酸混合物的试剂或组分。在不同的实施方式中,所述试剂盒可以包含或者可以另外地包含用于执行尺寸选择的试剂或组分。所述试剂盒通常可以包含合适的缓冲溶液、标签或洗涤液等。另外,所述试剂盒可包含一定量的已知核酸分子或蛋白质,可用于试剂盒的校准或作为内部对照。相应的成分是本领域技术人员已知的。
另外,所述试剂盒可包括说明书散页和/或可提供有关其用法等的信息。
还设想了一种执行上述方法步骤的设备。该设备可以例如由可以执行本发明方法的一个或多个步骤的不同模块组成。这些模块可以以任何合适的方式组合,例如它们可以存在于单个位置或分开。还设想了该方法在不同时间点和/或不同位置的性能。在本文所定义的方法的某些步骤之后可以是中断或暂停,其中将试剂或产物等适当地存储在例如冰箱或冷却装置中。如果这些步骤在如本文所定义的设备的特定模块中进行,则所述模块可用作存储载体。所述模块可以进一步用于将反应产物或试剂运输到不同的位置,例如不同的实验室等。
在又另一方面,本发明涉及sgrna的库在基于sgrna引导的核酸结合蛋白的测定中用于从多核苷酸混合物中去除靶标无关的多核苷酸的用途,所述sgrna的库是通过获得用于sgrna引导的核酸结合蛋白的靶标无关的合成的单一向导rna(sgrna)的库的方法可获得的。所述测定可以包含步骤:用sgrna引导的核酸结合蛋白来裂解从测试样品中获得的多核苷酸混合物,其中所述核酸结合蛋白被导向要通过根据本发明的方法获得的sgrna裂解的序列。如上文定义的方法的特征也应用于上述的用途或测定。
在上述方法、试剂盒或用途的优选实施方式中,所述sgrna引导的核酸结合蛋白是dna结合性cas蛋白。此种dna结合性cas蛋白的实例是cas2、cas3、cas5、csn1或csx12或cas9。还设想了其衍生物或突变体。在特别优选的实施方式中,所述sgrna引导的核酸结合蛋白来源于cas9蛋白质家族或其衍生物。甚至更优选所述sgrna引导的核酸结合蛋白为cas9或其衍生物。所述衍生物优选是具有核酸酶活性的功能性衍生物。本发明进一步设想了使用衍生自不同细菌来源的cas9。例如,cas9蛋白可以来源于化脓性链球菌、金黄色葡萄球菌或嗜热链球菌。优选所述cas9为化脓性链球菌cas9蛋白。有关cas蛋白的形式和用途的更多详细信息可以从合适的文献来源中获得,如jianganddoudna,2017,annu.rev.biophys.,46,505-529;makarovaetal.,2011,biologydirect,6,38或wangetal.,2016,annu.rev.biochem.,85,22.1-22.38。
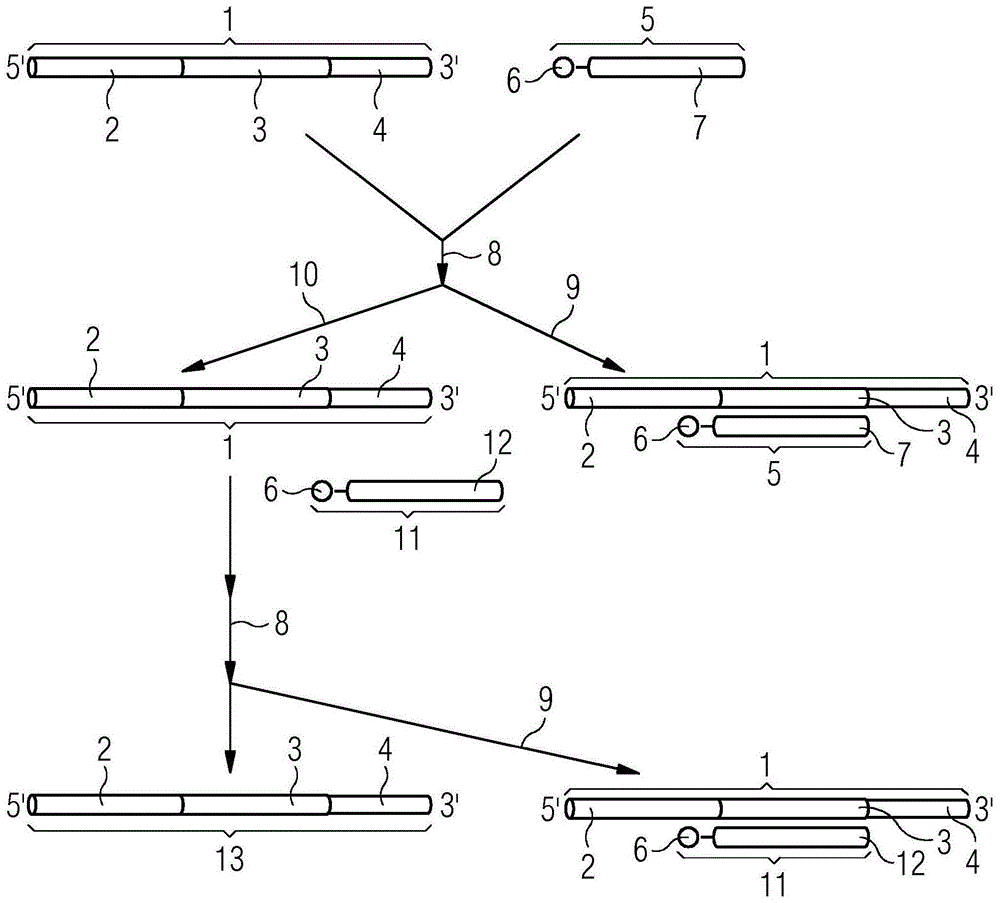
现在转到图1,提供了根据本发明一个实施方式的用于获得靶标无关的合成的单一向导rna(sgrna)的库的步骤的示意图。在第一步中,提供起始寡核苷酸的库1,该起始寡核苷酸的库1包含启动子节段2、作为靶标特异性序列的随机节段3和结合节段4,该结合节段4与支架序列的至少一部分互补以与sgrna引导的核酸结合蛋白相互作用。使起始寡核苷酸的库1与包含标签6和节段7(与随机节段3互补)的正义链捕捉子寡核苷酸5杂交8。随后,从溶液或反应混合物中去除9所述起始寡核苷酸1和正义链捕捉子寡核苷酸5的复合物。在所述溶液或反应混合物中,保留了减少的起始寡核苷酸的库10。在后续步骤中,使所述减少的起始寡核苷酸的库1与包含标签6和反义链节段12(与随机节段3互补)的反义链捕捉子寡核苷酸11杂交8。然后,从溶液或反应混合物中除去9所述起始寡核苷酸1和反义链捕捉子寡核苷酸11的复合物。在该溶液或反应混合物中,保留了进一步减少的起始寡核苷酸的库13。
图2示出了用于制备待根据本发明实施方式使用的靶标特异性sgrna27的步骤的示意图。该方法以包含启动子节段2、作为靶标特异性序列的随机节段3和结合节段4的起始寡核苷酸的库1开始,结合节段4与支架序列的至少一部分互补以与sgrna引导的核酸结合蛋白相应作用,使其与支架寡核苷酸20杂交22。在单管21中进行后续反应步骤29。杂交后,在dna延伸反应23中填充单链区域,从而提供双链dna分子24。在接下来的步骤中,通过启动子活性25开始转录26dsdna分子。这产生了包含靶标特异性序列3和sgrna支架节段28的靶标特异性sgrna分子27。
附图标记列表
1起始寡核苷酸的库
2启动子节段
3作为靶标特异性序列随机节段
4结合节段
5正义链捕捉子寡核苷酸
6标签
7与随机节段互补的节段
8杂交反应
9从溶液中去除复合物
10使用减少的起始寡核苷酸的库继续
11反义链捕捉子寡核苷酸
12与随机节段互补的反义链节段
13使用进一步减少的起始寡核苷酸的库继续
20支架寡核苷酸
21单管反应
22与支架寡核苷酸的杂交反应
23dna延伸反应
24双链dna分子
25启动子活性
26转录反应
27靶标特异性sgrna分子
28sgrna支架节段
提供以下附图用于说明性目的。因此,应当理解的是,所述附图不应被解释为限制。本领域技术人员将清楚地能够设想对本文提出的原理的进一步修改。
- 还没有人留言评论。精彩留言会获得点赞!