用于检测特定核酸的方法与流程
本发明涉及通过使用与靶标rna多核苷酸的至少一部分退火的捕捉子多核苷酸(catcherpolynucleotide)和结合至所述靶标rna多核苷酸的无催化活性的crrna引导的(crisprrna)rna结合蛋白用于检测所述靶标rna多核苷酸的方法。还设想了用于检测特定靶标rna多核苷酸的试剂盒,其具体地包括与所述靶标rna多核苷酸的至少一部分互补的一个或多个捕捉子多核苷酸,对所述靶标rna多核苷酸上的靶标序列特异的成熟crrna分子和无催化活性的crrna引导的rna结合蛋白;以及这些成分用于检测所述靶标rna多核苷酸的用途。
背景技术:
分子诊断领域在临床实验室中日益重要。在现代临床应用中使用了多种分子诊断测试和测定,例如,在传染性疾病、肿瘤学检查、凝血测试、药物遗传学或遗传性病症评价的背景中(williamsetal.,molecularpathology2018,691-707)。分子诊断测试通常用于检测与疾病直接或间接相关的特异性dna或rna序列,包括单核苷酸多态性(snp)、缺失和插入。当前用于检测或定量特异性核酸序列的技术包括异源杂交(heterogeneoushybridization)测定、pcr方法或直接测序。
crispr/cas技术是基于crispr/cas(成簇的规律间隔的短回文重复序列/cas)细菌免疫系统的再利用的新型且非常通用的基因组和表观基因组编辑工具(congetal,2013,science,339,819–824)。当与被称为单链向导rna(sgrna)的短rna寡核苷酸复合时,cas核酸酶可以在特异性sgrna互补位置引起双链断裂(dsb)。
最近,crispr/cas技术经改变适合于提供还用于rna靶向的廉价且实用的诊断工具。具体地,当通过适合的crna形式导向时,vi型crispr-cas系统,如基于cas13的系统能够结合至rna多核苷酸(muruganetal.,2017,molcell.,68(1),15-25)。基于cas13的方法的实例是sherlock(特异性高灵敏度酶促报告子unlocking),它是基于报告子释放信号的附带切割(collateralcleavage)能够快速且灵敏地检测样品中rna的诊断工具(gootenbergetal.,2017,science,360,6387,439-444)。
然而,这些方法被限制在相当特殊的情况并且不能利用通过基于rna的crispr/cas系统所提供的所有诊断选择。因此,需要新的和改善的检测方法,其使得能够有效且准确地鉴定rna多核苷酸。
技术实现要素:
本发明解决了这种需要并且提供了检测靶标rna多核苷酸的方法,其包括:(i)提供rna多核苷酸;(ii)将与所述靶标rna多核苷酸的至少一部分互补的一个或多个捕捉子多核苷酸退火以获得所述靶标rna多核苷酸和所述捕捉子多核苷酸的杂交物,其中所述捕捉子核苷酸固定在磁珠表面上或者连接至磁珠;(iii)使成熟的crrna(crisprrna)分子与所述靶标rna多核苷酸上的特异性靶标序列退火;(iv)将无催化活性的crrna引导的rna结合蛋白结合至步骤(iii)的复合物以获得蛋白-rna多核苷酸复合物;(v)去除未结合的成熟crrna分子和未结合的无催化活性的crrna引导的rna结合蛋白;(vi)抗体与步骤(iv)所述的蛋白-rna多核苷酸复合物结合;(vii)去除未结合的抗体;和(viii)检测步骤(vi)的抗体结合的蛋白-rna多核苷酸复合物。该方法适合于检测和/或定量rna并且允许获得具有改善的动态范围的可定量结果。另外,所述方法有利地适合于具有不同序列的rna分子并且可以容易地再利用于自动实验室平台或者床旁检查环境。其他益处包括相对短的程序时间,对高通量免疫测定分析仪的适应性和高特异性。
在本发明优选的实施方式中,将捕捉子多核苷酸固定在磁珠上或者通过抗生蛋白链菌素-生物素结合固定。
在特别优选的实施方式中,所述靶标rna多核苷酸是包含多聚a尾的mrna。
在其他实施方式中,所述捕捉子多核苷酸包含与所述靶标rna多核苷酸的多聚a尾至少部分互补的多聚t部分。
在另一个实施方式中,所述捕捉子多核苷酸包含与所述靶标rna多核苷酸上的特异性靶标序列至少部分互补的节段。
在本发明的其他实施方式中,所述捕捉子多核苷酸和所述靶标rna多核苷酸之间的互补部分包含12至30个核苷酸。优选地,所述捕捉子多核苷酸和所述靶标rna多核苷酸之间的互补部分包含20个核苷酸。
在本发明的另一个实施方式中,所述抗体对无催化活性的crrna引导的rna结合蛋白特异。在优选的实施方式中,所述抗体是单克隆抗体。
在本发明的另一个实施方式中,所述无催化活性的crrna引导的rna结合蛋白是cas蛋白。
在其他实施方式中,所述cas蛋白是cas12或cas13蛋白家族成员。特别优选地,cas蛋白是cas13蛋白或其衍生物。
在本发明的另一个优选实施方式中,步骤(viii)的抗体结合的蛋白-rna多核苷酸复合物的检测基于酶促或非酶促反应。
在特别优选的实施方式中,所述酶促反应是辣根过氧化物酶(hrp)、碱性磷酸酶(ap)、酯酶或葡萄糖氧化酶(god)的酶促反应,其中所述hrp、ap、酯酶或god共价连接至所述抗体。
在其他实施方式中,所述非酶促反应是吖啶鎓酯的化学发光反应,其中所述吖啶鎓酯共价连接至所述抗体。
在本发明所述方法的另一个优选实施方式中,所述检测是定量检测或半定量检测。
在另一个方面,本发明涉及用于检测靶标rna多核苷酸的试剂盒,其包含与所述靶标rna多核苷酸的至少一部分互补的一个或多个捕捉子多核苷酸,对所述靶标rna多核苷酸上的靶标序列特异的成熟crrna(crisprrna)分子,由所述成熟crrna引导的无催化活性的crrna引导的rna结合蛋白和结合至所述无催化活性的crrna引导的rna结合蛋白的抗体。
在最终方面,本发明涉及与靶标rna多核苷酸的至少一部分互补的一个或多个捕捉子多核苷酸,对所述靶标rna多核苷酸上的靶标序列特异的成熟crrna(crisprrna)分子和由所述成熟crrna引导的无催化活性的crrna引导的rna结合蛋白用于检测靶标rna多核苷酸的用途。
应理解不仅可以在所指明的各个组合中使用上述特征和以下将解释的那些特征,而且还可以在不背离本发明的范围的情况下,在其他组合中或单独使用。
附图说明
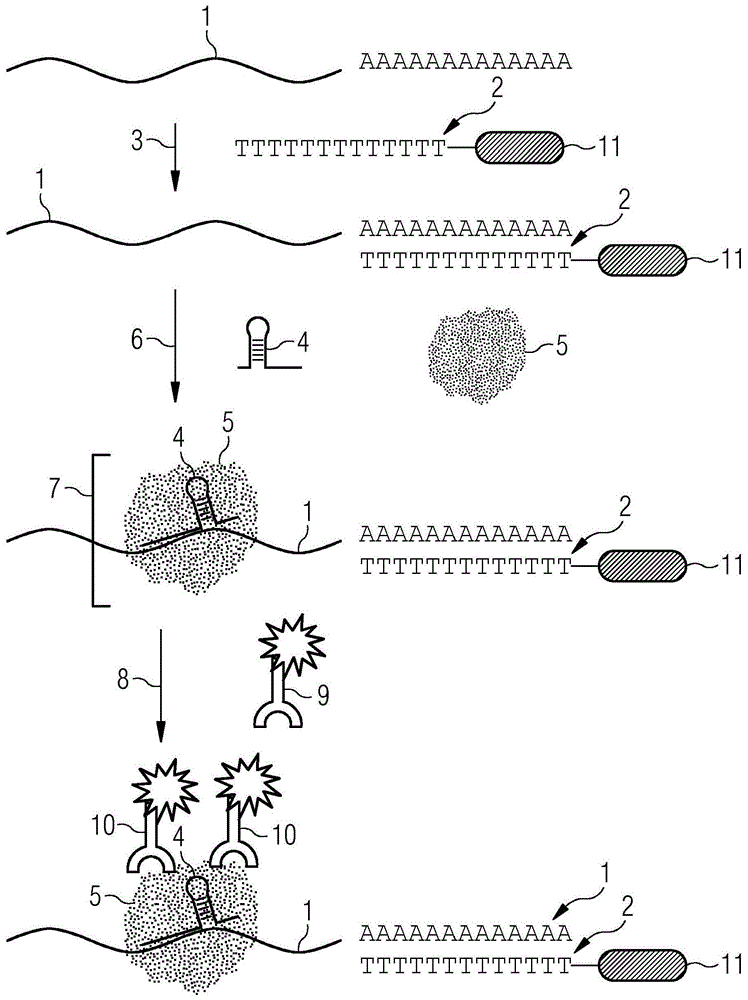
图1显示了根据本发明的实施方式用于检测靶标rna多核苷酸的步骤的示意图。
具体实施方式
尽管将相对于具体实施方式描述本发明,但是这种描述不应视为限制含义。
在详细描述本发明的示例性实施方式之前,提供了对于本发明的理解重要的定义。
除非上下文明确规定,否则如在本说明书和在所附权利要求中所使用的,单数形式的"一个"("a"和"an")还包括各自的复数形式。
在本发明的背景中,术语"约"和"大约"表示本领域技术人员将理解仍能确保所讨论的特征的技术效果的准确度间隔。该术语通常表示与所指明的数值±20%,优选地±15%,更优选地±10%,并且甚至更优选地±5%的偏离。
应理解术语"包含"不是限制性的。出于本发明的目的,术语"由...组成"或者"基本上由...组成"被认为是术语"包含"的优选实施方式。如果在下文中将组定义为包含至少某些实施方式,则这表示还涵盖了优选地仅由这些实施方式组成的组。
此外,描述或权利要求中的术语"(i)"、"(ii)"、"(iii)",或者"(a)"、"(b)"、"(c)"、"(d)",或者"第一"、"第二"、"第三"等用于区分类似的元素并且不必需用于描述顺序或时间次序。
应理解在适当情况下,所使用的术语是可互换的,并且本文所述的本发明的实施方式能够以不同于本文中所述或所示的其他顺序操作。除非另外说明,否则在术语涉及方法、程序或使用步骤的情况下,步骤之间没有时间或时间间隔连贯性,即可以同时进行所述步骤或者在这些步骤之间可以存在数秒、数分钟、数小时、数天、数周等的时间间隔。
应理解本发明不局限于本文所述的具体方法、规程等,因为这些是可以变化的。还应理解本文所使用的术语仅出于描述具体实施方式的目的,并且不意欲限制将仅由所附权利要求限制的本发明的范围。
附图将被认为是示意图,并且附图所示的元素不必需按比例显示。然而,显示了多种元素,从而它们的功能和一般目的将对于本领域技术人员变得显而易见。
除非另外定义,否则本文所使用的所有技术和科学术语具有与本领域技术人员通常理解的含义相同的含义。
如上所述,在一个方面,本发明涉及检测靶标rna多核苷酸的方法,其包括:(i)提供rna多核苷酸;(ii)将与所述靶标rna多核苷酸的至少一部分互补的一个或多个捕捉子多核苷酸退火以获得所述靶标rna多核苷酸和所述捕捉子多核苷酸的杂交物,其中所述捕捉子核苷酸固定在磁珠表面上或者连接至磁珠;(iii)使成熟的crrna(crisprrna)分子与所述靶标rna多核苷酸上的特异性靶标序列退火;(iv)将无催化活性的crrna引导的rna结合蛋白结合至步骤(iii)的复合物以获得蛋白-rna多核苷酸复合物;(v)去除未结合的成熟crrna分子和未结合的无催化活性的crrna引导的rna结合蛋白;(vi)将抗体与步骤(iv)所述的蛋白-rna多核苷酸复合物结合;(vii)去除未结合的抗体;和(viii)检测步骤(vi)的抗体结合的蛋白-rna多核苷酸复合物。
因此,在本发明所述方法的第一步中提供了rna多核苷酸。
如本文所使用的术语“rna多核苷酸”或者“靶标rna多核苷酸”涉及任何包含两种或更多种核糖核苷酸的大分子。核糖核苷酸通常含有核碱基、核糖和至少一种磷酸基。核碱基通常是腺嘌呤、鸟嘌呤、胞嘧啶和尿嘧啶。rna多核苷酸通常是单链分子,然而,还可以通过部分互补碱基配对以双链形式提供。rna多核苷酸通常不形成长的双螺旋延伸。rna多核苷酸可以是天然存在的或者是人工的。除上述元素之外,它可以包含修饰,如氧化核苷酸或甲基化核苷酸。在某些实施方式中,rna多核苷酸还可以包含人工添加,如标签或标记物。
rna多核苷酸可以是任何可能来源的,例如,原核、真核、古细菌或病毒来源的。根据本发明要鉴别的rna多核苷酸可以具有任何已知的可能的生物学或细胞学功能。例如,它可以是任何天然存在的或合成的多核苷酸,如信使rna(mrna)、核糖体rna(rrna)、核内不均一rna(hnrna)、转运rna(trna)、转运信使rna(tmrna)、微小rna(mirna)、小核rna(snrna)、剪接前导rna(slrna)、小核仁rna(snorna)、反义rna(asrna)、向导rna(grna)、长非编码rna(lncrna)、小干扰rna(sirna)、piwi-相互作用rna(pirna)、反式作用rna(tasirna)、前体mrna(pre-mrna)或重复相关sirna(rasirna)。所提及的rna物质通常在尺寸、核苷酸组成、折叠状态以及是否存在3'延伸方面不同。例如,真核生物中的mrna分子通常包含3'多聚a尾部,其包括多个一磷酸腺苷并且在转录之后通过聚腺苷酸聚合酶连接至所述分子。其他rna物质或真核mrna的片段可以不包含这种延伸。例如,前体mrna(前体mrna)是包含尚未被聚腺苷酸聚合酶修饰的内含子序列的未处理的mrna分子。在优选的实施方式中,所述靶标rna多核苷酸是mrna、mrna片段、前体mrna分子、ncrna、mirna、snorna、tmrna、sirna或pirna。特别优选地,所述靶标rna是在3'端包含多聚a尾或寡聚a尾的rna多核苷酸。还设想了不包含mrna3'部分或不包含多聚a尾的mrna多核苷酸的片段。还设想了通常不包含多聚a尾的前体mrna分子。最终,还设想了不属于真核mrna组的rna多核苷酸物质;这些物质通常也不包含多聚a延伸。
rna多核苷酸的提供可以包括rna分子的提取和/或纯化,例如,通过胍-异硫氰酸盐溶胞,与细胞碎片的分离,过滤,柱,例如,二氧化硅膜柱洗脱,离心、消化,例如,dna酶消化,或者样品中核苷酸或蛋白部分的去除等。优选地,在包含防止rna降解的任何适合成分的缓冲溶液中提供所述rna多核苷酸。所述缓冲液可以(例如)是包含edta(例如,0.1mm)或te缓冲液(10mmtris,1mmedta)的不含rna酶的h2o缓冲液。所述缓冲液可以优选地包含rna酶阻断化合物或者rna酶抑制剂,如rnasezap、superase、rnaseout、核糖核酸酶抑制剂、rnasin等。
rna多核苷酸通常可以存在于其他分子,例如,其他rna多核苷酸或者其他核酸的混合物中。其他rna多核苷酸或核酸可以具有任何比例或大量存在,通常以天然情况下存在的,例如,细胞或样品中存在的,或者在如本文所提及的典型富集步骤之后存在的任何量或比例存在。
在其他实施方式中,rna多核苷酸的提供还可以包括保持rna分子或其部分处于单链形式的适合条件的使用。这些条件可以包括在本发明所述方法的实施之前或期间,特定温度或温度范围的使用,和/或避免在所述rna分子中形成二级结构的特定缓冲液或盐条件的使用。还设想了通过短暂热变性使所述rna多核苷酸或其部分成为单链。例如,当如本文所述的捕捉子多核苷酸退火时,可以应用这种短暂热变性。
rna多核苷酸的提供还可以包括从受试者采集样品以及它们的处理,例如,rna的提取或者有利于rna的提取的准备步骤。如本文所使用的术语“来自受试者的样品”涉及通过本领域技术人员已知的适合方法从受试者获得的任何生物材料。应优选地以临床可接受的方式,更优选地以保存rna多核苷酸的方式采集在本发明的背景中所使用的样品。所述生物样品可以包括身体组织和/或液体,如血液,或血液组分,如血清或血浆、汗液、痰液或唾液、精液和尿液以及排泄物或粪便样品。此外,所述生物样品可以含有来源于细胞群体的细胞提取物,所述细胞群体包括上皮细胞,优选地肿瘤上皮细胞或者来源于怀疑为肿瘤的组织的上皮细胞,或者癌性细胞或癌性组织。作为另外一种选择,所述生物样品可以来源于环境,例如,来源于土壤、湖、河等,或者来自动物来源。
在某些实施方式中,细胞可以用作rna多核苷酸的原始来源。因此,如有必要,可以从所获得的身体组织和体液中纯化细胞,然后进一步处理以获得rna多核苷酸。在某些实施方式中,可以将样品,具体地,初始处理之后的样品混合。本发明优选地设想了非混合的样品的使用。
在本发明的具体实施方式中,还可以对生物样品的含量进行富集步骤。例如,样品可以与对于某些细胞类型的细胞膜或细胞器特异的配体所官能化的(例如)磁性颗粒接触。随后,通过磁性颗粒浓缩的材料可以用于rna多核苷酸的提取。在本发明的其他实施方式中,可以获得和/或使用活组织检查或切除样品。这些样品可以包含细胞或细胞裂解液。此外,可以通过流体或液体样品,例如,血液、尿液、汗液等的过滤法来富集细胞,例如,肿瘤细胞。这些过滤处理还可以与基于如上文所述的配体特异性相互作用的富集步骤结合。
所述rna多核苷酸通常提供于液体,例如,水性溶液中。所述溶液可以包含适合的缓冲液或由其组成,所述缓冲液如退火/杂交缓冲液,例如,其包含ssc、nacl、磷酸钠、sds、te和/或mgcl2。
在本发明所述方法的下一步中,将与靶标rna多核苷酸的至少一部分互补的一个或多个捕捉子多核苷酸与所述靶标rna多核苷酸退火以获得所述靶标rna多核苷酸和所述捕捉子多核苷酸的杂交物。
如本文所使用的术语“多核苷酸退火”涉及单链rna多核苷酸与互补的单链多核苷酸通过氢键形成双链多核苷酸的配对。所述互补多核苷酸可以是rna分子或dna多核苷酸中的任一种。它还可以包含一个或多个修饰,如包含一个或多个非天然存在的核苷酸、对核苷酸的化学修饰、标签或间隔元件的存在等。优选地,所述互补多核苷酸是dna多核苷酸或修饰的dna多核苷酸。在正常情况下,核苷酸或核苷酸类似物将结合至它们的互补物,从而两条互补链将容易地彼此结合。例如,可以在pcr仪或允许选择用于退火的预定温度的类似加热装置中进行退火。如果这种加热装置允许在整个微量滴定板领域应用温度梯度,则可以快速确定最优退火温度。
退火通常在液体溶液,例如,包含如上定义的适合的缓冲液的水溶液中进行。可以根据技术人员已知的任何适合的温度、离子浓度和/或ph参数进行退火。例如,可以在溶液中在靶标rna多核苷酸中的大部分,优选地所有互补碱基与捕捉子多核苷酸进行互补碱基配对的温度和/或ph和/或离子浓度下进行退火。例如,可以通过将温度设置在仅允许完全,即100%互补结合的值来避免非特异性结合或退火反应。作为另外一种选择,可以将温度设置为允许约99%、98%、95%、90%、85%或80%的互补碱基互补结合的值。
如本文所使用的,术语“互补的”是指在相对核酸链中存在相匹配的基底对。例如,对于有义链中的核苷酸或碱基a,互补或反义链通过核苷酸或碱基t结合,或者反之亦然;同样地,对于有义链中的核苷酸或碱基g,互补或反义链通过核苷酸或碱基c结合,或者反之亦然。在本发明的某些实施方式中,可以通过有义链和/或反义链内单个或多个非互补碱基或核苷酸延伸的存在的可能性来改变这种全部或完全互补性方案。因此,在一对有义链和反义链的概念内,两条链可以完全互补或者可以仅部分互补,例如,在两条链的所有核苷酸之间或者在如本文所定义的特定节段中的所有核苷酸之间显示出约80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或100%的互补性。非互补碱基可以包括核苷酸a、t、g、c之一,即显示出a和g之间或者t和c之间的错配,或者可以包括任何修饰的核苷碱基,其包括(例如)如wipo标准st.25中所述的修饰的碱基。
如本文所使用的,术语“与靶标rna多核苷酸的至少一部分互补的”是指退火节段与所述靶标rna多核苷酸具有互补重叠。例如,所述捕捉子多核苷酸可以与靶标rna多核苷酸或者包含如本文所定义的靶标特异性序列的多核苷酸互补。所述重叠可以是(例如)5、7、10、12、15、18、20、22、25、28或30个核苷酸的重叠,或者上述值之间的任何值的重叠。还设想了更长的重叠。所述重叠通常是在捕捉子多核苷酸的3'端和靶标rna多核苷酸的3'端。在所述重叠内,互补碱基之间的匹配或互补性优选地为100%。作为另外一种选择,所述匹配小于100%,例如,99%、95%、90%、85%或小于85%。
如本文所使用的,术语“捕捉子多核苷酸”涉及具有限定长度的多核苷酸,其设计与相应靶标rna多核苷酸退火并借此结合或捕捉所述靶标rna多核苷酸。所述捕捉子多核苷酸可以具有任何适合的长度。它可以(例如)包含约15至300个核苷酸,例如,15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、40、50、100、150、200、250或者300个核苷酸或者所述值之间的任何值。还设想了更长的捕捉子多核苷酸。特别优选地,所述捕捉子多核苷酸包含约15-25个核苷酸。在某些实施方式中,所述捕捉子多核苷酸还可以包含其他元件,如一个或多个间臂元件、接头元件等。所述捕捉子多核苷酸可以包含能够结合或杂交至靶标rna多核苷酸的一个或多个部分和不能结合或杂交至靶标rna多核苷酸的一个或多个节段。后者可以具有结构功能或提供间臂或间隔功能性。优选地,所述捕捉子多核苷酸是单链dna分子。还设想了rna、pna、cna、hna、lna或ana分子或其混合物作为捕捉子多核苷酸。
本发明还设想所述捕捉子多核苷酸包含能够结合至同源相互作用因子(interactor)的标签。相互作用因子-标签结合可以有利地用于将所述捕捉子多核苷酸与来自溶液的任何结合或相结合的rna多核苷酸拉到一起,或者当围绕所述捕捉子多核苷酸移动时捕捉靶标rna多核苷酸。适合的标签和相互作用因子的实例是捕捉子多核苷酸上的生物素标签和适合的表面,例如,反应容器表面或者磁珠上提供的抗生蛋白链菌素相互作用因子等。其他实例包括结合至捕捉子多核苷酸的磁珠和吸引所述磁珠(例如,附着在表面上)的磁力分离器。
优选地,将所述捕捉子多核苷酸固定在磁珠上或者通过抗生蛋白链菌素-生物素结合固定。
在优选的实施方式中,所述捕捉子多核苷酸包含与所述靶标rna多核苷酸的多聚a尾至少部分互补的多聚t部分。这类捕捉子多核苷酸特异性设计以结合或捕捉含有多聚a节段的靶标rna多核苷酸,具体地mrna多核苷酸。
在其他优选的实施方式中,所述捕捉子多核苷酸包含与所述靶标rna多核苷酸上的特异性靶标序列至少部分互补的节段。例如,所述捕捉子多核苷酸与所述靶标rna多核苷酸上的预定序列延伸相匹配。该序列延伸通常不是多聚a尾或节段。所述节段可以(例如)代表特定rna多核苷酸组中的保守序列基序,例如,16srna、线粒体rna等。
设想所述捕捉子多核苷酸和所述靶标rna多核苷酸之间的互补部分,例如,多聚t/多聚a互补性或序列特异的互补性,包含12至30个核苷酸,优选地20个核苷酸。
在下一步中,成熟crrna(crisprrna)分子退火至所述靶标rna多核苷酸上的特异性靶标序列。crrna的特异性靶标序列通常不同于捕捉子多核苷酸的特异性靶标序列。还优选地,这些序列节段不重叠。
通常,这种方法基于crispr/cas系统的使用。如本文所使用的术语“crispr/cas系统”涉及特异性切割和修饰核酸的生物化学方法,也称为基因组编辑。例如,通常可以通过crispr/cas系统插入、去除或关闭基因组中的基因,还可以改变基因或核酸分子中的核苷酸。crispr/cas系统的概念和活性步骤的效果与rna干扰具有多种相似性,因为约18至20个核苷酸的短rna片段介导了细菌防御机制中对靶标的结合。在crsipr/cas系统中,通常rna引导的核酸结合蛋白,如cas蛋白作为核糖核蛋白结合某些rna序列。例如,cas核酸内切酶可以结合至被称为crrna重复的某些rna序列并且切割紧邻这些序列的核酸。不希望受理论束缚,据信crrna重复序列形成了第二rna结构,并随后通过改变其蛋白折叠的核酸结合蛋白(例如,cas)结合,从而使得靶标核酸能够与rna结合。
在vi型crispr/cas系统中,当与crrna组装时,单链rna引导的效应因子蛋白cas13形成了crrna引导的rna靶向效应因子复合物。因此,crispr/cas13系统包含两个主要组分:(i)可编程单效应因子rna引导的rna酶cas13和(ii)64-66个核苷酸crisprrna(crrna),其通过前间隔区侧翼位点(pfs)识别靶标rna上的24-30个核苷酸序列。另外,所有cas13蛋白具有两种酶促活性不同的核糖核酸酶活性:(i)通过cas蛋白和/或宿主因子的前体-crrna(pre-crrna)前体-crispr-rna(pre-crispr-rna)的核降解处理和(ii)通过两个hepn(高等真核生物和原核生物核苷酸-结合)域的rna酶活性起始的靶标rna的降解(grandaros-riveronandaquino-jarquin,2018,cancerresearch,78(15),4107-13)。
因此,如本文所使用的术语“成熟crrna(crsiprrna)”涉及能够识别并结合特异性rna多核苷酸序列的vi型crispr/cas系统的rna分子。通常,成熟crrna包含可以用于将rna结合蛋白引导至结合位点的靶标特异性序列。这种靶标特异性序列可以具有任何适合的长度。优选地,所述长度在约19至60个核苷酸之间。更优选地,所述序列具有30个核苷酸的长度。
如east-seletskyetal.,2017,molcell.,66(3),373-383中所述,根据本发明的vi型crispr/cas系统的成熟crrna包含茎段、环段、凸起段(bulgesegment)和包含如上定义的靶标特异性序列的间臂段。成熟crrna通常通过成熟处理来源于前体-crrna分子。照此还可以提供它们并且在不来源于所述前体-crrna期的情况下使用。用于获得成熟crrna的其他选择可以来源于smargonetal.,2017,molcell.,16,65(4),618-630或者coxetal.,2017,science,10.1126/science.aaq0180。例如,可以提供包含不同形式的茎结构、不同的环结构或其中间隔序列差异截短等的成熟crrna。根据本发明的其他实施方式,根据crrna引导的rna结合蛋白,例如,cas蛋白的形式或特性,成熟crrna的序列和形式可以是不同的。因此,基于所述crrna引导的rna结合蛋白的来源,可以使用序列元件的不同组合。本发明还设想了在这种背景下的任何未来发展,并且包括超出可来源于smargonetal.,2017,molcell.,16,65(4),618-630的信息的crrna-rna结合蛋白相互作用的任何修饰或改善。对cas13a、cas13b、cas13c或cas13d使用成熟crrna是特别优选的。还设想了来自商品化供应商的成熟crrna或者单独制备的crrna。
因此,本发明的中心原理之一是结合至crrna内的靶标rna部分的序列的使用,其中所述结合序列对靶标rna多核苷酸特异并因此能够识别所述序列并将其与其他序列相区分。
在其他步骤中,无催化活性的crrna引导的rna结合蛋白结合至步骤(iii)的复合物,即成熟crrna(crisprrna)分子和靶标rna多核苷酸的复合物。这导致产生了蛋白-rna多核苷酸复合物。根据如上定义的crspr/cas方法,因此通过如上所述的成熟crrna所识别的序列与同源的无催化活性的crrna引导的rna结合蛋白间接结合(通过crrna)。
如本文所使用的术语“无催化活性的crrna引导的rna结合蛋白”涉及rna结合蛋白,例如,cas蛋白,其能够结合至rna的特异性延伸,但是不保留其核酸内切酶活性并因此不切割或消化rna。这使得能够可编程追踪和鉴别rna分子而不损害它们。在优选的实施方式中,所述无催化活性的crrna引导的rna结合蛋白是cas蛋白,更优选地它是cas12或cas13蛋白家族成员。cas12家族蛋白的实例包括cas12a。cas12蛋白优选地为天然存在的cas12蛋白的衍生物,具体地,已修饰的衍生物,例如,通过蛋白质工程修饰,从而能够结合至rna多核苷酸。特别优选地,它是cas13蛋白或其衍生物。适合的亚型可以包括(例如)cas13a、cas13b、cas13c和cas13d蛋白。有关无催化活性的crrna引导的rna结合蛋白的其他信息可以来源于适合的文献来源,如coxetal.,2017,science,10.1126/science.aaq0180。
还设想了所提及的rna结合蛋白,例如,cas蛋白的衍生物或其突变体。所述衍生物优选地为crrna引导的rna结合蛋白的功能衍生物,其能够结合至rna的特异性延伸(specificstretch),但是不保留其核酸内切酶活性。在具体的实施方式中,本发明具体地设想了无催化活性的cas13或cas12蛋白或“死”cas蛋白(dcas)的产生。可以根据技术人员已知的任何适合的方法产生这些蛋白。例如,可以通过使两个保守hepn域内的催化精氨酸残基突变来获得它们。其他信息可以来源于abudayyehetal.,2017,nature,550(7675),280-284。
本发明还设想了来源于不同细菌来源的cas蛋白,例如,cas13的使用。例如,所述cas13蛋白可以来源于沙氏纤毛菌(leptotrichiashahii)、韦德纤毛菌(leptotrichiawadei)、普雷沃氏菌属种(prevotellaspp.)或者酿脓链球菌(streptococcuspyogenes)。
有关cas蛋白的形式和使用的其他详细信息可以来源于适合的文献来源,如granados-riveronandaquinojarquin,2018,cancerresearch;coxetal.,2017,science,10.1126/science.aaq0180;gootenbergetal.,2018,science360,439-444或者abudayyehetal.,2016,science,353(6299)。
在后续步骤中,去除未结合的成熟crrna分子和未结合的无催化活性的crrna引导的rna结合蛋白。可以通过任何适合的技术,例如,通过去除或再配置反应物、抑制或破坏crrna分子或rna结合蛋白等来实施去除。在典型且优选的实施方式中,通过清洗如所述方法之前步骤所获得的复合物来实现所述去除。可以实施一次清洗步骤,或者它可以重复1、2、3或更多次。优选地,如技术人员已知的,用无核酸酶的水或者用含有适当离子浓度和/或具有适合ph的任何其他适合的溶液进行清洗。
在根据本发明所述的方法的其他步骤中,抗体结合至步骤(iv)的蛋白-rna多核苷酸复合物。
如本文所使用的术语“抗体”是指免疫球蛋白分子和免疫球蛋白分子的免疫活性部分,即含有免疫特异性结合抗原,具体地特异性结合如本文以上所定义的蛋白-rna多核苷酸复合物,更具体地结合作为所述复合物的一部分的无催化活性的crrna引导的rna结合蛋白的抗原结合位点的分子。本发明的免疫球蛋白分子可以是免疫球蛋白分子的任何类型(例如,igg、ige、igm、igd、iga和igy)、类(例如,igg1、igg2、igg3、igg4、iga1和iga2)或亚类。免疫特异性结合是指抗如本文以上所定义的无催化活性的crrna引导的rna结合蛋白的抗原性表位的抗体的免疫特异性检测和结合。在其他实施方式中,本发明的抗体包括多克隆、单克隆、多重特异性、人、人源化或嵌合抗体或者完整的免疫球蛋白分子。
优选地,所述抗体是单克隆抗体。在特别优选的实施方式中,根据本发明的抗体是能够结合无催化活性的dcas13蛋白的单克隆抗体。
在某些实施方式中,所述抗体还可以是或包含抗体子结构。如本文所使用的术语“抗体子结构”是指单链抗体、fab片段、fab'片段、通过fab表达文库产生的片段、f(ab')2、fv、二硫键连接的fv、微抗体、双链抗体、scfv、sc(fv)2和任何上述的表位结合片段。优选fab、fab'和f(ab')2、fv、单链fv(scfv)、sc(fv)2、单链抗体、二硫键连接的fv(sdfv)和包含vl或vh域的片段。如本文所使用的术语“fab片段”是指由完整免疫球蛋白的重链(ch1)的第一恒定域、轻链(cl)的恒定域、重链(vh)的可变域和轻链(vl)的可变域组成的抗体片段
如本文所使用的术语“f(ab')2”或“f(ab')2片段”是指由完整免疫球蛋白的两个重链(ch1)的第一恒定域、两个轻链(cl)的恒定域、两个重链(vh)的可变域和两个轻链(vl)的可变域组成的抗体片段,即它包含两个fab片段。另外,f(ab')2分子在抗体铰链区中包含s-s键,其将fab片段结合。如本文所使用的术语“fab'片段”是指来源于“f(ab')2”分子的片段,优选地包含抗体铰链区中的s-s键的片段。如本文所使用的术语“fv片段”是指由两个可变抗体域vh和vl组成的抗体片段;其他详细信息可以来源于skerraandplückthun,1988,science,240:1038-1041。如本文所使用的术语“单链fv片段(scfv)”表示由通过柔性肽接头连接在一起的两个vh和vl域所组成的抗体片段;其他详细信息可以来源于birdandwalker,1991,trendsbiotechnol.,9:132-137。
还设想了抗体形成,如双链抗体或微抗体。详细信息可以来源于hudsonandkortt,1999,j.immunol.methods,231(1-2):177-89或quiocho,1993,nature,362(6418):293-294。
所述抗体可以来自任何动物来源,包括鸟和哺乳动物。优选地,所述抗体是鼠科(例如,小鼠和大鼠)、驴、猴、兔、山羊、豚鼠、骆驼、马、鸡或人抗体。
根据本发明的抗体通常是单特异性的。在某些具体的实施方式中,所述抗体还可以是双重特异性的或者具有更大的多重特异性。多重特异性抗体可以对如本文以上所定义的无催化活性的crrna引导的rna结合蛋白的不同表位特异。
还可以就它们识别或特异性结合的多肽的表位或部分来描述或指明本发明的抗体。所述表位可以优选地存在于如本文以上所定义的无催化活性的crrna引导的rna结合蛋白上,更优选地存在于无催化活性的cas12或cas13蛋白上,或者能够结合至rna多核苷酸的无催化活性的cas12a衍生物上,或者无催化活性的cas13a、cas13b、cas13c或cas13d蛋白上。
在本发明所述方法的其他步骤中,去除未结合的抗体。可以通过任何适合的技术实施所述去除。在典型且优选的实施方式中,通过清洗如所述方法之前步骤所获得的抗体结合的复合物来实现所述去除。可以实施一次清洗步骤,或者它可以重复1、2、3或更多次。优选地,如技术人员已知的,用无核酸酶的水或者用含有适当离子浓度和/或具有适合ph的任何其他适合的溶液进行清洗。
在本发明所述方法的最终步骤中,检测如上所述的抗体结合的蛋白-rna多核苷酸复合物。可以根据技术人员已知的任何适合的方法进行检测。如上所述的抗体结合的蛋白-rna多核苷酸复合物的检测优选地基于酶促反应或非酶促反应。
例如,可以通过如本文所定义的抗体上存在的标记的鉴定来进行非酶促反应。这种标记可以是(例如)技术人员已知的任何适合的标记,例如,放射性标记、荧光标记、化学发光标记或生物发光标记。可以缀合至根据本发明的抗体的标记的实例包括荧光染料或金属(例如,荧光素、罗丹明、藻红蛋白、荧光胺)、发色染料(例如,视紫红质)、化学发光化合物(例如,鲁米那、咪唑)、荧光多肽(例如,绿色荧光蛋白(gfp))和生物发光蛋白(例如,萤光素、荧光素酶)和造影剂,如uspios或19fluor。可以在本发明的背景中使用的其他标记包括6-fam、hex、tet、rox、cy3、cy5、德克萨斯红或罗丹明、tamra、dabcyl、黑洞猝灭剂(blackholequencher)、bhq-1或bhq-2。所述抗体还可以用放射性同位素标记,例如,3h、14c、32p、33p、35s、125i、11c、13n、15o、18f、64cu、62cu、124i、76br、82rb、68ga或18f。特别优选化学发光检测。
更优选地,所述检测基于吖啶鎓酯的化学发光反应。通常,在存在稀碱性过氧化氢的情况下,可以刺激吖啶鎓酯以产生光。此外,所形成的n-甲基吖啶酮分子通常在辐照前耐受淬灭。化学发光标记,具体地吖啶鎓酯可以在任何适合的位置缀合或共价连接至如本文所述的抗体。
如上所述的抗体结合的蛋白-rna多核苷酸复合物通过酶促反应的检测可以包括酶促标记的存在。优选的酶促活性或标记是辣根过氧化物酶(hrp)、碱性磷酸酶(ap)、葡萄糖氧化酶(god)或者酯酶。因此,酶促活性可以在任何适合的位置缀合或共价连接至如本文所述的抗体。
基于酶的检测还需要通过如上所述的由酶活性转化的适合的底物。例如,对于辣根过氧化物酶(hrp),存在几种不同类型的底物,其可以根据具体测定和检测模式来选择。一种选择是使用生色hrp底物,其保留在溶液中并且在与hrp反应后生色。通常使用的生色hrp底物包括3,3',5,5'-四甲基联苯胺(tmb)和2,2'-连氮基-二-[3-乙基苯并噻唑-6-磺酸](abts)。在通过hrp氧化后,一些底物沉淀。氧化的hrp底物可以(例如)形成有色、电子密集或发光的沉淀。通过本发明设想的有色且电子密集的适合的hrp底物的实例是3,3'-二氨基联苯胺(dab)。还设想了增强化学发光(ecl)技术的使用,例如,如通过bioradinc.商品化的技术。
适合于碱性磷酸酶(ap)的底物包括磷酸p-硝基苯酯(pnpp)和4-甲基伞形酮磷酸酯(4-mup)。pnpp的使用基于以下原理:当碱性磷酸酶和pnpp反应时,形成黄色水溶性反应产物。由于它在405nm吸收光,因此可以检测这种反应产物。4-mup是碱性磷酸酶的底物,其形成了可溶性荧光反应产物甲基7-羟基香豆素。可以通过360nm激发和440nm发射来测量荧光。例如,可以使用uv光源来观察荧光终产品。
使用葡萄糖氧化酶(god)的酶促测试基于葡萄糖氧化酶对葡萄糖的氧化,即葡萄糖的c1碳原子的氧-依赖性氧化,其导致产生了葡糖酸内酯和过氧化氢。随后,可以在通过过氧化物酶(pod),如hrp所实施的下游显色反应中使过氧化氢还原。作为另外一种选择,可以电化学测量所产生的过氧化氢并因此进行定量。
适合于酯酶基测试的底物包括5-溴-4-氯-3-吲哚基乙酸酯、4-甲基伞形酮乙酸酯、1-乙酸萘酯、1-丁酸萘酯、4-硝基苯月桂酸酯、4-硝基苯豆蔻酸酯、4-硝基苯丁酸酯、p-氨基苯基丁酸酯、5-(和6-)羧基-2',7'-二氯荧光素双乙酸酯或者4-硝基苯碘苯腈辛酸酯。
可以根据任何适合的测定形式,具体地免疫生物学测定进行检测。其中可以使用根据本发明的靶标rna多核苷酸的设想的免疫生物学测定的实例包括使用如下所述技术的竞争性和非竞争性测定系统,所述技术如免疫印迹、放射免疫测定,如ria(放射性联接免疫测定)、elisa(酶联免疫吸附测定)、“夹心”免疫测定、免疫放射测定、荧光免疫测定,例如,fia(荧光-联接免疫测定)、化学发光免疫测定和电化学发光免疫测定(eclia)或其适合的衍生物。这些测定的详细信息和其他特征将是技术人员已知的或者可以来源于适合的文献来源,如g.sittasittampalam,bethesda(md)主编的电子书assayguidancemanual:elililly&companyandthenationalcenterforadvancingtranslationalsciences;2004(http://www.ncbi.nlm.nih.gov/books/nbk53196/),具体地,immunoassaymethods节,karenl.coxetal.,elililly&company,indianapolis,in,2012或其随后的修订形式。在具体的实施方式中,所述测定形式是elisa。如本文所使用的术语“elisa”或“elisa测定”涉及固相酶免疫测定(eia),其通常用于使用一种或多种抗体检测样品中化合物的存在,所述样品通常是液体或已成为溶液。elisa可以用作诊断工具,例如,在医学或质量控制检查中。
通常,将来自样品的抗原,即结合至如本文所述的靶标rna多核苷酸的无催化活性的crrna引导的rna结合蛋白上存在的抗原连接至固相,如表面或磁珠,其可以(例如)通过rna多核苷酸与捕捉子多核苷酸的结合而被吸引至相容表面,所述捕捉子多核苷酸与如本文以上所述的靶标rna多核苷酸的至少一部分互补。优选使用磁珠。随后,在表面或磁珠上应用特异性抗体,从而它可以结合至抗原。这种抗体可以联接至酶,例如,如本文以上所定义的,并且在最后一步,加入含有酶底物的物质。后续反应产生了可检测信号,例如,底物中的颜色变化。
在特别优选的实施方式中,根据和/或在免疫测定平台上进行测定,如通过siemenshealthineers商品化的centaur或atellica。这些平台上的其他信息可以来源于(例如)https://www.healthcare.siemens.de/immunoassay/systems/advia-centaur-xpt(2018年10月24日访问)或https://www.healthcare.siemens.com/integrated-chemistry/systems/atellica-solution-analyzers(2018年10月24日访问)或者来源于文档“adviacentaurxptimmunoassaysystemtechnicalspecifications”,其可以来源于适合的因特网资料库,如https://static.healthcare.siemens.com/siemens_hwem-hwem_ssxa_websites-context-root/wcm/idc/groups/public/@global/@lab/documents/download/mda2/otmw/~edisp/170168-gc1_updates_advia_centaur_xpt_ss_fnl2-03931885.pdf(2018年10月25日访问)或来源于文档“atellicaim1300analyzerandatellicaim1600analyzertechnicalspecifications”,其可以来源于适合的因特网资料库,如https://static.healthcare.siemens.com/siemens_hwem-hwem_ssxa_websites-context-root/wcm/idc/groups/public/@global/@lab/@corelab/documents/download/mda4/mtgy/~edisp/30-17-10702-01-76_atellica_im_1300-1600_ss_final_v2-05269699.pdf(2018年10月25日访问)。
根据本发明的检测可以是定性检测、半定量检测或定量检测。
如本文所使用的术语“定性检测”表示本发明所述的方法能够指明特定靶标rna多核苷酸是否存在。因此,通过经由结合抗体对信号的检测,可以推断存在靶标rna多核苷酸,例如,在如上所述的不同的rna多核苷酸的混合物中存在。在优选设想的elisa中,定性分析表示该测定可以用于实现对指明样品中是否存在靶标rna多核苷酸(通过如本文以上所定义的无催化活性的crrna引导的rna结合蛋白)的问题的是或否的回答。这可以通过相对于不包含靶标rna多核苷酸或不相关对照靶标rna多核苷酸的样品的比较实现。
如本文所使用的术语“半定量检测”表示本发明所述的方法能够表明特定靶标rna多核苷酸是否相对于其在溶液中的数目或量或浓度以高于特定阈值存在。可以如技术人员已知的适合地定义阈值。例如,通过在基于如本文所述的抗体的测定中检测信号,可以推断在(例如)如上所述的不同的rna多核苷酸的混合物中存在的靶标rna多核苷酸相对于其数目、量或浓度超过了特定预定限制。所述形式还允许比较样品间,具体地,相同测定形式,例如,elisa,或者在如本文以上所提及的平台centaur或atellica上实施的测定内所使用的样品间的靶标rna多核苷酸的相对水平。
如本文所使用的术语“定量检测”表示本发明所述的方法能够表示用于所述方法的特异性靶标rna多核苷酸的近似或准确数目、量或浓度。对于定量检测,需要适合的对照和/或校准步骤。通常,定量检测包括与标准曲线(例如,已知纯化的靶标rna多核苷酸的连续稀释)相比对信号的解释,以准确计算多种样品中的靶标rna多核苷酸的浓度。例如,在elisa形式中,所获得的信号数据可以以光密度vs.log浓度绘图来产生s形曲线。已知浓度的靶标rna多核苷酸可以用于产生标准曲线。该数据随后可以通过与标准曲线的直线部分相比,用于测量未知样品的浓度。这可以有利地直接在图上完成,或者通过技术人员已知的适合的曲线拟合软件完成。
还优选地,通过对标准品读数的三次重复取平均值并扣除空白对照样品的读数来实施定量检测。随后,绘制标准曲线并鉴别出最佳拟合线,从而可以确定样品浓度。在此阶段,需要对所制备的任何稀释液进行调整。作为另外一种选择,可以使用半对数(semi-log)、对数/对数(log/log)、对数/分对数(log/logit)或其衍生物在4或5参数逻辑模型(logisticmodel)中对信号数据绘图。使用基于软件的/自动的方案,可以实施适合的绘图方法。所述方法还设想了线性回归的使用,例如,软件包内的线性回归的使用,其允许其他控制可能性。其他详细信息将是技术人员已知的或者可以来源于适合的文献来源,如华盛顿大学医疗中心(universityofwashingtonmedicalcentre)的文档laboratoryproceduremanual:complexpsausingadviacentaurinserumnhanes2007-2008。
在非常具体的实施方式中,随后可以将所检测的靶标rna多核苷酸,即包含靶标特异性序列的rna多核苷酸提取,任选地纯化,储存和/或用于其他活动。
在具体的实施方式中,本发明还设想了在如上所述的上述步骤中的任何一个或多个之间或之后,任选地使用或实施一个或多个其他清洗或去除步骤。可以通过任何适合的技术,例如,通过去除或再配置反应物、抑制或破坏分子来实施这些去除步骤。在典型且优选的实施方式中,通过如本文以上所述的清洗实现所述去除。可以实施一次清洗步骤,或者它可以重复1、2、3或更多次。优选地,如技术人员已知的,用无核酸酶的水或者用含有适当离子浓度和/或具有适合ph的任何其他适合的溶液进行清洗。
在优选的实施方式中,可以利用能够收集磁珠,例如,连接至如上所述的靶标rna多核苷酸的磁珠的磁铁来实施如本文以上所提及的一个或多个去除或清洗步骤,包括未结合的成熟crrna、未结合的无催化活性的crrna引导的rna结合蛋白或者未结合的抗体的去除步骤。随后可以用连续水流清洗所述磁珠,然后产生去除水的真空。特别优选地,根据如本文以上所述的或者技术人员已知的对于siemenshealthineers的centaur或者atellica测定平台所述的程序进行清洗步骤,包括如本文以上所提及的任何清洗步骤。
在另一个方面,本发明涉及试剂盒,其包含与所述靶标rna多核苷酸的至少一部分互补的一个或多个捕捉子多核苷酸,对所述靶标rna多核苷酸上的靶标序列特异的成熟crrna(crisprrna)分子,由所述成熟crrna引导的无催化活性的crrna引导的rna结合蛋白和结合至所述无催化活性的crrna引导的rna结合蛋白的抗体。所述试剂盒优选地用于检测靶标rna多核苷酸,例如,rna多核苷酸混合物中的靶标rna多核苷酸。如本文以上所定义的方法的特征还适用于本发明所述的试剂盒。所述试剂盒可以(例如)包含如本发明所述方法的一个或多个步骤中所定义的试剂和组分。一般地,所述试剂盒可以包含适合的缓冲溶液、标记物或清洗液等。所述试剂盒还可以包含用于结合抗体检测的适合的底物,例如,如本文以上所定义的酶促底物,或者用于如本文以上所述的非酶促检测的底物。此外,所述试剂盒可以包含一定量的已知的核酸分子,例如,rna多核苷酸或者蛋白,其可以用于所述试剂盒的校准或者用作内部对照。相应成分将是技术人员已知的。
另外,所述试剂盒可以包含说明书活页和/或可以提供有关其使用等的信息。
还设想了实施上述方法步骤的设备。所述设备可以(例如)由不同模块组成,其可以实施本发明所述方法的一个或多个步骤。这些模块可以以任何适合的方式组合,例如,它们可以存在于单一位置或者是分离的。还设想了所述方法在不同时间点和/或不同位置的实施。在如本文所定义的所述方法的一些步骤之后,可以是休息或暂停,其中适当储存所述试剂或产物等,例如,在冰箱或冷却装置中储存。在如本文所定义的设备的特定模块中实施这些步骤的情况下,所述模块可以用作储存车辆。所述模块还可以用于将反应产物或试剂运输至不同的位置,例如,不同的实验室等。
在另一个方面,本发明涉及与靶标rna多核苷酸的至少一部分互补的一个或多个捕捉子多核苷酸,对所述靶标rna多核苷酸上的靶标序列特异的成熟crrna(crisprrna)分子和由所述成熟crrna引导的无催化活性的crrna引导的rna结合蛋白用于检测靶标rna多核苷酸的用途。所述用途优选地为用于rna多核苷酸检测测定。所述测定可以包括(例如)将与靶标rna多核苷酸的至少一部分互补的捕捉子多核苷酸结合至所述靶标rna多核苷酸的步骤,将对靶标序列特异的成熟crrna(crisprrna)分子结合至靶标rna多核苷酸的步骤和将rna引导的无催化活性的rna结合蛋白通过成熟crrna结合至靶标序列的步骤。在其他实施方式中,本发明还设想了如本文以上所定义的抗体用于检测如上所述的未结合的无催化活性的crrna引导的rna结合蛋白的用途。所述测定因此还可以包括如上所列的抗体结合和后续检测步骤。如本文以上所定义的方法的特征还适用于如上所述的用途或测定。
现转向图1,提供了根据本发明的实施方式用于检测靶标rna多核苷酸的测定的步骤的示意图。在第一步中,提供了靶标rna多核苷酸1和结合至磁珠11的具有多聚t链的捕捉子多核苷酸2。具有多聚t链并且结合至磁珠11的捕捉子多核苷酸2与靶标rna多核苷酸1退火3。随后,成熟crrna(crisprrna)分子4结合6至靶标rna多核苷酸1上的特异性靶标序列,随后是无催化活性的crrna引导的rna结合蛋白5的结合6。这产生了蛋白-rna多核苷酸复合物7。在后续步骤中,包含标记的抗体9结合8至蛋白-核酸复合物7,具体地,无催化活性的crrna引导的rna结合蛋白5。最终,可以检测结合的抗体10。
附图标记列表
1具有多聚a尾的靶标rna多核苷酸
2具有与靶标rna多核苷酸的多聚a尾互补的多聚t部分的捕捉子多核苷酸
3捕捉子多核苷酸与靶标rna多核苷酸的退火
4成熟crrna(crisprrna)
5无催化活性的crrna引导的rna结合蛋白
6成熟crrna与靶标rna多核苷酸上的靶标序列的退火和无催化活性的crrna引导的rna结合蛋白与crrna-靶标rna多核苷酸复合物的结合
7蛋白-rna多核苷酸复合物
8抗体与蛋白-核酸复合物的结合
9对无催化活性的crrna引导的rna结合蛋白特异的抗体
10结合至蛋白-rna多核苷酸复合物的抗体
11磁珠
出于说明性目的提供了以下实施例和图。因此,应理解附图不应视为限制性的。本领域技术人员将明显能够设想对本文所述原理的进一步改变。
实施例
实施例1
所提出的mrna免疫测定是适合于advia
在测定中,将来自血液样品的纯化的mrna首先杂交至生物素化的多聚t捕捉子多核苷酸,从而产生完全匹配的dna/rna异源杂交物。在第二步中,然后将这些生物素化的dna/rna异源杂交物与抗生蛋白链菌素-标记的固相培育并结合,并通过crrna引导的无活性cas13a蛋白识别。在下一步中,添加无活性的cas13a蛋白的吖啶鎓酯-标记的抗体。因此,所结合的抗体的量将与反应中存在的crrna引导的无活性cas13a蛋白所识别的mrna的量成比例,其还与血液样品中存在的特异性mrna物质的量成比例。然后,通过酸和碱试剂的后续添加引发化学发光。
具体地,通过adviacentaur系统以自动方式实施以下9步:
1)将75μl样品移液至比色皿。2)移液75μl含有生物素化的多聚t捕捉子寡聚核苷酸(10nmol/l)的试剂(20mmol/l磷酸钠,ph7.2,300mmnacl,0.1%tritonx-100,0.5%牛血清白蛋白,0.02%叠氮化钠)并在37℃培育6分钟。3)移液150μl固相,crrna引导的无活性cas13a蛋白并在37℃培育18分钟。4)从混合物分离固相并去除液相。5)用清洗溶液i清洗比色皿并在37℃培育6.75分钟。6)移液95μl抗体试剂并在37℃培育18分钟。7)从混合物分离固相并去除液相。8)用清洗溶液i清洗比色皿。9)移液300μl试剂a(酸)和300μl试剂b(碱),以分别产生化学发光信号。
校准曲线和浓度计算:使用浓度为1pmol/l至1nmol/l的合成mrna在adviacentaur系统上测量校准曲线,实施二次多项式分析以确定rlu(相对光单位)计数和mrna浓度之间的关系方程。然后,在相同adviacentaur系统上测量生物样品。
基于校准曲线方程,根据rlu计数计算生物样品的特定mrna的浓度。
- 还没有人留言评论。精彩留言会获得点赞!