信使RNA纯化的方法和组合物与流程
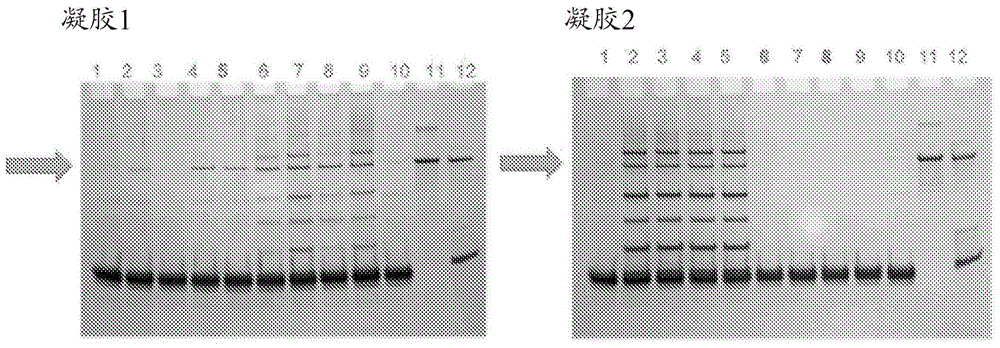
相关申请本申请要求2018年11月8日提交的美国临时申请序列号62/757,612的优先权,所述美国临时申请的公开内容在此通过引用并入。背景信使rna疗法(mrt)是一种治疗多种疾病的有前途的新方法。mrt涉及向需要治疗的患者施用信使rna(mrna)。施用的mrna产生由患者体内的mrna编码的蛋白质或肽。通常使用涉及rna聚合酶的酶促反应的体外转录系统(ivt)合成mrna。ivt合成过程之后通常进行用于添加5'-帽子(加帽反应)和3'-polya尾巴(聚腺苷酸化)的反应。这些反应产生这样的组合物,其不仅包括如此形成的全长mrna,而且包括所得反应混合物中的各种不期望的污染物,例如在反应中使用或产生的蛋白质、盐、缓冲液和非mrna核酸。各种纯化方法可以用于去除污染物以提供纯化的mrna。然而,痕量的残留污染物蛋白或酶可能在患者中导致未知的副作用。为了获得适于在对象中施用的纯化的mrna,目前需要多轮纯化。因此,常规的纯化方法和组合物不足以提供干净且均质的mrna,其不含污染物并且无需昂贵和多步纯化过程就适合于患者施用。需要新的和改善的方法来获得用于治疗用途的mrna,其不含污染物,特别是来自mrna合成过程中的残留蛋白质或酶。发明概述本发明提供了体外合成mrna的改善的纯化方法。本发明部分基于令人惊讶的发现,即mrna在包含高浓度胍盐和去污剂的缓冲液中的沉淀极大地改善了从mrna产物中去除蛋白质污染物。具体地,加帽和加尾的mrna的单轮沉淀,然后进行纯化步骤,可以从体外合成的mrna中成功地去除可检测水平的残留酶。纯化步骤(如重复的沉淀步骤)数量的减少导致更容易和更具成本效益的制备过程。更重要的是,本文所述的组合物和方法导致出乎意料地高的mrna回收率、纯度和完整性。因此,本发明允许用于治疗用途的mrna的更有效和更具成本效益的制备。另外,本发明的方法可用于纯化大量的mrna。一方面,本发明提供了从通过大规模体外转录过程(ivt)合成的信使rna(mrna)制备物中去除杂质的方法,所述方法包括:在包含变性盐与还原剂的组合的缓冲液中沉淀所述ivt合成的mrna;捕获沉淀的mrna;以及将捕获的mrna溶解于溶液中,从而纯化所述mrna。在一些实施方案中,所述方法还包括在沉淀所述mrna之前使所述mrna加帽和加尾的步骤。在一些实施方案中,通过大规模ivt过程获得的mrna制备物中的杂质包括蛋白质、不完全的rna转录物、核苷酸和盐,所述蛋白质包括用于ivt、加帽和加尾的酶。在一些实施方案中,通过所述方法获得的纯化的mrna大于合成的mrna的量的至少90%。在一些实施方案中,通过所述方法获得的纯化的mrna基本上不含任何酶杂质。在一些实施方案中,在所述ivt反应中合成至少约1mgmrna。在一些实施方案中,在所述ivt反应中合成至少约50mgmrna。在一些实施方案中,在所述ivt反应中合成至少约1克(g)mrna。在一些实施方案中,在所述ivt反应中合成至少约10gmrna。在一些实施方案中,在所述ivt反应中合成至少约100gmrna。在一些实施方案中,在所述ivt反应中合成至少约1kgmrna。在一些实施方案中,用于所述沉淀步骤的缓冲液还包含醇。在一些实施方案中,沉淀步骤在mrna、变性缓冲液和醇以1:(5):(3)的体积比存在的条件下进行。在一些实施方案中,沉淀步骤在mrna、变性缓冲液和醇以1:(3.5):(2.1)的体积比存在的条件下进行。在一些实施方案中,沉淀步骤在mrna、变性缓冲液和醇以1:(2.8):(1.9)的体积比存在的条件下进行。在一些实施方案中,沉淀步骤在mrna、变性缓冲液和醇以1:(2.3):(1.7)的体积比存在的条件下进行。在一些实施方案中,沉淀步骤在mrna、变性缓冲液和醇以1:(2.1):(1.5)的体积比存在的条件下进行。在一些实施方案中,所述变性盐是硫氰酸胍。在一些实施方案中,所述变性缓冲液包含硫氰酸胍-柠檬酸钠,n-月桂基肌氨酸(gscn)。在一些实施方案中,硫氰酸胍以2m或更高、3m或更高、4m或更高、5m或更高、或者6m或更高、7m或更高的最终浓度存在。在一些实施方案中,硫氰酸胍以高于至少3m的最终浓度存在。在一些实施方案中,硫氰酸胍以高于至少4m的最终浓度存在。在一些实施方案中,硫氰酸胍以5m的最终浓度存在。在一些实施方案中,所述还原剂选自二硫苏糖醇(dtt)、β-巯基乙醇(b-me)、三(2-羧乙基)膦(tcep)、三(3-羟丙基)膦(thpp)、和二硫代丁胺(dtba)。在一些实施方案中,所述还原剂是二硫苏糖醇(dtt)。在一些实施方案中,dtt以大于1mm且至多约200mm的最终浓度存在。在一些实施方案中,dtt以2.5mm至100mm的最终浓度存在。在一些实施方案中,dtt以5mm至50mm的最终浓度存在。在一些实施方案中,dtt的浓度是5mm、10mm、15mm或20mm。在一些实施方案中,沉淀所述mrna的步骤进行一次以上。在一些实施方案中,沉淀所述mrna的步骤仅进行一次。在一些实施方案中,捕获所述mrna的步骤还包括对所述mrna进行过滤、离心、固相可逆吸附或它们的组合。在一些实施方案中,所述过滤是切向流过滤(tff)。在一些实施方案中,所述过滤是深度过滤(df)。在一些实施方案中,使用nutsche过滤器进行过滤。在一些实施方案中,所述过滤与离心组合进行。在一些实施方案中,溶解所述捕获的mrna的步骤在水溶液中进行。在一些实施方案中,所述捕获的mrna的步骤进一步在包含较低盐浓度的合适缓冲液中进行透析。在一些实施方案中,纯化的组合物基本上不含任何蛋白质杂质,其是少于5%、少于4%、少于3%、少于2%、少于1%的蛋白质杂质或者是0%的蛋白质杂质。在一些实施方案中,所述纯化的mrna基本上不含盐。在一些实施方案中,所述纯化的mrna包含至少大于95%、大于96%、大于97%、大于98%、大于99%或约100%的编码蛋白质的全长mrna。本文提及的专利和科学文献建立了本领域技术人员可获得的知识。本文引用的所有美国专利和公开的或未公开的美国专利申请通过引用并入。本文引用的所有公开的外国专利和专利申请在此通过引用并入。本文引用的所有其它公开的参考文献、文件、手稿和科学文献在此通过引用并入。本发明的其它特征和优点将从附图以及以下详述和权利要求中显而易见。附图简述当结合附图时,从以下详述更清楚地理解上述和其它特征。然而,附图仅用于说明目的;不是为了限制。图1描述了纯化的rna酶1消化产物的银染凝胶分析,用于检测mrna制备物中的残留蛋白质。通过柱过滤纯化cftrmrna。凝胶1(左图)或凝胶2(右图)的泳道1代表阳性对照mrna,显示了污染物蛋白质的微弱条带。凝胶1,泳道5描述了使用4m硫氰酸胍-柠檬酸钠,n-月桂基肌氨酸(gscn)缓冲液纯化的样品;凝胶2,泳道5描述了使用5mgscn-1%月桂基肌氨酸缓冲液纯化的样品;凝胶2,泳道6:使用5mgscn-0.1%月桂基肌氨酸缓冲液纯化的样品。任一凝胶的泳道9-11分别描述了rna酶1、sp6和鸟苷酸转移酶的电泳迁移对照。本文未标识的其它泳道不适用(n/a)于上下文。箭头表示主要污染物条带sp6聚合酶/鸟苷酸转移酶迁移的位置。图2描述了纯化的rna酶1消化的mrna产物的银染凝胶分析,用于检测mrna制备物中的残留蛋白质。通过在24孔微量滴定板中使用硫氰酸胍缓冲液过滤来纯化cftrmrna。凝胶1(左图)或凝胶2(右图)的泳道1代表阳性对照mrna,显示了污染物蛋白质的微弱条带。凝胶1,泳道6描述了使用不含dtt的5m硫氰酸胍缓冲液纯化的样品;凝胶2,泳道6描述了使用含有dtt的5m硫氰酸胍缓冲液纯化的样品;任一凝胶的泳道10-12分别描述了rna酶1、sp6和鸟苷酸转移酶的电泳迁移对照。本文未标识的其它泳道不适用(n/a)于上下文。箭头表示主要污染物条带sp6聚合酶/鸟苷酸转移酶的迁移。图3描述了克级纯化的rna酶1消化产物的银染凝胶分析,用于检测mrna制备物中的残留蛋白质。泳道1描述了微弱阳性对照样品。泳道5描述了使用5mgscnw/dtt缓冲液纯化1gcftrmrna制备物的样品。泳道6-10分别描述了rna酶1、sp6、鸟苷酸转移酶、polya聚合酶和o-甲基转移酶的电泳迁移对照。本文未标识的其它泳道不适用(n/a)于上下文。箭头表示主要污染物条带sp6聚合酶/鸟苷酸转移酶迁移的位置。图4描述了10克(10g)级纯化的rna酶1消化产物的银染凝胶分析,用于检测mrna制备物中的残留蛋白质。泳道5描述了使用5mgscnw/dtt缓冲液纯化10gcftrmrna制备物的样品。泳道7-11分别描述了rna酶1、sp6、鸟苷酸转移酶、polya聚合酶和o-甲基转移酶的电泳迁移对照。箭头表示主要污染物条带sp6聚合酶/鸟苷酸转移酶迁移的位置。本文未标识的其它泳道不适用(n/a)于上下文。图5a-b描述了10g级纯化的mrna样品的毛细管电泳。图5a,没有加尾的mrna产物;图5b,在加尾反应之后。图6描述了100克(100g)级纯化的rna酶1消化产物的银染凝胶分析,用于检测mrna制备物中的残留蛋白质。泳道5和6描述了纯化的产物。泳道1描述了对照纯化的mrna样品,显示了污染物酶的微弱条带。泳道8-10分别描述了加工酶rna酶1、sp6、鸟苷酸转移酶、polya聚合酶和2-o-甲基转移酶的电泳迁移对照。图7描述了100g级纯化的mrna样品的毛细管电泳。弯箭头描述的峰表示通过本发明的方法纯化的mrna。直箭头描绘的峰表示使用4mgscn缓冲液处理的对照样品。图8描述了用各种还原剂纯化的银染凝胶分析mrna产物。泳道2描述了在没有还原剂的情况下,仅使用5mgscn的纯化产物。泳道3-9描述了在不同浓度的各种还原剂的情况下,使用5mgscn的纯化产物。泳道10-12分别描述了加工酶rna酶i、sp6和鸟苷酸转移酶的电泳迁移对照。定义为了使本发明更容易理解,下文首先定义某些术语。在整个说明书中阐述了以下术语和其它术语的另外定义。如本说明书和所附权利要求书中所使用的,单数形式“一个/一种(a)”、“一个/一种(an)”和“所述”包括复数指示物,除非上下文另有明确规定。除非特别说明或从上下文明显看出,如本文所用的术语“或”应理解为是包括性的并且涵盖“或”和“和”两者。如本文所用的术语“例如”和“即”仅以示例的方式使用,而不是旨在限制,并且不应被解释为仅是指在说明书中明确列举的那些项目。在整个说明书中,词语“包含(comprising)”或变体(如“包含(comprises)”或“包含(comprising)”)将被理解为暗示包括所陈述的元素、整数或步骤、或者元素、整数或步骤的组,但不排除任何其它元素、整数或步骤、或者元素、整数或步骤的组。除非特别说明或从上下文显而易见,如本文所用的术语“约”应理解为在本领域的正常公差范围内,例如在平均值的2个标准偏差内。“约”可以被理解为在所述值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%、0.01%或0.001%内。除非上下文中另外清楚,本文提供的所有数值均由术语“约”修饰。如本文所用,术语“一批(batch)”是指一次合成的,例如,在同一制造周期期间根据单一制造顺序产生的mrna的数量或量。一批可以是指在一个反应中合成的mrna的量,所述反应是通过单一等份的酶和/或单一等份的dna模板在一组条件下连续合成而发生的。在一些实施方案中,“一批”将包括由反应产生的mrna,在该反应中随着反应的进行不是补充和/或添加所有的试剂和/或组分。术语“一批”不意指在不同时间合成的mrna,其被组合以实现期望的量。如本文所用,术语“污染物”是指在有限量的液体、气体或固体内的物质,其不同于目标材料或化合物的化学组成。污染物也被称为杂质。污染物或杂质的实例包括缓冲液、蛋白质(例如酶)、核酸、盐、溶剂和/或洗涤溶液。如本文所用,术语“分散剂”是指减少mrna沉淀物将形成水凝胶的可能性的固体颗粒。分散剂的实例包括但不限于灰、粘土、硅藻土、过滤剂、玻璃珠、塑料珠、聚合物、聚丙烯珠、聚苯乙烯珠、盐(例如,纤维素盐)、沙和糖中的一种或多种。在实施方案中,分散剂是聚合物微球(例如,聚(苯乙烯-共-二乙烯基苯)微球)。如本文所用,核酸序列的“表达”是指一个或多个以下事件:(1)从dna序列产生mrna模板(例如,通过转录);(2)加工mrna转录物(例如,通过剪接、编辑、5’帽子形成和/或3’末端形成);(3)将mrna翻译成多肽或蛋白质;和/或(4)多肽或蛋白质的翻译后修饰。在本申请中,术语“表达”和“产生”以及语法上的等同物可互换使用。如本文所用,“全长mrna”是在当使用特定的测定,例如凝胶电泳或使用uv和uv吸收光谱的检测以及通过毛细管电泳分离时表征的。编码全长多肽和如根据本文所述的任何纯化方法获得的mrna分子的长度是从目标dna转录的全长mrna分子的长度的至少50%,例如,从目标dna转录的并且在根据本文所述的任何方法纯化之前的全长mrna分子的长度的至少60%、70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.01%、99.05%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%。如本文所用,术语“分离的”是指已经(1)与最初生产时(无论在自然界和/或在实验环境中)与其缔合的至少一些组分分离,和/或(2)由人的手生产、制备和/或制造的物质和/或实体。如本文所用,术语“信使rna(mrna)”是指编码至少一种多肽的多核糖核苷酸。本文所用的mrna涵盖修饰的和未修饰的mrna。mrna可以含有一个或多个编码区和非编码区。mrna可以从天然来源中纯化,使用重组表达系统产生并任选地进行纯化、体外转录或化学合成。如本文所用,术语“mrna完整性”通常是指mrna的质量。在一些实施方案中,mrna完整性是指在纯化过程(例如本文所述的方法)之后未降解的mrna的百分比。mrna完整性可以使用本文具体描述的方法测定,如tae琼脂糖凝胶电泳或通过具有银染的sds-page或通过本领域熟知的方法,例如通过rna琼脂糖凝胶电泳(例如ausubel等人,johnwiley&sons,inc.,1997,currentprotocolsinmolecularbiology)。如本文所用,术语“药学上可接受的”是指在合理的医学判断范围内适合用于与人类和动物的组织接触而没有过度的毒性、刺激、过敏反应或其它问题或并发症,与合理的益处/风险比相称的物质。“药学上可接受的赋形剂”意指适于制备药物组合物的赋形剂,所述药物组合物通常是安全的、无毒的并且既不是生物学上也不是其他方面不期望的,并且包括兽医用途以及人类药物用途可接受的赋形剂。本说明书和权利要求书中使用的“药学上可接受的赋形剂”包括一种和一种以上此类赋形剂。通常,合适的mrna溶液还可以含有缓冲剂和/或盐。通常,缓冲剂可以包括hepes、硫酸铵、碳酸氢钠、柠檬酸钠、乙酸钠、磷酸钾和磷酸钠。如本文所用,术语“基本上”是指表现出所关注的特性或性质的全部或几乎全部范围或程度的定性条件。生物领域的普通技术人员将理解生物和化学现象很少(如果有的话)走向完成和/或继续进行完整性或者实现或避免绝对结果。因此,术语“基本上”在本文中用于捕获许多生物和化学现象中固有的完整性的潜在缺乏。因此,基本上不含化合物‘x’的组合物应理解为包含小于5%的化合物‘x’,或小于1%、或小于0.1%或小于0.01%的化合物‘x’。除非另有定义,本文所用的所有技术和科学术语具有与本申请所属领域的普通技术人员通常所理解的和本申请所属领域中通常所使用的相同的含义;此类技术通过引用以其整体并入。在冲突的情况下,以本说明书(包括定义)为准。详述本发明涉及用于制备可扩展数量的纯化的且高质量的mrna的方法。通常使用聚合酶如sp6或t7-聚合酶通过体外转录(ivt)合成mrna,然后加帽和加尾以产生全长的体内可翻译的mrna。然而,使用常规纯化方法难以从mrna产物中去除与mrna合成和/或加帽和加尾反应相关的蛋白质(“加工酶”)。因此,纯化过程通常涉及多个沉淀步骤以从污染物蛋白质中分离mrna。由于mrna在结构上是不稳定的并且易于发生与搅拌相关的降解,因此重复的沉淀、离心和/或过滤步骤可能影响mrna的完整性,这对于下游的治疗用途是不期望的。本发明至少部分地基于以下令人惊讶的且出乎意料的发现:当包含高于常规浓度的胍盐(如硫氰酸胍)的缓冲液用于mrna沉淀和加工时,观察到污染蛋白的去除显著改善。另外,在一些实施方案中,当包含高浓度胍盐的缓冲液还包含本发明所述的去污剂时,与无去污剂的沉淀缓冲液相比,沉淀缓冲液在从mrna制备物中去除蛋白质污染物中显示出更高的效率。在一些实施方案中,缓冲液包括硫氰酸胍-柠檬酸钠,n-月桂基肌氨酸(gscn)。在变性缓冲液的上下文中,硫氰酸胍和gscn在整个申请中通常可互换使用。在一些实施方案中,使用如所述的本发明的缓冲液和方法导致在单个沉淀步骤之后产生高质量的纯化的mrna。在一些实施方案中,术语“加工酶”包括酶、或蛋白质、或其蛋白质片段。在一些实施方案中,加工酶可以包括但不限于聚合酶、或磷酸酶、或激酶、或鸟苷酰基转移酶、或其它蛋白质、或其片段。在一些实施方案中,本文所用的术语“蛋白质污染物”可以包括污染的酶、蛋白质或其蛋白质片段,其可以包括多肽或寡肽(肽)。另外,本发明的缓冲液和方法是可扩展的以批量生产大量纯化的mrna。因此,本发明的方法和组合物在减少大规模制造过程中的步骤数量方面提供了优点。在一些实施方案中,大规模纯化可以包括纯化包含1克mrna或更多,如5克或更多、10克或更多、20克或更多、50克或更多、100克或更多、150克或更多、200克或更多、500克或更多、1000克或更多、或10,000克或更多的mrna的组合物。在一些实施方案中,大规模mrna合成方法产生大于约1克mrna、或大于约10克mrna、或大于约20克、或大于约50克、或大于约100克、或大于约150克、或大于约200克、或大于约500克、或大于约1000克、或大于约10,000克mrna。信使rna本文所述的纯化方法适于任何mrna的纯化。本发明可以用于纯化编码多种蛋白质(例如多肽)或肽的mrna。根据各种实施方案,本发明可以用于纯化多种长度的体外合成的mrna。在一些实施方案中,本发明可以用于纯化长度等于或大于约1kb、1.5kb、2kb、2.5kb、3kb、3.5kb、4kb、4.5kb、5kb、6kb、7kb、8kb、9kb、10kb、11kb、12kb、13kb、14kb、15kb或20kb的体外合成的mrna。在一些实施方案中,本发明可以用于纯化长度范围为约1-20kb、约1-15kb、约1-10kb、约5-20kb、约5-15kb、约5-12kb、约5-10kb、约8-20kb或约8-15kb的体外合成mrna。例如,典型的mrna的长度可以是约1kb至约5kb。更典型地,mrna的长度是约1kb至约3kb。然而,在一些实施方案中,本发明组合物中的mrna长得多(大于约20kb)。在某些实施方案中,修饰mrna核苷酸以提供“修饰的mrna”。因此,根据本发明的修饰的mrna可以包括,例如,主链修饰、糖修饰或碱基修饰。在一些实施方案中,编码抗体的mrna(例如,编码重链和轻链的mrna)可以由天然存在的核苷酸和/或核苷酸类似物(修饰的核苷酸)合成,包括但不限于嘌呤(腺嘌呤(a)、鸟嘌呤(g))或嘧啶(胸腺嘧啶(t)、胞嘧啶(c)、尿嘧啶(u)),以及嘌呤和嘧啶的修饰的核苷酸类似物或衍生物,诸如例如1-甲基-腺嘌呤、2-甲基-腺嘌呤、2-甲硫基-n-6-异戊烯基-腺嘌呤、n6-甲基-腺嘌呤、n6-异戊烯基-腺嘌呤、2-硫代-胞嘧啶、3-甲基-胞嘧啶、4-乙酰基-胞嘧啶、5-甲基-胞嘧啶、2,6-二氨基嘌呤、1-甲基-鸟嘌呤、2-甲基-鸟嘌呤、2,2-二甲基-鸟嘌呤、7-甲基-鸟嘌呤、肌苷、1-甲基-肌苷、假尿嘧啶(5-尿嘧啶)、二氢-尿嘧啶、2-硫代-尿嘧啶、4-硫代-尿嘧啶、5-羧甲基氨基甲基-2-硫代-尿嘧啶、5-(羧羟基甲基)-尿嘧啶、5-氟-尿嘧啶、5-溴-尿嘧啶、5-羧甲基氨基甲基-尿嘧啶、5-甲基-2-硫代-尿嘧啶、5-甲基-尿嘧啶、n-尿嘧啶-5-氧基乙酸甲酯、5-甲基氨基甲基-尿嘧啶、5-甲氧基氨基甲基-2-硫代-尿嘧啶、5'-甲氧基羰基甲基-尿嘧啶、5-甲氧基-尿嘧啶、尿嘧啶-5-氧基乙酸甲酯、尿嘧啶-5-氧基乙酸(v),1-甲基-假尿嘧啶、辫苷(queosine),β-d-甘露糖基-辫苷、怀丁氧苷(wybutoxosine)和氨基磷酸酯、硫代磷酸酯、肽核苷酸、甲基膦酸酯、7-脱氮鸟苷、5-甲基胞嘧啶和肌苷。此类类似物的制备是本领域技术人员,例如根据美国专利第4,373,071号、美国专利第4,401,796号、美国专利第4,415,732号、美国专利第4,458,066号、美国专利第4,500,707号、美国专利第4,668,777号、美国专利第4,973,679号、美国专利第5,047,524号、美国专利第5,132,418号、美国专利第5,153,319号、美国专利第5,262,530号和第5,700,642号已知的,所述美国专利的公开内容通过引用以其全部范围包括在本文中。在一些实施方案中,本发明可以用于纯化未修饰的体外合成的mrna。在一些实施方案中,mrna包括5’和/或3’非翻译区(utr)。在一些实施方案中,5’非翻译区包括影响mrna的稳定性或翻译的一个或多个元件,例如铁反应元件。在一些实施方案中,5’非翻译区的长度可以是约50至500个核苷酸。在一些实施方案中,3’非翻译区包括一个或多个聚腺苷酸化信号,影响mrna在细胞中定位的稳定性的蛋白质的结合位点,或mirna的一个或多个结合位点。在一些实施方案中,3’非翻译区的长度可以是50至500个核苷酸或更长。在一些实施方案中,5’非翻译区包括影响mrna的稳定性或翻译的一个或多个元件,例如铁反应元件。示例性的3’和/或5’utr序列可以来源于稳定的mrna分子(例如,珠蛋白、肌动蛋白、gapdh、微管蛋白、组蛋白和柠檬酸循环酶)以增加有义mrna分子的稳定性。例如,5'utr序列可以包括cmv立即早期1(ie1)基因的部分序列或其片段以改善核酸酶抗性和/或改善多核苷酸的半衰期。还考虑了将编码人生长激素(hgh)的序列或其片段包含到多核苷酸(例如mrna)的3’末端或非翻译区以进一步稳定多核苷酸。通常,相对于没有此类特征的相同多核苷酸,这些特征改善了多核苷酸的稳定性和/或药代动力学特性(例如半衰期),并且包括,例如,为改善此类多核苷酸对体内核酸酶消化的抗性而制得的特征。mrna合成可以根据多种已知方法中的任一种来合成mrna。例如,mrna可以通过体外转录(ivt)合成。尽管本发明特别用于纯化通过体外转录反应合成的mrna,但它也可用于纯化通过任何其它方法产生的mrna。在一些实施方案中,来自其它来源的mrna考虑在本发明的范围内,包括由细菌、真菌、植物和/或动物产生的野生型mrna。根据前述部分中所述的几个实施方案,试剂和残留酶及蛋白质的存在在最终mrna产物中是不期望的,因此可以被称为杂质或污染物。同样,含有这些杂质或污染物中的一种或多种的制备物可以被称为不纯制备物。在一些实施方案中,体外转录以单批发生。在一些实施方案中,ivt反应包括加帽和加尾反应(c/t)。在一些实施方案中,加帽和加尾反应与ivt反应分开进行。在一些实施方案中,从ivt反应中回收mrna,然后通过本申请中所述的方法首先沉淀和纯化mrna;然后对回收的纯化的mrna进行加帽和加尾,并进行第二次沉淀和纯化。在一些实施方案中,本发明可以用于纯化含有至少10mg、50mg、100mg、200mg、300mg、400mg、500mg、600mg、700mg、800mg、900mg、1g、5g、10g、25g、50g、75g、100g、250g、500g、750g、1kg、5kg、10kg、50kg、100kg、1000kg或更多mrna的组合物或批次。在一些实施方案中,mrna分子的长度大于600、700、800、900、1000、2000、3000、4000、5000、10,000或更多个核苷酸;本发明还包括具有其间任何长度的mrna。ivt反应ivt通常用含有启动子的线性或环状dna模板、核糖核苷酸三磷酸的库、可以包括dtt和镁离子的缓冲系统、以及适当的rna聚合酶(例如t3、t7或sp6rna聚合酶)、dna酶i、焦磷酸酶和/或rna酶抑制剂进行。确切的条件将根据具体的应用而变化。合适的dna模板通常具有用于体外转录的启动子,例如t3、t7或sp6启动子,然后是期望mrna的期望核苷酸序列和终止信号。在一些实施方案中,产生的mrna是密码子优化的。在一些实施方案中,示例性的ivt反应混合物含有具有sp6聚合酶特异性启动子的线性双链dna模板、sp6rna聚合酶、rna酶抑制剂、焦磷酸酶、29mmntp、10mmdtt和反应缓冲液(当在10x下,为800mmhepes,20mm亚精胺,250mmmgcl2,ph7.7),以及用无rna酶的水,量足以(qs)至期望的反应体积;然后将该反应混合物在37℃孵育60分钟。然后通过添加dna酶i和dna酶i缓冲液(当在10x下时,为100mmtris-hcl,5mmmgcl2和25mmcacl2,ph7.6)淬灭聚合酶反应,以促进制备物中双链dna模板的消化,用于纯化。该实施方案已经显示足以产生100克mrna。其它ivt方法在本领域中是可用的,并且可以用于实施本发明。加帽和加尾(c/t)反应通常,在真核有机体中,mrna加工包括在n-末端(5’)添加“帽子”,以及在c-末端(3')添加“尾巴”。典型的帽子是7-甲基鸟苷帽子,其是通过5’-5’-三磷酸键与第一个转录的核苷酸连接的鸟苷。帽子的存在在提供对大多数真核细胞中发现的核酸酶的抗性方面是重要的。在一些实施方案中,如fechter,p.;brownlee,g.g.“recognitionofmrnacapstructuresbyviralandcellularproteins”j.gen.virology2005,86,1239-1249所述,通过使用鸟苷酸转移酶添加5’n7-甲基鸟苷酸帽子0(cap0)结构以及使用2’o-甲基转移酶在倒数第二个核苷酸的2’o位置添加甲基,产生帽子1(cap1)结构来酶促修饰体外转录的mrna。在一些实施方案中,通常如下添加5’帽子:首先,rna末端磷酸酶从5’核苷酸去除末端磷酸基团之一,留下两个末端磷酸;然后通过鸟苷酰基转移酶将鸟苷三磷酸酯(gtp)添加到末端磷酸中,产生5’-5’三磷酸酯键;然后鸟嘌呤的7-氮被甲基转移酶甲基化。帽子结构的实例包括但不限于m7g(5′)ppp(5′)g、g(5′)ppp(5′)a和g(5′)ppp(5′)g。简而言之,在包含tris-hcl、mgcl2和无rna酶的h2o的反应缓冲液存在下,纯化的ivtmrna通常与gtp、s-腺苷甲硫氨酸、rna酶抑制剂、2'-o-甲基转移酶、鸟苷酰基转移酶混合;然后在37℃下孵育。在一些实施方案中,在添加帽子1结构之后,使用poly-a聚合酶将聚腺苷酸尾巴添加到体外酶促转录的mrna的3’末端。尾巴通常是聚腺苷酸化事件,由此聚腺苷酰部分被添加到mrna分子的3’末端。在一些实施方案中,在用于加帽反应的孵育之后,通过添加包含tris-hcl、nacl、mgcl2、atp、polya聚合酶和无rna酶的h2o的加尾缓冲液来引发加尾反应。通过添加edta来淬灭反应。这种“尾巴”的存在用于保护mrna免于核酸外切酶降解。3’尾巴可以在添加5’帽子之前,之后或同时添加。在一些实施方案中,polya尾的长度是25-5,000个核苷酸。通常,尾巴结构包括polya和/或polyc尾巴。(a,腺苷;c,胞嘧啶)。在一些实施方案中,mrna的3’末端上的poly-a或poly-c尾巴分别包括至少50个腺苷或胞嘧啶核苷酸、至少150个腺苷或胞嘧啶核苷酸、至少200个腺苷或胞嘧啶核苷酸、至少250个腺苷或胞嘧啶核苷酸、至少300个腺苷或胞嘧啶核苷酸、至少350个腺苷或胞嘧啶核苷酸、至少400个腺苷或胞嘧啶核苷酸、至少450个腺苷或胞嘧啶核苷酸、至少500个腺苷或胞嘧啶核苷酸、至少550个腺苷或胞嘧啶核苷酸、至少600个腺苷或胞嘧啶核苷酸、至少650个腺苷或胞嘧啶核苷酸、至少700个腺苷或胞嘧啶核苷酸、至少750个腺苷或胞嘧啶核苷酸、至少800个腺苷或胞嘧啶核苷酸、至少850个腺苷或胞嘧啶核苷酸、至少900个腺苷或胞嘧啶核苷酸、至少950个腺苷或胞嘧啶核苷酸或者至少1kb腺苷或胞嘧啶核苷酸。在一些实施方案中,poly-a或poly-c尾巴可以分别是约10至800个腺苷或胞嘧啶核苷酸(例如,约10至200个腺苷或胞嘧啶核苷酸、约10至300个腺苷或胞嘧啶核苷酸、约10至400个腺苷或胞嘧啶核苷酸、约10至500个腺苷或胞嘧啶核苷酸、约10至550个腺苷或胞嘧啶核苷酸、约10至600个腺苷或胞嘧啶核苷酸、约50至600个腺苷或胞嘧啶核苷酸、约100至600个腺苷或胞嘧啶核苷酸、约150至600个腺苷或胞嘧啶核苷酸、约200至600个腺苷或胞嘧啶核苷酸、约250至600个腺苷或胞嘧啶核苷酸、约300至600个腺苷或胞嘧啶核苷酸、约350至600个腺苷或胞嘧啶核苷酸、约400至600个腺苷或胞嘧啶核苷酸、约450至600个腺苷或胞嘧啶核苷酸、约500至600个腺苷或胞嘧啶核苷酸、约10至150个腺苷或胞嘧啶核苷酸、约10至100个腺苷或胞嘧啶核苷酸、约20至70个腺苷或胞嘧啶核苷酸或者约20至60个腺苷或胞嘧啶核苷酸)。在一些实施方案中,尾巴结构包括具有本文所述的各种长度的polya和polyc尾巴的组合。在一些实施方案中,尾巴结构包括至少50%、55%、65%、70%、75%、80%、85%、90%、92%、94%、95%、96%、97%、98%或99%的腺苷核苷酸。在一些实施方案中,尾巴结构包括至少0%、55%、65%、70%、75%、80%、85%、90%、92%、94%、95%、96%、97%、98%或99%的胞嘧啶核苷酸。其它的加帽和/或加尾方法在本领域中是可用的,并且可以用于实施本发明。体外合成的mrna中的污染物来自例如如上所述的合成过程的mrna产物可能含有各种污染物(也称为杂质),包括残留的模板dna;流产的产物;酶,包括聚合酶,例如sp6或t7-聚合酶,加帽酶,例如鸟苷酰基转移酶或甲基鸟苷酰基转移酶,dna酶1;各种盐和过早流产的mrna寡核苷酸,它们是mrna合成反应的副产物。mrna纯化根据本发明的纯化过程可以在合成期间或之后进行。例如,在将帽子和/或尾巴添加到mrna之前,可以如本文所述纯化mrna。在一些实施方案中,在将帽子和/或尾巴添加到mrna中之后纯化mrna。在一些实施方案中,在添加帽子之后纯化mrna。在一些实施方案中,在将帽子和/或尾巴添加到mrna之前和之后均纯化mrna。通常,本文所述的纯化步骤可以在mrna合成的每个步骤之后进行,任选地与其它纯化过程如透析一起进行。mrna的沉淀根据本发明,不纯制备物(如体外合成反应混合物)中的mrna可以使用本文所述的缓冲液和合适的条件沉淀,然后进行本领域已知的各种纯化方法。如本文所用,术语“沉淀”(或其任何语法等效物)是指在溶液中形成不溶性物质(例如,固体)。当与mrna结合使用时,术语“沉淀”是指在液体中形成不溶性或固体形式的mrna。通常,mrna沉淀涉及变性条件。如本文所用,术语“变性条件”是指可以引起mrna天然构象破坏的任何化学或物理条件。由于分子的天然构象通常是水溶性最强的,因此破坏分子的二级和三级结构可引起溶解度的变化,并可导致mrna从溶液中沉淀出来。例如,从不纯制备物中沉淀mrna的合适方法涉及用变性剂处理不纯制备物,使得mrna沉淀。适用于本发明的示例性变性剂包括但不限于氯化锂、氯化钠、氯化钾、氯化胍、硫氰酸胍、异硫氰酸胍、乙酸铵及其组合。合适的试剂可以以固体形式或溶液提供。在一些实施方案中,胍盐用于变性缓冲液中以沉淀mrna。作为非限制性实例,胍盐可以包括氯化胍、硫氰酸胍或异硫氰酸胍。硫氰酸胍(guanidiniumthiocyanate)(也称为硫氰酸胍(guanidinethiocyanate))可以用于沉淀mrna。本发明基于以下令人惊讶的发现:在包含胍盐(如硫氰酸胍)的mrna沉淀缓冲液中,可以以高于通常用于变性反应的浓度使用,导致mrna基本上不含蛋白质污染物。在一些实施方案中,适于mrna沉淀的溶液含有浓度大于4m的硫氰酸胍。根据本发明,在一些实施方案中,包含适于mrna沉淀的变性剂的缓冲液包含大于4m的硫氰酸胍。在一些实施方案中,包含适于mrna沉淀的变性剂的缓冲液包含约5mgscn。在一些实施方案中,包含适于mrna沉淀的变性剂的缓冲液包含约5.5mgscn。在一些实施方案中,包含适于mrna沉淀的变性剂的缓冲液包含约6mgscn。在一些实施方案中,包含适于mrna沉淀的变性剂的缓冲液包含约6.5mgscn。在一些实施方案中,包含适于mrna沉淀的变性剂的缓冲液包含约7mgscn。在一些实施方案中,包含适于mrna沉淀的变性剂的缓冲液包含约7.5mgscn。在一些实施方案中,包含适于mrna沉淀的变性剂的缓冲液包含约8mgscn。在一些实施方案中,包含适于mrna沉淀的变性剂的缓冲液包含约8.5mgscn。在一些实施方案中,包含适于mrna沉淀的变性剂的缓冲液包含约9mgscn。在一些实施方案中,包含适于mrna沉淀的变性剂的缓冲液包含约10mgscn。在一些实施方案中,包含适于mrna沉淀的变性剂的缓冲液包含大于10mgscn。除了使试剂变性之外,用于mrna沉淀的合适溶液可以包含另外的盐、表面活性剂和/或缓冲剂。例如,合适的溶液还可以包含月桂基钠十二烷基肌氨酸钠(sodiumlaurylsarcosyl)和/或柠檬酸钠。在一些实施方案中,适于mrna沉淀的缓冲液包含约5mm柠檬酸钠。在一些实施方案中,适于mrna沉淀的缓冲液包含约10mm柠檬酸钠。在一些实施方案中,适于mrna沉淀的缓冲液包含约20mm柠檬酸钠。在一些实施方案中,适于mrna沉淀的缓冲液包含约25mm柠檬酸钠。在一些实施方案中,适于mrna沉淀的缓冲液包含约30mm柠檬酸钠。在一些实施方案中,适于mrna沉淀的缓冲液包含约50mm柠檬酸钠。在一些实施方案中,适于mrna沉淀的缓冲液包含表面活性剂,如n-月桂基肌氨酸(十二烷基肌酸钠)。在一些实施方案中,适于mrna沉淀的缓冲液包含约0.01%的n-月桂基肌氨酸。在一些实施方案中,适于mrna沉淀的缓冲液包含约0.05%的n-月桂基肌氨酸。在一些实施方案中,适于mrna沉淀的缓冲液包含约0.1%的n-月桂基肌氨酸。在一些实施方案中,适于mrna沉淀的缓冲液包含约0.5%的n-月桂基肌氨酸。在一些实施方案中,适于mrna沉淀的缓冲液包含1%的n-月桂基肌氨酸。在一些实施方案中,适于mrna沉淀的缓冲液包含约1.5%的n-月桂基肌氨酸。在一些实施方案中,适于mrna沉淀的缓冲液包含约2%、约2.5%或约5%的n-月桂基肌氨酸。在一些实施方案中,用于mrna沉淀的合适溶液包含还原剂。在一些实施方案中,还原剂选自二硫苏糖醇(dtt)、β-巯基乙醇(b-me)、三(2-羧乙基)膦(tcep)、三(3-羟丙基)膦(thpp)、二硫赤藓糖醇(dte)和二硫代丁胺(dtba)。在一些实施方案中,还原剂是二硫苏糖醇(dtt)。在一些实施方案中,dtt以大于1mm且至多约200mm的最终浓度存在。在一些实施方案中,dtt以2.5mm至100mm的最终浓度存在。在一些实施方案中,dtt以5mm至50mm的最终浓度存在。在一些实施方案中,dtt以1mm或更高的最终浓度存在。在一些实施方案中,dtt以2mm或更高的最终浓度存在。在一些实施方案中,dtt以3mm或更高的最终浓度存在。在一些实施方案中,dtt以4mm或更高的最终浓度存在。在一些实施方案中,dtt以5mm或更高的最终浓度存在。在一些实施方案中,dtt以6mm或更高的最终浓度存在。在一些实施方案中,dtt以7mm或更高的最终浓度存在。在一些实施方案中,dtt以8mm或更高的最终浓度存在。在一些实施方案中,dtt以9mm或更高的最终浓度存在。在一些实施方案中,dtt以10mm或更高的最终浓度存在。在一些实施方案中,dtt以11mm或更高的最终浓度存在。在一些实施方案中,dtt以12mm或更高的最终浓度存在。在一些实施方案中,dtt以13mm或更高的最终浓度存在。在一些实施方案中,dtt以14mm或更高的最终浓度存在。在一些实施方案中,dtt以15mm或更高的最终浓度存在。在一些实施方案中,dtt以16mm或更高的最终浓度存在。在一些实施方案中,dtt以17mm或更高的最终浓度存在。在一些实施方案中,dtt以18mm或更高的最终浓度存在。在一些实施方案中,dtt以19mm或更高的最终浓度存在。在一些实施方案中,dtt以约20mm的最终浓度存在。在一些实施方案中,变性缓冲液包含2mgscn或更高,以及dtt。在一些实施方案中,变性缓冲液包含3mgscn或更高,以及dtt。在一些实施方案中,变性缓冲液包含4mgscn或更高,以及dtt。在一些实施方案中,变性缓冲液包含约5mgscn或更高,以及dtt。在一些实施方案中,变性缓冲液包含约6mgscn或更高,以及dtt。在一些实施方案中,变性缓冲液包含约7mgscn或更高,以及dtt。在一些实施方案中,变性缓冲液包含约8mgscn或更高,以及dtt。在一些实施方案中,变性缓冲液包含约9mgscn或更高,以及dtt。在一些实施方案中,变性缓冲液包含1mmdtt或更高且gscn浓度为约5m。在一些实施方案中,变性缓冲液包含2mmdtt或更高且gscn浓度为约5m。在一些实施方案中,变性缓冲液包含3mmdtt或更高且gscn浓度为约5m。在一些实施方案中,变性缓冲液包含4mmdtt或更高且gscn浓度为约5m。在一些实施方案中,变性缓冲液包含5mmdtt或更高且gscn浓度为约5m。在一些实施方案中,变性缓冲液包含6mmdtt或更高且gscn浓度为约5m。在一些实施方案中,变性缓冲液包含7mmdtt或更高且gscn浓度为约5m。在一些实施方案中,变性缓冲液包含8mmdtt或更高且gscn浓度为约5m。在一些实施方案中,变性缓冲液包含9mmdtt或更高且gscn浓度为约5m。在一些实施方案中,变性缓冲液包含10mmdtt或更高且gscn浓度为约5m。当存在或不存在还原剂时,蛋白质变性甚至可以在低浓度的变性剂下发生。本发明的方法提供的变性溶液中高浓度的gscn和高浓度的dtt的组合是令人惊讶的和出乎意料的,因为例如它是高度离液溶液。出乎意料的是,当用于根据本发明的方法沉淀含有杂质的mrna时,此类组合产生mrna,其是令人惊讶地纯的并且基本上不含蛋白质污染物。根据本发明的方法在缓冲液中沉淀的mrna可以通过过滤器处理。在一些实施方案中,在单次沉淀之后,然后使用包含约5mgscn和约10mmdtt的缓冲液过滤的洗脱液具有令人惊讶的高质量和纯度,没有可检测出的蛋白质杂质。另外,该方法在涉及约1克,或约10克,或约100克,或约500克,或约1000克的mrna和更多的规模中在宽范围的mrna加工量下是可重现的,而不会阻碍流体流过过滤器。在一些实施方案中,用于沉淀步骤的缓冲液还包含醇。在一些实施方案中,沉淀在mrna、变性缓冲液(包含gscn和还原剂,例如dtt)和醇以1:(5):(3)的体积比存在的条件下进行。在一些实施方案中,沉淀在mrna、变性缓冲液和醇以1:(3.5):(2.1)的体积比存在的条件下进行。在一些实施方案中,沉淀在mrna、变性缓冲液和醇以1:(4):(2)的体积比存在的条件下进行。在一些实施方案中,沉淀在mrna、变性缓冲液和醇以1:(2.8):(1.9)的体积比存在的条件下进行。在一些实施方案中,沉淀在mrna、变性缓冲液和醇以1:(2.3):(1.7)的体积比存在的条件下进行。在一些实施方案中,沉淀在mrna、变性缓冲液和醇以1:(2.1):(1.5)的体积比存在的条件下进行。在一些实施方案中,可取的是在允许大量mrna沉淀的期望温度下,将不纯制备物与本文所述的一种或多种变性剂一起孵育一段时间。例如,不纯制备物和变性剂的混合物可以在室温或环境温度下孵育一段时间。在一些实施方案中,合适的孵育时间是约2、3、4、5、6、7、8、9、10、15、20、25、30、40、50或60分钟的时间段或以上。在一些实施方案中,合适的孵育时间是约60分钟、55分钟、50分钟、45分钟、40分钟、35分钟、30分钟、25分钟、20分钟、15分钟、10分钟、9分钟、8分钟、7分钟、6分钟或5分钟的时间段。在一些实施方案中,将混合物在室温下孵育约5分钟。通常,“室温”或“环境温度”是指范围为约20-25℃的温度,例如,约20℃、21℃、22℃、23℃、24℃或25℃。在一些实施方案中,不纯制备物和变性剂的混合物也可以在高于室温(例如,约30-37℃或者特别是在约30℃、31℃、32℃、33℃、34℃、35℃、36℃或37℃)或低于室温(例如,约15-20℃或者特别是在约15℃、16℃、17℃、18℃、19℃或20℃)孵育。可以基于孵育温度调节孵育时段。通常,较高的孵育温度需要较短的孵育时间。可选地或另外地,可以使用溶剂来促进mrna沉淀。合适的示例性溶剂包括但不限于异丙醇、丙酮、甲基乙基酮、甲基异丁基酮、乙醇、甲醇、地那铵及其组合。例如,可以将溶剂(例如,无水乙醇)与变性剂一起添加到不纯制备物中,或者可以在添加变性剂并如本文所述孵育之后添加溶剂(例如,无水乙醇),以进一步增强和/或加速mrna沉淀。通常,在添加合适的溶剂(例如,无水乙醇)之后,可以将混合物在室温下孵育另一段时间。通常,合适的孵育时间段是或大于约2、3、4、5、6、7、8、9、10、15、20、25、30、40、50或60分钟。在一些实施方案中,合适的孵育时间段是或小于约60分钟、55分钟、50分钟、45分钟、40分钟、35分钟、30分钟、25分钟、20分钟、15分钟、10分钟、9分钟、8分钟、7分钟、6分钟或5分钟的时段。通常,将混合物在室温下孵育约5分钟。在适当调节孵育时间的情况下,可以使用高于或低于室温的温度。可选地,孵育可以在4℃或-20℃下发生,用于沉淀。mrna回收由于沉淀,形成了含有沉淀的mrna和各种污染物的悬浮液。在一些实施方案中,对悬浮液混合物进行过滤以分离和回收mrna。在一些实施方案中,切向流过滤(tff)用于在沉淀之后将mrna与污染物分离。关于用于mrna纯化的tff的另外教导可以从申请人的以下相关申请获得:2015年9月14日提交的ussn14/775,915,其在2018年5月1日作为美国专利9,957,499授权,标题为“信使rna纯化的方法(methodsforpurificationofmessengerrna)”;或者2015年4月24日提交的ussn14/696,140,其在2017年12月26日作为美国专利9,850,269授权,标题为“纯化信使rna的方法(methodsforpurificationofmessengerrna)”,或者作为ussn14/696,140的继续申请在2017年12月4日提交的ussn15/831,252,其各自的主题在此通过引用以其整体并入。在一些实施方案中,对沉淀的mrna和污染物进行正常流过滤。关于用于mrna纯化的正常流过滤(nff)的另外教导可以从申请人的以下相关申请获得:2018年8月24日提交的us62/722,674,将其通过引用以其整体并入。在一些实施方案中,通过离心回收mrna。另外的教导可以从申请人的以下相关申请获得:2018年2月27日提交的标题为“信使rna纯化的方法(methodsforpurificationofmessengerrna)”的ussn15/907,086;2018年2月27日提交的标题为“信使rna纯化的方法(methodsforpurificationofmessengerrna)”的ussn15/906,864,其涵盖使用nutsche过滤器的纯化方法;或者2018年2月27日提交的标题为“信使rna的大规模合成(largescalesynthesisofmessengerrna)”的ussn15/907,163,其各自的主题在此通过引用以其整体并入。在一些实施方案中,对如前面部分所述的沉淀的mrna进行色谱分离或本领域中任何其它已知的方法以回收纯的mrna。在一些实施方案中,本文所述的方法导致从不纯制备物中沉淀和回收大量mrna。在一些实施方案中,本文所述的方法导致从不纯制备物中沉淀和回收至少约80%、85%、90%、95%、96%、97%、98%或99%的总mrna。在一些实施方案中,本文所述的方法导致从不纯制备物中沉淀和回收至少80%的总mrna。在一些实施方案中,本文所述的方法导致从不纯制备物中沉淀和回收基本上90%的总mrna。在一些实施方案中,本文所述的方法导致从不纯制备物中沉淀和回收基本上91%的总mrna。在一些实施方案中,本文所述的方法导致从不纯制备物中沉淀和回收基本上92%的总mrna。在一些实施方案中,本文所述的方法导致从不纯制备物中沉淀和回收基本上93%的总mrna。在一些实施方案中,本文所述的方法导致从不纯制备物中沉淀和回收基本上94%的总mrna。在一些实施方案中,本文所述的方法导致从不纯制备物中沉淀和回收基本上95%的总mrna。在一些实施方案中,本文所述的方法导致从不纯制备物中沉淀和回收基本上96%的总mrna。在一些实施方案中,本文所述的方法导致从不纯制备物中沉淀和回收基本上97%的总mrna。在一些实施方案中,本文所述的方法导致从不纯制备物中沉淀和回收基本上98%的总mrna。在一些实施方案中,本文所述的方法导致从不纯制备物中沉淀和回收基本上99%的总mrna。在一些实施方案中,本文所述的方法导致从不纯制备物中沉淀和回收基本上100%的总mrna。在一些实施方案中,通过本文公开的方法纯化的mrna包含少于10%、少于9%、少于8%、少于7%、少于6%、少于5%、少于4%、少于3%、少于2%、少于1%、少于0.5%、少于0.1%的除全长mrna以外的杂质,如通过本文所述和本领域已知的各种检测方法(例如,毛细管电泳、凝胶电泳、hplc或uplc)所测定的。杂质包括ivt污染物,例如蛋白质、酶、游离核苷酸和/或“短的流产性转录物”(短聚体(shortmer))。如本文所用,术语“短聚体”或指小于全长的任何转录物。在一些实施方案中,“短聚体”或“流产性转录物”的长度小于100个核苷酸、小于90个、小于80个、小于70个、小于60个、小于50个、小于40个、小于30个、小于20个、或小于10个核苷酸。在一些实施方案中,在添加5’-帽子和/或3’-polya尾巴之后检测或定量短聚体。此外,本文所述的纯化方法可以用于制备用于治疗用途的mrna。通过本文所述的各种表征技术测定的纯化mrna的纯度和/或完整性可以用作批量释放标准。在一些实施方案中,在制造过程中批量生产mrna的释放标准包括以下中的一种或多种的毛细管电泳测定:纯化的mrna包含5%或更少、4%或更少、3%或更少、2%或更少、1%或更少的蛋白质污染物,或者基本上不含蛋白质污染物;纯化的mrna包含5%或更少、4%或更少、3%或更少、2%或更少、1%或更少的短的流产性rna污染物,或者基本上不含短的流产性rna污染物;纯化的mrna包含5%或更少、4%或更少、3%或更少、2%或更少、1%或更少的盐污染物,或者基本上不含盐污染物;纯化的mrna包含95%或更高、96%或更高、97%或更高、98%或更高或者99%或更高的完整性。在一些实施方案中,在制造过程中批量生产mrna的释放标准包括以下中的一种或多种的hplc测定:纯化的mrna包含5%或更少、4%或更少、3%或更少、2%或更少、1%或更少的蛋白质污染物,或者基本上不含蛋白质污染物;纯化的mrna包含5%或更少、4%或更少、3%或更少、2%或更少、1%或更少的短的流产性rna污染物,或者基本上不含短的流产性rna污染物;纯化的mrna包含5%或更少、4%或更少、3%或更少、2%或更少、1%或更少的盐污染物,或者基本上不含盐污染物;纯化的mrna包含95%或更高、96%或更高、97%或更高、98%或更高或者99%或更高的完整性。另外,根据本发明纯化的mrna导致高产率。例如,以导致至少约70%、75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的产率的量回收总纯化的mrna。根据本发明,可以大规模纯化mrna。例如,可以在单个批次中纯化至少0.5克、1克、5克、10克、15克、20克、35克、40克、45克、50克、60克、70克、80克、90克、100克、200克、300克、400克、500克、1千克、10千克、50千克、100千克的mrna。mrna治疗组合物根据本发明纯化的mrna可以作为裸mrna(未包装的)或通过递送媒介物递送。如本文所用,术语“递送媒介物”、“转移媒介物”、“纳米颗粒”或语法等效物可互换使用。递送媒介物可以与一种或多种另外的核酸、载体、靶向配体或稳定剂组合配制,或者配制在其与合适的赋形剂混合的药物组合物中。用于配制和施用药物的技术可以在"remington'spharmaceuticalsciences,"mackpublishingco.,easton,pa.,最新版,中找到。基于特定的递送媒介物促进核酸转染至靶细胞的能力来选择该特定的递送载体。根据各种实施方案,合适的递送媒介物包括但不限于基于聚合物的载体,如聚乙烯亚胺(pei),脂质纳米颗粒(lnps)和脂质体,纳米脂质体,含神经酰胺的纳米脂质体,蛋白脂质体,天然和合成衍生的外来体,天然、合成和半合成环层体(lamellarbodies),纳米颗粒,磷硅酸钙纳米颗粒,磷酸钙纳米颗粒、二氧化硅纳米颗粒、纳米晶体颗粒、半导体纳米颗粒、聚(d-精氨酸)、溶胶-凝胶、纳米树状聚合物、基于淀粉的递送系统、胶束、乳液、泡囊(noisome)、多域嵌段聚合物(乙烯基聚合物、聚丙烯丙烯酸聚合物、动态多缀合物)、干粉制剂、质粒、病毒、磷酸钙核苷酸、适配子、肽和其它媒介标签(vectorialtag)。在一些实施方案中,合适的递送媒介物是脂质体递送媒介物,例如脂质纳米颗粒(lnp)或脂质体。在一些实施方案中,脂质体可以包含一种或多种阳离子脂质。在一些实施方案中,脂质体包含一种或多种阳离子脂质、一种或多种非阳离子脂质和一种或多种peg修饰的脂质。在一些实施方案中,脂质体包含至少一种或多种peg修饰的脂质。在一些实施方案中,脂质体包含不超过四种不同的脂质组分。在一些实施方案中,脂质体包含不超过三种不同的脂质组分。在一些实施方案中,一种不同的脂质组分是基于固醇的阳离子脂质。本文所用的术语“阳离子脂质”是指在选定的ph(如生理ph)下具有净正电荷的许多脂质和类脂质(lipidoid)物质中的任一种。文献中已经描述了几种阳离子脂质,其中许多是可商购获得的。在一些实施方案中,mrna编码细胞内蛋白质或肽。在一些实施方案中,mrna编码细胞溶质蛋白。在一些实施方案中,mrna编码与肌动蛋白细胞骨架相关的蛋白。在一些实施方案中,mrna编码与质膜相关的蛋白。在一些具体的实施方案中,mrna编码跨膜蛋白。在一些具体的实施方案中,mrna编码离子通道蛋白。在一些实施方案中,mrna编码核周蛋白。在一些实施方案中,mrna编码核蛋白。在一些具体的实施方案中,mrna编码转录因子。在一些实施方案中,mrna编码伴侣蛋白。在一些实施方案中,mrna编码胞内酶(例如,编码与脲循环或溶酶体贮积代谢病症相关的酶的mrna)。在一些实施方案中,mrna编码参与细胞代谢、dna修复、转录和/或翻译的蛋白质。在一些实施方案中,mrna编码细胞外蛋白或肽。在一些实施方案中,mrna编码与细胞外基质相关的蛋白或肽。在一些实施方案中,mrna编码分泌的蛋白或肽。在具体的实施方案中,本发明的组合物和方法中使用的mrna可以用于表达由一种或多种靶细胞排泄或分泌到周围细胞外液中的功能性肽、蛋白或酶(例如,编码激素和/或神经递质的mrna)。在一些实施方案中,mrna编码用于疫苗目的的免疫原性蛋白。在一些实施方案中,mrna编码抗体或其片段。在一些实施方案中,mrna编码代谢蛋白。在一些实施方案中,mrna编码酶。在一些实施方案中,mrna编码受体蛋白或肽。在一些实施方案中,mrna编码抗原。在一些实施方案中,mrna编码癌症相关抗原。在一些实施方案中,mrna编码疫苗。作为非限制性实例,mrna编码蛋白质或肽,如abc7、abcb3、abcb7、abcc7、abcd1、akt;akt2、akt3、atf4、alas2、α半乳糖苷酶,α-1蛋白酶抑制剂,apa、apc;apoa1、apoa1-milano、apoe,抗胰蛋白酶α1,精氨酸琥珀酸合成酶,asat;atm;atp7b、atr;肌萎缩蛋白-1(atrophin-1);atx3;atxn10;atxn2;atxn7;atxnl;bax;bcl2;brca1;brca2;氨基甲酰磷酸合成酶、casp8、cbp(creb-bp);cdkn2a;cftr、creb1、cvap、cyp1bl、dba、dmd、dmpk;egfr、eif2b1、eif2ba、eif2b2、eif2b3、eif2b5、eif2b4;erbb2;erbb3;erbb4;红细胞生成素、因子ix、因子v;因子vii、因子vii;因子viii;因子viiia轻链、因子x;因子xi(f11);因子xii缺乏(f12、haf);因子xiiia(f13al、f13a);因子xiiib(f13b);fbn1、fgf受体家族成员;fhl3;fkrp、fxn/x25;fxr1、g6pc、g6pt、gaa、半乳糖-1-磷酸尿苷酰基转移酶、glut2、h1fla;hba1;hbb;hba2、hbb、hbd、乙酰肝素n-硫酸酯酶、hif;hif3a;hlh3、hplh2、hplh3、亨廷顿蛋白(huntingtin)、idh2;idh1、igf受体;igf;igf1r、igf2受体;igf2;igfl受体;igfl;itgb2、kiaa1596;kras;lcrb、甲基丙二酰基-coa变位酶、mrp7、munc13-4、n-乙酰基-α-d-氨基葡糖苷酶、nos3、npc1、otc(鸟氨酸转氨甲酰酶)、pah、pkhd1、pkd1、pkd2、pkd4、pklr、pku1、pparγ;pparα;prf1、psen2、psf2、pten;rb、视网膜劈裂蛋白(retinoschisin);ring11、sbma/smaxl/ar;sec63、serpina1、serpina2、serpina3、serpina5、serpina6、sftpa1、sftpb、sftpc、sftpd、slc2a、slc7a9、smpd1、sptb、tap2、tapbp、tpsn、unc13d、vegf-a、vegf-b、vegf-c、vldlr;和wt1。因此,在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna包含编码用于递送至对象的肺或肺细胞或者治疗对象的肺或肺细胞的肽或多肽。在某些实施方案中,本发明提供了用于产生治疗组合物的方法,所述治疗组合物包含编码内源性蛋白质的纯化的mrna,所述内源性蛋白质在对象中可能是缺陷的或非功能性的。在某些实施方案中,本发明提供了用于产生治疗组合物的方法,所述治疗组合物包含编码内源性蛋白质的纯化的mrna,所述内源性蛋白质在对象中可能是缺陷的或非功能性的。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码用于递送至对象的肺或肺细胞或者治疗对象的肺或肺细胞的肽或多肽。在某些实施方案中,本发明可用于制备编码囊性纤维化跨膜传导调节剂cftr的mrna的方法中。cftrmrna在用于治疗囊性纤维化的治疗组合物中被递送至有需要的对象的肺。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码用于向对象的肝脏或肝细胞递送或者治疗对象的肝脏或肝细胞的肽或多肽。此类肽和多肽可以包括与尿素循环病症相关的那些、与溶酶体贮积病症相关的那些、与糖原贮积病症相关的那些、与氨基酸代谢病症相关的那些、与脂质代谢或纤维化病症相关的那些、与甲基丙二酸血症相关的那些或与任何其它代谢病症相关的那些,对于所述代谢病症,向肝脏或肝细胞递送富集的全长mrna或者用富集的全长mrna治疗肝脏或肝细胞提供了治疗益处。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码与尿素循环病症相关的蛋白质。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码鸟氨酸氨甲酰基转移酶(otc)蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码精氨酰琥珀酸合成酶1蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码氨基甲酰磷酸合成酶i蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码精氨酰琥珀酸裂解酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码精氨酸酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码与溶酶体贮积病症相关的蛋白质。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码α半乳糖苷酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码葡糖脑苷脂酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码艾杜糖醛酸-2-硫酸酯酶蛋白。在某些实施方案中,本发明提供了产生包含的治疗组合物的方法,所述纯化的mrna编码艾杜糖醛酸酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码n-乙酰基-α-d-氨基葡糖苷酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码乙酰肝素n-硫酸酯酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码半乳糖胺-6硫酸酯酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码β-半乳糖苷酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码溶酶体脂肪酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码芳基硫酸酯酶b(n-乙酰半乳糖胺-4-硫酸酯酶)蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码转录因子eb(tfeb)。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码与糖原贮积病症相关的蛋白质。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码酸性α-葡糖苷酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码葡萄糖-6-磷酸酶(g6pc)蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码肝糖原磷酸化酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码肌肉磷酸甘油酸变位酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码糖原脱支酶。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码与氨基酸代谢相关的蛋白质。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码苯丙氨酸羟化酶。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码戊二酰-coa脱氢酶。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码丙酰-coa羧化酶。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码草酸酶(oxalase)丙氨酸-乙醛酸氨基转移酶。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码与脂质代谢或纤维化病症相关的蛋白质。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码mtor抑制剂。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码atp酶磷脂转运8b1(atp8b1)蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码一种或多种nf-κb抑制剂,如i-κbα、干扰素相关发育调节剂1(ifrd1)和sirtuin1(sirt1)中的一种或多种。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码ppar-γ蛋白或活性变体。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码与甲基丙二酸血症相关的蛋白质。例如,在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码甲基丙二酰coa变位酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码甲基丙二酰coa差向异构酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述mrna递送至肝脏或肝脏的治疗可以提供治疗益处。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码atp7b蛋白(也称为wilson病蛋白)。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码胆色素原脱氨酶。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码一种或多种凝固酶,如因子viii、因子ix、因子vii和因子x。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码人血色素沉着症(hfe)蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码用于递送至对象或心血管细胞或者治疗对象的心血管疾病或心血管细胞的肽或多肽。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码血管内皮生长因子a蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码松弛素蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码骨形态发生蛋白-9蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码骨形态发生蛋白-2受体蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码用于递送至对象的肌肉或肌细胞或者治疗对象的肌肉或肌细胞的肽或多肽。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码抗肌萎缩蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码共济蛋白(frataxin)。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码用于递送至对象的心肌或心肌细胞或者治疗治疗对象的心肌或心肌细胞的肽或多肽。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码调节肌肉组织或肌肉细胞中钾通道和钠通道中的一种或两种的蛋白质。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码在肌肉组织或肌肉细胞中调节kv7.1通道的蛋白质。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码在肌肉组织或肌肉细胞中调节nav1.5通道的蛋白质。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码用于递送至对象的神经系统或神经系统细胞或者治疗对象的神经系统或神经系统细胞的肽或多肽。例如,在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码运动神经元生存蛋白1。例如,在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码运动神经元生存蛋白2。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码共济蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码atp结合盒亚家族d成员1(abcd1)蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码cln3蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码用于递送至对象的血液或骨髓或者血液或骨髓细胞或者治疗对象的血液或骨髓或者血液或骨髓细胞的肽或多肽。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码β珠蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码布鲁顿氏酪氨酸激酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码一种或多种凝固酶,如因子viii、因子ix、因子vii和因子x。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码用于递送至对象的肾脏或肾细胞或者治疗对象的肾脏或肾细胞的肽或多肽。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码iv型胶原α5链(col4a5)蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码用于递送至对象的眼睛或眼细胞或者治疗对象的眼睛或眼细胞的肽或多肽。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码atp结合盒亚家族a成员4(abca4)蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码视网膜劈裂蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码视网膜色素上皮特异性65kda(rpe65)蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码290kda的中心体蛋白(cep290)。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码用于向对象或对象的细胞递送疫苗或者用疫苗治疗对象或对象的细胞的肽或多肽。例如,在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码来自传染剂如病毒的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码来自流感病毒的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码来自呼吸道合胞病毒的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码来自狂犬病病毒的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码来自巨细胞病毒的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码来自轮状病毒抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码来自肝炎病毒,如甲型肝炎病毒、乙型肝炎病毒或丙型肝炎病毒的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码来自人乳头瘤病毒的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码来自单纯疱疹病毒,如单纯疱疹病毒1或单纯疱疹病毒2的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码来自人免疫缺陷病毒,如人免疫缺陷病毒1型或人免疫缺陷病毒2型的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码来自人偏肺病毒的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码来自人副流感病毒,如人副流感病毒1型、人副流感病毒2型或人副流感病毒3型的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码来自疟疾病毒的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码来自寨卡病毒的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码来自基孔肯尼雅病毒的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码与对象的癌症相关的抗原或者从对象的癌细胞中鉴定的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码从对象自身的癌细胞确定的抗原,即提供个性化的癌症疫苗。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码由突变的kras基因表达的抗原。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码抗体。在某些实施方案中,抗体可以是双特异性抗体。在某些实施方案中,抗体可以是融合蛋白的一部分。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码ox40的抗体。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码vegf的抗体。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码组织坏死因子α的抗体。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码cd3的抗体。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码cd19的抗体。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码免疫调节剂。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna的编码白介素12。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码白介素23。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码白介素36γ。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码一种或多种干扰素基因刺激蛋白(sting)的组成型活性变体。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码核酸内切酶。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码rna引导的dna核酸内切酶蛋白,如cas9蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码兆核酸酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码转录激活因子样效应物核酸酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码锌指核酸酶蛋白。在某些实施方案中,本发明提供了产生包含纯化的mrna的治疗组合物的方法,所述纯化的mrna编码用于治疗眼部疾病。在一些实施方案中,所述方法用于产生包含纯化的mrna的治疗组合物,所述纯化的mrna编码视网膜劈裂蛋白。本发明的另一方面是通过上述方面或实施方案制备的纯化的mrna组合物。在一些实施方案中,本发明提供了药物组合物,其包含含有上述纯化的mrna和至少一种药学上可接受的赋形剂的溶液。通常,合适的mrna溶液还可以含有缓冲剂和/或盐。通常,缓冲剂可以包括hepes、硫酸铵、碳酸氢钠、柠檬酸钠、乙酸钠、磷酸钾和磷酸钠。药学上可接受的盐是本领域熟知的。例如,s.m.berge等人,在j.pharmaceuticalsciences(1977)66:1-19中详细描述了药学上可接受的盐。本发明化合物的药学上可接受的盐包括衍生自合适的无机和有机酸和碱的盐。药学上可接受的无毒酸加成盐的实例是与无机酸或有机酸或通过使用本领域中使用的其它方法如离子交换形成的氨基的盐,所述无机酸例如盐酸、氢溴酸、磷酸、硫酸和高氯酸,所述有机酸例如乙酸、草酸、马来酸、酒石酸、柠檬酸、琥珀酸或丙二酸。其它药学上可接受的盐包括己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、双葡萄糖酸盐、十二烷基硫酸盐、乙磺酸盐、甲酸盐、延胡索酸盐、葡庚糖酸盐、甘油磷酸盐、葡糖酸盐、半硫酸盐、庚酸盐、己酸盐、氢碘酸盐、2-羟基-乙磺酸盐、乳糖酸盐、乳酸盐、月桂酸盐、月桂基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、扑酸盐(palmoate)、果胶酸盐(pectinate)、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、对甲苯磺酸盐、十一烷酸盐、戊酸盐等。衍生自适当碱的盐包括碱金属的盐、碱土金属的盐、铵盐和n+(c1-4烷基)4盐。代表性的碱金属或碱土金属的盐包括钠、锂、钾、钙、镁等。当合适时,其它药学上可接受的盐包括使用抗衡离子如卤化物、氢氧化物、羧酸盐、硫酸盐、磷酸盐、硝酸盐、磺酸盐和芳基磺酸盐形成的无毒的铵、季铵和胺阳离子。其它药学上可接受的盐包括使用适当的亲电子试剂(例如烷基卤化物)季铵化胺以形成季铵化的烷基化氨基盐所形成的盐。本发明的一个方面是用于治疗疾病或病症的方法,其包括向有需要的对象施用上述方面的药物组合物的步骤。本发明的另一方面是包含通过上述方面或实施方案制备的纯化的mrna的溶液。本文描述的任何方面或实施方案可以与本文公开的任何其它方面或实施方案组合。虽然已经结合其详细描述描述了本公开内容,但上述描述旨在说明而不是限制本公开内容的范围,本公开内容的范围由所附权利要求的范围限定。其它方面、优点和修改在所附权利要求的范围内。与本发明相关的另外教导在以下一项或多项中描述:wo2010/053572;wo2011/068810;wo2012/075040;wo2012/170889;wo2012/170930;wo2013/063468;wo2013/149140;wo2013/149141;wo2013/185067;wo2013/185069;wo2014/089486;wo2014/152513;wo2014/152659;wo2014/152673;wo2014/152774;wo2014/152966;wo2014/153052;wo2015/061461;wo2015/061467;wo2015/061491;wo2015/061500;wo2015/148247;wo2015/164773;wo2015/184256;wo2015/200465;wo2016/004318;wo2016/149508;wo/2014/152940;pct/us16/57044;us62/320,073;us62/349,331;us62/420,413;us62/420,421;us62/420,428;us62/420,435;us62/421,007;us62/421,021,其各自在此通过引用以其整体并入。尽管与本文所述的方法和材料类似或等同的方法和材料可以用于本发明的实践或测试中,但下文描述了合适的方法和材料。本文提及的所有出版物、专利申请、专利和其它参考文献通过引用以其整体并入。本文引用的参考文献不被视为是所要求保护的发明的现有技术。另外,材料、方法和实施例仅是说明性的,而不旨在是限制性的。实施例实施例1:使用5mgscn沉淀缓冲液改善mrna纯化在本实施例中,将5mgscn沉淀缓冲液与具有4mgscn的缓冲液比较它们使用柱过滤形式去除毫克级加工酶的能力。如通过银染凝胶分析测定的,期望在单个沉淀步骤然后过滤之后获得的纯化产物具有减少的或不可检测的蛋白质污染物。材料和方法通过如别处所述的体外转录制备cftrmrna。简而言之,用包含密码子优化的cftr序列的线性或环状dna模板(所述模板dna还包含启动子)、核糖核苷酸三磷酸的库、包含dtt和镁离子的缓冲系统以及适当的rna聚合酶(例如t3、t7或sp6rna聚合酶)、dna酶i、焦磷酸酶和/或rna酶抑制剂进行示例性ivt反应。在纯化之前立即进行涉及5’-帽子和3’polya尾巴的掺入的反应(帽子-尾巴反应)。如下添加5’帽子:首先向反应中添加末端磷酸酶,其中rna末端磷酸酶从5’核苷酸中去除一个末端磷酸基团,留下两个末端磷酸;然后通过鸟苷酰基转移酶将鸟苷三磷酸(gtp)添加到末端磷酸中,产生5’-5’三磷酸酯键;然后鸟嘌呤的7-氮被甲基转移酶甲基化。使用poly(a)聚合酶进一步处理构建体以掺入poly(a)尾巴。然后对包含mrna的反应混合物进行如下所述的沉淀和随后的步骤。表1总结了在本实施例中描述的方法步骤中使用的材料。表1沉淀:使用以上列出的沉淀缓冲液(4mgscn对照,5mgscn1%或5mgscn0.1%n-月桂基肌氨酸)中的一种,在以下条件下沉淀2.5mgcftrmrna帽尾反应:将1体积的mrna反应物与2.3体积的沉淀缓冲液混合并充分混合。对于每一体积的初始帽尾反应,将1.7体积的100%etoh添加到rna:沉淀缓冲液中并充分混合以沉淀。过滤:将沉淀的混合物上样到maxiprep过滤柱(qiagen,germantown,md)上并离心以将沉淀的mrna捕获到qiagen过滤器上(所有离心在3,600rpm下进行)。然后将捕获的mrna沉淀物用80%etoh(每次洗涤,1ml80%etoh/mgrna)洗涤2次,第一次洗涤后离心2分钟,第二次洗涤后离心10分钟。通过向膜中添加水,然后在室温下孵育并离心来进行洗脱。将该过程重复总共5次,总洗脱体积为2.0ml。测量在260nm的吸光度并确定每个样品的浓度。银染:使用前述实施例中描述的方法运行银染凝胶。在37℃下,将15.5μl1mg/ml纯化的rna用4μlrna酶i(100u/ml,invitrogen)处理30分钟。在具有还原剂的invitrogenlds上样缓冲液中制备样品,并将其上样到10%bis-tris凝胶上。电泳在200v下运行35分钟。使用silverquest染色试剂盒将凝胶染色8分钟。结果在如上所述的cftrmrna帽尾反应的单一纯化循环后,使用nano-drop计算每个样品的产率以确定浓度(a260nm),并总结在表2(下文)中。mrna产率=洗脱浓度(mg/ml)*洗脱体积(ml)。来自所有条件的产率是可接受的并且在基于反应规模的期望产率的范围内。表2在银染凝胶测定中分析样品以检测残留的加工酶。银染的凝胶图像呈现在图1中。当与使用4mgscn缓冲液沉淀的样品(图1,凝胶1的泳道5)相比时,对于使用5mgscn-1%月桂基肌氨酸缓冲液沉淀的样品(图1,凝胶2的泳道6),或5mgscn-0.1%月桂基肌氨酸缓冲液沉淀的样品(图1,凝胶2的泳道8),注意到加工酶去除的显著改善。这些数据表明,不管缓冲液中表面活性剂的浓度如何,增加gscn摩尔浓度改善了加工酶去除。实施例2:使用含有dtt的5mgscn沉淀缓冲液改善mrna纯化在本实施例中,比较含有和不含二硫苏糖醇(dtt)的沉淀缓冲液去除与mrna制备/制造过程相关的残留酶(即,加工酶)以及减少确保充分去除该残留酶所必需的沉淀数量的能力。使用多孔微板形式通过过滤以毫克级进行mrna纯化。材料和方法通过如上所述的体外转录制备cftrmrna。使用下文所述的方法对mrna帽尾反应进行纯化。表3总结了在本实施例中描述的方法步骤中使用的材料。表3沉淀:对于24孔板的每个孔,使用以上列出的沉淀缓冲液(5mgscn或含有10mmdtt的5mgscn)中的一种,在以下条件下沉淀2.0mgmrna帽-尾(c/t)反应:将1体积的mrna反应物添加到2.3体积的沉淀缓冲液中并充分混合。对于每一体积的初始帽尾反应,将1.7体积的100%etoh添加到rna:沉淀缓冲液中并充分混合以沉淀。过滤:将沉淀的混合物上样到24孔过滤板的各个孔中,并向板施加约5psi的真空压力以捕获沉淀的mrna。然后将捕获的mrna沉淀物用80%etoh(每次洗涤,1ml80%etoh/mgrna)洗涤2次,第一次洗涤和第二次洗涤后5psi真空过滤。通过向膜中添加水,然后在室温下孵育并真空过滤来进行洗脱。将该过程重复总共5次,总洗脱体积为2.0ml/孔。测量在260nm的吸光度并确定每个样品的浓度。银染:使用以下预染样品制备物,根据制造商的说明,使用invitrogen试剂盒(invitrogen,carlsbad,ca),运行银染凝胶。在37℃下,将15.5μl1mg/ml纯化的rna用4μlrna酶i(100u/ml,invitrogen)处理30分钟。在具有还原剂的invitrogenlds上样缓冲液中制备样品,并将其上样到10%bis-tris凝胶上。电泳在200v下运行35分钟。使用silverquest银染试剂盒(invitrogen,carlsbad,ca)将凝胶染色8分钟。结果在如上所述单次纯化cftrmrna帽尾反应后,在使用nano-drop分光光度计(nanodroptechnologies,wilmington,de)测量mrna洗脱的光密度以测定mrna浓度(a260nm)之后,计算每个样品的总产率。mrna产率=洗脱浓度(mg/ml)*洗脱体积(ml)。结果总结在下表4中。表4表明针对反应规模的基于dtt缓冲液的方案的期望产率。表4如前述段落所述,在银染测定中分析样品以检测残留的加工酶。银染的凝胶图像呈现在图2中。凝胶1的泳道6(图2,左图)代表使用不含dtt的5mgscn纯化的样品。凝胶2的泳道6(图2,右图)代表使用含有10mmdtt的5mgscn纯化的样品。当与单独的5mgscn相比时,在使用含有10mmdtt缓冲液的5mgscn去除沉淀样品中的加工酶中注意到了显著的改善(凝胶2的泳道6与凝胶1的泳道6相比)。凝胶1或凝胶2中的泳道1显示了对照样品,其显示了污染酶的微弱条带。每种凝胶中的泳道10-12分别显示了加工酶rna酶1(泳道10)、sp6(泳道11)、鸟苷酸转移酶(泳道12)的电泳迁移对照。实施例3:使用gscn-dtt沉淀缓冲液纯化1克加帽和加尾的mrna在本实施例中,评价了gscn-dtt缓冲液成功去除来自克级mrna制造过程中可检测水平的污染物残留酶的能力。材料和方法以1克批量纯化规模加工mrna。使用先前描述的体外转录方法合成cftrmrna。在纯化之前立即进行加帽和加尾反应。表5总结了在本实施例中描述的过程中使用的材料。表5沉淀:使用含有dtt的5mgscn,在以下条件下沉淀1克(1g)cftrmrna加帽和加尾反应(帽尾反应)。将1体积的mrna反应物添加到2.3体积的沉淀缓冲液中并充分混合。对于1体积的初始帽尾反应,将1.7体积的100%etoh添加到mrna:沉淀缓冲溶液中并充分混合以沉淀。沉淀后,添加10gsolka-floc100作为过滤剂(助滤剂)以防止膜积垢并有助于最终洗脱。过滤:将具有过滤剂的沉淀混合物装载到1l真空过滤瓶中,并施加真空以将沉淀物从沉淀缓冲液中过滤出来。然后用80%etoh(1l80%etoh/grna)洗涤捕获的mrna沉淀物,然后进行10分钟真空干燥步骤。通过去除沉淀的mrna和助滤剂以及悬浮在250ml水中进行洗脱。将悬浮液在室温下搅拌30分钟,然后通过新鲜的0.22μmpes过滤瓶以去除助滤剂。测量在260nm的吸光度并确定每个样品的浓度。银染:用以下预染样品制备物,根据invitrogen试剂盒运行银染凝胶。在37℃下,将15.5μl1mg/mlrna用4μlrna酶i(100u/ml,invitrogen)处理30分钟。在具有还原剂的invitrogenlds上样缓冲液中制备样品,并最终上样到10%bis-tris凝胶上。电泳在200v下进行35分钟。使用silverquest染色试剂盒将凝胶染色,并显影8分钟。结果:在如上所述的cftrmrna帽尾反应的单轮纯化后,使用nano-drop计算样品产率以确定浓度(a260nm)并总结在表6(下文)中。来自1g反应的mrna产率是可接受的并且在基于反应规模的期望产率的范围内。表6在银染凝胶中分析样品以检测来自该过程的任何残留酶的存在。银染凝胶图像呈现在以下的图3中。在纯化的cftrmrna样品中未检测到可观察到的残留酶(图3,泳道5)。用于加工酶的电泳迁移对照在凝胶中描述如下:rna酶1(泳道6)、sp6(泳道7)、鸟苷酸转移酶(泳道8)、polya聚合酶(泳道9)和2-o-甲基转移酶(泳道10)。这些结果表明,使用含有助滤剂和5mgscn-10mmdtt的1l0.22μm真空过滤瓶成功地沉淀、捕获、洗涤和回收了克级帽尾mrna。令人惊讶的是,基于我们的检测方法的灵敏度,单个纯化步骤能够去除任何可检测水平的残留加工酶。实施例4:使用gscn-dtt沉淀缓冲液纯化10克加帽和加尾的mrna在本实施例中,gscn-dtt缓冲液能够从以10克批量纯化规模加工的mrna中成功地去除可检测水平的污染物残留酶,并且涉及单个沉淀步骤。材料和方法:使用先前描述的体外转录方法合成cftrmrna。在纯化之前立即进行加帽和加尾反应。表7总结了在以下描述的过程中使用的材料。表7沉淀:使用5mgscnw/dtt在以下条件下沉淀10克(10g)cftrmrna加帽和加尾反应(帽尾反应)。将1体积的mrna反应物添加至2.3体积的沉淀缓冲液中并充分混合。对于1体积的初始帽尾反应,将1.7体积的100%etoh添加到rna:沉淀缓冲溶液中并充分混合以沉淀。在沉淀后,添加20gsolka-floc100作为过滤剂以防止膜积垢并有助于最终洗脱。过滤:将含有过滤剂的沉淀混合物以2.0l/min装载到1500rpm的h300p过滤离心机(heinkelusa,swedesboro,nj)上。然后用80%etoh(5l80%etoh/grna)洗涤捕获的rna沉淀物,然后进行15分钟的干燥步骤。通过去除沉淀的mrna和助滤剂以及悬浮在5l水中进行洗脱。将悬浮液在室温下搅拌30分钟,然后通过h300p过滤离心机以去除助滤剂。进行两次另外的5l洗脱以从助滤剂滤饼中回收尽可能多的材料。测量在260nm的吸光度并确定每个样品的浓度。银染:用以下预染样品制备物,根据invitrogen试剂盒运行银染琼脂糖凝胶。在37℃下,将15.5μl1mg/mlrna用4μlrna酶i(100u/ml,invitrogen)处理30分钟。在具有还原剂的invitrogenlds上样缓冲液中制备样品,并最终上样到10%bis-tris凝胶上。电泳在200v下进行35分钟。使用silverquest染色试剂盒将凝胶染色,并显影8分钟。毛细管电泳(ce):使用ce片段分析仪和大的rna检测试剂盒评估rna完整性和尾巴长度。进行对于完整性的峰分布和尾巴长度的大小变化的分析。结果:在如上所述的cftrmrna帽尾反应的单个纯化后,使用nano-drop计算样品产率以确定浓度(a260nm),并总结在下表8中。来自10g反应的最终mrna产率是良好的,并且在基于反应规模的期望产率的范围内。表8样品产率(g)%回收10gh300p纯化的cftrmrna9.191在银染凝胶测定中分析样品以检测残留的加工酶。银染凝胶图像显示在图4中,描述了在纯化的cftrmrna样品中没有可观察到的残留加工酶(泳道4)。泳道1显示了对照纯化的mrna样品,显示了污染物酶的微弱条带。泳道7-11描述了如下加工酶的电泳迁移对照:rna酶1(泳道7)、sp6(泳道8)、鸟苷酸转移酶(泳道9)、polya聚合酶(泳道10)和2-o-甲基转移酶(泳道11)。通过ce评估使用h300p和5mgscnw/10mmdtt单次纯化后的rna完整性和尾巴长度。在单次纯化之后mrna的完整性显示在图5a和图5b中。图5a显示了在加尾反应之前的mrna峰。图5b显示了在相同原始mrna制备物的加尾反应之后的mrna峰。在图5b中ce电泳图上的单个明显的峰与历史对照样品(未显示)一致。基于与无尾的rna相比的ce凝胶位移来评估534nt的poly-a尾巴长度(图5b对比图5a)。尾巴长度在基于加尾反应条件的预测的尾巴大小内。该实施例显示了在5mgscn-10mmdtt作为沉淀缓冲液的情况下,使用h300p成功地沉淀、捕获、洗涤和回收了10gmrna。基于我们的检测方法的灵敏度,使用5mgscn-10mmdtt的单个纯化过程可以去除任何可检测水平的残留加工酶。当与历史样品相比时,过滤器离心和5mgscn-10mmdtt对mrna完整性或尾巴没有负面影响。实施例5:使用gscn-dtt沉淀缓冲液纯化100克加帽和加尾的mrna在本实施例中,gscn-dtt缓冲液能够从以100克(100g)批量纯化规模加工的mrna中成功地去除可检测水平的污染物残留酶,并且涉及单个沉淀步骤。材料和方法:使用先前描述的体外转录方法合成cftrmrna。在纯化之前立即进行加帽和加尾反应。表9总结了在以下描述的过程中使用的材料。表9沉淀:使用含有dtt的5mgscn在以下条件下沉淀100gcftrmrna帽尾反应。将1体积的mrna反应物添加到2.3体积的沉淀缓冲液中并充分混合。对于1体积的初始帽尾反应,将1.7体积的100%etoh添加到rna:沉淀缓冲溶液中并充分混合以沉淀。在沉淀后,添加1200gsolka-floc100作为过滤剂以防止膜积垢并有助于最终洗脱。过滤:将含有过滤剂的沉淀混合物以6.0l/min装载到1000rpm的ehbl503过滤离心机(rousseletrobatel,annonay,fr)上。然后用80%etoh(1.5l80%etoh/grna)洗涤捕获的rna沉淀物,然后进行20分钟的干燥步骤。通过去除沉淀的mrna和助滤剂以及悬浮在25l水中进行洗脱。将悬浮液在室温下搅拌30分钟,然后通过ehbl503过滤离心机以去除助滤剂。进行两次另外的15l洗脱以从助滤剂滤饼中回收尽可能多的材料。测量在260nm的吸光度并确定每个样品的浓度。银染:用以下预染样品制备物,根据invitrogen试剂盒运行银染凝胶。在37℃下,将15.5μl1mg/mlrna用4μlrna酶i(100u/ml,invitrogen)处理30分钟。在具有还原剂的invitrogenlds上样缓冲液中制备样品,并最终上样到10%bis-tris凝胶上。电泳在200v下进行35分钟。使用silverquest染色试剂盒将凝胶染色,并显影8分钟。ce:使用ce片段分析仪和大的rna检测试剂盒评估rna完整性和尾巴长度。进行对于完整性的峰分布和尾巴长度的大小变化的分析。帽子测定:使用hplc/ms方法测定存在于最终纯化的mrna产物中的帽子种类,其能够精确地计算未加帽的、capg、cap0和cap1的量,并且报告为总信号的百分比。结果:在如上所述cftrmrna帽尾反应的单个纯化后,使用nano-drop计算样品产率以确定浓度(a260nm),并总结在下表10中。100g反应的最终mrna产率在基于反应规模的期望产率的范围内。表10样品产率(g)%回收100g离心纯化cftrmrna102102银染凝胶图像显示在图6中,其表明在纯化的cftrmrna样品中没有可观察到的残留加工酶(泳道5和6)。令人惊讶的是,用本发明的缓冲液进行的单个纯化步骤可以产生高纯度的mrna,而没有可检测出的污染物加工酶。在该图中,泳道8-12描述了如下泳道的加工酶的电泳迁移对照:rna酶1(泳道8)、sp6(泳道9)、鸟苷酸转移酶(泳道10)、polya聚合酶(泳道11)和2-o-甲基转移酶(泳道12)。rna的ce电泳图显示了与代表性的历史对照样品一致的单个显著的峰(图7,由箭头表示)。基于与未加帽的rna(数据未显示)相比的c/tmrna的ce凝胶位移(图7)来评估300nt的poly-a尾巴长度。尾巴长度在基于加尾反应条件的预测的尾巴大小内。使用5mgscnw/10mmdtt单次纯化后,最终mrna产物中cap1种类的百分比是(95%)。其余种类都是未加帽的(5%)。这些结果与该转录物的历史cap1%一致(数据未显示)。这些数据表明在5mgscn-10mmdtt作为沉淀缓冲液的情况下,使用ehbl503离心机成功地沉淀、捕获、洗涤和回收了100gmrna。基于我们的检测方法的灵敏度,使用5mgscn-10mmdtt的单个纯化过程可以去除任何可检测水平的残留加工酶。当与历史样品相比时,使用过滤离心机和5mgscn-10mmdtt对mrna完整性、尾巴长度、mrna加帽效率或稳定性没有负面影响。实施例6:使用各种还原剂纯化加帽和加尾的mrna在本实施例中,评估不同的还原剂在添加到5mgscn沉淀缓冲液中时去除加工酶的能力。材料和方法:使用先前描述的体外转录方法合成8批5mgcftrmrna。对于沉淀,每一体积的ivt反应中添加2.3体积的具有表11中列出的各种还原剂的5mgscn缓冲液(最终为2.3mgscn)。然后,将1.7体积的100%etoh(最终为34%etoh)添加到混合物中。将沉淀的rna样品捕获在qiagenrneasymaxi柱上,用10ml80%乙醇洗涤两次,然后溶解在2ml无rna酶的h2o中。使用nano-drop2000分光光度计,使用在260nm的吸光度计算溶解的rna样品的浓度。表11然后将所得的cftrivtmrna样品用作8个5mg帽尾反应的起始材料。在加帽和加尾后,通过每一体积的ivt反应添加2.3体积的表11中列出的5mgscn缓冲液(最终为2.3mgscn),沉淀八个反应中的每一个。然后,将1.7体积的100%etoh(最终为34%etoh)添加到混合物中。将沉淀的rna样品捕获在qiagenrneasymaxi柱上,用10ml80%乙醇洗涤两次,然后溶解在5ml无rna酶的h2o中。使用nano-drop2000分光光度计,使用在260nm的吸光度计算溶解的rna样品的浓度。使用如实施例1中所述的银染方法评价每个样品,以确定在用各种还原剂纯化后存在的残留加工酶的量。结果:如图8所示,在5mgscn沉淀缓冲液中使用5-15mm的浓度下测试的任何还原剂都导致完全去除可检测水平的rna加工酶(泳道3-9)。在没有任何还原剂的情况下,仅使用5mgscn纯化的cftr反应(泳道2)具有微弱的并且在rna聚合酶和guat的分子量范围内观察到的条带,这提供了进一步的证据,即单独的gscn在去除rna合成加工酶方面是低效的。这些结果证实了当使用gscn作为离液盐时,在rna沉淀缓冲液中添加还原剂对于确保足够的加工酶去除是必需的。有趣的是,在不同浓度下的多种还原剂的性能与原始评估的10mmdtt试剂类似。不希望受理论束缚,在添加有机溶剂以沉淀rna之前还原rna加工酶是重要的步骤,因为当使用乙醇盐诱导的沉淀纯化rna时,该还原步骤促进加工酶的去除。等效物本领域技术人员将认识到或仅使用常规实验就能够确定本文所述的本发明的特定实施方案的许多等效物。本发明的范围不旨在限于以上描述,而是如所附权利要求书中所阐述的。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1