生产高级烷酮优选6-十一烷酮及其衍生物的方法与流程
发明领域
本发明涉及生产高级烷酮、优选6-十一烷酮的方法。特别地,本发明涉及使用联用的生物技术的和化学的方法生产高级烷酮、优选6-十一烷酮。
发明背景
6-十一烷酮通常存在于草本植物和香辛料中并且是桂花(osmanthusfragrans)(甜桂花)的成分。6-十一烷酮是具有式(ch3(ch2)4)2co的二烷基酮。它尤其在食品行业中用作增味剂。在其他行业中,6-十一烷酮用作溶剂并用于油漆和涂料中。
在工业上,6-十一烷酮通常通过在升高的温度下使相应的羧酸与各种金属氧化物催化剂接触而由羧酸生产。例如,在美国专利号4,754,074中描述了使用负载在氧化铝上的二氧化锰生成二烷基酮的方法以及可用于由丙酸生成二乙基酮的催化剂的其他实例。在本领域中众所周知,在由羧酸制备酮时,可以使用其他催化剂诸如铅、铁、锆、锰、钍和钕的氧化物。尽管需要在250-450℃的高反应温度下的高压氢气使该方法高效,但是可以使用这些催化剂而不会有显著的碳损失。这些条件增加了生产酮的成本。
此外,在实践的所有这些方法中,生产的二烷基酮总是由羧酸作为起始材料形成。例如,6-十一烷酮的生产从己酸开始。己酸主要排他地从植物和动物油脂中获得。作为原材料的动物脂肪仍然不能满足客户要求,而含有短长度和中长度羧酸的植物油要么难以获得,要么仅在热带地区生产,而且常常还导致雨林的破坏。此外,特定的植物和动物油脂原材料具有特定但限定的脂肪酸分布,从而导致联产(coupledproduction)。因此,难以获得纯的己酸作为用于生产6-十一烷酮的底物(substrate)。
因此,在本领域中需要从其他起始材料或在其他起始点处生产6-十一烷酮和其他高级烷酮的更高效手段。特别地,在本领域中需要一种从另一种原材料源生产6-十一烷酮的方法,该方法能够使生产高效而有效。
发明附图
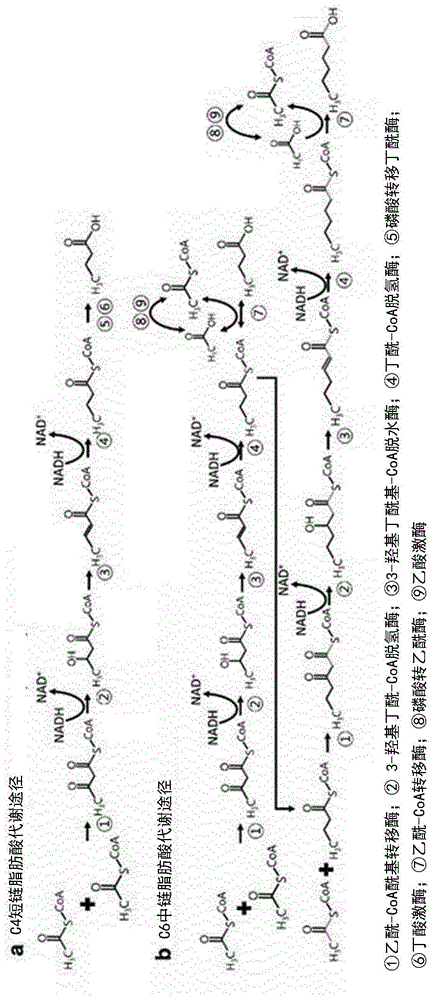
图1显示了碳链延长的微生物代谢途径,诸如(a)由梭菌(clostridium)和丁酸弧菌(butyrivibrio)属生产丁酸(c4)(kimbh等人,applenvironmicrobiol.1984;48(4):764–70)和(b)假定在埃氏巨型球菌(megasphaeraelsdenii)和克鲁维氏梭菌(clostridiumkluyveri)中生产己酸(khanma..melbourne:victoriauniversity;2006)。
技术实现要素:
本发明试图通过提供用于生产高级烷酮、优选6-十一烷酮的完整循环来解决上述问题,涉及了生物技术和化学手段。特别地,高级烷酮、优选6-十一烷酮的生产使用生物技术手段从简单的底物诸如乙醇和/或乙酸酯开始来生产己酸。然后可以将产生的己酸萃取并对萃取的己酸进行化学步骤,该化学步骤将己酸转化为高级烷酮、优选6-十一烷酮。该方法的优点是从便宜且容易获得的原材料开始来生产高级烷酮、优选6-十一烷酮。原材料(乙酸酯和/或乙醇)也使用不杀灭任何动物或植物的手段生产。此外,根据本发明的任何方面使用用于生产己酸的生物技术步骤并接着进行萃取步骤得到高且纯收率的己酸,该己酸然后可容易地用于使用化学步骤生产高级烷酮、优选6-十一碳烷酮。
根据本发明的一个方面,提供了一种由乙醇和/或乙酸酯生产高级烷酮、优选6-十一烷酮的方法,所述方法包括
(a)使乙醇和/或乙酸酯与至少一种能够进行碳链延长的微生物接触以由乙醇和/或乙酸酯生产己酸和/或其酯;
(b)在含水介质中使用至少一种萃取剂萃取来自(a)的己酸和/或其酯,其中所述萃取剂包含至少一种烷基氧化膦和至少一种包含至少12个碳原子的烷烃;或至少一种三烷基胺和至少一种包含至少12个碳原子的烷烃;和
(c)在合适的反应条件下使来自(b)的所萃取的己酸和/或其酯与至少一种酮基化催化剂以及任选存在的包含1至22个碳原子的其他烷酸接触以将己酸以及任选存在的其他烷酸化学酮基化为高级烷酮、优选6-十一烷酮。
本文所用的术语“高级烷酮/烷醇/烷酸”是指包含至少六个碳原子的烷酮/烷醇/烷酸。
(a)中能够进行碳链延长以产生己酸的微生物可以是可根据图1碳链延长的任何生物体(jeon等人,biotechnolbiofuels(2016)9:129)。在seedorf,h.,等人,2008中也公开了碳链延长途径。根据本发明的任何方面的微生物还可以包括其野生型形式不能碳链延长但是由于遗传修饰而获得了这种特性的微生物。特别地,(a)中的微生物可以选自食一氧化碳梭菌(clostridiumcarboxidivorans)和克鲁维氏梭菌(clostridiumkluyveri)。更特别地,根据本发明的任何方面的微生物可以是克鲁维氏梭菌(clostridiumkluyveri)。
根据本发明的任何方面的(b)中的萃取步骤允许相对于所用萃取剂的量收率的提高。例如,少于50重量%的萃取剂可用于萃取相同量的己酸,就好像仅使用纯烷烃一样。因此,使用小体积的萃取剂,可以以更高收率萃取己酸。萃取剂也对微生物无害。因此,当根据本发明的任何方面以生物技术方式生产己酸时,可以存在根据本发明的任何方面的萃取剂。因此,根据本发明的任何方面的含水介质,特别是在分离己酸的步骤(b)之后,可以再循环回到步骤(a)中。该再循环步骤允许微生物被再循环和再利用,因为根据本发明的任何方面的萃取剂对微生物无毒。在根据本发明的任何方面的方法中该再循环含水介质的步骤的其他优点是能够给予己酸的残留物(该残留物在第一循环中起初并未从步骤(b)中萃取)再次被萃取或被多次萃取(与含水介质再循环次数相同)的机会。此外,己酸可以通过蒸馏容易地与根据本发明的任何方面的萃取剂分离。这是因为己酸至少在比萃取剂显著更低的沸点下蒸馏并且在经由蒸馏分离之后,可以容易地使萃取剂再循环。
根据本发明的任何方面的方法可以包括从含水介质中萃取分离的己酸的步骤。分离的己酸可以指可以与已产生己酸的介质分离的己酸。在一个实例中,己酸可在含水介质(例如通过特定的细胞由碳源产生己酸的发酵培养基(fermentationmedium))中产生。分离的己酸可以指从含水介质中萃取的己酸。特别地,萃取步骤允许过量的水与含水介质分离,从而导致形成含有萃取的己酸的混合物。
萃取剂也可称为“萃取介质(extractionmedium)”或“萃取介质(extractingmedium)”。萃取剂可用于从最初产生己酸的含水介质中萃取/分离根据本发明的任何方法产生的己酸。在萃取步骤结束时,可以除去来自含水介质的过量水,从而得到含有萃取的己酸的萃取剂。特别地,在萃取步骤结束时,随着己酸被萃取和除去,剩下的可能是具有用于生产己酸的细胞的发酵培养基,然后可以将这些细胞与发酵培养基一起再循环用于步骤(a)。技术人员将能够确定在第一循环之后是否需要补充发酵培养基和/或细胞。特别地,根据本发明的任何方面的第一循环涉及步骤(a)至(c)的一轮。然后可以从第二循环开始使介质和/或细胞再循环。萃取剂可以包含这样的化合物的组合,该化合物可以导致从含水介质中萃取己酸的高效方法。特别地,萃取剂可以包括:
-至少一种烷基氧化膦和至少一种包含至少12个碳原子的烷烃;或
-至少一种三烷基胺和至少一种包含至少12个碳原子的烷烃。
根据本发明的任何方面的萃取剂可以高效地将己酸萃取到萃取剂中。可以认为这种烷基氧化膦或三烷基胺与至少一种烷烃的混合物的萃取剂在根据本发明的任何方面的方法中是合适的,因为该混合物在发酵培养基的存在下在萃取所需己酸方面是高效地。特别地,可以认为烷基氧化膦或三烷基胺与至少一种烷烃的混合物比本领域目前已知的用于萃取己酸的任何方法都更好,因为它不需要任何特殊的设备来进行并且相对容易以高产物收率来进行。此外,根据本发明的任何方面的萃取剂也不毒害根据步骤(a)的微生物。
萃取剂中的烷烃可以包含至少12个碳原子。特别地,烷烃可以包含12-18个碳原子。在一个实例中,烷烃可以选自十二烷、十三烷、十四烷、十五烷、十六烷、十七烷和十八烷。在另外的实例中,萃取剂可以包含烷烃的混合物。
烷基氧化膦具有通式opx3,其中x为烷基。根据本发明的任何方面的合适的烷基氧化膦包括由直链、支化或环状烃构成的烷基,该烃由1至约100个碳原子和1至约200个氢原子构成。特别地,用于根据本发明的任何方面的烷基氧化膦的“烷基”可以指具有1至20个碳原子、通常4至15个碳原子或6至12个碳原子且可由直链、环状、支链或这些的混合物构成的烃基。烷基氧化膦在每个磷原子上可具有一个至三个烷基。在一个实例中,烷基氧化膦在p上具有三个烷基。在一些实例中,烷基可以包含氧原子来置换c4-c15或c6-c12烷基的一个碳,前提是该氧原子不连接到烷基氧化膦的p上。通常,烷基氧化膦选自三辛基氧化膦、三丁基氧化膦、己基氧化膦、辛基氧化膦及其混合物。甚至更特别地,烷基氧化膦可以是三辛基氧化膦(topo)。
三烷基胺是衍生自氨(nh3)的有机化合物,其三个氢原子被烷基置换。三烷基胺的实例有二甲基乙胺、甲基二乙胺、三乙胺、二甲基正丙胺、二甲基异丙胺、甲基二正丙胺、二甲基丁胺、三辛胺等。特别地,根据本发明的任何方面的萃取剂中使用的三烷基胺可以不溶于水并且可以是三辛胺。
在一个实例中,根据本发明的任何方面的萃取剂可以是烷基氧化膦或三烷基胺与至少一种烷烃的组合。特别地,烷烃可以包含至少12个碳原子。更特别地,烷烃可以包含12-18个碳原子。在一个实例中,烷烃可以选自十二烷、十三烷、十四烷、十五烷、十六烷、十七烷和十八烷。在另一个实例中,萃取剂可以包含烷烃的混合物。甚至更特别地,根据本发明的任何方面的萃取剂可以是topo与十四烷或十六烷的组合。
三辛基氧化膦(topo)是具有式op(c8h17)3的有机磷化合物。topo可以与根据本发明的任何方面的至少一种烷烃一起是萃取剂的一部分。特别地,topo和包含至少12个碳原子的烷烃的混合物的topo与烷烃的重量比可为约1:100至1:10。更特别地,根据本发明的任何方面的萃取剂中topo与烷烃的重量比可以为约1:100、1:90、1:80、1:70、1:60、1:50、1:40、1:30、1:25、1:20、1:15或1:10。甚至更特别地,topo与烷烃的重量比可以在1:90至1:10、1:80至1:10、1:70至1:10、1:60至1:10、1:50至1:10、1:40至1:10、1:30至1:10或1:20至1:10的范围内选择。topo与烷烃的重量比可以在1:40至1:15或1:25至1:15之间。在一个实例中,topo与烷烃的重量比可为约1:15。在该实例中,烷烃可以是十六烷,因此topo与十六烷的重量比可以为约1:15。
在另一个实例中,当萃取剂包含的烷基氧化膦或三烷基胺与topo在包含至少12个碳原子的烷烃中的溶解度相比更加可溶于萃取剂中的烷烃时,该烷基氧化膦(除了topo之外)或三烷基胺与烷烃的重量比可以为1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1或10:1。在一个实例中,萃取剂可以是三己基氧化膦并且三己基氧化膦与烷烃的比率可以是1:1。在其他实例中,萃取剂可以是短链烷基氧化膦并且短链烷基氧化膦与烷烃的比率可以是2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1或10:1。在这种情况下,短链烷基氧化膦是指具有c1-c4烷基的氧化膦。在另一个实例中,萃取剂可以是三烷基胺,已知其比氧化膦更可溶于烷烃中。例如,三烷基胺可以是可以至多1:1的与烷烃的比率存在于根据本发明的任何方面的萃取剂中的三辛胺(toa)。链长较短的胺可以甚至更高的比率使用。在其他实例中,萃取剂可以是短链三烷基胺并且短链三烷基胺与烷烃的比率可以是2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1或10:1。在这种情况下,短链烷基氧化膦是指具有c1-c4烷基的氧化膦。
本文所用的术语“约”是指在20%内的变化。特别地,本文所用的术语“约”是指给定测量结果或数值+/-20%,更具体地+/-10%,甚至更具体地+/-5%。
在根据本发明的任何方面的步骤(a)中,使乙醇和/或乙酸酯与至少一种能够进行碳链延长的微生物接触以由乙醇和/或乙酸酯产生己酸和/或其酯。在一个实例中,碳源可以是乙醇与至少一种选自乙酸酯和丁酸酯的其他碳源的组合。特别地,碳源可以是乙醇和乙酸酯。在另一个实例中,碳源可以是乙醇与丁酸的组合。在一个实例中,碳底物可以是单独的乙醇。在另一个实例中,碳底物可以是单独的乙酸酯。
乙酸酯和/或乙醇的来源可能根据可得性而有所不同。在一个实例中,乙醇和/或乙酸酯可以是合成气或本领域已知的任何碳水化合物的发酵产物。特别地,用于乙酸酯和/或乙醇生产的碳源可以选自醇、醛、葡萄糖、蔗糖、果糖、右旋糖、乳糖、木糖、戊糖、多元醇、己糖、乙醇和合成气。
混合源可以用作碳源。
甚至更特别地,碳源可以是合成气。可以在至少一种产乙酸细菌的存在下将合成气转化为乙醇和/或乙酸酯。
关于包括二氧化碳和/或一氧化碳的底物的来源,技术人员将理解,存在许多可能的用于提供co和/或co2作为碳源的来源。可以看出,实际上由于可以使用能够向微生物提供足够量的碳的任何气体或任何气体混合物作为本发明的碳源,使得可以由该co和/或co2源形成乙酸酯和/或乙醇。
通常对于本发明的产乙酸细胞,碳源包含至少50重量%、至少70重量%、特别是至少90重量%的co2和/或co,其中重量百分比%涉及根据本发明的任何方面可用于细胞的所有碳源。可以提供碳材料源。
气体形式的碳源的实例包括废气诸如通过酵母发酵或梭菌发酵产生的合成气、烟道气和石油炼油厂气。这些废气由含纤维素材料的气化或煤气化形成。在一个实例中,这些废气可能不一定作为其他工艺的副产物产生,而是可以特别地产生以与本发明的混合培养物一起使用。
根据本发明的任何方面,在根据本发明的任何方面的步骤(a)中使用的用于生产乙酸酯和/或乙醇的碳源可以是合成气。合成气例如可以作为煤气化的副产物产生。因此,根据本发明的任何方面的微生物可能能够将为废产物的物质转化为有价值的资源。
在另一个实例中,合成气可以是用于与本发明的混合培养物一起使用以产生取代的和未取代的有机化合物的广泛可得的低成本农业原材料的气化副产物。
可以转化为合成气的原材料有众多实例,因为几乎所有形式的植物都可以用于此目的。特别地,原材料选自多年生草诸如芒草、玉米残渣、加工废物诸如锯末等。
通常,合成气可以主要通过热解、部分氧化和水蒸汽重整在干燥生物质的气化装置中获得,其中合成气的主要产物是co、h2和co2。合成气也可能是电解co2的产物。技术人员将理解进行co2电解以产生包含所需量的co的合成气的合适条件。
通常,首先处理从气化工艺获得的一部分合成气以优化产品收率,并避免形成焦油。合成气中不希望的焦油和co的裂解可以使用石灰和/或白云石来进行。
本发明的方法的总效率、乙醇和/或乙酸酯生产率和/或总碳捕获可以取决于连续气流中co2、co和h2的化学计量。施用的连续气流可以具有组分co2和h2。特别地,在连续气流中,co2的浓度范围可以为约10-50重量%,特别是3重量%并且h2的浓度范围可以在44重量%至84重量%、特别是在64-66.04重量%内。在另一个实例中,连续气流还可以包括惰性气体如n2,n2的浓度至多为50重量%。
甚至更特别地,包含co和/或co2的碳源以连续气流与产乙酸细胞接触。甚至更特别地,连续气流包括合成气。这些气体例如可以使用开口到含水介质中的喷嘴、玻璃料、将气体供给到含水介质中的管内的膜等来供应。
技术人员将理解,可能必需以相应的间隔监测料流的组成和流速。料流的组成的控制可以通过改变各组成料流的比例以实现目标或期望组成来实现。共混料流的组成和流速可以通过本领域已知的任何方法来监测。在一个实例中,该系统适于连续监测至少两种料流的流速和组成并将它们组合以在具有最佳组成的连续气流和用于将该优化的底物料流传送至发酵罐的装置中产生单一共混底物料流。
根据本发明的任何方面,还原剂例如氢气可以与碳源一起供应。特别地,在供应和/或使用co和/或co2时,可以供应该氢气。在一个实例中,氢气是根据本发明的任何方面存在的合成气的一部分。在另一个实例中,在合成气中的氢气不足以用于本发明的方法的情况下,可以供应额外的氢气。
如本文所用的术语“产乙酸细菌”是指能够进行wood-ljungdahl途径并因此能够将co、co2和/或氢气转化为乙酸酯的微生物。这些微生物包括其野生型形式不具有wood-ljungdahl途径但是由于遗传修饰而获得了该特性的微生物。这样的微生物包括但不限于大肠杆菌(e.coli)细胞。这些微生物也可以称为一氧化碳营养菌(carboxydotrophicbacteria)。目前本领域已知21种不同的产乙酸细菌属(drake等人,2006),并且这些细菌可能还包括一些梭菌(drake&kusel,2005)。这些细菌能够使用二氧化碳或一氧化碳作为碳源而使用氢气作为能源(wood,1991)。此外,醇、醛、羧酸以及众多己糖也可以用作碳源(drake等人,2004)。导致乙酸酯形成的还原性途径被称为乙酰辅酶a(acetyl-coa)或wood-ljungdahl途径。特别地,产乙酸细菌可以选自潮湿厌氧醋菌(acetoanaerobiumnotera)(atcc35199)、长醋丝菌(acetonemalongum)(dsm6540)、甲醇醋酸杆菌(acetobacteriumcarbinolicum)(dsm2925)、苹果酸醋酸杆菌(acetobacteriummalicum)(dsm4132)、醋酸杆菌属no.446(acetobacteriumspeciesno.446)(morinaga等人,1990,j.biotechnol.,vol.14,p.187-194)、威氏醋酸杆菌(acetobacteriumwieringae)(dsm1911)、伍氏醋酸杆菌(acetobacteriumwoodii)(dsm1030)、碱基杆菌(alkalibaculumbacchi)(dsm22112)、闪烁古生球菌(archaeoglobusfulgidus)(dsm4304)、产生布拉氏菌(blautiaproducta)(dsm2950,先前称作产生瘤胃菌(ruminococcusproductus),先前称作产生消化链球菌(peptostreptococcusproductus))、食甲基丁酸杆菌(butyribacteriummethylotrophicum)(dsm3468)、醋酸梭菌(clostridiumaceticum)(dsm1496)、产乙醇梭菌(clostridiumautoethanogenum)(dsm10061,dsm19630和dsm23693)、食一氧化碳梭菌(clostridiumcarboxidivorans)(dsm15243)、克氏梭菌(clostridiumcoskatii)(atccno.pta-10522)、德雷克氏梭菌(clostridiumdrakei)(atccba-623)、蚂酸醋酸梭菌(clostridiumformicoaceticum)(dsm92)、乙二醇梭菌(clostridiumglycolicum)(dsm1288)、永达尔梭菌(clostridiumljungdahlii)(dsm13528)、永达尔梭菌c-01(clostridiumljungdahliic-01)(atcc55988)、永达尔梭菌eri-2(clostridiumljungdahliieri-2)(atcc55380)、永达尔梭菌o-52(clostridiumljungdahliio-52)(atcc55989)、马犹母贝梭菌(clostridiummayombei)(dsm6539)、食甲氧苯梭菌(clostridiummethoxybenzovorans)(dsm12182)、拉氏梭菌(clostridiumragsdalei)(dsm15248)、粪味梭菌(clostridiumscatologenes)(dsm757)、梭菌种atcc29797(schmidt等人,1986,chem.eng.commun.,vol.45,p.61-73)、库氏脱硫肠状菌属(desulfotomaculumkuznetsovii)(dsm6115)、热苯甲酸脱硫肠状菌热互养共栖亚种(desulfotomaculumthermobezoicumsubsp.thermosyntrophicum)(dsm14055)、粘液真杆菌(eubacteriumlimosum)(dsm20543)、乙酸甲烷八叠球菌c2a(methanosarcinaacetivoransc2a)(dsm2834)、穆尔氏菌属huc22-1(moorellasp.huc22-1)(sakai等人,2004,biotechnol.let.,vol.29,p.1607-1612)、热醋穆尔氏菌(moorellathermoacetica)(dsm521,先前称作clostridiumthermoaceticum(热醋梭菌))、热自氧穆尔氏菌((moorellathermoautotrophica)(dsm1974)、普氏产醋杆菌(oxobacterpfennigii)(dsm322)、食空气鼠孢菌(sporomusaaerivorans)(dsm13326)、卵形鼠孢菌(sporomusaovata)(dsm2662)、森林土壤醋酸鼠孢菌(sporomusasilvacetica)(dsm10669)、球形鼠孢菌(sporomusasphaeroides)(dsm2875)、白蚁鼠孢菌(sporomusatermitida)(dsm4440)和凯伍热厌氧菌(thermoanaerobacterkivui)(dsm2030,先前称作凯伍产醋菌(acetogeniumkivui))。
更特别地,可以使用食一氧化碳梭菌(clostridiumcarboxidivorans)的atccbaa-624菌株。甚至更特别地,可以使用例如u.s.2007/0275447和u.s.2008/0057554中所述的标记为食一氧化碳梭菌(clostridiumcarboxidivorans)“p7”和“p11”的细菌菌株。
另一种特别合适的细菌可以是永达尔梭菌(clostridiumljungdahlii)。特别地,选自永达尔梭菌petc(clostridiumljungdahliipetc)、永达尔梭菌eri2(clostridiumljungdahliieri2)、永达尔梭菌col(clostridiumljungdahliicol)和永达尔梭菌o-52(clostridiumljungdahliio-52)的菌株可以用于合成气向己酸的转化。这些菌株例如在wo98/00558、wo00/68407、atcc49587、atcc55988和atcc55989中有所描述。
在一个实例中,己酸的生产来自源自合成气的乙酸和/或乙醇并且可能涉及将产乙酸细菌与能够延长碳链的微生物联用。例如,永达尔梭菌(clostridiumljungdahlii)可与克鲁维氏梭菌(clostridiumkluyveri)同时使用。在另一个实例中,单个产乙酸细胞能够同时具有这两种生物体的活性。例如,产乙酸细菌可以是食一氧化碳梭菌(c.carboxidivorans),其能够执行wood-ljungdahl途径和碳链延长途径。
在根据本发明的任何方面的步骤(a)中使用的乙醇和/或乙酸酯可以是合成气的发酵产物或者可以通过其他手段获得。然后可以在步骤(a)中使乙醇和/或乙酸酯与微生物接触。
如本文所用的术语“接触”是指使微生物与乙醇和/或乙酸酯之间直接接触。在一个实例中,乙醇是碳源并且在步骤(a)中的接触涉及使乙醇与步骤(a)的微生物接触。接触可以是直接接触或间接接触,间接接触可以包括将细胞与乙醇分开的膜等或者其中细胞和乙醇可以保持在两个不同的隔室等中。例如,在步骤(b)中,己酸和萃取介质可在不同的隔室中。
可以用本领域通常已知的用于培养细菌的任何培养基、底物、条件和方法来培养根据本发明的任何方面的能够产生己酸的微生物。这允许使用生物技术方法生产己酸。取决于用于己酸生产的微生物,适当的生长培养基、ph、温度、搅拌速率、接种物水平和/或好氧、微好氧或厌氧条件是变化的。技术人员将理解实施根据本发明的任何方面的方法必需的其他条件。特别地,容器(例如发酵罐)中的条件可以根据所用微生物而变化。适合于微生物的最佳功能的条件的变化在技术人员的知识范围内。
在一个实例中,根据本发明的任何方面的方法特别是步骤(a)可以在ph为5至8、5.5至8或5.5至7之间的含水介质中进行。压力可以在1至10巴之间。可以在约20℃至约80℃的温度范围内培养微生物。在一个实例中,可以在37℃下培养微生物。
在一些实例中,为了微生物的生长及其产生己酸,含水介质可以包含适合于微生物生长或促进己酸产生的任何营养物、成分和/或补充物。特别地,含水介质可以包含以下中的至少一种:碳源、氮源诸如铵盐、酵母萃取物或蛋白胨;矿物质;盐;辅酶因子;缓冲剂;维生素;以及任何其他可能促进细菌生长的成分和/或萃取物。所使用的培养基必须适合特定菌株的要求。在“通用细菌学方法手册(manualofmethodsforgeneralbacteriology)”中对各种微生物的培养基进行了描述。
术语“水溶液”或“介质”包括包含水、主要含水作为溶剂的任何溶液,所述溶液可以用于至少暂时地将根据本发明的任何方面的细胞保持在代谢活性和/或存活状态中,并且如果需要这样的话,则包括任何额外的底物。本领域技术人员熟悉众多水溶液的制备,所述水溶液通常称为可用于保存和/或培养细胞的培养基,例如在大肠杆菌(e.coli)的情况下为lb介质,在克鲁维氏梭菌(c.ljungdahlii)的情况下可以使用atcc1754-介质。与复杂的介质相比,使用基本介质(即仅包含使细胞保持在代谢活性和/或存活状态必不可少的盐和营养物的最基本组的具有合理的简单组成的介质)作为水溶液以避免具有不要的副产品对产品造成不必要污染是有利的。例如,m9介质可用作基本介质。将细胞与碳源一起温育足够长的时间以产生所需产物。例如持续至少1小时、2小时、4小时、5小时、10小时或20小时。选择的温度必须使得根据本发明的任何方面的细胞保持催化活性和/或代谢活性,例如,如果细胞是永达尔梭菌(c.ljungdahlii)细胞,则温度为10至42℃、优选30至40℃、特别是32至38℃。根据本发明的任何方面的含水介质还包括其中产生己酸的介质。它主要是指其中溶液基本上包含水的介质。在一个实例中,其中将细胞用于产生己酸的含水介质正是与萃取剂接触以萃取己酸的介质。
根据本发明的任何方面,优选在步骤(a)中进行发酵的同时在步骤(b)中进行萃取。这描述了在步骤(b)中原位萃取己酸和/或其酯。
在根据本发明的任何方面的步骤(b)中,含水介质中的己酸可以与萃取剂接触足以将己酸从含水介质中萃取到萃取剂中的时间。技术人员可能能够确定达到分配平衡所需的时间量以及优化萃取工艺可能需要的正确的气泡凝聚(bubbleagglomeration)。在一些实例中,所需时间可能取决于可被萃取的己酸的量。特别地,将己酸从含水介质萃取到萃取剂中所需的时间可能仅为几分钟。根据本发明的任何方面,在步骤(a)中进行发酵时在步骤(b)中进行萃取的情况下,萃取时间可以等于发酵时间。
所使用的萃取剂与要萃取的己酸的量之比可以根据萃取要进行的速度而变化。在一个实例中,萃取剂的量等于包含己酸的含水介质的量。在使萃取剂与含水介质接触的步骤之后,使用本领域已知的任何方法分离这两相(水相和有机相)。在一个实例中,可以使用分离漏斗将这两相分离。也可以使用混合沉降器、脉冲塔等将这两相分离。在一个实例中,鉴于己酸在比萃取剂明显更低的沸点下蒸馏的事实,可以使用蒸馏将萃取介质与己酸分离。技术人员可能能够根据己酸的特性选择步骤(b)中将萃取剂与所需己酸分离的最佳方法。特别地,根据本发明的任何方面的步骤(c)涉及从步骤(b)中回收己酸。使己酸与有机萃取剂接触导致形成两个相,使用本领域已知的任何方法将这两相(水相和有机相)分离。在一个实例中,可以使用分离漏斗将这两相分离。也可以使用混合沉降器、脉冲塔、热分离等将这两相分离。在一个实例中,在烷酸是己酸的情况下,鉴于己酸在比萃取介质明显更低的沸点下蒸馏的事实,可以使用蒸馏将萃取介质与己酸分离。
步骤(b)结束时,有机吸收剂再次可供再循环或再利用。
因此,根据本发明的任何方面的萃取己酸的方法可以与生产己酸的任何生物技术方法一起使用。这是特别有利的,因为通常在使用生物方法的生产己酸的发酵工艺期间,己酸在含水介质中留待收集,并且在发酵培养基中达到一定浓度后,恰是这个目标产物(即己酸)可抑制微生物的活性和生产率。因此,这限制了发酵工艺的总收率。使用这种萃取方法,在生产己酸时对其进行萃取,从而大大降低了终产物的抑制作用。
根据本发明的任何方面的方法也比去除己酸的传统方法更高效和更具成本效益,特别是在其生产时从发酵方法中去除己酸,因为不存在对蒸馏和/或沉淀的主要依赖来回收己酸。蒸馏或沉淀过程会导致较高的制造成本、较低的收率和较高的废品,因此降低了该过程的整体效率。根据本发明的任何方面的方法试图克服这些缺点。
特别地,根据本发明的任何方面的微生物和碳源的混合物可以用于任何已知的生物反应器或发酵罐中以实施本发明的任何方面。在一个实例中,根据本发明的任何方面的始于由乙酸酯和/或乙醇以生物技术生产己酸并终于己酸的萃取的完整方法在单个容器中进行。因此,在生产己酸的步骤与萃取己酸的步骤之间可以没有分离步骤。这节省时间和成本。特别地,在发酵过程期间,微生物可以在含水介质中并且在萃取剂的存在下生长。因此,根据本发明的任何方面的方法提供了生产己酸的“一锅法”。另外,由于己酸在其生产时就被萃取,因此不发生终产物抑制作用,确保了己酸的收率得以维持。可以进行进一步的分离步骤以除去己酸。可以使用本领域已知的任何分离方法,诸如使用漏斗、塔、蒸馏等。然后可以使剩余的萃取剂和/或细胞再循环。
在另一个实例中,己酸萃取过程可以作为单独的步骤和/或在另一个罐中发生。在发酵已经发生之后,在已经产生了要萃取的所需己酸的情况下,可以将根据本发明的任何方面的萃取剂添加到发酵培养基中,或者可以将发酵培养基添加到包含萃取剂的罐中。然后可以通过本领域已知的任何分离方法诸如使用漏斗、柱、蒸馏等来萃取所需己酸。然后可以将剩余的萃取剂再循环。也可以将具有细胞的发酵培养基再循环。
所述方法的另一个优点是可以将萃取剂再循环。因此,一旦将己酸与萃取剂分离,可以将萃取剂再循环并再利用,从而减少浪费。
根据本发明的任何方面的方法的步骤(c)涉及(c)在合适的反应条件下使来自(b)的所萃取的己酸和/或其酯与至少一种酮基化催化剂以及任选存在的包含1至22个碳原子的其他烷酸接触以将己酸化学酮基化为高级烷酮、优选6-十一烷酮。
术语“包含1至22个碳原子的其他烷酸”不涵盖己酸。优选地,包含1至22个碳原子的其他烷酸选自包含4至18个、优选5至12个碳原子的直链烷酸。
根据本发明的任何方面的酮基化催化剂可以是任何金属氧化物催化剂或其混合物。酮基化反应使己酸与所述另外的烷酸和/或己酸反应,优选将两个己酸分子二聚成一个酮分子并除去一个水和一个二氧化碳。至少在woo,y.,ind.eng.chem.res.2017,56:872-880中公开了其中可能形成己酸酐((ch3(ch2)4)cooco(ch2)4ch3)的己酸酮基化所涉及的机理。在wang,s.j.phys.chem.c2017,121,18030-18046中也示出了在各种金属氧化物催化剂的存在下的己酸的酮基化。
根据本发明的任何方面使用的酮基化催化剂可以是用于由根据步骤(a)以生物方式产生的己酸高效生产高能密度的酮优选c11酮的非均相催化剂。特别地,酮基化催化剂可以是任何金属氧化物催化剂或其混合物,其选自选自以下的金属氧化物催化剂或其混合物:杂多酸(h3pw12o40)催化剂、氧化铌((nb2o5)催化剂、氧化钛(tio2)催化剂、氧化铈(ceo2)催化剂、锌-铬(zn-cr)混合氧化物催化剂、氧化锰(mnox)催化剂、氧化镧(la2o3)催化剂、氧化镁(mgo)催化剂、氧化铁(feo,feo2,fe2o3,fe3o4,fe4o5,fe5o6,fe5o7)、硅-铝(siyalzo)混合氧化物催化剂、氧化铝(al2o3)催化剂和氧化锆(zro2)催化剂。mnox中的“x”可以为1、2或4。siyalzo中的“y”和“z”可以指任何数值,其中z/y之比为0至1之间的任何数值。在一个实例中,如phamt.n.,acscatal.2013,3:2456-2473中所述,使用适合的非均相加氢金属催化剂和合适的反应条件对己酸进行酮基化。所公开的条件可以根据用于高效产生高级烷酮、优选6-十一烷酮的催化剂而变化。在又一个实例中,可以基于在gliński,m.等人,polishj.chem.2004,78:299-302中公开的内容使用mno2和/或al2o3催化剂来将己酸酮基化为6-十一烷酮。在又一个实例中,如us6,265,618b1、尤其是实施例3中所公开可以使用nb2o5催化剂将己酸酮基化为6-十一烷酮。技术人员基于现有技术通过简单的试验和纠错就能够确定由己酸以及任选存在的其他烷酸生产高级烷酮、优选6-十一烷酮的合适催化剂和合适条件。orozco,l.m等人chemsuschem,2016,9(17):2430-2442和orozco,l.m等人greenchemistry,2017,19(6):1555-1569还公开了可用作根据本发明的任何方面的酮基化催化剂的其他催化剂。
确定在步骤(c)中针对使用不同酮基化催化剂的合适条件将在技术人员的知识范围内。特别是,酮基化催化剂可以是氧化锆气凝胶催化剂并且可以如woo,y.,ind.eng.chem.res.2017,56:872-880中所公开用于己酸的酮基化。氧化锆气凝胶催化剂不仅可以有效地生产高级烷酮、优选6-十一烷酮,而且还避免了催化剂的浸出。lee,y.等人在appliedcatalysisa:general.2015,506:288-293中公开了不同的酮基化催化剂及其在酮基化己酸中的有效性。技术人员可以非常容易地使用lee,y.等人描述的方法来确定合适的酮基化催化剂和/或用于己酸酮基化的条件。特别地,步骤(c)的合适反应条件包括100℃-500℃、100℃-450℃、100℃-400℃、100℃-350℃、100℃-300℃、100℃-250℃、100℃-200℃、150℃-500℃、150℃-450℃、150℃-400℃、150℃-350℃、150℃-300℃、150℃-250℃、150℃-200℃、200℃-500℃、200℃-450℃、200℃-400℃、200℃-350℃、200℃-300℃、200℃-250℃、250℃-500℃、250℃-450℃、250℃-400℃、250℃-350℃、250℃-300℃等的反应温度。更特别地,高级烷酮、特别是6-十一烷酮可以使用氧化锆气凝胶催化剂作为酮基化催化剂由己酸在150℃-250℃的反应温度下生产。
根据本发明的另一方面,提供了一种由乙醇和/或乙酸酯生产高级烷醇、优选6-十一烷醇的方法,所述方法包括:(d)使根据本发明的任何方面生产的高级烷酮、优选6-十一烷酮与至少一种氢化金属催化剂接触以将高级烷酮、优选6-十一烷酮催化氢化为高级烷醇、优选6-十一烷醇。高级烷醇(优选6-十一烷醇(c11h24o),是一种仲醇)是高级烷酮、优选6-十一碳烷酮的催化氢化的结果,在碳-氧双键上添加了氢分子以最终提供作为最终产物的高级烷醇、优选6-十一烷醇。
特别地,本发明的该方面包括:(a)使乙醇和/或乙酸酯与至少一种能够进行碳链延长的微生物接触以由乙醇和/或乙酸酯生产己酸和/或其酯;(b)在含水介质中使用至少一种萃取剂萃取来自(a)的己酸和/或其酯,其中所述萃取剂包含至少一种烷基氧化膦和至少一种包含至少12个碳原子的烷烃;或至少一种三烷基胺和至少一种包含至少12个碳原子的烷烃;(c)在合适的反应条件下使来自(b)的所萃取的己酸和/或其酯与至少一种酮基化催化剂以及任选存在的包含1至22个碳原子的其他烷酸接触以将己酸以及任选存在的其他烷酸化学酮基化为高级烷酮、优选6-十一烷酮;和(d)使高级烷酮、优选6-十一烷酮与至少一种氢化金属催化剂接触以将高级烷酮、优选6-十一烷酮催化氢化为高级烷醇、优选6-十一烷醇。
氢化金属催化剂可以是均相或非均相催化剂。均相金属催化剂可以是本领域已知的金属络合物。特别地,氢化金属催化剂可以是非均相催化剂。使用固体催化剂进行多相催化反应的一些优点包括容易分离催化剂和产物、容易回收和使催化剂再循环以及相对温和的操作条件。使用非均相催化剂也有明显的经济和环境考量。特别地,氢化金属催化剂可以选自钌(ru)催化剂、铼(re)催化剂、镍(ni)催化剂、铁(fe)催化剂、钴(co)催化剂、钯(pd)催化剂和铂(pt)催化剂。更特别地,催化剂可以选自ni催化剂、pd催化剂和pt催化剂。在一个实例中,根据本发明的任何方面使用的氢化金属催化剂可以是如alonso,f.tetrahedron,2008,64:1847-52中所公开的镍纳米颗粒。在另一个实例中,如在gorgas,n.,organometallics,2014,33(23):6905-6914中所述,铁(ii)pnp钳型络合物(pnppincercomplexes)可以用作将高级烷酮氢化为高级醇,优选将6-十一烷酮氢化为6-十一烷醇的氢化金属催化剂。在又一个实例中,如在tariqshahm.,等人,acsappliedmaterials&interfaces,2015:7(12),6480-9中所公开,钌(ru)催化剂、铼(re)催化剂、镍(ni)催化剂、铁(fe)催化剂、钴(co)催化剂、钯(pd)催化剂或铂(pt)催化剂的磁铁矿纳米颗粒可用作根据本发明的任何方面的非均相氢化金属催化剂。在又一个实例中,如在chen,j-x.,tetrahedron,2000,56:2153-2166中所公开,铜-膦络合物用作根据本发明的任何方面的均相氢化金属催化剂。在另一个实例中,如在journalofmolecularcatalysisa:chemical,2014,388-389:116-122中公开的非均相pt催化剂、特别是pt/al2o3催化剂可以用于将高级烷酮氢化为高级醇,优选将6-十一烷酮氢化为6-十一烷醇。chemsuschem,2017:10(11),2527-2533还公开了多种非均相催化剂,诸如pt/c、ru/c和pd/c,其可以与或可以不与酸催化剂一起用于将6-十一烷酮氢化为6-十一烷醇。基于上文所述,技术人员可以确定根据本发明的任何方面的待使用的合适的氢化催化剂以由高级烷酮产生高级烷醇,优选由6-十一烷酮产生6-十一烷醇。
技术人员将能够容易地确定合适的氢化金属催化剂并相应地改变条件以由6-十一烷酮的氢化高效地产生高级烷醇、优选6-十一烷醇。
根据本发明的又一方面,提供了一种由乙醇和/或乙酸酯生产烷酸、优选月桂酸的方法,所述方法包括
(e)使根据本发明的任何方面生产的高级烷醇、优选6-十一烷醇与co2和能够使高级烷醇、优选6-十一烷醇羧化为烷酸、优选月桂酸的均相羧化催化剂接触。
特别地,本发明的该方面包括:(a)使乙醇和/或乙酸酯与至少一种能够进行碳链延长的微生物接触以由乙醇和/或乙酸酯生产己酸和/或其酯;(b)在含水介质中使用至少一种萃取剂萃取来自(a)的己酸和/或其酯,其中所述萃取剂包含至少一种烷基氧化膦和至少一种包含至少12个碳原子的烷烃;或至少一种三烷基胺和至少一种包含至少12个碳原子的烷烃;(c)在合适的反应条件下使来自(b)的所萃取的己酸和/或其酯与至少一种酮基化催化剂以及任选存在的包含1至22个碳原子的其他烷酸接触以将己酸以及任选存在的其他烷酸化学酮基化为高级烷酮、优选6-十一烷酮;和(d)使高级烷酮、优选6-十一烷酮与至少一种氢化金属催化剂接触以将高级烷酮、优选6-十一烷酮催化氢化为高级烷醇、优选6-十一烷醇;以及(e)使根据本发明的任何方面生产的高级烷醇、优选6-十一烷醇与co2和能够使高级烷醇、优选6-十一烷醇羧化为烷酸、优选月桂酸的均相羧化催化剂接触。
烷酸(优选月桂酸(c12h24o2),也称为十二烷酸)可以在羧化催化剂的存在下由高级烷醇、优选6-十一烷醇生产。可能的方法至少在方案1中公开。
方案1由己酸形成6-十一烷酮、6-十一烷醇和月桂酸
羧化催化剂可以选自rh、ni、ru、co、pt、pd和fe催化剂。技术人员将能够确定与羧化催化剂结合使用以有效且高效地将根据本发明的任何方面生产的高级烷醇、优选6-十一烷醇转化为烷酸、优选月桂酸可能必需的合适条件和配体。特别地,根据本发明的任何方面的羧化催化剂可以是均相羧化催化剂。在一个实例中,根据本发明的任何方面的步骤(e)包括(ei)在大气压下使根据本发明的任何方面生产的高级烷醇、优选6-十一烷醇与至少一种镍催化剂和二氧化碳接触以将高级烷醇羧化为高级烷酸,优选将6-十一烷醇羧化为月桂酸。步骤(ei)可以包括形成的溴化物中间体。juliá-hernández,nature,2017,545:84-88进一步公开了方法的步骤(ei)的细节。
在另一个实例中,根据本发明的任何方面的步骤(e)涉及(eii)使根据本发明的任何方面生产的高级烷醇、优选6-十一烷醇与氢气、co2和均相rh催化剂接触以将高级烷醇羧化为高级烷酸,优选将6-十一烷醇羧化为月桂酸。这种催化加氢羧化的方法(方案2)在ostapowicz,t.g等人,angew.chem.int,ed.,2013,52:12119-23中进一步详细描述。
方案2:烯烃与co2的催化加氢羧化。
特别地,步骤(eii)可以在升高的温度的存在下进行。更特别地,步骤(eii)的升高的温度可以在100至300℃的范围内。例如,步骤(eii)的温度可以在100-250℃、100-200℃、150-300℃或150-250℃的范围内。此外,步骤(eii)的合适条件可以包括在0.1至200巴的范围内的co2分压,特别地,co2分压可以在0.1-150巴、0.1-100巴、0.1-60巴之间等。技术人员将能够确定合适羧化条件,该羧化条件不抑制催化剂并由高级烷醇以高收率生产高级烷酸、优选由6-十一烷醇生产月桂酸。
可以在根据本发明的任何方面的步骤(e)中使用的羧化催化剂的其他实例至少可以见述于journalofmolecularcatalysisa:chemical,2003,197:61-64;j.am.chem.soc.1985,107:3568-3572;j.am.chem.soc.1985,107:3565-3567和journalofmolecularcatalysts,1987,40:71-82。
在一个实例中,步骤(c)的氢化金属催化剂还能够进行根据本发明的任何方面的步骤(e)的羧化。因此,单一催化剂可导致由高级烷酮直接形成烷酸、优选由6-十一烷酮直接形成月桂酸。特别地,可用于将高级烷酮转化为烷酸、优选将6-十一烷酮转化为月桂酸(即步骤(d)和(e))的催化剂可以是均相金属催化剂。更特别地,可用于进行步骤(d)和(e)的均相催化剂可以是均相rh催化剂。均相rh催化剂的可能的实例和使用的合适条件至少见述于organicletters,2008,10(20):4697-4700;organometallics,2008,27(21):5494-5503;europeanjournaloforganicchemistry,2002,10:1685-1689;europeanjournalofinorganicchemistry,2001,1:289-296和angewandtechemie,internationaledition,1998,37(8):1100-1103。
具体实施方式
实施例
上文描述了优选的实施方案,如本领域技术人员将理解的,在不偏离权利要求的范围的情况下,可以对设计、构造或操作进行改变或修改。例如,这些变化旨在涵盖在权利要求的范围内。
实施例1
使用克鲁维氏梭菌(clostridiumkluyveri)由乙酸酯和乙醇形成己酸
为了将乙醇和乙酸酯生物转化为己酸,使用了克鲁维氏梭菌(clostridiumkluyveri)。所有培养步骤均在厌氧条件下在耐压玻璃瓶中进行,该玻璃瓶可用丁基橡胶塞气密密封。
对于预培养,将5ml克鲁维氏梭菌(clostridiumkluyveri)的冷冻低温培养物接种在250ml瓶中的100mldmsz52培养基(ph=7.0;10g/l乙酸钾,0.31g/lk2hpo4,0.23g/lkh2po4,0.25g/lnh4cl,0.20g/lmgso4x7h2o,1g/l酵母提取物,0.50mg/l刃天青,10μl/lhcl(25%,7.7m),1.5mg/lfecl2x4h2o,70μg/lzncl2x7h2o,100μg/lmncl2x4h2o,6μg/lh3bo3,190μg/lcocl2x6h2o,2μg/lcucl2x6h2o,24μg/lnicl2x6h2o,36μg/lna2mo4x2h2o,0.5mg/lnaoh,3μg/lna2seo3x5h2o,4μg/lna2wo4x2h2o,100μg/l维生素b12,80μg/l对氨基苯甲酸,20μg/ld(+)生物素,200μg/l烟酸,100μg/ld-泛酸钙,300μg/l盐酸吡哆醇,200μg/l盐酸硫胺素x2h2o,20ml/l乙醇,2.5g/lnahco3,0.25g/l半胱氨酸-hclxh2o,0.25g/lna2sx9h2o)中并在37℃下温育144小时至od600nm>0.2。
对于主培养,将来自预培养的经离心的细胞接种在500ml瓶中的200ml新鲜的dmsz52培养基中至od600nm为0.1。将该生长的培养物在37℃下温育27小时至od600nm>0.6。然后将细胞悬浮液离心,用生产用缓冲液(ph6.0;0.832g/l乙酸钾,5.0g/l乙醇)洗涤并再次离心。
对于生产培养,将来自主培养的经洗涤的细胞接种在500ml瓶中的200ml生产用缓冲液中至od600nm为0.2。用丁基橡胶塞盖住培养物并在37℃和100rpm的开放式水浴振荡器中温育71小时。在培养期的开始和结束时取样。测试这些样品的光密度、ph和不同的分析物(通过nmr测试)。
结果表明,在生产阶段,乙酸酯的量从0.54g/l降低至0.03g/l且乙醇的量从5.6g/l降低至4.9g/l。另外,丁酸的浓度从0.05g/l增加至0.28g/l且己酸的浓度从0.03g/l增加至0.79g/l。
实施例2
使用克鲁维氏梭菌(clostridiumkluyveri)由丁酸和乙醇形成己酸
为了将乙醇和丁酸生物转化为己酸,使用了细菌克鲁维氏梭菌(clostridiumkluyveri)。所有培养步骤均在厌氧条件下在耐压玻璃瓶中进行,该玻璃瓶可用丁基橡胶塞气密密封。
对于预培养,将5ml克鲁维氏梭菌(clostridiumkluyveri)的冷冻低温培养物接种在250ml瓶中的100mldmsz52培养基(ph=7.0;10g/l乙酸钾,0.31g/lk2hpo4,0.23g/lkh2po4,0.25g/lnh4cl,0.20g/lmgso4x7h2o,1g/l酵母提取物,0.50mg/l刃天青,10μl/lhcl(25%,7.7m),1.5mg/lfecl2x4h2o,70μg/lzncl2x7h2o,100μg/lmncl2x4h2o,6μg/lh3bo3,190μg/lcocl2x6h2o,2μg/lcucl2x6h2o,24μg/lnicl2x6h2o,36μg/lna2mo4x2h2o,0.5mg/lnaoh,3μg/lna2seo3x5h2o,4μg/lna2wo4x2h2o,100μg/l维生素b12,80μg/l对氨基苯甲酸,20μg/ld(+)生物素,200μg/l烟酸,100μg/ld-泛酸钙,300μg/l盐酸吡哆醇,200μg/l盐酸硫胺素x2h2o,20ml/l乙醇,2.5g/lnahco3,0.25g/l半胱氨酸-hclxh2o,0.25g/lna2sx9h2o)中并在37℃下温育144小时至od600nm>0.3。
对于主培养,将来自预培养的经离心的细胞接种在500ml瓶中的200ml新鲜的dmsz52培养基中至od600nm为0.1。将该生长的培养物在37℃下温育25小时至od600nm>0.4。然后将细胞悬浮液离心,用生产用缓冲液(ph6.16;4.16g/l乙酸钾,10.0g/l乙醇)洗涤并再次离心。
对于多次生产培养,将来自主培养的经洗涤的细胞接种在500ml瓶中的200ml生产用缓冲液中至od600nm为0.2。在第一次培养中,开始时将1.0g/l丁酸添加到生产用缓冲液中,在第二次培养中,不向生产用缓冲液中添加丁酸。用丁基橡胶塞盖住培养物并在37℃和100rpm下在开放式水浴振荡器中温育71小时。在培养期的开始和结束时取样。测试这些样品的光密度、ph和不同的分析物(通过nmr测试)。
结果表明,在丁酸补充培养的生产阶段,乙酸酯的量从3.1g/l降低至1.1g/l且乙醇的量从10.6g/l降低至7.5g/l。并且,丁酸的浓度从1.2g/l增加至2.2g/l且己酸的浓度从0.04g/l增加至2.30g/l。
在未补充培养的生产阶段,乙酸酯的量从3.0g/l降低至1.3g/l且乙醇的量从10.2g/l降低至8.2g/l。并且,丁酸的浓度从0.1g/l增加至1.7g/l且己酸的浓度从0.01g/l增加至1.40g/l。
实施例3
在癸烷和topo存在下培养克鲁维氏梭菌(clostridiumkluyveri)
培养细菌克鲁维氏梭菌(clostridiumkluyveri)细菌以将乙醇和乙酸酯生物转化为己酸。为了原位萃取所产生的己酸,将癸烷与三辛基氧化膦(topo)的混合物加入培养物中。所有培养步骤均在厌氧条件下在耐压玻璃瓶中进行,该玻璃瓶可用丁基橡胶塞气密密封。
对于预培养,将10ml活克鲁维氏梭菌(clostridiumkluyveri)培养物接种在250mlveri01培养基(ph7.0;10g/l乙酸钾,0.31g/lk2hpo4,0.23g/lkh2po4,0.25g/lnh4cl,0.20g/lmgso4x7h2o,10μl/lhcl(7.7m),1.5mg/lfecl2x4h2o,36μg/lzncl2,64μg/lmncl2x4h2o,6μg/lh3bo3,190μg/lcocl2x6h2o,1.2μg/lcucl2x6h2o,24μg/lnicl2x6h2o,36μg/lna2mo4x2h2o,0.5mg/lnaoh,3μg/lna2seo3x5h2o,4μg/lna2wo4x2h2o,100μg/l维生素b12,80μg/l对氨基苯甲酸,20μg/ld(+)生物素,200μg/l烟酸,100μg/ld-泛酸钙,300μg/l盐酸吡哆醇,200μg/l盐酸硫胺素x2h2o,20ml/l乙醇,2.5g/lnahco3,65mg/l甘氨酸,24mg/l组氨酸,64.6mg/l异亮氨酸93.8mg/l亮氨酸,103mg/l赖氨酸,60.4mg/l精氨酸,21.64mg/ll-半胱氨酸-hcl,21mg/l蛋氨酸,52mg/l脯氨酸,56.8mg/l丝氨酸,59mg/l苏氨酸,75.8mg/l缬氨酸)中至起始od600nm为0.1。
在37℃、150rpm、1l/h的通风速度、100%co2下在开放式水浴振荡器中于1000ml耐压玻璃瓶中培养671小时。将气体排放到反应器的顶空。通过自动添加100g/lnaoh溶液将ph保持在6.2。将新鲜培养基以2.0d-1的稀释速率连续进料到反应器并通过孔径为0.2μm的
对于主培养,将来自预培养的经离心的细胞接种在250ml瓶中的100ml新鲜veri01培养基中至od600nm为0.1。加入另外的1ml的6%(w/w)topo在癸烷中的混合物。用丁基橡胶塞盖住培养物并在开放式水浴振荡器中于37℃和150rpm、100%co2气氛下温育43小时。
在培养期间,采集若干个5ml样品以确定od600nm、ph和产物形成。产物浓度的测定通过半定量1h-nmr光谱法进行。使用三甲基甲硅烷基丙酸钠(t(m)sp)作为定量内标物。
在主培养期间,丁酸酯的浓度从0.14g/l增加至2.12g/l且己酸酯的浓度从0.22g/l增加至0.91g/l,而乙醇的浓度从15.04g/l降低至11.98g/l,乙酸酯的浓度从6.01g/l降低至4.23g/l。
在此期间,od600nm从0.111减小至0.076。
实施例4
在十四烷和topo存在下培养克鲁维氏梭菌(clostridiumkluyveri)
培养克鲁维氏梭菌(clostridiumkluyveri)细菌以将乙醇和乙酸酯生物转化为己酸。为了将产生的己酸原位萃取,将十四烷与三辛基氧化膦(topo)的混合物加入培养物中。所有培养步骤均在厌氧条件下在耐压玻璃瓶中进行,该玻璃瓶可用丁基橡胶塞气密密封。
克鲁维氏梭菌(clostridiumkluyveri)的预培养在37℃、150rpm、1l/h的通风速度、25%co2+75%n2的混合物下在开放式水浴振荡器中在1000ml耐压玻璃瓶中于250mlevodm24培养基(ph5.5;0.429g/l乙酸镁,0.164g/l乙酸钠,0.016g/l乙酸钙,2.454g/l乙酸钾,0.107ml/lh3po4(8.5%),0.7g/l乙酸铵,0.35mg/l乙酸钴,1.245mg/l乙酸镍,20μg/ld-生物素,20μg/l叶酸,10μg/l盐酸吡哆醇,50μg/l盐酸硫胺素,50μg/l核黄素,50μg/l烟酸,50μg/l泛酸钙,50μg/l维生素b12,50μg/l对氨基苯甲酸酯,50μg/l硫辛酸,0.702mg/l(nh4)2fe(so4)2x4h2o,1ml/lks-乙酸盐(ks-acetate)(93,5mm),20ml/l乙醇,0.37g/l乙酸)中进行。将气体排放到反应器的顶空。通过自动添加2.5mnh3溶液将ph保持在5.5。将新鲜培养基以2.0d-1的稀释速率连续进料到反应器中并通过孔径为0.2μm的
对于主培养,将来自预培养的经离心的细胞接种在250ml瓶中的100mlveri01培养基(ph6.5;10g/l乙酸钾,0.31g/lk2hpo4,0.23g/lkh2po4,0.25g/lnh4cl,0.20g/lmgso4x7h2o,10μl/lhcl(7.7m),1.5mg/lfecl2x4h2o,36μg/lzncl2,64μg/lmncl2x4h2o,6μg/lh3bo3,190μg/lcocl2x6h2o,1.2μg/lcucl2x6h2o,24μg/lnicl2x6h2o,36μg/lna2mo4x2h2o,0.5mg/lnaoh,3μg/lna2seo3x5h2o,4μg/lna2wo4x2h2o,100μg/l维生素b12,80μg/l对氨基苯甲酸,20μg/ld(+)生物素,200μg/l烟酸,100μg/ld-泛酸钙,300μg/l盐酸吡哆醇,200μg/l盐酸硫胺素x2h2o,20ml/l乙醇,2.5g/lnahco3,65mg/l甘氨酸,24mg/l组氨酸,64.6mg/l异亮氨酸93.8mg/l亮氨酸,103mg/l赖氨酸,60.4mg/l精氨酸,21.64mg/ll-半胱氨酸-hcl,21mg/l蛋氨酸,52mg/l脯氨酸,56.8mg/l丝氨酸,59mg/l苏氨酸,75.8mg/l缬氨酸,2.5mg/lhcl25%)中至od600nm为0.1。加入另外的1ml的6%(w/w)topo在十四烷中的混合物。用丁基橡胶塞盖住培养物并在开放式水浴振荡器中于37℃和150rpm、100%co2气氛下温育47小时。
在培养期间,采集若干个5ml样品以确定od600nm、ph和产物形成。产物浓度的测定通过半定量1h-nmr光谱法进行。使用三甲基甲硅烷基丙酸钠(t(m)sp)作为定量内标物。
在主培养期间,丁酸酯的浓度从0.05g/l增加至3.78g/l且己酸酯的浓度从0.09g/l增加至4.93g/l,而乙醇的浓度从15.52g/l降低至9.36g/l,乙酸酯的浓度从6.36g/l降低至2.49g/l。
在此期间,od600nm从0.095增加至0.685。
实施例5
在十六烷和topo存在下培养克鲁维氏梭菌(clostridiumkluyveri)
培养克鲁维氏梭菌(clostridiumkluyveri)细菌以将乙醇和乙酸酯生物转化为己酸。为了将产生的己酸原位萃取,将十六烷与三辛基氧化膦(topo)的混合物加入培养物中。所有培养步骤均在厌氧条件下在耐压玻璃瓶中进行,该玻璃瓶可用丁基橡胶塞气密密封。
对于预培养,将10ml活克鲁维氏梭菌(clostridiumkluyveri)培养物接种在250mlveri01培养基(ph7.0;10g/l乙酸钾,0.31g/lk2hpo4,0.23g/lkh2po4,0.25g/lnh4cl,0.20g/lmgso4x7h2o,10μl/lhcl(7.7m),1.5mg/lfecl2x4h2o,36μg/lzncl2,64μg/lmncl2x4h2o,6μg/lh3bo3,190μg/lcocl2x6h2o,1.2μg/lcucl2x6h2o,24μg/lnicl2x6h2o,36μg/lna2mo4x2h2o,0.5mg/lnaoh,3μg/lna2seo3x5h2o,4μg/lna2wo4x2h2o,100μg/l维生素b12,80μg/l对氨基苯甲酸,20μg/ld(+)生物素,200μg/l烟酸,100μg/ld-泛酸钙,300μg/l盐酸吡哆醇,200μg/l盐酸硫胺素x2h2o,20ml/l乙醇,2.5g/lnahco3,65mg/l甘氨酸,24mg/l组氨酸,64.6mg/l异亮氨酸93.8mg/l亮氨酸,103mg/l赖氨酸,60.4mg/l精氨酸,21.64mg/ll-半胱氨酸-hcl,21mg/l蛋氨酸,52mg/l脯氨酸,56.8mg/l丝氨酸,59mg/l苏氨酸,75.8mg/l缬氨酸)中至起始od600nm为0.1。
在37℃、150rpm、1l/h的通风速度、100%co2下在开放式水浴振荡器中于1000ml耐压玻璃瓶中培养671小时。将气体排放到反应器的顶空。通过自动添加100g/lnaoh溶液将ph保持在6.2。将新鲜培养基以2.0d-1的稀释速率连续进料到反应器并通过孔径为0.2μm的
对于主培养,将来自预培养的经离心的细胞接种在250ml瓶中的100ml新鲜veri01培养基中至od600nm为0.1。加入另外的1ml的6%(w/w)topo在十六烷中的混合物。用丁基橡胶塞盖住培养物并在开放式水浴振荡器中于37℃和150rpm、100%co2气氛下温育43小时。
在培养期间,采集若干个5ml样品以确定od600nm、ph和产物形成。产物浓度的测定通过半定量1h-nmr光谱法进行。使用三甲基甲硅烷基丙酸钠(t(m)sp)作为定量内标物。
在主培养期间,丁酸酯的浓度从0.14g/l增加至2.86g/l且己酸酯的浓度从0.20g/l增加至2.37g/l,而乙醇的浓度从14.59g/l降低至10.24g/l,乙酸酯的浓度从5.87g/l降低至3.32g/l。
在此期间,od600nm从0.091增加至0.256。
实施例6
在十七烷和topo存在下培养克鲁维氏梭菌(clostridiumkluyveri)
培养克鲁维氏梭菌(clostridiumkluyveri)细菌以将乙醇和乙酸酯生物转化为己酸。为了将产生的己酸原位萃取,将十七烷与三辛基氧化膦(topo)的混合物加入培养物中。所有培养步骤均在厌氧条件下在耐压玻璃瓶中进行,该玻璃瓶可用丁基橡胶塞气密密封。
对于预培养,将10ml活克鲁维氏梭菌(clostridiumkluyveri)培养物接种在250mlveri01培养基(ph7.0;10g/l乙酸钾,0.31g/lk2hpo4,0.23g/lkh2po4,0.25g/lnh4cl,0.20g/lmgso4x7h2o,10μl/lhcl(7.7m),1.5mg/lfecl2x4h2o,36μg/lzncl2,64μg/lmncl2x4h2o,6μg/lh3bo3,190μg/lcocl2x6h2o,1.2μg/lcucl2x6h2o,24μg/lnicl2x6h2o,36μg/lna2mo4x2h2o,0.5mg/lnaoh,3μg/lna2seo3x5h2o,4μg/lna2wo4x2h2o,100μg/l维生素b12,80μg/l对氨基苯甲酸,20μg/ld(+)生物素,200μg/l烟酸,100μg/ld-泛酸钙,300μg/l盐酸吡哆醇,200μg/l盐酸硫胺素x2h2o,20ml/l乙醇,2.5g/lnahco3,65mg/l甘氨酸,24mg/l组氨酸,64.6mg/l异亮氨酸93.8mg/l亮氨酸,103mg/l赖氨酸,60.4mg/l精氨酸,21.64mg/ll-半胱氨酸-hcl,21mg/l蛋氨酸,52mg/l脯氨酸,56.8mg/l丝氨酸,59mg/l苏氨酸,75.8mg/l缬氨酸)中至起始od600nm为0.1。
在37℃、150rpm、1l/h的通风速度、100%co2下在开放式水浴振荡器中于1000ml耐压玻璃瓶中培养671小时。将气体排放到反应器的顶空。通过自动添加100g/lnaoh溶液将ph保持在6.2。将新鲜培养基以2.0d-1的稀释速率连续进料到反应器并通过孔径为0.2μm的
对于主培养,将来自预培养的经离心的细胞接种在250ml瓶中的100ml新鲜veri01培养基中至od600nm为0.1。加入另外的1ml的6%(w/w)topo在十七烷中的混合物。用丁基橡胶塞盖住培养物并在开放式水浴振荡器中于37℃和150rpm、100%co2气氛下温育43小时。
在培养期间,采集若干个5ml样品以确定od600nm、ph和产物形成。产物浓度的测定通过半定量1h-nmr光谱法进行。使用三甲基甲硅烷基丙酸钠(t(m)sp)作为定量内标物。
在主培养期间,丁酸酯的浓度从0.15g/l增加至2.82g/l且己酸酯的浓度从0.19g/l增加至2.85g/l,而乙醇的浓度从14.34g/l降低至9.58g/l,乙酸酯的浓度从5.88g/l降低至3.20g/l。
在此期间,od600nm从0.083增加至0.363。
实施例7
在十二烷和topo存在下培养克鲁维氏梭菌(clostridiumkluyveri)
培养克鲁维氏梭菌(clostridiumkluyveri)细菌以将乙醇和乙酸酯生物转化为己酸。为了将产生的己酸原位萃取,将十二烷与三辛基氧化膦(topo)的混合物加入培养物中。所有培养步骤均在厌氧条件下在耐压玻璃瓶中进行,该玻璃瓶可用丁基橡胶塞气密密封。
对于预培养,将10ml活克鲁维氏梭菌(clostridiumkluyveri)培养物接种在250mlveri01培养基(ph7.0;10g/l乙酸钾,0.31g/lk2hpo4,0.23g/lkh2po4,0.25g/lnh4cl,0.20g/lmgso4x7h2o,10μl/lhcl(7.7m),1.5mg/lfecl2x4h2o,36μg/lzncl2,64μg/lmncl2x4h2o,6μg/lh3bo3,190μg/lcocl2x6h2o,1.2μg/lcucl2x6h2o,24μg/lnicl2x6h2o,36μg/lna2mo4x2h2o,0.5mg/lnaoh,3μg/lna2seo3x5h2o,4μg/lna2wo4x2h2o,100μg/l维生素b12,80μg/l对氨基苯甲酸,20μg/ld(+)生物素,200μg/l烟酸,100μg/ld-泛酸钙,300μg/l盐酸吡哆醇,200μg/l盐酸硫胺素x2h2o,20ml/l乙醇,2.5g/lnahco3,65mg/l甘氨酸,24mg/l组氨酸,64.6mg/l异亮氨酸93.8mg/l亮氨酸,103mg/l赖氨酸,60.4mg/l精氨酸,21.64mg/ll-半胱氨酸-hcl,21mg/l蛋氨酸,52mg/l脯氨酸,56.8mg/l丝氨酸,59mg/l苏氨酸,75.8mg/l缬氨酸)中至起始od600nm为0.1。
在37℃、150rpm、1l/h的通风速度、100%co2下在开放式水浴振荡器中于1000ml耐压玻璃瓶中培养671小时。将气体排放到反应器的顶空。通过自动添加100g/lnaoh溶液将ph保持在6.2。将新鲜培养基以2.0d-1的稀释速率连续进料到反应器并通过孔径为0.2μm的
对于主培养,将来自预培养的经离心的细胞接种在250ml瓶中的100ml新鲜veri01培养基中至od600nm为0.1。加入另外的1ml的6%(w/w)topo在十二烷中的混合物。用丁基橡胶塞盖住培养物并在开放式水浴振荡器中于37℃和150rpm、100%co2气氛下温育43小时。
在培养期间,采集若干个5ml样品以确定od600nm、ph和产物形成。产物浓度的测定通过半定量1h-nmr光谱法进行。使用三甲基甲硅烷基丙酸钠(t(m)sp)作为定量内标物。
在主培养期间,丁酸酯的浓度从0.14g/l增加至2.62g/l且己酸酯的浓度从0.22g/l增加至2.05g/l,而乙醇的浓度从14.62g/l降低至10.64g/l,乙酸酯的浓度从5.92g/l降低至3.54g/l。
在此期间,od600nm从0.091增加至0.259。
实施例8
测定己酸在水与十六烷和topo的混合物之间的分配系数
在实验的所有阶段期间,从两相中取样以通过高效液相色谱(hplc)测定ph和己酸浓度。将100g己酸水溶液(5g/kg)和33g6%的三辛基氧化膦(topo)在十六烷中的混合物填充到分液漏斗中并在37℃下混合1分钟。然后将漏斗置于三脚架环中并使乳液静置以自发分离。测量水相的ph。然后将1mnaoh溶液添加到漏斗中并混合。重复分离和采样步骤,直到水相中的ph达到6.2。此时从两个相取样以用于后续分析。可以通过hplc直接分析水相。为了分析有机相,首先将稀释的己酸重新萃取至水中(通过添加1mnaoh实现ph为12.0)并然后通过hplc分析。由己酸在两相中的浓度计算己酸在水和6%topo/十六烷的系统中的分配系数kd
在ph6.2下己酸在水和6%topo/十六烷的系统中的分配系数kd为4.7。
实施例9
测定己酸在水与十七烷和topo的混合物之间的分配系数
在实验的所有阶段期间,从两相中取样以通过高效液相色谱(hplc)测定ph和己酸浓度。将100g己酸水溶液(5g/kg)和33g6%的三辛基氧化膦(topo)在十七烷中的混合物填充到分液漏斗中并在37℃下混合1分钟。然后将漏斗置于三脚架环中并使乳液静置以自发分离。测量水相的ph。将1mnaoh溶液添加到漏斗中并混合。重复分离和采样步骤,直到水相中的ph达到6.2。此时从两个相取样以用于后续分析。可以通过hplc直接分析水相。为了分析有机相,首先将稀释的己酸重新萃取至水中(通过添加1mnaoh实现ph为12.0)并然后通过hplc分析。由两相中己酸的浓度计算己酸在水和6%topo/十七烷的系统中的分配系数kd。
在ph6.2下己酸在水和6%topo/十七烷的系统中的分配系数kd为5.0。
实施例10
测定己酸在水与十四烷和topo的混合物之间的分配系数
在实验的所有阶段期间,从两相中取样以通过高效液相色谱(hplc)测定ph和己酸浓度。将130g的己酸(5g/kg)加上乙酸(0.5g/kg)的水溶液和15g6%的三辛基氧化膦(topo)在十四烷中的混合物填充到分液漏斗中并在37℃下混合1分钟。然后将漏斗置于三脚架环中并使乳液静置以自发分离。测量水相的ph。将1mnaoh溶液添加到漏斗中并混合。重复分离和采样步骤,直到水相中的ph达到6.2。此时从两个相取样以用于后续分析。可以通过hplc直接分析水相。为了分析有机相,首先将稀释的己酸重新萃取至水中(通过添加1mnaoh实现ph为12.0)并然后通过hplc分析。由两相中己酸的浓度计算己酸在水和6%topo/十四烷的系统中的分配系数kd。
在ph6.9下己酸在水和6%topo/十四烷的系统中的分配系数kd为1.3。
实施例11
培养克鲁维氏梭菌(clostridiumkluyveri)原位萃取己酸
培养克鲁维氏梭菌(clostridiumkluyveri)细菌以将乙醇和乙酸酯生物转化为己酸。为了将产生的己酸原位萃取,使十四烷与三辛基氧化膦(topo)的混合物连续通过培养物。所有培养步骤均在厌氧条件下在耐压玻璃瓶中进行,该玻璃瓶可用丁基橡胶塞气密密封。
克鲁维氏梭菌(clostridiumkluyveri)的预培养在37℃、150rpm、1l/h的通风速度、25%co2+75%n2的混合物下在开放式水浴振荡器中在1000ml耐压玻璃瓶中于250mlevodm45培养基(ph5.5;0.004g/l乙酸镁,0.164g/l乙酸钠,0.016g/l乙酸钙,0.25g/l乙酸钾,0.107ml/lh3po4(8.5%),2.92g/l乙酸铵,0.35mg/l乙酸钴,1.245mg/l乙酸镍,20μg/ld-生物素,20μg/l叶酸,10μg/l盐酸吡哆醇(pyridoxine-hcl),50μg/l盐酸硫胺素,50μg/l核黄素,50μg/l烟酸,50μg/l泛酸钙,50μg/l维生素b12,50μg/l对氨基苯甲酸酯,50μg/l硫辛酸,0.702mg/l(nh4)2fe(so4)2x4h2o,1ml/lks-乙酸盐(ks-acetate)(93,5mm),20ml/l乙醇,0.37g/l乙酸)中进行。将气体排放到反应器的顶空。通过自动添加2.5mnh3溶液将ph保持在5.5。将新鲜培养基以2.0d-1的稀释速率连续进料到反应器中并通过孔径为0.2μm的
对于主培养,将来自预培养的100ml细胞肉汤接种在1000ml瓶中的150mlevodm39培养基(ph5.8;0.429g/l乙酸镁,0.164g/l乙酸钠,0.016g/l乙酸钙,2.454g/l乙酸钾,0.107ml/lh3po4(8.5%),1.01ml/l乙酸,0.35mg/l乙酸钴,1.245mg/l乙酸镍,20μg/ld-生物素,20μg/l叶酸,10μg/l盐酸吡哆醇,50μg/l盐酸硫胺素,50μg/l核黄素,50μg/l烟酸,50μg/l泛酸钙,50μg/l维生素b12,50μg/l对氨基苯甲酸酯,50μg/l硫辛酸,0.702mg/l(nh4)2fe(so4)2x4h2o,1ml/lks-乙酸盐(ks-acetate)(93,5mm),20ml/l乙醇,8.8mlnh3溶液(2,5mol/l),27.75ml/l乙酸(144g/l))中至od600nm为0.71。
培养在37℃、150rpm、1l/h的通风速度、25%co2和75%n2的混合物下在敞开式水浴振荡器中进行65小时。将气体排放到反应器的顶空。通过自动添加2.5mnh3溶液将ph保持在5.8。将新鲜培养基以0.5d-1的稀释速率连续进料到反应器中并通过保持od600nm为约0.5来从反应器连续除去发酵肉汤。向发酵肉汤中添加另外的120g6%(w/w)topo在十四烷中的混合物。然后将该有机混合物连续进料到反应器中并且还以1d-1的稀释速率连续地从反应器中除去有机相。
在培养期间,从水相和有机相二者采集若干个5ml样品以确定od600nm、ph和产物形成。产物浓度的测定通过半定量1h-nmr光谱法进行。使用三甲基甲硅烷基丙酸钠(t(m)sp)作为定量内标物。
在主培养期间,在水相中实现了8.18g/l乙醇、3.20g/l乙酸酯、1.81g/l丁酸酯和0.81g/l己酸酯的稳态浓度。od600nm保持稳定在0.5。在有机相中实现了0.43g/kg乙醇、0.08g/kg乙酸酯、1.13g/kg丁酸酯和8.09g/kg己酸酯的稳态浓度。在实验之后,细胞被转移以进行进一步培养时仍保持存活。
由两相中的浓度计算底物和产物在含水介质和6%topo/十四烷的系统中的分配系数kd
在稳态下乙醇的kd为0.05,乙酸的kd为0.03,丁酸的kd为0.62,己酸的kd为9.99。
实施例12
己酸的酮基化
酮基化在加热的连续流化床反应器中进行。首先,将载在二氧化硅上的氧化镁(50重量%,14.00g)装入反应器中并在氩气流(54ml/min)下在330℃下加热1小时。将温度升至360℃。然后将十六烷酸在十四烷中的混合物(v/v:3/1)以3.3ml/h的速率连续地进料到反应器中。气态流出料流由两个冷阱收集,该冷阱用水以及干冰和异丙醇的混合物冷却。称重收集的级分并通过气相色谱法(gc)分析其组成。总共将370.65g己酸进料到反应器中,这等于最大理论产量为271.70g6-十一烷酮和作为副产物的28.75g水和70.21g二氧化碳。获得的6-十一烷酮的量为267.67g,水的量为28.32g。这对应于在完全转化下99%的质量回收率。通过常规gc测量证实了高生产率和高选择性,因为仅检测到痕量的己酸而未检测到副产物。
实施例13
己酸与棕榈酸的交叉酮基化。
交叉酮基化的技术程序与己酸单独酮基化(实施例12)相同,不同之处在于底物进料的组成。进料由作为底物的己酸(116.16g,1.00mol)和棕榈酸(256.43g,1.00mol)和作为内标的十四烷(124.20g)组成。以3.3ml/h的速率添加底物进料并在360℃的温度下反应。两种烷酸的存在导致以下三种酮的产物混合物:6-十一烷酮、6-二十一烷酮和16-三十一烷酮。在完全转化时,获得的量为42.58g6-十一烷酮、155.29g6-二十一烷酮和112.71g16-三十一烷酮。
实施例14
己酸与乙酸的交叉酮基化。
交叉酮基化的技术程序与己酸单独酮基化(实施例12)相同,不同之处在于底物进料的组成。进料由作为底物的己酸(232.32g,2.00mol)和乙酸(120.10g,2.00mol)和作为内标的十四烷(117.47g)组成。以3.3ml/h的速率添加底物进料并在360℃的温度下反应。两种烷酸的存在导致以下三种酮的产物混合物:2-丙酮、2-庚酮和6-十一烷酮。在完全转化时,获得的量为29.04g2-丙酮、114.19g2-庚酮和85.15g6-十一烷酮。
- 还没有人留言评论。精彩留言会获得点赞!