用于从发酵液纯化bio-1,3-丁二醇的方法与流程
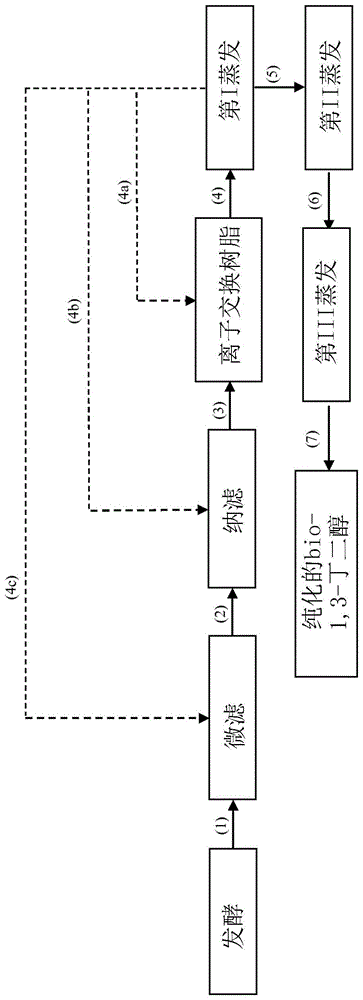
描述本发明涉及用于从发酵液纯化bio-1,3-丁二醇的方法。更具体地,本发明涉及用于从发酵液纯化bio-1,3-丁二醇的方法,包括以下步骤:(a)对发酵液进行分离;(b)对步骤(a)中获得的产物进行离子交换树脂处理;(c)对步骤(b)中获得的产物进行第一蒸发;(d)对步骤(c)中获得的产物进行第二蒸发;(e)对步骤(d)中获得的产物进行第三蒸发,获得纯化的bio-1,3-丁二醇。所述纯化的bio-1,3-丁二醇可以有利地用于生产bio-1,3-丁二烯,而bio-1,3-丁二烯又可以有利地用作生产弹性体和(共)聚合物的单体或中间体。因此,本发明的另一主题是用于由如上所述获得的纯化的bio-1,3-丁二醇生产bio-1,3-丁二烯的方法,以及所述bio-1,3-丁二烯作为生产弹性体和(共)聚合物的单体或中间体的用途。还应注意,从所述用于生产bio-1,3-丁二烯的方法,特别是从bio-1,3-丁二醇的脱水,获得了其它烯醇,即bio-2-丁烯-1-醇(巴豆醇)、bio-3-丁烯-2-醇(甲基乙烯基甲醇)、bio-3-丁烯-1-醇(烯丙基甲醇),更特别是bio-2-丁烯-1-醇(巴豆醇)和bio-3-丁烯-2-醇(甲基乙烯基甲醇),其除了生产bio-1,3-丁二烯外,还可以有利地用于生产可继而用于精细化学、农业化学、药物化学或石油化学的中间体。为了本说明书和所附权利要求的目的,术语bio-2-丁烯-1-醇(巴豆醇)是指:顺式和反式异构体的混合物,指单独顺式异构体,还指单独反式异构体。例如,bio-2-丁烯-1-醇(巴豆醇)可以用作卤化物、巴豆基酯或巴豆基醚的前体,所述卤化物、巴豆基酯或巴豆基醚又可以用作例如生产精细化学(例如,用于生产山梨酸、三甲基氢醌、巴豆酸、3-甲氧基丁醇)、农业化学、药物化学中的单体的中间体。bio-3-丁烯-2-醇(甲基乙烯基甲醇)可以在精细化学中用作溶剂,用作聚合物如聚烯烃的修饰的组分(例如,德国专利de1,908,620中所述)。bio-3-丁烯-1-醇(烯丙基甲醇)可以用作例如药物化学、农业化学、香水、树脂中的原料。例如,从钯催化的bio-3-丁烯-1-醇(烯丙基甲醇)与芳基卤化物的偶合反应,获得了芳基取代的醛,其可以用在药物化学中,例如作为抗叶酸剂。多元醇的纯化方法是本领域已知的。例如,美国专利us6,361,983涉及用于从发酵液分离一种或多种多元醇,特别是1,3-丙二醇(1,3-pdo)的方法,包括以下步骤:(a)向发酵液添加碱以将ph提高至大于7;和(b)从发酵液分离多元醇,特别是1,3-丙二醇。特别关注的多元醇是1,3-丙二醇、1,4-丁二醇、甘油、乙二醇。分离步骤(b)通过蒸发、蒸馏、过滤、萃取或结晶进行。所述方法还可以包括步骤(c),通过(1)过滤或离心或2)在真空下蒸馏去除存在于步骤(b)获得的产物中的沉淀的固体。在所述专利中,没有具体提及1,3-丁二醇。美国专利us7,919,658涉及用于从发酵液纯化bio-1,3-丙二醇的方法,所述发酵液获自能够产生1,3-丙二醇的微生物,包括按顺序的以下步骤:(a)对发酵液进行过滤;(b)对步骤(a)中获得的产物进行两个通过离子交换的纯化步骤,包括:(i)阴离子交换和(ii)阳离子交换,以去除离子杂质;(c)对步骤(ii)中获得的产物进行化学还原;和(d)对步骤(c)中获得的产物进行包括至少两个蒸馏柱的至少两个蒸馏过程,其中所述蒸馏柱之一去除沸点高于1,3-丙二醇的沸点的分子,并且另一个去除沸点低于1,3-丙二醇的沸点的分子;获得纯化的bio-1,3-丙二醇,其杂质总浓度低于约400ppm,在275nm处的吸光度低于0.075,并且b*颜色值(ciel*a*b*)低于约0.15。国际专利申请wo2014/141780涉及用于从发酵液分离1,4-丁二醇(1,4-bdo)的方法,包括使富含1,4-bdo的液体级分与包含细胞的固体级分分离,从所述液体级分中去除水,从所述液体级分中去除盐,并且纯化1,4-bdo。所述方法包括多个步骤,例如:细胞:去除(离心和/或微滤和/或超滤),通过包括双效或三效蒸发器的蒸发系统去除水和轻质化合物,盐:通过纳滤和/或离子交换树脂和/或沉淀和/或结晶去除。所述专利申请声称,为了分离1,3-丁二醇的目的,可以容易地改良其中描述的方法:然而,没有给出这种效果的实例。美国专利申请us2014/0275465涉及用于纯化1,4-丁二醇(1,4-bdo)的方法,包括:(a)使1,4-bdo的原料混合物经过第一蒸馏柱以去除沸点低于1,4-bdo的沸点的化合物,获得包含1,4-bdo的第一流;和(b)使所述包含1,4-bdo的第一流经过第二蒸馏柱以去除沸点高于1,4-bdo的沸点的化合物,获得高沸点化合物的第一流,从而产生纯化的1,4-bdo,所述纯化的1,4-bdo从所述第二柱侧向提取。在可以使用所述方法纯化的化合物中,提及了1,3-丁二醇:然而,没有给出这种效果的实例。美国专利us9,533,931涉及用于生产1,4-丁二醇的方法,包括以下步骤:(a)将除了氨化合物和胺化合物以外的碱性物质添加到源自发酵液的包含1,4-丁二醇的水溶液中;(b)蒸馏步骤(a)中获得的混合物;和(c)从蒸气流中回收包含1,4-丁二醇的溶液;其中,在添加所述碱性物质之前,对所述源自发酵液的包含1,4-丁二醇的水溶液进行纳滤步骤以从中回收渗透物;和/或离子交换步骤。据说获得的纯化的1,4-丁二醇有利地用作生产聚酯的材料。然而,所述从发酵液分离和纯化1,3-丙二醇或1,4-丁二醇的方法可能存在一些困难。例如,所述方法需要通过使用一个或多个蒸馏柱进行纯化的步骤,从而延长了工艺时间并增加了工艺成本。此外,即使据说所述方法中的一些也适用于1,3-丁二醇的纯化,但是纯化1,3-丁二醇的关键步骤之一是蒸馏。实际上,与发酵液中存在的用于产生其它二醇的那些不同(即使仅是浓度不同)的特定污染物[例如,4-羟基-2-丁酮(4-oh-2b)]在发酵液中的存在可能在蒸馏过程本身中引起不受控制的反应。实际上,如例如ichikawan.等人在“catalysiscommunications”(2005),第6卷,第19-22页所述的,已知4-羟基-2-丁酮(4-oh-2b)即使在较低温度(例如100℃-120℃)下也可通过酸性位点的存在而促进脱水成3-丁烯-2-酮(mvk)。在包含1,3-丁二醇的溶液的蒸馏过程中酮的存在可导致通过1,3-丁二醇与3-丁烯-2-酮(mvk)之间的反应形成缩酮,其污染包含纯化的1,3-丁二醇的级分,即使被成功去除,也会导致部分1,3-丁二醇损失,并且从而导致该方法的产率降低[如从以下报告的实施例3(对比例)中可以看出]。如果将所述包含1,3-丁二醇的溶液在高真空下蒸馏,则会抑制3-丁烯-2-酮(mvk)的形成和因此缩酮的形成,但是对于所用的相同柱,这导致所述溶液在煮沸器中的停留时间增加,从而导致1,3-丁二醇的热分解产物增加[如从以下报告的实施例4(对比例)中可以看出]。因此,申请人已经自己确定的问题是寻找能够克服上述缺点的用于从发酵液纯化bio-1,3-丁二醇的方法。申请人现在已经发现,通过避免本领域已知的蒸馏步骤,并且通过采用第一、第二和第三蒸发步骤,可以克服上述缺点。特别是,申请人发现了用于从发酵液纯化bio-1,3-丁二醇的方法,包括以下步骤:(a)对发酵液进行分离;(b)对步骤(a)中获得的产物进行离子交换树脂处理;(c)对步骤(b)中获得的产物进行第一蒸发;(d)对步骤(c)中获得的产物进行第二蒸发;(e)对步骤(d)中获得的产物进行第三蒸发,获得纯化的bio-1,3-丁二醇。通过前述方法实现了许多优点。例如,所述方法使得可以避免由于bio-1,3-丁二醇与bio-3-丁烯-2-酮(mvk)之间的反应而形成缩酮和bio-1,3-丁二醇的热分解二者,从而提高了工艺产率。此外,通过避免使用蒸馏柱,简化了系统和工艺二者,使得在经济方面和在工艺时间方面是节约的此外,所述方法使得可以获得纯化的bio-1,3-丁二醇,其可以有利地用于生产bio-1,3-丁二烯,而bio-1,3-丁二烯又可以有利地用作生产弹性体和(共)聚合物的单体或中间体。因此,本发明的另一主题是用于由如上所述获得的纯化的bio-1,3-丁二醇生产bio-1,3-丁二烯的方法,以及所述bio-1,3-丁二烯作为生产弹性体和(共)聚合物的单体或中间体的用途。因此,本发明的主题包括用于从发酵液纯化bio-1,3-丁二醇的方法,包括以下步骤:(a)对发酵液进行分离;(b)对步骤(a)中获得的产物进行离子交换树脂处理;(c)对步骤(b)中获得的产物进行第一蒸发;(d)对步骤(c)中获得的产物进行第二蒸发;(e)对步骤(d)中获得的产物进行第三蒸发,获得纯化的bio-1,3-丁二醇。为了本说明书和所附权利要求的目的,除非另有说明,否则数值范围的定义总是包括端点。为了本说明书和所附权利要求的目的,术语“包含”还包括术语“基本上由…组成”或“由…组成”。为了本说明书和所附权利要求的目的,术语“纯化的bio-1,3-丁二醇”表示在根据本发明的方法结束时,即在第三蒸发步骤(e)结束时,得到一种水溶液,其中:-基于所述水溶液的总重量,bio-1,3-丁二醇以按重量计大于或等于85%、优选地按重量计大于或等于90%的浓度存在;-基于所述水溶液的总重量,水以按重量计小于或等于15%、优选地按重量计小于或等于8%的浓度存在;-基于所述水溶液的总重量,任何有机杂质[例如,酸、4-羟基-2-丁酮(4-oh-2b)]可以以按重量计小于或等于2%的量、优选地按重量计小于或等于1%的量存在;-基于所述水溶液的总重量,由bio-1,3-丁二醇分解得到的任何产物[例如,3-丁烯-2-酮、2-丁烯-1-醇(顺式和反式异构体)、3-丁烯-1-醇、3-丁烯-2-醇]可以以按重量计小于或等于0.01%、优选地按重量计小于或等于0.005%的量存在;-任何糖(例如,葡萄糖)可以以小于或等于0.001g/l、优选地小于或等于0.0005g/l的量存在。为了本说明书和所附权利要求的目的,术语“bio-1,3-丁二醇”表示所述1,3-丁二醇是由活生物体的一种或多种物种或菌株,包括优选细菌、酵母、真菌和其它生物体的菌株合成的。通常,所述发酵液可以源自市售糖的发酵,或源自可再生来源,其在合适的培养基中在至少一种经遗传修饰以产生1,3-丁二醇的微生物的存在下进行。通常,通过引入一种或多种外源基因对所述微生物进行遗传修饰,所述外源基因编码属于涉及产生1,3-丁二醇的酶通路的化合物。任选地,所述微生物可以进一步包含基因破坏,以优化碳流通过产生1,3-丁二醇的期望通路。所述可再生来源通常是植物来源的生物质:为此目的,可以使用例如甘蔗和甜菜作为糖的来源(例如,葡萄糖、阿拉伯糖、木糖、蔗糖),或玉米和马铃薯作为淀粉和因此右旋糖的来源。然而,展望未来,非食物生物质受到更高的关注,例如玉米秸秆、谷类秸秆、芦竹(arundo)、蓟秆、银胶菊渣(guayulebagasse)等,其可以通过纤维素和半纤维素的分解而提供糖。通常,对植物来源的生物质进行化学和/或酶促水解以获得底物,其随后可以以生物催化的方式被处理以获得目的化学产物。所述底物包含源自生物质中存在的纤维素、半纤维素和木质素的碳水化合物以及芳族化合物和其它产物的混合物。由所述生物质的水解得到的碳水化合物是富含具有5和6个碳原子的糖的混合物,并且包括例如蔗糖、葡萄糖、木糖、阿拉伯糖、半乳糖、甘露糖和果糖,其将用于发酵中。例如,与上述合成1,3-丁二醇的方法有关的更多细节可以在美国专利申请us2010/330635、us2012/329113、us2013/066035、us2013/109064中找到,其通过引用并入本文。为了从发酵液纯化bio-1,3-丁二醇,首先需要从所述发酵液分离具有相对高分子量的细胞生物质以及细胞碎片和污染物。用于从液体分离颗粒形式的细胞生物质和其它化合物的方法(例如过滤、离心)是本领域已知的。在本发明的优选实施方案中,所述步骤(a)可以包括以下步骤:(a1a)微滤;和(a2)纳滤。在本发明的其它优选实施方案中,所述步骤(a)可以包括以下步骤:(a1b)离心;和(a2)纳滤。在本发明的优选实施方案中,所述微滤步骤(a1a)可以通过具有0.01μm至1.0μm范围、优选地0.02μm至0.08μm范围的平均孔径的膜进行。在本发明的优选实施方案中,所述微滤步骤(a1a)可以在0.1巴至8巴范围、优选地1巴至5巴范围的跨膜压力下操作进行,所述跨膜压力被定义为在微滤模块上游测得的压力与下游测得的压力之间的平均压力。在本发明的优选实施方案中,所述微滤步骤(a1a)可以在20℃至90℃范围、优选地40℃至70℃范围的温度下,更优选地在发酵温度下进行。在本发明的优选实施方案中,所述微滤步骤(a1a)可以通过浸没的或错流构造或动态错流构造的陶瓷膜或者通过浸没的或错流构造的扁平或中空纤维聚合物膜进行。可以用于本发明的目的并且是可商购的膜的实例是来自sartorius的“microfiltrationcassettes”产品,或来自tami的ceram产品,或来自pall的schumasivtm或产品,或来自asahikaseicorporation的microza产品。在所述微滤步骤(a1a)结束时,获得了包含bio-1,3-丁二醇、水和残留杂质(例如,糖、其它有机杂质、盐)的渗透物,其可被送至如上所述的纳滤步骤(a2),或者被直接送至离子交换树脂处理步骤(b),以及包含细胞生物质和任何细胞碎片的截留物。所述截留物可被干燥并丢弃在垃圾填埋场中或焚化,或者可以被直接送至水处理厂。在本发明的优选实施方案中,所述离心步骤(a1b)可以在20℃至90℃范围、优选地25℃至70℃范围的温度下,更优选地在室温(25℃)下进行。在本发明的优选实施方案中,所述离心步骤(a1b)可以以50l/h至1000l/h范围、优选地90l/h至500l/h范围的离心进料速率操作进行。在本发明的优选实施方案中,所述离心步骤(a1b)可以以2000rpm至50000rpm范围、优选地3000rpm至9000rpm范围的旋转速率进行。为了本发明的目的,所述离心步骤(a1b)可以在本领域已知的任何类型的离心机中进行;特别地,已经使用了具有自动面板弹出的圆盘离心机,来自andritz的ca21-p型。在所述离心步骤(a1b)结束时,获得了包含bio-1,3-丁二醇、水和残留杂质(例如,糖、其它有机杂质、盐)的较轻水相(上清液),其可被送至如上所述的纳滤步骤(a2),或者被直接送至离子交换树脂处理步骤(b),以及包含细胞生物质和任何细胞碎片的第二较重水相(沉淀物)。所述第二水相(沉淀物)可以被干燥并丢弃在垃圾填埋场中或焚化,或者可以被直接送至水处理厂。在本发明的优选实施方案中,所述纳滤步骤(a2)可以通过具有100道尔顿至500道尔顿范围、优选地120道尔顿至400道尔顿范围的“截留分子量”(mwco)的纳滤膜进行。在本发明的优选实施方案中,所述纳滤步骤(a2)可以通过具有15℃至100℃范围、优选地20℃至80℃范围的最高操作温度的纳滤膜进行。在本发明的优选实施方案中,所述纳滤步骤(a2)可以在10巴至50巴范围、优选地20巴至40巴范围的跨膜压力下操作进行,所述跨膜压力被定义为在纳滤模块上游测得的压力与下游测得的压力之间的平均压力。前述亲水性纳滤膜可以是扁平片、中空纤维、管状膜、螺旋缠绕膜的形式,或者其它有益形式。可以有利地用于本发明的目的的纳滤膜是来自gepower&water的商品名为dkseries或来自kochmembranesystems的商品名为sr3dtmmembrane的已知产品。在所述纳滤步骤(a2)结束时,获得了包含bio-1,3-丁二醇、水和残留杂质(例如,盐、酸)的渗透物,其可被送至离子交换树脂处理步骤(b),以及包含具有高位阻的化合物(例如,蛋白质、二价盐)的截留物。所述截留物可以被直接送至水处理厂。在本发明的优选实施方案中,所述离子交换树脂处理步骤(b)可以包括两个步骤:(b1)阴离子交换步骤;(b2)阳离子交换步骤。在本发明的优选实施方案中,所述步骤(b1)可以通过包含弱阴离子树脂的柱进行。可以有利地用于本发明的目的的弱阴离子树脂是来自dowchemical的商品名为dowextmmonospheretm77或来自mitsubishichemicalcorporation的商品名为wa30的已知产品。在本发明的优选实施方案中,所述步骤(b2)可以通过包含强阳离子树脂的柱进行。可以有利地用于本发明的目的的强阳离子树脂是来自dowchemical的商品名为dowextmmonospheretm88或来自rohm&haasresins的商品名为amberlitetmmb150的已知产品。在本发明的优选实施方案中,所述步骤(b1)和(b2)可以在15℃至50℃范围、优选地20℃至45℃范围的温度下进行。在本发明的优选实施方案中,所述步骤(b1)和(b2)可以以2bv/h至4bv/h范围、优选地2.5bv/h至3.5bv/h范围(bv=“床体积”=每单个柱的树脂体积)的流速[每小时步骤(a)中获得的产物的升数]进行。在本发明的优选实施方案中,从所述步骤(b1)和(b2)获得的产物可以具有0.1μs/cm至100μs/cm范围,优选地0.5μs/cm至15μs/cm范围的残余电导率。在本发明的优选实施方案中,步骤(a)中获得的产物可以被进料至步骤(b1)并且然后被进料至步骤(b2),或者可以被进料至步骤(b2)并且然后被进料至步骤(b1)。在所述离子交换树脂处理步骤(b)结束时,获得了包含bio-1,3-丁二醇、水、轻质有机化合物(例如,乙醇)、重质有机化合物[例如,4-羟基-2-丁酮(4-oh-2b)]、未转化的糖和任何未去除的盐的水溶液。所述水溶液被送至第一蒸发步骤(c)。在所述步骤(b)结束时,根据本领域已知的方法操作通过酸或碱的溶液对前述步骤(b1)和(b2)中使用的包含离子交换树脂的柱进行再生。在本发明的优选实施方案中,所述第一蒸发步骤(c)可以在30℃至100℃范围、优选地40℃至70℃范围的温度下进行。在本发明的优选实施方案中,所述第一蒸发步骤(c)可以在5毫巴至100毫巴范围、优选地10毫巴至80毫巴范围的压力下进行。为了所述步骤(c)的目的,可以有利地使用本领域已知的任何类型的蒸发器。可以有利地使用的蒸发器的具体实例是:旋转蒸发器、其中通过简单地由沸腾引起的运动来实现蒸发的“自然循环”蒸发器、釜式蒸发器、其中通过强制循环来实现蒸发的蒸发器(其中使用循环泵增加速度和湍流)(强制循环蒸发器)、me-ev蒸发器(多效蒸发器)、单级或多级蒸发器、单效蒸发器、stv蒸发器(短管立式蒸发器)、ltv蒸发器(长管立式蒸发器)、篮式蒸发器、水平管蒸发器、降膜蒸发器、刮膜蒸发器、闪蒸器、多级闪蒸器等。优选地,在所述步骤(c)中可以使用me-ev蒸发器(多效蒸发器)。在所述第一蒸发步骤(c)结束时,获得了包含bio-1,3-丁二醇、水、重质有机化合物[例如,4-羟基-2-丁酮(4-oh-2b)]、未转化的糖和任何未去除的盐的浓缩溶液,其被送至第二蒸发步骤(d),以及主要包含水和痕量的乙醇和痕量的bio-1,3-丁二醇的水相,其可以被再循环至以下步骤之一:(a1a)微滤、(a1b)离心、(a2)纳滤、(b)离子交换树脂处理。或者,所述水相可以被直接送至水处理厂。在本发明的优选实施方案中,所述第二蒸发步骤(d)可以在30℃至150℃范围,优选地40℃至130℃范围的温度下进行。在本发明的优选实施方案中,所述第二蒸发步骤(d)可以在1毫巴至100巴范围,优选地8毫巴至80毫巴范围的压力下进行。为了前述步骤(d)的目的,可以有利地使用本领域已知的任何类型的蒸发器。可以有利地使用的蒸发器的具体实例是以上报告的那些。优选地,在所述步骤(d)中可以使用刮膜蒸发器。在所述第二蒸发步骤(d)结束时,获得了包含bio-1,3-丁二醇、水和痕量的重质有机化合物[例如,4-羟基-2-丁酮(4-oh-2b)]、痕量的未转化的糖和痕量的任何未去除的盐的浓缩溶液,其被送至第三蒸发步骤(e),以及主要包含水、沸点低于bio-1,3-丁二醇的沸点的有机化合物和痕量的bio-1,3-丁二醇的水相,其可以被直接送至水处理厂。在本发明的优选实施方案中,所述第三蒸发步骤(e)可以在30℃至150℃范围、优选地40℃至130℃范围的温度下进行。在本发明的优选实施方案中,所述第三蒸发步骤(e)可以在5毫巴至100巴范围、优选地8毫巴至80毫巴范围的压力下进行。为了前述步骤(e)的目的,可以有利地使用本领域已知的任何类型的蒸发器。可以有利地使用的蒸发器的具体实例是以上报告的那些。优选地,在所述步骤(e)中可以使用刮膜蒸发器。在所述第三蒸发步骤(e)结束时,获得两个相:-水相,包含纯化的bio-1,3-丁二醇;-有机相,包含任何沸点高于bio-1,3-丁二醇的沸点的有机化合物和痕量的未纯化的bio-1,3-丁二醇、痕量的未转化的糖和痕量的任何未去除的盐。关于所用蒸发器类型的更多细节可以在例如“processheattransfer”,donaldq.kern,mcgraw-hill(1950),第14章,蒸发器,第375-510页;perry’schemicalengineers’handbook,mcgraw-hill(7thed.–1997),第11节,第108–118页中找到。应当注意,在所述蒸发步骤(c)、(d)和(e)中,蒸发速率在蒸发开始时将是最大的,并且将继续降低直到蒸发结束时为零。如上所述,在所述步骤(e)结束时回收的bio-1,3-丁二醇可以有利地用在生产bio-1,3-丁二烯的方法中。因此,本发明的另一主题是用于制备bio-1,3-丁二烯的方法,包括:-将包含根据上述方法获得的bio-1,3-丁二醇的混合物(i)进料至包含至少一种脱水催化剂的第一反应器,获得离开所述第一反应器的包含烯醇、水和任选的未反应的杂质和/或未反应的bio-1,3-丁二醇的流(ii),-任选地,将所述流(ii)进料至第一纯化部分,获得:-包含烯醇、水和任选的杂质的流(iii);-包含水和任选的杂质和/或未反应的bio-1,3-丁二醇的流(iv);和任选的-包含杂质的流(v);-将所述流(iii)和/或所述流(iv)进料至包含至少一种脱水催化剂的第二反应器,获得离开所述第二反应器的包含bio-1,3-丁二烯、水和任选的杂质和/或未反应烯醇的流(vi);-将所述流(vi)进料至第二纯化部分,获得:-包含纯bio-1,3-丁二烯的流(vii);-包含水和任选的未反应的烯醇的流(viii);和任选的-包含杂质的流(ix)。为了本发明的目的,所述制备bio-1,3-丁二烯的方法可以有利地如本申请人名下的美国专利申请us2017/313633中所述进行,其通过引用并入本文。然而,应注意的是,所述bio-1,3-丁二醇可有利地用于根据本领域已知的任何方法制备bio-1,3-丁二烯,如例如本申请人名下的国际专利申请wo2015/173780、美国专利申us2018/0002250、us2018/0002249中所述的操作,其通过引用并入本文。如上所述,本发明的另一主题还在于所述bio-1,3-丁二烯作为生产弹性体和(共)聚合物的单体或中间体的用途。现在将参考以下报告的图1和图2通过实施方式的方式来更详细地说明本发明。根据本发明的方法可以如例如图1中所述实施。在这种情况下,将包含bio-1,3-丁二醇和水的发酵液(1)送至微滤步骤,所述发酵液优选地源自从生物质获得的糖的发酵,获得了包含bio-1,3-丁二醇、水和残留杂质(例如,糖、其它有机杂质、盐)的渗透物(2),其被送至纳滤步骤,以及包含细胞生物质和任何细胞碎片的截留物(图1中未示出),其可以被干燥并丢弃在垃圾填埋场中或焚化,或者可以被直接送至水处理厂。在所述纳滤步骤结束时,获得了包含bio-1,3-丁二醇、水和残留杂质(例如,盐)的渗透物(3),其被送至离子交换树脂处理步骤,以及包含具有高位阻的化合物(例如,蛋白质、二价盐)的截留物(图1中未示出),其可以被直接送至水处理厂。因此,对所述渗透物(3)进行离子交换树脂处理步骤,即在包含弱阴离子树脂的柱中处理然后在包含强阳离子树脂的柱中处理,反之亦然(图1中未示出),获得了包含bio-1,3-丁二醇、水、轻质有机化合物(例如,乙醇)、重质有机化合物[例如,4-羟基-2-丁酮(4-oh-2b)]、未转化的糖和任何未去除的盐的水溶液(4)。所述水溶液(4)被送至第一蒸发步骤,获得了包含bio-1,3-丁二醇、水、重质有机化合物[例如,4-羟基-2-丁酮(4-oh-2b)]、未转化的糖和任何未去除的盐的浓缩溶液(5),其被送至第二蒸发步骤,以及主要包含水和痕量的乙醇和痕量的bio-1,3-丁二醇的水相(图1中未示出),其可以被再循环至以下步骤之一:(a1a)微滤(4c)、(a2)纳滤(4b)、(b)离子交换树脂处理(4a)(图1中虚线示出)。从所述第二蒸发步骤,获得了包含bio-1,3-丁二醇、水和痕量的重质有机化合物[例如,4-羟基-2-丁酮(4-oh-2b)]、痕量的未转化的糖和痕量的任何未去除的盐的浓缩溶液(6),其被送至第三蒸发步骤,以及主要包含水、沸点低于bio-1,3-丁二醇的沸点的有机化合物和痕量的bio-1,3-丁二醇的水相(图1中未示出),其可以被直接送至水处理厂。从所述第三蒸发步骤,获得两个相:包含纯化的bio-1,3-丁二醇的水相(7),以及包含任何沸点高于bio-1,3-丁二醇的沸点的有机化合物和痕量的未纯化的bio-1,3-丁二醇、痕量的未转化的糖和痕量的任何未去除的盐的有机相(图1中未示出)。图2示出了根据本发明的用于制备bio-1,3-丁二烯的方法的一种实施形式。在图2中,将包含根据本发明的方法目的获得的bio-1,3-丁二醇的混合物(i)进料至包含至少一种脱水催化剂的第一反应器中,获得了离开所述第一反应器的包含烯醇、水和任选的杂质和/或未反应的bio-1,3-丁二醇的流(ii);将所述流(ii)进料至第一纯化部分,获得了包含烯醇、水和任选的杂质的流(iii),包含水和任选的杂质和/或未反应的bio-1,3-丁二醇的流(iv)(图2中未示出),以及包含杂质的流(v)(图2中未示出);将所述流(iii)进料至包含至少一种脱水催化剂的第二反应器,获得了离开所述第二反应器的包含bio-1,3-丁二烯、水和任选的杂质和/或未反应烯醇的流(vi),其被进料至第二纯化部分,获得了包含纯bio-1,3-丁二烯的流(vii),包含水和任选的未反应的烯醇的流(viii)(图2中未示出),以及任选地,包含杂质的流(ix)(图2中未示出)。为了更好地理解本发明并将其付诸实践,在下文中报告了其说明性的非限制性实施例。实施例1.bio-1,3-丁二醇的纯化为此目的,使用了包含bio-1,3-丁二醇(为简洁起见,在下文中称为bio-1,3-bdo)的模型发酵液,其具有下表1中报告的平均组成。表1.包含bio-1,3-bdo的模型发酵液的组成化合物*量bio-1,3-bdo(g/l)70-95细胞生物质(g/l)20副产物(乙醇、乙酸、4-羟基-2-丁酮、蛋白质)(g/l)20-35残留盐(g/l)<10残留葡萄糖(g/l)<1*余量由水组成。使用配备有二元泵、脱气器、自动进样器和恒温柱隔室的waters2690alliance“模块系统”色谱仪,通过高效液相色谱法(hplc)测定稀溶液(即1,3-bdo的浓度<150g/l的水溶液)中糖和有机酸以及bio-1,3-丁二醇的含量。所用的柱为phenomenexrezexroa-organicacidh+,尺寸为300×7.8mm,在45℃下,用0.005n硫酸(h2so4)水溶液以0.6ml/min的流速等度洗脱。使用了两个检测器:waters2487uv/vis双吸光度检测器(dad)和waters2410折射率检测器(rid)。将表1中报告的发酵液分为三个独立的批次,即“批次03”、“批次04”和“批次05”,并如下操作进行纯化。通过微滤去除细胞生物质为了去除细胞生物质,将发酵液即“批次04”和“批次05”送至微滤模块,所述微滤模块包含平均孔径为0.05μm的错流构造的陶瓷膜。所述微滤模块细分为19个直径为6mm的通道,并且总过滤面积为0.36m2。在测试过程中,尝试在膜内保持4-5m/s的流速,以限制其结垢并达到大于5、优选为6至10范围的浓度系数[体积浓度比(vcr)],其被定义为进料的发酵液的体积与获得的渗透物的体积之间的比率:表2中报告了关于进行微滤的操作条件的更多数据。在微滤结束时,获得了包含bio-1,3-bdo、水和残留杂质(例如,糖、其它有机杂质、盐)的渗透物,其被送至如下文所述操作的纳滤模块,以及包含细胞生物质和任何细胞碎片的截留物,其被干燥并丢弃在垃圾填埋场中:表2中还报告了回收的bio-1,3-bdo的量。通过离心去除细胞生物质为了去除细胞生物质,使用具有自动面板弹出的圆盘离心机ca21-p型(andritz)对发酵液即“批次03”进行离心,并在以下条件下操作:-进料速率:100升/小时;-面板弹出间隔:5分钟;-弹出方式:注水;-转速:8000rpm;-温度:室温(25℃)。表2中报告了关于进行离心的操作条件的更多数据。在离心结束时,获得了包含bio-1,3-bdo、水和残留杂质(例如,糖、其它有机杂质、盐)的第一较轻水相(上清液),其被送至如下文所述操作的纳滤模块,以及包含细胞生物质和任何细胞“碎片”的第二较重水相(沉淀物),其被干燥并丢弃在垃圾填埋场:表2中还报告了回收的bio-1,3-bdo的量。表2.微滤(“批次04”和“批次05”)和离心(“批次03”)的操作条件(1):进料泵的流速;(2):非恒温系统;(3):离开离心机或微滤模块的bio-1,3-bdo的量除以进入离心机或微滤模块的bio-1,3-bdo的量×100。纳滤为了去除水和残留杂质(例如,糖、其它有机杂质、盐),进行了纳滤步骤。将源自“批次04”和“批次05”的离开微滤模块的渗透物进料至包含螺旋缠绕膜的纳滤模块,而将源自“批次03”的离开离心机的第一水相(上清液)进料至振动纳滤系统,称为vsep9(振动剪切增强处理单元-newlogicresearchinc.)。两种系统均配有截留分子量(mwco)为150道尔顿至300道尔顿范围的gedk膜(koch膜系统)。表3中报告了关于进行纳滤的操作条件的更多数据。在纳滤结束时,获得了包含bio-1,3-bdo、水和残留杂质(例如,盐、酸)的渗透物,其被送至离子交换树脂处理,以及包含具有高位阻的化合物(例如,蛋白质、二价盐)的截留物,其被干燥并丢弃在垃圾填埋场中:表3中还报告了回收的bio-1,3-bdo的量。表3.纳滤(“批次03”、“批次04”和“批次05”)的操作条件(1):离开纳滤模块的bio-1,3-bdo的量除以进入纳滤模块的bio-1,3-bdo的量×100。离子交换树脂处理为了去除残留杂质(例如,盐、酸),进行了离子交换树脂处理步骤。为此目的,将源自“批次03”的离开纳滤模块的渗透物分为两个等分试样,分别称为“批次03-1”和“批次03-2”,然后送至离子交换树脂处理步骤。将源自“批次03”(即“批次03-1”和“批次03-2”)、“批次04”和“批次-05”的离开纳滤模块的渗透物进料至离子交换树脂处理系统。该系统由两个具有以下尺寸的透明聚氯乙烯柱(pvc-u–gfpipingsystem)构成:直径=151mm,高度=1200mm。所述两个柱串联连接,填充有离子交换树脂:第一柱填充有强阳离子树脂(dowextmmonospheretm88–dowchemical),而第二柱填充有弱阴离子树脂(dowextmmonospheretm77–dowchemical)。该操作的目的是使离开第二柱的产物的电导率<15μs/cm,并且如果离开的产物具有更高的电导率,则在树脂再生之后将所述产物再次进料至所述系统。所述离子交换树脂处理步骤在室温下(25℃)下进行,而使用计量泵(电磁隔膜计量泵4-prominent)的流速为3.3bv/h。表4中报告了关于进行离子交换树脂处理步骤的操作条件的更多数据。在所述离子交换树脂处理结束时,获得了包含bio-1,3-bdo、水、轻质有机化合物(例如,乙醇)、重质有机化合物[例如,4-羟基-2-丁酮(4-oh-2b)]、未转化的糖和任何未去除的盐的水溶液,其被进料至旋转蒸发器(第一蒸发步骤):表4中还报告了回收的bio-1,3-bdo的量。表4.离子交换树脂处理(“批次03-1”、“批次03-2”、“批次04”和“批次05”)的操作条件(1):离开离子交换树脂处理系统的bio-1,3-bdo的量除以进入离子交换树脂处理系统的bio-1,3-bdo的量×100;(2):从离子交换树脂处理“批次03-1”和“批次03-2”获得的总量。第一蒸发为了消除水和轻质有机化合物(例如,乙醇),对从离子交换树脂处理步骤中获得的水溶液进行第一蒸发步骤。因此,将从离子交换树脂处理步骤获得的溶液进料至buchi旋转蒸发器,其具有通过浸入在恒温水浴中加热的20升装载球型烧瓶。将溶液半连续地进料至装载球型烧瓶中并从蒸发器中去除气相,获得了包含bio-1,3-bdo、水、重质有机化合物[例如,4-羟基-2-丁酮(4-oh-2b)]、未转化的糖和任何未去除的盐的浓缩溶液,其被送至第二蒸发步骤,以及主要包含水和痕量的乙醇和痕量的bio-1,3-bdo的水相,其可以被再循环至以下步骤之一:(a1a)微滤、(a1b)离心、(a2)纳滤、(b)离子交换树脂处理。用于所述第一蒸发步骤的条件如下:-恒温浴温度:60℃;-压力:70毫巴-10毫巴在蒸气冷凝结束时,认为蒸发完成。如以下报告的实施例中所述,进一步纯化包含bio-1,3-bdo的浓缩溶液。特别是:-将源自“批次04”的浓缩溶液分为两个等分试样,即“批次04-1”和“批次04-2”。-如实施例2(发明)和实施例5(发明)中所述,分别进一步纯化源自“批次03-2”和“批04-2”的浓缩溶液;-如实施例3(对比例)中所述,进一步纯化源自“批次03-1”的浓缩溶液;-如实施例4(对比例)和实施例6(对比例)中所述,分别进一步纯化源自“批次05”和“批次04-1”的浓缩溶液。实施例2.bio-1,3-bdo的纯化(第二和第三蒸发)(发明)在表5中报告的操作条件下,如以下报告的进行第二蒸发步骤和第三蒸发步骤。为此目的,将源自第一蒸发步骤即“批次03-2”的浓缩溶液(约2.6kg)进料至具有2升装载球型烧瓶的旋转蒸发器(4003control–heidolph)。通过将装载球型烧瓶浸入配备有恒温器的油浴中来提供加热。冷凝器由玻璃盘管形成,在其内部,水和乙二醇(约10%)在闭合回路中循环。制冷剂流体的冷却由空气/液体低温恒温器提供。在第一蒸发步骤的操作条件(即恒温浴中60℃,压力70-30毫巴)下开始测试,直到证实样品中没有蒸发。丢弃回收的任何水相。随后,第二蒸发步骤和第三蒸发步骤采用的操作条件报告在表5中(在蒸汽冷凝结束时认为蒸发完成):第二蒸发(步骤ii)和第三蒸发(步骤iii)。表5中还报告了如下定义的回收的相(ii)和相(iii)的量。表5.操作条件和从“批次03-2”回收的相从步骤ii(第二蒸发步骤),获得了包含水、沸点低于bio-1,3-bdo的沸点的有机化合物和痕量的未纯化的bio-1,3-bdo的水相,其被丢弃在垃圾填埋场中,以及包含bio-1,3-bdo、水和痕量的重质有机化合物[例如,4-羟基-2-丁酮(4-oh-2b)]、痕量的未转化的糖和痕量的任何未去除的盐的浓缩溶液(相ii),其形成第三蒸发步骤(步骤iii)的进料。从步骤iii(第三蒸发步骤),获得了包含纯化的bio-1,3-bdo的水相(相iii),以及包含任何沸点高于bio-1,3-bdo的沸点的有机化合物和痕量的未纯化的bio-1,3-bdo、痕量的未转化的糖和痕量的任何未去除的盐的有机相(相iv)。表6报告了如以上实施例1中所述对回收的相和进料(“批次03-2”)进行的气相色谱(gc)分析。表6.“批次03-2”和回收的相的组成。(1):bio-4-羟基-2-丁酮;(2):3-丁烯-2-酮、2-丁烯-1-醇(顺式和反式异构体)、3-丁烯-1-醇、3-丁烯-2-醇的总计;(3):由表6中未报告的其它有机杂质补足至100。相iv具有焦糖外观,并且仅通过如以上实施例1中所述操作的高效液相色谱法(hplc)进行分析。同时,为了分析相ii和相iii,使用了agilenthp6890气象色谱仪(gc),其配备有split/splitless进样器,在25m长度、0.32mm直径、1μm膜的quadrex007ffap柱上,使用的载体是速度为50cm/s的氦,检测器为火焰探测器。使用内标和已知个体组分的校准曲线进行测定。karlfischer滴定(831kfcoulometermetrohm)进一步用于分析相(iii)的水(相ii的水量通过差值计算)。随后将相iii进料至脱水系统中以生产丁烯醇,如以下报告的实施例7中所述操作。实施例3.bio-1,3-bdo的纯化(对比例)将约2.7kg的源自“批次03-1”的浓缩溶液进料至蒸馏柱并分批处理。使用5升煮沸器和具有sulzer填料的绝热柱(直径=2cm;高度=60cm)进行蒸馏。在蒸馏过程中,去除了残留水和沸点在水的沸点与bio-1,3-bdo的沸点之间的有机化合物,而高沸点有机化合物、残留盐和未转化的糖保留在煮沸器中:表7中报告了从蒸馏获得的级分。表7.从批次03-1蒸馏的级分富含bio-1,3-bdo的级分为级分7和级分8。然而,回收的所有级分最终都被起始溶液中不存在的分子污染;使用多种分析方法(ft-ir、gc-ms、gc、nmr)将所述分子鉴定为通过bio-1,3-bdo与3-丁烯-2-酮(mvk)之间的反应形成的缩酮,即2,4-二甲基-2-乙烯基-1,3-二噁烷(dmv13diox)。特别地,通过如以上实施例1中所述进行的气相色谱分析(gc)获得的色谱图使得可以观察到所有级分中新峰的存在,而起始进料中不存在。各种级分中峰的强度最终不同,因此对不同级分使用不同的分析技术。溶液nmr、ft-ir和gc-ms将所述分子鉴定为2,4-二甲基-2-乙烯基-1,3-二噁烷(dmv13diox)。所述分析如下进行。级分1样品的光谱nmr分析使用brukeravance400nmr工具在氘代丙酮溶液中记录nmr光谱。将位于1h-nmr谱中的2.05ppm和位于13c-nmr谱中的29.5ppm的丙酮的ch3信号作为参考信号。在1h-nmr谱中鉴定出多种产物(以不同的强度:其中最丰富的产物的特征是在5.80、5.32和5.29ppm处存在清晰可识别的乙烯基ch2=ch-,其强度与一组可归因于ch2-o-和ch-o的信号相对应,稀奇地是,特征在于非常高的耦合常数,这通常只存在于环状脂族体系中)。所述结果使得可以鉴定出dmv13diox的缩酮物质,特别是在已知该级分的主要化合物的情况下。仅借助于二维cosy1h-1h谱进一步理解了所有耦合。级分7样品的质谱使用顶部空间法在单四极杆质谱仪(tracedsq,thermo)上通过气相色谱-质谱(gc-ms)分析级分7。在顶部空间小瓶中测量样品,并将其加热至80℃约一小时。随后,浮在将液体表面上的1ml气相(从被检样品中衍生的区域和蒸气)注入气相色谱仪,方法为使得可以将空气(过量)与有机成分分离。所用的分析条件如下:气相色谱仪的温度方案,以4℃/分钟从50℃到300℃,以分流模式进样,进样器温度280℃,传输线250℃。在电子电离(ei)模式下从35道尔顿至500道尔顿记录的质谱。保留时间为3.9分钟的物质的质谱(ei)尽管看不到分子离子,但可以假设存在着来自生成离子127(相对丰度为22.5%)的分子离子的甲基(ch3)的损失,和离子115(相对丰度80.9%)的27(烯丙基)的损失。因此假设分子量为142,这将证实基于以上报告的nmr分析提出的假设。从由nmr分析假设的结构开始,还可以解释在ei-ms光谱中获得的其它碎片离子(实际上,ei技术通常包括有机分子的高度碎片化,并因此使得可以重建或确认结构)。特别地:-主离子55(相对丰度100%)可能对应于物质ch2=chchch3+*,-离子71(相对丰度35.3%)物质ch2=chchoch3+*。保留时间为4.44分钟的物质的质谱(ei)主离子55(相对丰度100%)物质ch2=chchch3+*,离子71(相对丰度19.3%)物质ch2=chchoch3+*。离子127(相对丰度32.5%)通过来自分子离子的甲基的损失;离子115(相对丰度11.9%)的来自分子离子的27(烯丙基)的损失。级分1样品的ft-ir光谱使用nicoletnexusft-ir光谱仪以64次扫描和2cm-1的分辨率获取存放在kbr窗口的样品的ft-ir光谱。可归因于产物dmv13diox的乙烯基基团的谱带发现于3088cm-1(ch2不对称伸缩)、985cm-1和916cm-1(ch和ch2摇摆),而1200cm-1–1100cm-1范围中和962cm-1处的谱带分别可归因于c-o键的不对称和对称伸缩。同样,从产物dmv13diox可以确定在1050cm-1处的c-o-c键和在1640cm-1处的c=c双键的振动。表8报告了如实施例1所述进行的进料(“批次03-1”)、源自“批次03-1”的蒸馏的级分7和级分8、以及蒸馏结束时获得的煮沸器残留物的气相色谱(gc)分析。表8.富含bio-1,3-bdo的级分的gc分析(1):bio-4-羟基-2-丁酮;(2):2,4-二甲基-2-乙烯基-1,3-二噁烷(表示为基于bio-1,3-bdo的峰面积的面积百分比);(3):由表8中未报告的其它有机杂质补足至100。煮沸器残留物具有焦糖外观,并且仅通过如以上实施例1中所述操作的hplc进行分析。karlfischer滴定(831kfcoulometermetrohm)进一步用于分析级分7和级分8的水。实施例4.bio-1,3-bdo的纯化(对比例)将约4.2kg的源自“批次05”的溶液进料至蒸馏柱并分批处理。使用5升煮沸器和具有sulzer填料的绝热柱(直径=2cm;高度=60cm)进行蒸馏。在蒸馏过程中,去除了残留水和沸点在水的沸点与bio-1,3-bdo的沸点之间的有机化合物,而高沸点有机化合物、残留盐和未转化的糖保留在煮沸器中;表9报告了从蒸馏获得的级分。表9.从“批次05”蒸馏的级分富含1,3-bdo的级分是级分6和级分7。通过降低柱中的压力和因此系统的温度,避免了3-丁烯-2-酮(mvk)和相应缩酮的形成。然而,在最后蒸馏的级分(级分7)中,注意到bio-1,3-bdo的分解产物的存在,其导致蒸馏产率的降低:表10报告了如以上实施例1中所述进行的富含bio-1,3-bdo的级分的气相色谱分析。表10.“批次05”的富含1,3-bdo的级分的gc分析(1):bio-4-羟基-2-丁酮;(2):2,4-二甲基-2-乙烯基-1,3-二噁烷(表示为基于bio-1,3-bdo的峰面积的面积百分比);(3):丁烯-2-酮、2-丁烯-1-醇(顺式和反式异构体)、3-丁烯-1-醇、3-丁烯-2-醇的总计;(4):由表10中未报告的其它有机杂质补足至100。煮沸器残留物具有焦糖外观,并且仅通过如以上实施例1中所述操作的hplc进行分析。karlfischer滴定(831kfcoulometermetrohm)进一步用于分析级分5、级分6和级分7的水。随后将“批次5”的级分6进料至脱水系统以生产丁烯醇,如以下实施例7中所述操作。实施例5.bio-1,3-bdo的纯化(第二和第三蒸发)(发明)在表11中报告的操作条件下,如以下报告的进行第二和第三蒸发步骤。为此目的,将源自第一蒸发步骤的浓缩溶液(即“批次04-2”)(约6.8kg)进料至具有2升装载球型烧瓶的旋转蒸发器(4003control–heidolph)中。通过将装载球型烧瓶浸入配备有恒温器的油浴中来提供加热。冷凝器由玻璃盘管形成,在其内部,水和乙二醇(约10%)在闭合回路中循环。制冷剂流体的冷却由空气/液体低温恒温器提供。在第一蒸发步骤的操作条件(即恒温浴中60℃,压力70-30毫巴)下开始测试,直到证实样品中没有蒸发。丢弃回收的任何水相。随后,第二蒸发步骤和第三蒸发步骤采用的操作条件报告在表11中(在蒸汽冷凝结束时认为蒸发完成):第二蒸发(步骤ii)和第三蒸发(步骤iii)。表11中还报告了如下定义的回收的相(ii)和相(iii)的量。表11.操作条件和从“批次04-2”回收的相从步骤ii(第二蒸发步骤),获得了包含水、沸点低于bio-1,3-bdo的沸点的有机化合物和痕量的未纯化的bio-1,3-bdo的水相,其被丢弃在垃圾填埋场中,以及包含bio-1,3-bdo、水和痕量的重质有机化合物(例如,4-羟基-2-丁酮)、痕量的未转化的糖和痕量的任何未去除的盐的浓缩溶液(相ii),其形成第三蒸发步骤(步骤iii)的进料。从步骤iii(第三蒸发步骤),获得了包含纯化的bio-1,3-bdo的水相(相iii),以及包含任何沸点高于bio-1,3-bdo的沸点的有机化合物和痕量的未纯化的bio-1,3-bdo、痕量的未转化的糖和痕量的任何未去除的盐的有机相(相iv)。表12报告了如以上实施例1中所述进行的回收的相和进料(“批次04-2”)的气相色谱(gc)分析。表12.“批次04-2”和回收的相的组成。(1):bio-4-羟基-2-丁酮;(2):3-丁烯-2-酮、2-丁烯-1-醇(顺式和反式异构体)、3-丁烯-1-醇、3-丁烯-2-醇的总计;(3):由表12中未报告的其它有机杂质补足至100。相iv具有焦糖外观,仅通过如以上实施例1中所述操作的高效液相色谱法(hplc)进行分析。karlfischer滴定(831kfcoulometermetrohm)进一步用于分析相(iii)的水(相ii的水量通过差值计算)。随后将相iii进料至脱水系统中以生产丁烯醇,如以下报告的实施例7中所述操作。实施例6.bio-1,3-bdo的纯化(对比例)将约4.05kg的源自“批次04-1”的溶液进料至蒸馏柱并分批处理。使用5升煮沸器和具有sulzer填料的绝热柱(直径=2cm;高度=60cm)进行蒸馏。在蒸馏过程中,去除了残留水和沸点在水的沸点和bio-1,3-bdo的沸点之间的有机化合物,而高沸点有机化合物、残留盐和未转化的糖保留在煮沸器中:表13报告了从蒸馏获得的级分。表13.从“批次04-1”蒸馏的级分富含1,3-bdo的级分是级分4和级分5。通过降低柱中的压力和因此系统的温度,避免了3-丁烯-2-酮(mvk)和相应缩酮的形成。然而,在最后蒸馏的级分(级分5)中,注意到bio-1,3-bdo的分解产物的存在,其导致蒸馏产率的降低:表14报告了如以上报告的实施例1中所述进行的富含bio-1,3-bdo的级分和进料(“批次04-1”)的气相色谱(gc)分析。表14.“批次04-1”的富含1,3-bdo的级分的gc分析(1):bio-4-羟基-2-丁酮;(2):2,4-二甲基-2-乙烯基-1,3-二噁烷(表示为基于bio-1,3-bdo的峰面积的面积百分比);(3):3-丁烯-2-酮、2-丁烯-1-醇(顺式和反式异构体)、3-丁烯-1-醇、3-丁烯-2-醇的总计;(4):由表14中未报告的其它有机杂质补足至100。煮沸器残留物具有焦糖外观,并且仅通过如以上实施例1中所述操作的hplc进行分析。karlfischer滴定(831kfcoulometermetrohm)进一步用于分析级分3、4和5的水。随后将“批次04-01”的级分4进料至脱水系统以生产丁烯醇,如以下报告的实施例7中所述操作。表15报告了实施例2(发明)(“批次03-2”的相iii)、实施例4(对比例)(“批次05”的级分6)、实施例5(发明)(“批次04-2”的相iii)和实施例6(对比例)(“批次04-1”的级分4)的产率。没有报告实施例3(对比例)的产率,这是因为富含1,3-bdo的级分被2,4-二甲基-2-乙烯基-1,3-二噁烷(dmv13diox)污染并且未送去脱水系统用于生产丁烯醇。表15.实施例1和实施例4(发明)、实施例3和实施例5(对比例)的级分的产率和回收率总回收率计算为回收的相或级分的总和(g)除以测试的总小时数(h),后者从去除第一冷凝滴开始计数。bio-1,3-bdo的回收率计算为回收的纯化相级分的量(g)除以纯化该单个相或级分的小时数(h),后者从去除所述相或级分的第一冷凝滴开始计数。从表15中报告的数据可以看出,实施例2和实施例5(发明)最终具有比实施例4和实施例6(对比例)更高的产率(即,富含bio-1,3-bdo的相或级分的回收率),并且从所用相或级分中得到的bio-1,3-bdo回收率最终要高得多。实施例7.从bio-1,3-bdo生产bio-丁烯醇对实施例2(发明)中获得的纯化的1,3-bdo(“批次03-2”的相iii)和实施例4(对比例)中获得的纯化的bio-1,3-bdo(“批次05”的级分6)进行如下所述操作的催化脱水。为此目的,首先如以下所述操作合成催化剂a和b。催化剂a的合成在配有磁力条状搅拌器的玻璃烧杯中在室温(25℃)下通过剧烈搅拌制备870g硝酸铈六水合物在4200g水中的溶液。将获得的溶液转移到配备有条状搅拌棒的玻璃反应器中,并在搅拌下保持15分钟。向保持在搅拌下的所获得溶液中通过蠕动泵经过3小时添加790g的15%的氢氧化铵(nh4oh)水溶液,该水溶液通过稀释28%-30%的商业水溶液预先制备,同时通过连接至metrohm691ph计的metrohm玻璃ph电极(6.0248.030)监测ph。在添加溶液结束时,混悬液的ph为9.0,将整体在相同条件下在搅拌下放置64小时,在此结束时ph最终为4.3。随后,向保持在搅拌下的所获得混悬液中通过蠕动泵经过25分钟添加另外90g的如上所述预先制备的15%的氢氧化铵(nh4oh)水溶液,得到ph9.0的混悬液。将该混悬液在搅拌下放置24小时,在此结束时再次测量ph并最终为8.8,获得沉淀物。将获得的沉淀物过滤,用约10升水洗涤,并且然后在120℃下烘箱干燥2小时。干燥后,将获得的固体在600℃下煅烧6小时。催化剂b的合成向配备有具teflon月牙形刀片的搅拌棒的烧杯中添加200g的约30%氢氧化铵(nh4oh)水溶液,然后引入电极[连接到metrohm780ph计的metrohm玻璃ph电极(6.0248.030)]以测量ph。在另一个配备有磁力条状搅拌器的烧杯中,制备200g硝酸铈六水合物在200g水中的溶液:然后通过在室温(25℃)下剧烈搅拌来溶解硝酸铈。将获得的溶液引入滴管中,并在恒定的剧烈搅拌下经过6分钟逐滴加入到包含在烧杯中的前述氢氧化铵溶液中。所得混悬液的ph为10.1。将整体在剧烈搅拌下放置3小时,在此期间添加200ml水,并测量ph,为9.6。将整体在剧烈搅拌下再放置1.5小时,在此结束时再添加200ml水,并且再次测量ph,为9.5。将所述混悬液在剧烈搅拌下放置64小时,在此结束时再次测量ph,为4.5。随后,添加另外23g的约30%氢氧化铵(nh4oh)的水溶液,得到ph9.0;将整体在搅拌下放置6小时,得到ph8.5。随后,添加16g的30%氢氧化铵(nh4oh)的水溶液,得到ph9.0。将整体在剧烈搅拌下放置17小时,在此结束时ph为7.9,并且获得沉淀物。将获得的沉淀物过滤,用2升水洗涤,然后在120℃下烘箱干燥2小时。干燥后,将得到的固体在600℃下煅烧5小时。脱水反应bio-1,3-bdo的脱水反应在aisi316l钢固定床连续管式反应器中进行,反应器长400mm,内径为9.65mm。使用电加热器将反应器恒温至反应温度。为了最佳地调节反应器内的温度,沿着反应器的轴线有外径为3mm的孔,其容纳用于温度调节的热电偶。筛选测试中使用的催化剂,并选择0.5mm至1mm范围的级分。在两层惰性材料(刚玉)之间将等于3g的催化剂负载插入反应器中,通过放置在反应器底部的烧结钢隔片将催化床固定在适当的位置。进料从反应器的顶部填充有惰性材料的区域上方进行,该区域还充当蒸发器,并允许试剂在与催化剂接触之前进入气态并达到反应温度。因此,反应器具有下降流(down-flow)设置。使用高效液相色谱法(hplc)中使用的类型的计量泵将液体试剂进料。通过热质量流量计(tmf)将气体进料。在反应器的下游,将获得的产物在热交换器中冷却,并使用一系列时间控制阀在玻璃小瓶中收集冷凝的液体。在25m长、0.32直径、1μm膜的quadrex007ffap柱上使用配备有split/splitless进样器的agilenthp7890气相色谱仪(gc)通过气相色谱分析对收集的液体样品进行分析,使用的载体是速度为50cm/s的氦,检测器为火焰探测器。使用内标和已知个体组分的校准曲线进行测定。同时,使用在线气相色谱仪(gc)对不可冷凝的气体进行分析,并且最后将其送至容积鼓式气量计,以测量体积。通过具有50m长度、0.53mm直径、15微米膜的hp-al/s柱的agilenthp7890气相色谱仪(gc)进行气体的在线分析,使用的载体是速度为30cm/s的氦,检测器为火焰探测器。使用外标和已知个体组分的校准曲线进行测定。表16和表17中报告的催化性能通过根据以下报告的公式计算bio-1,3-bdo的转化率(c1,3-bdo)和丁烯醇的选择性表示:其中-(摩尔数1,3-bdo)输入=1,3-丁二醇输入的摩尔数-(摩尔数1,3-bdo)输出=是1,3-丁二醇输出的摩尔数-摩尔数丁烯醇是烯醇[指3-丁烯-2-醇(甲基乙烯基甲醇)和2-丁烯-1-醇(巴豆醇)]的总摩尔数。如果所有产物的总选择性超过100%,则测试结果表示为标准化为100的丁烯醇的选择性,或:在开始催化测试之前,在300℃下在氮气流(n2)中原位处理催化剂。随后在大气压下(1巴绝对压力)向所述反应器中以36g/h进料83.3%的1,3-丁二醇在水中的溶液。将如实施例4(对比例)中所述获得约3.19kg的“批次05”的级分6用640g水稀释。将获得的溶液进料至在370℃的温度下使用催化剂a的脱水反应器中,该催化剂没有表现出活性损失或产率损失的问题。随后,在使用催化剂b的第二测试中,进料如实施例2(发明)中所述获得的2.135kg的“批次03-2”的相iii,其中添加有428g水。反应温度设定为355℃。在这种情况下同样,催化剂没有表现出活性损失或产率损失的问题。表16报告了根据如上所述计算的转化率(c%)和选择性(s%)获得的催化结果。表16.实施例2(发明)(“批次03-2”的相iii)和实施例4(对比例)(“批次05”的级分6)中获得的纯化的bio-1,3-bdo的脱水测试的结果实施例8对实施例5(发明)中获得的纯化的bio-1,3-bdo(“批次04-2”的相iii)和实施例6(对比例)中获得的纯化的bio-1,3-bdo(“批次04-1”的级分4)进行如下操作的催化脱水。为此目的,首先如下操作合成催化剂c。催化剂c的合成基于挤出氧化铈的催化剂的制备通过本申请人名下的国际专利申请wo2015/173780的实施例9中所述的操作获得挤出催化剂。为此目的,在配备有磁力条状搅拌器的玻璃烧杯中在室温(25℃)下通过剧烈搅拌制备870g硝酸铈六水合物(99%aldrich,产品代码238538;cas号10294-41-4)在4200g水中的溶液。将获得的溶液转移到配备有条状搅拌棒的玻璃反应器中,并在搅拌下保持15分钟。向保持在搅拌下的所获得溶液中通过蠕动泵经过3小时添加790g的15%的氢氧化铵(nh4oh)水溶液,该水溶液通过稀释28%-30%的商业水溶液(aldrich28%-30%nh3基础acs试剂;产品代码221228;cas号1336-21-6)预先制备,同时通过连接至metrohm691ph计的metrohm玻璃ph电极6.0248.030监测ph。在添加溶液结束时,混悬液的ph为9.0:将整体在搅拌下放置64小时,在此结束时ph最终为4.3。随后,向保持在搅拌下的所获得混悬液中通过蠕动泵经过25分钟添加另外90g的如上所述预先制备的15%的氢氧化铵(nh4oh)水溶液,得到ph9.0的混悬液。将该混悬液在搅拌下放置24小时,在此结束时再次测量ph并最终为8.8,获得沉淀物。将获得的沉淀物过滤,用约10升水洗涤,并且然后在120℃下烘箱干燥2小时。在对适于获得足够量的材料的多个批次重复所述制备之后,将获得的固体合并并在研钵中研磨:随后将1905g如此获得的粉末置于具有amd模型电机的erweka行星式混合器中。将粉末干燥混合1小时,然后按顺序地经过50分钟滴加250g的25%氢氧化铵(nh4oh)水溶液,其通过稀释28%-30%的商业水溶液(aldrich28%-30%nh3基础acs试剂;产品代码221228;cas号1336-21-6)预先制备,并且同样地经过50分钟滴加250ml去离子水,得到糊状物,将其使用安装有具有2mm孔的辊的hutt挤出机挤出。将从挤出获得的粒料风干两天。随后,将重量为134g的粒料样品在120℃下烘箱干燥2小时,随后在600℃下煅烧6小时,获得基于氧化铈的催化剂。然后通过将催化剂粉碎并过筛,选择0.5mm至1mm范围的级分,来制备用于催化测试的催化剂。将如上所述获得的催化剂c加载到反应器中,并按照实施例7中所述进行初步操作。在370℃的温度下以36g/h的流速,用去离子水中的非生物来源的83.3%1,3-bdo溶液(sigma-aldrichb84784)开始测试。在约125小时的操作之后,向脱水反应器中进料4.072kg的83.3%的bio-1,3-bdo在水中的溶液,其通过适当地稀释如实施例6(对比例)中所述获得的“批次04-1”的级分4而获得。表17报告了根据如上所述计算的转化率(c%)和选择性(s%)获得的催化结果。在测试过程中,性能保持恒定,并且催化剂没有表现出活性损失或产率损失的问题。使用非生物来源的1,3-bdo起始溶液继续进行测试。在该步骤中,将反应温度设定为375℃以恢复轻微的转化损失。随后,在相同测试中,进料4.226kg的通过用去离子水稀释如实施例5(发明)中所述获得的“批次04-2”的相iii而获得的溶液,得到83.3%的溶液。在这种情况下同样,表17报告了根据如上所述计算的转化率(c%)和选择性(s%)获得的催化结果。如前一种情况,性能保持恒定,并且催化剂没有表现出活性损失或产率损失的问题。表17.实施例6(对比例)(“批次04-1”的级分4)和实施例5(发明)(“批次04-2”的相iii)中获得的纯化的bio-1,3-bdo的脱水试验结果同时,表18报告了丁烯醇的总产率,理解为在最后的纯化步骤的产率与脱水产率之间产生的。表18.丁烯醇的总产率从表18中报告的数据可以看出,根据本发明的从发酵液产生bio-丁烯醇的方法在平均总产率方面是对现有技术的改进。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1