用于治疗病理性血栓的多肽的制作方法
用于治疗病理性血栓的多肽
1.技术领域
2.本公开内容是关于多肽领域;更明确地说,是关于一种具有抗纤维素抗体以及重组人类组织性血浆蛋白原活化因子(human tissue plasminogenactivator;hu-tpa)的丝氨酸蛋白酶部位的多肽,以及其治疗血栓的用途。
2.
背景技术:
4.血栓形成(或凝血)是指血液形成血栓的复杂过程。凝血作用通常会涉及一系列依序强化的由蛋白质酶催化的事件。在较为后段的步骤中,第xa型凝血因子可将前凝血酶(prothrombin)剪切为凝血酶(thrombin),而凝血酶又可将纤维蛋白原(fibrinogen)剪切得到纤维素;纤维素和血小板可共同形成血块的筛状架构。血块的溶解涉及了纤维蛋白溶酶(plasmin),可透过多种酵素(包括组织性血浆蛋白原活化因子)其中一种,由血浆蛋白原(plasminogen)产生纤维蛋白溶酶。
5.血栓症是一种凝血性疾病,其中血块(或血栓)将血管堵塞,因而妨碍受影响区域的血流。患有不同伴随症状的患者(如,患有心血管疾病、内分泌或其他涉及身体调控的疾病、手术、药物使用等等)较容易发展出病理性血栓。这些血栓可能导致出血性中风、头部创伤、心肌梗塞、肺栓塞或深层静脉栓塞,而这通常会导致严重的,危及生命的临床症状。
6.在面对这种血栓形成的病理性问题时,有两大药物需求面向:第一种面向着重于防止或抑制病理性血栓的形成或在形成血栓核的时候防止或抑制其长成到相当的大小;另一种面向则是即时溶解已形成的病理性血栓。在以上两种面向中,目前临床上都已有适用的药物产品。
7.目前已开发并使用了多种间接的第xa型凝血因子抑制剂。在过去数十年间,最主要的抑制剂为肝素(heparin)、小分子量肝素与肝素类(heparinoid) 化合物;肝素是一种天然存在多糖类混合物,其包含分子量介于5,000至30,000 道耳顿不等的糖胺聚糖(glycosaminoglycan)。这些物质可结合至肝素-结合蛋白 (包括抗凝血酶),进而使得此类物质能够抑制第xa型凝血因子,并进一步抑制血栓形成。组织因子路径抑制物(tissue factor pathway inhibitor,tfpi)是一种单链血清蛋白,随着蛋白溶解程度的不同,其分子量介于34,000至40,000道耳顿之间,tfpi能够抑制第xa型凝血因子。然而,目前并未利用重组dna技术来生产此类因子做为药物。
8.临床上也开发并使用了多种凝血酶的直接抑制剂。由医学用水蛭所取得的天然水蛭素(hirudin)以及重组水蛭素可以和凝血酶结合,过去临床上曾使用此类物质,但由于相继开发出更佳的药品,近年来已不再使用。
9.近年来,开发出多种第xa型凝血因子或凝血酶的小分子抑制剂,并已取得核准而可用于在多种临床症状中预防凝血。在某些临床应用中,所用的小分子是第xa型凝血因子的直接抑制剂,譬如:阿哌沙班(apixaban)、伊度沙班 (edoxaban)与利伐沙班(rivaroxaban)。另外有些小分子属于凝血酶的直接抑制剂,譬如:阿加曲班(argatroban)或达比加群(dabigatran)。希美加群(ximelagatran) 也是一种直接凝血酶抑制剂,其具有
较佳的药动学特性,且施用剂量极低,但其会造成肝毒性,故已不再使用。希美加群是一种前驱药物,口服的希美加群在肝脏中会被转换成美拉加群(melagatran),此一活性形式会和凝血酶结合并抑制其活性。因此,降低美拉加群相对于希美加群的剂量,以及避免希美加群在肝脏中的转换,极有可能能够避免使用希美加群时所发生的肝脏毒性副作用。
10.已开发出多种重组人类组织性血浆蛋白原活化因子(tissueplasminogen activator,tpa),包括:阿替普酶(alteplase)、瑞替普酶(reteplase)、替奈普酶(tenecteplase)与拉诺普酶(lanoteplase);这些重组tpa解决了血管栓塞问题的大部分问题。然而,在许多情形中,使用tpa不足以溶解血栓和/或可能会造成严重内出血。
11.完整tpa的分子结构相当复杂,包含具备不同功能或活性的多个结构域,然而并非所有结构域都是用于溶解血栓的血栓溶解产品所必须的。全长 tpa分子(阿替普酶)共有527个氨基酸残基,其包括(i)纤维结合素手指区域 (fibronectin finger domain),其可和纤维素结合;(2)表皮生长因子区域,其可和肝细胞结合并有助于tpa廓清;(3)kringle 1区域,其可和肝内皮细胞结合并有助于tpa廓清;(4)kringle 2区域,其可和纤维素结合并可活化丝氨酸蛋白酶;以及(5)蛋白酶区域,其可剪切血浆蛋白原并受到第i型血浆蛋白原活化物抑制剂(plasminogen activator inhibitor type 1,pai-1)的抑制。可利用哺乳类细胞、 cho细胞来制备阿替普酶、替奈普酶与拉诺普酶,而瑞替普酶则是由细菌细胞所制备。
12.瑞替普酶全长共355个氨基酸残基,不含纤维结合素手指区域、上皮生长因子区域、与kringle 1区域。瑞替普酶是利用细菌系统所制备,且因此不含有转译后糖类修饰。虽然瑞替普酶对纤维素的亲和力较低,且其蛋白质酶活性也比不上阿替普酶,但瑞替普酶的血浆半衰期为14至18分钟;相较之下,阿替普酶在血浆中的半衰期只有3至4分钟。瑞替普酶可采多次推注(boli)形式施用,而阿替普酶是在单次推注(bolus)后进行灌注(infusion)。
13.替奈普酶的全长和阿替普酶一样是527个氨基酸残基,但带有三个突变位点。将第103位的苏氨酸取代为天冬酰胺,以利进行糖基化修饰;将第 117位的天冬酰胺取代为谷氨酰胺,以避免该处的糖基化。这些突变可抑制替奈普酶被肝细胞清除。此外,在第296至299位的赖氨酸-组氨酸-精氨酸-精氨酸四个氨基酸残基则被取代为4个丙氨酸残基,此一突变使得其对pai-1的抗性提升了80倍。替奈普酶的血浆半衰期为18分钟。
14.在拉诺普酶中,删除了纤维结合素手指区域与上皮生长因子区域,且在第117位的天冬酰胺被取代为谷氨酰胺。拉诺普酶的血浆半衰期长达45分钟,大幅改善了给药方式的限制。
15.也有许多临床研究着眼于比较不同重组tpa形式的药效。多个临床试验显示,四种tpa的整体疗效不相上下,但其各自适用的特定适应症则有所不同。从与tpa、其变异株与医疗用途相关的大量文献可以得知,tpa对纤维素的结合亲和力、半衰期、肝细胞降解敏感性、对血浆蛋白原活化物抑制剂的抗性等各种性质和tpa在特定临床症状下的特定性质息息相关。
16.有鉴于此,本领域亟需一种更佳药品,以治疗病理性或堵塞性血栓。
技术实现要素:
17.发明内容旨在提供本公开内容的简化摘要,以使阅读者对本公开内容具备基本的
理解。此发明内容并非本公开内容的完整概述,且其用意并非在指出本发明实施例的重要/关键元件或界定本发明的范围。发明内容的目的在于以简化的方式提出某些本案的技术构思,以作为下文实施方式的前序。
18.本发明的第一方面是有关于一种对纤维素专一的抗体。根据本公开内容多种实施例,所述抗纤维素抗体可对人类或小鼠纤维素专一结合。此外,此处提出的抗纤维素抗体对聚合后的不可溶纤维素的结合亲和力,优于对可溶性纤维蛋白原的结合亲和力。根据本公开内容某些实施例,所述抗纤维素抗体对人类纤维素抗体的结合亲和力,比其对于人类纤维蛋白原的结合亲和力高了十倍。
19.于某些视需要而采用的实施例中,所述抗纤维素抗体包含一轻链可变区,其具有seq id no:1、17、19或21所示的氨基酸序列,以及一重链可变区,其具有seq id no:2、18、20或22所示的氨基酸序列。举例来说,所述抗纤维素抗体可以是一种scfv,其具有seq id no:3或5所示的氨基酸序列。
20.根据本公开内容一些实施例,所述抗纤维素抗体包含六个互补决定区(complementarity-determining region,cdr),其分别具有对应于以下序列的氨基酸序列:seq id no:1的第30至32个氨基酸残基(cdr-l1)、seq id no:1 的第49至54个氨基酸残基(cdr-l2)、seq id no:1的第91至96个氨基酸残基 (cdr-l3)、seq id no:2的第30至33个氨基酸残基(cdr-h1)、seq id no:2的第50至59个氨基酸残基(cdr-h2)以及序列编号2的第98至106个氨基酸残基 (cdr-h3)。
21.根据本公开内容多种实施例,所述抗纤维素抗体是单链可变片段 (scfv)或单域抗体(sdab)。
22.在其他视需要而采用的实施例中,所述轻链可变区以及重链可变区可透过如seq id no:16所示的亲水性连接物而连接。
23.在另一方面,本公开内容是关于一种多肽,其包含本公开内容的上述方面/实施例所述的抗纤维素抗体。当可理解,利用此种多肽来治疗血栓的方法,亦属于本公开内容的方面中。
24.根据本公开内容的实施例,所述多肽包含一抗纤维素抗体与一人类组织性血浆蛋白原活化因子(hu-tpa)的丝氨酸蛋白酶部分,其中抗纤维素抗体与人类纤维素的结合亲和力比其与人类纤维蛋白原的结合亲和力高十倍。或者是或额外地,所述多肽与人类纤维素的结合亲和力优于与人类纤维素的结合亲和力hu-tpa与人类纤维素的结合亲和力。又或者是或额外地,所述多肽与动物体内的血清半衰期比瑞替普酶长。
25.具体来说,tpa的丝氨酸蛋白酶部分可直接连接到抗纤维素抗体的 n-或c-端,或透过两者间的连接序列而间接连接。
26.根据本公开内容视需要而采用的实施例,所述hu-tpa的丝氨酸蛋白酶部分为瑞替普酶。
27.于某些实施例中,所述抗纤维素抗体是人类抗体或人源化抗体。
28.根据本公开内容一些实施例,所述多肽具有如seq id no:11或12 或14所示的氨基酸序列。
29.在参阅下文实施方式后,本发明所属技术领域中具有通常知识者当可轻易了解本发明的基本精神及其他发明目的,以及本发明所采用的技术手段与实施方式。
【附图说明】
30.为让本发明的上述与其他目的、特征、优点与实施例能更明显易懂,所附图式的说明如下。
31.图1a是对人类纤维素专一的噬菌体呈现scfv的病毒效价分析结果;图1b是对人类纤维素专一的噬菌体呈现的d10 scfv的单菌落elisa分析结果。
32.图2是纯化的对人类纤维素专一抗体102-10以及3d5的elisa分析结果。
33.图3是纯化的重组瑞替普酶-(3d5 v
l-弹性连接物-v
h scfvα纤维素)以及瑞替普酶-(102-10scfvα纤维素)的sds-page分析结果。
34.图4是纯化的重组瑞替普酶-(3d5 v
l-218-v
h scfvα纤维素)的 sds-page分析结果。
35.图5a是储存三天或六天后的纯化的重组瑞替普酶-(3d5 scfv)的 sds-page分析结果;图5b是储存一个月后的纯化的重组瑞替普酶-(3d5 scfv) 的sds-page分析结果;图5c是储存三天或六天后的纯化的重组瑞替普酶
‑ꢀ
(3d5 scfv)的elisa分析结果。
36.图6是瑞替普酶-(3d5 scfv)多肽对人类纤维素以及对经人类第 xiiia型凝血因子处理的交联纤维素的elisa分析结果。
37.图7是重组瑞替普酶-(3d5 scfv)多肽对小鼠纤维素结合能力的 elisa分析结果。
38.图8是重组瑞替普酶-(3d5 scfv)多肽在存有游离纤维蛋白原时,对人类纤维素的结合能力的elisa分析结果。
39.图9显示重组瑞替普酶-(3d5 scfv)多肽在pbs或人类血清中的血栓溶解活性。
40.图10显示重组瑞替普酶-(3d5 scfv)多肽在最终浓度1mm时的血栓溶解活性。
41.图11显示重组瑞替普酶-(3d5 scfv)多肽的标的效果。
42.图12显示重组瑞替普酶-(3d5 scfv)的剂量相依血栓溶解活性。
43.图13a至13c显示瑞替普酶-(3d5 scfv)对人类血栓的血栓溶解活性。
44.图14a以及14b显示瑞替普酶-(3d5 scfv)对猴子血栓的血栓溶解活性。
45.图15的柱状图显示瑞替普酶-(3d5 scfv)与阿替普酶对人类纤维素的结合亲和力。
46.图16a以及16b显示瑞替普酶-(3d5 scfv)、瑞替普酶与阿替普酶对人类血栓的血栓溶解活性。
47.图17a以及17b显示瑞替普酶-(3d5 scfv)与阿替普酶的蛋白分解活性。
48.图18a以及18b为经瑞替普酶-(3d5 scfv)或瑞替普酶处理的小鼠的 ivis影像图;图18c的折线图显示瑞替普酶-(3d5 scfv)的标的效果。
49.图19显示阿替普酶、瑞替普酶与重组瑞替普酶-(3d5 scfv)多肽的药动学图谱。
50.图20显示阿替普酶与重组瑞替普酶-(3d5 scfv)多肽的药动学图谱。
51.图21a是纯化的重组(3d5 v
l-(g4s)3-v
h scfvα纤维素)-瑞替普酶多肽的sds-page分析结果;图21b显示重组3d5 v
l-(g4s)3-v
h scfvα纤维素)
‑ꢀ
瑞替普酶多肽对人类纤维素的结合力的elisa分析结果。
52.图22显示重组(3d5 scfv)-瑞替普酶多肽对人类血栓的剂量相依血栓溶解活性。
53.根据惯常的作业方式,图中各种特征与元件并未依比例绘制,其绘制方式是为了以最佳的方式呈现与本发明相关的具体特征与元件。此外,在不同图式间,以相同或相似的
元件符号来指称相似的元件/部件。
【具体实施方式】
54.为了使本公开内容的叙述更加详尽与完备,下文针对了本发明的实施方面与具体实施例提出了说明性的描述;但这并非实施或运用本发明具体实施例的唯一形式。实施方式中涵盖了多个具体实施例的特征以及用以建构与操作这些具体实施例的方法步骤与其顺序。然而,亦可利用其他具体实施例来达成相同或均等的功能与步骤顺序。
55.为了便于说明,此处整理了说明书、实施例与附随申请专利范围中所用的某些词汇。除非本说明书另有定义,此处所用的科学与技术词汇的含义与本发明所属技术领域中具有通常知识者所理解与惯用的意义相同。
56.在不和上下文冲突的情形下,本说明书所用的单数名词涵盖该名词的复数型;而所用的复数名词时亦涵盖该名词的单数型。此外,在本说明书与申请专利范围中,“至少一”与“一或更多”等表述方式的意义相同,两者都代表包含了一、二、三或更多。更有甚者,在本说明书与申请专利范围中,“a、b及c其中至少一者”、“a、b或c其中至少一者”以及“a、b和/或c其中至少一者”系指涵盖了仅有a、仅有b、仅有c、a与b两者、b与c两者、a与 c两者、以及a、b与c三者。
57.虽然用以界定本发明较广范围的数值范围与参数皆是约略的数值,此处已尽可能精确地呈现具体实施例中的相关数值。然而,任何数值本质上不可避免地含有因个别测试方法所致的标准偏差。在此处,“约”通常系指实际数值在一特定数值或范围的正负10%、5%、1%或0.5%之内。或者是,“约”一词代表实际数值落在平均值的可接受标准误差之内,视本发明所属技术领域中具有通常知识者的考量而定。当可理解,除了实验例之外,或除非另有明确的说明,此处所用的所有范围、数量、数值与百分比(例如用以描述材料用量、时间长短、温度、操作条件、数量比例及其他相似者)均经过“约”的修饰。因此,除非另有相反的说明,本说明书与附随申请专利范围所揭示的数值参数皆为约略的数值,且可视需求而更动。至少应将这些数值参数理解为所指出的有效位数与套用一般进位法所得到的数值。在此处,将数值范围表示成由一端点至另一端点或介于二端点之间;除非另有说明,此处所述的数值范围皆包含端点
58.本公开内容一般系关于一种抗纤维素抗体以及包含此抗纤维素抗体的多肽。具体来说,上述抗纤维素抗体可作为所述多肽的标的元件(t),而多肽更包括一效应元件(e),因此,在本说明书中有时将此种多肽称为“t-e分子”、“t-e药物”或“t-e药品”。
59.虽然在此处利用“第一”、“第二、“第三”等词汇来描述多种元件、部件、区域和/或区段,这些元件(以及部件、区域和/或区段)不受上述修饰词的限制。此外,除非上下文有明示的说明,使用这些序数并未隐含序列或顺序。反之,这些词汇仅是用来区分各元件。因此,亦可将下文所述的第一元件命名为第二元件,而不会悖离例示性实施方式所揭示的内容。
60.在此处,“连接(link)”、“耦接(couple)”以及“复合(conjugate)”等词可互换使用,且都是用来指称透过直接或间接的连接关系,将两个元件连接在一起。
[0061]“多肽(polypeptide)”一词在此系指具有至少两个氨基酸残基的聚合物。一般来说,多肽包含2到200个氨基酸残基;在较佳的情形中,是2到50个残基。在本说明书中所提及的氨基酸序列涵盖了此种序列的l-、d-或β-氨基酸等形式。多肽亦包括氨基酸聚合物,其中
有一或多个氨基酸残基是与一天然氨基酸相应的人工化学类似物,当然也包括天然产生的氨基酸聚合物。此外,此一词汇亦涵盖以多肽链或其他方式连接的氨基酸,上述其他方式如经修饰的连接(modified linkage),譬如以α-酯(α-ester)、β-酯(β-ester)、硫酰胺(thioamide)、磷酰胺(phosphoramide)、氨基甲酸酯(carbomate)、羟基酯(hydroxylate)键、以及与其相似者来取代多肽键。
[0062]
于一些实施方式中,本发明范围亦涵盖了其他相较于所述序列具有保守性置换的蛋白。于多种实施方式中,有一、二、三、四或五个不同的残基经过置换。在此处,“保守性置换(conservative substitution)”一词是指所述氨基酸置换不会明显地改变分子活性(譬如生物或功能活性和/或专一性)。一般来说,保守性氨基酸置换是利用另一种具有相似化学性质(如电荷或疏水性)的氨基酸来取代某一氨基酸。某些保守性置换包括“类似物置换”,亦即以非标准(如罕见或合成等)氨基酸来取代标准氨基酸,而上述非标准氨基酸和被取代的原有氨基酸之间的差异极小。可由标准氨基酸经人工修饰而在不会大幅改变原有氨基酸结构的前提下,得到所述的氨基酸类似物,譬如异构物或代谢前驱物等皆属之。
[0063]
于一些实施方式中,本案的范围亦涵盖和任何所述序列具有至少 80%序列相似度的任何序列,上述序列相似度较佳为至少85%或90%、更佳为至少95%或98%。
[0064]
此处针对多肽序列所述的“氨基酸序列相似度百分比(percentage (%)amino acid sequence identity)”系指候选序列的氨基酸残基与参考多肽序列的氨基酸残基完全相同的百分比;于进行上述比对时,可将所述的候选多肽片段与所述的特定多肽片段并排,并于必要时引入间隙,以使二序列形成最高的序列相似度;在计算相似度时,保守性置换的氨基酸残基视为不同的残基。相关领域已有多种方法可用以进行上述并排,譬如可公开取得的软体如blast、blast-2、align或megalign(dnastar)等。本发明所属技术领域中具有通常知识者在进行并排时,可选择适当的参数与计算方式,以得到最佳的排列方式。在本说明书中,二多肽序列间的序列比较是采用美国国家生物科技资讯中心(nation center for biotechnology information,ncbi)所提供的蛋白质-蛋白质 blast分析资料库blastp来进行。候选多肽序列a相较于参考多肽序列b的氨基酸序列相似度(在本说明书中亦称之为多肽序列a与多肽序列b具有特定百分比 (%)的氨基酸序列相似度)的计算方式如下:其中x是利用blast序列并排程式对序列a、b进行排列后所得到的相同氨基酸残基数目(identical matches),而y是a、b二序列中较短者的氨基酸残基总数。
[0065]“聚乙二醇化氨基酸(pegylated amino acid)”一词在此系指带有一个氨基(amino group)与一个羧基(carboxyl group)的聚乙二醇(polyethyleneglycol,peg)链。一般来说,聚乙二醇化氨基酸的结构式为nh
2-(ch2ch2o)n‑ꢀ
cooh。在本公开内容中,n值介于1到20之间;较佳是介于2至12。
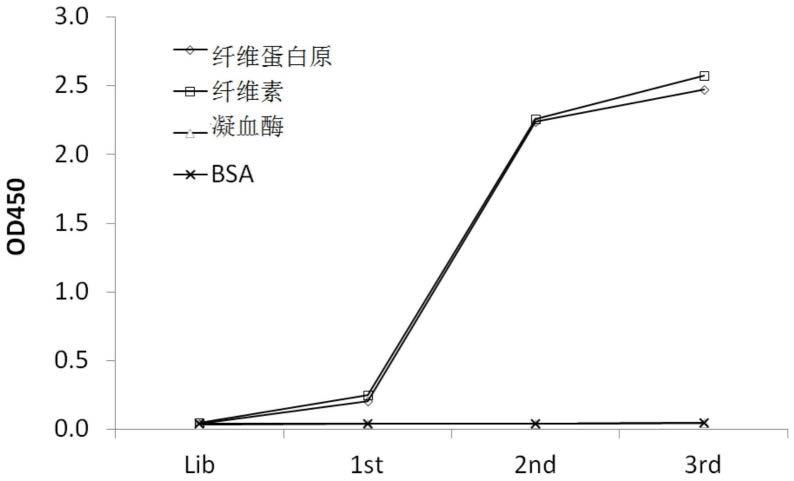
[0066]
在此处一多肽的“端”系指位于该多肽n-或c-端点的氨基酸残基。在描述一聚合物(譬如此处所述的聚乙二醇)的组成单元时时,“端”则是指在聚合物骨架末端的部分。在本说明书与申请专利范围中,“自由端”一词是用来指称并未与另一个分子形成化学键结的末端氨基酸残基或构成单元。
[0067]
在本说明书与申请专利范围中,“抗体(antibody)”一词应以广义方式解释,且包含完整组装的抗体、可和抗原结合的抗体片段,譬如抗原结合片段(fab/fab’)、f(ab’)2片段(具有彼此以双硫键连接的两个fab部分)、可变片段 (variable fragment,fv)、单链可变片段(scfv)、双专一性单链可变片段(bi-scfv)、单域抗体(single-domain antibodies,sdab),奈米抗体(nanobodies)、单抗体 (unibodies)以及双体抗体(diabodies)。“抗体片段”包含完整抗体的一部分,较佳为包括完整抗体的抗原结合区域或可变区域。在典型的例子中,“抗体”系指实质上由免疫球蛋白基因或其片段所编码的一或多种多肽所组成的蛋白质。习知的免疫球蛋白基因包括κ(kappa)、λ(lambda)、α(alpha)、γ(gamma)、δ(gamma)、ε(epsilon)与μ(mu)等恒定区基因(constant region gene)、以及无数的免疫球蛋白可变域基因(variable domain genes)。轻链通常归类为κ(kappa)或λ (lambda)。重链通常归类为γ(gamma)、μ(mu)、α(alpha)、δ(gamma)或ε(epsilon),基于这些结构,定义出了以下类型的免疫球蛋白:igg、igm、iga、igd以及ige。典型的免疫球蛋白抗体结构是一种四聚物(tetramer)。每一个四聚物是由两条相同的多肽链所组成,且每一对分别有一“轻”链(约25kda)与一“重”链(约50
‑ꢀ
70kda)。每一链的n-端界定了一个可变区域,包含约100至110个或更多的氨基酸,其主要负责抗原辨识。可变轻链区域(light-chain variable domain,v
l
)与可变重链区域(heavy-chain variable domain,vh)等词就是分别指上述的轻链与重链。根据本公开内容的实施方式,可藉由改变天然抗体或利用重组dna方式重新合成上述抗体片段。于本公开内容一些实施方式中,上述抗体和/或抗体片段可具有双专一性,且可有多种不同的构形。举例来说,双专一性抗体可包含二个不同的抗原结合部位(可变区域)。于多种实施方式中,可利用融合瘤技术或重组dna技术来制备双专一性抗体。于一些实施方式中,双专一性抗体对至少两种不同的表位(epitope)有结合专一性。
[0068]“专一地结合(specifically bind)”一词在此处系指抗体或其抗原结合片段能够和抗原结合的能力,上述结合的解离常数(dissociation constant,kd) 小于约1
×
10-6
m、1
×
10-7
m、1
×
10-8
m、1
×
10-9
m、1
×
10-10
m、1
×
10-11
m或1
×
10-12
m;或者是或额外地,相较于其对于非专一性抗原的结合亲和力,上述抗体或其抗原结合片段与抗原结合的亲和力为两倍以上。
[0069]“治疗(treatment)”一词系指预防性(如,预防用药)、疗愈性或缓和性的处置,藉以达到所欲的药学和/或生理学效果;而治疗的行为在此包括上述预防性、疗愈性或缓和性的处置。具体来说,治疗在此系指对于可能患有一医疗疾患(如,血栓)或与此疾患相关的症状、由此疾患所生的疾病或异常、或易于罹患此疾患的个体施用或投予本发明提出的多肽或包含此多肽的药学组合物,以期能部分地或完全地缓和、改善、减轻特定异常和/或病症的一或多种症状或特征,或是延缓其发生、阻碍其进展、减轻其严重性和/或减低发生率。亦可对尚未表出现疾病、异常和/或病症征兆的个体和/或出现早期征兆的个体进行治疗,以期降低发展出与该疾病、异常和/或病症相关的病理变化的风险。
[0070]
在此处,“有效量(effective amount)”一词系指本发明分子多肽的用量足以招致所欲的治疗反应。药剂的有效量不必然能够治愈疾病或病症,但能够延缓、阻碍或防止该疾病或病症的发生,或是可缓减与疾病或病症相关的病征。可将治疗有效量可分成一、二或更多剂,而以适当的剂型在指定期间内施用一次、二次或更多次。具体的治疗有效量取决于多种因素,例如欲治疗的特定状况、个体的生理条件(如,个体体重、年龄或性别)、接受治疗的
个体类型、治疗持续时间、并行治疗(如果有的话)的本质以及所用的具体配方和化合物或其衍生物的结构。举例来说,可将治疗有效量表示成活性成分的总重量,譬如以克、毫克或微克来表示;或表示成活性成分重量相对于体重的比例,譬如表示为每公斤体重多少毫克(mg/kg)。
[0071]
所述“施用(application)”与“投予(administration)”等词在此可交替使用,其系指将本发明的多肽或药学组合物提供给需要治疗的个体。
[0072]“个体(subject)”或“患者(patient)”等词在此可交互使用,且是指可接受本公开内容的多肽、药学组合物和/或方法处置的动物(包含人类)。除非另有指明,“个体”或“患者”一般包含雄性与雌性。“个体”或“患者”包含任何可因本公开内容的处置而获益的哺乳类动物。所述“个体”或“患者”的例示包含,但不限于:人类、大鼠、小鼠、天竺鼠、猴子、猪、山羊、牛、马、狗、猫、鸟和禽类。在一实例中,所述患者为人类。所述哺乳类动物涵盖哺乳动物纲的所有成员,包括人类、灵长类动物、家畜和农畜(如兔子、猪、绵羊和牛)、动物园动物或竞赛用动物、宠物,以及啮齿类动物(如,小鼠和大鼠)。“非人类哺乳动物”一词则涵盖除了人类以外的所有哺乳动物纲成员。
[0073]
本公开内容至少部分是基于鉴别出一种纤维素抗体,其与纤维素 (特别是,纤维素血栓)的结合专一性优于与纤维蛋白原的结合专一性。根据本公开内容某些实施例,所述抗纤维素抗体与人类纤维素的结合亲和力比起与人类纤维蛋白原的结合亲和力高了十倍。因此,此处提出的抗纤维素抗体可作为一种标的元件,来建构一种t-e分子,使其可聚集在纤维素血栓周围的区域。另一方面,所述t-e分子可包含一或更多种效应元件,譬如能够使病理性血栓溶解的元件。如此一来,所述t-e药物可被递送至目标细胞、目标组织或器官,且其在这些部位的比例相对高于在血液循环、淋巴系统以及其他细胞、组织和器官中的比例。当实现上述情境时,即可提升t-e药物的疗效,且其副作用与毒性的数目和严重性都会降低。相较于不含标的元件的药物,以t-e分子的形式来投递药物时,发挥疗效的效应物所用的浓度可能较低。因此,可在较低的剂量下施用治疗用的效应物而不会减损其有效性,但却能同时降低其副作用与毒性。
[0074]
有鉴于此,本公开内容的一方面是关于一种抗纤维素抗体,其能够鉴别纤维素血栓与纤维蛋白原。虽然先前已开发出其他的抗纤维素抗体,这些现有的抗纤维素抗体无法有效地鉴别纤维素血栓与纤维蛋白原,故不适用于临床开发应用。因此,产制出能够有效鉴别纤维素血栓与纤维蛋白原的单株抗体实乃开发治疗病理性血栓的t-e药物领域的重大突破。
[0075]
根据本公开内容的实施例,所述抗纤维素抗体包含一轻链可变区 (v
l
)及一重链可变区(vh),两者分别具有如seq id no:1、2、seq id no:17、 18、seq id no:19、20或seq id no:21、22所示的氨基酸序列。根据某些实施方式,v
l
区域与vh区域各自包含三个互补决定区(cdr)。具体来说,此处提出的抗纤维素抗体的cdr-l1、cdr-l2与cdr-l3的氨基酸序列分别对应至seqid no:1的第30至32个氨基酸残基、第49至54个氨基酸残基以及第91至96个氨基酸残基;而此处提出的抗纤维素抗体的cdr-h1、cdr-h2与cdr-h3的氨基酸序列分别对应至seq id no:2的第30至33个氨基酸残基、第50至59个氨基酸残基以及第98至106个氨基酸残基。
[0076]
根据本公开内容多种实施例,所述抗纤维素抗体可以是完整抗体或包含抗原结合
区域或可变区域(如,上述cdr)的抗体片段。举例来说,所述抗体可以是单链可变片段(scfv)或单域抗体(sdab)。然而,本公开内容不限于此。
[0077]
于某些视需要而采用的实施例中,抗纤维素抗体包含如seq id no:1所示的轻链可变区以及如seq id no:2所示的重链可变区。
[0078]
根据本公开内容某些视需要而采用的实施例,可在v
l
与vh序列间或在vh与v
l
序列间加入一连接物序列,以提升所述scfv的半衰期及/或结合亲和力。举例来说,所述连接物序列可以是一亲水性序列。于某些视需要而采用的实施例中,所述抗纤维素抗体可以是具有seq id no:3或5所示的氨基酸序列的scfv。
[0079]
本公开内容的另一方面是关于一种多肽。具体来说,所述多肽为t
‑ꢀ
e药物,其包含标的元件(如,本公开内容上述方面/实施例所述的抗纤维素抗体) 以及用以治疗血栓的效应元件(如,组织性血浆蛋白原活化因子)。因此,本公开内容的范围亦涵盖利用所述多肽来治疗血栓的方法。
[0080]
根据本公开内容多种实施例,所述多肽包含抗纤维素抗体与连接到抗纤维素抗体n-或c-端的人类组织性血浆蛋白原活化因子(hu-tpa)的丝氨酸蛋白酶部分,上述连接可以是直接连接或透过一连接物而间接连接。
[0081]
hu-tpa的丝氨酸蛋白酶部分的一种例示为瑞替普酶。其他与瑞替普酶均等的多肽亦属于本公开内容的范围。
[0082]
于某些实施例中,抗纤维素抗体与hu-tpa的丝氨酸蛋白酶部分是直接连结,而在其他情形中,两者透过一中间序列而键结连接。根据本公开内容一些实施例,在抗纤维素抗体与hu-tpa的丝氨酸蛋白酶部分间加入一亲水性连接物序列,以利多肽和血栓中的纤维素筛状架构连接。举例来说,当hu-tpa 的丝氨酸蛋白酶部分连接到抗纤维素抗体的n-端时,所述多肽的氨基酸序列如 seq id no:11或12所示。或者是,当hu-tpa的丝氨酸蛋白酶部分连接到抗纤维素抗体的c-端时,所述多肽的氨基酸序列如seq id no:14所示。
[0083]
根据某些实施方式,此处提出的多肽和人类纤维素的结合能力优于hu-tpa。或者是或额外地,此处提出的多肽在动物体内的血清半衰期优于瑞替普酶。
[0084]
实验例
[0085]
实验例1:制备人类纤维素涂覆盘以进行噬菌体呈现筛选
[0086]
制备涂覆纤维蛋白原的孔盘时,将人类纤维蛋白原(sigma)的pbs 溶液以10μg/100μl每孔的量加入至maxi皂盘(nunc)中,密封平底盘并在4℃下放置一晚。
[0087]
每一纤维素盘的制备方式如下。将100μl的tris缓冲溶液(tbs,含最终浓度1.0u/ml凝血酶(sigma)、2mm cacl2与7mm l-半胱氨酸(merck))加入纤维蛋白原盘的孔中,之后以tbs冲洗,再以5%脱脂牛奶的磷酸盐缓冲溶液 (pbst,含0.1%tween-20)处理,以使反应中止。
[0088]
实验例2:构建与选择对人类纤维素专一的噬菌体呈现scfv
[0089]
经双方协议,由台湾地区“中央研究院”基因体研究中心(台北,中国台湾)杨安绥博士研究室取得带有对人类纤维素专一的scfv的噬菌体株。此scfv抗体库的框架序列(framework sequence)衍生自g6抗-vegf fab(蛋白库编码:2fjg),将其选殖到噬质体载体pcantab5e(ge healthcare)的限制位sfii与noti间,上述噬质体载体带有氨苄青霉素(ampicillin)抗性基因、lacz启动子、有助于将scfv片段分泌至培养上清液中的pelb引导
序列(leader sequence)以及用于侦测的e-标签。基于寡核苷定点突变(oligonucleotide-directed mutagenesis)技术将scfv模板的vh与v
l
域多样化;将每一可变区域中的三个cdr同时多样化。使用带有超过 109个选殖株的scfv抗体库在人类纤维素上进行筛选。
[0090]
利用涂覆有经经凝血酶处理的人类纤维素(每孔1μg/100μl pbs) 的maxisorp 96(nunc)孔盘来淘选抗-纤维素抗体。简言之,在室温下将带有涂覆溶液的孔盘摇晃2小时,以使人类纤维素涂覆于孔盘上。之后,在室温下以阻隔缓冲液处理经纤维素涂覆的孔盘,阻隔缓冲液是以5%脱脂牛奶溶于pbst(带有 0.1%tween-20),处理时间1小时。将重组噬菌体以阻隔缓冲液稀释到8x10
11
菌落形成单元(colony-forming unit,cfu)/ml的浓度后,加入纤维素涂覆的孔盘中,并温和摇晃1小时。接着以pbst剧烈地清洗孔盘十次,再以pbs冲洗六次,以移除未专一结合的噬菌体。利用0.1m hcl/甘氨酸缓冲液(ph 2.2)来冲提结合的噬菌体,并立刻以2m的tris缓冲液(ph 9.0)中和冲提液。利用大肠杆菌品系 er2738(od
600
=~0.6)在37℃下进行噬菌体感染,处理时间30分钟;利用氨苄青霉素处理30分钟,以移除未受感染的大肠杆菌。在氨苄青霉素处理后,加入带有康霉素抗性的辅助噬菌体m13ko7继续培育1小时。从大肠杆菌培养物中选择可被辅助噬菌体拯救的噬菌体,将其在带有康霉素的环境中于37℃下剧烈摇晃一晚,以扩增所选的噬菌体。在peg/nacl中使扩增的噬菌体析出,之后再重新悬浮于pbs中,以用于下一次的选择-扩增循环。重复上述选择-扩增循环,以在纤维素上连续进行三次淘选。
[0091]
依先前流程制备经纤维素处理的培养盘(每孔洞1微克/100微升)。利用涂覆有纤维素的培养盘来淘选抗-纤维素抗体。简言之,在室温下以阻隔缓冲液(5%脱脂牛奶溶于带有0.1%tween-20的pbst)处理经纤维素涂覆的孔盘,处理时间1小时。将重组噬菌体以阻隔缓冲液稀释到8x10
11 cfu/ml的浓度后,加入纤维素涂覆的孔盘中,并温和摇晃1小时。接着以pbst剧烈地清洗孔盘十次,再以pbs冲洗六次,以移除未专一结合的噬菌体。利用0.1m hcl/甘氨酸缓冲液(ph 2.2)来冲提结合的噬菌体,并立刻以2m的tris缓冲液(ph 9.0)中和冲提液。利用大肠杆菌品系er2738(od
600
=~0.6)在37℃下进行噬菌体感染,处理时间30分钟;利用氨苄青霉素处理30分钟,以移除未受感染的大肠杆菌。在氨苄青霉素处理后,加入带有康霉素抗性的辅助噬菌体m13ko7继续培育1小时。从大肠杆菌培养物中选择可被辅助噬菌体拯救的噬菌体,将其在带有康霉素的环境中于37℃下剧烈摇晃一晚,以扩增所选的噬菌体。在peg/nacl中使扩增的噬菌体析出,之后再重新悬浮于pbs中,以用于下一次的选择-扩增循环。重复上述选择-扩增循环,以在纤维素上连续进行三次淘选。
[0092]
经噬菌体感染的er2738菌落盘于系列稀释后,计算其数目与噬菌体效价,以得到每一淘选回合后每毫升的输出效价(output titer/ml;cfu/ml)。经过三回合淘选后,噬菌体输出效价由1.6e+04cfu/孔提升了超过1千倍而达到3.2e+07cfu/孔。图1a显示每一回合的噬菌体输出/输入效价比。y轴显示每一淘选回合的噬菌体输出/输入效价比。经过三回合的淘选后,阳性菌落的比例明显提升。相较于第一回合,第三回合的输出/输入效价比提高了100倍,而结合的菌落也逐渐成为抗体库中的优势族群。
[0093]
在一般的选择程序中,于涂覆人类纤维素的elisa孔盘上进行三回合的抗原淘选后,约有80%与纤维素结合的噬菌体粒子在elisa分析中可专一地与所涂覆的纤维素结合。
[0094]
实验例3:对人类纤维素专一的噬菌体呈现人类scfv的单菌落 elisa分析
[0095]
大肠杆菌品系er2738经单一菌落噬菌体感染后,分别获取了各噬菌体的噬质体内
的所选scfv基因;在深孔中加入2yt培养液(含16g/l胰化蛋白、 10g/l酵母抽出物以及5g/l nacl;ph 7.0)以及100μg/ml氨苄青霉素,在37℃下摇晃,以将这些大肠杆菌培养到中对数期(mid-log phase)。当培养液的od
600
达到1.0后,加入iptg,使其最终浓度为1μg/ml。在剧烈摇晃、37℃下将孔盘培育一晚;其后,以4,000g在4℃下将孔盘离心15分钟。
[0096]
利用elisa来进行可溶性scfv结合试验。简言之,将maxisorp 96
‑ꢀ
孔盘(nunc)涂覆纤维素(每孔0.5μg/100μl pbs)或人类纤维蛋白原(作为阴性对照组),在4℃下摇晃18小时。在以300μl的阻隔缓冲液处理1小时后,将100μl 含可溶性scfv的上清液和100μl的阻隔缓冲液混合,而后将此混和物加入经涂覆的孔盘再处理1小时。将山羊抗-e-标签抗体(与hrp复合,1:4000,型录编号 ab19400,abcam)加入孔盘处理1小时。将tmb基质(每孔50μl)加入孔盘,并于加入1n hcl(每孔50μl)使反应停止后,测量在450nm下的吸光值。测量每孔的od
450
,以决定每一scfv株对纤维素或纤维蛋白原的结合亲和力。对于每一 scfv株,将其对于纤维素的od
450
值除以其对于纤维蛋白原的od
450
值,以得到 od
450
比,此一数值代表所述scfv对纤维素相对于纤维蛋白原的选择结合。在单一菌落elisa分析中,经三轮淘选后,共选出192株噬菌体株进行本实验例的分析。其中有12株scfv对纤维素结合的od
450
比大于10,进一步对编码这10株scfv 的基因进行dna定序,并识别出6种不同的dna序列。图1b是scfv株d10的 elisa分析结果。scfv株d10和人类纤维素结合的od
450
为1.3,其氨基酸序列如 seq id no:4所示。
[0097]
利用上文所述的方法,再额外进行了一轮选择。本次实验中,在经过三回合淘选后,噬菌体输出效价由9.3e+04cfu/孔提升了超过1千倍而达到4.5e+07cfu/孔。相较于第一回合,第三回合的输出/输入效价比提高了130倍,而结合的菌落也逐渐成为抗体库中的优势族群。在第三轮逃选后,选出192株噬菌体株进行本实验例的分析。其中有18株scfv对纤维素结合的od
450
比大于 10,进一步对编码这18株scfv的基因进行dna定序,并识别出4种不同的dna 序列。这四株scfv的od
450
分析资料与序列摘要整理于下表1。表1
ꢀꢀ
3c28f23d57a3od
450
_纤维素0.75880.52730.82940.4285od
450
_纤维蛋白原0.01170.03660.00220.0209od
450
比64.854714.407137720.50239v
l
seq id no:17seq id no:19seq id no:1seq id no:21vhseq id no:18seq id no:20seq id no:2seq id no:22
[0098]
后续实验分析中,使用了其中具有最高od
450
比的3d5 scfv,噬菌体呈现的3d5 scfv的氨基酸序列如seq id no:5所示。
[0099]
实验例4:重组抗纤维素102-10抗体与抗纤维素3d5抗体的制备
[0100]
将对人类纤维素专一抗体3d5的v
l
与vh片段置于pg1k表达盒中,以进行表达。全长抗体的轻链与重链的氨基酸序列分别如seq id no:8、 9所示。
[0101]
将对人类纤维素专一抗体102-10(日本专利申请公开案第2012-72 号)的v
l
与vh片段置于pg1k表达盒中,以进行表达。全长抗体的轻链与重链的氨基酸序列分别如seq id no:6、7所示。
[0102]
于利用哺乳类动物表达系统来制备重组抗体时,使用以 expi293f
tm
细胞系为基础
的过度表达系统来制备。此系统使用expifectamine
tm 293转染试剂盒(life technologies,carlsbad,usa),其包含expi293f
tm
细胞株、阳离子脂质系expifectamine
tm 293试剂、expifectamine
tm 293转染强化剂1与2、以及表达系统所用的培养基(gibco,new york,usa)。
[0103]
将expi293f细胞以每毫升2.0
×
106个活细胞的密度播于expi293f 表达培养基中,并维持18至24小时后进行转染,以确保进行转染时细胞处于分裂状态。进行转染时,将带有7.5
×
108个细胞的255毫升培养基置于2-l艾氏烧瓶中,并加入expifectamine
tm 293转染试剂。将转染细胞在37℃下以定轨摇动器 (125rpm)培育16至18小时;之后在烧瓶中加入expifectamine
tm 293转染强化剂 1与强化剂2,并继续培育5到6天。收集培养上清液,并使用蛋白a亲和力层析法纯化培养基中的抗体。
[0104]
实验例5:102-10抗体与3d5抗体对人类纤维蛋白原、纤维素以及经人类第xiiia型凝血因子处理的交联纤维素的结合能力的elisa分析。
[0105]
进行elisa分析,以探讨102-10抗体与3d5抗体对人类纤维蛋白原、纤维素以及交联纤维素的结合能力。
[0106]
于制备纤维素盘时,将人类纤维蛋白原(sigma)的pbs溶液以100 μl/孔的量加入至96孔聚苯乙烯微孔盘中,密封孔盘并在4℃下放置一晚。
[0107]
每一纤维素盘的制备方式如下。将100μl的tbs(含1.0u/ml凝血酶(sigma)、2mm cacl2与7mm l-半胱氨酸(sigma))加入纤维蛋白原孔盘的孔中,之后以tbs冲洗,再以5%脱脂牛奶的磷酸盐缓冲溶液(pbst,含0.1% tween-20)处理,以使反应中止。反应终止后,将100μl抗体加入每一孔中,再将孔盘于室温下培育1小时。之后将孔盘冲洗三次,将复合hrp的蛋白l稀释至 1/5000后加入每孔中,再次于室温下培育1小时。接着将孔洞冲洗三次,并加入 100μl的tmb底物缓冲液。5分钟后,以1m hcl使显色反应停止。以微量盘式分析仪测量在450nm下的吸光值(od)。
[0108]
elisa分析结果如图2所示,由图中可以看出,3d5抗体和人类纤维素或交联纤维素的结合能力优于102-10抗体的结合能力。
[0109]
实验例6:带有瑞替普酶与v
l-218连接物-vh配置的对人类纤维素专一的102-10scfv的多肽的制备
[0110]
透过弹性连接物(seq id no:15,下称:弹性连接物)将瑞替普酶接合到102-10scfv的n-端,以建构(瑞替普酶)-102-10scfv多肽。102-10scfv的配置为v
l-连接物-vh,其中两个结构域透过亲水性218连接物gstsgsgkpgsgegstkg(seq id no:16)而结合。重组多肽的氨基酸序列如 seq id no:10所示。
[0111]
此处提出的(瑞替普酶)-(102-10scfvα纤维素)多肽的结构如下所示。
[0112]
实验例7:利用expi293f过表达系统制备与纯化重组(瑞替普酶)
‑ꢀ
(scfvα纤维素)
[0113]
于本实验例中,将编码scfv的序列置于pcdna3表达盒中。利用 expi293f胞系表达所建构的基因以及纯化所表达的多肽的步骤,如上文实验例所述。
[0114]
利用sds-page来鉴定此一新的构建体。图3的10%非还原sda
‑ꢀ
page分析结果显示重组(瑞替普酶)-(102-10scfvα纤维素)蛋白(第2道)的主要条带位于约71kda,与期望大小相符。
[0115]
实验例8:带有瑞替普酶与v
l-弹性连接物-vh配置的对人类纤维素专一的3d5 scfv的多肽的制备
[0116]
透过弹性连接物将瑞替普酶接合到对人类纤维素专一的3d5 scfv 的n-端,以建构重组瑞替普酶-(3d5 v
l-弹性连接物-v
h scfvα纤维素)蛋白。
[0117]
所述scfv的配置为v
l-连接物-vh,其中两个结构域透过弹性连接物而结合。重组多肽的氨基酸序列如seq id no:11所示。利用sds-page来鉴定此一新的构建体。图3的10%非还原sda-page分析结果显示样本(第1道)的主要条带的期望大小约为71kda;然而,在约55kda处亦发现预期外的降解产物。
[0118]
实验例9:带有瑞替普酶与v
l-218连接物-vh配置的对人类纤维素专一的3d5 scfv的多肽的制备
[0119]
透过弹性连接物将瑞替普酶接合到对人类纤维素专一的3d5 scfv 的n-端,以建构重组瑞替普酶-(3d5 v
l-218-v
h scfvα纤维素)蛋白(下称:瑞替普酶-(3d5 scfv))。
[0120]
所述scfv的配置为v
l-连接物-vh,其中两个结构域透过亲水性 218连接物而结合。重组多肽的氨基酸序列如seq id no:12所示。利用sds
‑ꢀ
page来鉴定此一新的构建体。图4的10%非还原sda-page分析结果显示此一新颖构建体的重组链(第1、2道)的大小约为71kda,与期望大小相符。由于本实验例制备的瑞替普酶-(3d5 scfv)比其先前实验例所制备的瑞替普酶-(3d5 v
l-弹性连接物-v
h scfvα纤维素)多肽更为安定,下文实验例中利用本实验例的瑞替普酶-(3d5 scfv)进行后续分析。
[0121]
实验例10:利用expi293f过表达系统制备重组瑞替普酶-igg4.fc 蛋白
[0122]
将瑞替普酶透过弹性绞链区域接合到igg4.fc的ch2结构域的n
‑ꢀ
端,以建构瑞替普酶-ch2-ch3(人类γ4)重组链。所述igg4.fc多肽的重组链的氨基酸序列如seq id no:13所示。
[0123]
利用expi293f胞系表达所建构的基因的步骤,如上文实验例所述。
[0124]
实验例11:利用sds-page分析瑞替普酶-(3d5 scfv)的安定性
[0125]
为了评估瑞替普酶-(3d5 scfv)于储存后的安定性,将瑞替普酶
‑ꢀ
(3d5 scfv)在4℃下储存3、6与30天,之后进行sds-page与elisa分析。
[0126]
图5a与5b为10%非还原sds-page分析结果,结果显示重组瑞替普酶-(3d5 scfv)多肽可稳定储存至少一个月。
[0127]
进行elisa分析,以评估经储存的瑞替普酶-(3d5 scfv)多肽对人类纤维素的结合能力。
[0128]
将96孔的聚苯乙烯微孔盘涂覆人类纤维蛋白原(sigma)(20 μg/ml)的pbs缓冲液(100μl/孔)。在4℃下培育一夜后,以pbs缓冲液冲洗涂覆的孔盘。为了引发人类纤维素的交联,将tris缓冲溶液(tbs,含最终浓度1u/ml 人类α-凝血酶(sigma)、2mm cacl2与7mm l-半胱氨酸(merck))加入经涂覆的孔中,于37℃下培育1小时。以阻断缓冲液(5%脱脂奶粉/pbs)阻断反应后,将最终浓度为0.1、1与10μg/ml的100μl瑞替普酶-(3d5-scfv)加入每一孔中,并于室温下培育1小时。之后,冲洗孔盘三次,并将与hrp耦接的蛋白l稀释至 1/5000后
加入孔中,再于室温下培育1小时。冲洗孔盘三次,并加入100μl的 3,3’,5,5
’‑
四甲基联苯胺(tetramethylbenzidine,tmb)底物缓冲液。分钟后,以1 m hcl使显色反应停止。以微量盘式分析仪(molecular devices)测量在450nm下的吸光值(od),并以graph pad prism软体处理资料。
[0129]
在制备经过第xiiia型凝血因子处理的交联纤维素盘时,采用与上文制备纤维素涂覆盘相似的方法进行涂覆。简言之,人类纤维蛋白原(sigma)以 pbs稀释后以每孔100μl的量加入至96孔的聚苯乙烯微孔盘,之后将孔盘密封并于4℃下静置一夜。
[0130]
每一纤维素盘的制备方法如下。将100μl的tbs(含最终浓度1.0 u/ml凝血酶(sigma)、每孔0.55μg第xiiia型凝血因子(zedira,darmstadt,德国)、 2mm cacl2与7mm l-半胱氨酸(merck))加入纤维蛋白原盘的孔中,之后再以 tbs冲洗并以阻断缓冲液(5%脱脂奶粉/pbs)终止反应。
[0131]
利用与hrp复合的蛋白l侦测重组瑞替普酶-(3d5 scfv)多肽。图 5c的elisa分析结果显示,即使经过了指定的储存时间,瑞替普酶-(3d5 scfv) 仍能专一地和人类纤维素以及交联纤维素结合。
[0132]
实验例12:(瑞替普酶)-(3d5 scfv)多肽对人类纤维素以及交联纤维素的结合能力的elisa分析
[0133]
进行elisa分析以探讨重组瑞替普酶-(3d5 scfv)多肽对人类纤维素结合能力的剂量依存关性。
[0134]
elisa分析的步骤与上文实验例所述相似。简言之,将小鼠纤维蛋白原(sigma)经pbs稀释后,以每孔100μl的量加入96孔聚苯乙烯微孔盘中,之后将孔盘密封并在4℃下静置一夜。
[0135]
每一纤维素盘的制备方式如下。每一纤维素盘的制备方法如下。将100μl的tbs(含最终浓度1.0u/ml凝血酶(sigma)、2mm cacl2与7mm l-半胱氨酸(merck))加入纤维蛋白原盘的孔中,之后再以tbs冲洗并以阻断缓冲液 (5%脱脂奶粉/pbs)终止反应。接着,将不同浓度(600nm、200nm、66nm、22 nm、7.4nm、2.5nm以及0.8nm)的100μl瑞替普酶-(3d5-scfv)加入每一孔中,并于室温下培育1小时。接着将孔盘冲洗三次,并将与hpr复合的蛋白稀释成 1/5000后加入孔中,并于室温下培育1小时。之后将孔冲洗三次,再加入100μl 的tmb底物缓冲液。5分钟后,加入1m hcl使显色反应终止。以微量盘式分析仪测量在450nm下的吸光值(od)。
[0136]
利用与hpr复合的蛋白l来侦测重组瑞替普酶-(3d5 scfv)多肽。图6所示的elisa分析结果结果,瑞替普酶-(3d5 scfv)多肽可专一地结合到人类纤维素以及交联纤维素;然而,其对交联纤维素的结合能力比对纤维素更强。
[0137]
实验例13:重组(瑞替普酶)-(3d5 scfv)多肽对小鼠纤维素的结合能力的elisa分析
[0138]
制备小鼠纤维素涂覆的elisa盘,以透过elisa分析探究重组瑞替普酶-(3d5 scfv)多肽对小鼠纤维素的结合能力。
[0139]
在制备小鼠纤维素盘时,采用与上文制备人类纤维素涂覆盘相似的方法进行涂覆。简言之,小鼠纤维蛋白原(sigma)以pbs稀释后以每孔100μl 的量加入至96孔的聚苯乙烯微孔盘,之后将孔盘密封并于4℃下静置一夜。
[0140]
每一纤维素盘的制备方法如下。将100μl的tbs(含最终浓度1.0 u/ml凝血酶(sigma)、2mm cacl2与7mm l-半胱氨酸(merck))加入纤维蛋白原盘的孔中,之后再以tbs冲洗并以阻断缓冲液(5%脱脂奶粉/pbs)终止反应。接着,将最终浓度200nm的100μl瑞替普酶-(3d5-scfv)加入每一孔中,并于室温下培育1小时。接着将孔盘冲洗三次,并将与hpr复合的蛋白稀释成1/5000后加入孔中,并于室温下培育1小时。之后将孔冲洗三次,再加入100μl的tmb底物缓冲液。5分钟后,加入1m hcl使显色反应终止。以微量盘式分析仪测量在 450nm下的吸光值(od)。
[0141]
乐无喘(xolair)是一种抗ige抗体,在此作为阴性对照。利用与hpr 复合的蛋白l来侦测重组瑞替普酶-(3d5 scfv)多肽与瑞替普酶。图7摘要整理的 elisa结果显示,瑞替普酶-(3d5 scfv)可专一地结合到小鼠纤维素,但不会结合到小鼠纤维蛋白原。
[0142]
实验例14:重组(瑞替普酶)-(3d5 scfv)多肽在有游离纤维蛋白原时对人类纤维素的结合能力的elisa分析
[0143]
利用与上文实验例所述相似的方式来进行elisa分析,以评估当环境中存有200mg/dl或400mg/dll人类纤维蛋白原时,重组瑞替普酶-(3d5 scfv)多肽对人类纤维素的结合能力。
[0144]
简言之,人类纤维蛋白原以pbs稀释后以每孔100μl的量加入至 96孔的聚苯乙烯微孔盘,之后将孔盘密封并于4℃下静置一夜。
[0145]
每一纤维素盘的制备方法如下。将100μl的tbs(含最终浓度1.0 u/ml凝血酶(sigma)、2mm cacl2与7mm l-半胱氨酸(merck))加入纤维蛋白原盘的孔中,之后再以tbs冲洗并以阻断缓冲液(5%脱脂奶粉/pbs)终止反应。接着,将100μl最终浓度200nm瑞替普酶-(3d5-scfv)与最终浓度200mg/dl或400 mg/dl的人类纤维蛋白原的混合物加入每一孔中,并于室温下培育1小时。接着将孔盘冲洗三次,并将与hpr复合的蛋白稀释成1/5000后加入孔中,并于室温下培育1小时。之后将孔冲洗三次,再加入100μl的tmb底物缓冲液。5分钟后,加入1m hcl使显色反应终止。以微量盘式分析仪测量在450nm下的吸光值 (od)。
[0146]
利用与hpr复合的蛋白l侦测重组瑞替普酶-(3d5 scfv)多肽与瑞替普酶。图8摘要整理的elisa分析结果指出,在存有最终浓度200mg/dl或400 mg/dl的游离纤维蛋白原时,瑞替普酶-(3d5 scfv)多肽仍可专一地结合到人类纤维素。
[0147]
实验例15:重组瑞替普酶-(3d5 scfv)多肽在pbs或人类血清中的血栓溶解活性
[0148]
进行全血血栓溶解盘分析,以探究血栓溶解活性。简而言之,透过静脉穿刺从健康志愿者体内收集人类血液,并注入柠檬酸三钠中,最终浓度为3.2%w/v。利用凝血酶诱导血栓形成。在hepes缓冲液(25mm hepes、137 mm nacl)中,加入凝血酶(最终浓度6.25
×
10-3u)和氯化钙(最终浓度67mm),以得到新鲜制备的凝血混合物。将5μl的凝血混合物沉积到96孔微孔盘(costar) 的孔底边缘,然后添加25μl血液。接着将孔盘密封并在37℃下培育1小时,以使血栓形成于孔的边缘。
[0149]
将瑞替普酶-igg4.fc以及瑞替普酶-(3d5-scfv)稀释成为70μl的 pbs溶液。利用多通道吸量管在室温下同时将70-μl的样本加入至含有人类血栓的孔中并反应3分钟。在移除样本后,于孔中加入70μl的人类血清或pbs,并利用微量盘式分析仪(molecular devices)测量在510nm下的吸光值,由于溶解的血栓会逐渐覆盖孔的中心位置,可藉以决定人类血栓的溶解程度。利用graphpad prism软体处理资料。
[0150]
图9的血栓溶解分析结果指出,瑞替普酶-(3d5 scfv)在人类血清中的血栓溶解活性优于在pbs中的活性。
[0151]
实验例16:重组瑞替普酶-(3d5 scfv)多肽在最终浓度1mm时的血栓溶解活性
[0152]
将瑞替普酶-igg4.fc以及瑞替普酶-(3d5-scfv)稀释成为70μl的 pbs溶液,最终浓度1nm。利用多通道吸量管在室温下同时将70-μl的样本加入至含有人类血栓的孔中并反应3分钟。在移除样本后,于孔中加入70μl的人类血清或pbs,并利用微量盘式分析仪(molecular devices)测量在510nm下的吸光值,由于溶解的血栓会逐渐覆盖孔的中心位置,可藉以决定人类血栓的溶解程度。利用graph pad prism软体处理资料。
[0153]
图10的血栓溶解分析结果指出,在最终浓度1mm下,瑞替普酶
‑ꢀ
(3d5 scfv)的血栓溶解活性优于瑞替普酶-igg4.fc的活性。
[0154]
实验例17:重组瑞替普酶-(3d5 scfv)多肽的标的效果
[0155]
将瑞替普酶-igg4.fc以及瑞替普酶-(3d5-scfv)稀释成为70μl的 pbs溶液,最终浓度30nm。利用多通道吸量管在室温下同时将70-μl的样本加入至含有人类血栓的孔中并反应3分钟。在移除样本后,以250μl pbs冲洗血栓3次,之后在孔中加入70μl的人类血清,并利用微量盘式分析仪(molecular devices)测量在510nm下的吸光值,由于溶解的血栓会逐渐覆盖孔的中心位置,可藉以决定人类血栓的溶解程度。利用graph pad prism软体处理资料。
[0156]
图11的分析结果指出,瑞替普酶-(3d5 scfv)可标的到人类血栓,且即使经过冲洗处理,仍能够发挥所欲的血栓溶解活性。相反地,对照组蛋白瑞替普酶-igg4.fc没有标的效果,且经过冲洗后,几乎没有血栓溶解活性。
[0157]
实验例18:重组瑞替普酶-(3d5 scfv)多肽的血栓溶解活性的剂量相依性
[0158]
将瑞替普酶-(3d5-scfv)稀释成为70μl的pbs溶液,最终浓度5 nm、10nm、20nm与30nm,并将瑞替普酶-igg4.fc稀释成为70μl的pbs溶液,最终浓度30nm。利用多通道吸量管在室温下同时将70-μl的样本加入至含有人类血栓的孔中并反应3分钟。在移除样本后,以250μl pbs冲洗血栓3次,之后在孔中加入70μl的人类血清,并利用微量盘式分析仪(molecular devices)测量在510nm下的吸光值,由于溶解的血栓会逐渐覆盖孔的中心位置,可藉以决定人类血栓的溶解程度。利用graph pad prism软体处理资料。
[0159]
图12的分析结果指出,瑞替普酶-(3d5 scfv)可标的到人类血栓,且经过冲洗处理,即使在5nm的浓度下,仍能够发挥所欲的血栓溶解活性。另一方面,瑞替普酶-igg4.fc即使在30nm的浓度下,也没有血栓溶解活性。
[0160]
实验例19:重组瑞替普酶-(3d5 scfv)多肽与瑞替普酶对人类血栓的血栓溶解活性的剂量相依性
[0161]
利用与上述实验例相似的方法进行全血血栓溶解分析,以比较重组瑞替普酶-(3d5 scfv)多肽与瑞替普酶(购自reliance life science)对人类血栓的血栓溶解活性。
[0162]
将瑞替普酶以及瑞替普酶-(3d5-scfv)多肽稀释成为70μl的pbs 溶液,最终浓度5nm、10nm、20nm与30nm。利用多通道吸量管在室温下同时将70-μl的样本加入至含有人类血栓的孔中并反应3分钟。在移除样本后,以 250μl pbs冲洗血栓3次,之后在孔中加入70μl的人类血清,并利用微量盘式分析仪(molecular devices)测量在510nm下的吸光值,由于溶
(3d5 scfv)多肽、阿替普酶以及瑞替普酶对人类血栓的血栓溶解活性。
[0176]
将瑞替普酶-(3d5-scfv)多肽稀释成为70μl的pbs溶液。利用多通道吸量管在室温下同时将70-μl的样本加入至含有人类血栓的孔中并反应3分钟。在移除样本后,于孔中加入70μl的人类血浆或pbs,并利用微量盘式分析仪(molecular devices)测量在510nm下的吸光值,由于溶解的血栓会逐渐覆盖孔的中心位置,可藉以决定人类血栓的溶解程度。利用graph pad prism软体处理资料。
[0177]
图16a与16b的分析结果分别指出,重组瑞替普酶-(3d5 scfv)多肽 pbs与人类血浆中可溶解人类血栓。
[0178]
实验例23:重组瑞替普酶-(3d5 scfv)多肽与阿替普酶的蛋白分解活性动力学
[0179]
透过显色分析来探讨瑞替普酶-(3d5 scfv)多肽与阿替普酶的蛋白分解活性动力学,本分析利用重组瑞替普酶-(3d5 scfv)多肽与阿替普酶催化引发的血浆蛋白原转变为纤维蛋白溶酶。简言之,在96孔平底孔盘(nunc)中,将不同浓度(0.1、0.2、0.4、0.8、1.6、3.2以及6.4mm)的显色底物ch3so2-d-六氢酪氨酸-gly-arg-对硝基苯胺(ch3so2-d-hexahydrotyrosine-gly-arg-p
‑ꢀ
nitroanilide
·
acoh,购自sigma)和含有瑞替普酶-(3d5 scfv)多肽或阿替普酶的样本于25℃下培育15分钟。瑞替普酶的蛋白分解活性会使得底物水解,进而释放出黄色的对硝基苯胺,可利用盘式分析仪读取在405nm下的吸光值。
[0180]
图17a的折线图整理了此处提出的重组瑞替普酶-(3d5 scfv)多肽与阿替普酶在所述底物浓度下的蛋白分解活性。图17b为利用图17a的数据所得的双倒数图(double-reciprocal plot,又称lineweaver-burk图),而之后可以由 lineweaver-burk计算得到其蛋白酶活性的[km]、[v
max
]以及[k
cat
]数值。重组瑞替普酶-(3d5 scfv)多肽的[km]、[v
max
]以及[k
cat
]值分别是0.41mm、170nm/min 以及0.85,而阿替普酶的[km]、[v
max
]以及[k
cat
]值则分别是0.36mm、155nm/min 以及0.775。这些资料显示,瑞替普酶-(3d5 scfv)多肽与阿替普酶两者对显色底物有相似的蛋白分解活性。
[0181]
实验例24:重组瑞替普酶-(3d5 scfv)多肽在人类血浆中的安定性分析
[0182]
为了探讨瑞替普酶-(3d5 scfv)多肽在人类血浆中的安定性,将瑞替普酶-(3d5 scfv)多肽和10%或20%人类血浆一起培育3、6或24小时,之后进行elisa分析。
[0183]
利用与上文实验例似的方法制备纤维素涂覆盘。简言之,将96孔微孔盘涂覆人类纤维蛋白原(sigma)(20μg/ml)的pbs缓冲液(100μl/孔)。在4℃下培育一夜后,以pbs缓冲液冲洗涂覆的孔盘。为了引发人类纤维素的交联,将tbs缓冲溶液(含最终浓度1u/ml人类α-凝血酶(sigma)、2mm cacl2与7mml-半胱氨酸(merck))加入经涂覆的孔中,于37℃下培育1小时。以阻断缓冲液阻断反应后,将已于10%或20%的人类血浆中培育3、6或24小时的100μl瑞替普酶-(3d5-scfv)加入每一孔中,并于室温下再培育1小时。接着,将孔盘冲洗三次,并将与hpr复合的多株兔-抗-瑞替普酶抗体稀释成1/200后加入孔中,并于室温下培育1小时。之后将孔冲洗三次,再加入100μl的tmb底物缓冲液。5分钟后,加入1m hcl使显色反应终止。以微量盘式分析仪(molecular devices)测量在450nm下的吸光值(od),并以graph pad prism软体处理资料。
[0184]
图18摘要整理的elisa分析结果显示,瑞替普酶-(3d5 scfv)在10 %或20%的人类血浆中可保持安定。
[0185]
实验例25:重组瑞替普酶-(3d5 scfv)多肽在植入血栓的小鼠模型中的标的效果
[0186]
进行ivis影像分析,以探究重组瑞替普酶-(3d5 scfv)多肽在植入血栓的小鼠模型中的标的效果。为了监控小鼠模型中植入的血栓,在将人类血栓植入小鼠血管前,根据制造商的建议步骤,利用fitc标记的试剂盒(thermoscientific)来标记的人类血栓。在384孔微孔盘(axygen)中制备fitc-标记的人类血栓以得到大小适合植入小鼠下腔静脉(inferior vena cava,ivc)的人类血栓。简言之,以最终浓度1mg/ml的fitc染料标记的人类纤维蛋白原。将fitc-标记的纤维蛋白原和4μl人血混合。接着,以带有凝血酶(最终浓度6.25
×
10-3u)与氯化钙(最终浓度67mm)的hepes缓冲液(25mm hepes、137mm nacl)来处理混合的血液样本。之后,将5μl的混合血液样本加入384孔微孔盘的每一孔中,并将孔盘在37℃下培育1小时,以使人类血栓形成。
[0187]
为了监控注入脂蛋白的位置,在进行重组瑞替普酶-(3d5 scfv)多肽与瑞替普酶治疗前,根据制造商的建议步骤,使用dylight 680抗体标记的试剂盒(thermo scientific)来标记的重组瑞替普酶-(3d5 scfv)多肽与瑞替普酶。
[0188]
8到10周龄的nod-scid小鼠购自台湾地区“中央研究院”细胞与个体生物学研究所的实验动物中心(台北,中国台湾)。将经fitc-标记的人类血栓植入小鼠下腔静脉(ivc)。简言之,在氧气环境下,以异氟烷麻醉小鼠,并将小鼠置于保温灯下以维持其生理体温。剔除小鼠腹部毛发并以70%变性酒精消毒。进行中位剖腹手术,之后将fitc-标记的人类血栓置入ivc中。利用ivis体内光谱成像系统(perkinelmer)来观察曝光的ivc。利用living image software v3.2软体,在 ex/em=459/520(侦测fitc)或ex/em=675/720(侦测dylight680)的条件下撷取萤光影像。利用ivis光谱成像系统在指定时间撷取影像,并以living image软体分析。
[0189]
将小鼠分为每组两只小鼠,且分别经由眼眶静脉窦注入约50μl 的256nm dylight680-标记的瑞替普酶-(3d5 scfv)多肽(a组)或dylight680-标记的瑞替普酶(b组)。在投予dylight 680-标记的蛋白后的第0、5、10、20与30分钟,撷取经植入人类血栓小鼠的萤光影像。
[0190]
图18a显示5张a组小鼠的ivis影像,其中图框#1、#2是以ex/em= 675/720条件撷取,图框#3、#4是以ex/em=495/520条件撷取,而图框#2、#4中的萤光信号合并后得到图框#5。图框#3、#4中的绿色萤光指出小鼠体内带有 fitc-标记的人类血栓。另一方面,在刚注射dylight680-标记的瑞替普酶-(3d5 scfv)多肽时(0分钟),图框#1中没有明显的红色萤光,但在注射后30分钟,可以在图框#2中观察到强烈的红色萤光。在图框#5的综合影像中,重迭的红色与绿色信号代表dylight680-标记瑞替普酶-(3d5 scfv)多肽会集中在植入的人类血栓附近。
[0191]
图18b显示5张b组小鼠的ivis影像,其中图框#1、#2是以ex/em=675/720条件撷取,图框#3、#4是以ex/em=495/520条件撷取,而图框#2、#4中的萤光信号合并后得到图框#5。与图18a类似,图框#3、#4中的绿色萤光指出小鼠体内带有fitc-标记的人类血栓。然而,不论是刚投予dylight680-标记的瑞替普酶(图框#1)或经过30分钟后(图框#2),都无法观察到红色萤光。在图框#5的综合影像中只能观察到绿色信号,这代表dylight680-标记瑞替普酶不会集中在植入的人类血栓附近。
[0192]
将在指定时间点获取的影像的萤光强度相对于在0分钟时以 ex/em=675/720条件获取的参考影像进行标准化,以便根据辐射效率(radiantefficiency,r.e.)来定量
dylight680-标记的样本的萤光强度。分析结果摘要整理于图18c,其指出在小鼠模型中,此处提出的瑞替普酶-(3d5 scfv)能够标的到小鼠ivc中的人类血栓,而瑞替普酶则无法有效地标的到小鼠ivc中的人类血栓。
[0193]
实验例26:利用elisa分析重组瑞替普酶-(3d5 scfv)多肽在大鼠体内的半衰期
[0194]
将阿替普酶、瑞替普酶以及重组瑞替普酶-(3d5 scfv)多肽以静脉内注射到大鼠体内后,进行elisa分析,以测定其半衰期。利用elisa分析法,定量血清样本中,阿替普酶、瑞替普酶以及重组瑞替普酶-(3d5 scfv)多肽的浓度。6-周龄的wistar大鼠系购自biolasco(台北,中国台湾)。将大鼠分成每组3 只,并分别透过静脉注射500μl的0.364mg/kg药物分子。
[0195]
利用以下方法制备涂覆孔盘,以进行elisa分析。将带有最终浓度1.0μg/ml多株兔-抗-瑞替普酶抗体(购自ltk biolaboratories co.,ltd.,桃园,中国台湾)的100μl的tbs缓冲液加入孔盘的个别孔中,之后将孔盘在4℃下培育18小时,接着再以tbs冲洗并以缓冲液(5%脱脂奶粉/pbs)阻断反应。
[0196]
接着,所收集到的血液样本稀释成不同浓度后,将100μl的稀释样本加入各孔中,并在室温下培育1小时。之后将孔盘冲洗三次;将100μl的 1.65μg/ml与hpr复合的多株兔-抗-瑞替普酶抗体加入孔中,并于室温下培育1 小时。之后将孔冲洗三次,再加入100μl的tmb底物缓冲液。5分钟后,加入1 m hcl使显色反应终止。以微量盘式分析仪测量在450nm下的吸光值(od)。
[0197]
图19为阿替普酶、瑞替普酶以及重组瑞替普酶-(3d5 scfv)多肽的药动学图谱。由图19可以看处,相较于阿替普酶以及瑞替普酶,此处提出的瑞替普酶-(3d5 scfv)多肽于不同时点在大鼠血清中的蛋白含量较高。这些资料显示,此处提出的重组瑞替普酶-(3d5 scfv)多肽比起阿替普酶或瑞替普酶有较长的半衰期。
[0198]
实验例27:重组瑞替普酶-(3d5 scfv)多肽在大鼠体内的半衰期
[0199]
为了进一步探究重组瑞替普酶-(3d5 scfv)多肽的半衰期,在静脉内投予后,进行额外的蛋白分解分析。以瑞替普酶-(3d5 scfv)多肽的蛋白分解活性,来决定重组瑞替普酶-(3d5 scfv)多肽的血清含量,其步骤与上文实验例所述相似。
[0200]
6-周龄的wistar大鼠系购自biolasco(台北,中国台湾)。将大鼠分成每组3只,并分别透过静脉注射500μl的0.364mg/kg重组瑞替普酶-(3d5 scfv) 多肽或阿替普酶。在静脉投予后10、20、40与120分钟收集血液样本。
[0201]
在96孔平底孔盘(nunc)中,将0.8mm的显色底物ch3so2-d-六氢酪氨酸-gly-arg-对硝基苯胺(sigma)和稀释的血液样本(1/10)于25℃下培育15分钟。此处提出的瑞替普酶或阿替普酶的蛋白分解活性会使得底物水解,进而释放出黄色的对硝基苯胺,可利用盘式分析仪读取在405nm下的吸光值。
[0202]
图20为重组瑞替普酶-(3d5 scfv)多肽与阿替普酶的药动学图谱。由图20可以看处,相较于阿替普酶,本案提出的瑞替普酶-(3d5 scfv)多肽在大鼠血清中有较高的蛋白含量。有鉴于此,此处提出的重组瑞替普酶-(3d5 scfv) 多肽比起阿替普酶有较长的半衰期,此一结果亦与前述实验例的结果相符。
[0203]
实验例28:重组(3d5 scfv)-瑞替普酶多肽的制备
[0204]
将对人类纤维素专一的3d5 scfv透过一弹性连接物接合到瑞替普酶的n-端,以建
构重组(3d5 v
l-(g4s)3-v
h scfvα纤维素)-瑞替普酶多肽。利用 expi293f胞系表达所建构的基因以及纯化所表达的多肽的步骤,如上文实验例所述。。
[0205]
所述scfv的配置为v
l-连接物-vh,其中两个结构域透过弹性连接物而结合。重组多肽的氨基酸序列如seq id no:14所示。利用sds-page来鉴定此一新的构建体。图21a的10%非还原sda-page分析结果显示样本(第2道) 中含有分子量约71kda的期望产物。
[0206]
为了比较重组(3d5 scfv)-瑞替普酶多肽对人类纤维蛋白原以及纤维素结合能力,进行elisa分析,其步骤与上文实验例所述相似。
[0207]
利用与hpr复合的多株兔-抗-瑞替普酶抗体来侦测重组(3d5 scfv)-瑞替普酶多肽。图21b摘要整理的结果指出,本案的(3d5 scfv)-瑞替普酶多肽可专一地结合到人类纤维素而不是人类纤维蛋白原。
[0208]
实验例29:重组(3d5 scfv)-瑞替普酶多肽对人类血栓的血栓溶解活性的剂量依存性
[0209]
为了评估重组(3d5 scfv)-瑞替普酶多肽对人类血栓的血栓溶解活性,采用与上文实验例相似的步骤进行全血血栓溶解分析。
[0210]
将重组(3d5 scfv)-瑞替普酶多肽在70μl的pbs中稀释为最终浓度12.5nm、25nm与50nm。利用多通道吸量管在室温下同时将70-μl的样本加入至含有人类血栓的孔中并反应3分钟。在移除样本后,以250μl的pbs冲洗血栓三次,之后在孔中加入70μl的人类血清,并利用微量盘式分析仪(moleculardevices)测量在510nm下的吸光值,由于溶解的血栓会逐渐覆盖孔的中心位置,可藉以决定人类血栓的溶解程度。利用graph pad prism软体处理资料。
[0211]
图22摘要整理的分析结果显示,在12.5nm、25nm与50nm的浓度下,(3d5 scfv)-瑞替普酶多肽可标的到人类血栓,并可发挥血栓溶解活性。当可理解,上文实施方式的说明仅为例示,且本发明所属技术领域具有通常知识者可对其进行各种修饰。上文的说明、实验例与资料完整地说明了本发明例示性实施方式的结构与用途。虽然上文实施方式中揭露了本发明的具体实施例,然其并非用以限定本发明,本发明所属技术领域中具有通常知识者,在不悖离本发明的原理与精神的情形下,当可对其进行各种更动与修饰,因此本发明的保护范围当以附随申请专利范围所界定者为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1