新型酮糖3-差向异构酶
本发明涉及新型的酮糖3-差向异构酶及其制造方法、生产它的微生物、编码该酶的dna和含有该dna的重组载体与转化宿主细胞、酮糖3-差向异构酶突变体、和利用了酮糖3-差向异构酶或突变体的酮糖的制造方法。
背景技术:
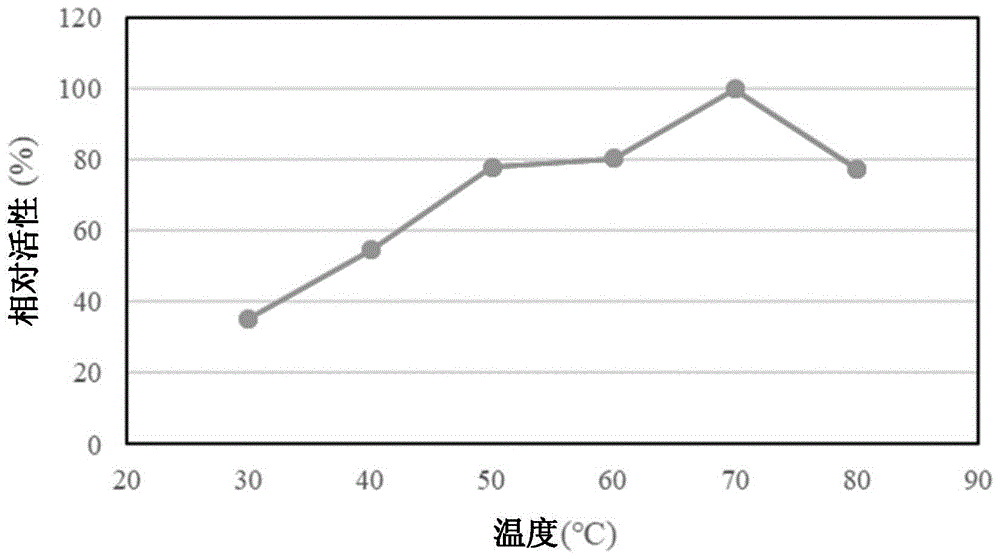
:稀少糖是不存在于自然界或者仅以极微量存在的单糖类的总称,作为己糖中的醛糖的阿洛糖、阿卓糖、古罗糖、艾杜糖、塔罗糖属于稀少糖,作为酮糖的阿卢糖(阿洛酮糖)、山梨糖、塔格糖属于稀少糖。另外,如果仅看l体时,l-果糖、l-葡萄糖也属于稀少糖。稀少糖的生产技术的研究、关于生理作用、化学的性质的研究也在进行中,至今为止其特异性的生理作用逐渐被揭示,但在将其制成医药、农药、功能性食品等来进行实用化时,需要开发能够使其大量生产的与稀少糖特异性反应的酶。d-阿卢糖又称为d-阿洛酮糖,是d-果糖的差向异构体,具有砂糖的70%左右的甜度,甜味的品质方面与d-果糖类似。然而,d-阿卢糖与d-果糖不同,已知在体内吸收时几乎不会被代谢,其卡路里接近为零,具有抑制脂质合成酶活性从而减少腹部脂肪的功能。至今为止,报道了d-阿卢糖能够作为低卡路里甜味剂(专利文献1)、对于减少体重有效的甜味剂(非专利文献1和2)来使用,专利文献2中,着眼于d-阿卢糖的血糖上升抑制作用,记载了其能够用于健康食品、糖尿病患者用饮食品、痩身用饮食品等。另外,d-塔格糖具有砂糖的90%左右的甜度,能量为2kcal/g,被用作低卡路里甜味剂。另外,还已知具有hdl胆固醇的上升效果和体脂肪蓄积抑制效果(专利文献3),与d-阿卢糖同样具有餐后血糖上升抑制作用。在这些稀少糖的制造中,现在使用利用异构酶的方法,这是由于发现了有用的酶反应的结果。其异构酶中的一种的酮糖3-差向异构酶能够以多种酮糖作为底物,有时将成为底物的酮糖之中3位的差向异构化活性最高的酮糖放入其名称,例如将对于d-塔格糖的3位的差向异构化活性最高的酶称为d-塔格糖3-差向异构酶。已确立了通过利用该d-塔格糖3-差向异构酶(dte)从d-果糖制造作为稀少糖的d-阿卢糖的技术。例如,非专利文献3中公开了来自菊苣假单胞菌(pseudomonascichorii)st-24株的d-酮糖3-差向异构酶,记载了通过使用该酶能够从d-果糖制造d-阿卢糖。然而,如该酶的别名d-塔格糖3-差向异构酶所示那样,其对于d-塔格糖的3位的差向异构化活性最高,对于d-果糖的作用比较弱。另外,专利文献4中公开了使用来自根癌农杆菌(agrobacteriumtumefaciens)的d-阿洛酮糖3-差向异构酶的d-阿洛酮糖(d-阿卢糖)的生成方法,专利文献5中公开了使用来自球形节杆菌(arthrobacterglobiformis)的酮糖3-差向异构酶的d-阿卢糖的制造方法,但这些酮糖3-差向异构酶都不具有能够工业规模大量生产d-阿卢糖、d-塔格糖的程度的高活性。现有技术文献专利文献专利文献1:日本专利第4473980号公报专利文献2:日本专利第5421512号公报专利文献3:日本专利第5749880号公报专利文献4:日本专利第4648975号公报专利文献5:日本专利第5997693号公报非专利文献非专利文献1:asiapac.j.clin.nutr.(2001)vol.10,p.233-237非专利文献2:asiapac.j.clin.nutr.(2004)vol.13,s127非专利文献3:biosci.biotech.biochem.(1993)vol.57,p.1037-1039技术实现要素:发明所要解决的课题本发明的课题在于提供一种新型的酮糖3-差向异构酶,提供该酶的制造方法,提供生产该酶的微生物,提供编码该酶的dna、包含该dna的重组载体和转化宿主细胞,提供该酶的固定化酶、提高了耐热性的酮糖3-差向异构酶突变体蛋白质、该突变体蛋白质的固定化蛋白质,以及提供使用该酶、固定化酶、该突变体蛋白质、固定化蛋白质的酮糖的制造方法,其中,上述酮糖3-差向异构酶来自在制造食物时的使用被认可、被认为是没有毒性的微生物,并且,活性高且具有耐热性,能够以高活性进行从d-果糖向d-阿卢糖的异构化的催化。用于解决课题的技术方案本发明人等着眼于不仅在日本而且在欧洲和美国作为食品的使用也被认可、收录于清单上的被认为几乎没有毒性的菌种,通过采集各地的土壤,从其中分离微生物,不断探索具有酮糖3-差向异构酶活性的微生物。作为其结果,从众多分离的菌株中发现了新型的产生酮糖3-差向异构酶的属于节杆菌(arthrobacter)属的微生物。该属于节杆菌属微生物的噬组氨醇节杆菌(arthrobacterhistidinolovorans)y586-1株能够产生活性高且高耐热性的新型的酮糖3-差向异构酶。来自该微生物的新型的酮糖3-差向异构酶作用于d或l-酮糖的3位,具有催化差向异构化反应而成为对应的d-或l-酮糖的活性。在d-或l-己酮糖中对于d-阿卢糖的3位的差向异构化活性最高,适于从d-果糖制造d-阿卢糖。即,本发明涉及下述(1)~(5)中所述的酮糖3-差向异构酶。(1)一种来自属于节杆菌(arthrobacter)属的微生物的酮糖3-差向异构酶,其利用sds-page测得的分子量为36kda,具有下述(a)和(b)的底物特异性。(a)具有使d-或l-酮糖的3位差向异构化并生成对应的d-或l-酮糖的活性。(b)在d-或l-己酮糖中对于d-阿卢糖的3位的差向异构化活性最高。(2)如上述(1)所述的酮糖3-差向异构酶,其具有下述(c)和(d)的物理化学性质。(c)反应最佳ph为6~8。(d)反应最佳温度为60℃。上述反应最佳温度为纯化酶的60℃。在实施例中存在使用纯化酶和使用粗酶的2种实验,粗酶的反应最佳温度显示为70℃(参照图1)。粗酶在70℃、纯化后的酶在60℃显示为最佳,但粗酶由于周围蛋白质等的影响而耐热性提高的例子也是常见现象。对于重组突变体,例如在国际公开第0047段中所述,如从能够得到耐热性高于野生型酮糖3-差向异构酶的多种突变体的方面考虑是优异的这样的记载,能够理解为粗酶。(3)如上述(1)或(2)所述的酮糖3-差向异构酶,其中,底物特异性的顺序为d-阿卢糖、d-塔格糖、l-塔格糖、d-果糖、l-阿卢糖。(4)如上述(1)~(3)中任一项所述的酮糖3-差向异构酶,其中,属于节杆菌属的微生物为噬组氨醇节杆菌(arthrobacterhistidinolovorans)。(5)如上述(1)~(4)中任一项所述的酮糖3-差向异构酶,其中,属于节杆菌属的微生物为在国际专利生物保藏中心(专利微生物保藏中心)以保藏编号nitebp-02813保藏的噬组氨醇节杆菌y586-1株。另外,本发明还涉及下述(6)~(8)所述的蛋白质、下述(9)~(13)所述的dna、重组载体、或转化宿主细胞、或者下述(14)所述微生物。(6)一种蛋白质,其为以下(a)或(b)所述的蛋白质。(a)包含序列编号1所示的氨基酸序列的蛋白质。(b)包含与序列编号1所示的氨基酸序列具有70%以上同一性的氨基酸序列的、具有下述(a)和(b)的酮糖3-差向异构酶活性、且在反应温度为70℃和50℃中的酮糖3-差向异构酶活性的比(t70/t50)为1.55以上的蛋白质。(a)具有使d-或l-酮糖的3位差向异构化并生成对应的d-或l-酮糖的活性。(b)在d-或l-己酮糖中对于d-阿卢糖的3位的差向异构化活性最高。(7)一种蛋白质,其为以下(a)或(b)所述的蛋白质。(a)包含序列编号1所示的氨基酸序列的蛋白质。(b)包含与序列编号1所示的氨基酸序列具有70%以上同一性的氨基酸序列的、具有下述(a)和(b)的酮糖3-差向异构酶活性,且在60℃保温1小时后的残留活性为31%以上的蛋白质。(a)具有使d-或l-酮糖的3位差向异构化并生成对应的d-或l-酮糖的活性。(b)在d-或l-己酮糖中对于d-阿卢糖的3位的差向异构化活性最高。(8)一种蛋白质,其为由包含序列编号1所示的氨基酸序列的蛋白质的氨基酸取代突变体构成的蛋白质,该蛋白质在序列编号1所示的氨基酸序列中选自h56、t59、a60、p77、l94、l97、d101、a109、a128、v129、v132、s144、s167、p172、e199、a200、k202、s218中的至少1个部位具有氨基酸取代,具有下述(a)和(b)的酮糖3-差向异构酶活性,并且,与包含序列编号1所示的氨基酸序列的蛋白质相比,在反应温度70℃和50℃的酮糖3-差向异构酶活性的比(t70/t50)更高,或者在60℃保温1小时后的残留活性更高。(a)具有使d-或l-酮糖的3位差向异构化并生成对应的d-或l-酮糖的活性。(b)在d-或l-己酮糖中对于d-阿卢糖的3位的差向异构化活性最高。(9)编码上述(6)~(8)中任一项所述的蛋白质的dna。(10)包含序列编号2所示的碱基序列或与其互补的序列的dna。(11)如上述(9)所述的dna,其为下述(a)~(c)中任一项所述的dna。(a)由包含序列编号2所示的碱基序列或与其互补的序列的一部分或全部序列构成的dna,(b)与由序列编号2所示的碱基序列构成的dna的互补链在严格条件下杂交的dna,和(c)与由序列编号2所示的碱基序列构成的dna具有70%以上的序列同一性的dna。(12)含有上述(9)~(11)中任一项所述的dna的重组载体。(13)利用(12)所述的重组载体转化得到的转化宿主细胞。(14)一种噬组氨醇节杆菌,其为在国际专利生物保藏中心(专利微生物保藏中心)以保藏编号nitebp-02813保藏的噬组氨醇节杆菌y586-1株,生产上述(1)~(3)中任一项所述的酮糖3-差向异构酶。另外,本发明涉及下述(15)~(17)所述的固定化酶、下述(18)和(19)所述的固定化蛋白质。(15)一种在载体上固定有上述(1)~(5)中任一项所述的酮糖3-差向异构酶的固定化酶。(16)一种在载体上固定有酮糖3-差向异构酶粗酶的固定化酶,上述酮糖3-差向异构酶粗酶为存在于将生产上述(1)~(5)中任一项所述的酮糖3-差向异构酶的节杆菌属微生物的菌体破碎物中的酮糖3-差向异构酶粗酶。(17)如上述(15)或(16)所述的固定化酶,其中,上述载体为离子交换树脂、有机高分子载体和/或无机载体。(18)一种在载体上固定有上述(6)~(8)中任一项所述的蛋白质的固定化蛋白质。(19)如上述(18)所述的固定化蛋白质,其中,上述载体为离子交换树脂、有机高分子载体和/或无机载体。另外,本发明涉及下述(19)和(20)所述的酮糖3-差向异构酶的制造方法、下述(21)所述的具有酮糖3-差向异构酶活性的蛋白质的制造方法、下述(22)所述的酮糖的制造方法。(19)一种酮糖3-差向异构酶的制造方法,其中,将生产上述(1)~(5)中任一项所述的酮糖3-差向异构酶的节杆菌属微生物在培养基中进行培养,在微生物菌体中蓄积该酮糖3-差向异构酶,收集该酮糖3-差向异构酶的制造方法。(20)如上述(19)所述的酮糖3-差向异构酶的制造方法,其中,上述培养基为添加有d-阿卢糖的无机盐培养基。(21)一种具有酮糖3-差向异构酶活性的蛋白质的制造方法,其中,将上述(13)中所述的转化宿主细胞在培养基中进行培养,从培养物中收集具有酮糖3-差向异构酶活性的蛋白质。(22)一种酮糖的制造方法,其中,在含有选自d-或l-酮糖中的1种以上的溶液中,使上述(1)~(5)中任一项所述的酮糖3-差向异构酶、上述(6)~(8)中任一项所述的蛋白质、上述(15)~(17)中任一项所述的固定化酶、或上述(18)或(19)所述的固定化蛋白质发生作用,使该酮糖的3位发生差向异构化,生成对应的酮糖并将其收集。发明效果本发明的酮糖3-差向异构酶的特征在于,与来自微生物的现有的酮糖3-差向异构酶相比,活性特别高。例如,与专利文献5所述的来自球形节杆菌(arthrobacterglobiformis)的酮糖3-差向异构酶相比,每单位培养液中生产的酶具有约2倍高的活性,因此通过使用由本发明得到的酶,能够高效地大量生产d-阿卢糖。另外,酶的最佳温度高达70℃,而且,即使在80℃,在将在最佳温度70℃中的活性设为100时的相对活性为59.4,约为60%,是高耐热性的。而且,具有即使在60℃保温处理1小时后的残留活性也达49.4%的热耐性,因此,在最佳温度的70℃的反应中,能够得到更大量的生产物。具有该酶所具有的优异耐热性通过制造酶的氨基酸取代突变体还能够进一步提高的特性。作为将来自节杆菌属的微生物的本发明的酶在食品工业中使用的优点,可以列举菌的安全性。附图说明图1为表示本发明的粗酶的最佳温度的图。图2为表示培养基对于酶生产量的影响的图。图3表示用于确认本发明的酶的分子量而进行的sds-page的结果。图中,左侧数字的单位为kda。图4为表示本发明的纯化酶与对照酶的最佳ph的图。图5为表示本发明的纯化酶的最佳温度的图。图6为表示本发明的纯化酶与对照酶在保温10分钟时的温度稳定性的图。图7为表示本发明的纯化酶的底物特异性的图。图8为表示将hpa25l、wa30、ira904cl、fra54、fra95、xad7hp作为载体使用时本发明的酶的固定化酶的相对活性。图9为表示在mg2+的存在下或非存在下时在30℃~80℃中的各固定化酶的载体的相对活性。图10为表示将图3的sds-page的36kda条带经过还原处理、烷基化处理后,使用胰蛋白酶消化的片段的maldi-tof-ms解析结果。即,利用maldi-tof-ms解析得到的经过胰蛋白酶消化的36kda蛋白质的肽峰。图11为表示大肠杆菌中表达的重组酶的sds-page的结果。在图中,将重组酶与y586-1株纯化酶的sds-page对比表示。重组酶在c末端具有rshhhhhh的添加序列,比y586-1株纯化酶约大了1kda。图中,左侧的数字的单位为kda。图12为表示利用x射线结晶结构解析得到的本发明的酶(重组体的纯化酶)的立体结构的图。具体实施方式本发明涉及从属于节杆菌(arthrobacter)属的微生物分离的酮糖3-差向异构酶,单位培养液的酶生产量高,在热稳定性方面具有特征性的性质。节杆菌属的微生物作为α-淀粉酶、异麦芽糖葡聚糖酶、蔗糖酶(invertase)、尿素酶、葡聚糖酶、α-葡糖基转移酶、果糖基转移酶等的酶起源微生物、以及作为海藻糖、维生素k(甲萘醌)的生产菌,是被收录于日本的食品添加物清单中的安全的微生物。酮糖(ketose)是将糖质以其结构进行分类时使用的化学术语,是在链状结构的内部含有1个酮基(酮性羰基)的单糖类的总称,分子式为cnh2non(n≥3)。作为代表的酮糖有果糖(fructose),是还包含戊糖等的术语。本发明中,酮糖是在广义上还包含戊糖等的酮糖,在记载为己酮糖的情况下,表示具有酮糖结构的己糖的己酮糖。具体来说为果糖、阿卢糖、塔格糖和山梨糖,d-或l-酮糖是指这些糖的d-体和l-体。因此,本发明的酮糖3-差向异构酶具有使d-或l-酮糖的3位差向异构化并生成对应的d-或l-酮糖的活性,具体来说,能够催化d-或l-果糖与d-或l-阿卢糖之间发生的相互转换、以及d-或l-塔格糖与d-或l-山梨糖之间发生的相互转换。而且,也能够作用于其它全部的酮糖。本发明的酮糖3-差向异构酶能够通过以下方法制备:将属于节杆菌(arthrobacter)属的、具有酮糖3-差向异构酶产生能力的微生物进行培养,从在培养液中生长的菌体中分离酮糖3-差向异构酶。作为属于节杆菌(arthrobacter)属的微生物,能够优选利用例如噬组氨醇节杆菌(arthrobacterhistidinolovorans)y586-1株及其突变株等。在进行本申请时,y586-1株已于2018年11月7日在位于日本国千叶县木更津市上总镰足2-5-8的国家高级工业科学技术学院国际专利生物保藏中心(独立行政法人制品评价技术基础机构专利微生物保藏中心)进行国际保藏,以保藏编号nitebp-02813进行保藏。关于y586-1株,对于其16srrna基因的碱基序列利用blast检索(日本dna数据库)与已知菌种进行了同源性检索,结果发现,根据碱基序列的同源性为98%以上的菌株名,最初被鉴定为原玻璃蝇节杆菌(arthrobacterprotophormiae)。之后,在日本食品分析中心的鉴定中判定为噬组氨醇节杆菌(arthrobacterhistidinolovorans),因此对于y586-1株进行了全基因组的序列检索,结果确定为噬组氨醇节杆菌。因此,向国家高级工业科学技术学院国际专利生物保藏中心递交了保藏编号nitebp-02813的菌株的名称变更请求,于2019年10月4日被接受。本发明的酮糖3-差向异构酶的粗酶液能够通过以下方式制备:将节杆菌属的酮糖3-差向异构酶生产菌在添加有d-阿卢糖的无机盐培养基中进行通气培养后,通过离心分离从培养液中回收菌体,将回收的菌体利用10mmtris-hcl(三羟甲基氨基甲烷盐酸盐)缓冲液(ph7.5)清洗后,悬浊于10ml的10mmtris-hcl缓冲液(ph7.5)中,添加作为溶菌酶的溶菌素(lysozyme)通过酶处理将细胞破碎,或者将菌体悬浊液在冰水中一边冷却一边利用超声波匀化器将细胞破碎,将这些破碎物离心分离,取其离心上清液。该纯化前的粗酶液的酮糖3-差向异构酶的活性能够通过d-果糖作为底物并测定d-阿洛糖的生成量来确认。作为逆反应的从d-阿卢糖向d-果糖的差向异构化的酶活性也能够以同样的条件进行测定。酮糖的转换反应通常在以下条件进行。底物浓度为1~60%(w/v),优选为约5~50%(w/v),反应温度为10~70℃,优选为约30~60℃,反应ph为5~10,优选为约7~10,反应时间能够适当选择,在批次反应的情况下,通常从5~50小时的范围选择。粗酶液利用改变聚乙二醇(peg)的浓度进行分取,将存在peg和酮糖3-差向异构酶的上清液利用离子交换树脂色谱法吸附目标的酶并将peg冲洗掉,之后使吸附的酶洗脱。之后,将酶洗脱液依次利用离子交换色谱法和疏水色谱法进行纯化,由此能够分离纯化酶。为了确认酶经过了纯化,施以sds-page(凝胶浓度12.5%),确认得到了单一的条带以及确认了分子量。如上所述纯化得到的本发明的酮糖3-差向异构酶在sds-page中显示为约36kda的分子量,是其活化能够通过金属离子进行调节的金属酶。与底物的反应可以在浓度0.5~5mm的选自锰、镁、铁、钴和铝中的金属离子的存在下进行。本发明的酮糖3-差向异构酶具有规定的氨基酸序列。然而,本发明的酶的基因无法使用pcr扩增的方法或已有的蛋白质数据库进行克隆,因此确定y586-1株的全基因组序列,构建了编码该基因组序列中的全orf的蛋白质群的数据库。对于将纯化后的酶利用胰蛋白酶处理得到的片段,利用maldi-tof-ms进行解析,由于与得到的片段氨基酸一致,最终,能够确定本发明的酮糖3-差向异构酶的氨基酸序列。作为其例子,可以列举具有序列编号1所示的氨基酸序列的蛋白质、或者具有与其同源的氨基酸序列、且维持同等的酮糖3-差向异构酶活性的蛋白质。同源的氨基酸序列是指例如与序列编号1的氨基酸序列具有70%以上的氨基酸序列的同一性、优选75%以上、更优选76、77、78、79或80%以上、更加优选85%以上、进一步优选86、87、88、89、90、91、92、93或94%以上、更进一步优选95%、96%、97%、98%以上的氨基酸序列的同一性。两个氨基酸序列或两个核酸序列(碱基序列)的同一性(%)能够通过例如以下的步骤来确定。首先,以能够进行最合适的比较的方式将二个序列并排。此时,例如,可以在第一序列导入间隔(gap),使与第二序列的比对最优化。当第一序列的确定位置的分子(氨基酸残基或核苷酸)与第二序列中的对应位置的分子相同时,可以说该位置的分子是同一的。两个序列的同一性是该两个序列中共通的同一位置的数量的函数(即,同一性(%)=同一位置的数量/位置的总数×100),优选还考虑比对的最优化所需间隔的数量和大小。另外,两个序列的比较和同一性的确定应使用数学上的算法来实现。作为能够用于序列的比较的数学算法的具体例,能够使用在karlin和altschul(1990)proc.natl.acad.sci.usa87:2264―68中记载的、在karlin和altschul(1993)proc.natl.acad.sci.usa90:5873―77中改良的算法,但不限于此。这样的算法被编入altschul等的(1990)j.mol.biol.215:403―10中记载的nblast程序和xblast程序(版本2.0)中。为了得到与本发明的核酸分子中等价的核苷酸序列,例如使用nblast程序,以score=100、wordlength=12进行blast核苷酸检索即可。本发明的dna是编码本发明的酮糖3-差向异构酶的基因,具有规定的碱基序列。作为其例子,可以列举编码序列编号1所示的氨基酸序列的dna序列、序列编号2所示的碱基序列、或具有与序列编号2所示的碱基序列同源的碱基序列且能够编码维持与序列编号1的蛋白质同等酮糖3-差向异构酶活性的蛋白质的dna序列。由序列编号2所示的碱基序列或与其互补的序列构成的dna是新型的化合物。本发明所涉及的dna能够通过组合公知的技术、例如组合杂交技术或pcr技术等来分离。另外,本发明所涉及的dna中还包括包含序列编号2所示的碱基序列的dna、与该dna和该dna的互补链在严格条件下杂交的dna、以及与该dna和该dna的互补链具有70%以上的序列同一性的dna。这里,严格条件是指能够由本领域技术人员容易地确定的杂交条件,一般来说,是依赖于探针长度、清洗温度和盐浓度而经验性确定的实验条件。通常,探针变长时,为了适当的退火而温度变高,探针变短时,温度变低。核酸彼此的杂交形成依赖于互补链在略低于其融点的环境中进行再退火的能力。更具体来说,作为严格条件,只要是作为能够分离上述dna的条件能够由本领域技术人员选择的条件即可,没有特别限定,例如优选在清洗阶段中,在42℃~70℃、优选在42℃~65℃的温度条件下、钠浓度为25mm~450mm、优选为25mm~500mm的条件。作为这样的条件,例如,可以列举在5×ssc(83mmnacl,83mm柠檬酸钠)、0.1%sds中,在42℃进行清洗的条件等。而且,通过设为提高温度等更高的严格条件,能够得到同源性高的dna。严格条件(严格条件)是使用最终为5×ssc、0.2%sds溶液,在45℃(非常低的严格)、50℃(低的严格)、55℃(中间高度的严格)、60℃(中等程度高的严格)、65℃(高的严格)和70℃(非常高的严格)分别进行3次每次15分钟的清洗。另外,同源的碱基序列是指“具有70%以上的序列同一性的dna”,只要是与序列编号2的碱基序列具有70%以上的序列同一性的dna,无论是多少%均可,例如可指与其具有70%以上、优选75%以上、更优选76、77、78、79或80%以上、更加优选85%以上、进一步优选86、87、88、89、90、91、92、93或94%以上、更进一步优选95%、96%、97%、98%以上的碱基序列的同一性。也能够将本发明的dna插入能够自主复制的适当载体中制成重组载体。重组载体由dna和能够自主复制的载体构成,只要能够获得dna,就能够通过常规方法的重组dna技术比较容易地制备。依照克隆或蛋白质的表达这样的使用目的,或者依照宿主细胞,能够选择适当的载体。作为这样的载体的例子,可以列举pbr322、puc18、pub110、ptz4、pc194、phv14、trp7、yep7、pbs7等的质粒载体、λgt·λc、λgt·λb、ρ11、等的噬菌体载体。能够将这样操作得到的重组载体导入例如大肠杆菌、枯草菌、放线菌、酵母等适当的宿主细胞。导入方法使用磷酸钙共沉降法、电穿孔法、脂质转染法、微注射法等的公知的方法。为了获得转化的宿主细胞,能够应用集落杂交法等。本发明的具有酮糖3-差向异构酶活性的蛋白质的制造方法没有特别限定,能够采用公知的方法。具体来说,本发明的酮糖3-差向异构酶能够通过如下所述来制造:将具有本发明的酮糖3-差向异构酶生产能力的微生物或将本发明的具有酮糖3-差向异构酶活性的蛋白质或利用编码后述的该蛋白质的氨基酸取代突变体的dna转化得到的宿主细胞在营养培养基中培养,从所得到的培养物收集具有酮糖3-差向异构酶活性的蛋白质。培养方法能够使用公知的手法,例如能够使用液体培养和固体培养均可。如上所述操作培养菌体后,将本发明的蛋白质纯化、回收。蛋白质的纯化、回收方法能够自由地选择公知的方法来进行,例如,从培养液回收的情况下,能够通过例如对培养上清液通过过滤、离心处理等去除不溶物后,适当组合利用了超滤膜的浓缩、硫酸铵沉淀等的盐析、透析、离子交换树脂等的各种色谱法等来进行分离、纯化。另外,从菌体内回收的情况下,例如将菌体利用溶解酶处理、超声波处理等破碎后,同样地进行分离、纯化。另外,本发明的酮糖3-差向异构酶与其它的差向异构酶、异构酶同样地,能够将酶固定化来使用,能够通过各种固定化方法得到活性高的固定化酶。通过使用固定化酶,能够连续地进行大量的差向异构化反应,能够利用公知的固定化方法、例如载体结合法、交联法、凝胶包裹法、微胶囊化法等制成固定化酶,另外,载体可以是任意的载体。在载体结合法中,使用物理吸附、离子键和共价键等使酶与载体(例如纤维素、葡聚糖、琼脂糖等的多糖类的衍生物、聚丙烯酰胺凝胶、聚苯乙烯树脂、多孔性玻璃、金属氧化物等)结合。在交联法中,能够通过使用具有2个或以上的官能团的试剂,使酶彼此交联而固定化。作为交联试剂,能够使用制造schiff碱的戊二醛、形成肽键的异氰酸衍生物、n,n′-乙烯基马来酰亚胺、发生重氮偶合的双重氮联苯胺、或者烷基化的n,n′-聚亚甲基双碘乙酰胺等。在凝胶包裹法中,能够使用在高分子凝胶的细微格子中收纳酶的格子型和利用半透膜的高分子的被膜将酶包裹的微胶囊型。在格子型的方法中,能够使用聚丙烯酰胺凝胶、聚乙烯醇、光固性树脂等的合成高分子物质、淀粉、魔芋粉、明胶、海藻酸、卡拉胶等的天然高分子物质这样的高分子化合物。在微胶囊型的方法中,能够使用己二胺、癸二酰氯、聚苯乙烯、卵磷脂等。载体上,能够将上述5种酶分别固定,或者也可以将选自这些之中的2、3、4或5种酶组合后固定。将本发明的酮糖3-差向异构酶固定化的方法的一个实施方式为使用粗酶液的固定化。将通过对菌体悬浊液超声波处理得到的含有酮糖3-差向异构酶的粗酶液添加到离子交换树脂等中,通过在低温下使其结合,能够将酮糖3-差向异构酶固定化。为了从菌体内取出酮糖3-差向异构酶,需要将菌体细胞壁破碎,有利用利用超声波处理或者溶菌素等的酶处理的破碎方法,如上所述。已知通过超声波处理得到的粗酶液中大量含有具有活性的酮糖3-差向异构酶。作为从如上所述得到的粗酶液将酶固定化的载体,也能够使用作为固定化载体公知的任意的载体。各种离子交换树脂、合成吸附剂等便利而被常用。另外,也能够使用利用海藻酸钠的包裹法。即,关于酮糖3-差向异构酶的固定化所使用的固定化用载体,只要能够进行该酶的固定化,就没有特别限制,例如可以列举离子交换树脂、聚乙烯醇、聚丙烯、丙烯酸树脂、壳聚糖、疏水吸附树脂、螯合树脂、合成吸附树脂等的有机高分子载体;硅藻土、硅藻土、高岭石、二氧化硅凝胶、分子筛、多孔质玻璃、活性碳、陶瓷等的无机载体。另外,将微生物制成固定化酶的使用时,能够将吡啶鎓化合物(例如电气化学工业株式会社制的商品名dac)、海藻酸盐作为固定化用载体使用。这些固定化用载体能够单独使用1种,另外也可以将2种以上组合使用。这些固定化用载体之中,从由固定化维持酮糖3-差向异构酶的活性、低价且压损失小、容易操作等观点出发,优选离子交换树脂,例如作为碱性阴离子交换树脂,强碱性阴离子交换树脂或者弱碱性阴交换树脂均能够使用,例如,作为强碱性阴离子交换树脂,可以列举hpa25l(三菱化学公司制)、ira904cl(organo公司制)等,作为弱碱性阴离子交换树脂,可以列举wa30(三菱化学公司制)、fpa54、fpa95(organo公司制)等。作为合成吸附剂,可以列举xad7hp(organo公司制)等。将弱碱性阴离子交换树脂用作载体制造固定化酶的情况下,固定化的酮糖3-差向异构酶在其异构化能消失后容易地洗脱,因此能够非常简便地进行固定化载体的再生,由此能够降低生产成本。如上,与将存在于生产酮糖3-差向异构酶的节杆菌属微生物的菌体破碎物中的酮糖3-差向异构酶粗酶固定化于载体的固定化酶进行的说明同样,在本发明中,作为固定化酮糖3-差向异构酶,可以使用将纯化品或粗纯化品的酮糖3-差向异构酶固定化的酶,另外也能够使用将产生酮糖3-差向异构酶的微生物固定化的酶。而且,与粗酶、纯化酶同样,可以使用固定有大肠杆菌表达酶的固定化蛋白质也是不必多言的。使用本发明的酮糖3-差向异构酶,将可以成为底物的酮糖的3位差向异构化,由此转换成对应的酮糖,由此能够制造对应的酮糖。本发明的酮糖3-差向异构酶对于d-阿卢糖或d-果糖的3位的差向异构化活性高,因此能够从可以成为底物的d-果糖高效地大量生产作为生产物的稀少糖的d-阿卢糖。另外,也能够向本发明的酮糖3-差向异构酶的基因导入突变,通过将对应的氨基酸残基通过位点特异性的突变操作取代为其它的氨基酸残基,制备具有各种氨基酸取代的突变体,由此能够得到与没有氨基酸取代的野生型酶相比耐热性更高的酶。以在反应温度70℃和50℃的酮糖3-差向异构酶活性之比(t70/t50)或者在60℃保温1小时后的残留活性这2个指标评价耐热性。根据立体结构解析显示,本发明的酶如图12所示,为同源四聚体(homotetramer),预测本发明的酶的活性部位残基为第6位、63位、110位、152位、179位、182位、205位、211位、240位的氨基酸,预测金属离子结合部位推定残基为第146位、177位、205位、240位的氨基酸,因此不对于这些氨基酸附近的氨基酸进行取代,而对其它的部位的氨基酸进行取代,由此制作突变体。图12是表示由x射线结晶结构解析得到本发明的酶(重组体的纯化酶)的立体结构的附图。使用重组体的纯化酶进行结晶化,利用x射线结晶解析确定来自y586-1株的酮糖3差向异构酶的结构。本发明的酶是4个亚单位聚合形成的同源四聚体(mola、mola、mola、mola)。通过sds-page确认的具有分子量约36kda的各亚单位结构显示为β/α桶状结构,在中心部的活性部位上结合有金属离子。令人惊奇的是,即使是与本发明的酮糖3-差向异构酶的氨基酸序列的同一性为70%多的突变体,也能够保持酶活性,并且,与序列编号1的野生型酶相比,在反应温度70℃和50℃的酮糖3-差向异构酶活性的比(t70/t50)更高,并且,在60℃保温1小时后的残留活性也更高。另外,序列编号1所示的酮糖3-差向异构酶与以前报告的球形节杆菌(arthrobacterglobiformis)来源的酮糖3-差向异构酶(专利文献5)的氨基酸序列相比,预测氨基酸残基不同的部位对酮糖3-差向异构酶活性的贡献少,将位于序列编号1中的该不同部位的氨基酸等通过位点特异性的突变导入进行碱基取代来使其发生突变,制作了各种酮糖3-差向异构酶突变体,从其中选取耐热性高于野生型的氨基酸取代突变体。位点特异性的突变导入法例如能够使用反向pcr法、退火法等(村松等编,“改訂第4版新遺伝子工学ハンドブック”,羊土社,p.82-88)任意的方法进行。依照需要也能够使用stratagene公司的quickchangeiisite-directedmutagenesiskit、quickchangemultisite-directedmutagenesiskit等的各种市售的位点特异性的突变导入用套装。位点特异性的突变导入最一般的方法是使用含有需要导入的核苷酸突变的突变引物的方式进行。这样的突变引物如下设计即可:在含有编码基因内的改变对象的氨基酸残基的核苷酸序列的区域进行退火,并且,含有将编码该改变对象的氨基酸残基的核苷酸序列(密码子)替换为具有编码改变后的氨基酸残基的核苷酸序列(密码子)的碱基序列。氨基酸取代突变体是指将原有序列的氨基酸取代为不同的氨基酸的突变体,关于取代,有保存性取代也有非保存性取代,没有特别限定,在本发明的优选实施方式中,取代为保存性取代。保存性取代相当于将碱性的氨基酸取代为碱性的氨基酸、将酸性的氨基酸取代为酸性的氨基酸、将极性的氨基酸取代为极性的氨基酸这样的具有相同性质(碱性、酸性或中性)、极性(亲水性或疏水性)的氨基酸之间的取代、或芳香族氨基酸之间或脂肪族氨基酸之间的取代等。保存性取代例如在碱性氨基酸(arg、lys、his)、酸性氨基酸(glu、asp)、中性非极性氨基酸(gly、ala、val、leu、ile、met)、脂肪族氨基酸(ala、val、leu、ile、met)、极性氨基酸(gln、asn、ser、thr)、芳香族氨基酸(phe、trp、tyr)等的组内进行。另一方面,非保存性取代是指与上述组外的成员的氨基酸相替换的情况,例如,为了防止3维结构中在蛋白质中发生折叠而使cys缺失,或者取代为其它的氨基酸。或者,为了保持亲水性/疏水性的平衡,或为了使合成变得容易而提高亲水度,考虑作为氨基酸的疏水性/亲水性的指标的氨基酸的亲水性指数(j.mol.biol.(1982)vol.157,p.105-132),进行氨基酸的取代。另外,也有时取代为位阻效应比原有的氨基酸小的氨基酸、将具有电荷的氨基酸取代为不具有电荷的氨基酸。关于取代,既有保存性取代也有非保存性取代,例如可以列举将ala取代为ser或thr,将arg取代为gln、his或lys,将asn取代为glu、gln、lys、his或asp,将asp取代为asn、glu或gln,将cys取代为ser或ala,将gln取代为asn、glu、lys、his、asp或arg,将glu取代为asn、gln、lys或asp,将gly取代为pro,将his取代为asn、lys、gln、arg或tyr,将ile取代为leu、met、val或phe,将leu取代为ile、met、val或phe,将lys取代为asn、glu、gln、his或arg,将met取代为ile、leu、val或phe,将phe取代为trp、tyr、met、ile或leu,将ser取代为thr或ala,将thr取代为ser或ala,将trp取代为phe或tyr,将tyr取代为his、phe或trp,以及将val取代为met、ile或leu,但不限于这些。关于这些氨基酸残基的取代,其中能够取代的残基的分类仅为例示,能够取代的氨基酸残基不受该分类限定。制作本发明的酶中取代了1处氨基酸的突变体~取代了11处氨基酸的突变体和多重突变体并进行了耐热性试验,结果发现,关于在反应温度70℃和50℃的酮糖3-差向异构酶活性的比(t70/t50),37种中的30种突变体高于专利文献5所述的来自球形节杆菌(arthrobacterglobiformis)m30的对照酶(1.54),另外,关于在60℃保温1小时后的残留活性,37种中的37种突变体均高于来自球形菌的(30.8%),不仅如此,37种中的36种高于序列编号1的本发明的野生型酶的残留活性。本发明的酮糖3-差向异构酶在能够得到多个耐热性高于野生型酮糖3-差向异构酶的突变体的方面也优异。实施例以下,通过实验对本发明进行详细说明。需要说明的是,在以下的实验中,存在测定从d-阿卢糖转换为d-果糖的d-阿卢糖3-差向异构酶活性并记载为酮糖3-差向异构酶活性的情况、以及测定从d-果糖转换为d-阿卢糖的d-果糖3-差向异构酶活性记载为酮糖3-差向异构酶活性的情况。本发明不受以下实施例的任何限定。<实验1:菌株的来源和鉴定>本发明的发明人将筛选分离的多种菌在添加有d-阿卢糖的液体培养基中接种并进行振荡培养,以d-果糖作为底物并测定d-阿卢糖的生成量,由此测定了酮糖3-差向异构酶的活性。这样操作,作为最高活性的菌株,发现了微生物y586-1株,利用基于y586-1株的16srrna基因碱基序列同源性的系统解析,判定为属于原玻璃蝇节杆菌。菌株的鉴定(1)16srrna基因碱基序列同源性对于16srrna基因区域进行解析,确定了碱基数为1,469bp。(2)相同性检索对于该菌株的16srrna基因的碱基序列,通过blast检索(日本dna数据库)进行了与已知菌种的相同性检索。对于上述确定的碱基数1,469bp的碱基序列,根据同源性为98%以上的菌株名和同源性(%)的值,y586-1株的微生物确定为原玻璃蝇节杆菌(arthrobacterprotophormiae),该y586-1株于2018年11月7日在国家高级工业科学技术学院国际专利生物保藏中心进行了国际保藏,保藏编号为nitebp-02813。之后,由于被判定为噬组氨醇节杆菌(arthrobacterhistidinolovorans),因此向国家高级工业科学技术学院国际专利生物保藏中心递交了保藏编号nitebp-02813的菌株的名称变更申请,于2019年10月4日被接受。<实验2:噬组氨醇节杆菌(arthrobacterhistidinolovorans)y586-1株(保藏编号nitebp-02813)的培养>在将d-阿卢糖1.0%作为碳源、将硫酸铵作为氮源的无机盐培养基中,以无菌的方式添加噬组氨醇节杆菌(arthrobacterhistidinolovorans)y586-1株(保藏编号nitebp-02813)的种培养液1%(v/v),一边通气搅拌,一边在30℃培养24小时。所得到的培养液中的酮糖3-差向异构酶活性为约2.694单位/100ml培养液。以下,将该菌株省略简称为“y586-1株”。分别在含有d-阿卢糖1.0%的无机盐液体培养基、酵母提取物液体培养基、肉汁液体培养基、tsb液体培养基中,分别以无菌的方式添加y586-1株的种培养液1%(v/v),一边通气一边搅拌,在30℃培养24小时。测定了培养24小时后的增殖(od600nm)和酮糖3-差向异构酶活性。将结果示于图2。结果发现,在所研究的培养基中,在增殖情况最低的无机盐培养基中的酶的生产量高。<实验3:粗酶的制备>通过离心分离从培养液中回收菌体。利用10mmtris-hcl缓冲液(ph7.5)清洗回收的菌体。之后,将菌体悬浊于10ml的10mmtris-hcl缓冲液(ph7.5)中后,将该菌体悬浊液在冰水中一边冷却一边利用超声波均质器(emersonjapan株式会社)进行细胞破碎。将破碎物以12000rpm离心20分钟,将其离心上清液作为粗酶。<实验4:粗酶的活性测定>纯化前的酶的酮糖3-差向异构酶的活性通过将d-阿卢糖作为底物并测定d-果糖的生成量来测定。具体来说,酶反应液组成使用50mmtris-hcl缓冲液(ph7.5)、0.1md-阿卢糖、酶液、2mm氯化镁,在70℃反应10分钟,通过煮2分钟停止反应,利用hplc测定反应后的液组成。酶活性1单位定义为:在上述条件下,将d-阿卢糖差向异构化,在1分钟生成1μmol的d-果糖的酶量。对于作为逆反应的从d-果糖向d-阿卢糖的差向异构化的酶单位,也是在同样条件下测定并以相同方式进行定义。<实验5:酶的纯化>1.利用离子交换色谱法、疏水色谱法进行的纯化将粗酶液利用离子色谱法进行纯化。使用的色谱柱是利用缓冲液(20mmtris-hclph7.5)平衡化后的hitrapqhp,使用duoflow系统以流速5ml/min以1mnacl的浓度梯度从0%至100%以每次分取5ml的组分。回收检测出酶活性的组分,通过离子交换色谱分离得到纯化酶。2.将通过离子交换色谱分离进行了纯化的酶进一步利用疏水色谱法进行纯化。使用的色谱柱为hitrapphenyl,向酶液中以成为2m的方式添加硫酸铵并使其溶解,以流速5ml/min使2m的硫酸铵的浓度100%降低至0%来进行洗脱,每次分取5ml。收集检测出酶活性的组分,通过透析去除硫酸铵,得到疏水色谱分离纯化酶。3.聚丙烯酰胺凝胶电泳依照常规方法进行sds-page(凝胶浓度12.5%),确认了纯化酶的纯度。在图3中,左边为标准分子量的蛋白质,中央的列为使用疏水色谱法纯化后的酶。根据该结果,在约36kda确认到单一的条带,由此确认了酶被纯净地纯化,关于经过纯化的本发明的酶的亚单位的分子量,利用sds-page得到的分子量为约36kda。<实验6:粗酶、纯化酶的物理化学性质的测定>作为比较对照的酶,使用了专利文献5所述的来自球形节杆菌(arthrobacterglobiformis)m30的酮糖3-差向异构酶。以下,有时称为“对照酶”,记为“agdae”。对于作为粗酶和纯化酶的酮糖3-差向异构酶活性的测定,进行与实验4同样的实验来进行酶反应。各条件下进行10分钟的酶反应,将从d-阿卢糖在1分钟生成1μmol的d-果糖的酶量作为1单位。反应后,将反应液放入沸腾液中3分钟来使反应停止,经过脱离子处理后,通过hplc分析测定了生成的d-果糖。1.反应最佳温度(野生株的粗酶)在50-80℃的各种温度中进行了反应。将求得最佳温度的反应条件示于表1。从60℃至80℃的温度范围为粗酶的优选的温度,根据表示反应温度和相对活性的测定结果的图1可知,本发明的酶的粗酶的最佳温度在添加mg2+离子时为70℃。[表1]对照酶的粗酶的最佳温度也为70℃,但本发明的酶的粗酶如图1所示,特别是,关于在将显示最高活性的70℃设为100时的相对活性(%),在80℃显示77.6%的相对活性,在60℃显示80.3%的相对活性,对照酶的粗酶在80℃显示58.7%的相对活性,在60℃显示96.8%的相对活性,本发明的酶具有特别是在高于最佳温度的温度能够维持活性的特征。通过同样的反应条件,求得了本发明的纯化酶(野生株的纯化酶)的反应最佳温度,结果如图5所示,为60℃。另外,图6表示将本发明的纯化酶与对照酶保温10分钟后的残留活性。在保温10分钟后的温度稳定性中,本发明的酶在60℃的相对活性的减少小于对照酶,而且在70℃时,其相对活性的减少之差扩大,由此可知,本发明的酶与对照酶相比,是在高温更为稳定的酶。2.酮糖3-差向异构酶活性使用实验3中制得的粗酶液、50mmtris-hcl缓冲液(ph7.5)、0.1md-阿卢糖、2mm氯化镁,在70℃反应10分钟,通过煮2分钟停止反应后,利用hplc测定反应后的液组成。酶活性1单位(u)是在上述条件下将d-阿卢糖差向异构化,在1分钟生成1μmol的d-果糖的酶量。将反应条件示于表2。[表2]该结果表明,从培养液100ml得到的粗酶的总活性为2.694u,而从培养液100ml得到的对照酶的粗酶的总活性为0.847u,本发明的酶的活性与对照酶的活性相比,高至约3倍。3.反应最佳ph(野生株的纯化酶)在测定中,使用d-阿卢糖作为底物,使用各种缓冲液ph4~11在70℃反应10分钟,利用hplc测定生成的d-果糖,求得反应的最佳ph。将反应条件示于表3。将使用的缓冲液示于表4。[表3][表4]将结果示于图4。本发明的酶的纯化酶的反应最佳ph为6~8,相对于此,对照酶的反应最佳ph为7.5~9,偏碱性,本发明的酶的反应最佳ph更为宽泛,并且,在更靠酸性下显示高的活性。4.热稳定性(野生株的粗酶)将在表2所示的上述2.中求得最佳温度的反应条件(10分钟)下在60℃的活性设为100时,通过测定在60℃保温处理1小时后的活性,求得该相对活性,研究了酶的热稳定性。作为热处理条件,使用粗酶液、缓冲液(50mmtris-hclph7.5)、2mmmgcl2,制成总量200μl,将其在60℃保持1小时后,在冰水中冷却10分钟后,依照常规方法测定了残留的酶活性。如表7所示,关于在60℃保温处理1小时后的残留活性,本发明的粗酶为49.4%,相对于此,对照酶的残留活性为30.8%,由此判明了本发明的酶具有高热稳定性。5.酮糖3-差向异构酶的底物特异性(野生株的纯化酶)使用8种己酮糖探讨了纯化后的本发明的酶的底物特异性。酶反应组如下述表5所示,在各底物终浓度0.1m、终浓度50mm的磷酸缓冲液ph8.0中,在70℃反应10分钟后利用hplc分析测定由各个糖经过差向异构化生产的酮糖。将d-阿卢糖的差向异构化活性设为100,将对于各个酮糖的活性以相对活性示出。将d-果糖(d-fructose)、d-阿卢糖(d-allulose)、d-山梨糖(d-sorbose)、d-塔格糖(d-tagatose)、l-果糖(l-fructose)、l-阿卢糖(l-allulose)、l-山梨糖(l-sorbose)、l-塔格糖(l-tagatose)作为底物,活性以相对活性表示,示于表6和图7。[表5][表6]基质相对活性(%)d-阿卢糖100.0d-果糖43.4d-塔格塘72.2d-山梨糖痕量l-阿卢糖27.1l-果糖痕量l-塔格塘58.2l-山梨糖痕量本发明的酶(野生株的纯化酶)在己酮糖之中对于d-阿卢糖的活性最强,其次为d-塔格糖(d-tagatose)。这些底物特异性与其它的酮糖3差向异构酶相比较时,也可以被称为d-阿卢糖3-差向异构酶(dae),显示与与菊苣假单胞菌的d-塔格糖3-差向异构酶(dte)明显不同的特异性。6.耐热性(热稳定性)试验(重组体的粗酶)(1)反应温度70℃与50℃中的酮糖3-差向异构酶活性之比(t70/t50)对于本发明的酶(重组体粗酶)和对照酶的粗酶,在表2所示的上述2.中求得最佳温度的反应条件(10分钟)下测定了在70℃的活性和在50℃的活性,求得其比(t70/t50),探讨了耐热性。将结果示于表7。关于t70/t50,本发明的酶(重组体粗酶)为1.78,对照酶为1.54,由此显示本发明的酶(重组体粗酶)在高温下的活性相对高。(2)在60℃保温1小时后的残留活性对于本发明的酶(重组体粗酶)与对照酶的粗酶,将在表2所示的上述2.中求得最佳温度的反应条件(10分钟)下在60℃的活性设为100时,通过测定在60℃保温处理1小时后的活性,求得其相对活性作为酶的耐热性的指标。作为热处理条件,使粗酶液、缓冲液(50mmtris-hclph7.5)、2mmmgcl2,制成总量200μl,将其在60℃保持1小时后,在冰水中冷却10分钟后,依照常规方法测定了残留的酶活性。将结果示于表7。在60℃保温1小时后,本发明的酶(重组体粗酶)的残留活性为49.4,对照酶的残留活性为30.8,由此显示了本发明的酶(重组体粗酶酵)在60℃的热稳定性高。[表7]<实验7:固定化酶的制备>以下1~5是关于使用野生株的粗酶进行固定化的固定化实验,使用了与实验2同样地培养并回收的y586-1株的菌体。1.利用超声波处理菌体来获得粗酶将菌体10g(湿重量)悬浊于50mmtris-hcl缓冲液(ph7.5)10ml中,将该菌体悬浊液在冰水中一边冷却一边利用超声波匀化器进行细胞破碎。将破碎物以12000rpm离心30分钟,将其离心上清液作为粗酶液。2.粗酶的固定化利用纯水充分清洗后并使其溶胀后,向以50mmtris-hcl缓冲液(ph7.5)平衡化后的离子交换树脂或合成吸附剂中添加上述得到的粗酶液,在4℃历时24小时使粗酶蛋白质与其结合。接着,利用50mmtris-hcl缓冲液(ph7.5)进行清洗,得到了固定化酶。作为预备实验,使用强碱性阴离子交换树脂(三菱化学公司制的sa10a、sa11a、sa12a、nsa100、sa20a、pa306s、pa308、pa312、pa316、hpa25l、pa408、pa412、pa418和organo公司制的ira904cl)、弱碱性阴离子交换树脂(三菱化学公司制的wa10、wa20、wa21j、wa30和organo公司制的fpa54、fpa60cl、fpa95),或合成吸附剂(organo公司制的xad7hp,xad118on)进行固定化试验,通过离子交换树脂或合成吸附剂与粗酶液的吸附得到的固定化酶的活性表现率为30%以上,将强碱性阴离子交换树脂hpa25l、ira904cl、弱碱性阴离子交换树脂wa30、fpa54、fpa95、合成吸附剂xad7hp用于以后的试验。3.固定化酶的酶活性的测定方法固定化酶的酶活性的测定通过测定以d-阿卢糖作为底物进行酶反应时的d-果糖的生成量来进行。首先,将100mg的固定化酶树脂、tris-hcl缓冲液(ph7.5)(终浓度50mm)和d-阿卢糖(终浓度100mm)的溶液(400μl)作为反应液组成,在30℃恒温水槽反应10~30分钟后,通过在100℃煮2分钟来使反应立即停止。将该反应后的溶液冷却至室温,利用离子交换树脂(200ct和ira67的混合树脂(均为organo公司制))进行脱盐,进一步进行过滤器处理,作为分析样品。分析通过使用高效液相色谱法(色谱柱:gl-c611(hitachi)、温度:60℃、洗脱液:0.1mmnaoh、流速:1.0ml/分钟、检测器:rid-20a(岛津))测定生成的d-果糖的峰面积来进行。4.酶固定化所使用的载体导致的酶活性的比较为了确认用于酶固定化的载体带来的影响,比较了固定化于hpa25l、wa30、ira904cl、fpa54、fpa95、xad7hp的各载体的本发明的酶的酶活性。需要说明的是,相对活性通过将比较样品之中峰面积最大的样品作为100算出而求得。图8表示各种固定化酶的相对活性。使用合成吸附剂xad7hp制作的固定化酶的活性最高。被固定化的粗酶量变多时,各树脂的相对活性均变高。5.温度导致固定化酶的酶活性的比较在30-80℃的各个温度进行反应,测定各种固定化酶的载体的相对活性,将结果示于图9。无论是否添加mg2+离子,利用了合成吸附剂的xad7hp的固定化酶在常温下相对活性高,利用了作为阴离子交换树脂的hpa25l、ira904cl、wa30的固定化酶在高温下相对活性高,可知应当依照反应温度选择固定化载体。<实验8:编码酶的dna的克隆以及包含该dna的重组载体和转化宿主细胞的制备>从噬组氨醇节杆菌(arthrobacterhistidinolovorans)y586-1株克隆出编码酮糖3-差向异构酶的dna,制作能够自主复制的重组dna,确定编码酶的dna的碱基序列,和制备转化微生物。<实验8-1:染色体dna的全碱基序列的确定>本菌的酮糖3-差向异构酶与已有的类似酶不同,无法通过pcr扩增的方法或已有蛋白质数据库来分离。为此,确定了y586-1株的全基因组序列,构建了其基因组序列中的编码全orf的蛋白质群的数据库。将y586-1株培养菌体作为供试菌体委托株式会社macrogenjapan,使用pacbio-rsii/sequel进行了次世代序列解析。其结果,得到了碱基数4,948,442bp与188,677bp的2个重叠群。该2个重叠群为约5.1mb,因此可以认为能够覆盖噬组氨醇节杆菌(arthrobacterhistidinolovorans)y586-1株的全基因组序列。<实验8-2:蛋白质数据库的构建>基于所得到的约5.1mb的dna序列,使用prokka程序推定4,734个orf,对于各个orf推定了氨基酸序列。将该4,734个氨基酸序列作为y586-1株的蛋白质数据库。<实验8-3:酮糖3-差向异构酶活性蛋白质的鉴定>使用上述的蛋白质数据库,登录蛋白质鉴定系统的mascotserver(matrixscience公司),进行了可见酮糖3-差向异构酶活性的蛋白质的鉴定。供试样品使用在国际公开[0049]段的sds-page的36kda的条带,在还原处理、烷基化处理后,将经过胰蛋白酶消化的片段供于maldi-tof-ms解析(图10)。作为其结果,发现与由下述289个氨基酸构成的序列1(序列表的序列编号1)的氨基酸序列中画有下划线所示的氨基酸序列具有87%的相似性,由此,强烈暗示由序列编号1的氨基酸构成的本发明的蛋白质为y586-1株的酮糖3-差向异构酶。[序列1](序列编号1)mkigchglvwtgrfdaegirysvqktkeagfdliefplmdpfsfdvataksalaehgltasaslglseatdvssedpaivkageellnraldvlaelgatdfcgviysamkkymepateqglsnskaavgrvvdraaglginvslevvnryetnvlntgrqalsylsdvkrpnlgvhldtyhmnieesdmfspvldtaealkyvhigeshrgylgtgsvdfdnffkalgrigydgpvvfesfssavvapdlsrmlgiwrnlwadneelgahanafirdkltaiktielh(序列1使用y586-1株的蛋白质数据库鉴定的氨基酸序列的下划线部所示的氨基酸序列为与在maldi-tof-ms中得到的峰一致的序列。)<实验8-3:酮糖3-差向异构酶基因的分离>合成通过氨基酸序列确定的基因的dna序列(序列表的序列编号2),重组入pqe60载体(qiagen公司),将表达用大肠杆菌转化。使用构建的大肠杆菌表达系进行了诱导酶的确认。sds-page的结果如图11所示,在可溶性组分中确认到在c末端添加有rshhhhhh的诱导蛋白质。重组酶在c末端具有rshhhhhh的添加氨基酸序列,因此比y586-1株纯化酶大了约1kda。另外,还确认了该条带的酮糖3-差向异构酶活性。[序列2](序列编号2)atgaaaattggctgccacggcctggtatggaccggccgtttcgacgctgaaggcatccgctactccgtccagaagaccaaggaagccgggtttgatctgatcgaattcccgctcatggatcccttctccttcgatgtggccacggcaaagtcggcactcgcagagcatggtttgaccgcctccgcatcattgggactttccgaagctacggatgtcagcagtgaagatccggccattgtgaaagcgggggaggagttgctcaaccgtgcccttgatgttcttgcggagctgggtgccaccgacttctgcggcgtgatctacagtgcgatgaagaagtacatggagccggccaccgagcaaggcttgagcaacagcaaggccgctgtcgggagggtggtcgacagggctgctggcctgggcatcaacgtctcgcttgaggtcgtgaaccggtatgaaaccaacgtgctgaacaccgggcggcaggctctgtcctacctctctgatgtcaagcggccgaatctaggcgttcatttggatacttaccacatgaacatcgaggaatcggacatgttctctccggtgctggacaccgccgaggctcttaagtacgtgcacattggcgagagccaccgaggttacctcggcaccgggagcgtcgatttcgacaacttcttcaaggctcttggccgcatcggctacgacggaccggtcgtcttcgaatcattctcctccgcggtcgtggccccggatctgagccgcatgcttggcatctggcgcaacctgtgggcggacaacgaagaactcggcgcccacgccaacgccttcatacgcgacaaactcacggccatcaagaccatcgaactgcactaa(序列2使用y586-1株的蛋白质数据库鉴定的dna序列下划线部所示的相对于终止密码子的碱基在克隆时被去除。)<实验9:与本发明的酶的氨基酸序列的同一性在70%以上的突变体及其酶活性>制作了与序列1的氨基酸序列具有78.5%的氨基酸序列同一性、下述序列3(序列表的序列编号3)的突变体、以及具有76.8%的氨基酸序列同一性的、下述序列4(序列表的序列编号4)的突变体,以与上述实验6的2.和6.相同的方法,测定了该粗酶的酶活性、耐热性。[序列3](序列编号3)(下划线部为与序列编号1不同的氨基酸)mnigchglvwtgtfdadgirlavektkqagfdliefplmdpfsfdvaaaqaalaehglavsaslglsdetditssdpavvaagealllravdvlaelggthfcgviysamkkymdpvtpeglassrrtiarvadhaaergvsvslevvnryetnvlntarqalaylgevdrpnlgihldtyhmnieesdmfapvldaapalryvhigeshrgylgtgtvdfdtffkalgrigydgpivfesfssavvapdlsrmlgiwrnlwtdndelgahanayirdklvavdsirlh[序列4](序列编号4)(下划线部为与序列编号1不同的氨基酸)mnigchglvwtgnfdaegirlavhktreagfdliefplmdpftfdvsvakdaleeydiavsaslglseetdvtsadpavaaageallikavdvladlggehfcgviysamkkymepvtpeglasskaaiarvadhaaargvsvslevvnryetnvlntarqalayiaevdrpnlgihidtyhmnieesdmftpvldaapalryvhigeshrgylgtgtvdfdtffkalgrigyngpivfesfssavvapdlsrmlgiwrnlwndndelgahanayirdklvavdsirlh本发明的酶的活性部位残基推测为第6位、63位、110位、152位、179位、182位、205位、211位、240位的氨基酸,金属离子结合推定部位残基推测为第146位、177位、205位、240位的氨基酸,因此在这些氨基酸附近不进行氨基酸取代。将重组体的粗酶的结果示于以下的表8。[表8]表8中,y586dae1是指属于来自y586-1株的酮糖3-差向异构酶的d-阿卢糖3-差向异构酶。以下相同。如表8所示,确认了即使具有约78%、77%的氨基酸同一性的突变体酶,只要是在除了活性部位、金属离子结合推定部位附近以外进行氨基酸取代,就能够维持酶活性,并且成为有用特性的耐热性的指标的t70/t50反而变高,其作为酶的特性不会发生变化。<实验10:本发明的酶的氨基酸取代突变体的制作及其酶活性>将本发明的序列编号1所示的酮糖3-差向异构酶的氨基酸序列与来自对照酶(球形节杆菌(arthrobacterglobiformis)的酮糖3-差向异构酶)(专利文献5)的氨基酸序列进行比较,推测氨基酸残基不同的部位对于酮糖3-差向异构酶活性的贡献小,将序列编号1的该不同的部位的氨基酸等通过位点特异性的突变操作进行碱基取代使其变化,制作各种酮糖3-差向异构酶突变体,从其中选取能够得到耐热性比野生型更高的氨基酸取代突变体的部位。通过位点特异性突变导入,首先制作了1个氨基酸取代的突变体。制作具有在目标突变导入部位引起氨基酸取代的1~2个碱基对加入了碱基取代的碱基序列的两条dna链的pcr引物,使用突变导入源的质粒dna与这些的两个引物进行pcr反应。将所得到的pcr片段转化至宿主大肠杆菌,从所得到的克隆提取质粒dna,通过序列分析确认了导入了目标突变。对于多重取代突变体,通过重复上述方法来制作。测定了通过重组得到的各1氨基酸取代突变体的粗酶的t70/t50和在60℃保温1小时后的残留活性。其中,选择t70/t50或在60℃保温1小时后的残留活性中的任一个高于对照酶的突变体,得到了表9的18个部位的氨基酸取代体。[表9]no突变氨基酸序号1h562t593a604p775l946l977d1018a1099a12810v12911v13212s14413s16714p17215e19916a20017k20218s218接着,制作将上述18个部位的氨基酸取代同时取代2~11个的任意的2~11重的突变体,测定了各重组突变体的粗酶的t70/t50和在60℃保温1小时后的残留活性。将结果示于表10和表11。在37种中的30种得到了t70/t50高于对照酶的agdae(1.54)的位点特异性的突变酶,其中,在37种中的20种得到了高于亲代野生型重组酶y586-1株dae(1.78)的突变酶(表10)。另外,在37种中的37种得到了在60℃保温1小时后的残留活性高于对照酶的agdae(30.8%)的位点特异性的突变酶,其中,在37种中的36种得到了高于亲代野生型重组酶y586-1株dae(49.4%)的突变酶(表11)。根据以上结果可知,本发明的酮糖3-差向异构酶是通过进行位点特异性的突变,能够得到多种热稳定性得到提高的突变体这样优异而有用的酶。[表10][表11]工业上的可利用性本发明的酮糖3-差向异构酶能够作用于游离的d-或l-酮糖、d-或l-戊酮糖,将这些酮糖的3位差向异构化,能够容易地生成对应的d-或l-酮糖、d-或l-酮糖。该反应拓宽了各种酮糖、特别是以d-果糖作为原料的d-阿卢糖的量产的道路。特别是,与现有的酮糖3-差向异构酶相比,从培养液得到的总活性高至对照酶的约3倍,因此,利用本发明的酶能够大量生产d-阿卢糖。另外,酶的最佳温度高至70℃,是高耐热性酶,因此能够在最佳温度的60~70℃附近的反应中带来更高的d-阿卢糖的生产收率。另外,本发明的酮糖3-差向异构酶能够通过各种固定化方法得到活性高的固定化酶,通过使用固定化酶,能够连续大量地进行差向异构化反应。通过能够工业化地固定化,能够大量生产目标的酮糖。而且,本发明的酮糖3-差向异构酶的氨基酸取代突变体中含有多种与突变前的本发明的酶相比热稳定性更高的酶。因此,本发明的酮糖3-差向异构酶及其制造方法的确立不仅对于制糖工业意义极大,还对于与其关联的食品、化妆品、医药品工业的工业意义极大。序列表<110>国立大学法人香川大学<120>新型酮糖3-差向异构酶<130>pct19347uk<150>jp2018-218287<151>2018-11-21<160>4<170>patentin3.5版<210>1<211>289<212>prt<213>噬组氨醇节杆菌(arthrobacterhistidinolovorans)<400>1metlysileglycyshisglyleuvaltrpthrglyargpheaspala151015gluglyileargtyrservalglnlysthrlysglualaglypheasp202530leuileglupheproleumetasppropheserpheaspvalalathr354045alalysseralaleualagluhisglyleuthralaseralaserleu505560glyleuserglualathraspvalsersergluaspproalaileval65707580lysalaglyglugluleuleuasnargalaleuaspvalleualaglu859095leuglyalathraspphecysglyvaliletyrseralametlyslys100105110tyrmetgluproalathrgluglnglyleuserasnserlysalaala115120125valglyargvalvalaspargalaalaglyleuglyileasnvalser130135140leugluvalvalasnargtyrgluthrasnvalleuasnthrglyarg145150155160glnalaleusertyrleuseraspvallysargproasnleuglyval165170175hisleuaspthrtyrhismetasnileglugluseraspmetpheser180185190provalleuaspthralaglualaleulystyrvalhisileglyglu195200205serhisargglytyrleuglythrglyservalasppheaspasnphe210215220phelysalaleuglyargileglytyraspglyprovalvalpheglu225230235240serpheserseralavalvalalaproaspleuserargmetleugly245250255iletrpargasnleutrpalaaspasnglugluleuglyalahisala260265270asnalapheileargasplysleuthralailelysthrilegluleu275280285his<210>2<211>870<212>dna<213>噬组氨醇节杆菌(arthrobacterhistidinolovorans)<400>2atgaaaattggctgccacggcctggtatggaccggccgtttcgacgctgaaggcatccgc60tactccgtccagaagaccaaggaagccgggtttgatctgatcgaattcccgctcatggat120cccttctccttcgatgtggccacggcaaagtcggcactcgcagagcatggtttgaccgcc180tccgcatcattgggactttccgaagctacggatgtcagcagtgaagatccggccattgtg240aaagcgggggaggagttgctcaaccgtgcccttgatgttcttgcggagctgggtgccacc300gacttctgcggcgtgatctacagtgcgatgaagaagtacatggagccggccaccgagcaa360ggcttgagcaacagcaaggccgctgtcgggagggtggtcgacagggctgctggcctgggc420atcaacgtctcgcttgaggtcgtgaaccggtatgaaaccaacgtgctgaacaccgggcgg480caggctctgtcctacctctctgatgtcaagcggccgaatctaggcgttcatttggatact540taccacatgaacatcgaggaatcggacatgttctctccggtgctggacaccgccgaggct600cttaagtacgtgcacattggcgagagccaccgaggttacctcggcaccgggagcgtcgat660ttcgacaacttcttcaaggctcttggccgcatcggctacgacggaccggtcgtcttcgaa720tcattctcctccgcggtcgtggccccggatctgagccgcatgcttggcatctggcgcaac780ctgtgggcggacaacgaagaactcggcgcccacgccaacgccttcatacgcgacaaactc840acggccatcaagaccatcgaactgcactaa870<210>3<211>289<212>prt<213>人工序列<400>3metasnileglycyshisglyleuvaltrpthrglythrpheaspala151015aspglyileargleualavalglulysthrlysglnalaglypheasp202530leuileglupheproleumetasppropheserpheaspvalalaala354045alaglnalaalaleualagluhisglyleualavalseralaserleu505560glyleuseraspgluthraspilethrserseraspproalavalval65707580alaalaglyglualaleuleuleuargalavalaspvalleualaglu859095leuglyglythrhisphecysglyvaliletyrseralametlyslys100105110tyrmetaspprovalthrprogluglyleualaserserargargthr115120125ilealaargvalalaasphisalaalagluargglyvalservalser130135140leugluvalvalasnargtyrgluthrasnvalleuasnthralaarg145150155160glnalaleualatyrleuglygluvalaspargproasnleuglyile165170175hisleuaspthrtyrhismetasnileglugluseraspmetpheala180185190provalleuaspalaalaproalaleuargtyrvalhisileglyglu195200205serhisargglytyrleuglythrglythrvalasppheaspthrphe210215220phelysalaleuglyargileglytyraspglyproilevalpheglu225230235240serpheserseralavalvalalaproaspleuserargmetleugly245250255iletrpargasnleutrpthraspasnaspgluleuglyalahisala260265270asnalatyrileargasplysleuvalalavalaspserileargleu275280285his<210>4<211>289<212>prt<213>人工序列<400>4metasnileglycyshisglyleuvaltrpthrglyasnpheaspala151015gluglyileargleualavalhislysthrargglualaglypheasp202530leuileglupheproleumetaspprophethrpheaspvalserval354045alalysaspalaleugluglutyraspilealavalseralaserleu505560glyleuserglugluthraspvalthrseralaaspproalavalala65707580alaalaglyglualaleuleuilelysalavalaspvalleualaasp859095leuglyglygluhisphecysglyvaliletyrseralametlyslys100105110tyrmetgluprovalthrprogluglyleualaserserlysalaala115120125ilealaargvalalaasphisalaalaalaargglyvalservalser130135140leugluvalvalasnargtyrgluthrasnvalleuasnthralaarg145150155160glnalaleualatyrilealagluvalaspargproasnleuglyile165170175hisileaspthrtyrhismetasnileglugluseraspmetphethr180185190provalleuaspalaalaproalaleuargtyrvalhisileglyglu195200205serhisargglytyrleuglythrglythrvalasppheaspthrphe210215220phelysalaleuglyargileglytyrasnglyproilevalpheglu225230235240serpheserseralavalvalalaproaspleuserargmetleugly245250255iletrpargasnleutrpasnaspasnaspgluleuglyalahisala260265270asnalatyrileargasplysleuvalalavalaspserileargleu275280285his当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1