使用非致病性细菌生产透明质酸的表达系统和使用该表达系统生产透明质酸的方法与流程
本发明涉及用于使用非致病性细菌生产透明质酸的利用组成型表达启动子的表达系统、包括该表达系统的非致病性细菌以及使用该非致病性细菌生产透明质酸的方法。
背景技术:
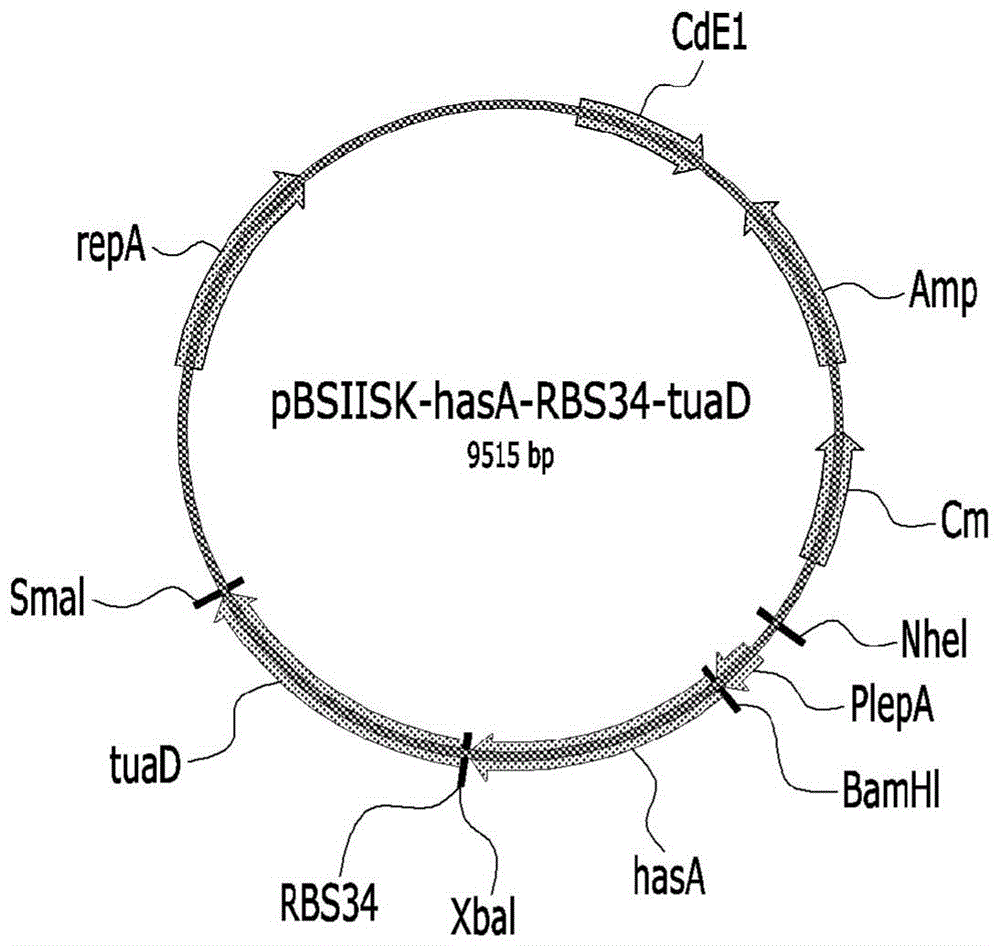
:透明质酸是由d-葡萄糖酸和n-乙酰基-d-葡萄糖胺的二糖单元组成的生物聚合物,并且取决于其分子量而用于各种用途,例如模制用填充剂、关节炎治疗剂和粘附抑制剂。该透明质酸可通过链球菌属(streptococcusspp.)菌株的发酵而产生,而链球菌属菌株是感染性微生物,并且在纯化过程中有可能被热原性物质等污染。为了改善这些问题,已经开发了通过用重组载体转化gras(generallyrecognizedassafe,通常被认为是安全的)菌株生产透明质酸的方法。韩国专利注册号10-0879908和10-0885163(us2003/175902)公开了将由组成型表达启动子(解淀粉芽孢杆菌(bacillusamyloliquefaciens)α-淀粉酶基因(amyq)启动子)调节的操纵子(由源自类马链球菌(streptococcusequisimilis)的透明质酸合酶基因(hasa)、源自枯草芽孢杆菌(bacillussubtilis)的udp-葡萄糖6-脱氢酶基因(tuad)和udp-葡萄糖焦磷酸化酶(gtab)组成)插入枯草芽孢杆菌基因组中,以能够产生透明质酸。随后,us2016/0237465公开了为了提高透明质酸的收率和透明质酸的分子量,使用含有由iptg诱导型强启动子(pgrac)调节的操纵子(由源自兽疫链球菌(streptococcuszooepidemicus)的hasa基因和源自枯草芽孢杆菌的tuad基因组成)的质粒转化枯草芽孢杆菌,从而显示出提高的收率和分子量。然而,在iptg诱导型的情况下,不仅必须使用昂贵的诱导剂iptg,而且必须进一步进行诱导剂处理的生产过程。因此,如果透明质酸的收率不低,则更优选组成型表达类型。技术实现要素:技术问题本发明的目的是提供一种表达系统或重组载体,该表达系统或重组载体使得能够在不存在诱导剂的情况下在非致病性菌株中合成透明质酸。本发明的另一个目的是提供导入了表达系统的菌株或通过重组载体转化的菌株以及使用该菌株生产透明质酸的方法。技术方案本文提供了用于生产透明质酸的表达系统,其包含udp-葡萄糖6-脱氢酶基因和透明质酸合酶基因;优选地,提供一种用于生产透明质酸的表达系统,其包含可操作地连接的转录启动子、透明质酸合酶基因、udp-葡萄糖6-脱氢酶基因的核糖体结合位点(rbs)和udp-葡萄糖6-脱氢酶基因。本发明的发明人致力于创建具有高的透明质酸生产收率的组成型表达系统,如稍后将描述的,通过选择各种启动子选择了最佳启动子,比较了由hasa基因和tuad基因组成的操纵子中tuad基因表达所需的各种核糖体结合位点(rbs),结果证实了合适的位点。由此,本发明的发明人生产了用于生产透明质酸的表达系统以及含有该表达系统的非致病性菌株,该表达系统由比使用iptg诱导型pgrac启动子具有更高的透明质酸生产效率的启动子和rbs组成,并且开发了一种利用该表达系统生产透明质酸的方法,从而完成了本发明。本发明的一种实施方式涉及一种用于生产透明质酸的表达系统,其包括可操作地连接的转录启动子、核糖体结合位点、udp-葡萄糖6-脱氢酶基因和透明质酸合酶基因。udp-葡萄糖6-脱氢酶基因和透明质酸合酶基因可以优选地配置一个操纵子,并且更优选地,其可以是其中透明质酸合酶基因、udp-葡萄糖6-脱氢酶基因的rbs和udp-葡萄糖6-脱氢酶基因按5'至3'方向顺序连接。本发明的另一种实施方式涉及用于生产透明质酸的转化菌株,优选为非致病性细菌,该转化菌株包含用于生产透明质酸的表达系统。本发明的另一种实施方式涉及用于生产透明质酸的转化菌株,该转化菌株包含用于生产透明质酸的表达系统,并且优选地涉及用于生产透明质酸的组合物,该组合物包含非致病性细菌。另外,本发明涉及用于生产透明质酸的转化菌株,该转化菌株包含用于生产透明质酸的表达系统,并且优选地涉及生产透明质酸的方法,该方法包括培养非致病性细菌的步骤。根据本发明的用于生产透明质酸的表达系统改善了透明质酸的生产收率和透明质酸的分子量,增加了透明质酸合成过程中的安全性,不使用昂贵的iptg诱导剂,因此具有降低生产成本的效果。根据本发明生产的透明质酸的分子量为500kda至10000kda,并且具有优异的优势,例如保湿效果、粘度增加、关节润滑作用、吸湿能力、弹性能力等。在下文中,将更详细地描述本发明。本发明的一种实施方式涉及用于生产透明质酸的表达系统,其包含udp-葡萄糖6-脱氢酶基因和透明质酸合酶基因,并且优选地涉及用于生产透明质酸的表达系统,其包括可操作地连接的转录启动子、核糖体结合位点(rbs)、udp-葡萄糖6-脱氢酶基因和透明质酸合酶基因。本发明提供的用于生产透明质酸的表达系统包括合成透明质酸所需的udp-葡萄糖6-脱氢酶和透明质酸合酶基因,并且可以提供基因表达所需的rbs和组成型表达启动子,从而即使在没有单独的诱导剂的情况下也产生透明质酸。根据本发明的用于生产透明质酸的表达系统可以应用于芽孢杆菌属(bacillusspp.)菌株,例如枯草芽孢杆菌或地衣芽孢杆菌(bacilluslicheniformis),但不限于此。适用于本发明的表达系统的转录启动子可以是芽孢杆菌属菌株中使用的组成型表达启动子,因此,该表达系统在没有表达诱导剂的情况下产生组成型表达的透明质酸合酶。另外,转录启动子可具有如下的转录水平,即透明质酸产量是具有包含p43启动子的表达系统的转化菌株的透明质酸产量的1.1至10倍。组成型表达启动子可以是例如p43、pmsm、ppbp、pylb、pyob、pyqe或pyvl,优选地,它可以是psigx、pyob或pyqe,但不限于此。可以选择并使用组成型表达启动子而没有限制,只要该组成型表达启动子可以获得与诱导型启动子相比相似或更高的透明质酸收率即可。psigx启动子可以使用seqidno:53和54的引物通过pcr从枯草芽孢杆菌168菌株的基因组中获得(芽孢杆菌遗传储备中心(bacillusgeneticstockcenter))。psigx、pyob或pyqe启动子可分别包括seqidno:62、seqidno:63或seqidno:64的核苷酸序列。下表1中显示了可用于本发明的启动子的具体实例,下表2中显示了用于产生每种启动子的具体引物组。[表1][表2]在本发明的一种实施方式中,作为使用psigx启动子将含有操纵子的载体转化到枯草芽孢杆菌中的结果,透明质酸的生产收率与使用需要iptg诱导剂的诱导型启动子的情况几乎相同(图4)。因此,可以看出,psigx启动子是适合于透明质酸生产的组成型表达启动子。转录启动子可以是以下的启动子,该启动子的透明质酸生产能力是具有含p43启动子的表达系统的转化菌株的透明质酸生产能力的1.1至10倍、1.15至10倍、1.5至10倍、2至10倍、3至10倍、4至10倍、5至10倍、1.1至9倍、1.15至9倍、1.5至9倍、2至9倍、3至9倍、4至9倍、5至9倍、1.1至8倍、1.15至8倍、1.5至8倍、2至8倍、3至8倍、4至8倍、5至8倍、1.1至7倍、1.15至7倍、1.5至7倍、2至7倍、3至7倍、4至7倍、5至7倍、1.1至6.5倍、1.15至6.5倍、1.5至6.5倍、2至6.5倍、3至6.5倍、4至6.5倍、5至6.5倍、1.1至6倍、1.15至6倍、1.5至6倍、2至6倍、3至6倍、4至6倍、5至6倍、1.1至5.5倍、1.15至5.5倍、1.5至5.5倍、2至5.5倍、3至5.5倍、4至5.5倍、或5至5.5倍。适用于本发明的表达系统的核糖体结合位点(rbs)可通过表达tuad基因以及hasa基因而在芽孢杆菌属中产生透明质酸。rbs可以高水平翻译编码udp-葡萄糖6-脱氢酶的基因,该核糖体结合位点可表现出透明质酸收率是使用tuadrbs时的透明质酸收率的1.1到3倍、1.15到3倍、1.2到3倍、1.1到2.5倍、1.15到2.5倍、1.2到2.5倍、1.1到2倍、1.15到2倍、1.2到2倍、1.1到1.5倍、1.15至1.5倍、1.15至1.5倍、1.1至1.3倍、1.15至1.3倍、或1.2至1.3倍。例如,rbs可以是bba_b0030、bba_b0031、bba_b0032、bba_b0033、bba_b0034、bba_b0035、tuad基因的rbs(tuadrbs)或pet质粒的rbs,其中的每个可包括seqidno:65至72的核苷酸序列,具体如下表3所示。[表3]名称seqidno核苷酸序列bba_b0030-rbs65attaaagaggagaaatactagbba_b0031-rbs66tcacacaggaaacctactagbba_b0032-rbs67tcacacaggaaagtactagbba_b0033-rbs68tcacacaggactactagbba_b0034-rbs69aaagaggagaaatactagbba_b0035-rbs70attaaagaggagaatactagrbs_tuad71gacactgcgaccattataaattggaagatcattttacaggagagggttgagcgctrbs_pet72aataattttgtttaactttaagaaggagatatacat在本发明的一种实施方式中,当使用bba_b0034作为rbs时,它显示出比使用tuadrbs时更优秀的收率,并且与先前已知,bba_b0035相比于bba_b0034表现出优异的表达效率的事实不同,当使用bba_b0034rbs序列时,透明质酸的生产收率最高(图5)。根据本发明的用于生产透明质酸的表达系统包含udp-葡萄糖6-脱氢酶基因和透明质酸合酶基因,其中该两个基因可以优选地配置一个操纵子,并且更优选地,其中透明质酸合酶基因、udp-葡萄糖6-脱氢酶基因的rbs和udp-葡萄糖6-脱氢酶基因按5'至3'方向顺序连接。根据本发明的udp-葡萄糖6-脱氢酶基因可以是例如tuad基因或其变体。作为tuad基因,可以不受限制地使用来源于已知具有tuad基因的物种的tuad基因。例如,它可以是来源于芽孢杆菌属菌株的tuad基因,优选是来源于枯草芽孢杆菌菌株的tuad基因。tuad基因可以优选是枯草芽孢杆菌2217菌株的tuad基因,但不限于此。tuad基因可以是在必要时将适当的突变引入其中的tuad基因。可以在不影响udp-葡萄糖6-脱氢酶活性的范围内自由地修饰和使用tuad基因。在本发明的一种实施方式中,tuad基因可以包括seqidno:73的核苷酸序列。在本发明的一种实施方式中,使用seqidno:37和38的引物对,通过聚合酶链式反应(pcr)从枯草芽孢杆菌2217菌株中获得核糖体结合位点和tuad。透明质酸合酶基因可以是例如hasa基因或其突变基因。作为hasa基因,可以不受限制地使用来源于已知具有hasa基因的物种的hasa基因,例如可以是链球菌属(streptococcusspp.)菌株,优选是来源于兽疫链球菌(streptococcuszooepidemicus)的菌株。hasa基因的突变基因可以包括在维持透明质酸活性合成的范围内的所有基因的突变。在本发明的一种实施方式中,hasa基因可以是编码由seqidno:74或76的氨基酸序列组成的蛋白质的基因,并且优选地可以包括seqidno:75或77的核苷酸序列。在本发明的一种实施方式中,使用seqidno:1至36的引物(表4),通过基于pcr的两步dna合成方法,从兽疫链球菌获得hasa基因作为透明质酸合酶基因。具体地,使用seqidno:1至12的引物制备dna片段1,并且分别使用seqidno:12至24和seqidno:25至36制备dna片段2和3。为了获得全长的hasa基因,将所得的dna片段1、片段2和片段3混合,并使用由seqidno:1和seqidno:36组成的引物对进行pcr。[表4]本发明的一种实施方式可以是用于生产透明质酸的转化菌株或重组菌株,该转化菌株或重组菌株包含用于生产透明质酸的表达系统。该菌株可以是gras级菌株,并且可以是革兰氏阳性细菌,例如芽孢杆菌属(bacillusspp.)菌株,优选枯草芽孢杆菌或地衣芽孢杆菌。透明质酸合成过程中的安全性可以通过使用gras级菌株来提高。在本发明的一种实施方式中,将用于生产透明质酸的表达系统引入枯草芽孢杆菌2217菌株中,以在即使没有诱导剂如iptg的情况下获得产生透明质酸的菌株。本发明涉及使用非致病性细菌生产透明质酸的方法,该方法包括培养含有透明质酸表达系统的用于生产透明质酸的转化菌株的步骤。更具体地,除了培养用于生产透明质酸的转化菌株的步骤之外,根据本发明的用于生产透明质酸的方法可以进一步包括分离和/或纯化透明质酸的步骤。例如,该方法可以包括从培养基中去除菌株的步骤,以及在已经去除了菌株的培养基中沉淀透明质酸的步骤。在用于生产透明质酸的转化菌株和生产透明质酸的方法中,转录启动子、透明质酸合酶基因、udp-葡萄糖6-脱氢酶基因表达的核糖体结合位点、udp-葡萄糖6-脱氢酶基因等如上所述。通过组成型表达启动子,即便在不存在诱导剂(例如iptg)的情况下,使用根据本发明的重组菌株生产透明质酸的方法也可以表现出与使用诱导型启动子时相等或更高的透明质酸收率。培养菌株的步骤可以使用蔗糖作为碳源,但不限于此。菌株的培养、菌株的去除和透明质酸的沉淀可以通过本领域已知的方法进行,并且可以根据需要由本领域技术人员适当地修改和使用。生产透明质酸的方法可以进一步包括在透明质酸的沉淀步骤之后浓缩、纯化,或浓缩并纯化透明质酸的步骤。使用上述生产方法获得的透明质酸的分子量可以为100至10,000kda、500至10,000kda、500至8,000kda、3,000至8,000kda或5,000至6,000kda。在本发明的一种实施方式中,可以从引入了透明质酸合成系统的芽孢杆菌属细菌中获得最大峰为5,455kda的超高分子量透明质酸。与低分子量透明质酸相比,这种高分子量透明质酸具有优异的性质,例如保湿效果、粘度增加、关节润滑作用、吸湿能力、弹性能力等。因此,高分子量透明质酸作为诸如膝盖注射剂、滴眼剂和用于模制的填充剂的药物产品具有很高的实用价值。特别地,具有3000kda或更高的超高分子量的透明质酸(例如通过使用本发明提供的表达系统生产的透明质酸)在体内的分解速率较慢,因此可以用作粘附抑制剂。另外,为了将低分子量透明质酸转化为高分子量透明质酸,处理交联剂或化合物并经过复杂的过程是麻烦的,而将高分子量透明质酸转化为低分子量透明质酸的过程具有使用物理或化学方法相对容易的优点。有益效果本发明的用于合成透明质酸的菌株是非致病性菌株,该菌株增加了透明质酸合成期间的安全性,并且不使用昂贵的iptg诱导剂作为表达诱导剂,从而降低了生产成本。附图说明图1显示了根据本发明的一种实施方式生产的phcmc02-hasa-rbs34-tuad质粒的载体图谱。图2是根据本发明的一种实施方式生产的phcmc02-hasa-rbs34-tuad质粒的克隆过程的示意图。图3图示了根据本发明的一种实施方式,在将包含各种启动子的表达系统引入芽孢杆菌属菌株后产生的透明质酸的相对浓度。图4图示了根据本发明的一种实施方式,当使用组成型表达启动子psigx和iptc诱导型启动子pgrac时产生的透明质酸的相对浓度。图5图示了根据本发明的一种实施方式,当使用各种核糖体结合位点时产生的透明质酸的相对浓度。图6是示出商购的透明质酸标准品和从根据本发明的一种实施方式的重组菌株的培养基中纯化的透明质酸的红外光谱分析的结果的图。图7是使用多角度激光散射(malls)检测器测量从根据本发明的一种实施方式的重组菌株的培养基中纯化的透明质酸的分子量的结果。具体实施方式在下文中,将参考实施例更详细地描述本发明。然而,以下实施例用于解释本发明,并且本发明的范围不限于这些实施例的描述。实施例1:hasa和tuad操纵子的克隆1-1:透明质酸合酶基因(hasa)的克隆使用表4中所示的seqidno:1至36的引物,以下通过基于pcr的两步dna合成方法(ptds;xiong,2004,核酸研究(nucleicacidsresearch)32:e98),合成了来源于兽疫链球菌的透明质酸合酶基因(hasa,genbank编号ay173078核苷酸序列1至1254)(seqidno:75)。具体地,使用seqidno:1至12制备了dna片段1,并且类似地,分别使用seqidno:13至24和25至36制备了dna片段2和片段3。为了获得全长的hasa基因,将所得的dna片段1、片段2和片段3混合,并使用由seqidno:1和seqidno:36组成的引物对进行pcr,从而获得hasa基因。pcr条件是:使用热循环仪(appliedbiosystem),94℃变性15秒,55℃退火15秒,72℃延伸1分钟30秒,这些步骤总共进行25个循环。使用来源于兽疫链球菌的hasa基因作为透明质酸合酶基因,并通过上述方法使用seqidno:1至36的引物(表4)获得全长hasa基因。用限制酶bamhi和xbai切割所获得的全长hasa基因,并用t4dna连接酶(neb)来连接由bamhi和xbai切割的phcmc02(芽孢杆菌属遗传储备中心)质粒。将该载体导入大肠杆菌dh5α(enzynomics)中,涂布在含有氨苄青霉素的琼脂平板培养基上,从所得到的耐氨苄青霉素转化体中分离出质粒phcmc02-hasa。通过核苷酸序列分析证实了获得的质粒phcmc02-hasa,该hasa基因被正常地克隆。1-2:udp-葡萄糖6-脱氢酶基因(tuad)的克隆为了在芽孢杆菌属菌株中生产透明质酸,仅透明质酸合酶是不足的,并且必须共表达udp-葡萄糖6-脱氢酶(winder,2005,appliedandenvironmentalmicrobiology,71:3747-3752)。为此,由hasa和tuad组成的操纵子必须是完整的。为了配置操纵子,由于rbs(核糖体结合位点)必须存在于tuad基因的前面,因此通过使用枯草芽孢杆菌2217菌株(韩国典型培养物保藏中心(kctc))的dna作为模板并使用seqidno:37的rbstuad_正向引物和seqidno:38的rbs_tuad_反向引物扩增tuad基因,使得rbs34(biobrickbba_b0034)被包含在tuad基因的5'末端。进行pcr,其步骤为:使用热循环仪(appliedbiosystem),94℃变性15秒,55℃退火15秒,72℃延伸1分钟30秒,总共进行30个循环。seqidno:37:5'-aatctagaaaagaggagaaatactagatgaaaaaaatagctgtcattgg-3'seqidno:38:5'-gggttataaattgacgcttcccaagtctttagccaatt-3'用限制酶xbai切割扩增的rbs34-tuad基因,并将用xbai和smai切割的pbluescriptiisk+(stratagene)质粒用t4dna连接酶(neb)连接。将其导入大肠杆菌dh5α(enzynomics)中,涂布在含有氨苄青霉素的琼脂平板培养基上,从得到的耐氨苄青霉素的转化体中分离出质粒pbsiisk-rbs34-tuad。通过核苷酸序列分析证实了获得的质粒pbsiisk-rbs34-tuad,genbank编号af015609的核苷酸序列bp(tuad基因的蛋白编码位点,seqidno:73)被正常地克隆。1-3:hasa和tuad操纵子的克隆为了完成由hasa和tuad基因组成的操纵子,将实施例1-2中获得的pbsiisk-rbs34-tuad用限制酶xbai和smai切割,将切割后的rbs34-tuad基因用相同的限制酶处理,并且将实施例1-1中获得的phcmc02-hasa质粒用t4dna连接酶(neb)连接。将其导入大肠杆菌dh5α(enzynomics)中,涂布在含有氨苄青霉素的琼脂平板培养基上,从得到的耐氨苄青霉素的转化体中分离出质粒phcmc02-hasa-rbs34-tuad。图1和图2分别显示了phcmc02-hasa-rbs34-tuad的载体图谱和克隆过程示意图。实施例2:选择用于hasa-tuad操纵子表达的启动子hasa-tuad操纵子在实施例1中制备的质粒phcmc02-hasa-rbs34-tuad中的表达由plepa启动子调节,并且已知plepa启动子具有弱活性。因此,用各种启动子替换plepa启动子,以选择具有高hasa-tuad操纵子表达活性的启动子。选择候选启动子作为与芽孢杆菌属菌株中使用的组成型表达启动子p43相比表达活性更高的启动子(yu,2015,scientificreports,5:18405;song,2016,plosone.11:e0158447)。为了构建由每种测试的启动子调节的质粒,使用枯草芽孢杆菌168菌株dna(芽孢杆菌遗传储备中心)作为模板并使用上表2中列出的引物通过pcr进行扩增。具体地,使用pp43启动子的正向和反向引物(seqidno:39和40)、pmsm启动子的正向和反向引物(seqidno:41和42)、ppbp启动子的正向和反向引物(seqidno:43和44)、pylb启动子的正向和反向引物(seqidno:45和46)、pyob启动子的正向和反向引物(seqidno:47和48)、pyqe启动子的正向和反向引物(seqidno:49和50)、pyv1启动子的正向和反向引物(seqidno:51和52)和psigx启动子的正向和反向引物(seqidno:53和54)。将通过pcr扩增的每种启动子用限制酶nhei和bamhi切割,并且将用相同的限制酶切割的实施例1的phcmc02-hasa-rbs34-tuad用t4dna连接酶(neb)连接。将其导入大肠杆菌dh5α(enzynomics)中,涂布在含有氨苄青霉素的琼脂平板培养基上,从得到的耐氨苄青霉素的转化体中分离出每种质粒。通过核苷酸序列分析证实,每种启动子被正常地克隆在每种分离的质粒中。通过电穿孔疗法(sun,2015,appliedmicrobiologyandbiotechnology,99:5151-5162)将具有互不相同的启动子的质粒导入芽孢杆菌2217菌株,以制备对氯霉素具有抗性的转化菌株。接下来,将每种转化菌株接种到lb培养基中并培养过夜。将0.2ml培养过夜的菌株接种到包含在250ml锥形瓶中的20ml蔗糖培养基(每1l中具有含50g蔗糖、20g酵母提取物和1.5g硫酸镁(mgso4)的50mm磷酸钾(ph7.0))中,然后在37℃下以180rpm振摇培养。在开始培养后65小时取出每种培养液,以10,000rpm离心1分钟,然后通过0.45μm的过滤器以去除菌株。将3倍体积的乙醇添加至去除了菌株的培养基中,使其在4℃下静置2小时,并在4℃的温度下以15,000rpm离心10分钟以沉淀透明质酸。使沉淀的透明质酸干燥并溶解在水中,然后使用ha定量检测试剂盒(corgenix,威斯敏斯特,co,美国)测量透明质酸含量。将含有组成型表达启动子p43的转化菌株生产的透明质酸的含量(g/l)设定为100,指出含有测试启动子的转化菌株生产的透明质酸的相对含量,并在表5和图3中以%比例显示。[表5]启动子透明质酸的相对生产能力(%)p43100.0±4.2pmsm15.1±1.9ppbp3.9±0.8pylb38.1±2.3pyob31.6±7.1pyqe134.3±6.7pyvl15.0±11.1psigx488.2±13.4图3图示了由含有每种启动子的转化菌株产生的相对透明质酸含量。证实了psigx启动子(seqidno:62)、pyob启动子(seqidno:63)和pyqe启动子(seqidno:64)具有比p43启动子更高的表达水平,并且特别地,psigx启动子比其他启动子更有效地生产透明质酸。随后,将克隆了psigx启动子的质粒命名为psigx-hasa-rbs34-tuad。实施例3:psigx启动子的透明质酸收率为了比较iptg诱导型启动子pgrac的表达效率与实施例2中被选为具有高表达效率的作为恒定表达启动子的psigx启动子的表达效率,用iptg诱导型pgrac启动子替换psigx-hasa-rbs34-tuad质粒的psigx启动子,以产生pgrac-hasa-rbs34-tuad。具体地,为了替换启动子,用限制酶nhei和bamhi切割pht01质粒(mobitec)以分离laci和pgrac启动子,将laci和pgrac启动子用相同的限制酶切割,将去除了psigx启动子的psigx-hasa-rbs34-tuad用t4dna连接酶(neb)连接。将其导入大肠杆菌dh5α(enzynomics)中,涂布在含有氨苄青霉素的琼脂平板培养基上,从得到的耐氨苄青霉素的转化体中分离出质粒pgrac-hasa-rbs34-tuad。通过电穿孔将分离的质粒导入芽孢杆菌2217菌株中,以完成对氯霉素具有抗性的转化菌株。比较了与透明质酸生产相关的合酶表达被完整ptg诱导型pgrac启动子调节的转化菌株的透明质酸的生产收率与在根据实施例2的psigx启动子中组成型表达与透明质酸生产相关的合酶的菌株的透明质酸的生产收率。以与实施例2基本相同的方式培养每种菌株,并在培养65小时后取培养液。但是,在iptg诱导型的情况下,将培养过夜的菌株接种到蔗糖培养基中以诱导合酶的表达。2小时后,添加iptg使得iptg变为0.5mm。在诱导型的情况下,在72小时时取出培养液。以与实施例2基本相同的方式测量两种菌株的透明质酸生产能力,结果示于图4中。如图4所示,证实了这两种菌株具有几乎相同的收率。由此,相比于使用昂贵的iptg的诱导型,廉价且简单地创立了生产透明质酸的方法。实施例4:用于过表达tuad基因的rbs选择d-葡萄糖醛酸是透明质酸的组分,它可由芽孢杆菌原本拥有的tuad基因产生。然而,为了有效生产透明质酸,需要过表达tuad基因。为此,如上所述,以操纵子的形式产生hasa基因和tuad基因,以诱导tuad基因与hasa基因一起过表达。为了配置操纵子,必须在tuad基因的5'末端存在高活性rbs序列以调节tuad基因的翻译。由于rbs的活性取决于序列的背景,因此它可以根据要调控的基因的序列而有所不同(mutalik,2013,naturemethods,10:347-353)。由于这些原因,进行了对tuad的实际翻译有利并且因此适合于透明质酸生产的rbs选择过程。具体来说,对于rbs选择,比较了来自标准生物元件登记库(biobrickregistryofstandardbiologicalparts)的6种合成rbs(bba_b0030、bba_b0031、bba_b0032、bba_b0033、bba_b0034、bba_b0035)、tuad基因的天然rbs(tuadrbs)和常用质粒(如pet)的rbs(rbs)。表3中显示了测试的8个rbs序列。为了确保包含在每个rbs序列的5'末端的tuad基因,通过使用表4和seqidno:38所示的引物,并使用枯草芽孢杆菌168菌株(芽孢杆菌遗传储备中心)的dna作为模板进行pcr。用xbai切割包括每个扩增rbs的tuad基因,并将通过用xbai和smai切割而缺失了rbs34-tuad的psigx-hasa-rbs34-tuad质粒用t4dna连接酶(neb)连接。将其导入大肠杆菌dh5α(enzynomics)中,涂布在含有氨苄青霉素的琼脂平板培养基上,从得到的耐氨苄青霉素的转化体中分离出每种质粒。通过核苷酸序列分析证实,克隆了正常对应于每种分离的质粒的包括rbs的tuad基因。[表6]通过电穿孔疗法将以上获得的具有互不相同的rbs的质粒导入枯草芽孢杆菌2217菌株,以生产对氯霉素具有抗性的转化菌株。接下来,以与实施例2基本相同的方式培养每种转化的菌株,取培养基,并测量透明质酸的含量。将使用pet质粒的rbs转化的菌株生产的透明质酸的含量(g/l)设定为100,指出由包含测试rbs序列的转化菌株产生的透明质酸的相对含量,结果在表7和图5中显示。[表7]rbs类型透明质酸的相对生产能力(%)bba_b0030-rbs83.6±8.9bba_b0031-rbs4.2±1.4bba_b0032-rbs4.7±0.5bba_b0033-rbs5.7±0.9bba_b0034-rbs123.3±1.8bba_b0035-rbs80.5±1.0tuadrbs75.7±9.5petrbs100.0±6.4根据标准生物元件登记库(http://parts.igem.org/ribosome_binding_sites/prokaryotic/constitutive/community_collection)的比较结果,已知bba_b0035比bba_b0034具有更优异的表达效率(对应于实施例1-2的rbs)。然而,根据本实施例的实验结果,不同于rbs本身的特性,在根据本发明的表达系统的情况下,当使用bba_b0034rbs序列时,证实了透明质酸的最高生产收率。实施例5:测量生产的透明质酸的分子量通过超滤纯化通过与实施例2中所描述的相同方法生产的透明质酸,然后测量分子量。首先,纯化生产的透明质酸的过程如下。将培养液以10,000rpm离心10分钟,然后通过0.45μm过滤器以去除菌株。将去除了菌株的培养液通过截止值为100kda的超滤膜进行过滤以获得产物。在以上获得的整个产物中,添加十六烷基三甲溴化铵至浓度为1%(v/v),搅拌并离心1小时(7,000rpm,30分钟)以获得沉淀物。在搅拌下将沉淀物溶解于0.25m碘化钠溶液中10分钟,使得十六烷基三甲溴化铵与碘和钠反应。将反应溶液离心(7,000rpm,30分钟),取上清液以去除十六烷基三甲溴化铵和碘化钠的反应产物。将2%活性炭添加至上清液,搅拌1小时以吸附杂质,并使所述上清液通过0.22μm的过滤器以获得纯化样品。通过红外光谱证实纯化样品与透明质酸标准品(sigma)一致,光谱分析的结果示于图6。接下来,使用多角度激光散射(malls)测量纯化样品的分子量。测定条件示于下表8,分析结果示于图7。作为图7显示的多角度激光散射测量的结果,纯化的透明质酸的分子量在属于超高分子量范围的1,000至7,000kda的范围内显示峰值,特别地,主峰测量为5,455kda。与低分子量透明质酸相比,这种高分子量透明质酸具有优异的性质,例如保湿效果、粘度增加、关节润滑作用、吸湿能力、弹性能力等。特别地,在3000kda或更高的超高分子量透明质酸(例如使用本发明的表达系统生产的透明质酸)的情况下,其在体内的分解速率慢,因此可以用作粘附抑制剂。[表8]当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1