多能干细胞用未分化维持培养基的制作方法
本发明涉及多能干细胞用未分化维持培养基。
背景技术:
人工多能干细胞(ips细胞)、胚胎干细胞(es细胞)等多能干细胞具有分化多能性和自我复制能力,被期待应用于再生医疗等再生医疗领域和医学研究领域等。多能干细胞的培养必须在安全的条件下以维持未分化的状态增殖。
一直以来,细胞培养使用含血清或白蛋白的细胞培养基。白蛋白有来源于生物体的白蛋白和基因重组的白蛋白,如果是来源于生物体的白蛋白,供体感染病毒等的情况下,培养基中可能会含有这些病毒等。此外,即使不感染病毒等,白蛋白的纯化中也可能会有某些因子混杂而含于培养基,由所述因子导致细胞在不期望的时机分化。另外,由于来源于生物体,因此批次间会有微量成分的浓度等或品质的差异,培养结果可能因所述差异而变化。另一方面,基因重组的白蛋白的费用高昂。因此,多能干细胞的培养较好是使用不含白蛋白的培养基。
近年来,不断进行着适合于多能干细胞培养的无血清培养基的开发。专利文献1中揭示了一种无血清培养基,其中,包含针对内皮细胞分化基因(edg)家族受体的配体、以及针对血清素受体的配体。专利文献2中揭示了一种不含白蛋白的无血清培养基,其中,包含普朗尼克(pluronic)类非离子型表面活性剂或动物类水解产物等。专利文献3中揭示了一种通过使用含聚乙烯醇且不含白蛋白的培养基,在防止胚胎干细胞对培养皿的粘附的同时进行培养的方法。专利文献4中揭示了聚乙烯醇等合成聚合物抑制包括胚胎干细胞在内的细胞对细胞培养基材表面的粘附。专利文献5中揭示了一种培养基,其中,包含白蛋白和聚乙烯醇。
然而,尚无具有足以作为培养基中不含白蛋白且具有高增殖性而适合于贴壁培养等的通用性高的多能干细胞用培养基的品质的培养基。
现有技术文献
专利文献
专利文献1:国际公开第2009/084662号公报
专利文献2:国际公开第2017/195745号公报
专利文献3:日本专利特开2007-228815号公报
专利文献4:日本专利特开2007-124982号公报
专利文献5:日本专利特许第6197947号公报
发明的揭示
发明所要解决的技术问题
因此,本发明的课题在于,提供培养基中不含血清或白蛋白且显示高增殖性的多能干细胞的贴壁培养用培养基以及使用所述培养基的通用性高的多能干细胞的贴壁培养的方法。
解决技术问题所采用的技术方案
本发明人对于赋予多能干细胞对细胞培养基材表面的粘附性的非白蛋白成分进行了探索,发现亲水性聚合物提高多能干细胞对细胞培养基材表面的粘附性,通过将所述聚合物添加于培养基,在多能干细胞的贴壁培养中不含白蛋白的情况下,赋予高增殖性,进一步进行研究后,完成了本发明。
即,本发明涉及以下内容。
[1]一种多能干细胞贴壁培养用培养基,其中,含有亲水性聚合物,实质上不含白蛋白。
[2]根据上述[1]所述的培养基,其中,还含有抗氧化物质。
[3]根据上述[1]或[2]所述的培养基,其中,亲水性聚合物为聚乙烯醇或聚乙烯吡咯烷酮。
[4]根据上述[2]或[3]所述的培养基,其中,抗氧化物质为选自n-乙酰-l-半胱氨酸、还原型谷胱甘肽、维生素c、维生素e和绿原酸的至少1种。
[5]根据上述[2]~[4]中的任一项所述的培养基,其中,抗氧化物质为n-乙酰-l-半胱氨酸。
[6]根据上述[1]~[5]中的任一项所述的培养基,其中,还含有除白蛋白以外的蛋白质成分。
[7]根据上述[6]所述的培养基,其中,除白蛋白以外的蛋白质成分为选自胰岛素、转铁蛋白和碱性成纤维细胞生长因子(bfgf)的至少1种。
[8]根据上述[1]~[7]中的任一项所述的培养基,其中,还含有分化抑制剂。
[9]根据上述[8]所述的培养基,其中,分化抑制剂为gsk3β(糖原合成酶激酶3β)抑制剂、和/或dyrk(双重特异性酪氨酸磷酸化调节激酶(dual-specificitytyrosine-phosphorylation-regulatedkinase))抑制剂。
[10]根据上述[9]所述的培养基,其中,gsk3β抑制剂为1-氮杂坎帕罗酮(1-azakenpaullone)。
[11]根据上述[9]所述的培养基,其中,dyrk抑制剂为id-8。
[12]根据上述[1]~[11]中的任一项所述的培养基,其中,还含有nfat(活化t细胞核因子)抑制剂。
[13]根据上述[12]所述的培养基,其中,nfat抑制剂为他克莫司(tacrolimus)。
[14]根据上述[1]~[13]中的任一项所述的培养基,其中,多能干细胞来源于人。
[15]根据上述[1]~[14]中的任一项所述的培养基,其中,多能干细胞为ips细胞。
[16]一种多能干细胞贴壁培养用培养基,其中,含有亲水性聚合物、抗氧化物质以及由gsk3β抑制剂和dyrk抑制剂形成的分化抑制剂。
[17]一种多能干细胞的培养方法,其中,使用上述[1]~[16]中的任一项所述的培养基。
[18]一种增强多能干细胞对培养基材的粘附的方法,其中,包括向培养基中添加亲水性聚合物的工序。
[19]一种多能干细胞,其中,该细胞通过上述[17]或[18]所述的方法制造。
发明的效果
如果采用本发明,通过含有亲水性聚合物,可培养基中不含白蛋白,在维持未分化的状态下以高增殖率培养多能干细胞。另外,通过向所述培养基中添加抗氧化物质,可实现更高的增殖率,因此能够高效地培养再生医疗领域和医疗研究领域中使用的多能干细胞。此外,如果采用发明所述的方法,可提供在不含白蛋白的培养基中增强细胞的粘附的方法。
附图的简单说明
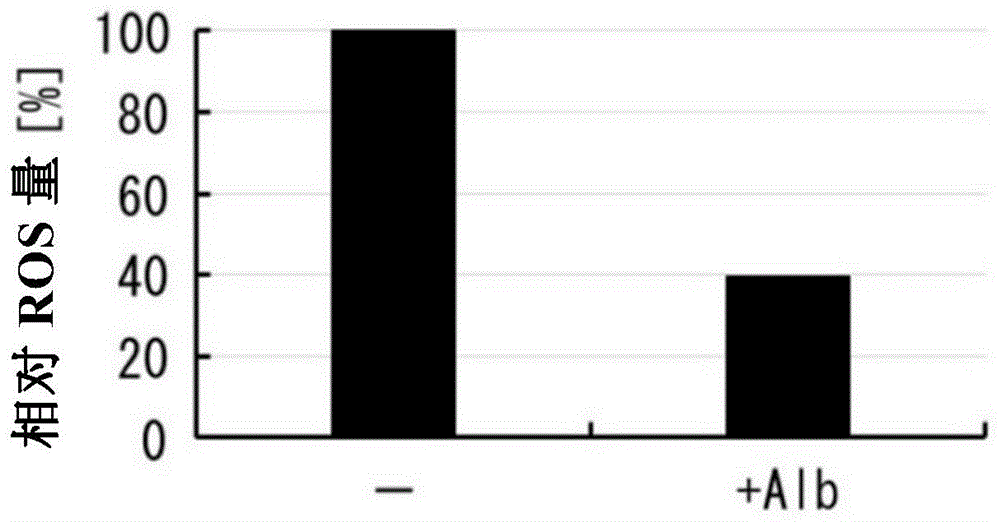
图1表示比较例1中的在添加白蛋白的培养基和无添加培养基中培养ips细胞时的细胞内活性氧簇(ros)量的关系。-是指通过未添加白蛋白的培养基培养的结果,+alb是指通过添加白蛋白的培养基培养的结果。图中的各结果的值表示将无添加培养基中的细胞内ros量设为100%时的相对值。
图2表示比较例1中的在添加白蛋白的培养基和无添加培养基中培养ips细胞时的培养第3天的相位差图像。图中的-是指通过未添加白蛋白的培养基培养的细胞的图像,+alb是指添加白蛋白培养的细胞的图像。细胞在状态好时呈纺锤状的形态,状态差时呈球状的形态。
图3表示实施例1中的在添加添加各抗氧化物质的培养基和无添加培养基中培养ips细胞时的抗氧化物质与细胞内ros量的关系。图中的+alb是指通过添加白蛋白的培养基培养的细胞的结果,+nac是指通过添加n-乙酰-l-半胱氨酸的培养基培养的细胞的结果,+gsh是指通过添加还原型谷胱甘肽的培养基培养的细胞的结果,+vc是指通过添加维生素c的培养基培养的细胞的结果,+ve是指通过添加维生素e的培养基培养的细胞的结果,+cha是指通过添加绿原酸的培养基培养的细胞的结果。图中的各结果的值表示将无添加培养基中的细胞内ros量设为100%时的相对值。
图4表示实施例2中的在添加白蛋白的培养基和添加n-乙酰-l-半胱氨酸的培养基中培养ips细胞时的培养第3天的相位差图像。+alb是指在添加白蛋白的培养基中培养的细胞的图像,+nac是指在添加n-乙酰-l-半胱氨酸的培养基中培养的细胞的图像。
图5表示实施例3中的将全部细胞用结晶紫染色成蓝色时的通过相位差显微镜拍摄培养容器整体而得的图像。-表示无添加培养基中的培养结果。+alb表示添加白蛋白的培养基中的培养结果。+pva表示添加聚乙烯醇的培养基中的培养结果。+pvp表示添加聚乙烯吡咯烷酮的培养基中的培养结果。
图6表示实施例4中的通过仅基础培养基的培养基以及基础培养基中仅添加n-乙酰-l-半胱氨酸的培养基、基础培养基中仅添加聚乙烯醇的培养基、基础培养基中添加n-乙酰-l-半胱氨酸和聚乙烯醇的培养基培养7天时的相对增殖率(平均值±标准差)。图中的基础培养基+nac是指基础培养基中仅添加n-乙酰-l-半胱氨酸的培养基,基础培养基+pva是指基础培养基中仅添加聚乙烯醇的培养基,基础培养基+nac+pva是指基础培养基中添加n-乙酰-l-半胱氨酸和聚乙烯醇的培养基。此外,图中的纵轴的数值是指将仅基础培养基的情况的增殖率设为1而相对表示的值。
具体实施方式
以下,基于本发明的优选实施方式对本发明进行详细说明。
本发明所述的“多能干细胞贴壁培养用培养基”是用于对多能干细胞进行贴壁培养的培养基。本发明所述的“多能干细胞”是具有可分化为构成生物体的所有组织或细胞的分化多能性和自我复制能力的细胞,作为一例,可例举es细胞、胚胎生殖细胞(eg细胞)、ips细胞,较好是ips细胞。作为本发明所述的“多能干细胞”的来源的生物种无特别限定,可例举例如人、猴、小鼠等,较好是来源于人。
本发明所用的培养基含有亲水性聚合物。本发明人发现在实质上不含白蛋白的培养基中亲水性聚合物增强细胞对培养皿的粘附性而促进贴壁培养中的细胞增殖。推测本发明的培养基中所添加的亲水性聚合物通过在粘附于培养基材的细胞表面形成被膜而提高细胞粘附性,但并不受理论限制。因此,本发明中所用的亲水性聚合物只要提高对培养基材的细胞粘附性即可,并无限定,可使用聚乙烯醇、聚乙烯吡咯烷酮、聚乙二醇、聚丙二醇、聚乙烯亚胺、羧甲基纤维素、甲基纤维素、葡聚糖、结冷胶(gellangum)、海藻酸等。从赋予对培养基材的更强的粘附性的观点来看,较好是聚乙烯醇。此外,从被用于再生医疗或医疗领域的研究的角度来看,本发明中的亲水性聚合物较好是非天然物且有应用于医药品的实际成果的安全性高的亲水性聚合物。
本发明的培养基中所添加的亲水性聚合物的浓度只要是可提高对培养基材的细胞粘附性的浓度即可,并无限定,例如为0.01%~5%,较好是0.05%~1%,特别是从可增强粘附性的观点来看,更好是聚乙烯醇的0.1~0.5%或聚乙烯吡咯烷酮的0.1~0.5%。
本发明所述的增强多能干细胞对培养基材的细胞粘附的方法包括向培养基中添加亲水性聚合物的工序,亲水性聚合物可在培养基制造时或培养基使用时的任意时机添加。本发明所述的培养基材可使用公知的基材,并无限定,例如聚丙烯树脂制或玻璃制的基材之外,还可使用对它们被覆层粘连蛋白、玻连蛋白、胶原、明胶、酪蛋白等蛋白质的基材或固定化高分子的基材。
来源于生物体的白蛋白可能会存在批次间的差异或夹杂有因子,因此较好是完全不含白蛋白,或者即使含有白蛋白也越少越好。因此,本发明中,“实质上不含白蛋白”是指完全不含白蛋白,或者含有不会产生批次间的差异或因子的影响的程度、即不会促进多能干细胞的细胞增殖、或不起到稳定维持效果的程度的白蛋白。因此,这样的实质上不含白蛋白的培养基例如包括含0.010%以下的白蛋白的培养基,较好是包括含10-6%以下的白蛋白的培养基。
本发明所用的基础培养基可使用公知的培养基,包括例如dmem(达尔伯克改良伊格尔培养基)、mem(伊格尔最低必需培养基)、α-mem(伊格尔最低必需培养基α改良型)、gmem(格拉斯哥最低必需培养基)、汉姆氏f-12(营养混合物f-12汉姆氏)、dmem/ham、imdm(伊思考夫改良达尔伯克培养基)、dmem/f-12(达尔伯克改良伊格尔培养基/营养混合物f-12汉姆氏),可优选例举dmem/f-12等,但并不仅限于这些例子。
该培养基成分中可根据需要包含公知的添加物。作为添加物,只要不阻碍细胞增殖即可,可包含一直以来用于多能干细胞的培养的各种无机盐类、碳水化合物、氨基酸、维生素、脂类等。此外,只要是除白蛋白以外的蛋白质成分,可作为添加物包含。除白蛋白以外的蛋白质成分例如为生长因子、铁的贮存/转运因子等。生长因子包括表皮生长因子(egf)、胰岛素样生长因子(igf)、的血管内皮生长因子(vegf)、促血小板生成素、转化生长因子(tgf)、性成纤维细胞生长因子(bfgf)和无直接作用的胰岛素,但并不仅限于这些。铁的贮存/转运因子包括转铁蛋白,但并不仅限于此。更优选的除白蛋白以外的蛋白质为胰岛素、转铁蛋白和bfgf。关于这些蛋白质的添加量,较好是以胰岛素的最终浓度达到1~50μg/ml、转铁蛋白的最终浓度达到1~30μg/ml、bfgf的最终浓度达到1~100ng/ml的条件添加,更好是以胰岛素的最终浓度达到10~30μg/ml、转铁蛋白的最终浓度达到5~20μg/ml、bfgf的最终浓度达到2.5~25ng/ml的条件添加。
本发明的一种形态中,可作为添加物包含抗氧化物质。推测本发明的培养基中所添加的抗氧化物质通过捕获因施加于细胞的应激而在细胞内大量产生的ros,有利于无害化的反应,但并不受理论限制。因此,本发明所用的“抗氧化物质”包括通过捕获ros而有利于无害化的反应的物质,包括n-乙酰-l-半胱氨酸、还原型谷胱甘肽、维生素c(l-抗坏血酸)、维生素c衍生物、维生素e(生育酚)、绿原酸,可优选例举n-乙酰-l-半胱氨酸和/或l-抗坏血酸磷酸镁,但并不仅限于这些。关于抗氧化物质的添加量,较好是以n-乙酰-l-半胱氨酸的最终浓度达到0.05~10mm和/或l-抗坏血酸磷酸镁的最终浓度达到30~500μg/ml的条件添加,更好是以n-乙酰-l-半胱氨酸的最终浓度达到0.3~1mm和/或l-抗坏血酸磷酸镁的最终浓度达到50~70μg/ml的条件添加。
本发明的一种形态中,可作为添加剂在基础培养基中包含分化抑制剂。分化抑制剂包括gsk3β抑制剂和dyrk抑制剂、白血病抑制因子(lif)、mek抑制剂和gsk3抑制剂,但并不仅限于这些。较好是分化抑制剂为gsk3β抑制剂和dyrk抑制剂。gsk3β抑制剂具有抑制gsk3β的功能或限制表达量的作用,包括sb216763、bio、ar-a014418、im-12、chir99021、坎帕罗酮、1-氮杂坎帕罗酮,但并不仅限于这些。dyrk抑制剂具有抑制dyrk的功能或限制表达量的作用,包括az191、id-8、盐酸去氢骆驼蓬碱,但并不仅限于这些。更好是gsk3β抑制剂为1-氮杂坎帕罗酮,dyrk抑制剂为id-8。关于分化抑制剂的添加量,较好是以1-氮杂坎帕罗酮的最终浓度达到400~2000nm、id-8的最终浓度达到200~1000nm的条件添加,更好是以1-氮杂坎帕罗酮的最终浓度达到700~1400nm、id-8的最终浓度达到400~800nm的条件添加。
本发明的一种形态中,可在基础培养基中包含nfat抑制剂。nfat抑制剂具有抑制nfat的功能或限制表达量的作用。nfat抑制剂包括他克莫司(fk506)、环孢素a(ciclosporina)、mcv-1、inca-6,较好是nfat抑制剂为他克莫司,但并不仅限于这些。关于nfat抑制剂的添加量,较好是以他克莫司的最终浓度达到10~100pm的条件添加,更好是以他克莫司的最终浓度达到10~50pm的条件添加。
本发明的基础培养基中,只要不阻碍多能干细胞的增殖,即使是除上述中例举的成分以外也可包含。从使细胞高效地增殖的观点来看,为硒、乙醇胺,较好是硒,更好是亚硒酸钠。
本发明的一种形态中,培养基用于贴壁培养,可以是在基础培养基中包含亲水性聚合物、抗氧化物质以及由gsk3β抑制剂和dyrk抑制剂形成的分化抑制剂的培养基。培养基还可根据需要包含公知的添加物。作为添加物,只要不阻碍细胞增殖即可,可包含一直以来用于多能干细胞的培养的各种无机盐类、碳水化合物、氨基酸、维生素、蛋白质、脂类等。
使用本发明的培养基的多能干细胞的培养可使用本领域技术人员公知的任意的贴壁培养法进行。作为例子,可如下进行:将多能干细胞用pbs清洗后,进行37℃、5分钟的细胞解离处理,分散为单一细胞并回收,接种于被覆了层粘连蛋白的贴壁培养用6孔板,通过包含rock抑制剂的本发明的培养基在37℃、5%co2的条件下过夜培养,适当置换为不含rock抑制剂的培养基并培养7天。
以下,例举实施例对本发明进一步进行详细说明,但本发明并不仅限于这些实施例。
实施例
[比较例1:细胞培养中的白蛋白的功能验证]
[培养基的制备]
将10.8g含微量元素的dmem/f12培养基(西格玛公司制,d0547)、14ml1mhepes(赛默科技公司制,15630-080)、1.1g碳酸氢钠、0.4g氯化钠、0.06gl-抗坏血酸磷酸镁(富士胶卷和光纯药株式会社制,013-19641)、18mlits溶液((赛默科技公司制,41400-045,胰岛素1mg/ml、转铁蛋白0.55mg/ml、硒0.7μg/ml)、361μg1-氮杂坎帕罗酮(多伦多研究化学品公司制,a800950)、179μgid-8(开曼化学公司(caymanchemicals)制,15222)、16ng他克莫司(开曼化学公司制,10007965)溶解混合于1l水中,获得1l基础培养基。
向100ml基础培养基中添加1g白蛋白(mp生物医疗公司(mpbiomedicals),0215240180-100g)而获得培养基。
[ros的测定]
在无添加基础培养基和添加了白蛋白的培养基中分别以单个细胞分散细胞,经过1小时后,分别通过dcfh-da对细胞进行荧光染色,用流式细胞仪测定了荧光强度。
[结果]
如图1所示,确认通过添加白蛋白,细胞内ros量减少约60%。
[培养]
将人ips细胞253g1株用pbs清洗后,用typleselect(赛默科技公司)和0.5mmedta的等量混合液在37℃处理5分钟,从而分散成单一细胞并回收,使用血球计数板测定细胞数后,向以0.25μg/cm2被覆有imatrix-511(株式会社玛特立松(matrixome,inc.))的贴壁培养用6孔板中以25000细胞/孔接种细胞,通过包含10μm的y-27632(开曼化学公司制,10005583)的上述培养基在37℃、5%co2的条件下培养一晚,每天更换不含y-27632的培养基并培养7天。
培养以基础培养基中未进行任何添加的培养基为对照,另通过基础培养基中添加白蛋白的培养基进行(n=1)。
[细胞形态的确认]
通过相位差显微镜对培养第3天的采用无添加基础培养基和添加白蛋白的培养基的培养中的细胞形态进行了观察。
[结果]
如图2所示,确认添加白蛋白的培养基中的细胞形态呈纺锤形,为比呈球形的无添加培养基中的细胞形态更好的状态。
[实施例1:包含抗氧化物质的培养基对细胞内ros量产生的影响的验证]
[培养基的制备]
与比较例1同样地制备基础培养基,向100ml基础培养基分别添加163mgn-乙酰-l-半胱氨酸(关东化学株式会社制,01763-30)、307mg还原型谷胱甘肽(关东化学株式会社制,17501-61)、278mg维生素c(富士胶卷和光纯药株式会社制,013-19641)、430mg维生素e(关东化学株式会社制,40562-30)、353mg绿原酸(关东化学株式会社制,10924-1a)而获得培养基。此外,作为对照,获得基础培养基中未进行任何添加的培养基和向100ml基础培养基中添加1g白蛋白的培养基。
[ros的测定]
将对照和分别添加各成分的培养基中培养的细胞分散为单个细胞,分别通过dcfh-da进行荧光染色,用流式细胞仪测定了荧光强度。
[结果]
如图3所示,确认分别通过添加5种抗氧化物质的培养基培养的细胞与无添加的培养基相比均荧光强度下降,提示ros量下降。此外,5种中,n-乙酰-l-半胱氨酸和还原型谷胱甘肽确认较高的效果,发现约50%的细胞内ros量的下降。
[实施例2:使用包含抗氧化物质的培养基的多能干细胞的培养]
[培养基的制备]
与比较例1同样地制备基础培养基,向100ml基础培养基分别添加8.2mgn-乙酰-l-半胱氨酸(关东化学株式会社制,01763-30)、16mg还原型谷胱甘肽(关东化学株式会社制,17501-61)、14mg维生素c(富士胶卷和光纯药株式会社制,013-19641)、21mg维生素e(关东化学株式会社制,40562-30)、17mg绿原酸(关东化学株式会社制,10924-1a)而获得培养基。此外,作为对照,获得基础培养基中未进行任何添加的培养基和向100ml基础培养基中添加1g白蛋白的培养基。
[培养]
将人ips细胞253g1株用pbs清洗后,用typleselect(赛默科技公司)和0.5mmedta的等量混合液在37℃处理5分钟,从而分散成单一细胞并回收,使用血球计数板测定细胞数后,向以0.25μg/cm2被覆有imatrix-511(株式会社玛特立松(matrixome,inc.))的贴壁培养用6孔板中以25000细胞/孔接种细胞,通过包含10μmy-27632的上述培养基在37℃、5%co2的条件下培养一晚,每天更换不含y-27632的培养基并培养7天。
关于培养,作为对照准备基础培养基中未进行任何添加的培养基和添加白蛋白的培养基,通过这些培养基以及添加n-乙酰-l-半胱氨酸的培养基、添加还原型谷胱甘肽的培养基、添加维生素c的培养基、添加维生素e的培养基、添加绿原酸的培养基进行(n=1)。
[细胞形态的确认]
通过相位差显微镜对采用对照和作为5种抗氧化物质的代表的添加n-乙酰-l-半胱氨酸的培养基的培养中的培养第3天的细胞形态进行了观察。
[结果]
如图4所示,确认添加n-乙酰-l-半胱氨酸的培养基中培养的细胞的形态也呈纺锤形,为良好的细胞状态。
[实施例3:使用包含亲水性聚合物的培养基的多能干细胞的培养]
[培养基的制备]
与比较例1同样地制备基础培养基,向100ml基础培养基中分别添加0.25g聚乙烯醇(西格玛公司制,p8136)、0.25g聚乙烯吡咯烷酮(西格玛公司制,pvp40)、添加1g白蛋白而获得培养基。
[培养]
将人ips细胞253g1株用pbs清洗后,用typleselect(赛默科技公司)和0.5mmedta的等量混合液在37℃处理5分钟,从而分散成单一细胞并回收,使用血球计数板测定细胞数后,向以0.25μg/cm2被覆有imatrix-511(株式会社玛特立松(matrixome,inc.))的贴壁培养用6孔板中以25000细胞/孔接种细胞,通过包含10μmy-27632的上述培养基在37℃、5%co2的条件下培养一晚,每天更换不含y-27632的培养基并培养7天。
关于培养,作为对照准备基础培养基中未进行任何添加的培养基和添加白蛋白的培养基,通过这些培养基以及添加聚乙烯醇的培养基、添加聚乙烯吡咯烷酮的培养基进行(n=3)。
[细胞粘附的确认]
将培养的细胞分别用结晶紫染色,在相位差显微镜下确认了细胞的粘附状态。
[结果]
如图5(-)所示,无添加培养基中仅培养容器中央发现被染色的细胞,确认培养容器的周缘部未粘附细胞。与之相对,如图5(+alb)所示,添加白蛋白的培养基中,在整个培养基容器发现染色的细胞,确认未发生细胞的剥离。此外,如图(+pva)和(+pvp)所示,分别通过添加2种亲水性聚合物的培养基培养的细胞中,也确认均与无添加条件下培养的细胞相比,细胞更无空隙地粘附至培养容器的周缘部。
[实施例4:添加各成分的培养基的增殖率的比较]
[培养基的制备]
与比较例1同样地制备基础培养基。
向100ml基础培养基中分别添加仅8.2mgn-乙酰-l-半胱氨酸、仅0.25g聚乙烯醇、8.2mgn-乙酰-l-半胱氨酸及0.25g聚乙烯醇而获得培养基。
[培养]
将人ips细胞253g1株用pbs清洗后,用typleselect(赛默科技公司)和0.5mmedta的等量混合液在37℃处理5分钟,从而分散成单一细胞并回收,使用血球计数板测定细胞数后,向以0.25μg/cm2被覆有imatrix-511(株式会社玛特立松(matrixome,inc.))的贴壁培养用6孔板中以25000细胞/孔接种细胞,通过包含10μmy-27632的上述培养基在37℃、5%co2的条件下培养一晚,每天更换不含y-27632的培养基并培养7天。
关于培养,作为对照准备基础培养基中未进行任何添加的培养基,通过这些培养基以及仅添加n-乙酰-l-半胱氨酸的培养基、仅添加聚乙烯醇的培养基、添加n-乙酰-l-半胱氨酸和聚乙烯醇的培养基进行(n=3)。
[结果]
如图6所示,确认相对于仅基础培养基的培养结果,仅添加n-乙酰-l-半胱氨酸的培养基的情况下相对增殖率增加约1.4倍,仅添加聚乙烯醇的培养基的情况下相对增殖率增加约1.5倍,同时添加n-乙酰-l-半胱氨酸和聚乙烯醇的培养基的情况下相对增殖率增加约2.0倍。
工业上利用的可能性
通过使用本发明的培养基,可在不使用白蛋白的情况下,高效地使多能干细胞稳定地增殖。通过所述培养基培养的多能干细胞未使用白蛋白,因此可广泛地用于再生医疗和医疗领域的研究等,而且由于成本低,可广泛地普及使用多能干细胞的再生医疗和医药品开发等。
- 还没有人留言评论。精彩留言会获得点赞!