子宫体癌的预后的判定方法与流程
本发明涉及一种子宫体癌的预后的判定方法。
背景技术:
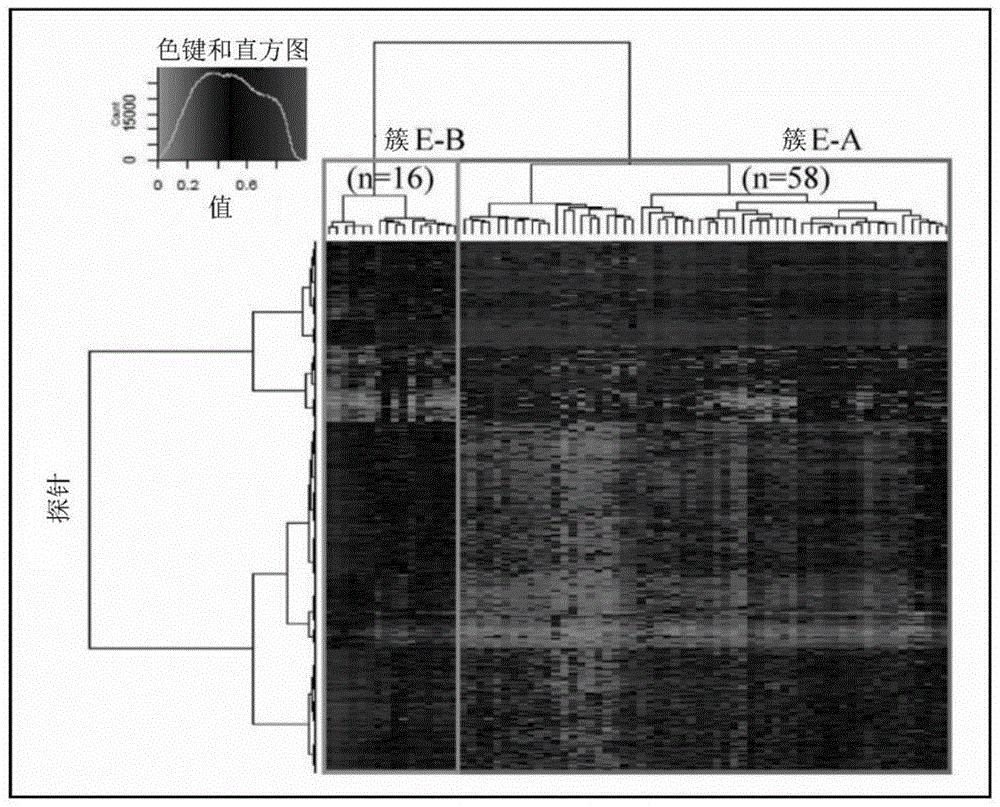
:子宫体癌(endometrialcancer)是在子宫内膜发生的癌,是在发达国家最常见的妇科恶心肿瘤之一。子宫体癌是闭经后的女性多发的疾病,但近年来,更年轻的40岁以下的闭经前女性的发病例正显著增加。现在的子宫体癌的治疗通常是外科手术、即子宫切除和双侧输卵管卵巢摘除术以及根据需要的淋巴结切除。但是,特别是针对将来期望怀孕的更年轻的患者,为了避免外科性闭经,有时选择生育能力保守疗法。生育能力保守疗法之一是利用醋酸甲羟孕酮(mpa)等的激素疗法。报告了针对非典型增生症、早期子宫体癌等子宫内膜的初期肿瘤,mpa疗法被认为有较高的治疗效果。另一方面,生育能力保守疗法的问题是复发。有报告称接受mpa疗法的早期子宫体癌患者的复发率约为63%(非专利文献1),这意味着mpa疗法与外科疗法相比,是复发风险高的治疗法。此外,通常mpa疗法有效的是观察不到向子宫肌层浸润的早期癌症患者。因此,在mpa疗法的应用中,需要不仅考虑患者的维持生育能力的期望,而且还要考虑癌症的阶段和癌症复发的风险而慎重地确认患者对该疗法的适合性。近年来,明确了dna的甲基化的异常与癌化密切相关,受到瞩目。作为癌细胞中的特征性的表观遗传异常,已知有cpg岛的异常的dna甲基化。cpg岛是介由磷酸二酯键(p)的胞嘧啶(c)-鸟嘌呤(g)这2个碱基序列以高频率出现的区域,多存在于基因上游的启动子区域。cpg岛的dna甲基化的异常通过癌抑制基因的失活等而参与致癌。在非专利文献2中记载了与子宫体癌患者的dna甲基化水平上升相关而cpg岛的甲基化水平上升的13个基因。在非专利文献3中记载了作为子宫体癌的高风险组的标记的甲基化dna标记。在非专利文献4中记载了包含与子宫体部的子宫内膜样癌和浆液性癌相关联而甲基化的dna区域、包含两种癌共通地相关联而甲基化的dna区域在内,分别鉴定出约27000个和约15700个。在非专利文献5中记载了已鉴定出在包含znf154启动子的cpg岛的卵巢癌、子宫体癌中甲基化的12个区域。作为甲基化dna的解析方法,已经确立了利用亚硫酸氢盐(bisulfite)法的方法,并被广泛使用。作为以亚硫酸氢盐法为基本原理的甲基化dna解析方法,正在利用甲基化特异性pcr(msp,methylation-specificpcr)法、联合亚硫酸氢钠限制性内切酶分析法(cobra,combinedbisulfiterestrictionanalysis)法、基于bac阵列的甲基化cpg岛扩增法(bamca法)、利用新一代测序仪的测序(methylcap-seq)、利用甲基化/非甲基化dna特异性探针检测单碱基的延伸反应的方法(例如infinium(注册商标)测定)、甲基化敏感性的限制酶测序(mre-seq,methylation-sensitiverestrictionenzymedigestionsequencing)法等。在专利文献1中公开了通过微珠阵列法、质谱分析(massarray法)、焦磷酸测序、甲基化敏感性高分辨率熔解曲线分析、定量pcr、亚硫酸氢盐处理物的直接测序、通过cobra法等来检测特定基因的cpg位点的甲基化水平,从而检测肾细胞癌的预后不良风险的方法。在专利文献2中公开了通过基于离子交换色谱的保留时间的不同来检测特定基因的cpg位点的甲基化水平,从而判定肾细胞癌的预后的方法。现有技术文献专利文献专利文献1:国际公开公报第2013/168644号专利文献2:国际公开公报第2015/129916号非专利文献非专利文献1:j.gynecol.oncol,2018,29:e21非专利文献2:plosone,2017,12:e0173242非专利文献3:epigenetics,2017,12:19-26非专利文献4:bmcgenomics,2014,15:868非专利文献5:epigenetics,2013,8:1355-72技术实现要素:本发明提供以dna的甲基化水平为基准来判定子宫体癌的状态、预后或发病风险的方法和取得用于它们的判定的数据的方法。本发明人等鉴定了子宫体癌组织与正常子宫内膜组织相比甲基化水平不同的基因区域,并进一步从这些基因区域中鉴定了因子宫体癌的恶性度而甲基化水平不同的基因区域。此外,本发明人等发现,通过测定关于该基因区域的dna甲基化水平的数据,从而能够判定子宫体癌的预后、子宫体癌患者对保守疗法的适合性和子宫体癌的发病风险。因此,本发明提供以下方案。〔1〕一种方法,是来自预后不良的子宫体癌患者的细胞或组织的检测方法,包括:对来自子宫体癌细胞或包含该子宫体癌细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及根据所检测的dna甲基化水平,对来自预后不良的子宫体癌患者的细胞或组织进行检测;该靶cpg位点为选自位于表a所记载的染色体上的位置或其附近的cpg位点中的至少1个cpg位点。〔2〕一种方法,是来自适合保守疗法的子宫体癌患者的细胞或组织的检测方法,包括:对来自子宫体癌细胞或包含该子宫体癌细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及根据所检测得dna甲基化水平,对来自适合保守疗法的子宫体癌患者的细胞或组织进行检测;该靶cpg位点为选自位于表a所记载的染色体上的位置或其附近的cpg位点中的至少1个的cpg位点。〔3〕一种方法,是子宫内膜的癌化风险的判定方法,包括:对来自子宫内膜细胞或包含该子宫内膜细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及根据所检测的dna甲基化水平,对该子宫内膜的癌化风险进行判定;该靶cpg位点为选自位于表a所记载的染色体上的位置或其附近的cpg位点中的至少1个cpg位点。〔4〕一种方法,是子宫体癌的预后判定方法,包括:对来自受试体的子宫体癌细胞或包含该子宫体癌细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及根据所检测的dna甲基化水平,对该受试体的子宫体癌的预后进行判定;该靶cpg位点为选自位于表a所记载的染色体上的位置或其附近的cpg位点中的至少1个cpg位点。〔5〕一种方法,是子宫体癌患者对保守疗法的适合性的判定方法,包括:对来自子宫体癌患者的子宫体癌细胞或包含该子宫体癌细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及根据所检测的dna甲基化水平,判定该子宫体癌患者对保守疗法的适合性;该靶cpg位点为选自位于表a所记载的染色体上的位置或其附近的cpg位点中的至少1个cpg位点。〔6〕一种方法,是子宫体癌的风险的判定方法,包括:对来自受试体的子宫内膜细胞或包含该子宫内膜细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及根据所检测的dna甲基化水平,对该受试体的子宫体癌的风险进行判定;该靶cpg位点为选自位于表a所记载的染色体上的位置或其附近的cpg位点中的至少1个cpg位点。〔7〕一种方法,是用于来自预后不良的子宫体癌患者的细胞或组织的检测或者子宫体癌的预后判定的数据的取得方法,包括:对来自受试体的子宫体癌细胞或包含该子宫体癌细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及基于所检测的dna甲基化水平,取得用于检测来自预后不良的子宫体癌患者的细胞或组织的数据或者用于判定该受试体的子宫体癌的预后的数据;该靶cpg位点为选自位于表a所记载的染色体上的位置或其附近的cpg位点中的至少1个cpg位点。〔8〕一种方法,是用于来自适合保守疗法的子宫体癌患者的细胞或组织的检测或者子宫体癌患者对保守疗法的适合性的判定的数据的取得方法,包括:对来自子宫体癌患者的子宫体癌细胞或包含该子宫体癌细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及基于所检测的dna甲基化水平,取得用于检测来自适合保守疗法的子宫体癌患者的细胞或组织的数据或者用于判定该子宫体癌患者对保守疗法的适合性的数据;该靶cpg位点为选自位于表a所记载的染色体上的位置或其附近的cpg位点中的至少1个cpg位点。〔9〕一种方法,是用于子宫内膜的癌化风险的判定或者子宫体癌的风险判定的数据的取得方法,包括:对来自受试体的子宫内膜细胞或包含该子宫内膜细胞组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及基于所检测的dna甲基化水平,取得用于判定该子宫内膜的癌化风险的数据或者用于判定该受试体的子宫体癌的风险的数据;该靶cpg位点为选自位于表a所记载的染色体上的位置或其附近的cpg位点中的至少1个cpg位点。〔10〕根据〔1〕~〔9〕中任一项所述的方法,其中,上述靶cpg位点为选自位于第10染色体106400259位、第8染色体56852290位、第14染色体60973823位、第6染色体28226980位、第1染色体62660624位、第6染色体10390919位、第8染色体132321917位、第11染色体5346249位、第21染色体31972506位、第2染色体1928480位和第1染色体248366399位的cpg位点、以及位于它们的附近的cpg位点中的至少1个cpg位点。〔11〕根据〔1〕~〔9〕中任一项所述的方法,其中,上述靶cpg位点为选自以下cpg位点中的至少1个cpg位点:第10染色体的从106400199位到106400320位的dna区域中所含的cpg位点,第8染色体的从56852230位到56852351位的区域中所含的cpg位点,第14染色体的从60973763位到60973884位的区域中所含的cpg位点,第6染色体的从28226920位到28227041位的区域中所含的cpg位点,第1染色体的从62660564位到62660685位的区域中所含的cpg位点,第6染色体的从10390859位到10390980位的区域中所含的cpg位点,第8染色体的从132321857位到132321978位的区域中所含的cpg位点,第11染色体的从5346189位到5346310位的区域中所含的cpg位点,第21染色体的从31972446位到31972567位的区域中所含的cpg位点,第2染色体的从1928420位到1928541位的区域中所含的cpg位点,以及第1染色体的从248366339位到248366460位的区域中所含的cpg位点。〔12〕根据〔1〕~〔9〕中任一项所述的方法,其中,上述靶cpg位点为选自由序列号1~11中的任一核苷酸序列或其互补序列构成的dna区域中所含的cpg位点中的至少1个cpg位点。〔13〕根据〔1〕~〔12〕中任一项所述的方法,其中,上述dna甲基化水平的检测包括使用经亚硫酸氢盐处理的上述基因组dna对上述靶cpg位点的dna甲基化水平进行检测。〔14〕根据〔13〕所述的方法,其中,上述dna甲基化水平的检测是使用焦磷酸测序法、质谱分析、微珠阵列法或离子交换色谱进行的。〔15〕一种引物或探针,是用于子宫体癌的预后判定、适合保守疗法的子宫体癌患者的判定、或子宫体癌的风险判定的引物或探针,该引物或探针具有至少12个碱基的链长,且与经亚硫酸氢盐处理后的靶cpg位点杂交,该靶cpg位点为选自位于表a所记载的染色体上的位置或其附近的cpg位点中的至少1个cpg位点。〔16〕根据〔15〕所述的引物或探针,其中,上述靶cpg位点为选自位于第10染色体106400259位、第8染色体56852290位、第14染色体60973823位、第6染色体28226980位、第1染色体62660624位、第6染色体10390919位、第8染色体132321917位、第11染色体5346249位、第21染色体31972506位、第2染色体1928480位和第1染色体248366399位的cpg位点以及位于它们的附近的cpg位点中的至少1个cpg位点。〔17〕根据〔15〕所述的引物或探针,其中,所述靶cpg位点为选自以下cpg位点中的至少1个cpg位点:第10染色体的从106400199位到106400320位的区域中所含的cpg位点,第8染色体的从56852230位到56852351位的区域中所含的cpg位点,第14染色体的从60973763位到60973884位的区域中所含的cpg位点,第6染色体的从28226920位到28227041位的区域中所含的cpg位点,第1染色体的从62660564位到62660685位的区域中所含的cpg位点,第6染色体的从10390859位到10390980位的区域中所含的cpg位点,第8染色体的从132321857位到132321978位的区域中所含的cpg位点,第11染色体的从5346189位到5346310位的区域中所含的cpg位点,第21染色体的从31972446位到31972567位的区域中所含的cpg位点,第2染色体的从1928420位到1928541位的区域中所含的cpg位点,以及第1染色体的从248366339位到248366460位的区域中所含的cpg位点。〔18〕根据〔15〕所述的引物或探针,其中,上述靶cpg位点为选自由序列号1~11中的任一核苷酸序列或其互补序列构成的dna区域中所含的cpg位点中的至少1个cpg位点。[表a-1][表a]根据本发明,能够以高灵敏度和特异度来判定子宫体癌的预后(包含恶性度、复发风险)、子宫体癌患者对保守疗法后的适合性、以及子宫体癌的发病风险。本发明能够进行子宫体癌的早期诊断。另外,本发明提供用于确定子宫体癌患者的治疗方针、例如外科手术或保守疗法的指南。特别是本发明提供关于期望怀孕的更年轻的子宫体癌患者的保守疗法的有效性、保守疗法后的复发风险的信息,有助于提高该患者的qol和存活率。另外,本发明能够提供用于它们的判定或诊断的数据。附图说明图1是基于子宫体癌患者组中显示甲基化异常的63033个cpg位点的dna甲基化水平的子宫体癌患者(n=74)的分级聚类。图2是基于年轻性子宫体癌患者组中显示甲基化异常的40589个cpg位点的dna甲基化水平的年轻性子宫体癌患者(n=34)的分级聚类。图3是关于cpg位点的甲基化水平的散点图:(a)第10染色体106400259位、(b)第8染色体56852290位、(c)第14染色体60973823位、(d)第6染色体28226980位、(e)第1染色体62660624位、(f)第6染色体10390919位、(g)第2染色体1928480位、(h)第1染色体248366399位、(i)第21染色体31972506位、(j)第11染色体5346249位、(k)第8染色体132321917位。cv是基于roc曲线将(ye-a)组与(ye-b)组分开的诊断阈值(临界值)。各图中显示基于韦尔奇t(welcht)检验的p值。具体实施方式本说明书中,“子宫体癌(endometrialcancer)”是指发生在子宫内膜的癌,优选为子宫内膜样癌。本说明书中的“子宫体癌”包含原发癌和复发癌。本说明书中,“年轻性子宫体癌”是指闭经前女性、优选可生育年龄女性、更优选40岁以下的女性的子宫体癌。另外,本说明书中,“老年性子宫体癌”是指年轻性子宫体癌以外的子宫体癌,优选为40岁以上的女性或可生育年龄以上的年龄的女性的子宫体癌。本说明书中,“癌的风险”是指患癌或者将来患癌的风险。另外,本说明书中,细胞或组织的“癌化风险”是指细胞或组织具有癌或者将来具有癌的风险。另外,本说明书中,癌的“复发风险”是指该癌复发或者将来复发的风险。优选地,本说明书中的子宫体癌的“复发风险”是指子宫体癌的保守疗法后的复发风险。本说明书中,“恶性度”是指癌的进展度(阶段)或异型度(等级)。子宫体癌的阶段可以依照根据figo(theinternationalfederationofgynecologyandobstetrics(国际妇产科联合会))的手术进展期分类或根据uicc(theunionforinternationalcancercontrol(国际抗癌联盟))的tnm分类(tumor-node-metastasisclassification(肿瘤-转移-淋巴结分类))来决定。本说明书中,“高恶性度”的癌是指进一步发展的阶段或更高异型度的癌。本说明书中,癌的“预后”是指该癌的将来的状态。例如,癌得到改善的可能性越高,视为预后更“良好”(或“非不良”),改善的可能性越低,则视为预后更“差”(或“不良”)。癌的“预后”还反映该癌的恶性度、复发风险。癌的恶性度、复发风险越高,则可将预后视为更“差”(或“不良”)。例如,癌的预后更差是指该癌为更高恶性度或者复发风险更高,另一方面,癌的预后更良好是指该癌为更低恶性度或者复发风险更低。本说明书中,子宫体癌的“保守疗法”是指以保存患者的子宫的方式治疗癌的方法,优选是指生育能力保守疗法、即以保存患者的生育能力的方式治疗癌的方法。作为保守疗法,例如可举出化学疗法、放射线疗法、激素疗法和它们的组合等非外科处置。作为激素疗法,可举出基于醋酸甲羟孕酮(mpa)给予等的黄体激素疗法。或者,只要可保存患者的生育能力,则保守疗法也可以为上述的非外科处置与外科处置(切除子宫内膜的一部分等)的组合。优选本说明书中的“保守疗法”是指基于醋酸甲羟孕酮(mpa)给予等的黄体激素疗法、或者该黄体激素疗法与能够保存患者的生育能力的外科处置的组合。本说明书中,“cpg位点”是指dna中胞嘧啶(c)与鸟嘌呤(g)之间进行磷酸二酯键合(p)的部位。cpg位点以高频率出现的区域被称为cpg岛。cpg岛多存在于接近基因的编码区域的置,例如启动子区域,因此,基因的cpg位点在存在于接近该基因的编码区域的位置的cpg岛或该基因的启动子区域大量存在。本说明书中,“(某)基因的cpg位点”只要没有另行定义,则优选指存在于接近该基因的编码区域的位置的cpg岛中所含的cpg位点,更优选指存在于该基因的启动子区域的cpg位点。本说明书中,“dna甲基化”是指在dna中胞嘧啶的5位的碳被甲基化的状态。另外,本说明书中,某cpg位点的“dna甲基化水平”是指在该cpg位点中dna被甲基化的比例。本说明书中,dna甲基化水平高和低分别是指dna被甲基化的比例高和低。本发明的一个方案涉及一种子宫体癌的预后判定方法。本方案的一个实施方式是一种子宫体癌的预后判定方法,该方法包括:对来自受试体的子宫体癌细胞或包含该子宫体癌细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及根据所检测的dna甲基化水平,对该受试体的子宫体癌的预后进行判定。本方案的另一个实施方式是来自预后不良的子宫体癌患者的细胞或组织的检测方法,该方法包括:对来自受试体的子宫体癌细胞或包含该子宫体癌细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及根据所检测的dna甲基化水平,对来自预后不良的子宫体癌患者的细胞或组织进行检测。在本方案中,作为该受试体的例子,可举出需要子宫体癌的预后判定的人,例如包含子宫体癌的治疗前、治疗中或治疗后的患者的子宫体癌患者。优选该子宫体癌患者为年轻性子宫体癌的患者。作为该受试体的优选的例子,可举出正接受子宫体癌的保守疗法或者期望接受子宫体癌的保守疗法的患者,作为更优选的例子,可举出正接受生育能力保守疗法或期望接受生育能力保守疗法的年轻性子宫体癌的患者。本发明的另一个方案涉及一种子宫体癌患者对保守疗法的适合性的判定方法。本方案的一个实施方式是一种子宫体癌患者对保守疗法的适合性的判定方法,该方法包括:对来自子宫体癌患者的子宫体癌细胞或包含该子宫体癌细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及根据所检测的dna甲基化水平,判定该子宫体癌患者对保守疗法的适合性。本方案的另一个实施方式是来自适合保守疗法的子宫体癌患者的细胞或组织的检测方法,该方法包括:对来自子宫体癌患者的子宫体癌细胞或包含该子宫体癌细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测;以及根据所检测的dna甲基化水平,对来自适合保守疗法的子宫体癌患者的细胞或组织进行检测。在本方案中,作为该子宫体癌患者的例子,可举出需要对保守疗法的适合性的判定的患者。作为该子宫体癌患者的优选的例子,可举出正接受子宫体癌的保守疗法或者期望接受子宫体癌的保守疗法的患者,作为更优选的例子,可举出正接受生育能力保守疗法或期望接受生育能力保守疗法的年轻性子宫体癌的患者。本发明的又一个方案涉及一种子宫体癌的风险判定方法。本方案的一个实施方式涉及一种受试体的子宫体癌的风险的判定方法,该方法包括:对来自受试体的子宫内膜细胞或包含该子宫内膜细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及根据所检测的dna甲基化水平,对该受试体的子宫体癌的风险进行判定。本方案的另一个实施方式是一种子宫内膜的癌化风险的判定方法,该方法包括:对来自受试体的子宫内膜细胞或包含该子宫内膜细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及根据所检测的dna甲基化水平,对该子宫内膜的癌化风险进行判定。在本方案中,作为该受试体的例子,可举出需要子宫体癌的风险的判定的人,例如检查诊断者(検診受診者)、怀疑患有子宫体癌的患者等。作为本发明的方法中使用的来自子宫内膜细胞、子宫体癌细胞或包含它们的组织的基因组dna,可举出由受试体的子宫内膜细胞、子宫体癌细胞或包含它们的组织制备的基因组dna。作为该子宫内膜细胞、子宫体癌细胞或包含它们的组织,例如可举出在外科手术、活检中采取的新鲜的子宫内膜细胞、子宫体癌细胞或包含它们的组织;采取后冷冻的冷冻子宫内膜细胞、冷冻子宫体癌细胞或包含它们的冷冻组织;采取后实施福尔马林固定和石蜡包埋而得的子宫内膜细胞、子宫体癌细胞或包含它们的组织等。其中,从抑制细胞或组织中的基因组dna的分解等,能够更高效地进行dna甲基化水平的检测这样的观点考虑,优选冷冻子宫内膜细胞、冷冻子宫体癌细胞或包含它们的冷冻组织。作为由组织或细胞制备样品dna的方法,没有特别限制,可以适当选择使用公知的方法。作为制备dna的公知的方法,可举出苯酚氯仿法或使用市售的dna提取试剂盒的dna提取方法等,上述市售的dna提取试剂盒例如有qiaampdnaminikit(qiagen公司制)、cleancolumns(nextec公司制)、aquapure(bio-rad公司制)、zrplant/seeddnakit(zymoresearch公司制)、prepgem(zygem公司制)、buccalquick(trimgen公司制)。优选所制备的基因组dna进行亚硫酸氢盐处理。作为dna的亚硫酸氢盐处理的方法,没有特别限制,可以适当选择使用公知的方法。作为用于亚硫酸氢盐处理的公知的方法,例如可举出使用ezdnamethylationgoldtmkit(zymoresearch公司制)、epitectbisulfitekit(48)(qiagen公司制)、methyleasy(humangeneticsignaturespty公司制)、cells-to-cpgbisulfiteconversionkit(appliedbiosystems公司制)、cpgenometurbobisulfitemodificationkit(merckmillipore公司制)等市售的试剂盒的方法。此外,优选将上述经亚硫酸氢盐处理的dna进行扩增。扩增的方法没有特别限制,优选可利用pcr。扩增的方法和条件可以根据扩增对象的dna的序列、长度、量等而适当选择公知的方法和条件而使用。如后述的实施例所示,本发明人等发现,表1~表3所示的cpg位点的dna甲基化水平在具有高恶性度的子宫体癌的患者组与具有更低恶性度的子宫体癌的患者组之间不同。其中,表1所示的cpg位点的dna甲基化水平能够在后述的实施例中以100%的灵敏度和特异度进行高恶性度患者与低恶性度患者的判别。表1~表3所示的cpg位点的dna甲基化水平反映了子宫体癌的进展程度(恶性度),因此,可以作为表示子宫体癌的预后(包含恶性度、复发风险)、风险的标记使用。[表1](a)(b)[表2][表3]因此,本发明的方法中,作为检测dna甲基化水平的靶cpg位点,可举出位于表1~表3所示的染色体上的位置或其附近的cpg位点。本发明的方法中,只要检测选自位于表1~表3所示的染色体上的位置或其附近的cpg位点中的至少1个cpg位点的dna甲基化水平即可。本说明书中,cpg位点的染色体上的位置以作为基准人基因组序列的ncbi数据库genomereferenceconsortiumhumanbuild37(grch37)上的位置为基准来表示。另外,本说明书中,基因的名称基于ncbi数据库([www.ncbi.nlm.nih.gov/gene])中所注册的基因的名称。本说明书中,染色体上的位置的“附近”是指从该染色体上的位置至上游(dna的5’侧)500个碱基~下游(dna的3’侧)500个碱基、优选上游200个碱基~下游200个碱基、更优选上游100个碱基~下游个100碱基、进一步优选上游60个碱基~下游60个碱基的区域。作为位于表1、表2和表3所示的染色体上的位置或其附近的cpg位点的例子,分别可举出以下的表4、表5和表6所示的dna区域中所含的cpg位点。[表4][表5][表6]换言之,作为检测dna甲基化水平的靶cpg位点的例子,可举出由序列号1~68中的任一核苷酸序列或其互补序列构成的dna区域中所含的cpg位点。本发明的方法中,只要检测关于上述的靶cpg位点中的至少1个cpg位点的dna甲基化水平即可。例如,本发明的方法中,只要检测选自上述的表4、表5和表6所示的dna区域中所含的cpg位点中的至少1个cpg位点的dna甲基化水平即可。或者,在本发明中,只要检测选自由序列号1~68的核苷酸序列或其互补序列构成的dna区域中所含的cpg位点中的至少1个cpg位点的dna甲基化水平即可。优选本发明的方法中使用的靶cpg位点为选自位于第10染色体106400259位、第8染色体56852290位、第14染色体60973823位、第6染色体28226980位、第1染色体62660624位、第6染色体10390919位、第8染色体132321917位、第11染色体5346249位、第21染色体31972506位、第2染色体1928480位和第1染色体248366399位的cpg位点以及位于它们的附近的cpg位点中的至少1个cpg位点。优选的实施方式中,本发明的方法中使用的靶cpg位点为选自以下cpg位点中的至少1个cpg位点:第10染色体的从106400199位到106400320位的区域中所含的cpg位点,第8染色体的从56852230位到56852351位的区域中所含的cpg位点,第14染色体的从60973763位到60973884位的区域中所含的cpg位点,第6染色体的从28226920位到28227041位的区域中所含的cpg位点,第1染色体的从62660564位到62660685位的区域中所含的cpg位点,第6染色体的从10390859位到10390980位的区域中所含的cpg位点,第8染色体的从132321857位到132321978位的区域中所含的cpg位点,第11染色体的从5346189位到5346310位的区域中所含的cpg位点,第21染色体的从31972446位到31972567位的区域中所含的cpg位点,第2染色体的从1928420位到1928541位的区域中所含的cpg位点,以及第1染色体的从248366339位到248366460位的区域中所含的cpg位点。优选的实施方式中,本发明的方法中使用的靶cpg位点为选自由序列号1~11的核苷酸序列或其互补序列构成的dna区域中所含的cpg位点中的至少1个cpg位点。更优选的实施方式中,本发明的方法中作为检测dna甲基化水平的对象的靶cpg位点为选自第10染色体106400259位、第8染色体56852290位、第14染色体60973823位、第6染色体28226980位、第1染色体62660624位、第6染色体10390919位、第8染色体132321917位、第11染色体5346249位、第21染色体31972506位、第2染色体1928480位和第1染色体248366399位的cpg位点中的至少1个cpg位点。从能够进一步提高dna甲基化水平的检测的灵敏度或特异度的观点考虑,可以将上述的cpg位点组合而用作靶。作为该组合的例子,可举出表1所示的任一cpg位点与位于其附近的cpg位点的组合、表1所示的cpg位点中的任意2个以上的组合、表1所示的全部cpg位点的组合、表1所示的cpg位点中的任意1个以上与表2或3所示的cpg位点中的任意1个以上的组合等。其中,优选表1所示的任一cpg位点与位于其附近的cpg位点的组合、表1所示的cpg位点中的任意2个以上的组合以及表1所示的全部cpg位点的组合。因此,本发明的方法中,如上所述将经亚硫酸氢盐处理的dna通过pcr等进行扩增时,包含上述靶cpg位点的dna区域被扩增。优选包含上述靶cpg位点的dna区域被扩增。本发明的方法中,将经亚硫酸氢盐处理的dna通过pcr等进行扩增时,更优选表4~6所示的dna区域中的任一部分或全部被扩增。进一步优选表4所示的dna区域中的任一部分或全部被扩增。该扩增的dna区域的尺寸只要在其中包含靶cpg位点就没有限定。本发明的方法中,作为检测cpg位点的dna甲基化水平的方法,只要是能够定量给定的cpg位点的dna甲基化水平的方法即可,可以适当选择公知的方法。作为该公知的方法,例如可举出以下所示的第1~第8方法。第1方法是利用使用了以在3’末端具有与甲基化胞嘧啶或非甲基化胞嘧啶互补的碱基的方式构建的探针的单碱基延伸反应,对cpg位点的dna的甲基化进行定量的方法。例如,第1方法是基于以下原理的方法。首先,对上述基因组dna实施亚硫酸氢盐处理。应予说明,通过该亚硫酸氢盐处理,非甲基化胞嘧啶残基被转换成尿嘧啶,但甲基化胞嘧啶残基未被转换(参照clarksj等,nucleicacidsres,1994年,22卷,2990~7页)。接着,以如此进行了亚硫酸氢盐处理的基因组dna为模板进行全基因组扩增,利用酶进行片段化(通常300~600bp左右的片段化),解离成单链。在第1方法中,制备一种探针,该探针是与通过亚硫酸氢盐处理而转换的基因组dna杂交的探针,该探针的3’末端的碱基是与上述cpg位点的胞嘧啶互补的碱基。即,该cpg位点被甲基化时,探针的3’末端的碱基成为鸟嘌呤,该cpg位点未被甲基化时,探针的3’末端的碱基成为腺嘌呤。然后,使这样的与上述cpg位点互补的仅3’末端的碱基不同的2种探针与上述单链dna片段杂交,在经荧光标记的碱基存在下进行单碱基延伸反应。其结果,该单链片段的cpg位点被甲基化时,在3’末端的碱基为鸟嘌呤的探针(甲基化检测用探针)中通过单碱基延伸反应而掺入经荧光标记的碱基,但在3’末端的碱基为腺嘌呤的探针(非甲基化检测用探针)中,由于3’末端的碱基的错配而未发生单碱基延伸反应,从而经荧光标记的碱基未被掺入。另一方面,该单链片段的cpg位点未被甲基化时,虽然在非甲基化检测用探针中掺入经荧光标记的碱基,但在甲基化检测用探针中未掺入经荧光标记的碱基。因此,可以根据甲基化检测用探针和/或非甲基化检测用探针所发出的荧光的强度来算出dna甲基化水平。另外,在该第1方法中,作为其它方式,可以代替上述甲基化检测用探针和非甲基化检测用探针而使用如下的探针,该探针是与通过亚硫酸氢盐处理而转换的基因组dna杂交的探针,该探针的3’末端的碱基成为与上述cpg位点的鸟嘌呤互补的碱基。然后,使该探针与上述单链dna片段杂交,在用荧光物质标记了的鸟嘌呤和/或利用与该荧光物质不同的荧光色素标记了的腺嘌呤的存在下进行单碱基延伸反应。其结果,上述cpg位点被甲基化时,在该探针掺入经荧光标记的鸟嘌呤,另一方面,上述cpg位点未被甲基化时,在该探针掺入经荧光标记的腺嘌呤,因此,可以根据掺入上述探针的各荧光物质所发出的荧光的强度来算出dna甲基化水平。作为该第1方法的优选的例子,例如可举出微珠阵列法(例如,infinium(注册商标)测定)。第2方法是通过质谱分析对甲基化dna进行定量的方法。例如,第2方法是基于以下原理的方法。首先,对上述基因组dna实施亚硫酸氢盐处理。接着,以经亚硫酸氢盐处理的基因组dna为模板,将含有至少一个上述cpg位点的dna用附加了t7启动子的引物进行扩增。接着,将经扩增的dna转录成rna,利用核糖核酸酶(rnase)进行碱基特异性的切割反应。然后,将该切割反应产物施加于质谱分析仪进行质量测定。然后,将通过质量测定而得到的来自甲基化胞嘧啶残基的质量(胞嘧啶的质量)与来自非甲基化胞嘧啶残基的质量(尿嘧啶的质量)进行比较,算出上述cpg位点中的dna甲基化水平。作为该第2方法的优选的例子,例如可举出使用质谱分析仪的dna甲基化解析法(例如,参照massarray(注册商标),jurinkec等,mutatres,2005年,573卷,83~95页和专利文献2)。在massarray(注册商标)中,将亚硫酸氢盐处理后的包含cpg位点的dna进行扩增,转录成rna后,利用rna酶(rnaase)在尿嘧啶的部位进行特异性切割。由此,根据dna的甲基化的有无而生成长度不同的rna片段。将得到的rna片段进行质谱分析,由此将cpg位点被甲基化的片段和非甲基化片段依照分子量的差进行分离并检测。用于包含该cpg位点的dna的扩增的引物可以使用epidesigner(sequenom公司制,massarray用引物设计软件)等进行设计。在rna片段的质谱分析中,可使用能够检测一个碱基的质量的差异的maldi-tofmas(例如,sequenom公司制,massarrayanalyzer4)。根据来自甲基化dna的rna片段与来自非甲基化dna的rna片段的质量的比来算出dna的甲基化水平。第3方法是基于以下原理的方法。首先,对上述基因组dna实施亚硫酸氢盐处理。应予说明,通过该亚硫酸氢盐处理,非甲基化胞嘧啶残基被转换成尿嘧啶,但在下述延伸反应(序列反应)中,尿嘧啶以胸腺嘧啶的形式显示。接着,以如此经亚硫酸氢盐处理的基因组dna为模板,将包含至少一个上述cpg位点的dna进行扩增。然后,使经扩增的dna解离成单链。接着,在经解离的单链dna中,仅分离一条链。然后,从上述cpg位点的碱基的附近1个碱基1个碱基地进行延伸反应,使此时生成的焦磷酸进行酶促发光,并测定发光的强度。将以这样的方式得到的来自甲基化胞嘧啶残基的发光的强度(胞嘧啶的发光强度)与来自非甲基化胞嘧啶残基的发光的强度(胸腺嘧啶的发光强度)进行比较,例如利用下述式算出上述cpg位点中的dna甲基化水平(%)。dna甲基化水平(%)=胞嘧啶的发光强度×100/(胞嘧啶的发光强度+胸腺嘧啶的发光强度)。作为第3方法,例如可举出焦磷酸测序法(注册商标,pyrosequencing)(参照anal.biochem.(2000)10:103-110)等。第4方法是基于以下原理的方法。首先,对上述基因组dna进行亚硫酸氢盐处理。接着,在包含插入到dna双链间时发出荧光的嵌入剂的反应体系中,以上述经亚硫酸氢盐处理的基因组dna为模板,对包含至少1个上述cpg位点的核苷酸进行扩增。接着,改变上述反应体系的温度,并检测上述嵌入剂所发出的荧光的强度的变动。将包含至少1个上述cpg位点的核苷酸的熔解曲线与以甲基化·非甲基化对照检测体为模板的扩增产物的熔解曲线相比,算出上述cpg位点的dna甲基化水平。作为第4方法,例如可举出甲基化敏感性高分辨率熔解曲线分析(methylation-sensitivehighresolutionmelting:ms-hrm,参照wojdacztk等,natprotoc.,2008年,3卷,1903~8页)。第5方法是基于以下原理的方法。首先,对上述基因组dna实施亚硫酸氢盐处理。接着,制备上述cpg位点被甲基化时可扩增的引物组和上述cpg位点未被甲基化时可扩增的引物组。然后,以上述经亚硫酸氢盐处理的基因组dna为模板,将包含至少1个上述cpg位点的核苷酸使用这些引物组分别进行扩增。然后,通过将得到的扩增产物的量、即甲基化cpg位点特异性的扩增产物的量和非甲基化cpg位点特异性的扩增产物的量进行比较,算出上述cpg位点的dna甲基化水平。进而,在该第5方法中,作为其它方式,首先,对上述基因组dna实施亚硫酸氢盐处理。接着,制备具有在上述cpg位点被甲基化时可杂交的核苷酸且标记了报告荧光色素和猝灭荧光色素的寡核苷酸探针。另外,制备具有在上述cpg位点未被甲基化时可杂交的核苷酸且标记了与上述报告荧光色素不同的报告荧光色素和猝灭荧光色素的寡核苷酸探针。然后,使上述寡核苷酸探针与经亚硫酸氢盐处理的基因组dna杂交,进一步以上述寡核苷酸探针杂交的基因组dna为模板,将包含上述cpg位点的核苷酸进行扩增。然后,通过伴随上述扩增的寡核苷酸探针的分解来检测上述报告荧光色素所发出的荧光。通过将以这样的方式检测的甲基化胞嘧啶cpg位点特异性的报告荧光色素所发出的荧光的强度与非甲基化胞嘧啶cpg位点特异性的报告荧光色素所发出的荧光的强度进行比较而算出上述cpg位点的dna甲基化水平。作为第5方法,例如可举出使用taqman探针(注册商标)的methylight法等甲基化特异性定量pcr法(methylation-specificpolymerasechainreaction(ms-pcr)usingreal-timequantitativepcr)。第6方法是基于以下原理的方法。首先,对上述基因组dna实施亚硫酸氢盐处理。接着,以经亚硫酸氢盐转换的包含上述cpg位点的核苷酸为模板进行直接测序反应。然后,通过将基于所确定的碱基序列的荧光强度、即来自甲基化胞嘧啶残基的荧光强度(胞嘧啶的荧光强度)与来自非甲基化胞嘧啶残基的荧光强度(胸腺嘧啶的荧光强度)进行比较而算出上述cpg位点的dna甲基化水平。进而,在该第6方法中,作为其它方式,首先,对上述基因组dna实施亚硫酸氢盐处理。接着,将经亚硫酸氢盐转换的包含上述cpg位点的核苷酸通过pcr反应等进行克隆。然后,分别确定所得到的多个克隆产物的碱基序列,通过将具有甲基化胞嘧啶cpg位点特异性的碱基序列的克隆产物的个数与具有非甲基化胞嘧啶cpg位点特异性的碱基序列的克隆产物的个数进行比较而算出上述cpg位点的dna甲基化水平。作为第6方法,例如可举出亚硫酸氢盐直接测序(bisulfitedirectsequencing)、亚硫酸氢盐克隆测序(bisulfitecloningsequencing)(参照kristensenls等,clinchem,2009年,55卷,1471~83页)。第7方法是基于以下原理的方法。首先,对上述基因组dna实施亚硫酸氢盐处理。接着,以经亚硫酸氢盐转换的包含上述cpg位点的核苷酸为模板,将包含上述cpg位点的区域利用pcr进行扩增。接着,将经扩增的dna片段用识别在该cpg位点被甲基化时和未被甲基化时序列不同的位置的限制酶进行处理。然后,对通过电泳而分级的、来自甲基化cpg位点的限制酶片段与来自非甲基化cpg位点的限制酶片段的条带浓度进行定量解析,由此能够算出该cpg位点的dna甲基化水平。作为第7方法,例如可举出cobra(通过并用亚硫酸氢盐与限制酶进行的解析)。第8方法是使用离子交换色谱的方法。例如,第8方法是基于以下原理的方法。首先,对上述基因组dna实施亚硫酸氢盐处理。接着,将其片段化而得到包含cpg位点的dna片段。以得到的dna片段为模板,将包含该cpg位点的区域利用pcr进行扩增。接着,将经扩增的dna片段施加于离子交换色谱,将该cpg位点被甲基化的dna和未被甲基化的dna分离。在第8方法中,pcr的扩增产物的链长可考虑pcr的扩增时间的缩短以及离子交换色谱中的分析时间的缩短、分离性能的维持等要素而适当选择。例如,使用cpg位点多的样品dna时的pcr扩增产物的链长优选为1000bp以下,更优选为700bp以下,进一步优选为500bp以下。另一方面,对于使用cpg位点少的样品dna时的pcr扩增产物的链长,使用避免pcr中的非特异性杂交的15mer附近的引物时的pcr扩增产物的链长即30~40bp成为下限。另一方面,优选以cpg位点的含有率变得丰富的方式设计引物。例如,cpg位点的胞嘧啶相对于pcr扩增产物的链长优选包含2%以上,更优选包含5%以上。在第8方法中,非甲基化胞嘧啶残基通过基因组dna的亚硫酸氢盐处理转换成尿嘧啶后,通过pcr进一步转换成胸腺嘧啶。另一方面,甲基化胞嘧啶残基在亚硫酸氢盐处理和pcr后也是胞嘧啶的状态。根据该碱基的不同,包含甲基化胞嘧啶的片段(甲基化片段)和非甲基化片段在离子交换色谱中作为保留时间不同的不同峰被检测出。即,甲基化片段与非甲基化片段相比,作为保留时间更短的峰被检测出。因此,可以基于离子交换色谱中的峰的保留时间来判定cpg位点的dna是否甲基化。进而,在施加于离子交换色谱的dna中含有多个cpg位点时,更多个cpg位点被甲基化时,峰的保留时间变得更短。因此,可以基于该峰的保留时间来算出cpg位点的dna甲基化水平。或者,也可以基于该峰的面积或高度来算出甲基化片段和非甲基化片段各自的存在量、存在比率。优选通过与cpg位点的dna甲基化水平已知的样品(对照)进行比较,或者利用使用dna甲基化水平已知的样品预先制作的校正曲线来判断cpg位点的dna是否被甲基化或者cpg位点的dna甲基化水平。或者使用dna甲基化水平已知的样品来预先确定作为将cpg位点被高度甲基化的甲基化片段的峰的保留时间与甲基化水平低的片段的峰的保留时间分开的基准的保留时间(在本说明书中也称为基准保留时间)。例如,在早于基准保留时间的保留时间检测出的片段可判断为被高度甲基化的dna。第8方法中进行的离子交换色谱优选为阴离子交换色谱。作为柱的填充剂,只要是在表面具有强阳离子性基团的基材粒子就没有特别限定,优选国际公开公报第2012/108516号所示的在填充剂表面具有强阳离子性基团和弱阳离子性基团两者的基材粒子。更优选该基材粒子是含有具有强阳离子性基团(优选为季铵盐)的亲水性聚合物的层共聚于疏水性交联聚合物粒子的表面的被覆聚合物粒子和导入该被覆聚合物粒子表面的弱阳离子性基团(优选为叔氨基)的基材粒子。色谱分析时的柱温优选为30℃以上且小于90℃。以上,例示了能够适宜用作本发明中“检测dna甲基化水平的方法”的方法,但方法并不限定于此。在上述第1~第8的方法中,如上所述,由子宫内膜细胞、子宫体癌细胞或包含它们的组织制备的基因组dna被进一步供于亚硫酸氢盐处理。因此,本发明的方法中,cpg位点的dna甲基化水平的检测中使用的基因组dna优选为来自子宫内膜细胞、子宫体癌细胞或包含它们的组织的经亚硫酸氢盐处理的基因组dna。本发明的方法中,根据所检测的cpg位点的dna甲基化水平,判定子宫体癌的预后(包含恶性度、复发风险)、受试体对保守疗法的适合性或子宫体癌的风险(子宫内膜的癌化风险)。在基于本发明的子宫体癌的预后判定中,优选判定受试体的子宫体癌的预后是否差,或者该受试体的子宫体癌是否为高恶性度,或者该受试体的子宫体癌的复发风险是否高。另外,优选判定该dna甲基化水平的检测中使用的细胞或组织是否为来自具有预后不良的子宫体癌的患者的细胞或组织,或者是否为来自具有高恶性度或复发风险高的子宫体癌的患者的细胞或组织。在基于本发明的受试体的对保守疗法的适合性的判定中,优选判定该受试体是否对子宫体癌的保守疗法具有适合性。另外,优选判定该dna甲基化水平的检测中使用的细胞或组织是否为来自适合子宫体癌的保守疗法的患者的细胞或组织。在基于本发明的子宫体癌的风险判定中,优选判定受试体的子宫内膜的癌化风险是否高,或者该受试体的子宫体癌的风险是否高。更优选判定该受试体的子宫内膜将来保有子宫体癌的风险是否高,或者该受试体将来患有子宫体癌的风险是否高。或者,判定该dna甲基化水平的检测中使用的细胞或组织是否为来自子宫体癌的风险高的受试体的细胞或组织。用于上述判定的具体的指标(阈值)可以由本领域技术人员根据检测dna甲基化水平的方法而适当设定。以下对判定步骤的实施方式进行描述。在用于上述判定的第一实施方式中,首先,关于各dna甲基化水平检测方法,对各个cpg位点进行接收者操作特性(roc)解析,求出灵敏度(阳性率)和特异度(阴性率)。可以将灵敏度和特异度的和达到最大的dna甲基化水平设定为临界值。例如,可以基于约登指数来设定临界值。在上述第一实施方式中,关于因子宫体癌的进展而甲基化水平亢进的cpg位点(例如,位于表1(a)和表2所示的染色体上的位置或其附近的cpg位点),通过本发明的方法检测出的dna甲基化水平比临界值高时,判断为dna甲基化水平超过诊断阈值,判定受试体为子宫体癌的预后不良组或子宫体癌的高风险组,或者判定为不适合保守疗法的组。另一方面,如果该所检测的甲基化水平为该临界值以下,则判定该受试体不是子宫体癌的预后不良组或子宫体癌的高风险组,或者判定为适合保守疗法组。另一方面,关于因子宫体癌的进展而甲基化水平降低的cpg位点(例如,位于表1(b)和表3所示的染色体上的位置或其附近的cpg位点),通过本发明的方法检测出的dna甲基化水平比临界值低时,判断为dna甲基化水平超过诊断阈值,判定受试体为子宫体癌的预后不良组或子宫体癌的高风险组,或者判定为不适合保守疗法的组。另一方面,如果所检测的甲基化水平为该临界值以上,则判定该受试体不是子宫体癌的预后不良组或子宫体癌的高风险组,或者判定为适合保守疗法的组。在用于上述判定的第二实施方式中,通过将关于包含来自受试体的靶cpg位点的dna(样品)的离子交换色谱解析(上述第8方法)中得到的峰的保留时间与关于包含未甲基化的该靶cpg位点的dna(阴性对照)或包含甲基化的该靶cpg位点的dna(阳性对照)的保留时间进行比较来进行该cpg位点的甲基化水平的确定或关于上述的子宫体癌的癌的预后判定、风险判定或者对保守疗法的适合性的判定。在上述第二实施方式中,关于因子宫体癌的进展而甲基化水平亢进的cpg位点(例如,位于表1(a)和表2所示的染色体上的位置或其附近的cpg位点),从样品检测出比阴性对照的峰短的规定的保留时间的峰时,判断为dna甲基化水平超过诊断阈值,判定受试体为子宫体癌的预后不良组或子宫体癌的高风险组,或者判定为不适合保守疗法的组。优选从样品检测出与阳性对照同等的保留时间的峰时,判断为dna甲基化水平超过诊断阈值,判定受试体为子宫体癌的预后不良组或子宫体癌的高风险组,或者判定为不适合保守疗法的组。另一方面,该dna甲基化水平不超过诊断阈值时,判定该受试体不是子宫体癌的预后不良组或子宫体癌的高风险组,或者判定为适合保守疗法的组。另一方面,关于因子宫体癌的进展而甲基化水平降低的cpg位点(例如,位于表1(b)和表3所示的染色体上的位置或其附近的cpg位点),从样品检测出比阳性对照的峰长的规定保留时间的峰时,判断为dna甲基化水平超过诊断阈值,判定受试体为子宫体癌的预后不良组或子宫体癌的高风险组,或者判定为不适合保守疗法的组。或者,从样品检测出与阴性对照同等的保留时间的峰时,判断为dna甲基化水平超过诊断阈值,判定受试体为子宫体癌的预后不良组或子宫体癌的高风险组,或者判定为不适合保守疗法的组。另一方面,该dna甲基化水平不超过诊断阈值时,判定该受试体不是子宫体癌的预后不良组或子宫体癌的高风险组,或者判定为适合保守疗法的组。在上述第一和第二实施方式中,在检测多个cpg位点的甲基化水平时,可以将dna甲基化水平超过上述诊断阈值的cpg位点的数量或比例作为用于判定的指标。例如,所调查的全部cpg位点的甲基化水平均超过诊断阈值时,可以将受试体判定为子宫体癌的预后不良组或子宫体癌的高风险组,或者判定为为不适合保守疗法的组。或者,所调查的cpg位点中的一定比例以上的甲基化水平超过诊断阈值时,可以将受试体判定为子宫体癌的预后不良组或子宫体癌的高风险组,或者判定为不适合保守疗法的组。或者,一定数量以上的cpg位点的甲基化水平超过诊断阈值时,可以将受试体判定为子宫体癌的预后不良组或子宫体癌的高风险组,或者判定为不适合保守疗法的组。另一方面,可判定不满足这些基准的受试体不是子宫体癌的预后不良组或子宫体癌的高风险组,或者判定为适合保守疗法的组。像这样,根据本发明能够判定子宫体癌的风险、预后。根据本发明的方法,如果能够在早期发现子宫体癌的发病的高风险组患者,则能够进行预防干预而避免子宫体癌的发病,或者通过早期的治疗而能够改善患者的生命预后。特别是通过本发明的方法来筛选恶性度、复发的可能性低的子宫体癌,能够预测保守疗法对患者的有效性。该对保守疗法的有效性的预测对将来有怀孕的可能性的年轻性子宫体癌的患者特别有用。mpa疗法等生育能力保守疗法对期望怀孕的患者是重要的治疗选择项,但仅对早期癌症患者有效,且与外科手术相比,复发的风险高。因此,在应用保守疗法时,需要慎重地确认患者对该疗法的适合性。本发明通过对期望保守疗法的患者提供关于保守疗法对该患者的有效性的信息,从而能够对该患者的qol和生命预后的改善作出贡献。因此,本发明还涉及对通过上述本发明的风险判定方法而分类为子宫体癌的高风险组的受试体进行预防干预。该本发明的方案使该高风险组的受试体的子宫体癌的予防、早期诊断或早期治疗成为可能。进而,本发明提供一种子宫体癌的治疗方法,包括对通过上述本发明的风险判定方法而判定为子宫体癌的受试体进行治疗。进而,本发明提供一种子宫体癌的治疗方法,包括对通过上述本发明的预后判定方法而分类为子宫体癌的预后不良组的受试体进行治疗。这些本发明的方案使对具有子宫体癌的受试体在更早期实施适当的治疗成为可能。作为治疗的手段,可举出外科手术、化学疗法、放射线疗法、mpa疗法等激素疗法等,但没有特别限定。在进一步的方案中,本发明涉及提供用于上述的子宫体癌的风险、预后判定或者用于患者对保守疗法的适合性的判定的数据。本方案的一个实施方式是用于来自预后不良的子宫体癌患者的细胞或组织的检测或者子宫体癌的预后判定的数据的取得方法,该方法包括:对来自受试体的子宫体癌细胞或包含该子宫体癌细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及基于所检测的dna甲基化水平而取得用于检测来自预后不良的子宫体癌患者的细胞或组织的数据或者用于判定该受试体的子宫体癌的预后的数据。本方案的另一个实施方式是用于来自适合保守疗法的子宫体癌患者的细胞或组织的检测或者子宫体癌患者的对保守疗法的适合性的判定的数据的取得方法,该方法包括:对来自子宫体癌患者的子宫体癌细胞或包含该子宫体癌细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及基于所检测的dna甲基化水平而取得用于检测来自适合保守疗法的子宫体癌患者的细胞或组织的数据或者用于判定该子宫体癌患者的对保守疗法的适合性的数据。本方案的另一个实施方式是用于子宫内膜的癌化风险的判定或子宫体癌的风险判定的数据的取得方法,该方法包括:对来自受试体的子宫内膜细胞或包含该子宫内膜细胞的组织的基因组dna中的靶cpg位点的dna甲基化水平进行检测,以及基于所检测的dna甲基化水平而取得用于判定该子宫内膜的癌化风险的数据或用于判定该受试体的子宫体癌的风险的数据。该受试体的例子、基因组dna的制备和dna甲基化水平的检测步骤以及应检测甲基化水平的靶cpg位点与上述同样。如上所述,表1~表3所示的cpg位点中的dna甲基化水平可以用作表示子宫体癌的预后、风险或对保守疗法的适合性的标记。基于上述本发明的数据的取得方法是不含由医生等得到的子宫体癌的预后、风险或对保守疗法的适合性的诊断的方法。例如,该方法是在研究所、临床检查机关等中实施的用于取得医生等的诊断所需的数据的方法。进而,本发明提供用于子宫体癌的预后(包含恶性度、复发风险)的判定、受试体的子宫体癌的对保守疗法的适合性的判定或子宫体癌的风险(子宫内膜的癌化风险)判定的引物或探针。该引物或探针具有至少12个碱基的链长且与经亚硫酸氢盐处理后的靶cpg位点杂交。本发明的引物或探针的一个例子为与表4~6所示的任一dna区域(例如,由序列号1~68中的任一核苷酸序列或其互补序列构成的dna区域)中所含的cpg位点杂交的引物或探针。优选该引物或探针为与表4所示的任一dna区域(例如,由序列号1~11中的任一核苷酸序列或其互补序列构成的dna区域)中所含的cpg位点杂交的引物或探针。本发明的引物或探针的优选的一个例子为由序列号1~68中的任一核苷酸序列或其互补序列构成的引物或探针。本发明的引物或探针的其它优选的一个例子为与序列号1~68中的任一核苷酸序列或其互补序列具有95%以上的同一性,且与和该序列所杂交的cpg位点相同的cpg位点杂交的引物或探针。另外,与和这些引物或探针所杂交的cpg位点相同的cpg位点杂交的该引物或探针的片段也可以用作本发明的引物或探针。本发明的引物或探针的更优选的例为由序列号1~11中的任一核苷酸序列或其互补序列构成的引物或探针。本发明的引物或探针的其它更优选的例子为与序列号1~11中的任一核苷酸序列或其互补序列具有95%以上的同一性,且与和该序列所杂交的cpg位点相同的cpg位点杂交的引物或探针。另外,与和这些引物或探针所杂交的cpg位点相同的cpg位点杂交的该引物或探针的片段也可以用作本发明的引物或探针。本发明的引物或探针的其它优选的一个例子为以与经亚硫酸氢盐处理的包含上述靶cpg位点的dna片段(例如,包含序列号1~68中的任一核苷酸序列的片段或其互补链)杂交且在其3’末端具有与甲基化胞嘧啶或非甲基化胞嘧啶互补的碱基的方式构建的引物或探针(例如上述的第1方法中可以使用的引物或探针)。本发明的引物或探针的其它优选的一个例子为可以从经亚硫酸氢盐处理的上述靶cpg位点的碱基的附近1个碱基1个碱基地进行延伸反应的引物(测序引物)(例如上述的第3方法中可以使用的引物或探针)。其它优选的一个例子为与经亚硫酸氢盐处理的包含上述靶cpg位点的核苷酸杂交的探针(例如上述的第4方法中可以使用的引物或探针)。本发明的引物或探针的其它优选的一个例子为能够将经亚硫酸氢盐处理的包含上述靶cpg位点的dna片段(例如,包含序列号1~68中的任一核苷酸序列的片段或其互补链)中的包含甲基化或未甲基化的该靶cpg位点的区域进行特异扩增的引物组(例如上述的第5方法或第8方法的pcr扩增中可以使用的引物组)。本发明的引物或探针的链长只要为至少12个碱基即可,优选为至少15个碱基,更优选为至少20个碱基,进一步优选为15~200个碱基。在探针的情况下,优选的链长为100~200个碱基,更优选为100~150个碱基。在pcr引物的情况下,优选的链长为12~60个碱基,更优选为15~40个碱基。另外,本发明的引物或探针可以被标记(例如荧光标记)。另外,本发明的引物或探针优选为上述第1~第8方法中的任一者中可以使用的引物或探针。进而,本发明提供用于子宫体癌的预后判定、受试体的子宫体癌的对保守疗法的适合性的判定、或子宫体癌的风险判定的试剂盒,其中,包含上述本发明的引物或探针。优选本发明的试剂盒用于通过上述第1~第8方法中的任一者来进行子宫体癌的预后判定、受试体的子宫体癌的对保守疗法的适合性的判定、或子宫体癌的风险判定,或者用于取得用于这些判定的数据。本发明的试剂盒可以包含上述本发明的引物或探针以外的成分。作为这样的成分的例子,可举出亚硫酸氢盐处理所需的试剂(例如,亚硫酸氢钠溶液等)、pcr反应所需的试剂(例如,脱氧核糖核苷酸、耐热性dna聚合酶等)、infinium(注册商标)测定所需的试剂(例如,利用荧光物质标记了的核苷酸)、massarray(注册商标)所需的试剂(例如,用于进行碱基特异性的切割反应的核糖核酸酶(rnase))、焦磷酸测序所需的试剂(例如,用于焦磷酸的检测的atp硫酸化酶、腺苷-5’-磷酰硫酸、荧光素酶、荧光素、用于将单链dna分离的链霉亲和素等)、ms-hrm法所需的试剂(例如,插入到dna双链间时发出荧光的嵌入剂等)、标记的检测所需的试剂(例如底物、酶、阳性对照或阴性对照样品、试样(来自组织的基因组dna等)的稀释和清洗中使用的缓冲液等)等,但并不限定于这些。另外,试剂盒中可以包含其使用说明书。实施例以下,利用实施例对本发明详细地进行说明,但本发明并不限定于以下的实施例。〔患者和组织样品〕本实施例是受到庆应义塾大学医院的伦理委员会的批准并依照赫尔辛基条约实施的。组织样品是由庆应义塾大学医院中接受了外科手术的患者得到的。得到了全部患者的书面的知情同意。由具有子宫内膜样癌的子宫体癌患者(e)组(年龄23-77岁)得到子宫体癌组织的样品(n=74)。另外,由不具有子宫体癌的患者(c)组(年龄33-55岁)得到子宫内膜组织样品(n=31)。将子宫体癌患者(e)组中年龄为40岁以下的34人分类为年轻性子宫体癌患者(ye)组,将年龄为40岁以上的40人分类为老年性子宫体癌患者(oe)组。(e)组中的癌的组织学诊断和异型度诊断基于who分类(2003)和tnm分类进行。临床阶段的诊断基于figo分类进行。癌的复发基于诊察和图像诊断由临床医师诊断。将(e)组的临床病理学因子示于表7。[表7]采取的组织被冷冻保存。将得到的新鲜冷冻组织样品利用苯酚-氯仿进行处理,接着实施透析,由此提取基因组dna。将提取的dna500ng使用ezdnamethylation-goldtm试剂盒(zymoresearch公司制)进行亚硫酸氢盐处理。〔实施例1伴随子宫体癌的dna甲基化的变化〕(通过infinium(注册商标)测定进行的dna甲基化水平的检测)使用infinium(注册商标)methylationepicbeadchip(illumina公司制)以1个cpg位点的分辨率对866895个cpg部位的dna甲基化状态进行解析。根据由销售商illumina公司提供的规格,methylationepicbeadchip在解析对象中包含启动子区域、5’非翻译区域、第1外显子、基因内、3’非翻译区域,覆盖refseq基因的99%、cpg岛的96%。使用infinium(注册商标)测定试剂盒(illumina公司制)对经亚硫酸氢盐处理的dna进行全基因组扩增处理。使经扩增的dna片段与上述芯片上的探针杂交,接着通过单碱基延伸反应对经杂交的dna插入经荧光标记的碱基。由此,将与包含甲基化cpg的dna片段杂交的甲基化检测用探针和与包含非甲基化cpg的dna片段杂交的非甲基化检测用探针分别进行荧光标记。接着,依照制造公司的说明书,使用iscanreader(illumina公司制)测定荧光信号。得到的数据使用genomestudiomethylationsoftware(illumina公司制)进行解析。在各cpg位点中,算出来自甲基化检测用探针的信号相对于来自甲基化检测用探针和非甲基化检测用探针的信号的合计的相对比。即,来自各cpg位点的甲基化水平表示为所谓β值(范围:0.00~1.00)。(统计解析)对得到的甲基化水平的数据进行韦尔奇t(welcht)检验和邦费罗尼校正,检测在(c)组与(e)组之间甲基化水平显示显著性差异(p值<0.01且|e组平均-c组平均|≥0.25)的cpg位点。其结果,与(c)组相比,(e)组中鉴定出了显示甲基化异常的63033个cpg位点。〔实施例2伴随年轻性子宫体癌的dna甲基化的变化〕通过与实施例1同样的步骤对年轻性子宫体癌患者(ye)组进行infinium(注册商标)测定,检测伴随癌而dna甲基化水平发生变化的cpg位点。其结果,与(c)组相比,在(ye)组中鉴定出了显示甲基化异常的40589个cpg位点。〔实施例3基于dna甲基化图的全部子宫体癌的聚类〕(分级聚类)通过基于实施例1中发现的63033个cpg位点的dna甲基化水平的分级聚类(欧几里得距离、沃德法和坎贝拉距离、全联法),将(e)组分为簇a((e-a)组,n=58)和簇b((e-b)组,n=16)(图1)。将(e-a)组和(e-b)组的临床病理学因子示于表8。(e-a)组与(e-b)组相比,具有年龄显著高,血管侵袭为显著高的频率,且高异型度g3病例多的趋势。另外,复发和死亡例均包含在(e-a)组中。因此,认为(e-a)组是临床病理学恶性度高的预后不良的患者组。[表8]〔实施例4基于dna甲基化图的年轻性子宫体癌的聚类〕(分级聚类)通过与实施例3同样的步骤,通过基于实施例2中发现的40589个cpg位点的dna甲基化水平的分级聚类,将(ye)组分为簇a((ye-a)组,n=22)和簇b((ye-b)组,n=12)(图2)。将(ye-a)组和(ye-b)组的临床病理学因子示于表9。(ye-a)组与(ye-b)组相比,具有血管侵袭和高异型度g3症例多的趋势。另外,唯一的复发例包含在(ye-a)组中。进而,(ye-a)组的患者全部包含在上述(e-a)组中,且(ye-b)组的患者全部包含在上述(e-b)组中。根据这些结果,认为(ye-a)组是临床病理学恶性度高的预后不良的患者组。[表9]〔实施例5能够检测低恶性度的子宫体癌的dna甲基化标记的鉴定〕对用于判别高恶性度的(ye-a)组和更低恶性度的(ye-b)组的标记进行了探索。对(ye-a)组和(ye-b)组中的dna甲基化水平的差最大的100个cpg位点进行了roc解析。对各位点的甲基化水平制作基于(ye-a)组和(ye-b)组的判别灵敏度和特异度的roc曲线,算出曲线下面积(auc)。roc解析的结果,发现auc为0.95以上的68个cpg位点。其中,31个cpg位点在(ye-a)组中甲基化水平亢进,37个cpg位点在(ye-b)组中甲基化水平亢进(表10和11)。进而,这些68个cpg位点中,发现auc为1(灵敏度和特异度100%)的11个cpg位点。11个中,6个cpg位点在(ye-a)组中甲基化水平亢进,5个cpg位点在(ye-b)组中甲基化水平亢进。表明这些68个cpg位点的甲基化水平可作为表示年轻性子宫体癌的风险或预后的标记、特别是用于判别低恶性度(即非预后不良)组的标记利用。由于恶性度低的年轻性子宫体癌的患者为保守疗法的有力的适用对象,因此,这些cpg位点的甲基化水平作为用于判别对保守疗法具有适合性的子宫体癌患者的标记也是有用的。[表10]甲基化水平:ye-a>ye-b[表11]甲基化水平:ye-b>ye-a染色体编号染色体的位置基因名称auc8132321917(非编码)1.000115346249(非编码)1.0002131972506(非编码)1.00021928480myt1l1.00012483663990r2m31.000865549360cyp7b10.99610118138962ccdc1720.9968114435951csmd30.9965152981133gria10.996165293539(非编码)0.9922119418938(非编码)0.9921482292196(非编码)0.9921259657344(非编码)0.99211107067568(非编码)0.992116049230(非编码)0.99222321788myt1l0.992115295849(非编码)0.9891152797107(非编码)0.9895166491296(非编码)0.9855166988043tenm20.9851018583838cacnb20.9851261961255(非编码)0.9811026461882my03a0.981898376014loc1019270660.98121984549myt1l0.9811087364316grid1-as10.9818139114773(非编码)0.9777116151921(非编码)0.97310135030554kndc10.97212132102188(非编码)0.97021417164tpo0.968872872845msc-as10.9667157933750ptprn20.9661229706215(非编码)0.96610132461281(非编码)0.962865528567cyp7b10.958584126213(非编码)0.958865525631cyp7b10.9551188911467tyr0.95510130844884(非编码)0.952161088479(非编码)0.9517126746802grm80.951〔实施例6使用了dna甲基化标记的子宫体癌的恶性度判定〕对于实施例5中鉴定出的auc为1的11个cpg位点,分别基于约登指数将灵敏度和特异度的和达到最大的(最接近roc曲线的图表上的左上角)甲基化水平设定为暂时的诊断阈值(临界值)。如图3所示,全部11个cpg位点中,根据所设定的诊断阈值,以100%的灵敏度和特异度将(ye-a)组与(ye-b)组相区别。因此,表明通过测定实施例5中鉴定出的cpg位点的甲基化水平,能够进行年轻性子宫体癌的风险或预后的判定或者低恶性度(即非预后不良)组的判别。进而,如实施例4所示,由于年轻性子宫体癌患者的(ye-a)组和(ye-b)组分别包含在全部子宫体癌患者的(e-a)组和(e-b)组中,因此,表明实施例5中鉴定出的dna甲基化标记不仅可作为表示关于年轻性子宫体癌患者癌的风险或预后的标记使用,而且可作为表示关于包含老年性子宫体癌患者的所有子宫体癌患者的癌的风险或预后的标记使用。因此,对实施例5中鉴定出的auc为1的11个cpg位点的dna甲基化水平制作有关高恶性度(e-a)组和低恶性度(e-b)组的判别灵敏度和特异度的roc曲线,算出曲线下面积(auc)。将结果示于表12。11个cpg位点的auc约为0.94~0.99以上,且其一半以上显示特异度100%。因此,表明这些cpg位点作为表示关于包含年轻性子宫体癌患者和老年性子宫体癌患者的所有子宫体癌患者的癌的风险或预后的标记是有用的。[表12]染色体编号染色体的位置auc约登灵敏度特异度101064002590.98280.40520.89661.00008568522900.95940.60190.85961.000014609738230.98060.60950.96550.93756282269800.99350.49000.98281.00001626606240.98810.57950.94831.00006103909190.98900.50440.92981.000081323219170.95040.44890.81031.00001153462490.95910.52810.94830.937521319725060.96550.62060.94830.9375219284800.94180.55800.86210.937512483663990.95690.50590.91380.9375序列表<110>学校法人庆应义塾积水医疗株式会社<120>子宫体癌的预后的判定方法<130>dc0119<150>jp2018-228276<151>2018-12-05<160>68<170>patentinversion3.5<210>1<211>122<212>dna<213>人<400>1gccgcgctcccggcccggctcagccaggtgcccccacgcggcagcgcccggtctgcccgc60cggccccctgcgaacccctcgcctcacgcccgcctgcctgcgcgcacgcacgcgcacgca120cg122<210>2<211>122<212>dna<213>人<400>2gctcgcggcgtgcgcagggtcctcgtgctgctattaacgtatttgcccatttgtaaagca60cgattttaagggatggtgagttaaacaccgctttttcggggagggtgacggggcgtggga120gg122<210>3<211>122<212>dna<213>人<400>3agcagctaggcgctgggatcggggtcggctctcggctcggctcgcgggctgtaaggtctc60cgcggaccccaccgcctcttctgcgcgctaagggtgagcgccaagcaatttcgcgagcaa120ta122<210>4<211>122<212>dna<213>人<400>4aatataagtcctaaaaacaggcgcaccctaatcctacctacttcccacaagaagccttca60cgcagccaaggcccgccccacatagcacacgcgcggattcgttttccgtttggtaactga120ca122<210>5<211>122<212>dna<213>人<400>5agtcgtccaggcggattcctttttcgccaggtaaggctggcccgggtgcatggggcccgg60cgtgccctgggtaaggctggcccaggcgcgtggggtccggggcgcgccgggtaaggctgg120gc122<210>6<211>122<212>dna<213>人<400>6tgactaaagatgcaagtgcctaaaaggttgcgttgggcaggaggcgcttggagggcagcg60cgggttcccagccattccttgggtccaggtcgaggaaggcctcgggagacgagtcccaca120gt122<210>7<211>122<212>dna<213>人<400>7caaaagtaatttttcagaattttcagctttttcttattgtaggcatgggaataagaactt60cgaagctcttacatgttggagccaaaattggaattcccatgcatggggttatgataaata120gt122<210>8<211>122<212>dna<213>人<400>8ccagtgcaaaacaatgtctgggcatcactgctataagcatttcatacctaatccatcttt60cgagatagaaaccttttaatgcttccatccagttgattttctcattttctccaaatatct120tc122<210>9<211>122<212>dna<213>人<400>9attgttttaaaattcagatttttaatagaagtccttttcttactatatacccagaatcaa60cgaagtcaaaaatcaaagtctttgccacggtttagaatcatatataaaatgatagctaca120tg122<210>10<211>122<212>dna<213>人<400>10tctgacacacctttctaaacttcggcaaatcaaatttaccttttattagacatagagaat60cgctaattgtgtgaaacaaatattgcccttcttctggataattcctataaatcatcttct120tt122<210>11<211>122<212>dna<213>人<400>11tttgtggtactaggtaaaaagcatacacatcatggcaagggagaattcgaccttcaactc60cgacttcatcctcctgggaatcttcaatcacagccccacccacaccttcctcttctttct120gg122<210>12<211>122<212>dna<213>人<400>12agctggaggaggaactaactgtaagtgtgtctcgaacttgcgcgggggcttcagcccgcc60cggggctgcggagctggccggtaaaggctctcgggagaggggcgcggtgtctccacggtg120ac122<210>13<211>122<212>dna<213>人<400>13cggacgccacctaccacactatgaataccatcccgtgcacgtcggccgcctcttcttcat60cggtgcccatctcgcacccttccgcgttggcgggcacgcaccaccaccaccaccatcacc120ac122<210>14<211>122<212>dna<213>人<400>14caaccggcagcgtccagctcccgcacctcgctgcacatcgcacctgagccccgccgcgac60cgcatcgcgctcgctgcgacccattcagaccccccagaaacgccaagccgctcccgctct120ag122<210>15<211>122<212>dna<213>人<400>15gaaaaaaaaaaggcccttaaaactctgacctggagcctcccggctcttcctcactgcacc60cgcaagcgcgctaagggagacgggaggcacaagcaagtcccaaacctttctctgggtttt120ac122<210>16<211>122<212>dna<213>人<400>16tgggattccctgcgcagccaacaacagaaagaagaaaaccagctcccacacagagcctcc60cggctgcgcagacctttcccagcacagcggattgccagctccgagacccgggactcctcc120tg122<210>17<211>122<212>dna<213>人<400>17gggaaggggtagagggggcggcgggggtcgctccaaagacttgtatttcgcgtttgcctc60cgggagctgggagtaaggccttggatggcgccgacgcggttgcgaggaagctgaggcctg120gg122<210>18<211>122<212>dna<213>人<400>18attgtagtattgttctcaccctcacttttcccattaattggaatcaccaatatcacatac60cgatgacagatacgagcagaaatgcgttcgccaaatatatcgactatattgttcggagtg120tt122<210>19<211>122<212>dna<213>人<400>19aatacgaggccgagggaggaattctgtcgtctgggaacggctggtttcgcggtcagacgc60cgagggccctcgaagtccctagcaacggctgcggagggagatgtaagtcgttttggacgc120ag122<210>20<211>122<212>dna<213>人<400>20agtacaagcggaggactcgccaggcgctgagccggaatgtggactgtaccacagtgactg60cgaagggaggggaagacgacggcaaggaggcctactacacgagcagtaaggtccacactt120tt122<210>21<211>122<212>dna<213>人<400>21tgcacaacttggataatcaagtaaattataaagcaaatttcagtactcttgcctcagaac60cgctgccatctctgcacctgtaatgtagacagtgaaaacgctggttatttattttgtact120tt122<210>22<211>122<212>dna<213>人<400>22aaggagccggaagagggcagagttaccaaatgggctccttagtcatggcttggggctcca60cgaccctcctggaagcccggagcctgggtgggatagcgaggctgcgcgcggccggcgccc120cg122<210>23<211>122<212>dna<213>人<400>23aaagctatttaacaattaatgcgttcctgggggaggccgggggaagtacccgccccttgt60cgggacgcaaagccaggcgtcaggtccaaaggggctgcagtgcagtccgatttcagcacg120ga122<210>24<211>122<212>dna<213>人<400>24cggagcgcagcggaggggagcgctggggggcggggagcgctcgggcagccaccctgtccc60cgtctggagccccgcgctgcgtctaggagggcgcaacacgcagtccccgcgggggccaga120gc122<210>25<211>122<212>dna<213>人<400>25agagggagggtgtgaccatggcccggagctctccgaaaggctgtgcggattgctcggtgg60cgggatgtggagcgcgtcttctatgatgccaggtgctggccaagcgctcgatgcaggctg120ct122<210>26<211>122<212>dna<213>人<400>26cagccgcccaggcttcggggaaggagggaggggagaataatgcgcccctctttcaataaa60cgccactgccaaccactccaacagacacactttcggtcccccgccagagctccggtgccc120cc122<210>27<211>122<212>dna<213>人<400>27cacgcccgagccacccgaggagtacgtgtacccggactaccgtggcaagggctgcgtgga60cgagagcggcttcgtgtacgcgatcggggagaagttcgcgccgggcccctcggcctgccc120gt122<210>28<211>122<212>dna<213>人<400>28tgtcctgccctgccctgccctgcgcgcgcaccgcactcacacgtacacccggtcctcgca60cgcgcacacacgcacactgttccccgccgctctaccctctagactgcaagggaaacggct120cc122<210>29<211>122<212>dna<213>人<400>29ccgccgggtggggtcgggccactgtaggctggagcggggttggatcaaatgcctttggcg60cgggaactgagtgctggcccgggagaccctccggagagctcgcgggctcggcctcggcct120cg122<210>30<211>122<212>dna<213>人<400>30tgaggtcgatcttcagggccagctcctcccgagtgtagatgtcggggtagtgagtctccg60cgaagaccctttccagctctttgagctgggcactggtgaaagtggtgcggatgcgccgct120gc122<210>31<211>122<212>dna<213>人<400>31tttcttatttccgagaaatctcgcaaacggcgtgaacactacgctgattccagaaatggt60cgggttcccttccttcactcaggatggtcgcctgctgggagctcatttcgaaccgagctg120aa122<210>32<211>122<212>dna<213>人<400>32aacagaagtggctctgaagtgcactggatcttaggagaaagcgagtcaaaaatgtttcaa60cggcctagacaatctgaaagggggaagtcgattcataactgaagttatttcagcccctta120at122<210>33<211>122<212>dna<213>人<400>33tgatcagaatatctgagaatcaaatctttgtgatagatatatgaatggtacccgttacaa60cggatccttgtgggaaatatggggtttaaaatattcaaattgttattatctagaaatgat120gt122<210>34<211>122<212>dna<213>人<400>34aaccaaatcagcatgtaatgcaaattacctcacatgaattagtataagatttaaataggt60cgtctttatgttatgtgttatggagattgttgaaaattcaccctgaaacacttggaagtg120ct122<210>35<211>122<212>dna<213>人<400>35gtgtgagtttcatgtcctcagtgcccatgtctaaaagcaaaagtgaaaattaaatcagag60cggaaaacacctctctattcaacaccagattgttagggctgagctgaaaagctcctaagt120aa122<210>36<211>122<212>dna<213>人<400>36ttggggtgagaccattcgtggtgctggtgggggccgtcccgtgtattgtaggatggttag60cggcatctgtggtctccatcctctaggtgccattcccccctcccagctatggctacccca120ga122<210>37<211>122<212>dna<213>人<400>37gtggggactgtggagaagtggggaatgcaggtcccacacacagcagcagccctgactcag60cgccagccagtaggtgccaagtggtaacacaggcccccagtggccatatctgatttttca120ag122<210>38<211>122<212>dna<213>人<400>38tccataaaattcagagtataggactggtgagttttctcttcgttcttgttaaccatatat60cgagttgttatttgtagctatagtgatataaatatcagaaagagattatattcaaagaat120ga122<210>39<211>122<212>dna<213>人<400>39cagcctcattctctcgtgtttcttgctcattgcacactctgtggcttctattgggggtat60cgtttctgagtctttaccactgttcatccttgaggggtcagttgaagtctctccttgtct120gg122<210>40<211>122<212>dna<213>人<400>40ctcatggaaagagagggcaggatgagagggagaataataactcacatactctctcacaca60cgcaaacacacaaccagagagctgctagagtagtcctggactgaggtcaaaatgtatggg120gt122<210>41<211>122<212>dna<213>人<400>41aaaaaaaaaagggtagtgacaggcagtaacctcactatatgttaaaacatattacaaaca60cgcaacaaattaggccagtatgttaccagtgtaagaaaagcaatggtagatgataagttt120tt122<210>42<211>122<212>dna<213>人<400>42tcaaaggaggaagggaaagagactcgatcttgtaggaggaaggacgagatgtgtgaaaat60cgtttactgattttttattgatagaggccgtttttgcaatgctgactgcccaatcagcaa120gc122<210>43<211>122<212>dna<213>人<400>43tgcgttgtttccctctatgagtccatgtgttctcatcatttagcttctaactgttgcttt60cgtagtgtacctctgcctcatctctcacgaagtttgcaggtgagtttgagccagggctga120gg122<210>44<211>122<212>dna<213>人<400>44ctaatgggtgaaaaaaataacccattaacatactaggtgctgattccaaagcataaagta60cgataccactcagtatgaagttcgagtgattctttaaaaattgaacatttccaaaaatgt120gt122<210>45<211>122<212>dna<213>人<400>45gtaaaatcgccgttttctagcctacaggcatttcccttgtcccgtttcaacaaacttcca60cggcccaatttgttattcaaaaatttatggaaaatgtatgttaaagtgaaaagggtacat120tg122<210>46<211>122<212>dna<213>人<400>46ggacagccccacaacaagccatgatccagcccaaaatgtcaatcatgccagttgagaaat60cgctattatccacagaggaactgaggtaagcaaaatcaccattttttcttgaggatttag120gt122<210>47<211>122<212>dna<213>人<400>47ccaagacagtcctcaattcctctgttcaaatccccagagaattctgacatgtaggaactt60cgtaagaaggtgcacaccagtgcctgccaatgaaggttataggtgacaggagagaggggg120ca122<210>48<211>122<212>dna<213>人<400>48attagaacttcctaaggctgtgccacaagctcatcctcaactttgacaaaataaagtttc60cgaattgactgagacctgactcagacacttttgggatcataatagcattcagccacttct120ca122<210>49<211>122<212>dna<213>人<400>49tctcacatgggtttctgggctaagatgaaaagtttggtgcaaaagccctccaagtagcaa60cgagaggtgttagcatatcaaggtgtcatggtatgacattttcattccatcttaactttt120tt122<210>50<211>122<212>dna<213>人<400>50gtcccagaatccagagctagggttgcttgcatagtgcttaagggtagagtatacaaagaa60cgccaggaacctgatgccaagccctacagggaactttcaggttataattccagcaagccg120at122<210>51<211>122<212>dna<213>人<400>51taaggaccaaaaatcacatgtctgtctttgtttccactaagcctcaggagcatgctgttg60cgtggtaaatatatacgagtatgtttgttcaccaaacattcccacagtatgggaagtgtt120tg122<210>52<211>122<212>dna<213>人<400>52tcagctcattcgtgctgggagaccatctctgagttagggtcacctctgcatggcaagtgt60cgtcgggaaattgtgggaactggctggagaatgccaggcttctacttgtcccagctaaat120ta122<210>53<211>122<212>dna<213>人<400>53taatttttcactacattatacatctaccttttagcccttcagactgaggctatattttgc60cgttttgtgaagataaaaccacagtgatgagagattgctgtagcttttcaactccttgga120aa122<210>54<211>122<212>dna<213>人<400>54accctaggagtgggcatgagggctctgctggaaccatgtgccctaaagacaatgccgaag60cgtgcaactgaaaatgaaaatgaaactgtaacttgtgaccatctatctgtgtcttctttc120gc122<210>55<211>122<212>dna<213>人<400>55gacaaagtagcagggtgggcgccgggggctgggagtggggcacggggagctcgtgttgaa60cggggaccgagtttccgtttgggaagatggagagtcgcagacatgctgcacagtgtggat120gt122<210>56<211>122<212>dna<213>人<400>56tcatagctttaaagacactgttgacatcctatggtgttggctacgtggaggagtcgggtc60cgagactgtgaggatgagggggtccaagtgccatgtcctgggagcagctacctgggggct120ca122<210>57<211>122<212>dna<213>人<400>57cccggcgcaaacacaacaaagcccgcagacattctgtccccacgaagaacggacgccact60cgacttcctagcatcttgacgggctatccaagcgcggagtcagtttataaggtgggtaac120ca122<210>58<211>122<212>dna<213>人<400>58atccattattggctctgtttacccaagggaaaattaagtgcagggccttagaacagtaag60cgctttaatacgcggatgcatatgctgatctctgacagatgttggtctttgggaacaaca120ga122<210>59<211>122<212>dna<213>人<400>59gacacagaatgtcctgacctcagtggggtctcaccacgaccctccactgtaggggggtcc60cgctgccaccctccacgctagaggggtctcaccacgaccctccaccctagacaggtcccg120cc122<210>60<211>122<212>dna<213>人<400>60agaaagcacaatgtgaagaaaaagaggcgagaacgacccccgaaccaaccaaagcccgcg60cgccgctgcatccggcgcccacgcccacgtcccactgccgtcgccaccgccgccgagatc120at122<210>61<211>122<212>dna<213>人<400>61tcttgtcgcgtgctgacgtcacatacgtgcttatgcataggcgagggccacatgcatcct60cgtttttgctttctaaagcagcgcatcaggccacacctctgagcttcctcttgcagtttt120gg122<210>62<211>122<212>dna<213>人<400>62atatatagttgtaaatgtgatctcaaatattattgagctgcagaatggatacagttctgc60cgtgtcccaacttgtggtttttaacagctggggttcaaaaacttgttttagattctgcat120ca122<210>63<211>122<212>dna<213>人<400>63cagtcaaaaggaccggatgccgtggagcagggggcgatgcccgttggggaggctctggcc60cgtttggggagcccactgtgggggatcttgggcatggcaggctgcatgtcggagccttgc120cc122<210>64<211>122<212>dna<213>人<400>64tgaaagaaaaaaatacacactattttctagatcacaaacagccccatcattttaaattct60cgtaatgaacaacactggcctctgctggtaaccaaggtcgtgatgaaccatccaggctgc120tg122<210>65<211>122<212>dna<213>人<400>65atgggattcaactgtggaaactgcaagtttggcttttggggaccaaactgcacagagaga60cgactcttggtgagaagaaacatcttcgatttgagtgccccagagaaggacaaatttttt120gc122<210>66<211>122<212>dna<213>人<400>66gcggcagaggccaaagtctataaatttctgactctgcgccctactcattgtccgagtttc60cgcgtttttcatgaacgctctcggccgccgggaattctctttgatgggatttcaggtttc120ag122<210>67<211>122<212>dna<213>人<400>67tcctgggggcttctttccacgaagcctcacgtcgccggctgctctttcaggggcgcccca60cgtctgcttgaccccgtagcccatcacacgcaccagcgttctttcatttactcaaccaag120gg122<210>68<211>122<212>dna<213>人<400>68tggatgcatagctgatttgaggtatctgcaaaacaaatgatgggtcatttcaacccatga60cgaatcttgaagaatgatggattgtcatatgagctaaacagccaaggctataccagaaac120ct122当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1