在螯合剂存在下具有可增强稳定性的突变的α-淀粉酶的制作方法
交叉引用本申请要求于2018年10月12日提交的美国临时申请序列号62/745070的权益,所述临时申请通过引用以其全文特此并入。本发明披露了在螯合剂存在下具有增强酶稳定性的突变的变体α-淀粉酶、设计此类变体的方法和由此产生的变体的使用方法。所述变体α-淀粉酶对在包括大量螯合剂的清洁和脱浆组合物中使用是特别有用的。
背景技术:
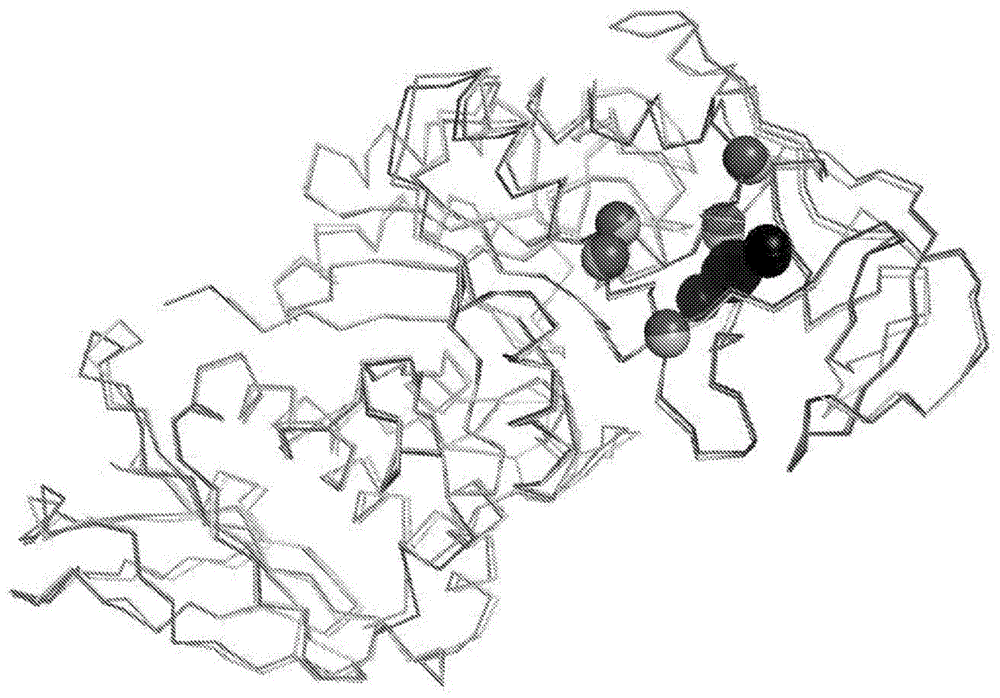
:淀粉由直链淀粉(15%-30%w/w)和支链淀粉(70%-85%w/w)的混合物组成。直链淀粉由具有分子量(mw)为从约60,000至约800,000的α-1,4-连接的葡萄糖单元的直链组成。支链淀粉是每24-30个葡萄糖单元含有α-1,6分支点的支链聚合物;其mw可高达1亿。α-淀粉酶通过随机裂解内部的α-1,4-糖苷键来水解淀粉、糖原和相关多糖。α-淀粉酶,特别是来自芽孢杆菌属(bacilli)的α-淀粉酶已经用于各种不同的目的,包括淀粉液化和糖化、纺织品脱浆、纸张和纸浆工业中的淀粉修饰、酿造、烘焙、用于食品工业的糖浆的生产、用于发酵过程的原料的生产、以及用于动物饲料中以增加可消化性。这些酶还可用于在餐具洗涤和衣物洗涤期间除去淀粉污垢和污渍。餐具洗涤和衣物洗涤剂组合物、其他硬质清洁组合物、和纺织加工液,尤其是但不限于,通常含有大量螯合剂,主要是为了减少由于当地水中不可预测水平的阳离子与清洁或脱浆组合物中存在的成分相互作用而导致的硬水沉积。不幸的是,许多最受欢迎的可商购的α-淀粉酶依赖于钙结合的稳定性和活性。因此,需要开发新的α-淀粉酶,以及工程化在螯合剂存在下具有高性能和高稳定性的α-淀粉酶的方法。技术实现要素:本发明的组合物和方法涉及在螯合剂存在下具有增强酶稳定性的突变的变体α-淀粉酶、设计此类变体的方法和由此产生的变体的使用方法。本发明的组合物和方法的方面和实施例总结在以下分别编号的段落中:1.在一方面,提供了一种亲本家族13α-淀粉酶的重组变体,其中所述变体(i)在不是钙或钠离子配体的氨基酸残基的侧链中具有突变,(ii)其中所述突变能够改变围绕ca2+-na+-ca2+位点的主链环的构象自由度、氢键结合相互作用、pi叠加相互作用或范德华相互作用,和(iii)其中与缺乏所述突变的亲本家族13α-淀粉酶相比,所述变体在预定量的螯合剂的存在下具有增加的稳定性。2.在段落1所述的变体的一些实施例中,所述突变位于如下氨基酸位置,所述氨基酸位置选自由以下组成的组:(i)e190、v206、h210、s244和f245,使用seqidno:1进行编号,或(ii)e187、i203、h207、s241、和f242,使用seqidno:2进行编号。3.在段落2所述的变体的一些实施例中,所述突变是选自由以下组成的组的取代:(i)e190p、v206t、v206y、h210q、s244c、s244d、s244h、s244n、s244e、s244f、s244v、s244l、s244q和f245e,使用seqidno:1进行编号,或(ii)e187p、i203t、i203y、h207q、s241c、s241d、s241h、s241n、s241e、s241f、s241v、s241l、s241q和f242e,使用seqidno:2进行编号。4.在一些实施例中,如段落1-3中任一项所述的变体进一步包含:(i)在对应于seqidno:1的氨基酸序列中的位置181、182、183和/或184的一个或多个残基处的缺失或取代;(ii)对应于seqidno:1的氨基酸序列的残基181和182或183和184的缺失;(iii)对应于seqidno:2的氨基酸序列的残基178和179或180和181的缺失;(iv)先前在家族13α-淀粉酶中描述的任何单个、多个或组合突变;和/或(v)n-末端和/或c-末端截短。5.在如段落1-4中任一项所述的变体的一些实施例中,所述变体与seqidno:1和/或seqidno:2的氨基酸序列具有至少60%、70%、80%或90%的氨基酸序列同一性。6.在另一方面,提供了一种洗涤剂组合物,所述洗涤剂组合物包含如段落1-5中任一项所述的变体淀粉酶,所述洗涤剂组合物进一步包含螯合剂。7.在另一方面,提供了一种用于液化淀粉的组合物,所述组合物包含如段落1-5中任一项所述的变体,所述组合物进一步包含螯合剂。8.在另一方面,提供了一种用于纺织品脱浆的组合物,所述组合物包含如段落1-5中任一项所述的变体,所述组合物进一步包含螯合剂。9.在另一方面,提供了一种用于酿造或烘焙的组合物,所述组合物包含如段落1-5中任一项所述的变体,所述组合物进一步包含螯合剂。10.在另一方面,提供了一种在螯合剂存在下增强家族13α-淀粉酶的稳定性的方法,所述方法包括(i)在不是钙或钠离子配体的氨基酸残基的侧链中向亲本家族13α-淀粉酶引入突变,(ii)其中所述突变能够改变围绕ca2+-na+-ca2+位点的主链环的构象自由度、氢键结合相互作用、pi叠加相互作用或范德华相互作用,和(iii)其中与缺乏所述突变的亲本家族13α-淀粉酶相比,所述变体在预定量的螯合剂的存在下具有增加的稳定性。11.在如段落10所述的方法的一些实施例中,所述突变位于如下氨基酸位置,所述氨基酸位置选自由以下组成的组:(i)e190、v206、h210、s244和f245,使用seqidno:1进行编号,或(ii)e187、i203、h207、s241、和f242,使用seqidno:2进行编号。12.在如段落11所述的方法的一些实施例中,所述突变是选自由以下组成的组的取代:(i)e190p、v206t、v206y、h210q、s244c、s244d、s244h、s244n、s244e、s244f、s244v、s244l、s244q和f245e,使用seqidno:1进行编号,或(ii)e187p、i203t、i203y、h207q、s241c、s241d、s241h、s241n、s241e、s241f、s241v、s241l、s241q和f242e,使用seqidno:2进行编号。13.在如段落10-12中任一项所述的方法的一些实施例中,所述变体进一步包含:(i)在对应于seqidno:1的氨基酸序列中的位置181、182、183和/或184的一个或多个残基处的缺失或取代;(ii)对应于seqidno:1的氨基酸序列的残基181和182或183和184的缺失;(iii)对应于seqidno:2的氨基酸序列的残基178和179或180和181的缺失;(iv)先前在家族13α-淀粉酶中描述的任何单个、多个或组合突变;和/或(v)n-末端和/或c-末端截短。14.在如段落10-13中任一项所述的方法的一些实施例中,所述变体与seqidno:1和/或seqidno:2的氨基酸序列具有至少60%、70%、80%或90%的氨基酸序列同一性。15.在另一方面,提供了一种用于将淀粉转化为寡糖的方法,所述方法包括使淀粉与有效量的如段落1-5中任一项所述的变体α-淀粉酶接触。16.在另一方面,提供了一种用于从表面除去淀粉污渍或污垢的方法,所述方法包括使所述表面与有效量的如段落1-5中任一项所述的变体α-淀粉酶或如段落7所述的组合物接触,并且允许所述多肽水解存在于所述淀粉污渍中的淀粉组分以产生溶解于水性组合物中的较小的衍生自淀粉的分子,从而从所述表面除去所述淀粉污渍。这些组合物和方法的这些和其他方面以及实施例将从本说明书和附图中显而易见。附图说明图1示出了两种α-淀粉酶模型,在该模型中用球体突出了氨基酸残基的α-碳位置,当这些位置突变时,在螯合剂存在下,会提供益处。所述bspamy24模型示出为浅灰色。所述cspamy2模型示出为深灰色。两个分子都有rg缺失。钙和钠离子示出为黑色。图2突出了环绕金属离子位点并且是大多数金属配体的来源的环的位置。所述环以较厚的管图示,而结构的其余部分则以较薄的线图示。bspamy24分子中的氨基酸示出为浅灰色。cspamy2分子中的氨基酸示出为深灰色。两个分子都有rg缺失。钙和钠离子示出为球体。具体实施方式描述了涉及在螯合剂存在下具有增强酶稳定性的突变的变体α-淀粉酶的组合物和方法、设计此类变体的方法和所述变体的使用方法。此类变体对在衣物洗涤、餐具洗涤、纺织品加工(例如脱浆)和其他应用中,在高水平螯合剂存在下或在特殊软水环境中用于清洁淀粉污渍特别有用。下文详细描述了所述组合物和方法的这些和其他方面。在描述本发明的组合物和方法的各个方面和实施例之前,描述了以下定义和缩写。1.定义和缩写根据这一详细说明,以下缩写和定义适用。应当注意单数形式“一个/一种(a/an)”和“所述(the)”包括复数个指示物,除非上下文中另有清楚地指示。因此,例如提及“酶”包括多个此类酶,并且提及“剂量”包括提及一个或多个剂量以及本领域普通技术人员已知的其等同物,等等。将本文件组织成若干部分以便于阅读;然而,读者将领会的是,在一个部分中进行的陈述可能适用于其他部分。以这种方式,用于本公开的不同部分的标题不应被解释为限制。除非另有定义,否则本文使用的所有技术和科学术语具有与本领域普通技术人员通常所理解的相同的含义。为了清楚起见,以下术语定义如下。1.1.缩写和首字母缩略词除非另外说明,以下缩写/首字母缩略词具有以下含义:dna脱氧核糖核酸ec酶学委员会ga葡糖淀粉酶gh总硬度hdl高密度液体洗涤剂hdd重垢粉末洗涤剂hsg高泡沫颗粒状洗涤剂hfcs高果糖玉米糖浆irs不可溶残留淀粉kda千道尔顿mw分子量mwu经修饰的wohlgemuth单位;1.6x10-5mg/mwu=活性单位ncbi国家生物技术信息中心pi性能指数ppm百万分率,例如μg蛋白质/克干固体rcf相对离心/向心力(即x重力)sp.物种w/v重量/体积w/w重量/重量v/v体积/体积wt%重量百分比℃摄氏度h2o水dh2o或di去离子水dih2o去离子水,milli-q过滤g或gm克μg微克mg毫克kg千克μl和μl微升ml和ml毫升mm毫米μm微米m摩尔mm毫摩尔μm微摩尔u单位sec秒min(s)分钟hr小时etoh乙醇n正常mwco分子量截止值cazy碳水化合物活性酶数据库wt野生型1.2.定义术语“淀粉酶”或“淀粉分解酶”是指这样的酶:除其他事项之外,其能够催化淀粉的降解。α-淀粉酶是裂解淀粉中α-d-(1→4)o-糖苷键的水解酶。通常,α-淀粉酶(ec3.2.1.1;α-d-(1→4)-葡聚糖葡聚糖水解酶)被定义为内切作用的酶,其以随机方式裂解淀粉分子内的α-d-(1→4)o-糖苷键,产生含有三个或更多个(1-4)-α-连接的d-葡萄糖单元的多糖。相反地,外切作用的淀粉分解酶,例如β-淀粉酶(ec3.2.1.2;α-d-(1→4)-葡聚糖麦芽糖水解酶)和一些产物特异性淀粉酶(如生麦芽糖α-淀粉酶(ec3.2.1.133))从底物的非还原端裂解多糖分子。β-淀粉酶、α-葡糖苷酶(ec3.2.1.20;α-d-葡萄糖苷葡糖水解酶)、葡糖淀粉酶(ec3.2.1.3;α-d-(1→4)-葡聚糖葡糖水解酶)和产物特异性淀粉酶(如麦芽四糖苷酶(ec3.2.1.60)和麦芽六糖苷酶(ec3.2.1.98))可以生产特定长度的麦芽寡糖或富含糖浆的特定麦芽寡糖。术语“淀粉”是指由植物的复合多糖碳水化物组成的任何材料,所述复合多糖碳水化物由具有式(c6h10o5)x(其中“x”可以是任何数目)的直链淀粉和支链淀粉构成。关于多肽,术语“野生型”、“亲本”或“参比”是指在一个或多个氨基酸位置处不包含人为取代、插入或缺失的天然存在的多肽。类似地,关于多核苷酸,术语“野生型”、“亲本”或“参考”是指不包含人为核苷变化的天然存在的多核苷酸。然而,注意编码野生型、亲本、或参考多肽的多核苷酸不限于天然存在的多核苷酸,并且涵盖编码野生型、亲本、或参考多肽的任何多核苷酸。关于多肽,术语“变体”是指与指定的野生型、亲本或参比多肽不同的多肽,因为它包括一种或多种天然存在的或人为的氨基酸取代、插入或缺失。类似地,关于多核苷酸,术语“变体”是指在核苷酸序列中与指定的野生型、亲本或参考多核苷酸不同的多核苷酸。野生型、亲本或参考多肽或多核苷酸的特性将从上下文中显而易见。在本发明α-淀粉酶的情况下,“活性”是指α-淀粉酶活性,其可以如本文所述测量。术语“性能益处”是指分子的期望特性上的改善。示例性的性能益处包括但不限于:淀粉底物水解增加,谷物、谷类或其他淀粉底物的液化性能增强,清洁性能增强,热稳定性增强,洗涤剂稳定性增强,储存稳定性增强,溶解度增加,ph曲线改变,钙依赖性降低,在螯合剂存在下稳定性增强,比活性增加,底物特异性经修饰,底物结合经修饰,ph依赖性活性经修饰,ph依赖性稳定性经修饰,氧化稳定性增加,和表达增加。在一些情况下,性能益处是在相对较低的温度下实现的。在一些情况下,性能益处是在相对较高的温度下实现的。术语“螯合剂(chelant)”和“螯合剂(chelatingagent)”可互换使用,指能够协调金属离子的化合物,从而防止或减少金属离子与溶液或悬浮液中的其他组分相互作用的可能性。本文描述了示例性螯合剂。术语“金属配体”指与金属结合的、氨基酸侧链或主链的原子,其可在例如组氨酸的咪唑、半胱氨酸的硫醇、天冬氨酸或谷氨酸的羧酸盐等中发现。术语“组合变体”是包括两个或更多个突变,例如,2、3、4、5、6、7、8、9、10或更多个取代、缺失、和/或插入的变体。术语“重组”当用于提及主题细胞、核酸、蛋白质或载体时,表明受试者已经从其天然状态被修饰。因此,例如,重组细胞表达在天然(非重组)形式的细胞中未发现的基因,或以不同于自然界发现的水平或在不同于自然界发现的条件下表达天然基因。重组核酸与天然序列不同在于一个或多个核苷酸,和/或有效地连接到异源序列,例如表达载体中的异源启动子。重组蛋白质与天然序列的不同可在于一个或多个氨基酸,和/或与异源序列融合。包含编码淀粉酶的核酸的载体是重组载体。术语“回收的”、“分离的”和“单独的”是指从如天然存在的与其天然相关的至少一种其他材料或组分中除去的化合物、蛋白质(多肽)、细胞、核酸、氨基酸、或者其他指定材料或组分。其“分离的”多肽包括但不限于含有在异源宿主细胞中表达的分泌多肽的培养液。术语“纯化的”是指处于相对纯的状态的材料(例如,分离的多肽或多核苷酸),例如,至少约90%纯、至少约95%纯、至少约98%纯、或甚至至少约99%纯。术语“富集的”是指处于约50%纯、至少约60%纯、至少约70%纯、或甚至至少约70%纯的材料(例如,分离的多肽或多核苷酸)。关于酶的术语“热稳定的”和“热稳定性”是指酶在暴露于升高的温度后保持活性的能力。酶(例如淀粉酶)的热稳定性通过以分钟、小时或天给出的其半衰期(t1/2)来测量,在此期间酶活性的一半在限定条件下丧失。半衰期可以通过测量暴露于(即,受挑战于)升高的温度后的残余α-淀粉酶活性来计算。关于酶的“ph范围”是指在其下酶显示催化活性的ph值的范围。关于酶的术语“ph稳定”和“ph稳定性”涉及在一个宽范围内的ph值下,酶保持预定时间段(例如,15min.、30min.、1小时)的活性的能力。术语“氨基酸序列”与术语“多肽”“蛋白质”和“肽”同义,并且可互换地使用。当此类氨基酸序列显示出活性时,它们可以被称为“酶”。使用针对氨基酸残基的常规单字母或三字母密码,采用标准氨基端-至-羧基端取向(即n→c)表示氨基酸序列。术语“核酸”涵盖能够编码多肽的dna、rna、异源双链体、以及合成分子。核酸可以是单链的或双链的,并且可以含有化学修饰。术语“核酸”和“多核苷酸”可互换地使用。由于遗传密码是简并的,可以使用多于一个密码子来编码具体的氨基酸,并且本发明的组合物和方法涵盖编码具体氨基酸序列的核苷酸序列。除非另有说明,核酸序列以5′-至-3′取向呈现。“杂交”是指如在印迹杂交技术和pcr技术期间发生的,一条核酸链与互补链形成双链体(即碱基对)的过程。严格杂交条件通过在以下条件下杂交来例证:65℃和0.1xssc(其中1xssc=0.15mnacl,0.015m柠檬酸三钠,ph7.0)。杂交的双链核酸的特征在于熔融温度(tm),其中一半杂交的核酸与互补链不配对。“合成的”分子通过体外化学或酶促合成而不是通过生物体产生。“宿主菌株”或“宿主细胞”是已经引入了表达载体、噬菌体、病毒或其他dna构建体,包括编码目的多肽(例如,淀粉酶)的多核苷酸的生物。示例性宿主菌株是能够表达目的多肽和/或发酵糖的微生物细胞(例如,细菌、丝状真菌和酵母)。术语“宿主细胞”包括从细胞产生的原生质体。关于多核苷酸或蛋白质的术语“异源”是指不是天然存在于宿主细胞中的多核苷酸或蛋白质。关于多核苷酸或蛋白质的术语“内源”是指天然存在于宿主细胞中的多核苷酸或蛋白质。术语“表达”是指基于核酸序列产生多肽的过程。所述过程包括转录和翻译两者。术语“比活性”是指在特定条件下每单位时间通过酶或酶制剂可转化为产物的底物的摩尔数。比活性通常表示为单元(u)/mg蛋白质。如本文所使用的,“水硬度”是水中存在的矿物质(例如钙和镁)的量度。美国地质调查局使用以下测量范围将水分为硬水和软水(表1):表1.美国地质调查局对水进行分类的测量范围。说明书硬度(mg/l)硬度(mmol/l)软0-600-0.60中等硬61-1200.61-1.20硬121-1801.21-1.80非常硬>181>1.81“样本”是一块材料,例如在其上涂有污渍的织物。所述材料可以是例如由棉、聚酯或天然和合成纤维的混合物制成的织物。样本还可以是纸张,例如滤纸或硝酸纤维素,或一块硬质材料,例如陶瓷、金属或玻璃。对于α-淀粉酶,污渍是基于淀粉的,但可包括血液、奶、墨水、草、茶、红酒、菠菜、肉汁、巧克力、蛋、奶酪、黏土、颜料、油、或这些化合物的混合物。“更小的样本”或“微样本”是已经使用单孔打孔装置或者是已经使用定制的多孔打孔装置切割的样本的一部分,其中多孔打孔机的图案与标准多孔微量滴定板匹配,或者所述部分已经从样本中另外除去。样本可以是纺织品、纸张、金属或其他适合的材料。更小的样本可以在将其置于24孔、48孔或96孔微量滴定板的孔中之前或之后具有附着的污渍。更小的样本也可以通过在一小块材料上涂上污渍来制作。例如,更小的样本可以是直径为5/8"或0.25"或5.5mm的污染的织物片。定制的打孔器以这样一种方式设计,使得其能够同时向96孔板的所有孔中递送96个样本。通过简单地多次装载相同的96孔板,所述装置允许每孔递送多于一个样本。可以想到多孔打孔装置同时将多个样本递送到任何规格的板,包括但不限于24孔、48孔、和96孔板。在另一种可想到的方法中,污染的测试平台可以是涂覆污垢底物的由金属、塑料、玻璃、陶瓷或其他适合材料制成的珠子或瓷砖。然后将一个或多个涂覆的珠子或瓷砖置于96孔、48孔或24孔板或更大规格板的孔中,所述孔含有适合的缓冲液和酶。在其他设想的方法中,通过将酶溶液点样到织物上,通过润湿附接到保持装置上的样本、或将样本浸入含有酶的更大溶液中,使污染的织物暴露于酶。“序列同一性百分比”是指当使用具有默认参数的clustalw算法比对时,具体序列具有与指定参考序列中的氨基酸残基相同的至少一定百分比的氨基酸残基。参见thompson等人,(1994)nucleicacidsres.[核酸研究]22:4673-4680。clustalw算法的默认参数是:与参考序列相比,缺失被视为不同一的残基。术语“约”是指参考值的±15%。2.本发明的组合物和方法的方面和实施例以下段落详细描述了本发明的组合物和方法的各个方面和实施例。2.1.对螯合剂耐受性提高的α-淀粉酶变体在两个模型cazy家族13α-淀粉酶中进行筛选,以确定在5mm羟乙二磷酸(hedp)螯合剂存在下具有增强稳定性的变体。在两种蛋白质的特定结构区域中发现了具有螯合物稳定性增强的氨基酸取代,所述区域与钙结合位点密切相关。在不限于理论的情况下,假设由残基185-210(对应于bspamy24α-淀粉酶的氨基酸序列(seqidno:1)和残基182-207(对应于cspamy2α-淀粉酶的氨基酸序列(seqidno:2)))形成的环,形成ca2+-na+-ca2+结合位点的送料架(图2)。这种185-210环是大多数金属配体的来源,其包围着金属离子结合位点,并且可以在螯合剂存在下调节稳定性。因此,在螯合剂存在下,金属离子的去除使得185-210环易于变形,从而降低了整个蛋白质解折叠的激活屏障。稳定残基185-210折叠构象的分子内相互作用,和该环相对于空间上相邻的二级结构区域(即残基104-184、211-230、236-257和272-284)的定位可以在螯合剂离子丢失时稳定折叠酶。实际上,发现改变185-210环构象自由度或185-210环在相邻蛋白质结构区域内的相互作用的若干取代提供了对普通洗涤剂螯合剂的稳定性的大幅度增强。发现这些相互作用可促进氨基酸序列同一性小于70%的两种不同α-淀粉酶对螯合剂的稳定性,表明所述策略广泛适用于cazy家族13α-淀粉酶。具体地,本发明的组合物和方法包含导致氨基酸残基侧链改变的氨基酸突变,所述氨基酸残基不是钙或钠离子的配体,而是在钙位点附近(即,在ca2+-na+-ca2+金属位点的原子的内具有至少一个原子),并且它们能够改变构象自由度或氢键、pi叠加、或范德华相互作用(稳定围绕ca2+-na+-ca2+位点的上述结构环的折叠构象)。用于举例说明本发明的组合物和方法的一个模型α-淀粉酶是来自芽孢杆菌属物种(bacillussp.)的α-淀粉酶,在本文中称为“bspamy24α-淀粉酶”,或简称为“bspamy24”。bspamy24α-淀粉酶的氨基酸序列如以下seqidno:1所示:用于举例说明本发明的组合物和方法的第二个模型α-淀粉酶是来自噬细胞菌属物种(cytophagasp.)的α-淀粉酶,在本文中称为“cspamy2α-淀粉酶”,或简称为“cspamy2”。cspamy2α-淀粉酶的氨基酸序列如以下seqidno:2所示:在一些实施例中,所述变体α-淀粉酶与seqidno:1和/或seqidno:2(排除野生型bspamy24和cspamy2酶,及其已知变体)具有至少60%、至少70%、至少80%、至少85%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或甚至至少99%氨基酸序列同一性。已知许多细菌(和其他)α-淀粉酶共享相同的折叠,并且通常受益于相同的突变。在本案中,可以容易地使用具有默认参数的clustalw,使用bspamy24和cspamy2,通过氨基酸序列比对鉴定其他α-淀粉酶中的相应氨基酸位置。其中前述突变可能产生性能益处的α-淀粉酶、包括与熟知的芽孢杆菌属淀粉酶(例如来自地衣芽孢杆菌(b.lichenifomis)、嗜热脂肪芽孢杆菌(b.stearothermophilus)、解淀粉芽孢杆菌(b.amyloliquifaciens)、芽孢杆菌属物种sp722等)、碳水化合物-活性酶数据库(cazy)家族13α-淀粉酶、或迄今为止由描述性术语“termamyl-样”引用的任何淀粉酶中的任一项具有类似折叠和/或具有60%或更大氨基酸序列同一性的那些α-淀粉酶。读者将理解,当α-淀粉酶天然具有上文列出的突变时(即,其中野生型α-淀粉酶已经包含被鉴定为突变的残基),那么特定突变不适用于所述α-淀粉酶。然而,其他描述的突变可以与在所述位置处的天然存在的残基组合起作用。2.2另外的突变在一些实施例中,除上述一个或多个突变(例如,在第2.1部分中),本发明的α-淀粉酶进一步包括提供进一步的性能或稳定性益处的一个或多个突变。示例性的性能益处包括但不限于:淀粉底物水解增加,谷物、谷类或其他淀粉底物的液化性能增强,清洁性能增强,热稳定性增强,储存稳定性增强,溶解度增加,ph曲线改变,钙依赖性降低,比活性增加,底物特异性经修饰,底物结合经修饰,ph依赖性活性经修饰,ph依赖性稳定性经修饰,氧化稳定性增加、和表达增加。在一些情况下,性能益处是在相对较低的温度下实现的。在一些情况下,性能益处是在相对较高的温度下实现的。在一些实施例中,基于suzuki等人,(1989)j.biol.chem.[生物化学杂志],264:18933-938的工作,本发明的α-淀粉酶变体在钙结合环中另外具有至少一个突变。示例性突变包括在对应于seqidno:1和/或2中的位置181、182、183和/或184的一个或多个残基处的缺失或取代。在特定实施例中,所述突变对应于181和182或183和184(使用seqidno:1和/或2进行编号)的缺失。其他α-淀粉酶中的同源残基可以通过结构比对、或通过一级结构比对来确定。在一些实施例中,本发明的α-淀粉酶变体另外具有已知在其他微生物α-淀粉酶中产生性能、稳定性或溶解性益处的至少一个突变,所述微生物α-淀粉酶包括但不限于与seqidno:1和/或2、碳水化合物-活性酶数据库(cazy)家族13淀粉酶、或迄今为止由描述性术语“termamyl-样”引用的任何淀粉酶具有类似折叠和/或具有60%或更大氨基酸序列同一性的那些α-淀粉酶。可以使用具有默认参数的clustalw确定氨基酸序列同一性。本发明的α-淀粉酶可以包括任何数量的保守氨基酸取代。示例性保守氨基酸取代列于表2中。表2.保守氨基酸取代应当理解的是,一些前述保守突变可以通过遗传操作产生,而其他通过用遗传或其他方式将合成的氨基酸引入多肽中产生。本发明的淀粉酶还可以衍生自通过在氨基酸序列中取代、缺失或添加一个或若干个氨基酸(例如小于10、小于9、小于8、小于7、小于6、小于5、小于4、小于3或甚至小于2个取代、缺失或添加)的任何上述淀粉酶变体。此类变体应具有与其衍生的淀粉酶相同的活性。特定的缺失包括一个或几个氨基酸残基,例如1、2、3、4或5个氨基酸残基的n-末端和/或c-末端截短。本发明的淀粉酶可以是“前体”、“未成熟”或“全长”的,在这种情况下,它们包含信号序列;或“成熟”的,在这种情况下,它们缺乏信号序列。成熟形式的多肽通常是最有用的。除非另有说明,本文使用的氨基酸残基编号是指相应淀粉酶多肽的成熟形式。只要所得的多肽保留淀粉酶活性,本发明的淀粉酶多肽也可被截短以除去n或c-末端。本发明的淀粉酶可以是“嵌合”、“杂合”或“结构域交换(domainswap)”多肽,因为其包括第一淀粉酶多肽的至少一部分和第二淀粉酶多肽的至少一部分。本发明的α-淀粉酶可进一步包括异源信号序列,即允许跟踪或纯化等的表位。示例性异源信号序列来自地衣芽孢杆菌(b.licheniformis)淀粉酶(lat)、枯草芽孢杆菌(b.subtilis)(amye或apre)、和链霉菌属(streptomyces)cela。2.3.编码变体淀粉酶多肽的核苷酸在另一方面,提供了编码变体淀粉酶多肽的核酸。所述核酸可以编码具体的淀粉酶多肽,或与具体淀粉酶具有指定程度的氨基酸序列同一性的淀粉酶。在一些实施例中,所述核酸编码淀粉酶,所述淀粉酶与seqidno:1和/或2具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或甚至至少99%的氨基酸序列同一性。应当理解,由于遗传密码的简并性,多个核酸可以编码相同的多肽。3.示例性螯合剂有关清洁化合物的配制和使用的一个主要问题是水的硬度,主要是由于钙、镁、铁和锰金属离子的存在。此类金属离子干扰表面活性剂的清洁能力,并可导致与表面活性剂发生大量沉淀。螯合剂(chelatingagents或chelants)与金属离子结合以防止与表面活性剂发生沉淀。不幸的是,金属离子经常是酶活性所必需的,这使得洗涤剂组合物的配制成为不可避免的妥协。传统上,工业清洁化合物中最常用类型的螯合剂一直是磷酸盐。在美国和欧洲,磷酸盐被禁止使用,因为即使在污水处理后,它们也会原封不动地重新进入环境,并导致水道缺氧。尽管如此,许多国家仍然使用磷酸盐,并且本发明的组合物和方法与基于磷酸盐的螯合剂完全相容。与本发明的组合物和方法相容的更环保的螯合剂,包括,但不限于,乙二胺四乙酸(edta)、二亚乙基三胺五亚甲基膦酸(dtpmp)、羟基乙烷二膦酸(hedp)、乙二胺n,n'-二琥珀酸(edds)、甲基甘氨酸二乙酸(mgda)、谷氨酸n,n-二乙酸(n,n-二羧基甲基谷氨酸四钠盐(glda)、二亚乙基三胺五乙酸(dtpa)、丙二胺四乙酸(pdta)、2-羟基吡啶-n-氧化物(hpno)、次氮基三乙酸(nta)、4,5-二羟基间苯二磺酸、n-羟基乙基乙二胺三乙酸(hedta)、三亚乙基四胺六乙酸(ttha)、n-羟基乙基亚氨基二乙酸(heida)、二羟基乙基甘氨酸(dheg)、乙二胺四丙酸(edtp)、柠檬酸盐和葡糖酸盐(及其任何盐)及上述化合物的衍生物。4.变体α-淀粉酶的生产本发明的变体α-淀粉酶可以使用本领域熟知的方法,例如通过分泌或细胞内表达,在宿主细胞中产生。发酵、分离和浓缩技术是本领域熟知的,并且可使用常规方法来制备浓缩的、含变体α-淀粉酶多肽的溶液。对于生产规模的回收,可以如上一般情况下所述通过用聚合物絮凝除去细胞来富集或部分纯化变体α-淀粉酶多肽。可替代地,可以通过微滤富集或纯化酶,然后使用可用的膜和设备通过超滤进行浓缩。然而,对于一些应用,酶不需要富集或纯化,并且可以裂解和使用全培养液培养物而无需进一步处理。然后可以将酶加工成例如颗粒。5.碳水化合物加工组合物和涉及变体α-淀粉酶的用途本发明的变体α-淀粉酶可用于本领域熟知的各种碳水化合物加工应用。此类应用可以涉及使用螯合剂,包括但不限于所列的那些,特别是在当地可用水供应特别困难的情况下。示例性应用包括燃料乙醇生产、糖浆生产以及其他有价值的生物化学品的生产。5.1.淀粉底物的制备用于制备用于本文公开的方法中的淀粉底物的方法是已知的。可以从例如块茎、根、茎、豆类、谷物或全谷类获得有用的淀粉底物。更具体地,可以从玉米、穗轴、小麦、大麦、黑麦、黑小麦、蜀黍、西米、粟、木薯、树薯(tapioca)、高粱、稻、碗豆、菜豆、香蕉、或马铃薯中获得颗粒状淀粉。具体考虑的淀粉底物是玉米淀粉和小麦淀粉。来自谷粒的淀粉可以是磨碎的或完整的,并且包括玉米固体,例如籽粒、麸皮和/或穗轴。淀粉也可以是高度精制的生淀粉或来自淀粉精制过程的原料。5.2.淀粉的糊化和液化糊化通常在淀粉底物与α-淀粉酶接触的同时进行或糊化之后淀粉底物与α-淀粉酶接触,尽管可以任选地添加另外的液化诱导酶。在一些实施例中,将如上文所述制备的淀粉底物用水制成浆料。液化也可以在液化温度下或低于液化温度的温度下进行,例如在“冷蒸煮”或“没有蒸煮的方法”中。5.3.糖化可以使用变体α-淀粉酶,任选地在另外一种或多种酶的存在下,将液化淀粉糖化成富含低dp(例如dp1+dp2)糖的糖浆。糖化的产物的确切组成取决于所使用的酶的组合以及所加工的颗粒状淀粉的类型。糖化和发酵可以同时进行或以重叠的方式进行(参见下文)。5.4.异构化可以将通过用淀粉酶处理生产的可溶性淀粉水解产物转化为基于高果糖淀粉的糖浆(hfss),例如高果糖玉米糖浆(hfcs)。可以使用葡萄糖异构酶(特别是固定在固体支持物上的葡萄糖异构酶)来实现所述转化。5.5.发酵可溶性淀粉水解产物(特别是富含葡萄糖的糖浆)可以通过使淀粉水解产物与发酵生物接触来发酵。eof产品包括代谢产物,如柠檬酸、乳酸、琥珀酸、谷氨酸一钠、葡萄糖酸、葡萄糖酸钠、葡萄糖酸钙、葡萄糖酸钾、衣康酸和其他羧酸、葡萄糖酸δ-内酯、异抗坏血酸钠、赖氨酸和其他氨基酸、ω3脂肪酸、丁醇、异戊二烯、1,3-丙二醇和其他生物材料。产乙醇微生物包括表达乙醇脱氢酶和丙酮酸脱羧酶的酵母(例如酿酒酵母(saccharomycescerevisiae))和细菌(例如运动发酵单胞菌(zymomonasmoblis))。产乙醇微生物的改善菌株是本领域已知的。酵母的商业来源包括ethanol(乐斯福公司(lesaffre));fermaxtm(玛翠公司(martrex))、yield+和yp3tm(拉勒曼德公司(lallemand));(红星公司(redstar));(dsm专业公司(dsmspecialties));(奥特奇公司(alltech));以及和thrive(杜邦工业生物科学公司(dupontindustrialbiosciences))。通过发酵产生其他代谢物如柠檬酸和乳酸的微生物也是本领域已知的。5.6.包含变体α-淀粉酶和另外的酶的碳水化合物加工组合物本发明的变体α-淀粉酶可以与来自以下的葡糖淀粉酶(ec3.2.1.3)进行组合:例如,木霉属(trichoderma)、曲霉属(aspergillus)、踝节菌属(talaromyces)、梭菌属(clostridium)、镰刀菌属(fusarium)、梭孢壳属(thielavia)、嗜热丝孢菌属(thermomyces)、阿太菌属(athelia)、腐质霉属(humicola)、青霉属(penicillium)、密瑚菌属(artomyces)、褐褶菌属(gloeophyllum)、密孔菌属(pycnoporus)、齿耳菌属(steccherinum)、栓菌属(trametes)等。可商购的葡糖淀粉酶,包括amg200l;amg300l;santmsuper和amgtme(诺维信公司(novozymes));300和optidexl-400(杜邦工业生物科学公司(dupontindustrialbiosciences));amigasetm和amigasetmplus(dsm);g900(酶生物系统公司(enzymebio-systems));和g990zr。可以与淀粉酶一起使用的其他适合的酶包括植酸酶、蛋白酶、支链淀粉酶、β-淀粉酶、异淀粉酶、α-葡糖苷酶、纤维素酶、木聚糖酶、其他半纤维素酶、β-葡糖苷酶、转移酶、果胶酶、脂肪酶、角质酶、酯酶、甘露聚糖酶、氧化还原酶、不同的α-淀粉酶或其组合。包含本发明α-淀粉酶的组合物可以是水性或非水性配制品、颗粒、粉末、凝胶、浆料、糊剂等,其可进一步包含本文列出的另外的酶中的任何一种或多种,以及缓冲液、盐、防腐剂、水、共溶剂、表面活性剂等。此类组合物可与内源酶或已存在于浆料、水浴、洗衣机、食品或饮料产品等中的其他成分(例如,内源植物(包括藻类)酶,来自先前加工步骤的残留酶等)组合起作用。6.用于食品和饲料制备的组合物和方法本变体组合物和方法还与涉及使用螯合剂的食品和饲料应用相容,包括但不限于本文所列的那些。此类应用包括食品、动物饲料和/或食品/饲料添加剂的制备。示例性应用(主要是为了人类的利益)是烘焙。7.酿造组合物本发明的组合物和方法还适用于涉及使用螯合剂的酿造应用,包括但不限于本文所列的那些。虽然硬水通常用于生产某些风格和品种的啤酒(或其蒸馏产品),但可能需要降低当地水的硬度,以在当地生产其他类型和品种的啤酒。8.纺织品脱浆组合物还考虑了本发明的组合物和方法用于在涉及使用螯合剂(包括但不限于本文所列的那些,特别是在当地可用水供应特别困难的情况下)的应用中处理织物(例如,使织物脱浆)的用途。织物处理方法是本领域中熟知的(参见例如,美国专利号6,077,316)。织物可以在压力下用溶液进行处理。9.清洁组合物本发明的组合物和方法的一个方面是包含螯合剂(包括但不限于作为组分所列的那些)的清洁组合物。此类应用包括,例如,手洗、衣物洗涤、餐具洗涤、和其他硬表面清洁。相应的组合物包括重垢液体(hdl)、重垢干(hdd)和手洗(手动)衣物洗涤剂组合物,包括单位剂量形式的衣物洗涤剂组合物,和自动餐具洗涤(adw)和手洗(手动)餐具洗涤组合物,包括单位剂量形式的餐具洗涤组合物。9.1.概述本发明淀粉酶多肽可以是包含螯合剂的洗涤剂组合物的组分,作为唯一的酶或与包括其他淀粉分解酶的其他酶一起。它可以按无尘颗粒、稳定化液体、或受保护的酶的形式包含在洗涤剂组合物中。洗涤剂组合物可以是任何有用的形式,例如粉末、颗粒、糊剂、条状、或液体。液体洗涤剂可以是水性的,通常含有高达约70%的水和0%至约30%的有机溶剂。它也可以是仅含有约30%水的紧密凝胶类型的形式。洗涤剂组合物包含一种或多种表面活性剂,每种表面活性剂可以是阴离子的、非离子的、阳离子的、或兼性离子的。所述洗涤剂组合物可以另外包含一种或多种其他酶,例如任何组合的蛋白酶、另一种淀粉分解酶、甘露聚糖酶、角质酶、脂肪酶、纤维素酶、果胶酸裂合酶、过水解酶、木聚糖酶、过氧化物酶、和/或漆酶。用于包含本发明的α-淀粉酶的具体形式的洗涤剂组合物描述如下。这些组合物中的许多可以按单位剂量形式提供以便于使用。单位剂量配制品和包装描述于例如us20090209445a1、us20100081598a1、us7001878b2、ep1504994b1、wo2001085888a2、wo2003089562a1、wo2009098659a1、wo2009098660a1、wo2009112992a1、wo2009124160a1、wo2009152031a1、wo2010059483a1、wo2010088112a1、wo2010090915a1、wo2010135238a1、wo2011094687a1、wo2011094690a1、wo2011127102a1、wo2011163428a1、wo2008000567a1、wo2006045391a1、wo2006007911a1、wo2012027404a1、ep1740690b1、wo2012059336a1、us6730646b1、wo2008087426a1、wo2010116139a1和wo2012104613a1中。9.2.重垢液体(hdl)衣物洗涤剂组合物示例性hdl衣物洗涤剂组合物包含去污表面活性剂(10%至40%wt/wt),包括阴离子清洁表面活性剂(选自以下组:直链或支链或无规链、取代或未取代的烷基硫酸盐、烷基磺酸盐、烷基烷氧基化硫酸盐、烷基磷酸盐、烷基膦酸盐、烷基羧酸盐和/或其混合物)和任选地非离子表面活性剂(选自以下组:直链或支链或无规链、取代或未取代的烷基烷氧基化醇,例如c8-c18烷基乙氧基化醇和/或c6-c12烷基苯酚烷氧基化物),其中阴离子清洁表面活性剂(具有从6.0至9的亲水指数(hic))与非离子清洁表面活性剂的重量比大于1:1。适合的去污表面活性剂还包括阳离子去污表面活性剂(选自以下的组:烃基吡啶鎓化合物、烃基季铵化合物、烃基季鏻化合物、烃基叔锍化合物、和/或其混合物);兼性离子和/或两性去污表面活性剂(选自链烷醇胺磺基甜菜碱的组);两性表面活性剂;半极性非离子表面活性剂及其混合物。所述组合物可以任选地包括由两亲烷氧基化油脂清洁聚合物组成的表面活性增强聚合物,所述两亲烷氧基化油脂清洁聚合物(选自以下组:具有支链亲水和疏水特性的烷氧基化聚合物,例如烷氧基化聚亚烷基亚胺(在0.05wt%-10wt%范围内))和/或无规接枝聚合物(典型地包含含有选自下组的单体的亲水主链,所述组由以下组成:不饱和的c1-c6羧酸、醚、醇、醛、酮、酯、糖单元、烷氧基单元、马来酸酐、饱和的多元醇(例如甘油)及其混合物);以及一个或多个疏水侧链,所述疏水侧链选自由以下组成的组:c4-c25烷基基团、聚丙烯、聚丁烯、饱和的c1-c6单羧酸的乙烯酯、丙烯酸或甲基丙烯酸的c1-c6烷基酯及其混合物)。组合物可以包含另外的聚合物,例如污垢释放聚合物(包括阴离子封端的聚酯(例如srp1);包含至少一种单体单元的聚合物(处于无规或嵌段构型),所述单体单元选自糖类、二羧酸、多元醇及其组合;基于乙二醇对苯二甲酸酯的聚合物及其处于无规或嵌段构型的共聚物,例如repel-o-texsf、sf-2和srp6、texcaresra100、sra300、srn100、srn170、srn240、srn300和srn325、marloquestsl);抗再沉积聚合物(0.1wt%至10wt%,包括羧酸酯聚合物,例如包含至少一种单体的聚合物,所述单体选自丙烯酸、马来酸(或马来酸酐)、富马酸、衣康酸、乌头酸、中康酸、柠康酸、亚甲基丙二酸及其任何混合物;乙烯基吡咯烷酮均聚物;和/或聚乙二醇,分子量范围为从500至100,000da);纤维素聚合物(包括那些选自烷基纤维素、烷基烷氧基烷基纤维素、羧基烷基纤维素、烷基羧基烷基纤维素的纤维素聚合物,它们的实例包括羧甲基纤维素、甲基纤维素、甲基羟乙基纤维素、甲基羧甲基纤维素以及其混合物)和聚合羧酸酯(如马来酸酯/丙烯酸酯无规共聚物或者聚丙烯酸酯均聚物)。所述组合物可以进一步包含饱和或不饱和脂肪酸,优选饱和或不饱和的c12-c24脂肪酸(0wt%至10wt%);沉积助剂(其实例包括多糖;优选纤维素聚合物;聚联丙烯二甲基卤化铵(dadmac));和dadmac与乙烯基吡咯烷酮、丙烯酰胺、咪唑、咪唑啉卤化物及其混合物的共聚物(处于无规或嵌段构型);阳离子瓜耳胶;阳离子纤维素,例如阳离子羟乙基纤维素;阳离子淀粉;阳离子聚丙烯酰胺,及其混合物。所述组合物可以进一步包含染料转移抑制剂,其实例包括锰酞菁、过氧化物酶、聚乙烯基吡咯烷酮聚合物、聚胺n-氧化物聚合物、n-乙烯基吡咯烷酮和n-乙烯基咪唑的共聚物、聚乙烯基噁唑烷酮和聚乙烯基咪唑和/或其混合物。所述组合物优选地包含选自以下的酶(通常约0.01wt%活性酶至0.03wt%活性酶):α-淀粉酶(包括本发明α-淀粉酶和任选地其他α-淀粉酶)、蛋白酶、脂肪酶、纤维素酶、胆碱氧化酶、过氧化物酶/氧化酶、果胶酸裂合酶、甘露聚糖酶、角质酶、漆酶、磷脂酶、溶血磷脂酶、酰基转移酶、过水解酶、芳基酯酶、及其任何混合物。组合物可以包含酶稳定剂(其实例包括多元醇,例如丙二醇或甘油;糖或糖醇;乳酸;可逆蛋白酶抑制剂;硼酸或硼酸衍生物,例如芳香族硼酸酯;或苯基硼酸衍生物例如4-甲酰基苯基硼酸)。所述组合物任选地包含硅树脂或基于脂肪酸的泡沫抑制剂;调色染料、钙和镁阳离子、视觉信号传导成分、抗泡沫剂(0.001wt%至约4.0wt%)和/或结构剂/增稠剂(0.01wt%至5wt%,选自由以下组成的组:甘油二酸酯和甘油三酸酯、乙烯乙二醇二硬脂酸酯、微晶纤维素、基于纤维素的材料、超细纤维素、生物聚合物、黄原胶、结冷胶、及其混合物)。组合物可以是任何液体形式,例如液体或凝胶形式,或其任何组合。所述组合物可以处于任何单位剂量形式,例如小袋。9.3.重垢干/固体(hdd)衣物洗涤剂组合物示例性hdd衣物洗涤剂组合物包含去污表面活性剂,其包括阴离子去污表面活性剂(例如,直链或支链或无规链、取代或未取代的烷基硫酸盐、烷基磺酸盐、烷基烷氧基化硫酸盐、烷基磷酸盐、烷基膦酸盐、烷基羧酸盐和/或其混合物);非离子去污表面活性剂(例如,直链或支链或无规链、取代或未取代的c8-c18烷基乙氧基化物和/或c6-c12烷基苯酚烷氧基化物);阳离子去污表面活性剂(例如,烷基吡啶化合物、烷基季铵化合物、烷基季鏻化合物,烷基三元锍化合物及其混合物);兼性离子和/或两性去污表面活性剂(例如,链烷醇胺磺基甜菜碱)、两性表面活性剂、半极性非离子表面活性剂;及其混合物;助洗剂,包括无磷酸盐助洗剂(例如沸石助洗剂,其实例包括在0wt%至小于10wt%范围内的沸石a、沸石x、沸石p和沸石map),磷酸盐助洗剂(例如在0wt%至小于10wt%范围内的三聚磷酸钠),柠檬酸、柠檬酸盐和次氮基三乙酸,硅酸盐(例如,在0wt%至小于10wt%的范围内的硅酸钠或硅酸钾或偏硅酸钠,或层状硅酸盐(sks-6)));碳酸盐(例如,在0wt%至小于80wt%范围内的碳酸钠和/或碳酸氢钠);和漂白剂,所述漂白剂包括光漂白剂(例如磺化锌酞菁、磺化铝酞菁、呫吨染料及其混合物);疏水或亲水性漂白活化剂(例如十二烷酰氧基苯磺酸盐、癸酰基氧基苯磺酸盐、癸酰基氧基苯甲酸或其盐、3,5,5-三甲基己酰基氧基苯磺酸盐、四乙酰基乙二胺-taed、壬酰基氧基苯磺酸盐-nobs、腈季铵盐及其混合物);过氧化氢源(例如,无机过氧水合物盐,其实例包括过硼酸盐、过碳酸盐、过硫酸盐、过磷酸盐或过硅酸盐的单或四水合钠盐);预先形成的亲水和/或疏水过酸(例如过羧酸和盐、过碳酸和盐、过碘酸和盐,过氧单硫酸和盐、及其混合物);和/或漂白催化剂(例如,亚胺漂白促进剂,其实例包括亚胺阳离子和聚离子、亚胺两性离子、改性胺、改性氧化胺、n-磺酰基亚胺、n-膦酰基亚胺、n-酰基亚胺、噻二唑二氧化物、全氟亚胺、环状糖酮及其混合物);和含金属的漂白催化剂(例如铜、铁、钛、钌、钨、钼或锰阳离子以及辅助金属阳离子,例如锌或铝)。组合物优选地包含酶,例如蛋白酶、淀粉酶、脂肪酶、纤维素酶、胆碱氧化酶、过氧化物酶/氧化酶、果胶酸裂合酶、甘露聚糖酶、角质酶、漆酶、磷脂酶、溶血磷脂酶、酰基转移酶、过水解酶、芳基酯酶、及其任何混合物。所述组合物可以任选地包含另外的洗涤剂成分,包括香料微囊剂、淀粉包封的香料协调剂、调色剂、另外的聚合物(包括织物完整性和阳离子聚合物)、染料锁定成分、织物柔顺剂、增亮剂(例如c.i.荧光增亮剂)、絮凝剂、螯合剂、烷氧基化多胺、织物沉积助剂和/或环糊精。9.4.自动餐具洗涤(adw)洗涤剂组合物示例性adw洗涤剂组合物包含非离子表面活性剂,包括乙氧基化非离子表面活性剂、醇烷氧基化表面活性剂、环氧封端的聚(氧基烷基化)醇或胺氧化物表面活性剂,它们以0%至10%(按重量计)的量存在;在5%-60%范围内的助洗剂;多元羧酸及其部分或完全中和盐的均聚物和共聚物、单体多元羧酸和羟基羧酸及其盐,它们在0.5%至50%(按重量计)的范围内;在约0.1%至约50%(按重量计)的范围内的磺化/羧化聚合物以提供尺寸稳定性;在约0.1%至约10%(按重量计)范围内的干燥助剂(例如,聚酯,尤其是阴离子聚酯(任选地与具有利于缩聚的3至6个官能团-通常是酸、醇或酯官能团的另外的单体一起),聚碳酸酯-、聚氨酯-和/或聚脲-聚有机硅氧烷化合物或其前体化合物,特别是反应性环状碳酸酯和尿素类型);在约1%至约20%(按重量计)的范围内的硅酸盐(包括硅酸钠或硅酸钾,例如二硅酸钠、偏硅酸钠和结晶页硅酸盐);无机漂白剂(例如,过氧水合物盐例如过硼酸盐、过碳酸盐、过磷酸盐、过硫酸盐和过硅酸盐)和有机漂白剂(例如有机过氧酸,包括二酰基和四酰基过氧化物,尤其是二过氧十二烷二酸、二过氧十四烷二酸、和二过氧十六烷二酸);漂白活化剂(即有机过酸前体,其在约0.1%至约10%(按重量计)的范围内);漂白催化剂(例如锰三氮杂环壬烷及相关络合物、co、cu、mn和fe双吡啶胺及相关络合物、以及五胺乙酸钴(iii)及相关络合物);在约0.1%至5%(按重量计)的范围内的金属护理剂(例如苯并三氮唑、金属盐和络合物、和/或硅酸盐);每克自动餐具洗涤剂组合物的从约0.01mg至5.0mg活性酶范围内的酶(例如蛋白酶、淀粉酶、脂肪酶、纤维素酶、胆碱氧化酶、过氧化物酶/氧化酶、果胶酸裂合酶、甘露聚糖酶、角质酶、漆酶、磷脂酶、溶血磷脂酶、酰基转移酶、过水解酶、芳基酯酶、及其混合物);以及酶稳定剂组分(例如寡糖、多糖、和无机二价金属盐)。9.5.另外的酶本文描述的含螯合剂的清洁组合物中的任何一个均可以包含任何数量的另外的酶。通常,所述一种或多种酶应与所选择的洗涤剂相容(例如,在ph最佳、与其他酶和非酶成分的相容性等方面),并且所述一种或多种酶应以有效量存在。提供以下酶作为实例。适合的蛋白酶包括动物、植物或微生物来源的那些蛋白酶。包括化学修饰的或蛋白质工程化的突变体,连同天然加工的蛋白质。蛋白酶可以是丝氨酸蛋白酶或金属蛋白酶、碱性微生物蛋白酶、胰蛋白酶样蛋白酶、或胰凝乳蛋白酶样蛋白酶。碱性蛋白酶的实例是枯草杆菌蛋白酶,尤其是衍生自芽孢杆菌属的那些,例如枯草杆菌蛋白酶novo、枯草杆菌蛋白酶carlsberg、枯草杆菌蛋白酶309、枯草杆菌蛋白酶147、和枯草杆菌蛋白酶168(参见例如,wo89/06279)。示例性蛋白酶包括但不限于wo199523221、wo199221760、wo2008010925、wo20100566356、wo2011072099、wo201113022、wo2011140364、wo2012151534、wo2015038792、wo2015089441、wo2015089447、wo2015143360、wo2016001449、wo2016001450、wo2016061438、wo2016069544、wo2016069548、wo2016069552、wo2016069557、wo2016069563、wo2016069569、wo2016087617、wo2016087619、wo2016145428、wo2016174234、wo2016183509、wo2016202835、wo2016205755、us20080090747、us5,801,039、us5,340,735、us5,500,364、us5,855,625、re34,606、us5,955,340、us5,700,676、us6,312,936、us6,482,628、us8530219,美国临时申请号62/331282、62/343618、62/351649、62/437171、62/437174、和62/437509,和pct申请号pct/cn2017/076749中描述的那些;以及wo2007/044993、wo2009/058303、wo2009/058661、wo2014/071410、wo2014/194032、wo2014/194034、wo2014/194054和wo2014/194117中描述的金属蛋白酶。示例性商业蛋白酶包括但不限于maxatase、maxacal、maxapem、oxp、puramaxtm、excellasetm、preferenztm蛋白酶(例如,p100、p110、p280)、effectenztm蛋白酶(例如,p1000、p1050、p2000)、excellenztm蛋白酶(例如,p1000)、和purafast(杜邦工业生物科学公司(dupontindustrialbiosciences));ultra、ultra、primase、durazym、progress和(诺维信公司(novozymes));blaptm和blaptm变体(汉高公司(henkel));lavergytmpro104l(basf)、和(嗜碱芽孢杆菌枯草杆菌(b.alkalophilussubtilisin)蛋白酶(花王公司(kao)))。适合的蛋白酶包括特别选择或工程化以在相对低温下起作用的天然存在的蛋白酶或者工程化变体。适合的脂肪酶包括细菌或真菌来源的那些。包括化学修饰的、蛋白水解修饰的或蛋白工程化的突变体。有用的脂肪酶的实例包括但不限于来自腐质酶属(humicola)(同义词嗜热丝孢菌属)的脂肪酶,例如来自绵毛状腐质菌(h.lanuginosa)(疏棉状嗜热丝孢菌(t.lanuginosus))(参见例如ep258068和ep305216)、来自特异腐质霉(h.insolens)(参见例如,wo96/13580);假单胞菌属(pseudomonas)脂肪酶(例如,来自产碱假单胞菌(p.alcaligenes)或假产碱假单胞菌(p.pseudoalcaligenes;参见例如,ep218272);洋葱假单胞菌(p.cepacia)(参见例如,ep331376);施氏假单胞菌(p.stutzeri)(参见例如,gb1,372,034);萤光假单胞菌(p.fluorescens);假单胞菌属物种菌株sd705(参见例如,wo95/06720和wo96/27002);威斯康星假单胞菌(p.wisconsinensis)(参见例如,wo96/12012);芽孢杆菌属脂肪酶(例如,来自枯草芽孢杆菌;参见例如,dartois等人(1993),biochemicaetbiophysicaacta[生物化学与生物物理学报],1131:253-360);嗜热脂肪芽孢杆菌(参见例如,jp64/744992);或短小芽孢杆菌(b.pumilus)(参见例如,wo91/16422)。考虑用于配制品中的另外的脂肪酶变体包括例如wo92/05249、wo94/01541、wo95/35381、wo96/00292、wo95/30744、wo94/25578、wo95/14783、wo95/22615、wo97/04079、wo97/07202、ep407225和ep260105中描述的那些。示例性商业脂肪酶包括但不限于m1lipase、lumafast和lipomax(杜邦工业生物科学公司(dupontindustrialbiosciences));和ultra(诺维信公司);和lipasep(天野药业有限公司(amanopharmaceuticalco.ltd))。聚酯酶:适合的聚酯酶可以包括在组合物中,例如描述于例如wo01/34899、wo01/14629、和us6933140中的那些。本发明的组合物可以与其他淀粉酶组合,包括其他α-淀粉酶。当不同的α-淀粉酶表现出不同的性能特征并且多种不同的α-淀粉酶的组合导致提供不同α-淀粉酶的益处的组合物时,这种组合是特别令人希望的。其他α-淀粉酶包括可商购的α-淀粉酶,例如但不限于和bantm(诺和诺德公司(novonordiska/s)和诺维信公司(novozymesa/s));和preferenztm(来自杜邦工业生物科学公司(dupontindustrialbiosciences))。示例性α-淀粉酶描述于wo9418314a1、us20080293607、wo2013063460、wo10115028、wo2009061380a2、wo2014099523、wo2015077126a1、wo2013184577、wo2014164777、w09510603、wo9526397、wo9623874、wo9623873、wo9741213、wo9919467、wo0060060、wo0029560、wo9923211、wo9946399、wo0060058、wo0060059、wo9942567、wo0114532、wo02092797、wo0166712、wo0188107、wo0196537、wo0210355、wo2006002643、wo2004055178、和wo9813481中。适合的纤维素酶包括细菌或真菌来源的那些。包括化学修饰的突变体或蛋白质工程化的突变体。适合的纤维素酶包括来自芽孢杆菌属、假单胞菌属、腐质霉属、镰刀菌属(fusarium)、梭孢壳属、枝顶孢属(acremonium)的纤维素酶,例如,在例如美国专利号4,435,307;5,648,263;5,691,178;5,776,757;和wo89/09259中公开的从特异腐质霉(humicolainsolens)、嗜热毁丝霉(myceliophthorathermophila)和尖孢镰刀菌(fusariumoxysporum)产生的真菌纤维素酶。考虑使用的示例性纤维素酶是对纺织品具有颜色护理益处的那些。此类纤维素酶的实例是描述于例如ep0495257、ep0531372、wo96/11262、wo96/29397、和wo98/08940中的纤维素酶。其他实例是纤维素酶变体,例如wo94/07998;wo98/12307;wo95/24471;pct/dk98/00299;ep531315;美国专利号5,457,046;5,686,593;和5,763,254中描述的那些。示例性纤维素酶包括wo2005054475、wo2005056787、us7,449,318、us7,833,773、us4,435,307;ep0495257;和美国临时申请号62/296,678和62/435340中描述的那些。示例性商业纤维素酶包括但不限于premium、和(诺维信公司);100、200/220和2000(杜邦工业生物科学公司(dupontindustrialbiosciences));以及kac-500(b)(花王公司)。示例性甘露聚糖酶包括但不限于细菌或真菌来源的那些甘露聚糖酶,例如像如wo2016007929;uspn6,566,114、6,602,842和6,440,991;和国际申请号pct/us2016/060850和pct/us2016/060844中所描述的。示例性甘露聚糖酶包括但不限于细菌或真菌来源的那些甘露聚糖酶,例如像如wo2016007929;uspn6566114、6,602,842和6,440,991;和国际申请号pct/us2016/060850和pct/us2016/060844中所描述的。考虑用于组合物中的适合的过氧化物酶/氧化酶包括植物、细菌或真菌来源的那些。包括化学修饰的突变体或蛋白质工程化的突变体。有用的过氧化物酶的实例包括来自鬼伞属(coprinus)(例如来自灰盖鬼伞(c.cinereus))的过氧化物酶、及其变体,如wo93/24618、wo95/10602、以及wo98/15257中所述的那些。可商购的过氧化物酶包括例如guardzymetm(诺和诺德公司和诺维信公司)。洗涤剂组合物还可以包含2,6-β-d-果聚糖水解酶,其对于除去/清洁存在于家用和/或工业纺织品/衣物上的生物膜是有效的。通过添加含有一种或多种酶的单独的添加剂,或通过添加包含所有这些酶的组合的添加剂,可以将一种或多种洗涤剂酶包含在洗涤剂组合物中。洗涤剂添加剂,即单独的添加剂或组合的添加剂,可以配制成例如颗粒、液体、浆料等。示例性洗涤剂添加剂配制品包括但不限于颗粒(特别是无尘颗粒)、液体(特别是稳定的液体)或浆料。洗涤剂组合物可以是任何方便的形式,例如条状、片剂、粉末、颗粒、糊剂、或液体。液体洗涤剂可以是水性的,通常含有高达约70%的水和0%至约30%的有机溶剂。还考虑了含有约30%或更少水的紧密洗涤剂凝胶。wo2013063460中描述了许多示例性洗涤剂配制品,其中可以向这些配制品中添加本发明的α-淀粉酶(或在一些情况下所述α-淀粉酶被鉴定为这些配制品的组分)。这些包括可商购的单位剂量洗涤剂配制品/包装,例如ultrapacks(汉高公司)、quantum(利洁时公司(reckittbenckiser))、cloroxtm2packs(高乐士公司(clorox))、oxicleanmaxforcepowerpaks(杜威公司(church&dwight))、stainrelease、actionpacs、和pods(宝洁公司(procter&gamble))、ps。9.6.评估洗涤剂组合物中淀粉酶活性的方法本领域已知许多α-淀粉酶清洁测定,包括样本和微样本测定。所附实例仅描述了少数此类测定。为了进一步说明组合物和方法及其优点,给出以下具体实例,应理解它们是说明性的而不是限制性的。出于所有目的,本文引用的所有参考文献均通过引用以其全文并入本文。为了进一步说明组合物和方法及其优点,给出以下具体实例,应理解它们是说明性的而不是限制性的。实例实例1:菌株和样品分离用常规的基因合成方法获得编码目的蛋白的dna序列。利用标准pcr扩增技术,引入了分泌信号肽和另外的5′和3′序列进行扩增和亚克隆。可替代地,整个合成基因可以商业化生产。使用标准程序将这些dna序列插入细菌载体中,以在枯草芽孢杆菌(bacillussubtilis)或地衣芽孢杆菌(bacilluslichenformis)细胞中整合和分泌。通过dna测序验证构建体。使转化细胞在合适的表达培养基中生长68-hr。通过离心将细胞与含蛋白的上清液分离,随后通过0.45μm膜(emd密理博公司(emdmillipore))过滤。在一些情况下,通过使用苯基琼脂糖6快速流动树脂(通用电气医疗公司(gehealthcare))进行离子交换色谱,以实现另外的纯化。通过高效液相色谱法(hplc)和在280nm处的吸光度确定蛋白质浓度。实例2:变体的稳定性根据高温下在螯合剂溶液中孵育时活性的相对损失,通过测量来评估所描述的工程化变体的相对的螯合剂稳定性。简言之,将酶稀释在大约1-5ppm浓度的螯合剂溶液中。螯合剂溶液由50mmcaps、0.005%tween-80和5mm羟乙二磷酸(hedp)组成,ph调节为10.5。通过在65℃至85℃处在热循环仪中加热4至10分钟来对含酶的溶液加压。在升高的温度下对溶液加压之前和之后均采集测试溶液中的酶样品。使用淀粉酶hr测定(麦格酶公司(megazyme))评估样品中存在的淀粉酶活性。所有变体包括熟知的“rg缺失”(即“δrg”),是指bspamy24的残基r181和g182和cspamy2的残基r178和g179。表4示出了两种α-淀粉酶中具有改进的突变,其位置在两种分子中按行排列。尽管这两种α-淀粉酶的氨基酸序列同一性不到70%,但仍发现一些突变可以增强两种分子的螯合剂稳定性。表4.增强bspamy24和cspamy2变体的螯合剂稳定性的突变。实例3:变体的结构分析bspamy24和cspamy2α-淀粉酶的同源性模型构建如下。将bspamy24的氨基酸序列(seqidno:1)或cspamy2的氨基酸序列(seqidno:2)用作moe(化学计算集团公司(chemicalcomputinggroup),蒙特利尔,加拿大)中的查询来检索蛋白质数据库(参见例如,berman,h.e.等人(2000)nuc.acidsres[核酸研究].28:235-42)。地衣芽孢杆菌(bacilluslicheniformis)α-淀粉酶(1bli)在两次检索中都是最高公共命中。使用具有所有默认参数的“同源模型”功能来创建每种酶的模型。还确定了bspamy24变体α-淀粉酶和cspamy2变体α-淀粉酶的x射线衍射晶体结构。这些实验结构与同源模型非常匹配,并且支持用同源模型进行的分析。表4中氨基酸的位置示出于图1中α-淀粉酶模型的结构比对中。这五个位置的α碳对于每种淀粉酶示出为球体。bspamy24α-淀粉酶分子中的氨基酸(具有本文所述的rg缺失)示出为浅灰色。cspamy2α-淀粉酶分子中的氨基酸(还是具有本文所述的rg缺失)示出为深灰色。钙和钠离子示出为黑色。如图所示,表4中的位置示出了两个分子中紧密的结构比对。结构建模还表明,这些位置处的突变可能会改变相互作用(稳定185-210环的构象和其在折叠蛋白质结构中的定位)。185-210位置的环(bspamy24编号)围绕ca2+-na+-ca2+金属位点,并且包含这些金属离子的大多数配体(图2)。表4中列出的氨基酸突变可能会改变稳定185-210环的相互作用,这可能是由于其在环内或能够与如表5所示的环相互作用的结果。表5.氨基酸位置在结构中的定位对结构建模的进一步观察表明,根据表4中氨基酸的位置和构象及其周围的结构环境,185-210环的特定相互作用类型可以在突变时发生改变。e190p/e187p突变将通过将环的构象自由度限制为脯氨酸侧链可用的更有限的phi和psi角来稳定环的折叠结构。206/203位置的突变将改变与附近蛋白质结构区域的范德华和疏水性堆积相互作用。空间变化可以移动主链使得氢在所述位置与相邻链(bspamy24-asn106)键合。酪氨酸突变可以产生新的氢键和/或与相邻残基进行pi叠加。h210q/h207q突变可以与bspamy24-glu212或bspamy24-tyr160的主链或bspamy24-lys185侧链产生新的氢键。位置244/241的突变可以产生新的与185-210环的氢键相互作用,也会改变ser与bspamy24-lys242的范德华相互作用,这在185-210环上三个位置的可行氢键几何结构内。245/242位置处的phe突变预期会改变与185-210环上残基(bspamy24-met208/cspamy24-tyr205)的范德华和pi叠加相互作用。glu突变也可以改变环残基bspamy24-asp209、bspamy24-asp188和bspamy24-met208处的潜在氢键。应当注意这些相互作用中的任何一个都可以导致185-210环构象的小的局部调整,同时稳定环的整体折叠结构,从而增强螯合剂存在下蛋白质的整体稳定性。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1