通过固相分子成像检测靶核酸的制作方法
相关申请的交叉引用
本申请要求于2018年12月20日提交的美国临时申请号62/782867的优先权的权益,该美国临时申请全文以引用方式并入本文。
参考序列表
本申请含有作为电子文本文件提交的序列表,其名为“p34923-wopctfling序列表”,字节大小为46kb,并于2019年11月17日创建。
本发明涉及聚合酶链式反应(pcr)的方法,尤其涉及用于通过固相生物传感器执行多重pcr和检测靶核酸的方法。
背景技术:
聚合酶链式反应(pcr)已成为生物医学研究、疾病监测和诊断中普遍存在的工具。通过pcr进行的核酸序列的扩增描述于美国专利号4,683,195、4,683,202和4,965,188中。现在,pcr在本领域中是众所周知的,并且已经在科学文献中进行了广泛的描述。参见pcrapplications,((1999)innis等人编辑,academicpress,sandiego)、pcrstrategies,((1995)innis等人编辑,academicpress,sandiego);pcrprotocols,((1990)innis等人编辑,academicpress,sandiego)以及pcrtechnology,((1989)erlich编,stocktonpress,newyork)。“实时”pcr测定能够同时对靶序列的起始量进行扩增和检测以及定量。利用dna聚合酶的5′至3′核酸酶活性的基本
在大多数的当前方法中,多重测定的能力受到检测仪器的限制。具体而言,在同一反应中多个探针的使用需要使用不同的荧光标记。为了同时检测多个探针,仪器必须能够区分每个探针发出的光信号。市场上大多数的当前技术都不允许在同一反应容器中检测到四至七个以上的不同波长。因此,每个靶标使用一个独特地带标记的探针,在同一容器中最多只能检测到四至七个不同的靶标。实际上,至少一个靶标通常是对照核酸。因此,实际上,在同一根管中最多只能检测到三至六个实验靶标。由于光谱宽度的限制,荧光染料的使用也受到限制,其中在可见光谱内没有明显的重叠干扰的只有约六种或七种染料可以适用。因此,除非在扩增和检测策略上进行了根本性改变,否则多重测定的能力将无法跟上临床需求。
已知有许多用于检测靶核酸的方法。核酸检测的当前可用的均相测定法包括
作为一种对特定生物分子相互作用进行实时可视化的分析方法,最近已对聚焦分子成像(focalmolography)进行了描述(参见fattingerc.,physicalreviewx4,031024,2014;fattingerc.,u.s.2016/0139115;以及gatterdam,v.等人,naturenanotechnology12,1089-1095,2017,其公开内容通过引用整体并入本文)。聚焦分子成像将传感器表面上的亲和力调制转换为由靶分子引起的折射率调制,这些靶分子与分子识别位点的精确组装的纳米图样结合,称为“mologram”。对mologram进行设计,以使激光在特异性结合的分子处散射,经由相长干涉在mologram的焦点处生成强信号,而在非特异性结合的分子处的散射则不会起到作用。可以通过在光敏整体接枝共聚物层上的近场反应性浸没式光刻法将mologram呈现在芯片上。可以证明对与mologram的识别位点结合的生物分子的选择性、敏感性和无标记检测。
技术实现要素:
本发明提供了用于核酸序列检测的新型方法,特别是使用实时pcr测定法和固相聚焦分子成像对多个靶核酸进行的扩增和检测。该方法通过使用寡核苷酸探针来执行,该寡核苷酸探针各自包含退火部分和标签部分,称为“加标签的探针”,其中标签部分包含与靶核酸序列不互补的核苷酸序列,其中退火部分包含与靶核酸序列至少部分互补的核苷酸序列,并与靶核酸子序列的区域进行杂交。该方法还通过使用附着在被称为“moligo”的分子成像芯片上的寡核苷酸来执行,每个moligo包括退火部分和延伸部分,该退火部分包含与寡核苷酸探针之一的标签部分互补的核苷酸序列,该延伸部分包含与靶核酸序列或与标签部分不互补的核苷酸序列。
因此,在一个实施例中,本发明涉及一种用于对样品中的靶核酸进行扩增和检测的方法,该方法包括以下步骤:使在单个反应容器中的含有所述靶核酸的所述样品与一对寡核苷酸引物接触,每个寡核苷酸引物能够与所述靶核酸的子序列的相反链杂交;加标签的探针,其包含寡核苷酸序列,该寡核苷酸序列包含退火部分和标签部分,其中标签部分包含与靶核酸序列不互补的核苷酸序列,其中退火部分包含与靶核酸序列至少部分互补的核苷酸序列,并与所述靶核酸的所述子序列的区域杂交,所述靶核酸的所述子序列以所述寡核苷酸引物对为界;使用具有5′至3′核酸酶活性的核酸聚合酶通过pcr扩增所述靶核酸,从而在每个pcr循环的延伸步骤期间,聚合酶的核酸酶活性可将标签部分从加标签的探针的退火部分裂解和分离;将来自加标签的探针的裂解的标签部分与包含寡核苷酸序列的moligo模板杂交,该寡核苷酸序列包含退火部分和延伸部分,该退火部分包含与加标签的探针的标签部分互补的核苷酸序列,该延伸部分包含与靶核酸序列或加标签的探针的标签部分不互补的核苷酸序列以形成部分双链体分子,其中所述moligo模板附着在固相芯片上;使部分双链体分子与核酸聚合酶反应,以将裂解的标签部分延伸到moligo模板的延伸部分中;通过分子成像测量延伸,其中杂交步骤和延伸步骤之间的分子成像信号的增加表示检测到靶核酸的存在;其中所有步骤均在不存在标记的情况下执行。在一个特定实施例中,moligo模板的长度比加标签的探针的长度长至少10个核苷酸。在其他实施例中,moligo的长度比加标签的探针的长度长至少20个核苷酸或30个核苷酸或40个核苷酸或50个核苷酸。在某些实施例中,moligo模板的长度比加标签的探针的标签部分的长度长至少10个核苷酸。在其他实施例中,moligo的长度比加标签的探针的标签部分的长度长至少20个核苷酸或30个核苷酸或40个核苷酸或50个核苷酸。
附图说明
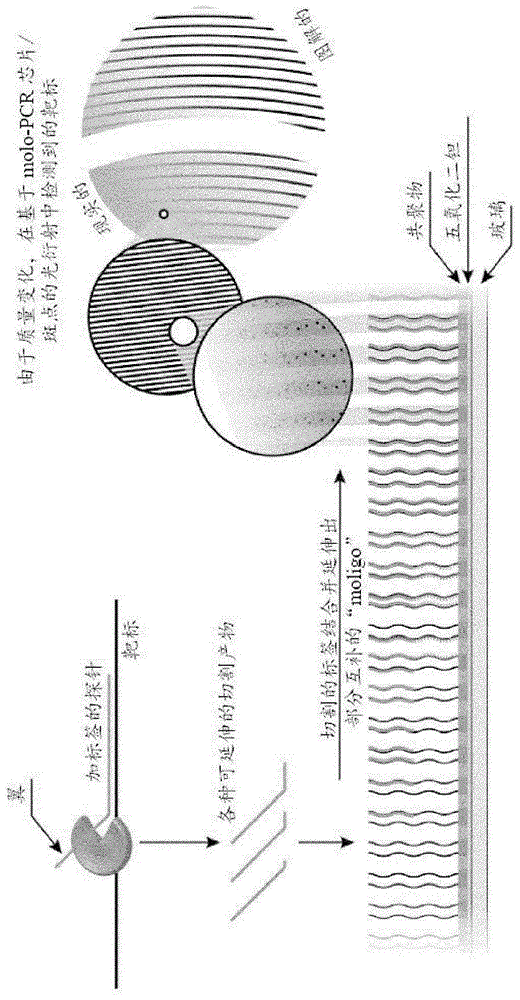
图1是本发明的方法的图形描述。
图2示出了如实例1中所述的执行pcr实验的hplc色谱图。
图3示出了如实例2中所述的实验生成的分子成像信号。
图4示出了柱状图,其表示通过由22bp引物序列组成的寡核苷酸和由与moligo序列互补的100bp序列组成的寡核苷酸在100bpmoligo上的杂交之间的分子成像信号。
具体实施方式
定义
本文所用的术语“样品”包括包含核酸的标本或培养物(例如微生物学培养物)。术语“样品”还旨在包括生物学样品和环境样品两者。样品可包括合成来源的标本。生物学样品包括全血、血清、血浆、脐带血、绒毛膜绒毛、羊水、脑脊髓液、脊髓液、灌洗液(例如,支气管肺泡、胃、腹膜、导管、耳朵、关节镜)、活检样品、尿液、粪便、痰、唾液、鼻粘液、前列腺液、精液、淋巴液、胆汁、眼泪、汗液、母乳、乳房液、胚胎细胞和胎儿细胞。在一个优选实施例中,生物学样品是血液,且更优选是血浆。如本文所用,术语“血液”涵盖全血或血液的任何级分,诸如常规定义的血清和血浆。血浆是指对用抗凝血剂处理过的血液进行离心产生的全血级分。血清是指血液样品凝结后残留的流体的水状部分。环境样品包括环境材料,诸如表面物质、土壤、水和工业样品,以及从食品和奶制品加工仪器、设备、装备、器皿、一次性和非一次性物品中获得的样品。这些实例不应解释为限制适用于本发明的同一样品类型。
本文所用的术语“靶标”或“靶核酸”是指待检测或测量其存在或待研究其功能、相互作用或特性的任何分子。例如,靶标可以是能够与寡核苷酸探针结合或以其他方式接触的生物分子,诸如核酸分子。
在整个本公开中,术语“核酸”和“核酸分子”可以互换使用。该术语是指寡核苷酸、oligo、多核苷酸、脱氧核糖核苷酸(dna)、基因组dna、线粒体dna(mtdna)、互补dna(cdna)、细菌dna、病毒dna、病毒rna、rna、信使rna(mrna)、转运rna(trna)、核糖体rna(rrna)、sirna、催化性rna、克隆、质粒、m13、p1、粘粒、细菌人工染色体(bac)、酵母人工染色体(yac)、扩增的核酸、扩增子、pcr产物和其他类型的扩增的核酸、rna/dna杂交体和聚酰胺核酸(pna),所有这些都可以是单链或双链形式,并且除非另有限制,否则将涵盖可以以相似方式起作用的天然核苷酸的已知类似物作为天然存在的核苷酸及它们的组合和/或混合物。因此,术语“核苷酸”是指天然存在的和经修饰的/非天然存在的核苷酸,包括存在于多核酸或寡核苷酸内的核苷三磷酸、核苷二磷酸和核苷单磷酸以及单磷酸单体。核苷酸也可以是核糖;2′-脱氧;2′,3′-脱氧以及本领域众所周知的大量的其他核苷酸模拟物。模拟物包括链终止核苷酸,诸如3′-o-甲基、卤代碱基或糖取代;替代性糖结构,包括非糖、烷基环结构;替代性碱基,包括肌苷;脱氮杂修饰的;chi和psi,经连接基修饰;经大量标记修饰的;磷酸二酯修饰或替代,包括硫代磷酸酯、甲基膦酸酯、硼烷磷酸酯、酰胺、酯、醚;以及基本或完全的核苷酸间替代,包括诸如可光解的硝基苯基部分的裂解键。
可以定量或定性地测出靶标的存在与否。靶标可以以多种不同形式出现,包括例如简单或复杂的混合物,或以基本上纯化的形式出现。例如,靶标可以是含有其他成分的样品的一部分,也可以是样品的唯一或主要成分。因此,靶标可以是整个细胞或组织、细胞或组织提取物、其分馏的裂解物或基本上纯化的分子的成分。靶标也可以具有已知或未知的序列或结构。
术语“扩增反应”是指用于扩增核酸靶序列的拷贝的任何体外方式。
“扩增”是指将溶液提交至足以允许扩增的条件的步骤。扩增反应的成分可包括但不限于例如引物、多核苷酸模板、聚合酶、核苷酸、dntp等。术语“扩增”通常是指靶核酸中的“指数”增加。然而,本文所用的“扩增”还可以指核酸的选择性靶序列数目的线性增加,但是不同于一次性、单一引物延伸步骤。
“聚合酶链式反应”或“pcr”是指以几何级数由此扩增靶双链dna的特定区段或子序列的方法。pcr对于本领域技术人员是众所周知的;参见,例如美国专利号4,683,195和4,683,202;以及pcrprotocols:aguidetomethodsandapplications,innis等人编,1990。
如本文所用,“寡核苷酸”是指通过磷酸二酯键或其类似物连接的天然或经修饰的核苷单体的线性寡聚物。寡核苷酸包括能够与靶核酸特异性结合的脱氧核糖核苷、核糖核苷、其端基异构体形式、肽核酸(pna)等。通常,单体通过磷酸二酯键或其类似物连接以形成寡核苷酸,其大小范围从几个单体单元,例如3-4个,到几十个单体单元,例如40-60个。每当寡核苷酸由字母序列表示时,诸如“atgcctg”,应理解的是核苷酸从左至右为5′-3′顺序,并且除非另有说明,否则“a”表示脱氧腺苷,“c”表示脱氧胞苷,“g”表示脱氧鸟苷,“t”表示脱氧胸苷,以及“u”表示核糖核苷尿苷。通常,寡核苷酸包含四个天然的脱氧核苷酸;然而,它们也可以包含核糖核苷或非天然的核苷酸类似物。当酶对活性具有特定的寡核苷酸或多核苷酸底物要求时,例如单链dna、rna/dna双链体等,那么为该寡核苷酸或多核苷酸底物选择合适的组合物是本领域普通技术人员所熟知的。
如本文所用,“寡核苷酸引物”或简称为“引物”是指与靶核酸模板上的序列杂交并促进检测寡核苷酸探针的多核苷酸序列。在本发明的扩增实施例中,寡核苷酸引物用作核酸合成的起始点。在非扩增实施例中,寡核苷酸引物可用于产生能够被裂解剂裂解的结构。引物可以具有各种长度,并且通常长度小于50个核苷酸,例如长度为12-25个核苷酸。可以基于本领域技术人员已知的原理来设计用于pcr的引物的长度和序列。
如本文所用,术语“寡核苷酸探针”是指能够与目标靶核酸杂交或退火并允许靶核酸进行特异性检测的多核苷酸序列。
“标记”或“标记分子”是赋予可检测信号的分子。例如,可检测信号可以是比色、荧光或发光的信号。相反,“无标记”是指不存在赋予可检测信号的分子。为了本发明的目的,本身不赋予可检测信号的亲和标签不是标记,并且采用本身不赋予可检测信号的亲和标签的测定法被认为是无标记的测定法。
“错配的核苷酸”或“错配”是指在一个或多个位置处与靶序列不互补的核苷酸。寡核苷酸探针可以具有至少一个错配,但是也可以具有2、3、4、5、6或7个或更多个错配的核苷酸。
如本文所用,术语“多态性”是指等位基团变体。多态性可包括单核苷酸多态性(snp)以及简单的序列长度多态性。多态性可以归因于一个等位基因与另一个等位基因相比的一个或多个核苷酸取代,或者可以归因于本领域已知的插入或缺失、重复、倒位和其他改变。
本文所用的术语“修饰”是指寡核苷酸探针在分子水平上的改变(例如,碱基部分、糖部分或磷酸主链)。核苷修饰包括但不限于裂解阻断剂或裂解诱导剂的引入、小沟结合剂的引入、同位素富集、同位素贫化、氘的引入和卤素修饰。核苷修饰还可包括增加杂交严格性或增加寡核苷酸探针的解链温度的部分。例如,可以用连接2′和4′碳的额外桥来修饰核苷酸分子,从而产生对核酸酶裂解有抗性的锁核酸(lna)核苷酸(如imanishi等人在美国专利号6,268,490以及在wengel等人的美国专利号6,794,499中所述,其全部内容通过引用整体并入本文)。寡核苷酸探针和淬灭寡核苷酸分子的标签部分的组合物仅受它们形成稳定双链体的能力的限制。因此,这些寡核苷酸可以包含dna、l-dna、rna、l-rna、lna、l-lna、pna(肽核酸,如nielsen等人,美国专利号5,539,082中所述)、bna(桥接核酸,例如2′,4′-bna(nc)[2′-o,4′-c-氨基亚甲基桥接的核酸],如rahman等人,j.am.chem.soc.2008;130(14):4886-96)上所述)、l-bna等(其中“l-xxx”是指核酸糖单元的l对映体)或核苷酸碱基、糖、或磷酸二酯主链上的任何其他已知的变化和修饰。
核苷修饰的其他实例包括在寡核苷酸的糖部分中引入的各种2′取代,诸如卤代、烷氧基和烯丙氧基基团。已有证据表明2′-取代的-2′-脱氧腺苷多核苷酸类似于双链rna而不是dna。ikehara等人,(nucleicacidsres.,1978,5,3315)已表明,聚a、聚i或聚c中与其互补序列进行双链体化的2′-氟取代基比核糖核苷酸或脱氧核糖核苷酸聚双链体明显更稳定,其通过标准解链测定法确定。inoue等人,(nucleicacidsres.,1987,15,6131)已描述了在每个核的核苷酸上含有2′-ome(o-甲基)取代基的混合寡核苷酸序列的合成。混合的2′-ome取代的寡核苷酸与其rna互补序列杂交的强度与rna-rna双链体一样强,而rna-rna双链体比相同序列的rna-dna异源双链体明显更强。因此,在糖的2′位处的取代的实例包括f、cn、cf3、ocf3、ome、ocn、o-烷基、s-烷基、sme、so2me、ono2、no2、nh3、nh2、nh-烷基、och3=ch2和occh。
关于一个分子与另一分子诸如靶多核苷酸的探针的结合的术语“特异性的”或“特异性”是指两个分子之间的识别、接触和稳定的复合物的形成,以及该分子与其他分子的实质上较少的识别、接触或复合物的形成。如本文所用,术语“退火”是指两个分子之间稳定的复合物的形成。
如果探针的至少一个区域与核酸序列的互补序列的至少一个区域具有基本的序列同一性,则该探针对核酸序列“能够退火”。“基本的序列同一性”是至少约80%,优选至少约85%,更优选至少约90%、95%或99%,以及最优选100%的序列同一性。为了确定dna序列和rna序列的序列同一性,通常将u和t视为相同的核苷酸。例如,包含序列atcagc的探针能够与包含序列gcugau的靶rna序列杂交。
如本文所用,术语“裂解剂”是指能够裂解寡核苷酸探针以产生片段的任何方式,包括但不限于酶。对于其中不发生扩增的方法,裂解剂可仅用于裂解、降解或以其他方式分离寡核苷酸探针的第二部分或其片段。裂解剂可以是酶。裂解剂可以是天然的、合成的、未经修饰的或经修饰的。
对于其中发生扩增的方法,裂解剂优选是具有合成(或聚合)活性和核酸酶活性的酶。此类酶通常是核酸扩增酶。核酸扩增酶的实例是核酸聚合酶,诸如水生栖热菌(thermusaquaticus)(taq)dna聚合酶
“核酸聚合酶”是指催化核苷酸并入核酸的酶。示例性的核酸聚合酶包括dna聚合酶、rna聚合酶、末端转移酶、逆转录酶、端粒酶等。
“耐热dna聚合酶”是指在升高的温度达到选择的时间段时,是稳定的(即,抵抗分解或变性)并保留足够的催化活性的dna聚合酶。例如,当在升高的温度下达到使双链核酸变性所需的时间时,耐热dna聚合酶保留足够的活性以进行后续的引物延伸反应。核酸变性所需的加热条件是本领域中众所周知的,并且在美国专利号4,683,202和4,683,195中举例说明。如本文所用,耐热聚合酶通常适用于温度循环反应,诸如聚合酶链式反应(“pcr”)。耐热的核酸聚合酶的实例包括水生栖热菌(thermusaquaticus)taqdna聚合酶、栖热菌属(thermus)物种z05聚合酶、黄栖热菌(thermusflavus)聚合酶、海栖热袍菌(thermotogamaritima)聚合酶,诸如tma-25和tma-30聚合酶、tthdna聚合酶等。
“经修饰的”聚合酶是指其中至少一个单体不同于参考序列的聚合酶,诸如天然或野生型形式的聚合酶或另一种经修饰的形式的聚合酶。示例性修饰包括单体插入、缺失和取代。经修饰的聚合酶还包括嵌合聚合酶,其具有衍生自两个或更多个亲本的可鉴定的成分序列(例如,结构性或功能性结构域等)。在经修饰的聚合酶的定义内还包括包含参考序列的化学修饰的那些。经修饰的聚合酶的实例包括g46ee678gcs5dna聚合酶、g46el329ae678gcs5dna聚合酶、g46el329ad640gs671fcs5dna聚合酶、g46el329ad640gs671fe678gcs5dna聚合酶、g46ee678gcs6dna聚合酶、z05dna聚合酶、δz05聚合酶、δz05-gold聚合酶、δz05r聚合酶、e615gtaqdna聚合酶、e678gtma-25聚合酶、e678gtma-30聚合酶等。
术语“5′至3′核酸酶活性”或“5′-3′核酸酶活性”是指核酸聚合酶的活性,通常与核酸链合成有关,由此从核酸链的5′端去除核苷酸,例如大肠杆菌dna聚合酶i具有此活性,而klenow片段则没有。一些具有5′至3′核酸酶活性的酶是5′至3′核酸外切酶。此类5′至3′核酸外切酶的实例包括:来自枯草芽孢杆菌(b.subtilis)的核酸外切酶、来自脾脏的磷酸二酯酶、λ核酸外切酶、来自酵母的核酸外切酶ii、来自酵母的核酸外切酶v以及来自粗糙脉孢菌(neurosporacrassa)的核酸外切酶。
术语“丙二醇”或“丙二醇间隔基”是指1,3-丙二醇,并且与丙烷-1,3-二醇、1,3-二羟基丙烷和三亚甲基乙二醇同义。术语“heg”或“heg间隔基”是指六甘醇,其与3,6,9,12,15-五氧杂十七烷-1,17-二醇同义。
本发明的各个方面基于核酸聚合酶的特殊性质。核酸聚合酶可具有多种活性,其中包括5′至3′核酸酶活性,由此核酸聚合酶可从退火至其较大的、互补的多核苷酸的寡核苷酸中裂解单核苷酸或小的寡核苷酸。为了有效地进行裂解,上游的寡核苷酸也必须退火至相同的更大的多核苷酸。
可以通过
用于检测靶核酸的5′核酸酶测定法可以采用具有5′至3′核酸外切酶活性的任何聚合酶。因此,在一些实施例中,具有5′-核酸酶活性的聚合酶是耐热的和热活性的核酸聚合酶。此类耐热的聚合酶包括但不限于来自真细菌属栖热菌属(thermus)、栖热袍菌属(thermatoga)和栖热腔菌属(thermosipho)的多个物种的天然和重组形式的聚合酶,以及它们的嵌合形式。例如,可用于本发明方法的栖热菌种聚合酶包括水生栖热菌(taq)dna聚合酶、嗜热栖热菌(tth)dna聚合酶、栖热菌种z05(z05)dna聚合酶、栖热菌种sps17(sps17)和栖热菌种z05(例如,在美国专利号5,405,774;5,352,600;5,079,352;4,889,818;5,466,591;5,618,711;5,674,738和5,795,762中描述的)。可用于本发明方法中的栖热袍菌属(thermatoga)聚合酶包括,例如,海栖热袍菌(thermotogamarmma)dna聚合酶和那不勒斯栖热袍菌(thermotoganeapolitana)dna聚合酶,而可以使用的栖热腔菌(thermosipho)聚合酶的实例是非洲栖热腔菌(thermosiphoafricanus)dna聚合酶。在具有公开号wo92/06200的国际专利申请号pct/us91/07035中公开了海栖热袍菌和非洲栖热腔菌dna聚合酶的序列。那不勒斯栖热袍菌的序列可在国际专利公开号wo97/09451中找到。
在5′核酸酶测定法中,扩增检测通常与扩增同时进行(即“实时”)。在一些实施例中,扩增检测是定量的,并且扩增检测是实时的。在一些实施例中,扩增检测是定性的(例如,靶核酸的存在或不存在的端点检测)。在一些实施例中,扩增检测是在扩增之后。在一些实施例中,扩增检测是定性的,并且扩增检测是在扩增之后。
在本发明中,使用称为加标签的探针的寡核苷酸探针在单个反应容器(例如管、孔)中执行两个或更多个靶核酸的实时pcr扩增和检测,每个加标签的探针均包含两个不同的部分。第一部分是退火部分,并包含与靶核酸序列至少部分互补的序列,使得其能够与靶序列杂交。寡核苷酸探针的第二部分(即加标签的探针)称为标签部分。在一个实施例中,标签部分附着至退火部分的5′末端。在另一个实施例中,标签部分附着至退火部分的3′末端。在另一个实施例中,标签部分经由连接基附着在退火部分的5′末端与3′末端之间的任何位置。标签部分可包含与靶核酸序列不互补的核苷酸序列,并形成不能够与靶核酸结合的“翼”区(关于5′翼探针的图形表示,参见图1)。加标签的探针的退火部分和标签部分可以任选地通过非核苷酸“连接基”分开。该连接基可以由碳、碳和氧、碳和氮或它们的任意组合组成并且可具有任何长度。此外,连接基可以由线性部分或环状部分组成。连接基可以衍生自单个单元或衍生自通过磷酸键分开的多个相同或不同的单元。连接基的目的是在加标签的探针的退火部分和标签部分的交界处产生一个区域。当标签部分与退火部分分离时,连接基还可以防止标签部分被核酸聚合酶延伸。可替代地,对分离的标签部分的另一种修饰使其不能被核酸聚合酶延伸。
下面描述了在5′核酸酶测定法中使用加标签的探针执行实时pcr扩增和靶核酸检测的一般原理。首先,提供怀疑含有靶核酸的样品。然后使样品在单个反应容器(例如,单个试管或多孔微板中的单个孔)内与含有能够生成靶核酸扩增子的寡核苷酸引物和新型寡核苷酸探针两者的pcr试剂接触。pcr扩增通过使用具有5′至3′核酸酶活性的核酸聚合酶开始,从而在每个pcr循环的延伸步骤期间,聚合酶的核酸酶活性可将标签部分从加标签的探针的退火部分裂解和分离。分离的标签部分可以任选地含有修饰(诸如非核苷酸连接基),使得其不能被核酸聚合酶延伸。
然后将分离的标签部分与附着在分子成像芯片上的寡核苷酸杂交。附着的寡核苷酸被称为“moligo”,并且包含两个部分,退火部分和延伸部分,该退火部分包含与加标签的探针的标签部分互补的核苷酸序列,该延伸部分包含与靶核酸序列或与加标签的探针的标签部分不互补的核苷酸序列。moligo充当经分离的标签部分的延伸的模板,该标签部分作为引物,因为它与moligo的退火部分杂交并沿着moligo的延伸部分延伸以形成延伸的双链体分子。然后使用聚焦分子成像检测该延伸的双链体在芯片上的生成。
聚焦分子成像最近已被描述为一种检测生物学样品中分子相互作用的新型分析方法(参见fattinger,c.,physicalreviewx,4,031024,2014;gatterdam,v.等人,naturenanotechnology12,1089-1095,2017)。简而言之,在聚焦分子成像中,相干激光在相互作用位点的相干组装体处被衍射。相干组装体包括相同的相互作用位点的精确亚微米图案,其需要在整个图案上与入射相干光进行相位匹配。在该组装体处衍射的光在受衍射限制的焦点斑(艾里斑(airydisc))进行相长干涉。具有这些特性的分子组装体称为“mologram”。从本质上讲,mologram是由分子组成的合成全息图,它将光散射到衍射极限焦点中,并进行了微调以允许进行分子相互作用分析。通过检测在mologram的焦点处的衍射相干光来实现分子成像信号的采集。分子成像焦点上的光强度与mologram的表面质量密度调制成二次比例关系。随机附着到测定表面的分子的背景散射,本质上通过聚焦分子成像从相干分子成像信号中分离出来。分子成像不需要标记的存在。因此,无标记的分子成像通过检测在mologram中识别位点的纳米环境中微小的相位差变化来对生物分子识别事件进行可视化。这为分析非共价相互作用开辟了新的视角和可能性。
在生物学相互作用的测量中,大多数生物分析方法都面临着背景信号的严重问题或涉及费力的参考程序。尽管诸如基于荧光的技术(例如forster共振能量转移或fret)的某些方法绕开了其中一些问题,但由于使用荧光染料或其他干扰标记,它们可能会干扰所研究的分子相互作用。相比之下,聚焦分子成像将mologram的不可见亲和力调制转换为折射率调制,从而产生聚焦光束,其中亲和力调制是脊和沟之间的靶分子识别位点密度处的差异。通过将感测通道和参考通道的分离程度最小化至最低(小于光波长),同时将数百个参考区域和信号区域嵌入到单个感测点中,可以实现对特异性结合和非特异性结合之间的区分。
为了执行有意义的分子成像测量,需要满足一些仪器要求。聚焦分子成像需要对mologram进行适当的暗场照明,这可以通过高折射率薄膜光波导的引导模式来实现。这样确保了高的信噪比。分子成像还需要识别位点的亚微米级的相干图案,这可以通过为生物芯片开发的各种现有的软光刻方法来创建。一个特定的实施例涉及光可活化的接枝共聚物的使用,类似于serrano等人(macromol.rapidcommun.37,622-629,2016)描述的接枝共聚物,以涂覆五氧化二钽(ta2o5)薄膜光波导。该共聚物具有四个关键特性。(1)在光刻法曝光之前,就其化学特性和光学特性两者而言,测定表面上的共聚物层是整体且均质的。整体层不含有相干排列的分子,因此在光刻法步骤之前,它没有显示出任何分子成像信号。(2)共聚物层对非特异性分子吸附有抗性。尽管该共聚物层在纳米级上表现出缺陷和不规则性,但是这些缺陷没有被相干地排列,并且对分子成像信号没有贡献。(3)共聚物层含有可光活化的官能团,用于通过暴露于光而形成识别位点。(4)形成的共聚物吸附层可以在初始表面涂覆后进行必要的化学修饰和生化修饰,并且足够稳定以在pcr反应过程中进行温度循环。
本发明的实施例将进一步在以下实例中描述,这些实例不限制权利要求中描述的本发明的范围。
实例
实例1可行性研究:溶液中hiv-ltr探针的裂解和延伸
执行实时pcr实验以验证:加标签的探针包含退火部分,该退火部分在靶标hiv-1ltr基因存在的情况下,能与hiv-1ltr基因的一部分杂交并且独特的标签部分会被裂解;以及释放的标签部分将能够退火至“moligo”模板并从“moligo”模板延伸出去,该模板包含与标签部分互补的序列。表1示出了加标签的探针和moligo的核苷酸序列。
表1
在靶标hiv-1ltr基因的存在(flhiv(+))或不存在(flhiv(-))以及在moligo标签3模板的存在或不存在的情况下,在各个孔中进行pcr测定。在测定法结束时,从孔中取出等分试样,并进行hplc色谱法以分析所得产物。实验结果显示在图2的色谱图中。在存在靶基因且不存在标签3moligo的pcr反应中,观察到表示hiv-1ltr标记探针的裂解片段的峰(参见flhiv(+)nomoligo图)。对这些裂解产物峰的仔细检查表明,它们表示了含有完整标签部分的片段,这些片段具有来自退火部分的一个(+1)、两个(+2)、三个(+3)、四个(+4)或五个(+5)核苷酸(请参见图2的右下图)。有趣的是,在存在靶基因和标签3moligo两者的反应中,观察到一个小峰,该峰的大小与全长带标记的moligo互补序列相对应(参见有moligo图的fl(hiv(+))。该结果证明,裂解的标签部分能够与溶液中的moligo模板杂交并延伸出moligo模板,并且提供了在固定于固相上的moligo模板上执行这种类型的测定法的可行性。
实例2通过分子成像对核酸杂交检测的可行性研究
在zeptochip微阵列芯片(zeptosensag,witterswil,switzerland)上执行了通过分子成像检测核酸杂交和延伸的可行性研究,该研究已在pawlakm.等人,proteomics2002;2(4):383-93中进行了描述,其通过引用整体并入本文。将由20mmtris、5mmmgcl2、50mmkcl、ph8.0组成的运行dna缓冲液以15μl/分钟的恒定流速施加到芯片流通系统内的流动室中。首先,将链霉亲和素(sav)作为用于聚焦分子成像的归一化信号注入至表面质量密度调制为520pg/mm2中。没有亲和标签的cdna与固定的sav之间的阴性对照没有产生分子成像信号的任何变化(参见图3(i)),这表示没有发生不需要的相互作用。接下来,以1∶1的比率的100nmsav和生物素化的hiv-ltrmoligo-100作为预复合物,实现了生物素加标签的100bp的hiv-ltrmoligo寡核苷酸(seqidno:4)的固定化。如图3(i)和图3(ii)左侧之间的比较所示,这种预复合物的形成导致了分子成像信号的增加。然后比较固定的hiv-ltrmoligo-100与以下项之间的杂交:22bp引物(at-molo-3(seqidno:3)),该引物可以与moligo-100模板的退火部分结合(图3(iii));或与moligo-100模板完全互补的100bp序列(图3(ii)左侧)。在22bp引物和100bp互补序列的杂交之间的分子成像信号的增加在图4中以图形表示。这表明,分子成像能够区分延伸的裂解的标签与未延伸的裂解的标签。
非正式的序列表
seqidno1:hiv-1ltr标签3探针序列
seqidno2:moligo标签3寡核苷酸序列
seqidno3:at-molo-3寡核苷酸序列
seqidno4:hiv-ltr-moligo-100寡核苷酸序列
- 还没有人留言评论。精彩留言会获得点赞!