优化的用于工业利用单细胞红藻的方法与流程
1.本发明涉及一种为使培养产物增值而优化的用于培养单细胞红藻(ura)的方法,所述培养产物是所获得的生物质、从其中提取的藻蓝蛋白二者或诸如卟啉或蛋白质提取物的其他培养产物。
背景技术:
2.不同的培养微藻类,特别是单细胞红藻(ura)的方法已知用于制造用于工业或食品用途的不同产品。
3.特别地,可以提及的是用于培养和加工用于制造富含蛋白质的食品补充剂或用于制造可用作食用着色剂的藻蓝蛋白的螺旋藻(spirulina)的方法。
4.还可以提及的是用于培养和加工ura以获得相似产品的方法,并且特别是专利申请wo 2017/050917、wo 2017/093345和wo 2018/178334中所述的用于培养和加工嗜硫原始红藻(galdieria sulphuraria)的方法。
5.图1示出了用于培养和加工ura(诸如嗜硫原始红藻)的工业方法。
6.然而,应当注意的是,在ura的生产和加工的每个步骤中,可以进一步改善这些不同的方法。特别地,鉴于当在通常的培养条件下培养时ura(诸如嗜硫原始红藻)会积累大量的糖原的事实、影响特别是对生物质处理(特别是细胞裂解)的条件的糖原量、从生物质分离产物的条件和这些分离产物(特别是藻蓝蛋白)的品质,可以改善这些方法。
7.特别地,重要的是能够优化这些不同的步骤以更好地使获得的产物增值。
技术实现要素:
8.本发明涉及一种优化的用于ura(特别是嗜硫原始红藻)的培养和增值的方法,所述方法包括以下的步骤:(a)ura的发酵培养,(b)从发酵液中分离生物质,如果需要(c)细胞裂解,以及如果需要,步骤(d)从裂解的生物质中提取可增值产物,所述方法包括以下的步骤中的至少一个:
9.(c1)通过研磨同时在研磨过程中将生物质维持在低于50℃的温度来裂解,和/或
10.(a1)在成熟期的情况下进行发酵培养,其中限制输入到培养基中的碳源,和/或
11.(b1)从发酵液中提取卟啉,和/或
12.(d1)以表示总计小于裂解的生物质总体积的4倍的水量通过至少2次连续洗涤从裂解的生物质中提取藻蓝蛋白。
13.本发明还涉及通过所述方法获得的产物,特别是从发酵液中提取的卟啉、生物质、裂解的生物质、分离的蛋白质和/或藻蓝蛋白。
附图说明
14.图1表示用于从嗜硫原始红藻培养物制造不同产物的方法的简化图。
15.图2表示在成熟期的情况下在甘油上以补料分批的模式的嗜硫原始红藻株的生
长。
16.图3表示在成熟期的情况下在甘油上在补料分批培养期间对生物质组成的监测。
17.图4表示在成熟期的情况下在奶渗透物上以补料分批模式的嗜硫原始红藻株的生长。
18.图5表示在成熟期的情况下以补料分批模式在奶渗透物上培养期间对生物质组成的监测。
19.图6表示在没有卟啉产生的情况下在甘油上连续生长的嗜硫原始红藻株的生长监测。
20.图7表示在甘油上连续生长的嗜硫原始红藻的培养过程中对生物质组成的监测。
21.图8表示在葡萄糖上以连续模式的嗜硫原始红藻株的生长监测。
22.图9表示在葡萄糖上连续生长的嗜硫原始红藻的培养期间对生物质组成的监测。
23.图10表示在奶渗透物上以连续模式的嗜硫原始红藻株的生长监测。
24.图11表示在奶渗透物上连续生长的嗜硫原始红藻的培养过程中对生物质组成的监测。
25.图12示出了在不冷却的情况下bertoli hhp研磨数据(1200巴)。
26.图13示出了在冷却的情况下bertoli hhp研磨数据(1200巴)。
27.图14表示在50℃下藻蓝蛋白对调节至不同ph的裂解物的抗性。
28.图15表示珠粒直径对通过球磨机的细胞裂解率的影响。
29.图16表示对于不同体积的水,与用单次洗涤相比,用连续洗涤提取的藻蓝蛋白的量。
具体实施方式
30.在以下和实施方案中更详细地描述了根据本发明的方法的各个步骤。
31.根据本发明,“增值(valorization)”意指允许分离用于工业的有用产物的技术步骤。
32.特别地,根据本发明的方法包括以下连续步骤:
33.(a1)在成熟期的情况下进行发酵培养,所述成熟期包括限制在培养基中的碳源,
34.(b1)如果需要,从发酵液中提取卟啉,
35.(c1)如果需要,通过研磨同时在研磨过程中将生物质维持在低于50℃的温度来裂解,以及
36.(d1)如果需要,以总计小于裂解的生物质总体积的4倍的水量通过至少2次连续洗涤从所述裂解的生物质中提取藻蓝蛋白。
37.更特别地,根据本发明的方法包括以下连续步骤:
38.(a1)在成熟期的情况下进行发酵培养,所述成熟期包括限制在培养基中的碳源,
39.(b1)从发酵液中提取卟啉,
40.(c1)通过研磨同时在研磨过程中将生物质维持在低于50℃的温度来裂解,和
41.(d1)以总计小于裂解的生物质总体积的3倍的水量通过连续洗涤从裂解的生物质中提取藻蓝蛋白。
42.根据本发明的特定的实施方案,所述方法包括至少以下步骤:
43.(a1)通过限制在培养基中的碳源的供应在成熟期的情况下进行发酵培养,以及
44.(b1)从发酵液中提取卟啉。
45.根据本发明的另一个特定的实施方案,所述方法包括至少以下步骤:
46.(c1)通过研磨同时在研磨过程中将生物质维持在低于50℃的温度来裂解,以及如果需要
47.(d1)以总计小于裂解的生物质总体积的3倍的水量通过连续洗涤从裂解的生物质中提取藻蓝蛋白。
48.ura是本领域技术人员熟知的,特别是可被工业培养用于生产生物质及其副产物(蛋白质或藻蓝蛋白)的ura。可以特别提及的是cyanidiale的藻类(或微藻类)。cyanidiale目包括氰化物藻科和原始红藻科,它们本身细分为cyanidioschyzon属、氰化物藻属(cyanidium)和原始红藻属(galdieria),属于其的尤其是以下种:cyanidioschyzon merolae 10d、红藻dbv201、cyanidium caldarum、cyanidium daedalum、cyanidium maximum、cyanidium partitum、cyanidium rumpens、galdieria daedala、galdieria maxima、galdieria partita和嗜硫原始红藻。可以特别提及的是嗜硫原始红藻(也称为高温红藻(cyanidium caldarium))株utex 2919。
49.还可以提及的是已知的藻蓝蛋白生产者,诸如节螺旋藻属(arthrospira)的丝状蓝细菌,它们以螺旋藻的通用名称在工业上培养。
50.在以上提及的微生物中特别鉴定出产生具有高糖原含量的藻蓝蛋白的微生物,特别是节螺旋藻属、螺旋藻属、聚球藻属、cyanidioschyzon属、氰化物藻属或原始红藻属的物种,特别是嗜硫原始红藻。
51.本发明还涉及通过所述方法获得的产物,特别是生物质、从发酵液中分离的卟啉、裂解的生物质、蛋白质和从裂解的生物质中分离的藻蓝蛋白。
52.通过微生物产生的藻蓝蛋白(pc)包括c
‑
藻蓝蛋白(c
‑
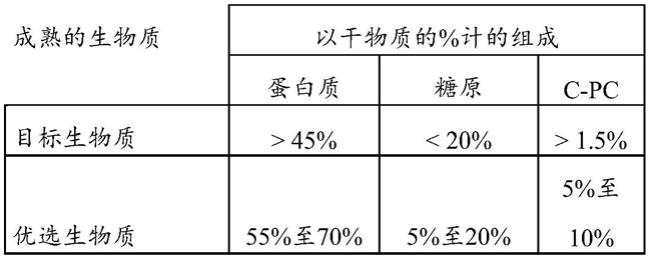
pc)和别藻蓝蛋白。根据本发明,藻蓝蛋白定义为c
‑
pc和别藻蓝蛋白(分离的或以任何比例的混合物),特别是c
‑
pc。
53.ura的培养(a1).
54.在科学文献中已经广泛描述了以异养或混合营养模式的以补料分批或连续模式的ura并且特别是嗜硫原始红藻的发酵培养。
55.产生的生物质不仅包括藻蓝蛋白和蛋白质,还包括储备糖,像糖原。生物质中的糖原含量相对于干物质的总质量的按质量计大约20%至50%。最终生物质中的糖原含量越高,藻蓝蛋白(pc)和蛋白质的浓度越低。由ura(特别是在原始红藻属中)产生的糖原可溶于冷水,并且因此在pc的提取过程中在水相中被发现,这在过滤过程中带来了技术问题(诸如粘度的增加、过滤膜的堵塞、压力积累、糖原在含有藻蓝蛋白的级分中的积累),并且因此获得纯度较低的藻蓝蛋白。本发明允许通过发酵的“引航(piloting)”将糖原水平降低到低于按质量/dm计20%的值。
56.因此,本发明涉及一种用于生产根据本发明的生物质的方法,所述方法包括在成熟期的情况下发酵培养如上定义的ura,所述成熟期包括限制培养基中的碳源的供应。
57.在包含允许细胞生长的各种营养物的培养基上通过发酵进行培养。这些本领域技术人员熟知的培养基包括以允许细胞生长的适当浓度的碳源、氮源、磷源、常量元素、微量元素。
58.特别在补料分批或连续培养模式下实现成熟步骤。
59.碳源可以是本领域技术人员已知的并且可以用于培养ura并且特别是嗜硫原始红藻的任何碳源,诸如多元醇(特别是甘油)、糖(诸如葡萄糖或蔗糖或者乳糖)或包含乳糖的复合培养基(诸如奶渗透物、血清渗透物、酪乳及其混合物并且特别是奶渗透物)。
60.已知的是一些碳质底物(诸如葡萄糖)强烈抑制pc合成,而另一些则不怎么抑制。然而,对于工业pc生产方法的可行性,必须考虑许多经济参数,并且特别是原料的成本。因此,碳源(诸如含有乳糖的奶渗透物)的使用不允许pc产率与甘油一样高,但是使用奶渗透物的方法的整体经济性仍然是有利的,因为它是难以再循环的乳制品工业的副产物。更有利的是,实现根据本发明的方法使得有可能获得具有低糖原含量的高细胞密度,这有利于在方法结束时提取pc。
61.成熟后获得的生物质具有以下组成:
[0062][0063]
对于这两种培养方法通过限制碳源来实现成熟期的具体条件在以下描述。
[0064]
分批/补料分批培养.
[0065]
在补料分批培养中,根据本发明的发酵培养方法包括在包含如上定义的碳源的培养基中的第一细胞生长期,以便获得在培养基中至少30g/l dm的细胞密度。本领域技术人员将了解如何限定适于获得这样的细胞密度和特别是碳源含量的培养基组成,特别是关于特别是在专利申请wo 2017/050917、wo 2017/093345和wo 2018/178334中描述的现有技术方法。
[0066]
一旦获得了所希望的细胞密度,就进行“成熟”期,所述“成熟”期包括向藻株断供有机碳底物。
[0067]
根据本发明的特定的实施方案,一旦处于生长期的培养物达到至少30g/l dm、优选至少80g/l dm、更优先地至少100g/l干物质,就会触发成熟期。
[0068]
在补料分批阶段期间,用包含至少100g/l碳底物、优选至少200g/l碳底物、更优先地至少500g/l碳底物的补料培养基向培养物补料。为了限制在补料分批阶段糖原的积累。本领域技术人员将了解如何限定允许在发酵汁(fermentation must)中具有低于5g/l、优选低于1g/l、更优先地低于0.1g/l的碳质底物含量的补料率。
[0069]
生长期之后是成熟期。在此成熟期中,由于在生长期间积累的储备糖(特别是糖原)的消耗,观察到干质量/升汁(must)的降低。同时,可以观察到藻蓝蛋白量/克干物质的增加。对于蛋白质含量也是如此。这种成熟过程允许获得低糖原含量的生物质。
[0070]
根据本发明的第一实施方案,将培养物用不包含碳源的成熟补料培养基补料。应当理解,在成熟补料培养基包含可检测的痕量碳源的情况下,也观察到碳源不存在。
[0071]
根据本发明的优选的实施方案,断供是完全的,即不再用培养基向细胞补料,所述
细胞通过以发酵汁的残余元素和它们的细胞储备为食来启动它们的成熟。
[0072]
有利地,获得的生物质包含相对于干物质的质量(%dm)按质量计小于20%的糖原、优选小于15%dm、更优选小于10%dm。
[0073]
根据培养温度,成熟时间可以或多或少地长。温度越接近生长的最佳温度,成熟期将越短。
[0074]
也有可能通过以下方式进行补料分批模式的培养:同时进行生长期和成熟期,通过碳源供应施加较低的生长速率,从而限制了藻株中糖原的积累。根据藻株的最大生长速率来确定此成熟的生长速率,根据本领域技术人员将能够确定所述最大生长速率。此生长速率应当小于藻株最大生长速率的80%、优先地小于藻株最大生长速率的70%、更优先地小于藻株最大生长速率的50%。
[0075]
根据本发明的方法在补料分批模式下使得有可能获得包含至少70g/ldm的发酵汁(图4)和具有至少10mg/g dm的pc(特别是c
‑
pc)含量(图5)和至少40%dm的蛋白质含量(图5)的生物质。
[0076]
连续培养.
[0077]
sloth等人,2006已经描述了具有底物限制的连续生长,其中检测水平低于0.05g/l,这被作者认为是分析的检测限。在这种情况下,补料培养基被连续地供应至培养物,但是几乎被细胞瞬间消耗,并且因此是不可定量的。本论文作者的目的是限制对pc合成的抑制,所述pc合成与培养基中显著的葡萄糖(已知葡萄糖会抑制pc合成)浓度有联系。在这些条件下,pc含量非常低,约28mg/g干物质,其中生物质含量约5g/l干物质。
[0078]
本发明的目的是进行连续培养,以与补料分批培养相比增加生物质和pc生产率。通过根据本发明的方法,有可能达到65
‑
70g/l或甚至更高的干质量以及包括在25与90mg/g dm之间或甚至更高的pc含量。
[0079]
根据本发明的第一实施方案,通过将一部分发酵汁从连续培养物转移到没有营养供应的罐中来实现成熟期。与上述补料分批培养模式一样,糖原含量随之降低,并且藻蓝蛋白和蛋白质含量增加。
[0080]
本领域技术人员将了解如何根据已知的参数(诸如在不补料的情况下维持生物质的温度)以及和根据所希望的目标来确定成熟所必需的时间。此成熟时间将是至少12h、优先地至少48h、更优先地至少72h。
[0081]
也可以经由补料培养基的流速通过施加降低的生长速率来同时实现生长步骤和成熟步骤。有利地,生长速率小于0.06h
‑
1、优先地小于0.03h
‑
1、更优先地小于0.015h
‑
1。
[0082]
有利地,生长速率小于藻株最大生长速率的80%、优先地小于藻株最大生长速率的60%、更优先地小于藻株最大生长速率的40%。在图7中,在培养400h之后,生长速率降低到低于最大生长速率的80%的值,从而与最初施加的生长速率相比,增加了生物质中的pc和蛋白质含量并且降低了糖原含量。
[0083]
碳源含量确保获得至少65g/l、或甚至至少70g/l、更特别地至少80g/l的干物质含量。
[0084]
在单独或同时成熟的情况下如此获得的生物质具有小于20%、有利地小于15%或甚至小于10%的糖原含量。获得的生物质具有至少45%、有利地至少50%dm的蛋白质含量。
[0085]
藻蓝蛋白含量,特别是c
‑
pc,将是至少20mg/g dm,有利地从25至50mg/g dm。对于
某些碳源(诸如多元醇),可以达到超过50mg/g dm的c
‑
pc含量。
[0086]
发酵汁中卟啉的产生(b.1).
[0087]
若干项研究显示,藻蓝蛋白和叶绿素合成途径中的几个关键步骤是通过光诱导的,并且其他步骤在培养基中存在有机底物的情况下被抑制(foley等人,1982;brown等人,1982;troxler等人,1989;rhie and beale,1994;stadnichuck等人,1998)。根据文献,异养培养导致在生长培养基中粪卟啉的排泄,并且在从粪卟啉原iii转换到原卟啉原ix的过程中导致细胞中色素含量(藻蓝蛋白和叶绿素)的降低。在混合营养条件下,光诱导光合色素的生物合成和卟啉向环境中的排泄。从一种形式的卟啉到另一种形式的转换有时通过自发反应完成,因此有可能在生长培养基中找到几种形式的卟啉(brown等人,1982;stadnichuck等人,1998)。
[0088]
与文献中描述的相反,只要培养基中存在有机碳源,特别是葡萄糖、甘油、乳糖或蔗糖,根据本发明的方法的实现就不会导致卟啉排泄。在补料分批和连续培养两者中,仅在成熟期(培养基中不含有机碳)中检测到卟啉。当在成熟期后将有机底物添加到培养基中时,可以观察到细胞对卟啉的再消耗,并且在发酵液中这些卟啉恢复到不可检测的水平。
[0089]
在根据本发明的成熟期后,获得发酵汁,其包含富含如上定义的蛋白质和pc的具有低糖原含量的生物质和含有卟啉的液体。
[0090]
通过ura(特别是通过嗜硫原始红藻)产生的这些卟啉是可用于例如处理线虫的天然螯合剂(us 2006/0206946)。一些分子(诸如原卟啉ix)也可能在通过光疗治疗癌症的医学领域中引起关注(huang等人,2015)。
[0091]
因此,本发明涉及一种方法,其包括回收发酵液并且从此液体中提取卟啉的步骤。
[0092]
通过所有通常的生物质分离方法,特别是通过本领域技术人员熟知的离心(板式离心或双锥筒体离心机(sedicanter))或通过过滤(板式过滤器、压滤、陶瓷或有机切向过滤)回收发酵液。
[0093]
卟啉可以通过通常的方法,像色谱法(亲和色谱法或尺寸排阻色谱法)来提取。
[0094]
可以纯化提取的卟啉,并且然后包装以用于进一步使用,特别是在疗法中。
[0095]
生物质的研磨(c.1).
[0096]
为了从生物质中提取藻蓝蛋白和/或蛋白质,必须进行细胞裂解,所述细胞裂解将释放所希望的产物。ura并且特别是嗜硫原始红藻具有非常大抗性的细胞壁,这使得通过通常的方法进行裂解变得困难,除非操作条件诸如会降解所希望的藻蓝蛋白。
[0097]
回收的产物(藻蓝蛋白和/或蛋白质)的产率不仅取决于生物质中产物的含量,而且还取决于从此生物质中提取最大量的能力。这种提取能力将取决于细胞裂解的效率,而且还取决于在不导致藻蓝蛋白大量降解的条件下所述提取的实现。
[0098]
研磨基于两个主要问题:研磨率和由机械摩擦产生的热量。在藻蓝蛋白的情况下,这种热控制甚至更重要,因为所述藻蓝蛋白是热敏分子。在实施例7所述的条件下用bertoli型高压均质机进行测试。用高压均质机研磨需要多个道次以达到一致的裂解率。尽管连续3个道次,但是嗜硫原始红藻生物质的道次处理不允许获得高于40%的裂解率。在每个道次时,都可以观察到温度升高,直到达到呈绿褐色的温度约70℃的生物质,在这种情况下大多数藻蓝蛋白被降解。
[0099]
因此,本发明涉及一种用于裂解ura细胞(特别是嗜硫原始红藻)的方法,其特征在
于通过用球磨机研磨同时在研磨期间将ura生物质维持在低于50℃的温度来裂解。
[0100]
本发明包括在研磨期间在研磨室内调节生物质的温度,使得其不超过50℃、优先地47℃、更优先地40℃和更低。这种温度控制可以通过磨机夹套的水冷却系统或通过将先前冷却到温度低于20℃的生物质注入磨机中来完成。
[0101]
根据本发明的研磨方法可以应用于生物质,而不管其获得方式(发酵模式和分离)。特别适用并且优选的是通过上述根据本发明的培养方法获得的生物质具有降低的糖原含量。
[0102]
本发明还涉及如此获得的裂解的生物质。
[0103]
诸位发明人已经发现,与未研磨的生物质相比,根据本发明研磨的生物质提供了更好的蛋白质消化率。这种消化率的改善已经通过体外消化率测试(boisen和fernandez,1995)得到证实。
[0104]
样品消化率总蛋白质螺旋藻属79.3(
±
2)%68.2(
±
2)%嗜硫原始红藻(g.sulphuraria)(研磨)92.2(
±
2)%63.4(
±
1.9)%嗜硫原始红藻(未研磨)66(
±
2)%63.9(
±
1.9)%
[0105]
因此,本发明涉及一种研磨的ura生物质,并且特别涉及一种可通过根据本发明的研磨方法获得的嗜硫原始红藻生物质。
[0106]
本发明特别涉及一种下述组成的研磨的嗜硫原始红藻生物质。
[0107]
营养因子 能量值394(
±
22)kcal/100g蛋白质64.8(
±
9.3)g/100g脂质6.15(
±
0.5)g/100g纤维7.65(
±
5.16)g/100g碳水化合物16.1(
±
2.2)g/100g灰分4.1(
±
0.6)g/100g湿度4.1(
±
0.6)g/100g藻蓝蛋白7(
±
0.3)g/100g
[0108]
氨基酸组成在下表中给出。
[0109][0110][0111]
脂质组成如下:
[0112][0113]
本发明还涉及这种研磨的生物质作为食品补充剂或用于人类或动物消费的食品的用途。
[0114]
藻蓝蛋白的提取(d1).
[0115]
本发明还涉及一种用于从裂解的ura细胞(特别是嗜硫原始红藻)的生物质中提取藻蓝蛋白的方法,其特征在于所述方法包括以表示总计小于裂解的生物质总体积的4倍、优选从2至3倍、更优先地约3倍的水量的连续洗涤。
[0116]
此裂解的生物质包含不溶性细胞残余物在水溶液中的悬浮液,所述水溶液包含在细胞裂解后溶解的各种细胞提取物,包括藻蓝蛋白。所述裂解的生物质有利地包含至少2%、优先地至少5%、更优先地至少7%的干物质。
[0117]
提取所需的水的总体积(vw)是作为待处理的裂解的生物质的体积(vb)的函数来计算的,并且将表示此体积的至多4倍(vw/vb小于或等于4)。当然,有可能用更大总体积的水来实现本发明,但是由于之后要处理大量的水回收藻蓝蛋白,因此所述方法的经济性仍然不太令人感兴趣。
[0118]
然后将此总体积的水分为几个部分,这些部分将用于通过对生物质进行多道处理来提取藻蓝蛋白,所述部分的数量(n)是至少2、优选至少3。本领域技术人员可以计划用多于3个部分的水进行提取,同时考虑所述方法的实现的所有经济参数,诸如固定设备的成本价格和生物质的重复处理。优选地,部分的数量是3。
[0119]
根据本发明的第一实施方案,所述部分具有彼此不同的相应体积。根据本发明的另一个实施方案,所有部分具有等于vw/n的相同体积。
[0120]
本领域技术人员将了解如何确定部分的数量和每个部分的相应体积,以便优化他或她将实现的藻蓝蛋白制备方法。
[0121]
需要连续洗涤沉淀的不溶性元素,以从生物质中提取适当量的藻蓝蛋白。几次洗涤后,沉淀中的c
‑
pc和apc的比例相反。从图16中清楚地看出,更好的是用连续小体积的水而不是用相等的大体积的水来提取藻蓝蛋白(图16)。
[0122]
在y轴上,并且从图的左侧开始,存在三个块s1、s2和s3,其对应于用3份等体积的水进行的3次连续提取,水的总体积vw对于第一个块是生物质体积vb的1倍(1/2连续稀释),对于第二个块是2倍(1/3连续稀释)并且对于第三个块是3倍(1/4连续稀释)。条s1给出通过第一提取而提取的pc值。条s2给出通过第一和第二提取而提取的pc的累积值。条s3给出连续使用的3个部分的累积值。然后存在用不同体积的水的5个单独提取试验,从5x至12x。
[0123]
从图16中可以看出,在第一提取中较大的初始体积的水给出高达一定极限的较好结果(5x至12x)。使用连续提取方法,可以在提取效率和减少用水量方面看到实际收益。例如,3次连续提取给出比单次提取更好的结果,并且将所使用的水总量减少为至少2倍。
[0124]
可以单独处理从包括藻蓝蛋白的每次连续提取中回收的洗涤水以回收藻蓝蛋白或合并,然后进行这种回收。
[0125]
根据本发明的提取方法适用于ura(特别是嗜硫原始红藻)的任何裂解的生物质,与生物质产生所用的培养方法和细胞裂解所用的方法无关。优先地,根据本发明的提取方法特别适用于通过上述根据本发明的方法获得的具有低糖原含量的生物质和/或适用于通过上述根据本发明的研磨方法裂解的生物质。
[0126]
通常处理所得的藻蓝蛋白溶液以分离藻蓝蛋白。用于从水溶液中回收藻蓝蛋白的方法是技术人员熟知的。可以特别提及的是专利申请wo2018/178334中所述的酸沉淀。
[0127]
它也可以通过选择性沉淀来分离,所述选择性沉淀包括将初始溶液的ph调节至在藻蓝蛋白较难溶解的ph值的范围(也称为不稳定性范围)内选择的值,并且将藻蓝蛋白浓缩
在溶液中以促进其沉淀,然后回收沉淀的藻蓝蛋白。对于由嗜硫原始红藻产生的耐酸藻蓝蛋白,这种不稳定性范围特别是从ph4.4至5.5。当然,本领域技术人员将了解如何通过简单的实验来确定由其他ura产生的其他藻蓝蛋白的这种不稳定性范围。这种方法特别描述于2019年1月11日提交的专利申请fr 1900278中。
[0128]
在回收藻蓝蛋白之前,还可以通过糖原的酶降解来处理水溶液以降低其糖原含量。当将多糖裂解为甚至更易溶的低分子量多糖时,很可能随着藻蓝蛋白的沉淀而被带走的痕量的这些多糖(已经很低)甚至降低更多。此外,当通过切向过滤进行浓缩步骤时,低分子量多糖与溶液中的其他小分子一起被消除,这有利于获得具有甚至更高藻蓝蛋白含量的溶液。特别地,糖原的酶裂解在室温下在5或更低、优选约4.5的ph下进行。这些温度和ph条件特别适于在酶反应过程中保留藻蓝蛋白。在酸性ph和室温条件下具有活性的酶选自已知具有α1
‑
4葡萄糖醛酸酶、α1
‑
4葡萄糖苷酶(或α
‑
葡萄糖苷酶)活性的酶。可以特别提及的是已知降解果胶的果胶酶,并且特别是从丝状真菌(诸如曲霉属(aspergillus))中提取的果胶酶,更特别是从棘孢曲霉(aspergillus aculeatus)中提取的果胶酶(诸如由novozymes公司以名称销售的酶)。除α1
‑
4葡萄糖醛酸酶或α1
‑
4葡萄糖苷酶外,还可以用α1
‑
6葡萄糖苷酶进行糖原的酶裂解。在以上阐述的ph和温度条件下具有活性的α1
‑
6葡萄糖苷酶也是本领域技术人员已知的。特别地,这些是已知水解普鲁兰多糖的α1
‑
6糖苷键,特别已知去除淀粉分支的普鲁兰酶。这些通常是从细菌,特别是从芽孢杆菌属(bacillus)中提取的酶。us 6,074,854、us 5,817,498和wo2009/075682描述了从bacillus deramificans或嗜酸普鲁兰芽孢杆菌(bacillus acidopullulyticus)提取的此类普鲁兰酶。可商购获得的普鲁兰酶也是已知的,特别是以名称“promozyme d2”(novozymes)、“novozym 26062”(novozymes)和“optimax l 1000”(dupont
‑
genencor)。应当注意,普鲁兰酶/α
‑
淀粉酶混合物描述于现有技术中,但是特别地用于从淀粉生产葡萄糖糖浆(us 2017/159090)。本领域技术人员将了解如何确定适当的反应条件以最佳地减少糖原的量,这取决于待处理溶液中的初始糖原含量、所用酶的量以及产生的藻蓝蛋白所寻求的纯度。这种方法特别描述于2019年1月11日提交的专利申请fr 1900278中。
[0129]
然后可以通过本领域技术人员已知的方法(诸如渗滤)来纯化回收的藻蓝蛋白。
[0130]
通过根据本发明的提取方法获得的藻蓝蛋白具有至少2、优选至少3或甚至高于4的纯度指数。通过用moon等人(2014)描述的方法进行吸光度测量来测量这种纯度指数。
[0131]
有利地,获得的藻蓝蛋白是具有低于6、有利地低于4、优选低于3、更优先地低于2.5、甚至更优先地低于1的糖原/藻蓝蛋白比率(基于干重)的藻蓝蛋白。
[0132]
本发明还涉及获得的藻蓝蛋白作为着色剂,特别是作为食品着色剂的用途。本发明还涉及固体或液体食品,特别是包含通过根据本发明的提取方法获得的藻蓝蛋白的饮料。
[0133]
还回收洗涤后剩余的固体残余物。它是一种富含蛋白质的生物质残余物,其也可以用于制备食品补充剂或用于人类或动物消费的食品。
[0134]
根据特定的实施方案,洗涤所述裂解的生物质包括将所述生物质悬浮液酸化至小于或等于5的ph。藻蓝蛋白提取后获得的残余生物质包含基于干物质至少60%蛋白质,和基于干物质至少小于20%的总糖含量和/或基于干物质小于10%的糖原含量和/或基于干物质至少5%的脂肪含量。这种用于回收富含蛋白质的生物质的方法特别描述于2018年9月5
macromol.2016;89:12
‑
8]所述的提取方法在不同的培养时间进行糖原含量/克干物质的估计。
[0153]
实施例1:在甘油上在成熟期的情况下的补料分批发酵.
[0154]
培养基.
[0155]
起始物:30g/l甘油、8g/l(nh4)2so4、250mg/l kh2po4、716mg/l mgso4、44mg/l cacl2,2h2o、0.2843849g/l k2so4、0.07g/l feso4,7h2o、0.01236g/l na2edta、0.00657g/l znso4,7h2o、0.0004385g/l cocl2,6h2o、0.00728g/l mncl2,4h2o、0.005976g/l(nh4)6mo7o
24
,4h2o、0.005976g/l cuso4,5h2o、0.00016g/l navo3、0.01144g/l h3bo3、0.00068g/l na2seo3。
[0156]
结果呈现于图2和3中。
[0157]
实施例2:在成熟期的情况下在葡萄糖上的补料分批发酵.
[0158]
培养基.
[0159]
起始物:30g/l葡萄糖、8g/l(nh4)2so4、250mg/l kh2po4、716mg/l mgso4、44mg/l cacl2,2h2o、0.2843849g/l k2so4、0.07g/l feso4,7h2o、0.01236g/l na2edta、0.00657g/l znso4,7h2o、0.0004385g/l cocl2,6h2o、0.00728g/l mncl2,4h2o、0.005976g/l(nh4)6mo7o
24
,4h2o、0.005976g/l cuso4,5h2o、0.00016g/l navo3、0.01144g/l h3bo3、0.00068g/l na2seo3。
[0160]
结果呈现于图4和5中。
[0161]
实施例3:在成熟期的情况下在蔗糖上的补料分批发酵
[0162]
培养基
[0163]
起始物:30g/l蔗糖、8g/l(nh4)2so4、250mg/l kh2po4、716mg/l mgso4、44mg/l cacl2,2h2o、0.2843849g/l k2so4、0.07g/l feso4,7h2o、0.01236g/l na2edta、0.00657g/l znso4,7h2o、0.0004385g/l cocl2,6h2o、0.00728g/l mncl2,4h2o、0.005976g/l(nh4)6mo7o
24
,4h2o、0.005976g/l cuso4,5h2o、0.00016g/l navo3、0.01144g/l h3bo3、0.00068g/l na2seo3。
[0164]
结果示出在图6和7中。
[0165]
实施例4:在成熟期的情况下在奶渗透物上的补料分批发酵.
[0166]
培养基.
[0167]
起始物:30g/l奶渗透物、8g/l(nh4)2so4、716mg/l mgso4、0.07g/l feso4,7h20、0.01236g/l na2edta、0.00657g/l znso4,7h2o、0.0004385g/l cocl2,6h2o、0.00728g/l mncl2,4h2o、0.005976g/l(nh4)6mo7o
24
,4h2o、0.005976g/l cuso4,5h2o、0.00016g/l navo3、0.01144g/l h3bo3、0.00068g/l na2seo3。
[0168]
结果呈现于图8和9中。
[0169]
实施例5:原始红藻属藻株在甘油上的连续培养.
[0170]
培养基.
[0171]
起始物:起始物:30g/l甘油、8g/l(nh4)2so4、250mg/l kh2po4、716mg/l mgso4、44mg/l cacl2,2h2o、0.2843849g/l k2so4、0.07g/l feso4,7h20、0.01236g/l na2edta、0.00657g/l znso4,7h2o、0.0004385g/l cocl2,6h2o、0.00728g/l mncl2,4h2o、0.005976g/l(nh4)6mo7o24,4h2o、0.005976g/l cuso4,5h2o、0.00016g/l navo3、
0.01144g/l h3bo3、0.00068g/l na2seo3。
[0172]
结果示出在图10和11中。
[0173]
实施例6:原始红藻属藻株在奶渗透物上的连续培养.
[0174]
培养基.
[0175]
起始物:起始物:30g/l奶渗透物、8g/l(nh4)2so4、716mg/l mgso4、0.2843849g/l k2so4、0.07g/l feso4,7h2o、0.01236g/l na2edta、0.00657g/l znso4,7h2o、0.0004385g/l cocl2,6h2o、0.00728g/l mncl2,4h2o、0.005976g/l(nh4)6mo7o
24
,4h2o、0.005976g/l cuso4,5h2o、0.00016g/l navo3、0.01144g/l h3bo3、0.00068g/l na2seo3。
[0176]
结果示出在图12和13中。
[0177]
实施例7:没有生物质冷却的hhp研磨.
[0178]
程序.
[0179]
将来自连续培养物的生物质通过连续离心洗涤,然后浓缩至1.4.10
10
个细胞/ml的浓度。然后将体积为1l的生物质冷却至16℃,然后在bertoli原子均质机上以1200巴经历3次连续均质化,在各系列之间不冷却。对于它们中的每一个,监测生物质的温度、通过用malassez细胞计数的细胞裂解以及生物质中藻蓝蛋白的浓度。
[0180]
对于3次连续均质化所测量的研磨温度分别是46.7℃、57.6℃和67℃。
[0181]
未裂解的细胞的百分比和藻蓝蛋白含量在图12中给出。
[0182]
实施例8:具有生物质冷却的hhp研磨.
[0183]
程序.
[0184]
将来自连续培养物的生物质通过连续离心洗涤,并且然后浓缩至2.10
10
个细胞/ml的浓度。然后将体积为1l的生物质冷却至16℃,然后在bertoli原子均质机上以1200巴经历3次连续均质化。在每次均质化之间,使生物质的温度恢复到16℃。以相同的方式,监测生物质的温度、通过用malassez细胞计数的细胞裂解以及生物质中藻蓝蛋白的浓度。
[0185]
在研磨过程开始和结束时测量的生物质温度如下。
[0186]
研磨开始时的t
°
16℃16.1℃15.4℃14.4℃研磨结束时的t
°
42℃45.2℃47.7℃46℃
[0187]
未裂解的细胞的百分比和藻蓝蛋白含量在图13中给出。
[0188]
还发现,研磨的生物质的ph越大酸性,藻蓝蛋白对热降解越敏感。因此,优选在研磨细胞之前将它们的ph调节至在5与7之间,而不管研磨方法是否伴随着热量的释放。
[0189]
实施例9:在生物质中藻蓝蛋白的热敏性.
[0190]
程序.
[0191]
将来自连续培养物的生物质通过连续离心洗涤并且浓缩至150mg/g的干物质,然后在允许保留色素和90%的裂解率的条件下通过球磨机(wab,multilab)进行研磨。将裂解物样品调节至ph 2.4至6,并且在范围为50℃至70℃的不同温度下进行从0至120分钟的动力学。每次进行藻蓝蛋白的定量。
[0192]
结果在图14中示出。
[0193]
实施例10:珠粒尺寸对研磨和温度控制的影响.
[0194]
程序.
[0195]
将嗜硫原始红藻细胞在20 000g下离心5min并且然后重新悬浮于10mm tris
‑
cl缓
冲液ph 7中。将2ml safelock eppendorf管用此悬浮液填充1/3体积的细胞等分试样,另外的1/3用测试直径(netzsch 0.8mm;0.6mm;0.3mm;plus 0.2mm;nano 0.2mm;plus 0.1mm;和0.05mm)的陶瓷珠粒填充。将管置于tissuelyser ii仪器(qiagen)中并且在30hz下振摇2min。通过与不含珠粒的对照管相比的malassez细胞计数计算裂解率。
[0196]
结果在图15中示出。
[0197]
可以看出,珠粒的直径极大地影响研磨效率。随着珠粒直径的减小,裂解率增加,直到对于直径为0.2mm的珠粒其达到最佳情况。低于此直径,裂解效率再次降低,直到对于直径为0.05mm的珠粒其达到最低比率。
[0198]
如果增加研磨时间,则可以用较大的珠粒实现接近100%的研磨率。然而,增加研磨时间导致研磨室中的温度随着施加的球磨机进料率而升高。这种温度升高以裂解的生物质中的藻蓝蛋白含量为代价。
[0199]
实施例11:室填充率对研磨率的影响.
[0200]
程序.
[0201]
将细胞在来自wab的multilab模型球磨机中进行研磨。将研磨室用0.8mm直径的陶瓷珠粒填充50%和65%。65%填充率是最大填充率。在这两种情况下,研磨模块的速度和流速是相同的。碾磨出口处的裂解率是通过与未碾磨的输入生物质相比的malassez细胞中的计数来计算的。
[0202]
可以看出,当室处于制造商推荐的最大填充率(即65%)时,获得最佳裂解率。当填充率低于65%时,裂解率降低。
[0203]
实施例12:细胞浓度对研磨率和温度控制的影响.
[0204]
程序.
[0205]
将细胞在来自wab的multilab模型球磨机中进行研磨。将研磨室用0.8mm直径的陶瓷珠粒以65%比率进行填充。在所有情况下,研磨模块的速度和流速是相同的。碾磨出口处的裂解率是通过与未碾磨的输入生物质相比的malassez细胞计数来计算的。
[0206]
可以看出,对于相同的研磨参数(研磨模块速度、进料率、室填充率、珠粒直径),无论待研磨产物中的细胞浓度(10%、20%或30%干物质的生物质)多少,获得的裂解率都是相等的。但是,应当注意,输入产物的干质量越高,离开磨机的裂解物的温度就越高。为了通过增加输入干质量来提高碾磨步骤的生产率,还必须提供适于将裂解物温度维持在低于45℃的冷却能力。
[0207]
实施例13:工业球磨机上的流速的估计.
[0208]
材料与方法.
[0209]
藻株:嗜硫原始红藻(也称为高温红藻)utex#2919
[0210]
程序.
[0211]
将细胞在来自wab的multilab模型球磨机中进行研磨。将研磨室(600ml)用0.8mm直径的陶瓷珠粒以65%比率进行填充。在这两种情况下,研磨模块的速度和进料率是相同的。磨机出口处的裂解率是通过与未碾磨的输入生物质相比的malassez细胞计数来计算的。对于95%
‑
100%的研磨率,在这些条件下施加的流速是在1与2升/小时之间。使用实施例10中获得的结果对这些流速进行外推。
biology,biotechnology,foods and medicine.applied microbiology and biotechnology 80,1(2008):1 14.
[0224]
‑
cruz de jes
ú
s,ver
ó
nica,gabriel alfonso guti
é
rrez
‑
rebolledo,marcela hern
á
ndez
‑
ortega,lourdes valadez
‑
carmona,ang
é
lica mojica
‑
villegas,gabriela guti
é
rrez
‑
salme
á
n,et german chamorro
‑
cevallos.“methods for extraction,isolation and purification of c
‑
phycocyanin:50 years of research in review”3,no 1(2016).
[0225]
‑
montalescot v,rinaldi t,touchard r,jubeau s,frappart m,jaouen p,bourseau p,et marchal l.optimization of bead milling parameters for the cell disruption of microalgae:process modeling and application to porphyridium cruentum and nannochloropsis oculata.bioresource technology 196(2015):33946.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1