紫色红曲菌comp52324_c4基因过表达菌株的构建方法及其应用
本发明涉及一种紫色红曲菌comp52324_c4基因过表达菌株的构建方法,属于生物基因工程领域。
背景技术:
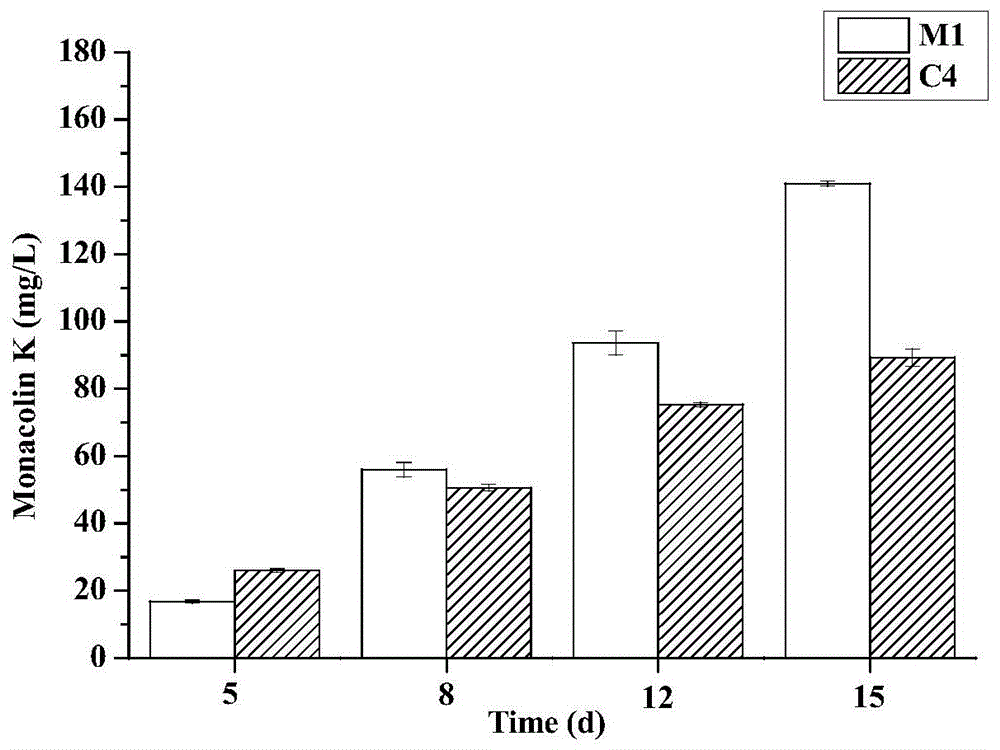
:红曲菌是一种嗜酸性丝状腐生真菌,在许多亚洲国家特别是东亚地区作为传统食品加工的微生物。它的次级代谢产物主要包括monacolink、红曲色素、桔霉素、麦角固醇、γ-氨基丁酸等。monacolink是红曲菌产生的一种聚酮类次级代谢产物,具有降血压的功效,可以治疗心血管疾病且疗效显著。技术实现要素:本发明所要解决的技术问题是提供一种紫色红曲菌comp52324_c4基因过表达菌株的构建方法。本发明通过研究发现,紫色红曲菌中comp52324_c4基因可以抑制和降低紫色红曲菌的monacolink产量。为解决上述技术问题,本发明采用的技术方案是:利用基因过表达技术对comp52324_c4基因进行过表达,通过电击转化方式将重组质粒导入红曲菌原生质体,并成功筛选出重组菌株。comp52324_c4基因序列如下:gagtcgctggaggggtaatttccatcggaggacgaggcagttgaccagggctgcctgtactcggagtaagtagagataagtgaatcggtggctgtctcacagccatgactcgggagcgcacgcagaggtgcggttcttgcagcaggaatgagaattcttgattcttgagagcagtagggtattcgcaaaaaagacgggatcgtagactcttttcaggtcgagaagcgcagcgataaggacttttgccacgcgaaggttcttctaagaggtaccggaaatggtcagaattcagccaatcgaggctggagaagcatagtagtcaatgctgtatatatgacgacacgaaggagcgttggaaatagaagtatcatcgactagagaaccgtggtcgaagagaaacgaatgttgcggaagtctggatgaaaaatcacagcagagggacagagatagatagaagacgtgcgggacgataaaagcagcagcgtcgaagacatggcgaagggaagatagatgaacagcgtcggataaagcacagaagaaagagaagaagctgaaggaaggcgaaaaagaaacggcgacgcgaggaaaaggaaaagcaaccggcgatgacttcatcctgcatccgtttttggcaatgcagcaactctaaccaactccttctcttgccttctctttctcttctcctcctctttctctatcttcgtctcttcgcactgattgacttcacaatggcagctgcaacgggcatttcctctcattttccccttcctcctccccttcagcccttctcttcttcctcttcctccgcttcatcttgactcgccggtctttcgtttgattattcgctcgttattttgatcagcccattcgtttggcccttcaggcgctgtcttatccttgtatgccatatttcagcaatcctacatacccgtatcct本发明还提供一种紫色红曲菌comp52324_c4基因过表达菌株的构建方法,包括下列步骤:(1)菌株培养由北京工商大学食品添加剂工程技术中心保存的紫色红曲菌m1(菌种号:cgmcc.30568),将m1菌株在固体培养基(g/l)上活化2代,取菌液接种到种子培养基(g/l)中,30℃、200r/min培养2d,按10%的接种量将种子液接种到发酵养基(g/l)中,30℃、150r/min培养2d,再25℃、150r/min培养13d。(2)comp52324_c4基因过表达菌株的构建设计引物序列如下:c4-f:gagtcgctggaggggtaatttc;c4-r:aggatacgggtatgtaggattg。利用上述引物进行comp52324_c4目的基因扩增,以pbargpe-hygro(武汉淼灵生物公司)为过表达载体,通过dnaman软件选出该载体上的两个单一酶切位点,通过双酶切将扩增出的comp52324_c4目的基因进行连接,构建过表达pbargpe-hygro-c4重组质粒。将重组质粒转入大肠杆菌dh5α感受态细胞中,并进行重组质粒的提取和验证。(3)过表达质粒转化将红曲霉m1接种于pda培养基平板上,在30℃恒温培养箱中培养4d。在每个培养皿中加入10ml灭菌水,用接种环轻轻刮擦细菌表面以释放孢子,制备孢子悬浮液。将孢子悬液(200μl)涂在置于pda板上的灭菌玻璃纸盘上,涂布至干燥,在30℃下培养30-40h。将生长在玻璃纸盘上的淡粉色菌丝体用接种环刮除,置于单层mira布上,过滤并用50ml硫酸镁溶液洗涤。过滤灭菌后的菌丝体转移到50ml的溶解酶溶液中,在30℃和60rpm下消化2.5-3h,然后通过单层mira布再次过滤。滤液在4℃下以7000转/分离心5分钟,并丢弃上清液。然后用1.2moll-1山梨醇溶液过滤样品两次(随后离心,并去除上清液)。原生质体在山梨醇溶液中重新悬浮,并保存在冰上以备将来使用。将红曲霉m1活性细胞悬液(100μl)涂在pda平板上。采用电击转化法,将成功构建的高表达质粒导入红曲原生质体中,根据潮霉素b浓度筛选结果筛选转化子。(4)过表达菌株的筛选和验证将在潮霉素b抗性平板上筛选得到的阳性红曲菌转化子连续传5代,旨在筛选稳定遗传的转化子。对红曲菌阳性转化子中的monacolink产量进行检测,初步证明过表达菌株构建成功。利用阳性转化子的rna,将其反转录为cdna为模板,用hygro-f、hygro-r引物来扩增潮霉素基因。如果目的菌株能扩增出潮霉素基因,而对照菌株未能扩增出潮霉素基因,则证明过表达质粒在红曲菌中表达,进而证明过表达菌株构建成功。hygro-f、hygro-r引物如下:hygro-f:atgaaaaagcctgaactc;hygro-r:tctttgccctcggacg。在申请人前期的研究中,实验室前期利用高通量测序技术对紫色红曲菌m1的转录组进行分析,发现comp52324_c4基因对降低红曲菌monacolink产量具有明显作用。本发明的有益效果:本发明成功克隆出紫色红曲菌m1菌株中的comp52324_c4基因,验证其存在,并成功构建了过表达质粒pbargpe-hygro-c4,导入红曲菌m1菌株中,成功构建了过表达工程菌株。结果显示,与野生型m1相比,过表达comp52324_c4菌株第15天monacolink产量降低了36.66%。附图说明图1是过表达comp52324_c4菌株和野生型m1的monacolink产量比较。图2是重组质粒电泳图谱。图3.潮霉素b对紫色红曲菌m1耐受浓度的筛选。图4过表达菌株monacolink及其生物量的检测。图5过表达菌株和m1菌株产色素检测。图6过表达菌株和m1菌株在不同放大倍数下的扫描电镜照片。图7-图15分别是moka,mokb,mokc,mokd,moke,mokf,mokg,mokh,moki基因表达量变化。具体实施方式实施例1本实施例提供一种紫色红曲菌comp52324_c4基因过表达菌株,该菌株可以显著降低红曲monacolink产量。结果见图1,与野生型m1相比,过表达comp52324_c4菌株第15天monacolink产量降低了36.66%。实施例2本实施例具体提供一种紫色红曲菌comp52324_c4基因过表达菌株的构建方法,并按照下列实验方法进行。具体过程和步骤如下:2.1菌株及培养条件由北京工商大学食品添加剂工程技术中心保存的紫色红曲菌m1(菌种号:cgmcc.3.0568),将m1菌株在固体培养基(g/l)(葡萄糖20g,蛋白胨3g,酵母浸粉4g,麦芽浸粉20g,琼脂20g,kh2po42g,nano32g,mgso4.7h2o1g)上活化2代,取适量菌液接种到种子培养基(g/l)(葡萄糖30g,豆粕粉15g,蛋白胨10g,甘油70g,kh2po42g,nano32g,mgso4.7h2o1g)中,30℃、200r/min培养2d,按10%的接种量将种子液接种到发酵养基((g/l):甘油90g,大米粉20g,蛋白胨10g,kh2po42.5g,nano35g,mgso4.7h2o1g,znso4.7h2o2g)中,30℃、150r/min培养2d,再25℃、150r/min培养13d。2.2comp52338基因过表达菌株的构建根据已获得的红曲菌中comp52324_c4的基因序列设计引物,利用primerpremier5.0软件,设计引物(表1)。本实验以pbargpe-hygro(武汉淼灵生物公司)为过表达载体,通过dnaman软件选出该载体上的两个单一酶切位点,通过双酶切将扩增出的comp52324_c4目的基因进行连接,构建过表达pbargpe-hygro-c4重组质粒。将重组质粒转入大肠杆菌dh5α感受态细胞中,并进行重组质粒的提取和验证。2.3过表达质粒转化将红曲霉m1接种于pda培养基平板上,在30℃恒温培养箱中培养4d。在每个培养皿中加入10ml灭菌水,用接种环轻轻刮擦细菌表面以释放孢子,制备孢子悬浮液。将孢子悬液(200μl)涂在置于pda板上的灭菌玻璃纸盘上,涂布至干燥,在30℃下培养30-40h。将生长在玻璃纸盘上的淡粉色菌丝体用接种环刮除,置于单层mira布上,过滤并用50ml硫酸镁溶液洗涤。过滤灭菌后的菌丝体转移到50ml的溶解酶溶液中,在30℃和60rpm下消化2.5-3h,然后通过单层mira布再次过滤。滤液在4℃下以7000转/分离心5分钟,并丢弃上清液。然后用1.2moll-1山梨醇溶液过滤样品两次(随后离心,并去除上清液)。原生质体在山梨醇溶液中重新悬浮,并保存在冰上以备将来使用。将红曲霉m1活性细胞悬液(100μl)涂在pda平板上。采用电击转化法,将成功构建的高表达质粒导入红曲原生质体中,根据潮霉素b浓度筛选结果筛选转化子。2.4过表达菌株的筛选和验证将在潮霉素b抗性平板上筛选得到的阳性红曲菌转化子连续传5代,旨在筛选稳定遗传的转化子。对红曲菌阳性转化子中的monacolink产量进行检测,初步证明过表达菌株构建成功。利用阳性转化子的rna,将其反转录为cdna为模板,用hygro-f、hygro-r引物来扩增潮霉素基因。如果目的菌株能扩增出潮霉素基因,而对照菌株未能扩增出潮霉素基因,则证明过表达质粒在红曲菌中表达,进而证明过表达菌株构建成功。2.5色价检测发酵液的预处理:取发酵液5ml,加入15ml70%的乙醇溶液,于恒温水浴锅60℃浸提1h,静置。用分光光度计测定410、448、505nm处吸光值。利用公式:红曲色素色价(u/ml)=吸光值×稀释倍数,计算得出。2.6干重测定采用干重法测菌丝体生物量。取5ml发酵液用3层纱布过滤,再用蒸馏水洗涤2-3次,拧干水分,在60℃烘箱中烘干至恒重,即为菌丝体干重。2.7扫描电镜处理培养8d的红曲菌菌体,12000r/min离心5min收集菌体细胞,将细胞重悬(用枪头吹打,吹打时注意不要将细胞吸入枪头造成细胞损失)于2.5%戊二醛溶液(pbs缓冲溶液稀释)固定12h。用0.1m磷酸盐缓冲液(pbs,ph7.2)漂洗细胞两次(两次重悬离心)弃去上清液。依次用不同浓度的乙醇溶液(30%,50%,70%,80%,90%,100%)对细胞进行脱水,每种浓度静置10min,12000r/min离心5min(每种浓度重复两次),弃去上清液。先把菌体重悬于醋酸异戊酯与乙醇(v:v=1:1)中,再重悬与醋酸异戊酯溶液中,以对细胞进行乙醇置换。将细胞重悬于每种溶剂中静置10min,12000r/min离心5min,弃去上清液。加入溶剂六甲基二硅胺(hexamethyldisilazane,hmds),用量没过样品即可,用脱脂棉将离心管口塞上,置于60℃烘箱干燥直至样品成粉末状,留待观察。2.8monacolink合成相关基因的转录量分析1.菌体的收集及处理分别取不同培养天数的红曲菌发酵液置于2ml离心管中,用无菌水洗涤离心直至上清液不再呈红色,吸除离心管中残余水分。首先进行红曲菌rna的提取,再将其反转录成cdna以用于荧光定量分析。2.引物的设计与合成用olige7.37软件,根据ncbi网站公开的红曲菌合成monacolink关键基因组序列,选取moka、mokb、mokc、mokd、moke、mokf、mokg、mokh、moki九段基因组、内参基因gapdh以及c3基因序列,表1为设计得到的rt-qpcr的引物序列,由华大基因科技有限公司制备合成。表1关键基因的引物序列1.荧光定量分析根据天根生化科技(北京)有限公司的superreal荧光定量预混试剂增强版(sybrgreen)试剂盒说明书设计反应体系并进行扩增。操作方法如下:(1)rt-qpcr反应体系:本研究反应体系如下表2所示。表2荧光定量pcr反应体系组成成分20μl体系2×superrealpremixplus10μl正向引物(10μm)0.6μl反向引物(10μm)0.6μlcdna模板1μlrnase-freeddh2o补足至20μl(2)rt-qpcr反应条件:1)95℃for15min;2)95℃for10sec;3)52℃for20sec;4)72℃for30sec;5)goto2,40moretimes;6)meltcurve65℃to95℃:increment0.5℃5sec;(3)提前设置好反应程序,荧光定量pcr仪中放入样品,开始反应。3结果3.1重组质粒的验证为了验证重组质粒是否构建成功,首先进行双酶切验证,并以原质粒做对照。对重组质粒pbargpe1-hygro-c4进行双酶切后,得到两段大小分别在6000bp左右和900bp左右的清晰条带,与目标条带大小一致。(图2b)再对重组质粒pbargpe1-hygro-c4进行电泳验证,发现长度在6900bp左右,均符合目的基因片段与原质粒长度之和。(图2d)3.2过表达菌株潮霉素基因的pcr验证通过hplc初步筛选出高产monacolink的转化子后,对c4-9菌株进行潮霉素基因的pcr验证。分别提取红曲菌m1菌株和c4-9菌株的rna,再将其反转录成cdna。以cdna为模板,hygro-f和hygro-r为引物进行扩增潮霉素基因。结果显示,对照菌株红曲菌m1菌株未能扩增出明显条带,而c4-9菌株能扩增出1000bp左右条带,与预期结果一致。证明c4-9过表达菌株构建成功。(图2f)3.3重组质粒转化子的筛选选取100μl红曲菌孢子悬液分别涂布于不同浓度梯度的潮霉素b抗性平板上。潮霉素浓度增长的同时,m1菌株的菌落数减少,最终选择潮霉素b的最佳筛选抑制浓度为10μg/ml。在随后的过表达质粒的转化子的筛选过程中,实验发现当潮霉素b浓度为10μg/ml时,加入质粒的红曲菌菌株有菌落生长,而未加入质粒的红曲菌m1菌株则无菌落生长。因此,挑取潮霉素b浓度为10μg/ml抗性板上的菌落,从而成功获得具有潮霉素b抗性的转化子。(图3)将分别获得的11株转化子在具有潮霉素b抗性的平板上传5代,再进行发酵培养。将c4的11株转化子与m1进行发酵培养后,取菌液处理,利用hplc测定monacolink产量。结果发现在c4的11株菌株中,第9株(编号为c4-9)产量最低,达到51mg/l(图4b)。因此实验选择c4-9分别作为目标菌株。3.4生物量通过比较c4-9和m1菌株在不同发酵天数下菌丝干重的差异,研究了comp52324_c4基因过表达对红曲霉菌丝生长的影响。结果显示c4-9和m1菌株的菌丝体生长趋势相似,差异不显著。(图4d)3.5过表达菌株红曲色素产量检测通过紫外分光光度计分别检测2,5,8,12,15d的c4-9菌株和m1菌株的红曲红色素、红曲橙色素和红曲黄色素。三种色素的产量变化总体呈现上升趋势,在第15d时产量达到最高。c4-9和m1菌株对比,三种色素在第15d时产量达到最高,在第15d时,c4-9菌株三种色素产量与m1相比分别提高了16%,19.76%,23.05%。(图5)3.6过表达菌株微观菌体形态的检测扫描电镜观察c4-9和m1菌株菌丝体的形态差异。对比相同倍数下的c4-9菌株和m1菌株的菌丝体,发现在凹陷程度和颗粒数上没有显著变化,但c4-9菌株的褶皱程度比m1菌株更多(图6b)3.7monacolink生物合成基因转录水平检测利用rt-qpcr技术检测过表达菌株c4-9和野生型菌株中monacolink生物合成基因簇上moka-moki九段基因的表达量。结果如图7-15所示,moka基因的表达量在发酵第12天较m1菌株下降了71.24%,在第15天下降了94.14%。在发酵第12天,c4-9菌株的大多数基因的表达量较m1菌株下调,包括moka,mokb,mokc,mokd,moke,mokf,mokg,mokh,moki基因等,其中mokc基因表达量下降了86.26%。序列表<110>北京工商大学<120>紫色红曲菌comp52324_c4基因过表达菌株的构建方法及其应用<160>2<170>siposequencelisting1.0<210>1<211>22<212>dna<213>人工序列(artificialsequence)<400>1gagtcgctggaggggtaatttc22<210>2<211>22<212>dna<213>人工序列(artificialsequence)<400>2aggatacgggtatgtaggattg22当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1