一种防治太子参病害的假单胞菌以及分离筛选鉴定方法与应用
本发明涉及植物病害防治技术领域,具体涉及一种防治病害的假单胞菌以及分离筛选鉴定方法与应用。
背景技术:
太子参为石竹科植物孩儿参pseudostellariaheterophylla(miq.)paxexpaxethoffm.的干燥块根,具有益气健脾、生津润肺的功效。现代药理学研究表明太子参具有降糖、改善慢性心衰、抗氧化活性等作用。在人工栽培过程中,太子参存在严重的连作障碍问题,主要表现为病害频发,常见病害有立枯病、叶斑病、根腐病等,发病率逐年加重,相关报道表明,同地块上连作2年比正茬的减产30%左右,连作3年以上的比正茬的减产50%以上,导致太子参药材产量和质量下降,给药农造成较大经济损失。在太子参病害防治过程中,目前参农主要是使用霜霉威盐酸盐、氟吡菌胺、溴氰菊酯等化学药剂来对病害进行防治,但过量使用化学药品会导致生态平衡破坏、农药残留量增加、病原菌抗药性提高、土壤呈强酸化等不良影响。寻找一类既能保护环境也能够有效预防植物病害的新方法成为当下太子参栽培过程中急需解决的问题。
在农作物、蔬菜、水果中病害防治中,我国目前生物农药制品中比较成熟有200多种,针对中药材病害防治的生物农药比较少。本研究中从太子参植株中分离得到了假单胞菌,具有较强的抗逆性,对人畜无毒无害,对环境友好。同时该菌对太子参的叶斑病、立枯病、根腐病、紫纹羽病等多种病原菌具有明显的抑制作用,可作为生防杀菌剂用于太子参多种病原菌病害的防治。
技术实现要素:
本发明的目的是提供一种防治太子参病害的假单胞菌bbh16-1;
本发明的另一目的是提供一种防治病害的假单胞菌分离筛选方法;
本发明的另一目的是提供一种防治病害的假单胞菌鉴定方法;
本发明的另一目的是提供假单胞菌bbh16-1菌株在制备太子参拮抗剂中的应用。
本发明的另一目的是提供的假单胞菌bbh16-1菌株在制备镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌、球毛壳菌、裂褶菌、鸡腿菇菌、黑外皮球菌、可可毛色二孢菌、微扁沃利雅炭皮菌等太子参病原菌拮抗剂中的应用。
本发明所述假单胞菌为假单胞菌bbh16-1。
本发明所述的假单胞菌bbh16-1的分离筛选方法具体为:
1)收集新鲜的太子参叶片和块根用水冲洗干净;
2)用灭菌的剪刀切成碎片置于研钵中;
3)按照0.5~1.5g叶片和块根组织加入10mlpbs溶液,超声15~25min后收集悬液,采用10倍体积比例依次稀释至10-2,得到含菌稀释液;
4)取10-2稀释浓度的100μl含菌稀释液涂布于pda平板上,每个处理三个重复;
5)25~30℃培养1~3d后,挑取表型差异的单菌落划线于lb培养基进行纯化培养;
6)鉴定分离的菌株假单胞菌;
7)采用平皿对峙培养法筛选假单胞菌;
镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌接种于pda培养基平板表面,20~30℃培养2~4d制备新鲜菌丝;
8)用1ml枪头打孔挑取新鲜镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌丝块,接种于pda平板中央,同时在其四周3cm处等距的四点分别接种培养20~28h的细菌菌液,以接菌大肠杆菌dh5α为阴性对照,每个处理重复三次;
9)所有处理于20~30℃下培养2~4d,即得假单胞菌:假单胞菌bbh16-1。
优选的,本发明所述的假单胞菌bbh16-1的分离筛选方法具体为:
1)收集新鲜的太子参叶片和块根用水冲洗干净;
2)用灭菌的剪刀切成碎片置于研钵中;
3)按照1g叶片和块根组织加入10mlpbs溶液,超声20min后收集悬液,采用10倍体积比例依次稀释至10-2,得到含菌稀释液;
4)取10-2稀释浓度的100μl含菌稀释液涂布于pda平板上,每个处理三个重复;
5)28℃培养2d后,挑取表型差异的单菌落划线于lb培养基进行纯化培养;
6)鉴定分离的菌株假单胞菌;
7)采用平皿对峙培养法筛选假单胞菌;
镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌接种于pda培养基平板表面,25℃培养3d制备新鲜菌丝;
8)用1ml枪头打孔挑取新鲜镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌丝块,接种于pda平板中央,同时在其四周3cm处等距的四点分别接种培养24h的细菌菌液,以接菌大肠杆菌dh5α为阴性对照,每个处理重复三次;
9)所有处理于25℃下培养3d,即得假单胞菌:假单胞菌bbh16-1。
本发明所述pda培养基的配方如下:马铃薯160~230g,葡萄糖15~25g,磷酸二氢钾0.5~2.1g,七水硫酸镁0.3~0.7g,琼脂10~20g。
优选的,本发明所述pda培养基的配方如下:马铃薯200g,葡萄糖20g,磷酸二氢钾1.5g,七水硫酸镁0.5g,琼脂15g。
本发明所述的pda培养基如下:将马铃薯煮沸4~6min后用纱布过滤收集滤液,添加葡萄糖,磷酸二氢钾,七水硫酸镁,琼脂,蒸馏水定容至0.5~1.5l。
本发明所述lb培养基的配方如下:胰蛋白胨5~15g,酵母提取物2~8g,氯化钠5~15g,琼脂10~20g,蒸馏水定容至0.5~1.5l。
优选的本发明所述lb培养基的配方如下:胰蛋白胨10g,酵母提取物5g,氯化钠10g,琼脂15g,蒸馏水定容至1l。
本发明所述鉴定方法包括形态学鉴定及生物学鉴定,具体如下:
1)形态学鉴定
将假单胞菌bbh16-1菌株接种到lb培养基培养48h后,可见lb培养基上菌落黄白色菌落,菌落圆形,边缘整齐透明。
2)分子生物学鉴定
将假单胞菌bbh16-1菌株于lb培养基培养48h后,采用ctab/nacl提取方法提取基因组dna,提取后先后用苯酚-氯仿-异戊醇(25:24:1)和氯仿-异戊醇(24:1)抽提和无菌水溶解,利用特异性引物扩增v3v4rdna并测序,测序序列长度为408bp,序列编号为seqidno.1;
测序引物dna序列:
v3v4rdna(正向引物):ctacgggmsgcagcag;
v3v4rdna(反向引物):ggactachvgggtwtctaat;
在ncbi中genbank数据库中,将bbh16-1菌株的v3v4rdna序列采用blastn检索,鉴定。
本发明所述的假单胞菌bbh16-1菌株在制备中药材及农作物拮抗剂中的应用。
优选的,本发明所述假单胞菌bbh16-1菌株在制备镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌、球毛壳菌、裂褶菌、鸡腿菇菌、黑外皮球菌、可可毛色二孢菌、微扁沃利雅炭皮菌等太子参病原菌拮抗剂中的应用。
有益效果:
本发明与现有技术相比,具有以下有益效果:
1、现有技术存在的问题:在太子参病害防治过程中,目前参农主要是使用霜霉威盐酸盐、氟吡菌胺、溴氰菊酯等化学药剂来对病害进行防治,但过量使用化学药品会导致生态平衡破坏、农药残留量增加、病原菌抗药性提高、土壤呈强酸化等不良影响。
本发明解决了上述问题:使用本发明的一种防治太子参病害的假单胞菌分离筛选、鉴定方法得到的假单胞菌bbh16-1菌株,该菌株在制备镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌、球毛壳菌、裂褶菌、鸡腿菇菌、黑外皮球菌、可可毛色二孢菌、微扁沃利雅炭皮菌等太子参病原菌拮抗剂中的应用。解决了化学药品会导致生态平衡破坏、农药残留量增加、病原菌抗药性提高、土壤呈强酸化等不良影响的问题。
2、本发明通过假单胞菌bbh16-1广谱抑菌试验证实,假单胞菌bbh16-1菌株对太子参燕麦镰刀菌的抑制率为29.3%、三线镰刀菌的抑制率为28.0%、互隔交链格孢菌的抑制率为31.8%、富克葡萄孢盘菌的抑制率为68.0%、米根霉菌的抑制率为31.7%、球毛壳菌的抑制率为21.8%、裂褶菌的抑制率为36.1%、鸡腿菇菌的抑制率为51.8%、黑外皮球菌的抑制率为40.5%、可可毛色二孢菌的抑制率为34.0%、微扁沃利雅炭皮菌的抑制率为36.7%,说明假单胞菌bbh16-1菌株对上述病原菌具有明显抑制作用。
3、本发明通过对bbh16-1菌株发酵液降低病原菌镰刀菌在太子参块根中的定殖试验证实,bbh16-1菌株发酵液可以有效的降低病原菌在太子参块根中的定殖能力。
4、本发明通过对bbh16-1菌株发酵液对太子参病害防治的田间小区试验证实,bbh16-1菌株发酵液可以有效的抑制太子参病害的发生;经过bbh16-1菌株发酵液的喷雾处理后,太子参在黄平县和施秉县两个实验点的病情指数于清水对照组相比均有显著的降低,防治效果分别为33.4%和47.3%,在施秉县试验点优于商品杀菌剂多菌灵(26.5%);bbh16-1菌株发酵液在抑制太子参发病的同时,其鲜品产量也明显增加,在施秉县和黄平县两个试验点的增产率分别为20.7%和35.7%,均优于多菌灵处理组。
分离的菌株命名为:假单胞菌bbh16-1(pseudomonassp.bbh16-1);
保藏单位:中国典型培养物保藏中心(cctcc);
保藏地址:中国武汉武汉大学
保藏日期:2020年12月25日;
保藏编号:cctccno:m2020971。
附图说明
序列表是本发明分离的假单胞菌bbh16-1菌株v3v4rdna序列、扩增v3v4rdna序列的正向引物序列、扩增v3v4rdna序列的反向引物序列。
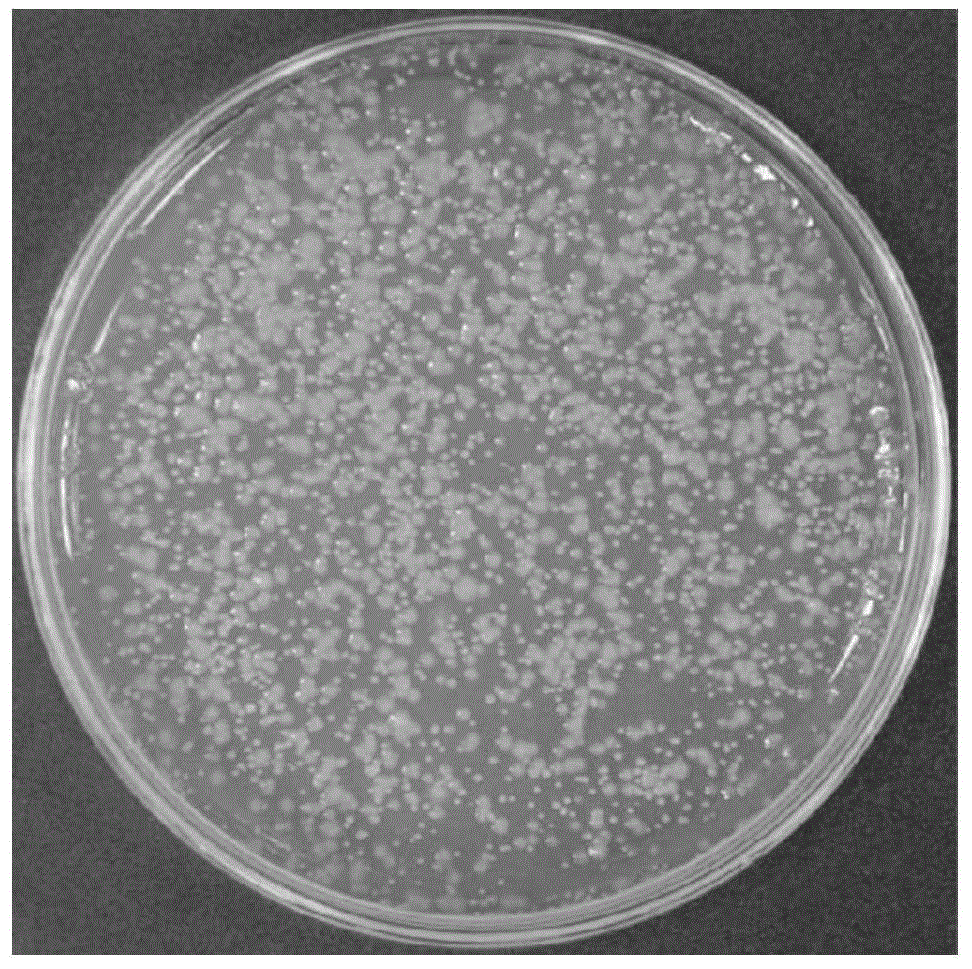
图1假单胞菌bbh16-1在lb培养基上培养48h后菌落形态。
图2假单胞菌bbh16-1对多种病原菌菌丝生长抑制作用结果。
图3假单胞菌bbh16-1菌株与其他近缘物种rdna系统发育树。
图4假单胞菌bbh16-1发酵液防治太子参病害田间小区试验效果图。
具体实施方式
下面通过具体实施例,对本发明的技术方案作进一步地具体说明。
实施例1防治太子参病害的假单胞菌分离筛选方法
1)收集新鲜的太子参叶片和块根用水冲洗干净;
2)用灭菌的剪刀切成碎片置于研钵中;
3)按照1g叶片和块根组织加入10mlpbs溶液,超声20min后收集悬液,采用10倍体积比例依次稀释至10-2,得到含菌稀释液;
4)取10-2稀释浓度的100μl含菌稀释液涂布于pda平板上,每个处理三个重复;
5)28℃培养2d后,挑取表型差异的单菌落划线于lb培养基进行纯化培养;
6)鉴定分离的菌株假单胞菌;
7)采用平皿对峙培养法筛选假单胞菌,镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌种置于pda培养基平板表面,25℃培养3d制备新鲜菌丝;
8)用1ml枪头打孔挑取新鲜镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌丝块,接种于pda平板中央,同时在其四周3cm处等距的四点分别接种培养24h的细菌菌液,以接菌大肠杆菌dh5α为阴性对照,每个处理重复三次;
9)所有处理于25℃下培养3d,即得假单胞菌:假单胞菌bbh16-1。
应用:假单胞菌bbh16-1菌株应用于制备太子参病原菌拮抗剂,尤其是应用于制备镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌、球毛壳菌、裂褶菌、鸡腿菇菌、黑外皮球菌、可可毛色二孢菌、微扁沃利雅炭皮菌等太子参病原菌拮抗剂。
实施例2防治太子参病害的假单胞菌分离筛选方法
1)收集新鲜的太子参叶片和块根用水冲洗干净;
2)用灭菌的剪刀切成碎片置于研钵中;
3)按照0.5g叶片和块根组织加入10mlpbs溶液,超声15min后收集悬液,采用10倍体积比例依次稀释至10-2,得到含菌稀释液;
4)取10-2稀释浓度的100μl含菌稀释液涂布于pda平板上,每个处理三个重复;
5)25℃培养1d后,挑取表型差异的单菌落划线于lb培养基进行纯化培养;
6)鉴定分离的菌株假单胞菌;
7)采用平皿对峙培养法筛选假单胞菌,镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌种置于pda培养基平板表面,20℃培养2d制备新鲜菌丝;
8)用1ml枪头打孔挑取新鲜镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌丝块,接种于pda平板中央,同时在其四周3cm处等距的四点分别接种培养20h的细菌菌液,以接菌大肠杆菌dh5α为阴性对照,每个处理重复三次;
9)所有处理于20℃下培养2d,即得假单胞菌:假单胞菌bbh16-1。
应用:假单胞菌bbh16-1菌株应用于制备太子参病原菌拮抗剂,尤其是应用于制备镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌、球毛壳菌、裂褶菌、鸡腿菇菌、黑外皮球菌、可可毛色二孢菌、微扁沃利雅炭皮菌等太子参病原菌拮抗剂中的应用。
实施例3防治太子参病害的假单胞菌分离筛选方法
1)收集新鲜的太子参叶片和块根用水冲洗干净;
2)用灭菌的剪刀切成碎片置于研钵中;
3)按照1.5g叶片和块根组织加入10mlpbs溶液,超声25min后收集悬液,采用10倍体积比例依次稀释至10-2,得到含菌稀释液;
4)取10-2稀释浓度的100μl含菌稀释液涂布于pda平板上,每个处理三个重复;
5)30℃培养3d后,挑取表型差异的单菌落划线于lb培养基进行纯化培养;
6)鉴定分离的菌株假单胞菌;
7)采用平皿对峙培养法筛选假单胞菌,镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌接种于pda培养基平板表面,30℃培养4d制备新鲜菌丝;
8)用1ml枪头打孔挑取新鲜镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌丝块,接种于pda平板中央,同时在其四周3cm处等距的四点分别接种培养28h的细菌菌液,以接菌大肠杆菌dh5α为阴性对照,每个处理重复三次;
9)所有处理于30℃下培养4d,即得假单胞菌:假单胞菌bbh16-1。
应用:假单胞菌bbh16-1菌株应用于制备太子参病原菌拮抗剂,尤其是应用于制备镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌、球毛壳菌、裂褶菌、鸡腿菇菌、黑外皮球菌、可可毛色二孢菌、微扁沃利雅炭皮菌等太子参病原菌拮抗剂。
实施例1-3使用的pda培养基按实施例4-11任一pda培养基的配方及制备方法实施。
实施例1-3使用的lb培养基按实施例12-14任一lb培养基的配方及制备方法实施。
实施例4pda培养基
配方:马铃薯200g,葡萄糖20g,磷酸二氢钾1.5g,七水硫酸镁0.5g,琼脂15g。
制备方法:
将马铃薯煮沸5min后用纱布过滤收集滤液,添加葡萄糖,磷酸二氢钾,七水硫酸镁,琼脂,蒸馏水定容至1.0l。
实施例5pda培养基
配方:马铃薯200g,葡萄糖20g,磷酸二氢钾1.5g,七水硫酸镁0.5g,琼脂15g。
制备方法:
将马铃薯煮沸4min后用纱布过滤收集滤液,添加葡萄糖,磷酸二氢钾,七水硫酸镁,琼脂,蒸馏水定容至1.5l。
实施例6pda培养基
配方:马铃薯200g,葡萄糖20g,磷酸二氢钾1.5g,七水硫酸镁0.5g,琼脂15g。
制备方法:
将马铃薯煮沸6min后用纱布过滤收集滤液,添加葡萄糖,磷酸二氢钾,七水硫酸镁,琼脂,蒸馏水定容至0.5l。
实施例7pda培养基
配方:马铃薯160g,葡萄糖15g,磷酸二氢钾0.5g,七水硫酸镁0.3g,琼脂10g。
制备方法:
将马铃薯煮沸5min后用纱布过滤收集滤液,添加葡萄糖,磷酸二氢钾,七水硫酸镁,琼脂,蒸馏水定容至1.0l。
实施例8pda培养基
配方:马铃薯160g,葡萄糖15g,磷酸二氢钾0.5g,七水硫酸镁0.3g,琼脂10g。
制备方法:
将马铃薯煮沸5min后用纱布过滤收集滤液,添加葡萄糖,磷酸二氢钾,七水硫酸镁,琼脂,蒸馏水定容至0.5l。
实施例9pda培养基
配方:马铃薯160g,葡萄糖15g,磷酸二氢钾0.5g,七水硫酸镁0.3g,琼脂10g。
制备方法:
将马铃薯煮沸5min后用纱布过滤收集滤液,添加葡萄糖,磷酸二氢钾,七水硫酸镁,琼脂,蒸馏水定容至1.5l。
实施例10pda培养基
配方:马铃薯230g,葡萄糖25g,磷酸二氢钾2.1g,七水硫酸镁0.7g,琼脂20g。
制备方法:
将马铃薯煮沸5min后用纱布过滤收集滤液,添加葡萄糖,磷酸二氢钾,七水硫酸镁,琼脂,蒸馏水定容至0.5l。
实施例11pda培养基
配方:马铃薯230g,葡萄糖25g,磷酸二氢钾2.1g,七水硫酸镁0.7g,琼脂20g。
制备方法:
将马铃薯煮沸5min后用纱布过滤收集滤液,添加葡萄糖,磷酸二氢钾,七水硫酸镁,琼脂,蒸馏水定容至1.5l。
实施例12lb培养基
胰蛋白胨10g,酵母提取物5g,氯化钠10g,琼脂15g,蒸馏水定容至1l。
实施例13lb培养基
胰蛋白胨5g,酵母提取物2g,氯化钠5g,琼脂10g,蒸馏水定容至0.5l。
实施例14lb培养基
胰蛋白胨15g,酵母提取物8g,氯化钠15g,琼脂20g,蒸馏水定容至1.5l。
实施例1-3按实施例15鉴定方法鉴定
实施例15假单胞菌bbh16-1的鉴定方法
1)形态学鉴定
将假单胞菌bbh16-1菌株接种到lb培养基培养48h后,可见lb培养基上菌落黄白色菌落,菌落圆形,边缘整齐透明。
2)分子生物学鉴定
将假单胞菌bbh16-1菌株于lb培养基培养48h后,采用ctab/nacl提取方法提取基因组dna,提取后先后用苯酚-氯仿-异戊醇(25:24:1)和氯仿-异戊醇(24:1)抽提和无菌水溶解,利用特异性引物扩增v3v4rdna并测序,测序序列长度为408bp,序列编号为seqidno.1;
测序引物dna序列:
v3v4rdna(正向引物):ctacgggmsgcagcag;
v3v4rdna(反向引物):ggactachvgggtwtctaat;
在ncbi中genbank数据库中,将bbh16-1菌株的v3v4rdna序列采用blastn检索,鉴定。
为了进一步验证本发明的有效性与可行性,发明人进行了一系列的试验,具体如下:
试验设备:超净工作台(上海捷迅实业有限公司医疗设备厂,bsd-50),光照恒温培养箱(天津市泰斯特仪器有限公司,gzx-400ef),自动蒸汽灭菌锅(tomykogyo,es-315),超声波清洗机(宁波新芝生物科技股份有限公司,sb25-12dtd),台式冷冻离心机(eppendorf,centrifuges810r),恒温水浴锅(天津市泰斯特仪器有限公司,dr-98-ⅱ),核酸定量仪(thermo,nanodrop2000),pcr扩增仪(bio-rad,c1000);电泳仪(bio-rad,powerpacbasic),凝胶成像仪(bio-rad,chemidoctmtouchimagingsystem),纯水制备系统(fdeer,fl-up-jx-30),ph酸度计(mettler,toledo),移液器(eppendorf,research)。
试验试剂:葡萄糖(天津市永大化学试剂有限公司),磷酸二氢钾(天津市科密欧化学试剂有限公司),硫酸镁(天津市永大化学试剂有限公司),胰蛋白胨(oxoid),酵母膏(oxoid),无水硫酸镁(天津市永大化学试剂有限公司),磷酸二氢钾(天津市科密欧化学试剂有限公司),氯化钠(国药集团化学试剂有限公司),琼脂(solarbio),75%乙醇(四川金山制药有限公司),异丙醇(成都金山化学试剂有限公司),taq酶(宝生物工程(大连)有限公司)。
试验菌株:试验所用互隔交链格孢菌、富克葡萄孢盘菌、球毛壳菌、裂褶菌、鸡腿菇菌、黑外皮球菌、三线镰刀菌、燕麦镰刀菌、可可毛色二孢菌、米根霉菌、微扁沃利雅炭皮菌等菌株来源于贵州中医药大学中药民族药资源研究院中药材现代种植技术研究室分离保存菌株。
1.拮抗菌的分离与筛选
本发明涉及菌分离材料采自于中国贵州省黔康生态科技农业发展责任公司太子参连作种植基地,选取太子参发病较重的田块中的发病较轻的太子参叶片、块根进行拮抗菌的分离。收集新鲜的太子参叶片和块根用自来水冲洗干净,之后用灭菌的剪刀切成2cm×2cm碎片置于研钵中,按照1g叶片和块根组织加入10mlpbs溶液,超声20min后收集悬液,采用10倍体积比例依次稀释至10-2。得到含菌稀释液,取10-2稀释浓度的100μl含菌稀释液涂布于pda平板上,每个处理三个重复,28℃培养2d后,挑取表型差异的单菌落划线于lb培养基(培养基配方见表1)进行纯化培养。通过分析,将该分离的菌株初步鉴定为假单胞菌。
拮抗菌的筛选采用平皿对峙培养法。镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌种pda培养基(培养基配方见表1)平板表面。25℃培养3d制备新鲜菌丝。用1ml枪头打孔挑取新鲜镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌丝块,接种于pda平板中央。同时在其四周3cm处等距的四点分别接种培养24h的细菌菌液,以接菌大肠杆菌dh5α为阴性对照,每个处理重复三次。所有处理于25℃下培养3d,检测供试菌株的抑菌率。经过上述筛选,获得一株对镰刀菌、链格孢菌、富克葡萄孢盘菌、米根霉菌具有明显拮抗作用的菌株bbh16-1(图2),其抑菌率分别达到29.3%、31.8%、68.0%、31.7%(表2),抑菌圈清晰且边缘整齐,抑菌效果明显。
表1bbh16-1菌株培养所需培养基
2.拮抗菌菌学鉴定
2.1假单胞菌bbh16-1菌株的形态学鉴定
将假单胞菌bbh16-1菌株接种到lb培养基培养48h后,可见lb培养基上菌落黄白色菌落,菌落圆形,边缘整齐透明。
2.2假单胞菌bbh16-1菌株分子生物学鉴定
将假单胞菌bbh16-1菌株于lb培养基培养48h后,采用ctab/nacl提取方法提取基因组dna,提取后先后用苯酚-氯仿-异戊醇(25:24:1)和氯仿-异戊醇(24:1)抽提和无菌水溶解。利用特异性引物扩增v3v4rdna并送生工生物公司测序。测序序列长度为408bp,序列编号为seqidno.1。
测序引物dna序列:
v3v4rdna(正向引物):ctacgggmsgcagcag
v3v4rdna(反向引物):ggactachvgggtwtctaat
在ncbi中genbank数据库中,将bbh16-1菌株的v3v4rdna序列采用blastn检索,发现其于假单胞菌假单胞菌菌属相似度较高,为了进一步确定该菌的遗传特性,选取匹配结果中相似度大于97%的菌株10株构建系统发育树(图3)。
本发明涉及的菌株分类地位的鉴定,参照金典的微生物学分类手册:例如georgem.garrity《bergey’smannualofsystematicbacteriology》vol.viii,1974年版的内容。根据其形态特征,以及v3v4rdna基因序列比对结果,经多相分类鉴定本发明所分离的菌株是一株假单胞菌(pseudomonassp.bbh16-1),申请人将该分离的菌株命名为假单胞菌bbh16-1,该菌株于2020年12月25日将该菌株送交中国.武汉.武汉大学中国典型微生物保藏中心(cctcc)保藏,其保藏号为cctccno:m2020971。
4.假单胞菌bbh16-1广谱抑菌试验
通过培养皿内对峙培养法,检测bbh16-1菌株对不同病原真菌的抑制作用。结果显示,该菌株不仅对镰刀菌具有抑制作用,而且可以明显抑制互隔交链格孢菌alternariaalternata、富克葡萄孢盘菌botryotiniafuckeliana、球毛壳菌chaetomiumglobosum、裂褶菌chizophyllumcommune、鸡腿菇菌coprinellusxanthothrix、黑外皮球菌epicoccumnigrum、三线镰刀菌fusariumtricinctum、燕麦镰刀菌fusariumavenacea、可可毛色二孢菌lasiodiplodiatheobromae、米根霉菌rhizopusoryzae、微扁沃利雅炭皮菌whalleyamicroplaca在内的11种病原菌的生长(表1)。
表2假单胞菌bbh16-1菌株的广谱抑菌性
5.bbh16-1菌株发酵液降低病原菌镰刀菌在太子参块根中的定殖试验
bbh16-1菌株降低太子参种植土壤中病原菌丰度试验在贵州中医药大学科研楼实验室内进行,按照蛭石:营养土(3:1)的比列配置培养基质,在121℃下高温灭菌处理30min,分装到10cm直径的培养钵中。试验共分为4个处理,分别为10ml的bbh16-1菌株发酵液(浓度为od600nm=1)、10ml的镰刀菌孢子液(浓度为1×104cfu/ml)、20ml的bbh16-1菌株发酵液(浓度为od600nm=1)和镰刀菌(浓度为1×104cfu/ml)等体积混合液、无菌水。然后将太子参种植到培养钵中,每钵种植1株,每个处理6株。在25℃下种植15d后,收集太子参块根样本,qpcr定量检测tri5基因的含量,进而测定太子参块根中定殖的病原菌镰刀菌的相对丰度。结果表明,bbh16-1菌株发酵液可以有效的降低病原菌在太子参块根中的定殖能力,镰刀菌孢子液处理组中镰刀菌定殖到太子参块根上的相对丰度显著高于bbh16-1发酵液和镰刀菌孢子液混合液、bbh16-1发酵液和无菌水处理组(表3)。
表3bbh16-1对太子参种植土壤中病原菌丰度的抑制作用结果
6.bbh16-1菌株发酵液对太子参病害防治的田间小区试验
太子参病害防治的田间试验于贵州省黔康生态科技农业发展责任公司和贵州省金草海药材发展有限公司太子参连作过的种植地进行。种植材料为施太1号,采用棋盘法分组设计进行小区喷雾试验。田间试验共分为3个处理,分别为bbh16-1菌株发酵液,多菌灵粉剂(商品杀菌剂,有效成分含量70%)和清水,每个处理共设计4个重复,每个小区面积2m2(1×2m)。处理方式为喷雾法bbh16-1菌株发酵液、用无菌水溶解的多菌灵、清水分别喷晒不同处理土壤,发酵液每亩喷雾量为10l,多菌灵按照包装说明每亩50g。处理时序如下:在12月种植太子参时,按照以上方式喷晒处理种植太子参土壤;次年2月底到6月初,太子参出苗后的半个月,每15天喷晒处理1次。其中,在3月初、4月初和采挖时期分别调查立枯病、叶斑病、根腐病的病情指数。采收后测定太子参产量和质量。
结果表明,bbh16-1菌株发酵液可以有效抑制太子参病害的发生(图4)。经过bbh16-1菌株发酵液的喷雾处理后,在黄平县和施秉县2个试验点,太子参的病情指数于清水对照组相比均有显著的降低,防治效果分别为33.4%和47.3%,在施秉县试验点优于商品杀菌剂多菌灵(26.5%)。bbh16-1菌株发酵液在抑制太子参发病的同时,其产量也明显增加,在施秉县和黄平县2个验点的增产率分别为20.7%和35.7%,优于多菌灵处理组(表4)。
表4bbh16-1菌株防治太子参病害田间小区试验结果
7.附表
>seqidno.1
tgatccagccatgccgcgtgtgtgaagaaggtcttcggattgtaaagcactttaagttgggaggaagggcagttgcctaatacgtaactgttttgacgttaccgacagaataagcaccggctaactctgtgccagcagccgcggtaatacagagggtgcaagcgttaatcggaattactgggcgtaaagcgcgcgtaggtggtttgttaagttggatgtgaaatccccgggctcaacctgggaactgcattcaaaactgactgactagagtatggtagagggtggtggaatttcctgtgtagcggtgaaatgcgtagatataggaaggaacaccagtggcgaaggcgaccacctggactgatactgacactgaggtgcgaaagcgtggggagcaaacaggattagaaa
序列表
<110>贵州中医药大学
<120>一种防治太子参病害的假单胞菌以及分离筛选鉴定方法与应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>408
<212>dna
<213>帕勒隆尼氏假单胞菌bbh16-1菌株v3v4rdna序列(artificialsequence)
<400>1
tgatccagccatgccgcgtgtgtgaagaaggtcttcggattgtaaagcactttaagttgg60
gaggaagggcagttgcctaatacgtaactgttttgacgttaccgacagaataagcaccgg120
ctaactctgtgccagcagccgcggtaatacagagggtgcaagcgttaatcggaattactg180
ggcgtaaagcgcgcgtaggtggtttgttaagttggatgtgaaatccccgggctcaacctg240
ggaactgcattcaaaactgactgactagagtatggtagagggtggtggaatttcctgtgt300
agcggtgaaatgcgtagatataggaaggaacaccagtggcgaaggcgaccacctggactg360
atactgacactgaggtgcgaaagcgtggggagcaaacaggattagaaa
408
<210>2
<211>16
<212>dna
<213>扩增v3v4rdna序列的正向引物序列(artificialsequence)
<400>2
ctacgggmsgcagcag
16
<210>3
<211>20
<212>dna
<213>扩增v3v4rdna序列的反向引物序列(artificialsequence)
<400>3
ggactachvgggtwtctaat20
- 还没有人留言评论。精彩留言会获得点赞!