海洋真菌来源的杂萜化合物及其在制备抗肝纤维化药物中的应用
本发明属于医药化合物技术领域,具体涉及一种海洋真菌来源的杂萜化合物及其在制备抗肝纤维化药物中的应用。
背景技术:
肝纤维化(hepaticfibrosis,hf)是各种慢性肝病共同的病理过程,被长期或反复损伤的肝细胞所分泌的多种细胞因子,会刺激肝星状细胞转变为肌成纤维细胞,肌成纤维细胞通过合成细胞外基质对损伤的肝细胞进行修复,但当细胞外基质的合成和降解失衡,细胞外基质大量沉积,就会导致肝纤维化,若无及时有效的干预,将演变成肝硬化、肝癌等肝病。因肝纤维化具有可逆性,所以有效的肝纤维化期治疗是防治慢性肝病和肝硬化的重中之重。
目前研究发现,转化生长因子β1(tgf-β1)是最主要的促纤维化因子,因此抑制tgf-β1信号通路表达在肝纤维化治疗中具有重要意义。tgf-β1先通过促进肌成纤维细胞分化,进而分泌大量α-平滑肌肌动蛋白(α-sma)等细胞外基质,最后引起肝纤维化。所以α-sma可以间接反映肝纤维化的程度。因此,本发明以抑制tgf-β1诱导的α-smamrna表达为筛选模型,筛选具有抗肝纤维化活性的先导化合物,为开发抗肝纤维化新药提供目标化合物。
目前一线临床上尚没有较好的治疗肝纤维化药物,常用的主要有:抗病毒类和抗肝纤维化类,且长期大量使用会产生一系列不良反应和耐受性。因此,为解决药物的耐受性及不良反应,寻找新的抗肝纤维化药物成为国际国内研究的热点。
海洋真菌由于其次级代谢产物的化学多样性丰富,产量高而成为海洋天然药物研究的热点。目前,从海洋真菌中寻找新的药物前体已成为国内外研究的热点。
技术实现要素:
本发明要解决的技术问题是提供一种海洋真菌来源的杂萜化合物,该新化合物可抑制tgf-β1诱导α-smamrna的表达,起到显著的抗肝纤维化作用,极具开发成新药的潜力。
本发明另一目的是提供上述海洋真菌来源的杂萜化合物在制备抗肝纤维化药物中的应用。
本发明上述目的通过以下技术方案实现:
一种海洋真菌来源的杂萜化合物,其结构式如下式1所示:
上述海洋真菌来源的杂萜化合物的制备方法,是利用海洋真菌aspergillusterreusgzu-31-1发酵生产得到,具体为从海洋真菌aspergillusterreusgzu-31-1的发酵产物中分离得到,优选的制备方法包括如下步骤:
s1.真菌种子液培养:
将海洋真菌aspergillusterreusgzu-31-1接种到斜面培养基中,培养,再接入马铃薯葡萄糖水培养基,培养得种子液;
s2.真菌发酵培养:
将种子液接种到固体大米发酵培养基中,培养得发酵产物;
s3.粗提:将步骤s2所得发酵产物用甲醇提取,浓缩提取液,将获得的浓缩浸膏用乙酸乙酯萃取,得乙酸乙酯粗提物;
s4.分离纯化:将步骤s3所得乙酸乙酯粗提物用正相硅胶色谱层析进行分离,再以硅胶、凝胶和c-18反相柱层析分离技术进行分离纯化,即得到所述的杂萜化合物。
优选地,步骤s1所述斜面培养基的配方为:以质量比计,葡萄糖0.3%,酵母提取物0.1%,蛋白胨0.1%~0.5%,琼脂1.5%~2.5%,氯化钠1.5%~4%,水补足至100%。
更优选地,步骤s1所述斜面培养基的配方为:以质量比计,葡萄糖0.3%,酵母提取物0.1%,蛋白胨0.5%,琼脂2.5%,氯化钠3%,水98%。
优选地,步骤s1中所述马铃薯葡萄糖水培养基的配方为:以质量比计,马铃薯20%,葡萄糖0.3%,氯化钠1.5%~4%,水补足至100%。
更优选地,步骤s1中所述马铃薯葡萄糖水培养基的配方为:以质量比计,马铃薯20%,葡萄糖0.3%,氯化钠3%,水补足至100%。
优选地,步骤s1所述接种到斜面培养基后的培养的条件为温度28~35℃、时间4~10天,接入马铃薯葡萄糖水培养基后的条件为温度28~35℃、时间3~7天。
更优选地,步骤s1所述接种到斜面培养基后的培养的条件为温度30℃、时间6天,接入马铃薯葡萄糖水培养基后的条件为温度30℃、时间3天。
优选地,步骤s2中所述固体大米发酵培养基的配方为:以质量比计,大米:海水=1:1~2。
更优选地,步骤s2中所述固体大米发酵培养基的配方为:以质量比计,大米:海水=1:1。
优选地,步骤s2中所述培养的条件为25~35℃静置1~2个月。
更优选地,步骤s2中所述培养的条件为35℃静置2个月。
优选地,步骤s3中所述甲醇提取的次数为2~5次。
优选地,步骤s4中所述正相硅胶色谱层析具体操作为:用石油醚的体积分数分别为90%、80%、70%、60%、50%、40%、30%的石油醚/乙酸乙酯梯度洗脱,收集90%~50%石油醚/乙酸乙酯洗脱液。
步骤s4中所述石油醚/乙酸乙酯是指石油醚/乙酸乙酯体积比的混合物,石油醚和乙酸乙酯均为分析纯的试剂。
上述海洋真菌来源的杂萜化合物在制备抗肝纤维化药物中的应用。
上述海洋真菌来源的杂萜化合物在制备tgf-β1抑制剂中的应用。
在所述的应用中,所述的杂萜化合物抑制tgf-β1的活性。
所述的杂萜化合物抑制tgf-β1诱导细胞表达α-sma的活性。
所述的细胞为肝星状细胞。
优选地,所述的杂萜化合物的工作浓度为2.5~10μmol/l。
更优选地,所述的杂萜化合物的工作浓度为6μmol/l。
经过实验证实,所述海洋真菌来源的新型杂萜类衍生物能够显著抑制tgf-β1诱导的α-smamrna的表达,具有抗肝纤维化治疗的临床应用潜力,可用于制备抗肝纤维化药物。因此,该类海洋真菌来源的新型杂萜类衍生物在制备抗肝纤维化药物中的应用,以及在制备能够抑制tgf-β1诱导α-smamrna表达的药物中的应用,均应在本发明的保护范围之内。
本发明具有以下有益效果:
本发明从海洋真菌aspergillusterreusgzu-31-1中分离得到一类新型杂萜类衍生物,该类新化合物具有显著抑制tgf-β1诱导的α-smamrna表达的活性,具有抗肝纤维化治疗的临床应用潜力,可用于制备抗肝纤维化药物,应用前景好。
附图说明
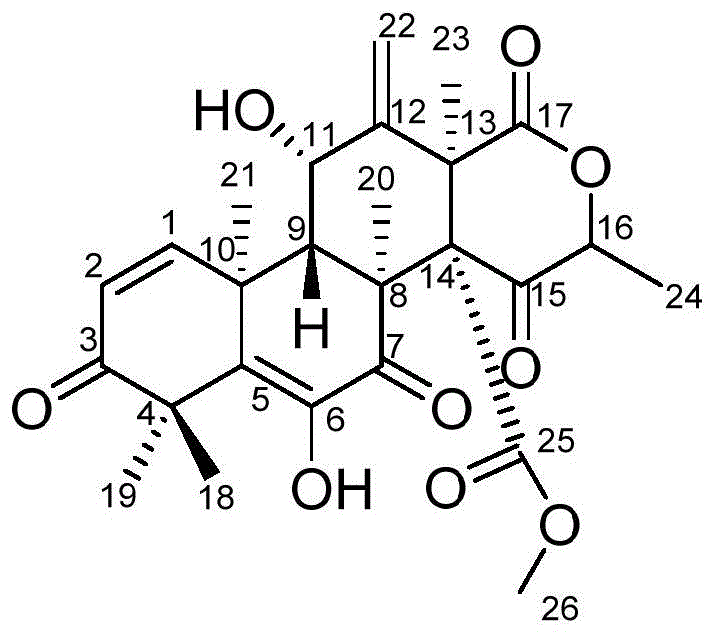
图1为化合物1的结构示意图。
图2为化合物1抑制肝星状细胞的活化结果图;其中,**p<0.01,与空白组相比;#p<0.05,##p<0.01,与tgf-β1组相比。
图3为化合物1细胞毒性评估结果图。
具体实施方式
以下结合具体实施来进一步说明本发明,但实施并不对本发明做任何形式的限定。
除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1海洋真菌aspergillusterreusgzu-31-1的获得
发明人团队从广东省湛江市徐闻沿海瘤背石磺躯干中分离纯化得到,分离得到一株海洋真菌aspergillusterreusgzu-31-1。通过对真菌its区域的dna扩增和测序对该真菌进行鉴定,具体步骤参考文献(natureprotocols,2010,5,480-490;journalofnaturalproducts,2006,69,11,1622-1625):采用dneasyplantminikit试剂盒,依据说明书的步骤,提取dna,以its为引物进行pcr扩增,扩增后的产物进行测序。将测序得到的序列通过blast数据库进行相似度检索,经比较,该序列与aspergillusterreus真菌序列相似度为100%,确定该真菌为海洋真菌aspergillusterreusgzu-31-1。该菌株于2019年12月19日保藏于广东省微生物菌种保藏中心(gdmcc),保藏号为gdmccno:60789,已在公开号为cn1111339188a的发明专利申请中公开。
实施例2化合物的分离
从海洋真菌aspergillusterreusgzu-31-1的发酵液中分离得到新型杂萜类衍生物,具体方法如下:
(1)真菌aspergillusterreusgzu-31-1的种子液培养:挑取菌株接入斜面,30℃培养6天后,接入马铃薯葡萄糖水培养基,30℃培养3天得种子液。斜面培养基组成按重量比为计为:葡萄糖0.3%,酵母提取物0.1%,蛋白胨0.5%,琼脂2.5%,氯化钠3%,水98%。马铃薯葡萄糖水培养基的组成按重量比计为:以质量比计,马铃薯20%,葡萄糖0.3%,氯化钠3%,水补足至100%。
(2)真菌aspergillusterreusgzu-31-1的发酵培养:将种子液中的菌株转接入发酵培养基中,于室温35℃静置2个月;其中发酵培养基为固体大米发酵培养基,组成按重量比计为大米:海水=1:1。
(3)将上述发酵后的提取物,用甲醇提取3次,浓缩提取液,将获得的浓缩浸膏用乙酸乙酯萃取,得乙酸乙酯粗提物。
(4)将乙酸乙酯粗提物用正相硅胶色谱层析进行分离;用石油醚的体积分数分别为90%、80%、70%、60%、50%、40%、30%的石油醚/乙酸乙酯梯度洗脱,收集90%~50%石油醚/乙酸乙酯洗脱液部分,再以硅胶、凝胶、c-18反相柱层析分离技术,进行依次分离纯化,即得到化合物1。
实施例3化合物的结构分析
对新化合物1进行结构测试解析,得到以下实验数据:
新化合物1:c26h30o9,hresi-ms:485.1805[m-h]-(caldforc26h29o9485.1806)。
nmr数据见表1。
化合物1的结构式如下所示:
表1化合物1的nmr数据(cdcl3,400mhz/101mhz,ppm)
实施例4化合物1的抗肝纤维化活性评估及毒性筛选
1、抗肝纤维化活性评估
①细胞的培养与处理
将大鼠肝星状细胞hsc-t6细胞(atcc)培养在含有10%(v/v)血清的dmem培养基(含青霉素60u/ml,链霉素100μg/ml)中,放置在5%co2的培养箱中,设置温度为37℃,进行常规维持培养和传代。所有试验均选取对数生长期的细胞。
②化合物干预
用胰酶消化贴壁细胞后收集于离心管中,离心后用培养基重悬,按照3×105细胞/ml密度将细胞接种于6孔板,待细胞贴壁12h。将10μg/ml的tgf-β1母液用空白dmem稀释1000倍,空白组换液为空白dmem,其余组别加入10ng/mltgf-β1预刺激1h。随后,空白组换液为空白dmem,其余组别加入含有10ng/mltgf-β1的dmem配制的不同浓度受试药物培养液共同作用24h,同时设置阳性对照组(木犀草素,浓度为10μmol/l)。各组细胞经药物处理后,吸去培养基,冰pbs清洗细胞1次;随后,于6孔板的每孔加入1mltrizol试剂,根据湖南艾科瑞生物工程有限公司的总rna提取试剂盒说明书进行rna的提取。对所提取的总rna进行浓度和纯度的测定,随后使用同公司的反转录试剂盒和实时荧光定量pcr试剂盒进行q-pcr实验。实验结束后,以2-δδct法对细胞样本中α-sma的基因表达进行计算,gapdh作为内参基因用于数据归一化。实验引物采用文献报道较多的碱基序列,经blast证实其可靠性后,由华大基因合成。q-pcr引物序列见下表。
表2q-pcr引物序列
③实验结果
结果如图2所示,tgf-β1导致细胞中α-sma水平显著上调。而给予化合物1后,α-sma的表达随着药物浓度的上升而下降。木犀草素(luteolin)是具有抗氧化、抗炎等活性的天然黄酮类化合物。近期研究表明,木犀草素对ccl4诱导的小鼠肝纤维化有治疗作用,此处以其作为考量化合物1体外药效的阳性药物。实验结果表明,化合物1能够抑制肝星状细胞的活化,其作用与阳性药木犀草素相当,但化合物1高剂量组与阳性药物组无显著性差异。
2、细胞毒性评估
①原理:依据mtt法来测定,mtt的化学名为3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,其商品名为:噻唑蓝。其检测原理为:活细胞和死细胞的区别在于,活细胞中线粒体中存在琥珀酸脱氢酶能使外源性的mtt还原为水不溶性的蓝色结晶甲臢。二甲基亚砜(dmso)可以溶解沉积在细胞内的甲臢,依据加入化合物的干预组和阳性对照组在490或者540nm波长处测定其吸光度,可间接反映细胞存活的数量。
②具体的步骤:将hsc-t6细胞培养在含有10%血清的dmem培养基(青霉素60u/ml,链霉素100μg/ml)中,放置在5%co2的培养箱中,设置温度为37℃。培养一代后待细胞稳定后,将其铺在96孔板中,浓度为5×103细胞/孔,贴壁24h。将化合物的母液溶于dmso中,用dmem培养基稀释。将不同浓度梯度的化合物样品(0-15μm)作用于96孔板中(200μl)。培养作用24h后,每孔加入mtt溶液(5mg/ml,用pbs配置)20μl,继续孵育4小时,终止培养,小心吸取上清液,每孔加入150μl的dmso,震荡10min,使结晶充分溶解。通过酶标仪检测490nm波长的吸收,记录结果。通过如下公式计算细胞活力:细胞活力(%)=[(an-a0)/(a-a0]×100%,其中an为样品的吸光度,a0是有培养基和mtt溶液而没有细胞的孔的吸光度,a是空白对照的吸光度。
③结果如图3所示
结果表明:化合物1在起效浓度下(2.5,5,10μm)不显示有细胞毒性,具有很大的安全系数。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!