一种超分子材料及其制备方法和应用
本发明属于材料技术领域,具体涉及一种超分子材料及其制备方法和应用。
背景技术:
有机荧光材料在荧光分析、生物检测、化学传感等方面具有重要的应用价值,从而这种材料引起了科研工作者浓厚的研究兴趣。传统的有机荧光材料有一个明显的缺陷:荧光分子在稀溶液中发光较强,而在聚集状态时由于π–π堆积会导致荧光减弱甚至猝灭。这种现象被称为聚集诱导荧光猝灭(acq)。在实际应用中,acq是非常不利的,人们尝试多种物理或者化学方法解决这一难题。然而,由于聚集是生色团固有的属性,很多尝试以失败告终。后有研究者发现了聚集诱导发光(aie)效应,具有“聚集诱导发光”性能的有机分子因其独特的荧光特性,可有效地解决传统荧光分子荧光自猝灭的问题,受到了科研人员的广泛重视。aie材料具有生物兼容性好、发光效率高、光稳定性好、斯特克斯位移大等优点,可以提供荧光“点亮型”检测等特性使其在众多领域具有重要的应用前景,如光电、生物成像、医学等。
但是目前报道的aie分子多为小分子,具有aie效应的配位超分子很少见,有文献报道了一种含有四苯乙烯基团的花环状二维超分子结构,但其结构柔性、稳定性不佳,限制了应用范围。
因此,亟需提供一种稳定性强,具有聚集诱导荧光猝灭性能的超分子材料。
技术实现要素:
本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种超分子材料,其结构稳定,具有聚集诱导荧光猝灭性能。
具体,所述超分子材料包括式(ⅰ)和/或式(ⅱ)所示的单元结构,所述超分子材料为笼状;
式中,r为氢原子、醚链、烷基链或聚芳香烃链;m为过渡金属离子。
r基团能够对三联吡啶类有机配体进行修饰的基团,用于改善化合物溶解性,或者是引入功能基团,从而提高其加工性能。
优选的,所述r为氢原子、c2-c12的烷基链或c2-c12的醚链。
优选的,所述m为正二价或正三价金属离子,正二价或正三价金属离子能够与x型四臂三联吡啶有机配体组装形成金属有机超分子,且稳定性好。进一步优选的,所述m为fe2+、co3+、os3+、hg2+、ir2+、pd2+、rh3+、zn2+、cu2+、cd2+、mn2+、ni2+、ru2+或mg2+中的至少一种。
本发明还提供了所述超分子材料的制备方法。
具体的,所述超分子材料的制备方法,包括以下步骤:
(1)制备式(ⅲ)或式(ⅳ)所示的x型四臂三联吡啶有机配体,
式中,r为氢原子、醚链、烷基链或聚芳香烃链;
(2)向步骤(1)制得的所述式(ⅲ)或式(ⅳ)所示的x型四臂三联吡啶有机配体中加入溶剂,溶解,然后滴加金属盐溶液,加热反应,反应完毕后加入阴离子置换剂,过滤得沉淀,即为所述超分子材料。
x型的三联吡啶有机配体是四臂配体,具有独特的几何角度和构型,可以和二价金属离子在溶液体系中自发组装成结构精确、有序、独特的八面体笼状结构。
优选的,在步骤(2)所述金属盐中,阳离子为fe2+、co3+、os3+、hg2+、ir2+、pd2+、rh3+、zn2+、cu2+、cd2+、mn2+、ni2+、ru2+或mg2+中的至少一种;阴离子为no3-、cl-或so42-。
优选的,步骤(2)中所述所述阴离子置换剂选自六氟磷酸铵或双三氟甲磺酰亚胺锂中的一种。利用所述阴离子置换剂置换出组装过程中引入的no3-、cl-或so42-等阴离子,在六氟磷酸铵或双三氟甲磺酰亚胺锂中的作用下,所述超分子材料能够溶剂中更好地析出,有利于后续沉淀物的分离和提纯。
优选的,步骤(2)中所述溶剂为醇、氯仿或醚中的至少一种;进一步优选的,步骤(2)中所述溶剂为醇和氯;更优选的,步骤(2)中所述溶剂为甲醇和氯仿的混合溶液,所述甲醇与所述氯仿的体积比为1:(1-1.5)。甲醇和氯仿混合溶剂对所述超分子材料的形成具有重要作用,所述x型的四臂三联吡啶配体在氯仿和甲醇混合溶剂具有很好的溶解性,生成的所述超分子材料也可以很好地溶解在氯仿和甲醇的混合溶剂中。
优选的,步骤(2)中所述加热反应的温度为40-70℃;步骤(2)中所述加热反应的时间为5-10h;进一步优选的,步骤(2)中所述加热反应的温度为45-55℃;步骤(2)中所述加热反应的时间为6-10h。
优选的,步骤(1)中所述式(ⅲ)所示的x型四臂三联吡啶有机配体的制备方法包括以下步骤:
(1)将噻蒽与卤素发生取代反应,得到2,3,6,7-四卤代噻蒽,即为中间体1;
(2)将4-甲酰基苯硼酸与2-乙酰基吡啶在碱性条件下反应,生成4-(2,2’,6,2”,-三联吡啶基)-苯硼酸,即为中间体2;
(3)将所述中间体1与所述中间体2进行suzuki-偶联反应,即得所述式(ⅲ)所示的x型四臂三联吡啶有机配体;
优选的,步骤(1)中所述卤素为溴;所述中间体1为2,3,6,7-四溴代噻蒽。
优选的,步骤(1)中所述式(ⅳ)所示的x型四臂三联吡啶有机配体的制备方法包括以下步骤:
(1)将噻蒽与卤素发生取代反应,得到2,3,6,7-四卤代噻蒽,即为中间体1;
(2)将4-甲酰基苯硼酸与2-乙酰基吡啶在碱性条件下反应,发生反应生成4-(2,2’,6,2”,-三联吡啶基)-苯硼酸,即为中间体2;
(3)将所述中间体1与氧化剂发生氧化反应,得到中间体3;
(4)将所述中间体2与所述中间体3进行suzuki-偶联反应,即得所述式(ⅳ)所示的x型四臂三联吡啶有机配体;
优选的,步骤(1)中所述卤素为溴;所述中间体1为2,3,6,7-四溴代噻蒽。
优选的,步骤(3)中所述氧化剂为h2o2。
一种分离大分子物质的的材料,包含所述超分子材料。
一种荧光探针,包含所述超分子材料。
一种催化剂,包含所述超分子材料。
相对于现有技术,本发明的有益效果如下:
(1)本发明提供的超分子材料具有八面体笼状结构,由x型的四臂三联吡啶有机配体与过渡金属离子通过配位键导向的自组装构建而成,其结构稳定。所述超分子材料具有独特的空腔结构,其中<tpy-zn-tpy>配位键限制了噻吩基团的震动,并且所述超分子材料可因溶解性降低而进一步限制噻吩基团的旋转和震动,从而引起了聚集诱导发光(aie)效应;且所述超分子材料的水溶液具有荧光增强效应。
(2)本发明提供的超分子材料因其独特的笼状结构,使其在光电、生物成像、医学等领域具有巨大的应用前景,可作为分离材料、荧光探针和催化剂等。
(3)本发明提供的超分子材料,其制备方法简单,反应条件温和,有利于大规模工业化生产。
附图说明
图1为实施例1制得的超分子材料c1的结构示意图;
图2为实施例2制得的超分子材料c2的结构示意图;
图3为实施例1制备超分子材料c1的流程图;
图4为实施例2制备超分子材料c2的流程图;
图5为实施例1制得的超分子材料c1的tem图;
图6为实施例2制得的超分子材料c2的tem图;
图7为有机配体和笼状超分子的荧光光谱图;
图8为不同浓度甲醇溶液中有机配体l1的荧光强度图;
图9为不同浓度甲醇溶液中有机配体l2的荧光强度图;
图10为不同浓度水溶液中超分子材料c1的荧光强度图;
图11为不同浓度水溶液中超分子材料c2的荧光强度图。
具体实施方式
为了让本领域技术人员更加清楚明白本发明所述技术方案,现列举以下实施例进行说明。需要指出的是,以下实施例对本发明要求的保护范围不构成限制作用。
以下实施例中所用的原料、试剂或装置如无特殊说明,均可从常规商业途径得到,或者可以通过现有已知方法得到。
实施例1
一种超分子材料,由式(ⅴ)所示的单元结构构成,所述超分子材料为笼状;
上述超分子材料的制备方法,包括以下步骤:
(1)制备2,3,6,7-四溴噻蒽
在三颈瓶中加入噻蒽(3.24g,15mmol),20ml冰醋酸,在氮气保护下缓慢加入液溴(19.2g,120mmol),恒温100℃反应24h,溶液冷却后加入100ml亚硫酸氢钠溶液猝灭过量的液溴,用ch2cl2萃取水洗,有机相用无水mgso4干燥,溶剂旋蒸得粗产物,再用正己烷重结晶得白色固体(3.21g,46%)。1hnmr(500mhz,cdcl3,300k,ppm):δ7.63(s,4h,phh).13cnmr(300mhz,cdcl3,300k,ppm):δ138.91,132.44,125.27。
(2)制备4-(2,2’,6,2”,-三联吡啶基)-苯硼酸(中间体2)
在500ml圆底烧瓶中加入乙醇(200ml),再加入naoh(9.6g,240mmol)搅拌溶解。依次加入4-甲酰基苯硼酸(6.0g,40mmol)和2-乙酰基吡啶(10.6g,88mmol),在室温下搅拌反应24h,加入nh3·h2o(28%,150mmol),加热回流反应20h。将反应液冷却至室温,抽滤,滤渣用冰的异丙醇和氯仿洗涤,得淡紫色粉末(11.96g,84.7%)。1hnmr(500mhz,cd3od,300k,ppm):δ8.71–8.68(m,2h,tpy-h3’,5’),8.68–8.62(m,4h,tpy-h6,6”andtpy-h3,3”),8.01(td,j=7.7,1.8hz,2h,tpy-h4,4”),7.78(d,j=7.8hz,2h,ph-hj),7.73(d,j=8.0hz,2h,ph-hk),7.48(ddd,j=7.5,4.8,1.1hz,2h,tpy-h5,5”).13cnmr(125mhz,cd3od,300k,ppm):δ157.46,156.84,153.10,149.87,138.57,135.29,134.99,125.75,125.11,122.82,119.40。
(3)制备式(ⅶ)所示的x型四臂三联吡啶有机配体(记作有机配体l1)
将2,3,6,7-四溴噻蒽(0.528g,1mmol)、4-(2,2’,6,2”,-三联吡啶基)-苯硼酸(2.12g,6mmol)、pd(pph)3cl2(210.5mg,0.3mmol)和k2co3(3.45g,25mmol)加入史莱克瓶中,抽换氮气三次,加入200ml甲苯,80ml乙醇和120ml水,在氮气保护下恒温95℃反应96h,反应结束后用ch2cl2萃取,饱和食盐水洗涤,有机相用无水mgso4干燥,溶剂旋蒸得粗产物,将所得固体用中性氧化铝过柱分离得式(ⅶ)所示的x型四臂三联吡啶有机配体l1,为白色粉末(0.86mg,59.5%)。
有机配体l1的1hnmr数据如下:1hnmr(500mhz,cdcl3,300k,ppm):δ8.74(s,2h,tpyh3′,5′),8.69(d,j3,3″-4,4″=4hz,2h,tpyh3,3″),8.65(d,j6,6″-5,5″=6hz,2h,tpyh6,6″),7.87(dd,j4,4″-3,3″=j5,5″-4,4″=4hz,2h,tpyh4,4″),7.84(d,ja-b=3hz,2h,phha),7.71(s,1h,phhc),7.34(d,jb-a=3hz,2h,phhb),7.32(dd,j5,5″-6,6″=6hz,j5,5″-4,4″=4hz,2h,tpyh5,5″)ppm.13cnmr(300mhz,cdcl3,300k,ppm):δ156.27,155.93,149.78,149.15,139.98,137.16,137.10,135.02,130.90,130.40,127.38,123.93,121.51,119.03。
(4)制备由式(ⅴ)所示的单元结构构成的超分子材料(记作超分子材料c1)
将x型四臂三联吡啶有机配体l1(8.7mg,6μmol)溶解于氯仿和甲醇的混合溶剂中(16ml,v/v=1:1),将zn(no3)2·6h2o(3.58g,12μmol)溶解于5ml的甲醇溶液中,然后将金属盐溶解缓慢加入到溶解有配体l1的溶液中,恒温50℃搅拌反应8h,待冷却至室温后,加入溶解有lintf2的meoh溶液中进行阴离子转换,立即出现大量白色絮状沉淀,离心分离,滤渣用蒸馏水洗涤三次,真空干燥后得到黄色粉末状固体(18.38mg,95.5%)。
超分子材料c1的1hnmr数据如下:1hnmr(500mhz,cd3cn/dmf-d7(v/v,4:1),300k,ppm)9.01(s,96h,tpy-h3',5'),8.73(d,j3,3”-4,4”=8.5hz,96h,tpy-h3,3”),8.18(d,ja-b=8.1hz,96h,ph-ha),8.09(m,96h,tpy-h4,4”),8.01(s,48h,ph-hc),7.85(d,j6,6”-5,5”=4.5hz,96h,tpy-h6,6”),7.66(d,jb-a=8.6hz,96h,ph-hb),7.36(m,96h,tpy-h5,5”)。
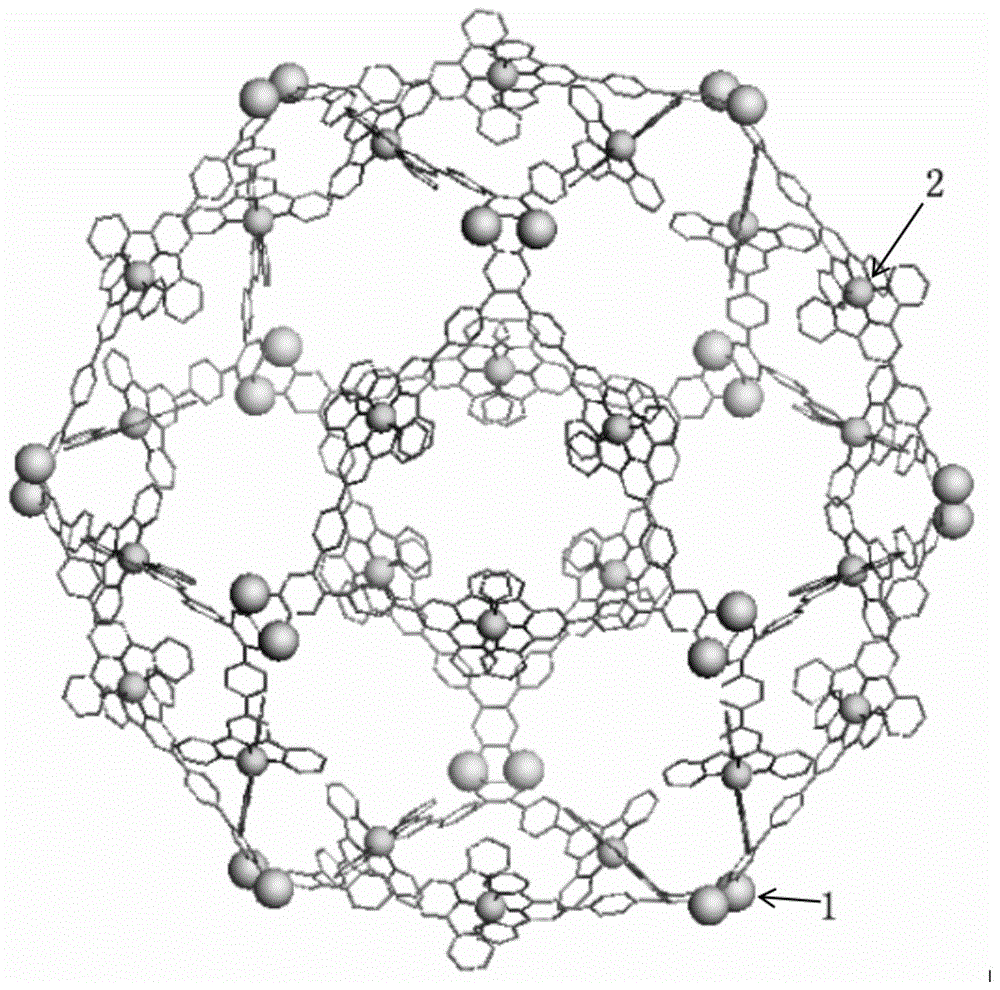
超分子材料c1的结构示意图见图1,图1中箭头1指示的是硫原子,箭头2指示的是锌离子。该制备过程如图3所示。
实施例2
一种超分子材料,由式(ⅵ)所示的单元结构构成,所述超分子材料为笼状;
上述超分子材料的制备方法,包括以下步骤:
(1)制备2,3,6,7-四溴噻蒽
在三颈瓶中加入噻蒽(3.24g,15mmol),20ml冰醋酸,在氮气保护下缓慢加入液溴(19.2g,120mmol),恒温100℃反应24h,溶液冷却后加入100ml亚硫酸氢钠溶液猝灭过量的液溴,用ch2cl2萃取水洗,有机相用无水mgso4干燥,溶剂旋蒸得粗产物,再用正己烷重结晶得白色固体(3.21g,46%)。1hnmr(500mhz,cdcl3,300k,ppm):δ7.63(s,4h,phh).13cnmr(300mhz,cdcl3,300k,ppm):δ138.91,132.44,125.27。
(2)制备4-(2,2’,6,2”,-三联吡啶基)-苯硼酸(中间体2)
在500ml圆底烧瓶中加入乙醇(200ml),再加入naoh(9.6g,240mmol)搅拌溶解。依次加入4-甲酰基苯硼酸(6.0g,40mmol)和2-乙酰基吡啶(10.6g,88mmol),在室温下搅拌反应24h,加入nh3·h2o(28%,150mmol),加热回流反应20h。将反应液冷却至室温,抽滤,滤渣用冰的异丙醇和氯仿洗涤,得淡紫色粉末(11.96g,84.7%)。1hnmr(500mhz,cd3od,300k,ppm):δ8.71–8.68(m,2h,tpy-h3’,5’),8.68–8.62(m,4h,tpy-h6,6”andtpy-h3,3”),8.01(td,j=7.7,1.8hz,2h,tpy-h4,4”),7.78(d,j=7.8hz,2h,ph-hj),7.73(d,j=8.0hz,2h,ph-hk),7.48(ddd,j=7.5,4.8,1.1hz,2h,tpy-h5,5”).13cnmr(125mhz,cd3od,300k,ppm):δ157.46,156.84,153.10,149.87,138.57,135.29,134.99,125.75,125.11,122.82,119.40。
(3)制备2,3,6,7-四溴-9,10-二砜噻蒽
在氩气保护下,在30ml冰醋酸溶液中加入2,3,6,7-四溴噻蒽(2.97g,5mmol),然后缓慢滴加30mlh2o2(30%),恒温90℃反应16h,反应结束后用ch2cl2萃取,饱和食盐水洗涤,有机相用无水mgso4干燥,溶剂旋蒸得粗产物,将所得固体进行柱分离得白色固体,即为2,3,6,7-四溴-9,10-噻蒽(2.14g,65%)。1hnmr(500mhz,cdcl3,300k,ppm):δ8.4(d,4h,phh)。
(4)制备式(ⅷ)所示的x型四臂三联吡啶有机配体(记作有机配体l2)
将2,3,6,7-四溴-9,10-二砜噻蒽(0.596g,1mmol)、4-(2,2’,6,2”,-三联吡啶基)-苯硼酸(2.12g,6mmol)、pd(pph)3cl2(210.5mg,0.3mmol)和k2co3(3.45,25mmol)加入史莱克瓶中,抽换氮气三次,加入200ml甲苯,80ml乙醇和120ml水,在氮气保护下恒温95℃反应96h,反应结束后用ch2cl2萃取,饱和食盐水洗涤,有机相用无水mgso4干燥,溶剂旋蒸得粗产物,将所得固体用中性氧化铝过柱分离得式(ⅷ)所示的x型四臂三联吡啶有机配体l2,为白色粉末(0.93mg,61.6%)。
有机配体l2的1hnmr数据如下:1hnmr(500mhz,cdcl3,300k,ppm)8.74(s,8h,tpy-h3',5'),8.68(d,j6,6”-5,5”=4.8hz,8h,tpy-h6,6”),8.64(d,j3,3”-4,4”=8.5hz,8h,tpy-h3,3”),8.44(s,4h,ph-hc),7.90(d,ja-b=8.4hz,8h,ph-ha),7.84(m,8h,tpy-h4,4”),7.38(d,jb-a=8.7hz,8h,ph-hb),7.32(m,8h,tpy-h5,5”).13cnmr(125hz,cdcl3,ppm):δ156.10,156.05,149.09,149.03,138.77,138.55,138.39,136.77,136.07,129.00,128.26,128.22,125.24,123.78,121.28,118.84。
(4)制备由式(ⅵ)所示的单元结构构成的超分子材料(记作c2)
将有机配体l2(9.3mg,6.16μmol)溶解于氯仿和甲醇的混合溶剂中(16ml,v/v=1:1),将zn(no3)2·6h2o(3.76g,12.32μmol)溶解于5ml的甲醇溶液中,然后将金属盐溶解缓慢加入到溶解有配体l2的溶液中,恒温50℃搅拌反应8h,待冷却至室温后,加入溶解有lintf2的meoh溶液中进行阴离子转换,立即出现大量白色絮状沉淀,离心分离,滤渣用蒸馏水洗涤三次,真空干燥后得到浅灰色粉末状固体(19.80mg,97.0%)。
超分子材料c2的1hnmr数据如下:1hnmr(500mhz,cd3cn/dmf-d7(v/v,4:1),300k,ppm)9.02(s,96h,tpy-h3',5'),8.75(d,j3,3”-4,4”=8.9hz,96h,tpy-h3,3”),8.62(s,48h,ph-hc),8.24(d,ja-b=7.3hz,96h,ph-ha),8.10(m,96h,tpy-h4,4”),7.86(d,j6,6”-5,5”=4.5hz,96h,tpy-h6,6”),7.74(d,jb-a=7.5hz,96h,ph-hb),7.38(m,96h,tpy-h5,5”)。
超分子材料c2的结构示意图见图2,图2中箭头1指示的是硫原子,箭头2指示的是氧原子,箭头3指示的是锌离子。该制备过程如图4所示。
产品效果测试
(1)利用多维质谱表征离散的超分子自组装:
电喷雾质谱(esi-ms)是通过测量样品组分的质量电荷比(m/z),检测样品组分的分子量,对于高分子化合物的测定可以产生多电荷峰,与传统的质谱相比扩大了检测的分子质量范围,同时提高了仪器的灵敏度,在pmol数量级的水平或者更少的样品检测中,当分辨率1000时可达0.005%精度。esi-ms是一种软电离方式,在一定的电压下它不会使样品分子产生碎片,是检测分析较纯的大分子化合物的首选方法。
首先利用电喷雾质谱(esi-ms)对超分子材料c1进行表征,测定其分子量和组成,观察到超分子材料c1的信号峰为m/z=3315.8423,m/z=2956.9682,m/z=2662.1448,m/z=2416.8960,m/z=2209.4453,m/z=2031.6304,m/z=1877.5287,m/z=1742.6908,m/z=1623.6532,m/z=1517.9028,m/z=1423.2758,m/z=1338.1191,m/z=1261.0193,m/z=1190.987,分别与[m-9ntf2-]9+,[m-10ntf2-]10+,[m-11ntf2-]11+,[m-12ntf2-]12+,[m-13ntf2-]13+,[m-14ntf2-]14+,[m-15ntf2-]15+,[m-16ntf2-]16+,[m-17ntf2-]17+,[m-18ntf2-]18+,[m-19ntf2-]19+,[m-20ntf2-]20+,[m-21ntf2-]21+,[m-22ntf2-]22+信号相对应。根据数据推算得超分子材料c1分子量为32364da,这与12个l1和24个zn(ntf2)2分子量相加得到得总分子量理论计算值相吻合。
接着,利用twim-ms检测超分子材料是否存在异构体或者其他构想异构体。发现超分子材料c1的结果显示电荷数从12+到23+是一组尖锐、窄且分离的单组信号峰,从而证明了体系中没有其他的同分异构,结构构型单一。
利用电喷雾质谱(esi-ms)对超分子材料c2进行表征,测定其分子量和组成,观察到超分子材料c2的信号峰为m/z=3401.2472,m/z=3033.1311,m/z=2731.9458,m/z=2480.9539,m/z=2268.5034,m/z=2086.4778,m/z=1928.7125,m/z=1790.6755,m/z=1668.8154,m/z=1560.5559,m/z=1463.6840,m/z=1376.5071,m/z=1225.8740,m/z=1160.4072,分别与[m-9ntf2-]9+,[m-10ntf2-]10+,[m-11ntf2-]11+,[m-12ntf2-]12+,[m-13ntf2-]13+,[m-14ntf2-]14+,[m-15ntf2-]15+,[m-16ntf2-]16+,[m-17ntf2-]17+,[m-18ntf2-]18+,[m-19ntf2-]19+,[m-20ntf2-]20+,[m-21ntf2-]21+,[m-22ntf2-]22+信号相对应。根据数据推算得超分子材料c1分子量为32364da,这与12个l1和24个zn(ntf2)2分子量相加得到得总分子量理论计算值相吻合
超分子材料c2的结果显示电荷数从10+到23+是一组尖锐、窄且分离的单组信号峰,从而证明了体系中没有其他的同分异构,结构构型单一。
(2)超分子材料表面形貌表征:
透射电镜,即透射电子显微镜(tem),是以波长极短的电子束作为光源,用电磁透镜对透射电子聚焦成像的一种具有高分辨本领、高放大倍数的电子光学仪器。tem是一种可以直接观察微观形貌的测试手段,利用tem对笼状超分子表面形貌进行表征。将超分子材料c1和c2分别溶解在乙腈溶液中,配成浓度为1×10-6mol/l的溶液,超声两分钟使其均匀分散在乙腈溶液中,使用超薄碳支撑膜作为衬底。
图5为超分子材料c1的tem图,由图5可知,超分子材料c1是一系列均匀分布的、直径约为5.68nm的笼状超分子材料,与软件模拟的分子结构的直径尺寸相吻合。
图6为超分子材料c2的tem图,由图6可知,超分子材料c2是一系列均匀分布的、直径约为5.91nm的笼状超分子材料,与软件模拟的分子结构的直径尺寸相吻合。
(3)测定有机配体l1和l2和超分子材料c1和c2的光物理性质:
光发射光谱测定有机配体和超分子材料的光谱性质。将有机配体l1和l2溶解分别在氯仿溶液中,浓度为0.5mg/ml;将超分子材料c1和c2分别溶解在dmf溶液中,浓度为0.5mg/ml,激发波长为330nm,得到如图7所示的荧光发射光谱。在氯仿溶液中有机配体l1在390nm处发射峰微弱,有机配体l2在波长430nm处有较强的荧光。有机配体l2和l1相比,荧光强度的增加主要与有机配体l2中硫氧化态的增加有关。硫代戊二烯部分在溶液中不是刚性的,但可以在连接二硫原子的直线上来回摆动,但是硫代-9,9′,10,10′-四氧化物在一定程度上被氧原子固定,此外,与未氧化的噻吩相比,噻吩-9,9′,10,10′-四氧化物的分子轨道能级要低得多,因此可以作为一个有效得电子受体。这导致激发波函数中电荷转移的贡献增多,减少了系统间的交叉到非辐射三态。有机配体与zn离子组装后形成的超分子材料也有类似的现象,在dmf溶液中,超分子材料c1在550nm处表现出黄色荧光,然而超分子材料c2在450nm有明显的蓝色荧光。
为了进一步研究本发明提供的超分子材料的可协调发光性能。加入不良溶剂观察超分子材料的聚集诱导发光性能。
有机配体l1在极性有机溶剂氯仿中有良好的溶解性,但是在不断向溶液中加入甲醇时,配体l1的荧光就会产生acq效应,如图8(不同浓度甲醇溶液中有机配体l1的荧光强度图)所示,当加入甲醇至40%时溶液荧光强度降低90%,甲醇的加入会让有机配体l1产生聚集诱导猝灭,但当有机配体l1与过渡金属组装形成超分子材料c1时,情况发生了改变。如图10(不同浓度水溶液中超分子材料c1的荧光强度图)所示,加入不良溶剂水为0%-30%时溶液表现出的是acq效应,荧光强度不断地减弱,当水加入到40%-50%时,荧光强度突然提升到70%,这时是因为产生了aie效应。当加入水量增加到50%以上时,发射波长发生红移,发射颜色由无色变为黄色,同时发射强度降低。发射颜色的变化主要由以下几个原因:一是溶剂化荧光变色,溶剂极性影响分子内电荷转移使荧光颜色发生变化;二是固体化合物组装方式不同,导致发射颜色不同。
如图9(不同浓度甲醇溶液中有机配体l2的荧光强度图)所示,向有机配体l2的氯仿溶液中加入不良溶剂甲醇溶液,当加入0%-50%甲醇时,溶液出现荧光增强,此时呈现aie效应;当加入甲醇60%-90%时,虽然荧光没有猝灭但是荧光变弱,此时出现了acq效应。当将有机配体l2与过渡金属组装成为超分子材料c2时,出现类似现象,具体如图11(不同浓度水溶液中超分子材料c2的荧光强度图)所示,向超分子材料c2加入不良溶剂水,当加入10%-50%水时,荧光强度增强,呈现aie效应。加入水60%-90%时,荧光强度减弱。
本发明提供的超分子材料具有良好的聚集诱导发光性能。
- 还没有人留言评论。精彩留言会获得点赞!