一种邻位卤代芳胺化合物及其合成方法与流程
本发明属于有机化学合成技术领域,涉及邻卤(邻氯、邻溴)芳胺类化合物及其合成方法。
背景技术:
芳基卤化物在现代有机化学中是非常有价值的化合物,它们广泛应用于过渡金属催化的交叉偶联反应中,作为构建不同碳-碳、碳-氮、碳-氧和碳-硫键的关键底物。此外,芳基卤化物还广泛用于无过渡金属催化的转化当中,如亲核芳香取代反应、高活性有机金属试剂(如芳基锂、芳基镁试剂)和苯炔类中间体的制备等。此外,芳基卤化合物是许多天然产物、药物、以及功能材料的关键成分。在这些芳基卤化合物中,卤代芳胺因在染料等领域的广泛应用而显得更加重要。
氯原子的引入对增强小分子的生物特性有深远的影响。芳香氯化反应可能会改变药物的物理化学性质,如pka效应、代谢率和偶极矩等。事实上,迄今已有数百种芳基氯化物被批准作为临床药物。而芳基溴化物比相应的芳基氯化物具有更高的反应活性,芳香溴化物中的溴基团可以高效、方便地转化为其他官能团。所以从成本和可用性考虑,芳基氯化物、溴化物是比相应的芳基碘化物、芳基三氟甲磺酸酯更有吸引力的底物。接下来将对目前的已知的一些芳环氯化、溴化策略进行概述。
亲电芳香卤化反应是制备芳基卤化物的主要策略,通常使用液溴或氯气;n-溴代丁二酰亚胺(nbs)或n-氯代丁二酰亚胺(ncs);过氧化物/hbr或dmso/hbr作为卤化试剂(如式1)。
式1.亲电芳香卤化反应
虽然这些方法很有效,但它们存在一些局限性:(1)通常需要使用高毒性或危险的试剂;(2)通常只有一些活化的芳环能够发生反应;(3)会产生一些不良副产物,例如多卤代产物或者存在多种区域异构体导致难以分离。
过渡金属催化的定向区域选择性碳氢卤化也是合成邻位卤代芳香族化合物的有效方法(如式2)。
式2.过渡金属催化的碳氢卤化反应
2006年,施章杰课题组在这方面取得重大进展。他们利用cux2(x=cl,br)作为卤素源,以催化量醋酸钯作为催化剂,两当量的醋酸铜作为氧化剂,在90℃加热条件下,实现了乙酰苯胺在钯催化下的芳胺的邻位选择性卤化(如式3)。
式3.钯催化的cux2作为卤源的芳胺邻位卤化反应
bedford课题组在2011年开发了对甲苯磺酸和醋酸钯共同催化的芳胺的邻位c-h卤化反应(如式4)。该反应利用nxs(x=cl,br)作为卤素源,以甲苯作溶剂,在室温下空气氛围中进行反应。
式4.钯催化的nxs作为卤源的芳胺邻位卤化反应
美中不足的是,这些过渡金属催化的碳氢卤化反应通常需要使用昂贵的过渡金属催化剂,如钯、铑等,有的需要在高温下长时间加热完成,反应条件较为苛刻。
最近,各种路易斯碱性有机催化剂被成功地应用于芳基化合物的亲电卤化,这是一种比金属催化剂体系更环保的途径。然而,这些策略经常受到特定催化剂和狭窄底物范围的影响。因此开发温和、有效和区域选择性的芳胺卤(氯、溴)化策略仍然是非常需要的。
技术实现要素:
针对现有技术中存在的缺陷和不足,本发明提供了邻位卤代(氯代、溴代)芳胺化合物及其合成方法。在无过渡金属、无氧化剂的温和条件下,通过芳基羟胺化合物与二卤亚砜(socl2,sobr2)参与的串联重排反应,实现邻位卤代芳胺化合物高效、高区域选择性的合成。
本发明的技术方案如下:
一种邻位卤代芳胺化合物,具有式(ⅲ)所示结构:
式(ⅲ)中,x为cl或br;
ar为取代的萘基、苯基、杂芳基中的一种;
r为苯甲酰基、乙酰基、特戊酰基、酯基、叔丁氧羰基、苄氧羰基、甲基中的一种。
根据本发明,优选的,所述的邻位卤代芳胺化合物
根据本发明,优选的,所述的邻位卤代芳胺化合物具有如下结构:
根据本发明,上述邻位卤代芳胺化合物的合成方法,包括步骤如下:
在氮气氛围下,将化合物(i)加入溶剂,加入碱或不加入碱的情况下,向混合液中滴加化合物(ii)进行反应,待反应完成后,提纯,即得到目标化合物(iii);
根据本发明,反应过程中,可通过tlc跟踪反应进程。
根据本发明,优先的,提纯方法如下:
反应结束后,反应混合物通过旋转蒸发仪浓缩,粗产品经过柱层析,过柱层析的洗脱剂为石油醚:乙酸乙酯=5:1,即得到目标化合物(iii)。
根据本发明,优先的,化合物(i)和化合物(ii)的摩尔比为1:(1-2),进一步优选1:(1.1-1.6);最优选的,当x为cl时,化合物(i)和化合物(ii)的摩尔比为1:1.2;当x为br时,化合物(i)和化合物(ii)的摩尔比为1:1.5。
根据本发明,优选的,所述的碱为碳酸钠、磷酸钾、碳酸氢钠、吡啶、dmap、et3n、dabco、dbn或dbu;
最优选的,当x为cl时,加入碱进行反应,所述的碱为碳酸钠;当x为br时,不加入碱进行反应。
根据本发明,优选的,所述的溶剂为mecn(乙腈)、dce(二氯乙烷)、dcm(二氯甲烷)、chcl3(三氯甲烷)、phcl(氯苯)、et2o(乙醚)或thf(四氢呋喃);
最优选,当x为cl时,所述的溶剂为thf,当x为br时,所述的溶剂为dcm。
根据本发明,所述的化合物(i)具有如下结构:
化合物(i)可按现有的技术路线制备,制备路线如下:
合成步骤如下:在n2氛围下,将硝基化合物(1.0当量)和5%rh/c(0.30mol%rh)溶于thf(0.324m)中,随后将反应体系冷却至0℃,逐滴加入水合肼(1.2当量)。反应混合物在0℃下搅拌1小时,然后缓慢升温至室温,并在室温下搅拌2小时,待反应完成后,通过硅藻土过滤反应混合物,旋蒸浓缩,重结晶,得到的粗产品羟胺直接用于下一步。
向羟胺的乙醚(0.5m)溶液中,加入饱和nahco3水溶液,然后将溶液冷却至0℃,向溶液中加入相应的酰氯(1.1当量),滴加完成后,在0℃下搅拌10秒后,将反应用饱和nh4cl水溶液淬灭,反应混合物用二氯甲烷萃取,有机层用饱和食盐水洗涤并经无水硫酸钠干燥,真空除去溶剂后,粗产品经过柱层析(洗脱剂为二氯甲烷:乙酸乙酯=50:1),得到化合物(i)。
根据本发明,所述的化合物(ii)二卤亚砜具有如下结构:
化合物(ii)可市场购得,也可按现有技术制备得到。本发明使用的化合物(ii),阿拉丁试剂有限公司和上海麦克林生化科技有限公司有售。
根据本发明,优选的,反应温度为-40℃~30℃,进一步优选0℃。
根据本发明,所述的邻位卤代芳胺化合物在药物研发、染料、有机合成和工业等领域应用非常广泛。事实上,迄今已有数百种芳基氯化物被批准作为临床药物。许多具有工业价值的产品,如农药、杀虫剂、除草剂、药物和医药活性分子、阻燃剂和其他带有卤素官能团的新材料都含有芳基氯化物的片段。同时,溴代芳胺化合物还广泛应用于过渡金属催化的交叉偶联反应和众多无过渡金属催化的转化当中。
本发明的技术路线如下:
本发明的有益效果:
1、本发明报道了一种无过渡金属催化的芳胺邻位卤化策略。利用廉价易得的二卤亚砜与芳基羟胺化合物进行反应,在温和条件下实现邻卤芳胺的高效合成。该策略普适性良好,各种官能团均能很好的耐受,并且成功地实现了含硅化合物的官能团化修饰,这也是推动其在功能材料、电子器件、生命及医药科学等领域进一步发展应用的基础和关键。
2、本发明反应条件温和,无过渡金属催化。原料芳基羟胺容易制备,二卤亚砜可直接商业购得。本发明具有普适性,包括杂环和天然产物分子在内的各种芳基羟胺可以有效地实现邻位碳氢键卤化,以良好的产率制备了具有优异的区域选择性的、结构多样的邻卤代芳胺类化合物。
附图说明
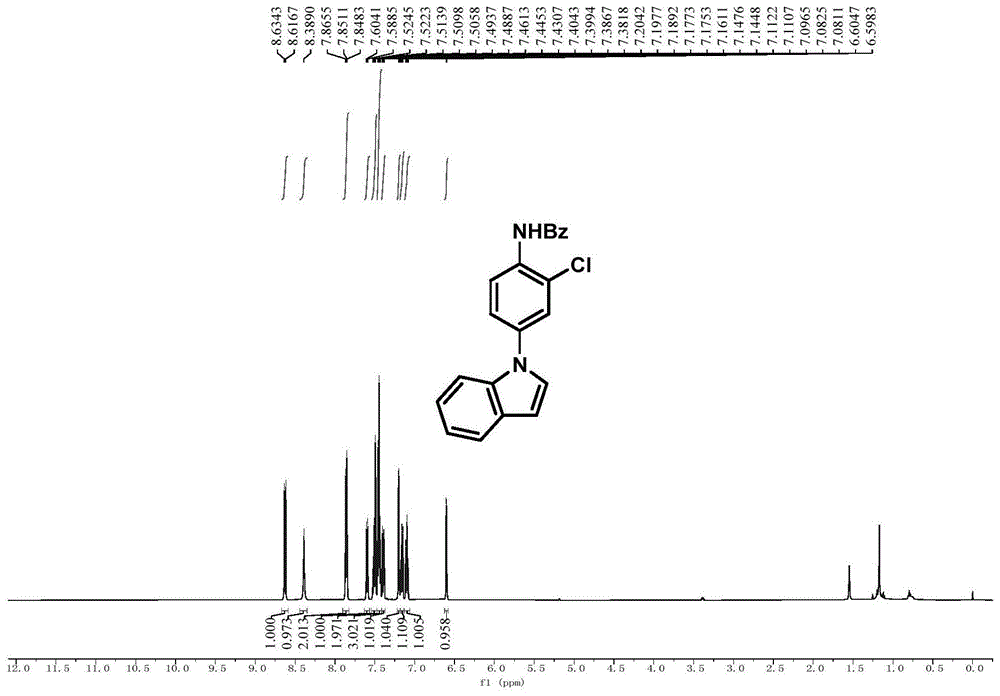
图1为实施例1制得的n-(2-氯-4-(1h-吲哚-1-基)苯基)苯甲酰胺的1h-nmr谱图;
图2为实施例1制得的n-(2-氯-4-(1h-吲哚-1-基)苯基)苯甲酰胺的13c-nmr谱图;
图3为实施例2制得的2-氯-n-甲基-4-硝基苯胺的1h-nmr谱图;
图4为实施例2制得的2-氯-n-甲基-4-硝基苯胺的13c-nmr谱图;
图5为实施例3制得的n-(2-氯-6-甲氧基-5-(三异丙基甲硅烷基)乙炔基)吡啶-3-基)苯甲酰胺的1h-nmr谱图;
图6为实施例3制得的n-(2-氯-6-甲氧基-5-(三异丙基甲硅烷基)乙炔基)吡啶-3-基)苯甲酰胺的13c-nmr谱图;
图7为实施例4制得的n-(2-氯-4-((3as,5ar,8ar,8bs)-2,2,7,7-四甲基四氢-3ah-双([1,3]二氧咯)[4,5-b:4',5'-d]吡喃-3a-基)甲氧基)苯基)苯甲酰胺的1h-nmr谱图;
图8为实施例4制得的n-(2-氯-4-((3as,5ar,8ar,8bs)-2,2,7,7-四甲基四氢-3ah-双([1,3]二氧咯)[4,5-b:4',5'-d]吡喃-3a-基)甲氧基)苯基)苯甲酰胺的13c-nmr谱图;
图9为实施例5制得的n-(2-氯-4-((8r,9s,13s,14s)-13-甲基-17-氧代-7,8,9,11,12,13,14,15,16,17-十氢-6h-环戊[a]菲-2-基)氧基)苯基)苯甲酰胺的1h-nmr谱图;
图10为实施例5制得的n-(2-氯-4-((8r,9s,13s,14s)-13-甲基-17-氧代-7,8,9,11,12,13,14,15,16,17-十氢-6h-环戊[a]菲-2-基)氧基)苯基)苯甲酰胺的13c-nmr谱图;
图11为实施例6制得的(3s,8s,9s,10r,13r,14s,17r)-10,13-二甲基-17-((r)-6-甲基庚-2-基)-2,3,4,7,8,9,10,11,12,13,14,15,16,17-四十氢-1h-环戊[a]菲-3-基-4-苯甲酰胺基-3-氯苯甲酸酯的1h-nmr谱图;
图12为实施例6制得的(3s,8s,9s,10r,13r,14s,17r)-10,13-二甲基-17-((r)-6-甲基庚-2-基)-2,3,4,7,8,9,10,11,12,13,14,15,16,17-四十氢-1h-环戊[a]菲-3-基-4-苯甲酰胺基-3-氯苯甲酸酯的13c-nmr谱图;
图13为实施例7制得的n-(1-溴萘-2-基)苯甲酰胺的1h-nmr谱图;
图14为实施例7制得的n-(1-溴萘-2-基)苯甲酰胺的13c-nmr谱图;
图15为实施例8制得的n-(1,6-二溴萘-2-基)苯甲酰胺的1h-nmr谱图;
图16为实施例8制得的n-(1,6-二溴萘-2-基)苯甲酰胺的13c-nmr谱图;
图17为实施例9制得的n-(1-溴-7-苯基萘-2-基)苯甲酰胺的1h-nmr谱图;
图18为实施例9制得的n-(1-溴-7-苯基萘-2-基)苯甲酰胺的13c-nmr谱图;
图19为实施例10制得的n-(2,3,5-三溴苯基)苯甲酰胺的1h-nmr谱图;
图20为实施例10制得的n-(2,3,5-三溴苯基)苯甲酰胺的13c-nmr谱图;
图21为实施例11制得的n-(2,5-二溴-6-甲氧基吡啶-3-基)苯甲酰胺的1h-nmr谱图;
图22为实施例11制得的n-(2,5-二溴-6-甲氧基吡啶-3-基)苯甲酰胺的13c-nmr谱图;
图23为实施例12制得的(1r,2s,5r)-2-异丙基-5-甲基环己基4-苯甲酰胺基-3-溴苯甲酸酯的1h-nmr谱图;
图24为实施例12制得的(1r,2s,5r)-2-异丙基-5-甲基环己基4-苯甲酰胺基-3-溴苯甲酸酯的13c-nmr谱图。
具体实施方式
下面通过具体实施例对本发明做进一步说明,但不限于此。
实施例1、n-(2-氯-4-(1h-吲哚-1-基)苯基)苯甲酰胺
在25mlschlenk管中,加入n-(4-(1h-吲哚-1-基)苯基)-n-羟基苯甲酰胺(0.2mmol,66mg)和碳酸钠(0.1mmol),氮气抽换气三次后,在氮气氛围中加入四氢呋喃(1ml),冷却至0℃后,在0℃条件下边搅拌边滴加二氯亚砜(0.24mmol),滴加完成后,通过tlc来追踪反应进程,待反应完成后,反应混合物通过旋转蒸发除去溶剂,粗产品经过柱层析(洗脱剂为石油醚:乙酸乙酯=5:1)得到白色粉末状纯品n-(2-氯-4-(1h-吲哚-1-基)苯基)苯甲酰胺,收率为66%。
1hnmr(500mhz,cdcl3):δ8.63(d,j=8.8hz,1h),8.39(s,1h),7.90-7.81(m,2h),7.60(d,j=7.8hz,1h),7.55-7.47(m,2h),7.45(t,j=7.6hz,3h),7.39(dd,j=8.8,2.4hz,1h),7.20(t,j=3.8hz,1h),7.19-7.13(m,1h),7.12-7.06(m,1h),6.60(d,j=3.2hz,1h)。
13cnmr(126mhz,cdcl3):δ165.4,136.2,135.8,134.4,133.1,132.4,129.4,129.1,127.7,127.2,124.7,123.8,123.7,122.8,122.4,121.3,120.7,110.3,104.2。
实施例2、2-氯-n-甲基-4-硝基苯胺
在25mlschlenk管中,加入n-甲基-n-(4-硝基苯基)羟胺(0.2mmol,34mg)和碳酸钠(0.1mmol),氮气抽换气三次后,在氮气氛围中加入四氢呋喃(1ml),冷却至0℃后,在0℃条件下边搅拌边滴加二氯亚砜(0.24mmol),滴加完成后,通过tlc来追踪反应进程,待反应完成后,反应混合物通过旋转蒸发除去溶剂,粗产品经过柱层析(洗脱剂为石油醚:乙酸乙酯=5:1)得到无色油状纯品2-氯-n-甲基-4-硝基苯胺,收率为65%。
1hnmr(500mhz,cdcl3):δ8.19(d,j=2.5hz,1h),8.09(dd,j=9.1,2.5hz,1h),6.60(d,j=9.1hz,1h),5.16(s,1h),3.02(d,j=5.0hz,3h)。
13cnmr(126mhz,cdcl3):δ149.8,137.4,125.3,124.9,117.8,108.4,30.2。
实施例3、n-(2-氯-6-甲氧基-5-(三异丙基甲硅烷基)乙炔基)吡啶-3-基)苯甲酰胺
在25mlschlenk管中,加入n-羟基-n-(6-甲氧基-5-(三异丙基甲硅烷基)乙炔基)吡啶-3-基)苯甲酰胺(0.2mmol,85mg)和碳酸钠(0.1mmol),氮气抽换气三次后,在氮气氛围中加入四氢呋喃(1ml),冷却至0℃后,在0℃条件下边搅拌边滴加二氯亚砜(0.24mmol),滴加完成后,通过tlc来追踪反应进程,待反应完成后,反应混合物通过旋转蒸发除去溶剂,粗产品经过柱层析(洗脱剂为石油醚:乙酸乙酯=5:1)得到白色粉末状纯品n-(2-氯-6-甲氧基-5-(三异丙基甲硅烷基)乙炔基)吡啶-3-基)苯甲酰胺,收率为95%。
1hnmr(500mhz,cdcl3):δ8.81(s,1h),8.10(s,1h),7.90(d,j=7.6hz,2h),7.59(t,j=7.3hz,1h),7.52(t,j=7.6hz,2h),3.97(s,3h),1.14(s,21h)。
13cnmr(126mhz,cdcl3):δ164.3,158.7,135.1,134.9,132.9,131.4,128.0,126.0,123.9,106.1,98.9,97.6,53.7,17.6,10.3。
实施例4、n-(2-氯-4-((3as,5ar,8ar,8bs)-2,2,7,7-四甲基四氢-3ah-双([1,3]二氧咯)[4,5-b:4',5'-d]吡喃-3a-基)甲氧基)苯基)苯甲酰胺
在25mlschlenk管中,加入n-羟基-n-(4-((3as,5ar,8ar,8bs)-2,2,7,7-四甲基四氢-3ah-双([1,3]二氧咯)[4,5-b:4',5'-d]吡喃-3a-基)甲氧基)苯基)苯甲酰胺(0.2mmol,94mg)和碳酸钠(0.1mmol),氮气抽换气三次后,在氮气氛围中加入四氢呋喃(1ml),冷却至0℃后,在0℃条件下边搅拌边滴加二氯亚砜(0.24mmol),滴加完成后,通过tlc来追踪反应进程,待反应完成后,反应混合物通过旋转蒸发除去溶剂,粗产品经过柱层析(洗脱剂为石油醚:乙酸乙酯=5:1)得到白色粉末状纯品n-(2-氯-4-((3as,5ar,8ar,8bs)-2,2,7,7-四甲基四氢-3ah-双([1,3]二氧咯)[4,5-b:4',5'-d]吡喃-3a-基)甲氧基)苯基)苯甲酰胺,收率为83%。
1hnmr(500mhz,cdcl3):δ8.37(d,j=9.1hz,1h),8.23(s,1h),7.94-7.84(m,2h),7.58-7.52(m,1h),7.52-7.45(m,2h),7.02(d,j=2.8hz,1h),6.91(dd,j=9.1,2.8hz,1h),4.64(dd,j=7.9,2.6hz,1h),4.51(d,j=2.6hz,1h),4.26(dd,j=7.9,1.2hz,1h),4.14(d,j=10.2hz,1h),4.04(d,j=10.2hz,1h),3.96(dd,j=13.0,1.8hz,1h),3.79(d,j=13.0hz,1h),1.56(s,3h),1.50(s,3h),1.46(s,3h),1.35(s,3h)。
13cnmr(126mhz,cdcl3):δ165.2,155.3,134.7,132.0,128.9,128.5,127.1,124.3,123.0,115.5,114.1,109.1,109.0,102.0,70.9,70.1,70.0,69.5,61.3,26.6,26.0,25.3,24.0。
实施例5、n-(2-氯-4-((8r,9s,13s,14s)-13-甲基-17-氧代-7,8,9,11,12,13,14,15,16,17-十氢-6h-环戊[a]菲-2-基)氧基)苯基)苯甲酰胺
在25mlschlenk管中,加入n-羟基-n-(4-((8r,9s,13s,14s)-13-甲基-17-氧代-7,8,9,11,12,13,14,15,16,17-十氢-6h-环戊[a]菲-2-基)氧基)苯基)苯甲酰胺(0.2mmol,96mg)和碳酸钠(0.1mmol),氮气抽换气三次后,在氮气氛围中加入四氢呋喃(1ml),冷却至0℃后,在0℃条件下边搅拌边滴加二氯亚砜(0.24mmol),滴加完成后,通过tlc来追踪反应进程,待反应完成后,反应混合物通过旋转蒸发除去溶剂,粗产品经过柱层析(洗脱剂为石油醚:乙酸乙酯=5:1)得到白色粉末状纯品n-(2-氯-4-((8r,9s,13s,14s)-13-甲基-17-氧代-7,8,9,11,12,13,14,15,16,17-十氢-6h-环戊[a]菲-2-基)氧基)苯基)苯甲酰胺,收率为78%。
1hnmr(500mhz,cdcl3):δ8.43(d,j=9.0hz,1h),8.32(s,1h),7.91(dd,j=5.2,3.3hz,2h),7.62-7.54(m,1h),7.54-7.46(m,2h),7.26(d,j=8.5hz,1h),7.08(d,j=2.7hz,1h),6.98(dd,j=9.0,2.7hz,1h),6.81(dd,j=8.5,2.7hz,1h),6.75(d,j=2.6hz,1h),2.92-2.83(m,2h),2.50(dd,j=19.0,8.6hz,1h),2.41(ddd,j=10.2,7.1,3.6hz,1h),2.28(td,j=10.9,4.0hz,1h),2.20-2.10(m,1h),2.04-1.93(m,2h),1.72-1.37(m,7h),0.93(s,3h)。
13cnmr(126mhz,cdcl3):δ165.2,154.6,154.1,138.5,135.4,134.6,132.2,130.0,128.9,127.1,126.8,124.3,123.0,119.2,119.0,118.0,116.4,50.5,48.0,44.1,38.2,35.9,31.6,29.5,26.4,25.9,21.6,13.9。
实施例6、(3s,8s,9s,10r,13r,14s,17r)-10,13-二甲基-17-((r)-6-甲基庚-2-基)-2,3,4,7,8,9,10,11,12,13,14,15,16,17-四十氢-1h-环戊[a]菲-3-基-4-苯甲酰胺基-3-氯苯甲酸酯
在25mlschlenk管中,加入(3s,8s,9s,10r,13r,14s,17r)-10,13-二甲基-17-((r)-6-甲基庚-2-基)-2,3,4,7,8,9,10,11,12,13,14,15,16,17-四癸基-1h-环戊[a]菲-3-基-4-(n-羟基苯甲酰胺基)苯甲酸酯(0.2mmol,125mg)和碳酸钠(0.1mmol),氮气抽换气三次后,在氮气氛围中加入四氢呋喃(1ml),冷却至0℃后,在0℃条件下边搅拌边滴加二氯亚砜(0.24mmol),滴加完成后,通过tlc来追踪反应进程,待反应完成后,反应混合物通过旋转蒸发除去溶剂,粗产品经过柱层析(洗脱剂为石油醚:乙酸乙酯=5:1)得到白色粉末状纯品(3s,8s,9s,10r,13r,14s,17r)-10,13-二甲基-17-((r)-6-甲基庚-2-基)-2,3,4,7,8,9,10,11,12,13,14,15,16,17-四十氢-1h-环戊[a]菲-3-基-4-苯甲酰胺基-3-氯苯甲酸酯,收率55%。
1hnmr(500mhz,cdcl3):δ8.71(d,j=8.7hz,1h),8.63(s,1h),8.10(d,j=1.9hz,1h),8.00(dd,j=8.7,1.9hz,1h),7.95-7.88(m,2h),7.65-7.56(m,1h),7.53(dd,j=10.4,4.7hz,2h),5.42(d,j=4.5hz,1h),4.94-4.71(m,1h),2.47(d,j=7.9hz,2h),2.08-1.95(m,3h),1.92(dt,j=13.2,3.3hz,1h),1.88-1.80(m,1h),1.79-1.72(m,1h),1.72-1.42(m,7h),1.41-1.32(m,3h),1.22-0.97(m,13h),0.92(d,j=6.5hz,3h),0.87(dd,j=6.6,2.2hz,6h),0.69(s,3h)。
13cnmr(126mhz,cdcl3):δ165.2,164.4,139.6,138.5,134.2,132.6,130.3,129.5,129.1,127.2,126.9,122.9,122.4,120.2,75.0,56.7,56.2,50.1,42.4,39.8,39.5,38.2,37.0,36.7,36.2,35.8,32.0,31.9,28.3,28.0,27.9,24.3,23.9,22.8,22.6,21.1,19.4,18.8,11.9。
实施例7、n-(1-溴萘-2-基)苯甲酰胺
在25mlschlenk管中,加入n-羟基-n-(萘-2-基)苯甲酰胺(0.2mmol,53mg),氮气抽换气三次后,在氮气氛围中加入二氯甲烷(2ml),冷却至0℃后,在0℃条件下边搅拌边滴加二溴亚砜(0.24mmol),滴加完成后,移至室温,通过tlc来追踪反应进程,待反应完成后,反应混合物通过旋转蒸发除去溶剂,粗产品经过柱层析(洗脱剂为石油醚:乙酸乙酯=5:1)得到白色粉末状纯品n-(1-溴萘-2-基)苯甲酰胺,收率为97%。
1hnmr(500mhz,cdcl3):δ8.76(s,1h),8.69(d,j=9.0hz,1h),8.19(d,j=8.5hz,1h),8.06-7.97(m,2h),7.86(dd,j=19.4,8.5hz,2h),7.66-7.52(m,4h),7.52-7.44(m,1h)。
13cnmr(126mhz,cdcl3):δ165.4,134.7,134.5,132.3,132.0,131.7,129.0,128.5,128.2,127.8,127.3,126.6,125.6,120.8,112.1。
实施例8、n-(1,6-二溴萘-2-基)苯甲酰胺
在25mlschlenk管中,加入n-(6-溴萘-2-基)-n-羟基苯甲酰胺(0.2mmol,68mg),氮气抽换气三次后,在氮气氛围中加入二氯甲烷(2ml),冷却至0℃后,在0℃条件下边搅拌边滴加二溴亚砜(0.24mmol),滴加完成后,移至室温,通过tlc来追踪反应进程,待反应完成后,反应混合物通过旋转蒸发除去溶剂,粗产品经过柱层析(洗脱剂为石油醚:乙酸乙酯=5:1)得到白色粉末状纯品n-(1,6-二溴萘-2-基)苯甲酰胺,收率为86%。
1hnmr(500mhz,cdcl3):δ8.74-8.65(m,2h),8.06-7.93(m,4h),7.74(d,j=9.0hz,1h),7.66-7.57(m,2h),7.54(dd,j=10.3,4.6hz,2h)。
13cnmr(126mhz,cdcl3):δ165.4,134.9,134.5,132.4,131.1,130.6,130.1,129.0(2c),128.4,127.5,127.2,121.8,119.8,111.9。
实施例9、n-(1-溴-7-苯基萘-2-基)苯甲酰胺
在25mlschlenk管中,加入n-羟基-n-(7-苯基萘-2-基)苯甲酰胺(0.2mmol,68mg),氮气抽换气三次后,在氮气氛围中加入二氯甲烷(2ml),冷却至0℃后,在0℃条件下边搅拌边滴加二溴亚砜(0.24mmol),滴加完成后,移至室温,通过tlc来追踪反应进程,待反应完成后,反应混合物通过旋转蒸发除去溶剂,粗产品经过柱层析(洗脱剂为石油醚:乙酸乙酯=5:1)得到白色粉末状纯品n-(1-溴-7-苯基萘-2-基)苯甲酰胺,收率为85%。
1hnmr(500mhz,dmso-d6):δ10.33(s,1h),8.41(s,1h),8.10(t,j=7.4hz,3h),8.04(d,j=8.7hz,1h),7.92(dd,j=8.5,1.5hz,1h),7.81(d,j=7.4hz,2h),7.74(d,j=8.6hz,1h),7.63(t,j=7.3hz,1h),7.59-7.50(m,4h),7.43(t,j=7.3hz,1h)。
13cnmr(126mhz,dmso-d6):δ165.9,140.2,136.1,134.5,132.6,132.4,132.0,129.73,129.68,129.0(2c),128.5,128.3,128.2,127.7,127.2,126.3,124.5,119.9。
实施例10、n-(2,3,5-三溴苯基)苯甲酰胺
在25mlschlenk管中,加入n-(3,5-二溴苯基)-n-羟基苯甲酰胺(0.2mmol,74mg),氮气抽换气三次后,在氮气氛围中加入二氯甲烷(2ml),冷却至0℃后,在0℃条件下边搅拌边滴加二溴亚砜(0.24mmol),滴加完成后,移至室温,通过tlc来追踪反应进程,待反应完成后,反应混合物通过旋转蒸发除去溶剂,粗产品经过柱层析(洗脱剂为石油醚:乙酸乙酯=5:1)得到白色粉末状纯品n-(2,3,5-三溴苯基)苯甲酰胺,收率为50%。
1hnmr(500mhz,cdcl3):δ8.80(d,j=2.2hz,1h),8.58(s,1h),7.96-7.86(m,2h),7.64-7.58(m,1h),7.57(d,j=2.2hz,1h),7.56-7.51(m,2h)。
13cnmr(126mhz,cdcl3):δ165.3,138.3,133.9,132.7,131.0,129.1,127.2,125.5,122.7,122.4,115.1。
实施例11、n-(2,5-二溴-6-甲氧基吡啶-3-基)苯甲酰胺
在25mlschlenk管中,加入n-(5-溴-6-甲氧基吡啶-3-基)-n-羟基苯甲酰胺(0.2mmol,64mg),氮气抽换气三次后,在氮气氛围中加入二氯甲烷(2ml),冷却至0℃后,在0℃条件下边搅拌边滴加二溴亚砜(0.24mmol),滴加完成后,移至室温,通过tlc来追踪反应进程,待反应完成后,反应混合物通过旋转蒸发除去溶剂,粗产品经过柱层析(洗脱剂为石油醚:乙酸乙酯=5:1)得到白色粉末状纯品n-(2,5-二溴-6-甲氧基吡啶-3-基)苯甲酰胺,收率为53%。
1hnmr(500mhz,dmso-d6):δ10.20(s,1h),8.21(s,1h),7.99(d,j=7.5hz,2h),7.62(t,j=7.3hz,1h),7.54(t,j=7.5hz,2h),3.96(s,3h)。
13cnmr(126mhz,dmso-d6):δ166.2,157.4,143.3,136.1,133.9,132.5,129.0,128.9,128.2,104.7,55.8。
实施例12、(1r,2s,5r)-2-异丙基-5-甲基环己基4-苯甲酰胺基-3-溴苯甲酸酯
在25mlschlenk管中,加入(1r,2s,5r)-2-异丙基-5-甲基环己基4-(n-羟基苯甲酰胺基)苯甲酸酯(0.2mmol,79mg),氮气抽换气三次后,在氮气氛围中加入二氯甲烷(2ml),冷却至0℃后,在0℃条件下边搅拌边滴加二溴亚砜(0.24mmol),滴加完成后,移至室温,通过tlc来追踪反应进程,待反应完成后,反应混合物通过旋转蒸发除去溶剂,粗产品经过柱层析(洗脱剂为石油醚:乙酸乙酯=5:1)得到白色粉末状纯品(1r,2s,5r)-2-异丙基-5-甲基环己基4-苯甲酰胺基-3-溴苯甲酸酯,收率为54%。
1hnmr(500mhz,cdcl3):δ8.70(d,j=8.7hz,1h),8.66(s,1h),8.26(d,j=1.6hz,1h),8.04(dd,j=8.7,1.7hz,1h),7.95(d,j=7.5hz,2h),7.61(t,j=7.2hz,1h),7.54(t,j=7.7hz,2h),4.94(td,j=10.9,4.4hz,1h),2.11(d,j=12.0hz,1h),1.93(dtd,j=13.9,6.9,2.6hz,1h),1.74(dd,j=9.1,7.0hz,2h),1.61-1.50(m,2h),1.20-1.06(m,2h),0.93(dd,j=6.7,4.3hz,7h),0.80(d,j=6.9hz,3h)。
13cnmr(126mhz,cdcl3):δ165.3,164.4,139.5,134.2,133.6,132.6,130.1,129.1,127.4,127.2,120.4,112.9,75.3,47.3,41.0,34.3,31.5,26.6,23.7,22.0,20.8,16.5。
试验例1
以n-羟基-n-(萘-2-基)苯甲酰胺和二氯亚砜为原料,四氢呋喃为溶剂,溶剂的用量为1ml,碱的用量为2当量,反应温度为0℃,在氮气氛围下反应1h,探究了碱的种类对反应的影响,如表1-1所示。
表1-1碱对反应的影响
从表1-1实验结果可以看出,当x为cl时,na2co3为该反应的最佳碱。
试验例2
以n-羟基-n-(萘-2-基)苯甲酰胺和二氯亚砜为原料,na2co3为碱,碱的用量为2当量,溶剂的用量为1ml,反应温度为0℃,在氮气氛围下反应1h,探究了溶剂的种类对反应的影响,碱的用量为2当量,如表1-2所示。
表1-2溶剂对反应的影响
从表1-2实验结果可以看出,当x为cl时,以上溶剂的效果都不如thf,thf为该反应的最佳溶剂。
试验例3
以n-羟基-n-(萘-2-基)苯甲酰胺和二氯亚砜为原料,na2co3为碱,碱的用量为2当量,thf为溶剂,溶剂的用量为1ml,反应温度为0℃,在氮气氛围下反应1h,探究了碱的用量对反应的影响,如表1-3所示。
表1-3碱的用量对反应的影响
从表1-3实验结果可以看出,当x为cl时,碱的用量为0.5当量时对反应最有利。
试验例4
以n-羟基-n-(萘-2-基)苯甲酰胺和二溴亚砜为原料,碳酸钠为碱,碱的用量为2当量,反应温度为-20℃,在氮气氛围下反应0.5h,探究了溶剂的种类对反应的影响,如表2-1所示。
表2-1溶剂对反应的影响
从表2-1实验结果可以看出,当x为br时,dcm为该反应的最佳溶剂。
试验例5
以n-羟基-n-(萘-2-基)苯甲酰胺和二溴亚砜为原料,dcm为溶剂,溶剂的用量为1ml,反应温度为-20℃,在氮气氛围下反应0.5h,探究了碱的种类对反应的影响,碱的用量为2当量,如表2-2所示。
表2-2碱对反应的影响
从表2-2实验结果可以看出,当x为br时,反应无需加碱即可顺利进行。
试验例6
以n-羟基-n-(萘-2-基)苯甲酰胺和二溴亚砜为原料,不加碱,dcm为溶剂,溶剂的用量为1ml,在氮气氛围下反应0.5h,探究了温度对反应的影响,如表2-3所示。
表2-3温度对反应的影响
从表2-3实验结果可以看出,当x为br时,0℃加入二溴亚砜后移至室温进行对反应最有利。
- 还没有人留言评论。精彩留言会获得点赞!