鬼臼毒素羧酸酯类衍生物在制备抗肿瘤产品中的应用的制作方法
一、技术领域
本发明属于化学制药技术领域,具体涉及一类苯磺酰胺苯乙酸鬼臼毒素羧酸酯类衍生物的制备及其在肿瘤抑制方面的应用。
二、
背景技术:
天然产物是发现药物的重要来源,在保健和预防疾病方面起着至关重要的作用。足叶草毒素(podophylolotoxin,ppt)属于环木素类,是足叶草树脂的核心成分,是一种有效的天然产物,长期以来一直被用作治疗、抗风湿、抗病毒和抗癌的药物。近年来,人们对ppt及其半合成衍生物的结构修饰进行了广泛的研究,如依托泊苷、替尼泊苷,它们已被用于多种恶性肿瘤的临床治疗,包括肺癌和睾丸癌、淋巴瘤和非淋巴细胞白血病。然而,这些药物在临床治疗中经常显现毒副作用,这限制了它们的临床使用。
研究表明,苯乙酸作为重要药物的中间体,具有抑菌,消炎,抗焦虑,抗癌等多种生物活性。如:罗美昔布是一种非甾体抗炎药,主要用于治疗风湿性关节炎;布洛芬和扶他林可以消炎止痛;4-羟基苯乙酸被认为是一种潜在的高渗、缺氧的抑制剂,具有抗焦虑、抑菌和防治肺水肿活性特性。另外,对氨基苯乙酸可用于合成非甾体抗炎药联苯乙酸,抗风湿药阿克他利等。
众所周知,磺胺类药物是开发较早的合成抗菌药物,有研究表明某些含有苯磺酰胺结构单元的化合物具有利尿、抗癌、抑制hiv-1蛋白酶、拮抗α1-肾上腺素受体等生物活性。
基于此,本发明将含有苯磺酰基及对氨基苯乙酸结构单元连接后,将其引入到鬼臼毒素中,设计合成了一系列苯磺酰胺苯乙酸鬼臼毒素酯类衍生物,以期获得新型高效、低毒的抗肿瘤药物。
三、
技术实现要素:
本发明需要解决的问题是提供一类结构新颖的苯磺酰胺苯乙酸鬼臼毒素酯类衍生物及其制备方法和在肿瘤抑制中的应用。
本发明的苯磺酰胺苯乙酸鬼臼毒素酯类衍生物结构式如式ⅰ所示:
本发明的式ⅰ结构苯磺酰胺苯乙酸鬼臼毒素酯类衍生物是通过鬼臼毒素与相应羧酸半合成得到新颖的结构活性功能化合物。
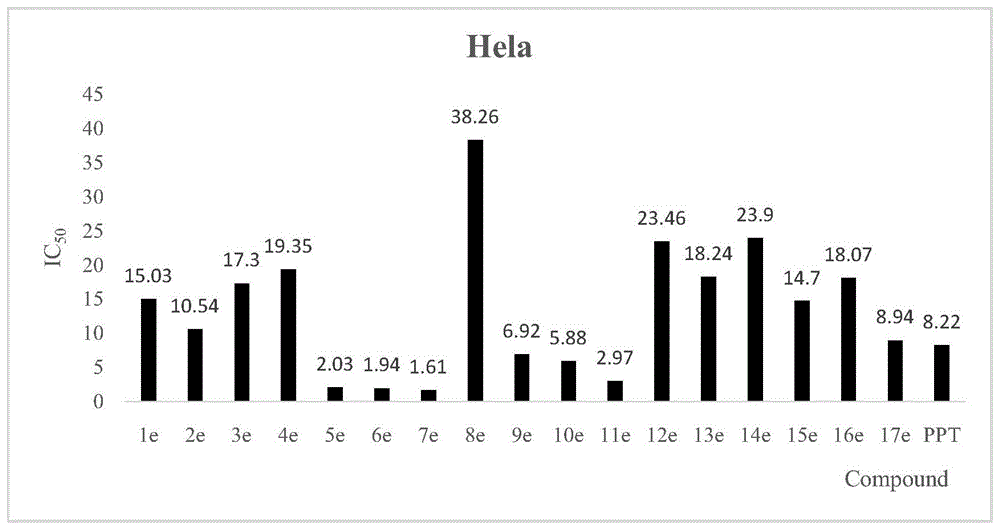
本发明通过体外肿瘤细胞抑制活性证明肿瘤细胞株mcf-7人乳腺癌细胞、hela人宫颈癌细胞、hepg-2人肝癌细胞、a549人肺癌细胞具有较强的抑制活性,其中化合物7e对hela具有最好的抑制活性,ic50值达到1.61μm,详见附图1、2、3、4。通过毒性实验证明了这一类新颖的化合物对人正常肾上皮细胞(293t)毒副作用较低,且化合物7e对293t细胞毒性也较低,ic50值为426.87μm,明显优于鬼臼毒素,ic50值为27.84μm,详见附图5。
本发明与现有技术相比较其有益效果:
在本发明中,所获苯磺酰胺苯乙酸鬼臼毒素酯类衍生物与股臼毒素相比,具有明显的肿瘤细胞抑制活性,部分新颖化合物对肿瘤细胞株的抑制活性明显优于其母体分子鬼臼毒素,并且毒副作用低。同时化合物7e对hela细胞具有最强抑制活性。本研究拟通过流式、westernblot及激光共聚焦手段对药物作用机制进行深入探究。
四:附图说明
图1表示化合物1e-17e及鬼臼毒素对hela细胞增殖的抑制
图2表示化合物1e-17e及鬼臼毒素对mcf-7细胞增殖的抑制
图3表示化合物1e-17e及鬼臼毒素对hepg-2细胞增殖的抑制
图4表示化合物1e-17e及鬼臼毒素对a549细胞增殖的抑制
图5表示化合物1e-17e及鬼臼毒素对293t细胞增殖的抑制
图6表示化合物7e和鬼臼毒素对人宫颈癌hela细胞凋亡诱导作用
五:具体实施方式
实例一:式ⅰ类苯磺酰胺苯乙酸鬼臼毒素酯类衍生物的制备
将5.58mmol的对氨基苯乙酸溶于20ml的水中,在室温条件下搅拌,用饱和碳酸钠溶液将ph调至8~9,继续搅拌直至酸完全溶解于水中。向该反应体系中加入6mmol的含不同取代基的苯磺酰氯,室温条件下搅拌过夜。反应结束后,向反应体系中逐滴滴加浓度为1mol/l的盐酸溶液至的ph为1~2,析出大量的固体,然后用布氏漏斗经真空抽滤,水洗,干燥得到的浅黄色固体,即得中间产物苯磺酰胺苯乙酸衍生物。该产物可以直接用于下一步化学合成,或者也可以通过在甲醇中重结晶来进一步纯化。
称取0.175mmol鬼臼毒素、0.035mmol4-二甲氨基吡啶(dmap)溶解于30ml二氯甲烷中,边搅拌边将0.35mmoln,n-二环己基碳二亚胺(dcc)加入到反应体系中,在冰浴条件中,分别加入0.263mmol不同取代的苯磺酰胺苯乙酸继续搅拌反应6小时。用tlc法检测反应进度(乙酸乙酯:石油醚=1:2~1:5),确认反应进程。反应结束后,将该体系置于-20℃冰箱中冷冻过夜并过滤,以除去体系中未参与反应的含不同取代基的苯磺酰胺苯乙酸、dmap和反应中产生的杂质。用旋转蒸发仪将所得滤液低温减压浓缩为5-6ml,以乙酸乙酯和石油醚(v:v=1:2)的混合溶剂为展开剂,进行薄层层析,经分离得淡黄色的目标产物苯磺酰胺苯乙酸鬼臼毒素酯衍生物。
相应化合物的理化数据如下:
化合物1e:1hnmr(600mhz,cdcl3)δ7.75(t,j=7.3hz,2h),7.54(t,j=7.1hz,1h),7.48(t,j=7.4hz,1h),7.39(d,j=7.7hz,2h),7.37–7.35(m,1h),7.16(d,j=8.3hz,2h),6.62(s,1h),6.53(s,1h),6.35(s,2h),6.00–5.96(m,2h),5.84(d,j=9.4hz,1h),4.59(d,j=4.4hz,1h),4.15(dd,j=15.4,8.2hz,2h),3.81(s,3h),3.73(s,6h),3.70(s,1h),3.64(d,j=2.8hz,2h),2.77–2.69(m,1h).
化合物2e:1hnmr(600mhz,cdcl3)δ7.83–7.79(m,2h),7.61(td,j=7.9,1.1hz,1h),7.54(dd,j=8.7,4.6hz,1h),7.48(s,1h),7.45(td,j=7.8,0.8hz,1h),7.21(d,j=5.5hz,2h),6.61(s,1h),6.52(s,1h),6.35(s,2h),5.99(dd,j=17.0,1.0hz,2h),5.85(d,j=9.4hz,1h),4.58(d,j=4.5hz,1h),4.14–4.10(m,2h),3.81(s,3h),3.73(s,6h),3.70(d,j=4.1hz,1h),3.67(d,j=3.9hz,2h),2.70(dq,j=14.3,8.9hz,1h).
化合物3e:1hnmr(600mhz,cdcl3)δ8.61(t,j=1.8hz,1h),8.34(dt,j=17.3,8.6hz,1h),8.03(d,j=7.9hz,1h),7.72(s,1h),7.19(d,j=8.4hz,2h),7.09(d,j=8.4hz,2h),6.62(s,1h),6.52(s,1h),6.36(s,2h),5.98(dd,j=14.2,1.0hz,2h),5.85(d,j=9.3hz,1h),4.59(d,j=4.4hz,1h),4.21(dd,j=9.1,7.3hz,1h),4.15–4.11(m,1h),3.80(s,3h),3.72(s,6h),3.70(s,1h),3.67(d,j=6.3hz,2h),2.81–2.73(m,1h).
化合物4e:1hnmr(600mhz,cdcl3)1hnmr(600mhz,cdcl3)δ8.22(d,j=8.8hz,1h),7.92(d,j=8.5hz,1h),7.18(d,j=8.4hz,1h),7.12(t,j=9.0hz,1h),7.07(d,j=8.3hz,2h),6.65(d,j=8.3hz,2h),6.61(s,1h),6.52(d,j=6.2hz,1h),6.36(d,j=6.5hz,2h),5.98(d,j=15.5hz,2h),5.84(t,j=9.4hz,1h),4.58(t,j=3.8hz,1h),4.22(dt,j=15.0,7.5hz,1h),4.17–4.10(m,1h),3.81(s,3h),3.74(s,6h),3.66(d,j=3.9hz,1h),3.60(s,2h),2.80–2.73(m,1h).
化合物5e:1hnmr(600mhz,cdcl3)δ8.01(d,j=15.5hz,1h),7.94(d,j=8.2hz,2h),7.36(d,j=8.2hz,2h),6.95(d,j=15.5hz,1h),6.81(s,1h),6.57(s,1h),6.41(s,2h),6.05(d,j=8.7hz,1h),6.00(dd,j=10.3,1.1hz,2h),4.64(d,j=4.1hz,1h),4.44(dd,j=9.1,6.7hz,1h),4.27(t,j=9.7hz,1h),3.81(s,3h),3.78(s,6h),3.72(s,1h),2.99(dd,j=14.5,4.3hz,1h),2.75(q,j=7.6hz,2h),1.20–1.01(m,3h).
化合物6e:1hnmr(600mhz,cdcl3)δ7.55(d,j=7.9hz,1h),7.49(d,j=8.0hz,1h),7.37(td,j=8.0,5.5hz,1h),7.22–7.20(m,1h),7.18(d,j=8.4hz,2h),7.10(d,j=8.3hz,2h),6.62(s,1h),6.53(s,1h),6.36(s,2h),5.98(dd,j=15.9,1.1hz,2h),5.85(d,j=9.3hz,1h),4.59(d,j=4.4hz,1h),4.22–4.18(m,1h),4.13(t,j=9.9hz,1h),3.81(s,3h),3.73(s,6h),3.70–3.67(m,1h),3.66(d,j=5.1hz,2h),2.80–2.72(m,1h).
化合物7e:1hnmr(600mhz,cdcl3)δ7.78(dd,j=8.8,5.0hz,2h),7.17(d,j=8.3hz,2h),7.08(dd,j=12.2,8.5hz,4h),6.61(s,1h),6.53(s,1h),6.36(s,2h),5.98(dd,j=15.5,1.0hz,2h),5.84(d,j=9.3hz,1h),4.59(d,j=4.4hz,1h),4.24–4.19(m,1h),4.13(t,j=9.9hz,1h),3.80(s,3h),3.73(s,6h),3.68(s,1h),3.65(d,j=3.8hz,h),2.81–2.73(m,1h).
化合物8e:1hnmr(600mhz,cdcl3)δ7.84(td,j=8.6,6.2hz,1h),7.18(d,j=8.5hz,2h),7.15(s,1h),7.11(dd,j=11.1,5.5hz,2h),6.92(ddd,j=11.7,7.6,5.6hz,1h),6.60(s,1h),6.53(s,1h),6.36(s,2h),5.99(dd,j=16.9,1.1hz,2h),5.84(d,j=9.3hz,1h),4.59(d,j=4.5hz,1h),4.18(dd,j=9.1,7.3hz,1h),4.14(d,j=7.1hz,1h),3.82(s,3h),3.74(s,6h),3.67(s,1h),3.64(d,j=4.7hz,2h),2.75(dtd,j=14.6,10.3,7.3hz,1h).
化合物9e:1hnmr(600mhz,cdcl3)δ7.53(d,j=8.6hz,1h),7.44–7.39(m,1h),7.36(t,j=2.0hz,1h),7.20(d,j=8.5hz,1h),7.17(d,j=8.6hz,1h),6.94(t,j=8.8hz,2h),6.62(s,1h),6.53(d,j=3.4hz,1h),6.35(s,2h),5.99(dd,j=16.3,1.1hz,2h),5.84(d,j=9.4hz,1h),4.58(d,j=4.5hz,1h),4.09(dd,j=12.9,6.7hz,2h),3.82(s,3h),3.74(s,6h),3.67(s,1h),3.64(d,j=5.6hz,2h),2.74–2.67(m,1h).
化合物10e:1hnmr(600mhz,cdcl3)δ8.02–7.97(m,1h),7.68–7.65(m,1h),7.51–7.45(m,1h),7.29(d,j=2.1hz,1h),7.15–7.11(m,4h),6.61(s,1h),6.52(s,1h),6.35(s,2h),6.01–5.96(m,2h),5.83(d,j=9.4hz,1h),4.58(d,j=4.5hz,1h),4.07(d,j=8.9hz,2h),3.82(s,3h),3.73(s,6h),3.64(s,1h),3.62(d,j=4.3hz,2h),2.69(dq,j=14.7,9.0hz,1h).
化合物11e:1hnmr(600mhz,cdcl3)δ7.94(d,j=1.7hz,1h),7.68–7.63(m,2h),7.36(s,1h),7.20(d,j=8.4hz,2h),7.08(d,j=8.1hz,2h),6.62(s,1h),6.53(s,1h),6.36(s,2h),5.99(dd,j=15.7,1.0hz,2h),5.85(d,j=9.3hz,1h),4.59(d,j=4.4hz,1h),4.22–4.19(m,1h),4.13(t,j=9.9hz,1h),3.81(s,3h),3.73(s,6h),3.70(s,1h),3.67(d,j=5.9hz,2h),2.77(ddd,j=12.3,9.4,6.3hz,1h).
化合物12e:1hnmr(600mhz,cdcl3)δ7.63–7.61(m,2h),7.57–7.53(m,2h),7.18(d,j=8.4hz,2h),7.08(dd,j=10.4,5.3hz,2h),6.61(s,1h),6.53(s,1h),6.36(s,2h),5.99(dd,j=14.8,1.1hz,2h),5.85(d,j=9.3hz,1h),4.59(d,j=4.4hz,1h),4.24(dd,j=9.1,7.2hz,1h),4.14(t,j=8.4hz,1h),3.81(s,3h),3.73(s,6h),3.69(s,1h),3.66(d,j=4.6hz,2h),2.82–2.74(m,1h).
化合物13e:1hnmr(600mhz,cdcl3)δ7.65(d,j=8.2hz,2h),7.16(dt,j=17.0,8.4hz,4h),7.07(d,j=8.4hz,2h),6.62(s,1h),6.52(s,1h),6.36(s,1h),6.01–5.96(m,2h),5.85(d,j=9.3hz,2h),4.59(d,j=4.4hz,1h),4.18(dd,j=9.0,7.4hz,1h),4.13(q,j=3.6hz,1h),3.80(s,6h),3.72(s,3h),3.67(s,1h),3.65(d,j=2.5hz,2h),2.80–2.72(m,1h),2.34(s,3h).
化合物14e:1hnmr(600mhz,cdcl3)δ7.65(t,j=8.6hz,1h),7.53(d,j=8.6hz,1h),7.38–7.33(m,2h),7.23(dd,j=7.3,2.1hz,2h),7.14–7.12(m,2h),6.51(s,1h),6.40(s,1h),6.37(s,2h),5.99(dd,j=4.3,1.2hz,2h),5.85(d,j=16.8hz,1h),4.77(d,j=9.4hz,1h),4.61(dd,j=8.7,6.8hz,1h),4.09(dd,j=11.6,7.4hz,1h),3.81(s,3h),3.78(s,2h),3.77(s,1h),3.76(s,6h),2.83(d,j=4.7hz,1h),2.60(dd,j=10.2,4.9hz,2h),1.66–1.59(m,2h),1.42(d,j=5.2hz,3h).
化合物15e:1hnmr(600mhz,cdcl3)δ7.70(d,j=8.4hz,2h),7.25(s,1h),7.21(s,1h),7.17(d,j=8.4hz,2h),7.09(d,j=8.4hz,2h),6.62(s,1h),6.53(s,1h),6.36(s,2h),6.01–5.95(m,2h),5.84(d,j=9.3hz,1h),4.59(d,j=4.4hz,1h),4.22(dd,j=9.1,7.3hz,1h),4.12(dd,j=12.9,6.9hz,1h),3.80(s,3h),3.73(s,6h),3.68(s,1h),3.65(d,j=4.1hz,2h),2.90–2.87(m,1h),2.82–2.74(m,1h),1.21(d,j=2.0hz,3h),1.20(d,j=2.0hz,3h).
化合物16e:1hnmr(600mhz,cdcl3)δ7.82(d,j=8.8hz,2h),7.25(s,1h),7.20(d,j=8.4hz,2h),7.14(s,1h),7.08(d,j=8.4hz,2h),6.61(s,1h),6.53(s,1h),6.36(s,2h),6.01–5.96(m,2h),5.85(d,j=9.3hz,1h),4.59(d,j=4.4hz,1h),4.23(dd,j=9.1,7.3hz,1h),4.14(t,j=7.2hz,1h),3.81(s,3h),3.73(s,6h),3.69(d,j=4.2hz,1h),3.67(d,j=5.3hz,2h),2.81–2.74(m,1h).
化合物17e:1hnmr(600mhz,cdcl3)δ8.09(s,1h),7.59(t,j=4.1hz,1h),7.19(d,j=8.4hz,2h),7.13(d,j=8.4hz,2h),6.61(s,1h),6.53(s,1h),6.36(s,2h),5.99(d,j=16.4hz,2h),5.84(d,j=9.3hz,1h),4.59(d,j=4.4hz,1h),4.24(dd,j=9.0,7.3hz,1h),4.14(t,j=8.8hz,1h),3.81(s,3h),3.74(s,6h),3.68(d,j=8.3hz,1h),3.66(d,j=8.5hz,2h),2.81–2.74(m,1h).
实例二:式ⅰ类苯磺酰胺苯乙酸鬼臼毒素酯类衍生物的应用
以mcf-7、hela、hepg-2、a549和293t人正常肾上皮细胞株作为检测株,mtt比色法为检测方法,通过对式ⅰ类苯磺酰胺苯乙酸鬼臼毒素酯类衍生物体外肿瘤细胞抑制活性研究发现,该类新颖结构衍生物具有明显的体外肿瘤细胞抑制活性。结果见附图1、2、3、4、5。
实例三:化合物7e显著诱导hela细胞凋亡
以不同浓度(0,1,2,4,8μm)化合物7e和ppt(4μm)分别作用于hela细胞,处理24h,收集细胞,离心,用pbs清洗细胞两遍;用pi/fitc双染试剂盒中的bindingbuffer重悬细胞,分别加入5μlfitc和10μlpi,避光染色15分钟,用流式细胞仪检测细胞凋亡情况。结果见附图6。该类新颖结构的衍生物能够明显的促进人宫颈癌细胞hela的凋亡。
本发明所述苯磺酰胺苯乙酸鬼臼毒素酯类衍生物可制备成抗肿瘤药物。
- 还没有人留言评论。精彩留言会获得点赞!