一种2-(4-苯甲氧基苯基)乙醇的制备方法与流程
本发明属于药物中间体合成领域,涉及一种2-(4-苯甲氧基苯基)乙醇的制备方法。
背景技术:
盐酸左旋倍他洛尔(如式a所示化合物),于2000年2月首次在美国上市,主要治疗慢性开角型青光眼或者高眼压病人降低眼内压。本药品的副作用小,疗效高,有望成为治疗慢性角型青光眼的首选药物。
2-(4-苯甲氧基苯基)乙醇(如式i所示化合物)是合成盐酸左旋倍他洛尔的重要中间体。
目前,关于2-(4-苯甲氧基苯基)乙醇的制备主要有以下几种方法:
1、wo2007/139923a1公开了一种以对羟基苯乙酸甲酯为起始原料,通过与苄氯缩合反应,再经四氢铝锂还原制备得到2-(4-苯甲氧基苯基)乙醇,该方法可用如下合成路线表示:
然而上述制备方法所用到的原料价格昂贵,成本高,同时还需要使用危险性较高的四氢铝锂作为还原剂,对操作要求严格,安全隐患大,后处理产生的大量三废也会污染环境,不适合工业化的生产。
2、wo2004/113282a1公开了一种以对羟基苯乙醇为原料,通过与苄溴在碱性条件下缩合制备得到2-(4-苯甲氧基苯基)乙醇,该方法可用如下合成路线表示:
上述制备方法的合成路线较短,但是原料价格昂贵,成本高,同时苄溴容易与醇羟基反应,导致反应选择性差,产物纯度低。
3、cn108689810a公开了一种以对氯苯酚为原料,通过与苄氯反应后制成格氏试剂与环氧乙烷反应制备得到2-(4-苯甲氧基苯基)乙醇,具体合成路线如下所示:
上述制备方法使用的反应原料成本较低,但在制备过程中使用到了环氧乙烷,环氧乙烷易燃易爆,使用危险性高,在工业化生产中有较大的局限性。
技术实现要素:
针对现有技术中存在的缺陷,本发明提供一种2-(4-苯甲氧基苯基)乙醇的制备方法,该制备方法以廉价易得的苯酚作为起始原料,经过傅克酰基化、亲核取代、还原环化、氢化开环等步骤高选择性地制备得到了2-(4-苯甲氧基苯基)乙醇,该方法具有成本低、反应条件温和、操作安全、三废污染少的优点,有利于应用到工业化生产中。
本发明提供一种2-(4-苯甲氧基苯基)乙醇的制备方法,包括以下步骤:
1)在三氯化铝的催化下,使苯酚与氯乙酰氯发生反应,得到式ii所示的化合物;
2)在碱性条件下,使式ii所示的化合物与苄卤反应,得到式iii所示的化合物;其中,苄卤为苄溴或苄氯中的一种;
3)对式iii所示的化合物进行还原处理后,调节反应体系为碱性体系,得到式iv所示的化合物;
4)在催化剂的作用下,使式iv的化合物在氢气条件下还原,得到如式i所示的2-(4-苯甲氧基苯基)乙醇;
在一种具体的实施方式中,步骤1)中的溶剂选自二氯甲烷、1,2-二氯乙烷、氯仿、苯、甲苯、乙苯、二甲苯、氯苯中的一种或多种。
在一种具体的实施方式中,步骤1)中,苯酚、三氯化铝以及氯乙酰氯的物质的量之比为1:(1.0~5.0):(1.0~5.0)。
在一种具体的实施方式中,步骤2)中的碱选自碳酸钾、碳酸钠、氢氧化钾、氢氧化钠、碳酸氢钠、碳酸氢钾、乙醇钠、乙醇钾、氢化钠中的一种或多种。
在一种具体的实施方式中,步骤2)中的溶剂选自n,n-二甲基甲酰胺、二甲亚砜、甲苯、四氢呋喃、乙腈、n-甲基吡咯烷酮、六甲基磷酰三胺、丙酮中的一种或多种。
在一种具体的实施方式中,步骤2)中,式ii所示的化合物、苄卤以及碱的物质的量之比为1:(1.0~3.0):(1.0~5.0)。
在一种具体的实施方式中,步骤3)中,所述还原处理的还原剂选自硼氢化钠、硼氢化钾、氰基硼氢化钠、三乙酰氧基硼氢化钠、四氢铝锂、硼烷中的一种或多种。
在一种具体的实施方式中,步骤3)中,式iii所示的化合物、还原剂以及碱的物质的量之比为1:(1.0~3.0):(1.0~5.0)。
在一种具体的实施方式中,步骤4)中,所述催化剂选自钯碳、钌碳、铂碳、雷尼镍中的一种或多种。
在一种具体的实施方式中,步骤4)中,还原反应在0.1~1.0mpa的压力下进行。
本发明所提供的2-(4-苯甲氧基苯基)乙醇的制备方法,以廉价易得的苯酚作为起始原料,经过傅克酰基化、亲核取代、还原环化、氢化开环等步骤高选择性地制备得到了2-(4-苯甲氧基苯基)乙醇,该方法具有成本低、反应条件温和、操作安全、三废污染少的优点,有利于应用到工业化生产中。
附图说明
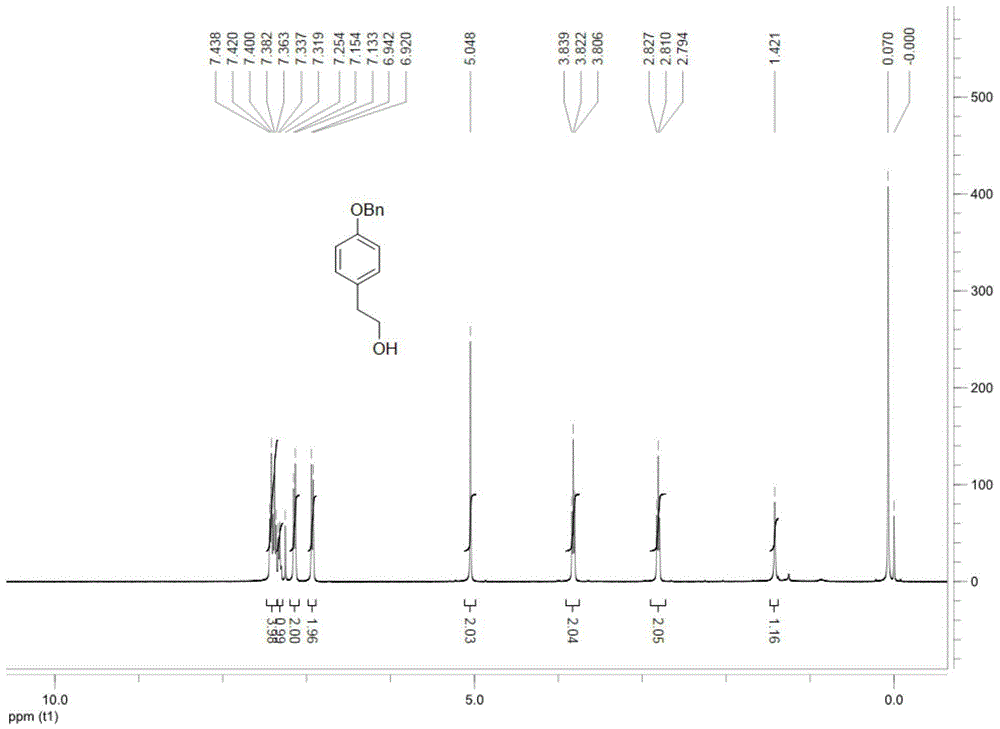
图1为本发明实施例1制备得到的2-(4-苯甲氧基苯基)乙醇的1hnmr图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合本发明的实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供一种本发明提供一种2-(4-苯甲氧基苯基)乙醇的制备方法,包括以下步骤:
1)在三氯化铝的催化下,使苯酚与氯乙酰氯发生反应,得到式ii所示的化合物;
2)在碱性条件下,使式ii所示的化合物与苄卤反应,得到式iii所示的化合物;其中,苄卤为苄溴或苄氯中的一种;
3)对式iii所示的化合物进行还原处理后,调节反应体系为碱性体系,得到式iv所示的化合物;
4)在催化剂的作用下,使式iv的化合物在氢气条件下还原,得到如式i所示的2-(4-苯甲氧基苯基)乙醇;
上述制备方法以苯酚为起始原料,经过傅克酰基化、亲核取代、还原环化、氢化开环等步骤制备得到2-(4-苯甲氧基苯基)乙醇,在该方法中所使用的原料廉价易得,制备过程中也未使用到昂贵和危险性高的其他辅助试剂,具有选择性高、成本低、条件温和、操作简单、三废污染少的优点。
本发明对2-(4-苯甲氧基苯基)乙醇制备过程中各步骤所使用的溶剂不作特别限制,只要能够能够溶解底物,利用反应的进行,在后处理过程中易于除去即可。
例如,步骤1)中的溶剂可选自二氯甲烷、1,2-二氯乙烷、氯仿、苯、甲苯、乙苯、二甲苯、氯苯中的一种或多种,进一步优选为二氯甲烷。
步骤2)中的溶剂可选自n,n-二甲基甲酰胺、二甲亚砜、甲苯、四氢呋喃、乙腈、n-甲基吡咯烷酮、六甲基磷酰三胺、丙酮中的一种或多种,进一步优选为n,n-二甲基甲酰胺。
步骤3)中的溶剂可选自四氢呋喃、水、乙腈、甲醇、乙醇、异丙醇中的一种或多种,进一步优选为甲醇。
步骤4)中的溶剂可选自乙酸乙酯、甲醇、乙醇、异丙醇、四氢呋喃中的一种或多种,进一步优选为甲醇。
可以理解的是,在反应过程中合理控制各个原料组分之间的物质的量,使各个原料组分保持至少等摩尔量的投料比有利于底物转化完全,也可根据反应需求的不同,例如,欲使反应加快速度,缩短反应时间,提高制备效率可适当使一个或多个底物的物质的量过量。
例如,步骤1)中,苯酚、三氯化铝以及氯乙酰氯的物质的量之比为1:(1.0~5.0):(1.0~5.0)。
步骤2)中,式ii所示的化合物、苄卤以及碱的物质的量之比为1:(1.0~3.0):(1.0~5.0)。
步骤3)中,式iii所示的化合物、还原剂以及碱的物质的量之比为1:(1.0~3.0):(1.0~5.0)。
反应温度也是决定反应是否能进行,影响反应速度快慢、副反应多少的重要因素。发明人在研究中发现,2-(4-苯甲氧基苯基)乙醇制备过程中的各步反应在0~100℃下均能进行。
根据各个步骤反应活性的不同,发明人对各个步骤反应的温度进行了进一步优化。当步骤1)的反应温度为20~30℃,和/或,步骤2)的反应温度为30~40℃时,和/或,步骤3)的反应温度为20~30℃时,和/或,步骤4)的反应温度为40℃时,反应速度适宜、副反应少、目标产物2-(4-苯甲氧基苯基)乙醇的收率较高。
进一步的,当步骤2)中的苄卤为苄溴时,更有利于获得式iii所示的化合物,原因可能在于,溴离子是一种更好的离去基团,有利于步骤2)中亲核取代反应的发生。
步骤2)中需要加入适量的碱,在碱的作用下,式ii所示的化合物中的酚羟基失去质子后变为氧负离子,是一种更好的亲核试剂,有利于与苄卤反应制备得到式iii所示的化合物。
本发明对步骤2)中所使用的碱不作特别限制,只要其碱性足以夺去酚羟基上的质子即可。例如,步骤2)中的碱可选自碳酸钾、碳酸钠、氢氧化钾、氢氧化钠、碳酸氢钠、碳酸氢钾、乙醇钠、乙醇钾、氢化钠中的一种或多种。
步骤3)中,需要把式iii所示的化合物中的羰基还原为羟基后,再在碱性条件下进行分子内的亲核取代反应。其中,步骤3)中还原处理的还原剂可选自硼氢化钠、硼氢化钾、氰基硼氢化钠、三乙酰氧基硼氢化钠、四氢铝锂、硼烷中的一种或多种,当进一步优选为硼氢化钠时,在具有较好还原效果的基础上,过量的硼氢化钠在后处理过程中更利于除去,还原剂也更便宜易得,有利于降低反应成本。
本发明对步骤3)中还原后使用的碱不作特别限制,可选用有机碱或无机碱,只要能够保证羰基还原后促进分子内环化生成环氧乙烷环即可,在一种具体的实施方式中,还原后所使用的碱可选自氢氧化钾、氢氧化钠、碳酸氢钠、碳酸氢钾、乙醇钠、乙醇钾、氢氧化钙、氢氧化锂中的一种或多种,进一步优选为甲醇钠。
在步骤4)中,在催化剂的作用下,将式iv所示的化合物中的环氧乙烷三元环打开还原即可获得目标产物2-(4-苯甲氧基苯基)乙醇,还原剂为氢气,氢气作为气体与式iv所示的化合物是多相反应,反应难度较大,需在0.1~1.0mpa的加压条件下进行。
步骤4)中的催化剂可选用氢化反应中常用的催化剂,例如可选自钯碳、钌碳、铂碳、雷尼镍中的一种或多种。当催化剂为钯碳,且进一步优选为5%钯碳时,在具有较好的催化效果的同时有利于降低反应的成本。
在一种具体的实施方式中,当催化剂选自5%的钯碳时,式iv所示的化合物与5%的钯碳的质量比为1:(0.1~1.0),该范围内能够保证步骤4)还原反应具有较好的还原效果。
以下,将结合具体的实施例对本发明所提供的2-(4-苯甲氧基苯基)乙醇的制备方法进行进一步地介绍。
在下述实施例中,如无特殊说明,本发明实施例中所使用到的原辅料均为工业级原料,可通过商购或常规方法制备得到。
实施例1
本实施例2-(4-苯甲氧基苯基)乙醇的制备方法包括以下步骤:
1)2-氯-1-(4-羟基苯基)乙烷-1-酮(式ii所示的化合物)的制备
向1000ml的四口反应瓶中加入苯酚(47g,0.5mol),二氯甲烷(100ml),冰水浴冷却至0~5℃,向苯酚溶液中缓慢加入三氯化铝粉末(166.70g,1.25mol,2.5equiv),维持温度0~5℃,加完三氯化铝粉末后缓慢滴加氯乙酰氯溶液,其中,氯乙酰氯溶液通过将氯乙酰氯(124.23g,1.1mol,2.2equiv)溶于二氯甲烷(150ml)中得到,大约1.0小时滴加完毕,滴加完毕后将温度缓慢升温至20~30℃,继续搅拌反应6.0小时后,hplc检测反应完毕,加入盐酸和冰水淬灭反应,过滤得到固体,加入水打浆洗涤,干燥后得到2-氯-1-(4-羟基苯基)乙烷-1-酮(式ii所示的化合物)80.1g,收率94.0%,纯度98.2%。
2)1-(4-(苄氧基)苯基)-2-氯乙烷-1-酮(式iii所示的化合物)的制备
向500ml四口反应瓶中加入2-氯-1-(4-羟基苯基)乙烷-1-酮(式ii所示的化合物)(17g,0.1mol),碳酸钾(41.4g,0.3mol,3.0equiv),n,n-二甲基甲酰胺(85ml),20~30℃下搅拌0.5小时,加入苄溴(17.3g,0.101mol,1.01equiv),缓慢升温至30~40℃反应4.0小时,hplc跟踪原料转化完毕,降温至室温,向反应体系中加入乙酸乙酯(170ml)和水(170ml)搅拌溶解,静置分液,水相再用乙酸乙酯(35ml)反萃一次,合并有机相,依次加入水,饱和食盐水各85ml洗涤,无水硫酸钠干燥,过滤,减压浓缩得1-(4-(苄氧基)苯基)-2-氯乙烷-1-酮(式iii所示的化合物)25.33g,收率97.5%,纯度98.8%。
3)(4-苄氧基苯基)-环氧乙烷(式iv所示的化合物)的制备
向反应瓶中加入1-(4-(苄氧基)苯基)-2-氯乙烷-1-酮(式iii所示的化合物)(26.0g,0.1mol),甲醇(260ml),降温至0~10℃,分批加入硼氢化钠(3.97g,0.105mol,1.05equiv),加完硼氢化钠后,升温至室温搅拌0.5-1.0小时,hplc跟踪原料转化完全,滴加甲醇钠溶液,其中,甲醇钠溶液是将甲醇钠(8.10g,0.15mol,1.50equiv)溶于甲醇(20ml)中制备得到,滴加完毕后,继续在20-30℃搅拌反应2.0小时,hplc跟踪原料转化完全,浓缩除去溶剂,加入甲基叔丁基醚(150ml)和水(150ml)搅拌溶解,静置分液,水相再加入甲基叔丁基醚(50ml)反萃一次,合并有机相,依次加入水和饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩得到(4-苄氧基苯基)-环氧乙烷(式iv所示的化合物)20.8g,收率92.0%,纯度97.82%。
4)2-(4-苯甲氧基苯基)乙醇(式i所示的化合物)的制备
向500ml高压釜中加入(对苄氧基苯基)-环氧乙烷(式iv所示的化合物)(10g),加入甲醇(150ml),氢氧化钠(0.2g),5%钯碳(0.1克,10wt%),升温至40℃,氢气压力维持在0.5mpa进行反应,反应完成,降温至室温,过滤回收钯碳,滤液减压浓缩回收甲醇,剩余物加入乙酸乙酯(100ml)和水(100ml)搅拌溶解,静置分液,有机相再加入饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩得2-(4-苯甲氧基苯基)乙醇9.67g,收率97.8%,纯度99.0%。
将步骤1)-步骤4)的反应收率相乘,计算得到反应总收率为82.5%。图1为本发明实施例1制备得到的2-(4-苯甲氧基苯基)乙醇的1hnmr图,如图1所示,2-(4-苯甲氧基苯基)乙醇通过1hnmr表征:1hnmr(400mhz,cdcl3)δ:7.32~7.44(m,5h),7.14(d,2h),6.93(d,2h),5.05(s,2h),3.82(t,2h),2.81(t,2h),1.42(s,1h).
实施例2
本实施例2-(4-苯甲氧基苯基)乙醇的制备方法与实施例1基本一致,不同之处在于,将步骤1)中的二氯甲烷替换为甲苯,经过1hnmr确认最终得到2-(4-苯甲氧基苯基)乙醇且其总收率为76.5%,纯度为98.4%。
实施例3
本实施例2-(4-苯甲氧基苯基)乙醇的制备方法与实施例1基本一致,不同之处在于,将步骤2)中的n,n-二甲基甲酰胺替换为四氢呋喃,经过1hnmr确认最终得到2-(4-苯甲氧基苯基)乙醇且其总收率为71.4%,纯度为98.1%。
实施例4
本实施例2-(4-苯甲氧基苯基)乙醇的制备方法与实施例1基本一致,不同之处在于,将步骤2)中的碳酸钾替换为氢氧化钠,经过1hnmr确认最终得到2-(4-苯甲氧基苯基)乙醇且其总收率为64.6%,纯度为98.6%。
实施例5
本实施例2-(4-苯甲氧基苯基)乙醇的制备方法与实施例1基本一致,不同之处在于,将步骤3)中的硼氢化钾替换为氰基硼氢化钠,经过1hnmr确认最终得到2-(4-苯甲氧基苯基)乙醇且其总收率为78.7%,纯度为98.7%。
实施例6
本实施例2-(4-苯甲氧基苯基)乙醇的制备方法与实施例1基本一致,不同之处在于,将步骤4)中的5%钯碳替换为雷尼镍,经过1hnmr确认最终得到2-(4-苯甲氧基苯基)乙醇且其总收率为75.8%,纯度为98.8%。
实施例7
本实施例2-(4-苯甲氧基苯基)乙醇的制备方法与实施例1基本一致,不同之处在于,将步骤2)中的苄溴替换为苄氯,经过1hnmr确认最终得到2-(4-苯甲氧基苯基)乙醇且其总收率为68.4%,纯度为98.5%。
实施例8
本实施例2-(4-苯甲氧基苯基)乙醇的制备方法与实施例1基本一致,不同之处在于,步骤1)中苯酚、三氯化铝以及氯乙酰氯的摩尔比为1:3.0:2.5,经过1hnmr确认最终得到2-(4-苯甲氧基苯基)乙醇且其总收率为80.11%,纯度为99.0%。
实施例9
本实施例2-(4-苯甲氧基苯基)乙醇的制备方法与实施例1基本一致,不同之处在于,步骤2)中苯酚、苄溴以及碳酸钾的摩尔比为1:3.0:1.1,经过1hnmr确认最终得到2-(4-苯甲氧基苯基)乙醇且其总收率为81.2%,纯度为98.80%。
实施例10
本实施例2-(4-苯甲氧基苯基)乙醇的制备方法与实施例1基本一致,不同之处在于,步骤3)中,式iii所示的化合物、硼氢化钠以及甲醇钠的摩尔比为1:1.0:1.5,经过1hnmr确认最终得到2-(4-苯甲氧基苯基)乙醇且其总收率为79.66%,纯度为98.60%。
实施例11
本实施例2-(4-苯甲氧基苯基)乙醇的制备方法与实施例1基本一致,不同之处在于,步骤4)中,还原反应的压力从0.5mpa替换为0.8mpa,经过1hnmr确认最终得到2-(4-苯甲氧基苯基)乙醇且其总收率为75.76%,纯度为98.72%。
以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!