产细菌素与阿魏酸酯酶的凝结芽孢杆菌的培养方法及应用
本发明涉及一种产细菌素与阿魏酸酯酶的凝结芽孢杆菌的培养方法及应用。
背景技术:
细菌素是细菌核糖体合成的抗菌肽,通常对多种致病菌具有杀菌作用,具有抗菌谱广、无毒、可被动物肠道蛋白酶降解等特性,在饲料工业中可以替代常规抗生素使用。饲料中大量添加亚治疗量的抗生素和促生长剂,造成了动物的耐药性。由于这种多抗性、顽固病菌的出现,使传统抗生素面临重大挑战。细菌素是被认为替代抗生素的最有前途的产品。它是一种具有杀菌的无毒小分子多肽。它可选择性地分解细菌细胞壁细胞膜杀死致病菌,且本身无毒无害,因而它是一种天然的安全性能很好的杀菌剂、防腐剂,可广泛应用于饲料加工、医学、食品工业、畜牧业、啤酒工业、水产养殖等领域;可替代抗生素在饲料中应用,具有庞大的市场。细菌素主要由乳酸菌及芽孢杆菌属细菌发酵获得。芽孢杆菌产细菌素与乳酸菌产生的细菌素不同,乳酸菌细菌素抗菌谱窄和ph稳定性差,芽孢杆菌产生的细菌素在抑制活性和ph方面表现出更好的优越性。
阿魏酯酶(faes,e.c.3.1.1.73)是一类羧酸酯酶,催化植物细胞壁上羟基肉桂酸和糖之间的酯键水解,从植物细胞壁释放阿魏酸,它可以显著提高麦麸、玉米芯、玉米麸皮和草木质纤维素等材料的生物降解率,在动物饲料开发中显示出巨大的应用前景。然而,大多数报道的faes均为碱性或中性,在动物的酸性胃肠道环境中不能有效使用,限制了其在动物饲料中的应用。因此,寻找既安全又能直接用于动物胃肠道的新型faes是一项有价值的工作。
技术实现要素:
针对上述现有技术存在的问题,本发明提供一种产细菌素与阿魏酸酯酶的凝结芽孢杆菌的培养方法及应用。
为了实现上述目的,本发明采用的一种产细菌素与阿魏酸酯酶的凝结芽孢杆菌的培养方法,包括步骤:
步骤一、采样及样品处理
从不同大蒜种植地土壤中取土样50份,称取每份土样10g,置于装有玻璃珠及100ml无菌水的三角瓶中,使用发酵振荡器在120r/min旋转振荡混匀1h,然后将三角瓶置于80℃震荡水浴锅中,震荡孵育处理30-40min,获得土样悬浊液;
步骤二、富集培养
从步骤一的土样悬浊液三角瓶中吸取1-2ml悬浊液到装有20-50ml富集培养基的250ml三角瓶中,30-40℃下于摇床上160-200r/min震荡培养2-3d,将以上培养液于5000-6000r/min离心10-15min,无菌操作下收集菌体,然后加入无菌水充分吹打悬浮,再次于以上相同条件下离心,洗涤菌体,离心后收集菌体并按照初始培养液每100ml加入50ml无菌水重复悬浮,吸取1-2ml悬浮液接种于装有20-50ml富集培养基的250ml三角瓶中,30-40℃下于摇床上160-200r/min震荡培养4-6d,得到富集培养菌液;
所述富集培养基包括蛋白胨1-2g、玉米芯粉10-20g、阿魏酸乙酯0.5-2g、nano31-3g、(nh4)2so42-4g、kh2po40.5-1g、kcl0.1-0.5g,去离子水加至1000ml,调节ph7.0-7.5,培养基121℃、15min灭菌;
步骤三、初筛
将经两次富集培养后的菌液充分系列稀释104~108倍,然后吸取各稀释液100-200μl于阿魏酸酯酶初筛培养基上,充分涂布均匀并晾干表面,于35-40℃恒温培养箱中倒置培养18-24h,然后在28-32℃倒置培养24-48h,观察阿魏酸酯酶初筛培养基上有无明显透明圈出现;将透明圈菌落挑出在牛肉膏蛋白胨培养基上充分划线三次,将充分划线获得的单菌落点到平行的两个细菌素初筛培养基二上,其中一个培养皿命名为培养皿一,另一个命名为培养皿二,于35-38℃恒温培养箱中倒置培养24-36h,然后在30-35℃倒置培养24-48h;将培养皿置于超净工作台上,开启可产臭氧的紫外灯,照射1-2h,将培养皿一中加入500-1000μl浓度为5mg/ml的复合蛋白酶液,并使酶液完全覆盖平板表面,将该平板封口膜封口并置于37℃恒温培养箱中孵育6-12h,培养皿二不用蛋白酶处理;然后将培养至对数期的金黄色葡萄球菌菌悬液稀释至1×106cfu/ml,吸取0.5-1ml菌悬液平行加到培养皿一和培养皿二上,旋转培养皿,使菌悬液充分在平板上展开,然后将残余菌液倒掉,并晾干培养基表面,于35-38℃恒温培养箱中倒置培养18-24h,观察抑菌圈情况;
所述阿魏酸酯酶初筛培养基包括牛肉膏5-10g、酵母提取物5-10g、蔗糖10-20g、nano31-3g、(nh4)2so42-4g、kh2po40.5-1g、kcl0.5g、mgso4·7h2o0.2-0.4g、feso4·7h2o0.01-0.02g、琼脂粉15g,补充去离子水至1000ml,调节ph7.0-7.5;培养基121℃、15min灭菌后,冷却至60-70℃时,加入阿魏酸乙酯溶液1ml,充分摇匀后,平均倒至3个直径90mm的培养皿中;
阿魏酸乙酯溶液包括将0.2g阿魏酸乙酯加到1.5ml无菌离心管中,再加入500μln、n-二甲基甲酰胺溶解,然后再加入500μl无菌水,充分摇匀;
细菌素初筛培养基包括蛋白胨10-15g、酵母提取物5-10g、葡萄糖10-20g、玉米浆干粉5-10g、尿素2-4g、(nh4)2so41-2g、kh2po40.5-1g、kcl0.2-0.5g、mgso4·7h2o0.2-0.4g、琼脂粉15g,补充去离子水至1000ml,调节ph7.0-7.5、培养基121℃、15min灭菌;
步骤四、复筛
初筛得到菌株于活化固体培养基上划线培养充分活化,32-37℃恒温培养箱培养20-24h,将活化好的菌株接种到种子培养基三角瓶中,种子培养基装液量20-40ml/250ml三角瓶,培养温度为32-37℃,摇床转速160-180r/min,培养时间18-24h,按照6-12%的接种量接种到复筛发酵培养基中,250ml三角瓶的装液量为30-60ml;在摇床上以160-200r/min的震荡频率32-37℃温度下发酵培养36-48h,将发酵液在4℃下、8000-10000r/min转速离心10-15min,保留上清,分别检测阿魏酸酯酶活性和细菌素抑菌活性;
种子培养基:蛋白胨5-10g、牛肉膏4-10g、酵母粉5-8g、阿魏酸乙酯0.5-2g、nacl1-5g、k2hpo40.1-0.2g,加去离子水至1000ml,ph7.0-7.5,121℃,灭菌15min;
复筛发酵培养基:玉米淀粉10-20g、蛋白胨5-10g、酵母粉5-8g、阿魏酸乙酯0.5-2g、nacl2-5g、尿素1-4g、kh2po40.1-0.2g、tween800.15-0.3g、mgso4·7h2o0.04g,去离子水加至1000ml,ph7.0-7.5,121℃,灭菌15min。
另外,本发明还提供了一种所述凝结芽孢杆菌的应用,包括步骤:
步骤一、液体发酵剂的制备
a)菌种活化:取甘油冷冻保存的凝结芽孢杆菌菌株在牛肉膏蛋白胨培养基上初次划线后,30-37℃培养24-48h,从以上培养基上挑取单菌落再次重复在新的牛肉膏蛋白胨培养基上再次划线,同以上相同条件下培养,得到的单菌落备用;
b)一级种子液体培养基培养:从第二次划线培养的培养基上挑取单菌落至种子液体培养基,培养条件为:150ml三角瓶装种子液体培养基10ml-30ml,ph为6.5-7.2,接种一环菌体,32-37℃震荡培养器按照140-210r/min震荡培养12-24h,得到一级种子液;
采用的种子液体培养基:牛肉膏4-10g、蛋白胨5-10g、酵母粉5-10g、葡萄糖10-20g、nacl0.05g、kh2po40.1-0.2g、mgso4·7h2o0.04,蒸馏水加至1000ml,ph7.0,121℃灭菌20min;
c)制备二级种子液:按照1-2v/v%的接种量吸取培养好的一级种子液至二级种子培养基中,培养条件为:100-200ml种子培养基装在500ml三角瓶中,在震荡培养器上按照150-210r/min震荡转速32-37℃下震荡培养1-2h,测定od600吸光值达到0.6-0.8,得到二级种子液;
采用的二级种子培养基:花生粕粉5-10g、可溶性淀粉10-20g、葡萄糖5-10g、蛋白胨5-10g、(nh4)2so41-2g、mgs04·7h2o0.01-0.02g、kh2po40.1-0.2g、去离子水定容至l000ml,ph7.0-7.4,121℃灭菌20min;
步骤二、液体深层通风搅拌发酵工艺
a)发酵罐及培养基消毒
30l发酵罐发酵工艺:按照发酵罐60-70%(v/v)装液量,将配制好的发酵培养基通过罐体顶部装料口装入发酵罐中,将校正好的溶氧电极、ph电极插入安装孔内,并用螺母固定,连接电极电缆线;开启发酵罐搅拌;高压蒸汽,通过空气过滤器,并调节过滤器排气口使过滤器压表压力控制在0.11~0.12mpa,并保持20-30min,同时对发酵罐的空气流通管路进行0.11~0.12mpa、20-30min灭菌;灭菌结束后通入除菌后的空气吹干过滤器,并保证过滤器保持正压;将蒸汽通入发酵罐夹层,温度升至95-98℃后,将蒸汽通入发酵罐中,通过调节发酵罐罐体顶部放气阀调节发酵罐罐压,在12l℃下保持20-30min,灭菌结束后冷水通入发酵罐夹层,使培养基温度降至30-40℃,并通入无菌空气使发酵罐保持正压,压力维持在0.03~0.05mpa;
b)深层液体通风发酵控制
将活化培养好的二级种子液火焰保护下由发酵罐接种口倾倒入罐体,接种量为5-8%(v/v),调节通气量并维持发酵罐罐压0.03-0.05mpa,发酵过程采取分阶段精密控制工艺:发酵开始到发酵6h,发酵温度控制在35-37℃,通气量为8-10l/min,搅拌转速120-140r/min,发酵初始培养基ph6.5-6.8;发酵6-12h,发酵温度维持不变,增加通气量至15-20l/min,提高搅拌转速至140-180r/min;发酵12-36h,每间隔6h向发酵液中补加浓缩补料培养基,每次补料400-800ml,调节发酵温度至32-35℃,通气量增加至25-35l/min,通过补加1mol/l的nano3和氨水调节发酵液ph维持在6.8-7.2;发酵36-48h,停止补料,发酵温度增加到35-37℃,通气量增加至35-40l/min,搅拌转速维持不变,ph维持6.8-7.2;在此发酵条件条件下,细菌素抑菌活性达到2512u/ml,阿魏酸酯酶酶活力达到512u/l;
发酵培养基配方:花生粕粉10-20g、糖化好的玉米淀粉10-20g、蛋白胨5-10g、酵母粉10-20g、玉米浆干粉5-10g、尿素1-4g、tween800.15-0.3g、tritonx-1000.2-0.4g、大量元素10ml、微量元素10ml、麸皮与玉米芯浸提液100-200ml、泡敌0.001g,最后加去离子水定容至1000ml;
其中,所述麸皮与玉米芯浸提液制备方法:将麦麸与玉米芯粉碎,然后加水,并加入盐酸,煮沸0.5小时,过滤取滤液,得到浸提液;
所述大量元素包括:kh2po420-30g/l、(nh4)2so430-50g/l、kno35-20g/l、(0.1g)mgso4·7h2o5-10g/l、cacl2·2h2o2-4g/l和nacl5-10g/l;
所述微量元素包括:mnso4·h2o0.2-0.4g/l、feso4·7h2o50-80mg/l、cocl2·6h2o100-200mg/l、znso4·7h2o40-80mg/l、cuso4·5h2o30-50mg/l、h3bo310-20mg/l和namoo4·2h2o5-10mg/l;
所述补料培养基包括:经蛋白酶部分水解后的豆粕粉10-20g、玉米浆干粉10-20g、甘蔗糖蜜10-30g、蚕蛹粉10-20g,去离子水定容至1000ml,121℃灭菌15min。
采用本发明的方法可以筛选到能同时产生阿魏酸酯酶和细菌素的芽孢杆菌菌株;采用本发明的液体发酵生产方法,凝结芽孢杆菌菌株可以同时大量合成阿魏酸酯酶和细菌素两种重要产物;通过非转基因菌株发酵的阿魏酸酯酶酶活高,达到512u/l;所产细菌素抗菌活性强,抑菌活性达到2512u/ml;该酶的最适作用ph4.0,较国内报道的同类酶更适合酸性条件下使用;在ph3.0-8.0范围内24h阿魏酸酯酶酶活性基本不发生变化,活性稳定,相对酶活均在95%以上,说明在酸性环境下稳定性很高,易于在饲料中使用。本发明中发酵所产细菌素具有广泛的抗菌谱,对常见的致病菌如单核细胞增生李斯特菌、蜡状芽孢杆菌、金黄色葡萄球菌等革兰氏阳性菌有较强的抑制作用,并能抑制包括副伤寒沙门氏菌、铜绿假单胞菌、痢疾杆菌和大肠杆菌在内的革兰氏阴性菌。本发明采用粗料培养基作为发酵原料,具有工艺简单、酶活性高、单位酶活生产成本低廉等优点,为阿魏酸酯酶的低成本化大规模生产提供依据。
附图说明
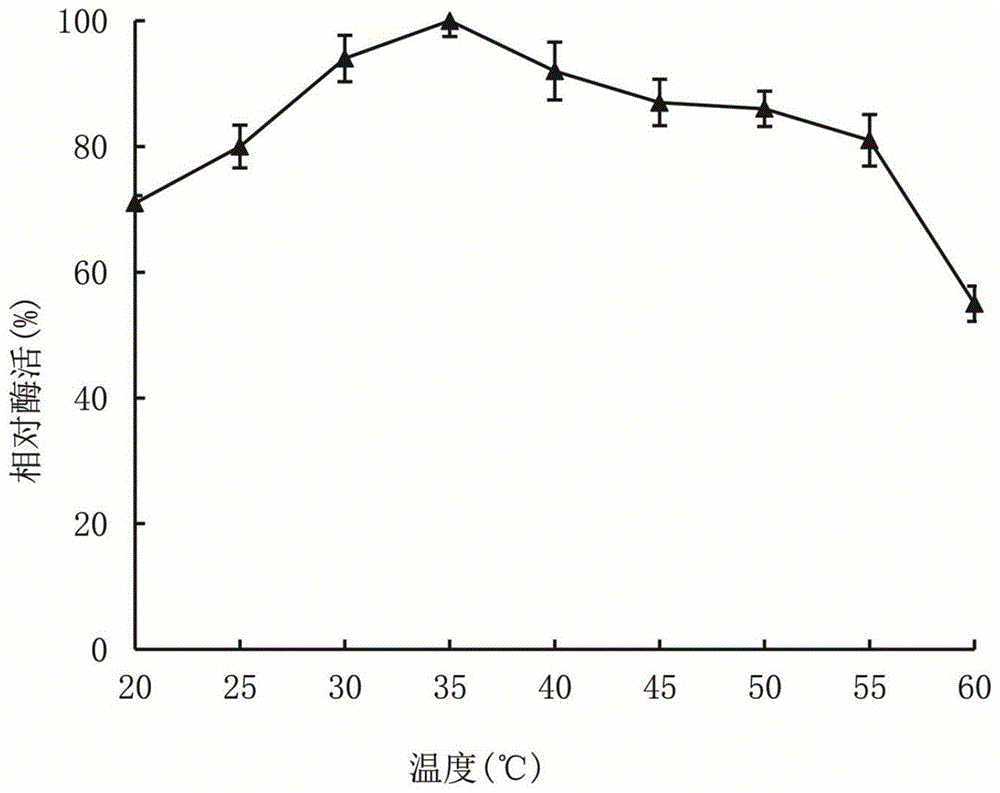
图1为本发明阿魏酸酯酶的最适温度测定图;
图2为本发明阿魏酸酯酶的最适ph测定图;
图3为本发明阿魏酸酯酶的热稳定性;
图4为本发明ph值对阿魏酸酯酶的热稳定性影响图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明了,下面对本发明进行进一步详细说明。但是应该理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限制本发明的范围。
除非另有定义,本文所使用的所有的技术术语和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同,本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
实施例1
一种产细菌素与阿魏酸酯酶的凝结芽孢杆菌的培养方法,包括步骤:
步骤一、采样及样品处理
从不同大蒜种植地土壤中取土样50份,称取每份土样10g,置于装有玻璃珠及100ml无菌水的三角瓶中,使用发酵振荡器在120r/min旋转振荡混匀1h,然后将三角瓶置于80℃震荡水浴锅中,震荡孵育处理35min,获得土样悬浊液;
步骤二、富集培养
从步骤一的土样悬浊液三角瓶中吸取1.5ml悬浊液到装有30ml富集培养基的250ml三角瓶中,35℃下于摇床上180r/min震荡培养2.5d,将以上培养液于6000r/min离心12min,无菌操作下收集菌体,然后加入无菌水充分吹打悬浮,再次于以上相同条件下离心,洗涤菌体,离心后收集菌体并按照初始培养液每100ml加入50ml无菌水重复悬浮,吸取1.5ml悬浮液接种于装有30ml富集培养基的250ml三角瓶中,35℃下于摇床上180r/min震荡培养5d,得到富集培养菌液;
所述富集培养基包括蛋白胨1.5g、玉米芯粉15g、阿魏酸乙酯1g、nano32g、(nh4)2so43g、kh2po40.5g、kcl0.3g,去离子水加至1000ml,调节ph7.2,培养基121℃、15min灭菌;
步骤三、初筛
将经两次富集培养后的菌液充分系列稀释104~108倍,然后吸取各稀释液150μl于阿魏酸酯酶初筛培养基上,充分涂布均匀并晾干表面,于38℃恒温培养箱中倒置培养20h,然后在30℃倒置培养34h,观察阿魏酸酯酶初筛培养基上有无明显透明圈出现;将透明圈较大的菌落挑出在牛肉膏蛋白胨培养基上充分划线三次,将充分划线获得的单菌落点到平行的两个细菌素初筛培养基二上,其中一个培养皿命名为培养皿一,另一个命名为培养皿二,于36℃恒温培养箱中倒置培养30h,然后在32℃倒置培养40h;将培养皿置于超净工作台上,开启可产臭氧的紫外灯,照射1.5h,将培养皿一中加入800μl浓度为5mg/ml的复合蛋白酶液,并使酶液完全覆盖平板表面,将该平板封口膜封口并置于37℃恒温培养箱中孵育8h,培养皿二不用蛋白酶处理;然后将培养至对数期的金黄色葡萄球菌菌悬液稀释至1×106cfu/ml,吸取0.8ml菌悬液平行加到培养皿一和培养皿二上,旋转培养皿,使菌悬液充分在平板上展开,然后将残余菌液倒掉,并晾干培养基表面,于36℃恒温培养箱中倒置培养20h,观察抑菌圈情况;
所述阿魏酸酯酶初筛培养基包括牛肉膏8g、酵母提取物8g、蔗糖15g、nano32g、(nh4)2so43g、kh2po40.8g、kcl0.5g、mgso4·7h2o0.3g、feso4·7h2o0.015g、琼脂粉15g,补充去离子水至1000ml,调节ph7.2;培养基121℃、15min灭菌后,冷却至65℃时,加入阿魏酸乙酯溶液1ml,充分摇匀后,平均倒至3个直径90mm的培养皿中;
阿魏酸乙酯溶液包括将0.2g阿魏酸乙酯加到1.5ml无菌离心管中,再加入500μln、n-二甲基甲酰胺溶解,然后再加入500μl无菌水,充分摇匀;
细菌素初筛培养基包括蛋白胨13g、酵母提取物8g、葡萄糖15g、玉米浆干粉8g、尿素3g、(nh4)2so41.5g、kh2po40.8g、kcl0.3g、mgso4·7h2o0.3g、琼脂粉15g,补充去离子水至1000ml,调节ph7.2、培养基121℃、15min灭菌;
步骤四、复筛
初筛得到菌株于活化固体培养基上划线培养充分活化,35℃恒温培养箱培养22h,将活化好的菌株接种到种子培养基三角瓶中,种子培养基装液量30ml/250ml三角瓶,培养温度为35℃,摇床转速170r/min,培养时间20h,按照8%的接种量接种到复筛发酵培养基中,250ml三角瓶的装液量为45ml;在摇床上以180r/min的震荡频率35℃温度下发酵培养40h,将发酵液在4℃下、9000r/min转速离心12min,保留上清,分别检测阿魏酸酯酶活性和细菌素抑菌活性;
阿魏酸酯酶活性测定方法(阿魏酸酯酶活力测定):取200μl稀释到一定倍数的发酵上清,加入浓度为1g/l的阿魏酸甲酯600μl,ph6.5、37℃反应10min后煮沸10min灭活酶;空白对照为煮沸灭活的酶液。产物阿魏酸测定方法:产物阿魏酸的量采用rp-hplc方法测定,反应结束后的混合物8000r/min离心15min,取200μl上清加到样品瓶中。rp-hplc测定色谱柱:c18柱(xbridage5.0μm×250mm×4.6mm,watersco.,ltd),检测波长320nm,进样体积:10μl;柱温为25℃,实验选用的流动相为ph7.5的20mmol/l磷酸钠缓冲液(90%)与甲醇(10%),流速0.5ml/min。阿魏酸酯酶酶活定义(u):在ph6.5、37℃条件下,每分钟水解阿魏酸甲酯生成1μmol阿魏酸所需要的酶量定义为1个酶的活力单位。
细菌素抑菌活性测定方法:采用琼脂孔扩散法测定发酵液上清抑菌活力。于lb培养基平板上涂布指示菌s.aureus菌液,晾干后用打孔器打孔,将150μl发酵液上清注入于培养基孔中,37℃下培养过夜,检测是否有抑菌圈并测量抑制圈直径。抑菌活力单位的定义为:以s.aureus为指示菌,样品经最大稀释后,打孔检测仍产生清晰抑菌圈的最大稀释倍数的倒数作为一个抑菌活力单位。
种子培养基:蛋白胨8g、牛肉膏8g、酵母粉6g、阿魏酸乙酯1g、nacl3g、k2hpo40.15g,加去离子水至1000ml,ph7.2,121℃,灭菌15min;
复筛发酵培养基:玉米淀粉15g、蛋白胨8g、酵母粉6g、阿魏酸乙酯1g、nacl3g、尿素3g、kh2po40.15g、tween800.2g、mgso4·7h2o0.04g,去离子水加至1000ml,ph7.2,121℃,灭菌15min。
步骤五、菌种保藏
将阿魏酸酯酶活性和细菌素抑菌活性均较高的菌株挑选出来,进一步划线传代培养,最终得到一株产酶稳定、有较高酶活的既产耐高阿魏酸酯酶又产高抑菌活性的细菌素菌株xzbc-6。纯化的菌株xzbc-6接种于lb液体培养基,35℃温度下170r/min震荡培养22h,于甘油-20℃冷冻保藏备用。
本发明所得菌株xzbc-6在牛肉膏蛋白胨平板上48h形成直径2-3mm大小的圆形菌落,菌落扁平,呈灰白色,正反面颜色一致,不透明,表面湿润,边缘整齐。其革兰氏阳性,菌体形态均一,呈短杆状,两端钝圆,单个存在,产近端生的椭圆形芽孢,无鞭毛。接触酶试验、硝酸盐还原、v.p试验、淀粉水解阳性;柠檬酸利用、明胶液化、酪氨酸水解、硫化氢试验、吲哚试验阴性。根据生理生化结果,对照《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》上关于芽孢杆菌属的描述确定该菌株是凝结芽孢杆菌(bacilluscoagulans)。
提取本发明菌株xzbc-6基因组,依据真菌16srdna中最保守的序列设计引物,扩增采用上游引物:5'-gagtttgatcactggctcag-3',反向引物为:5'-tacggctaccttgttacgactt-3';
反应条件为:95℃预变性5min,94℃变性40s,56℃退火40s,72℃延伸2min,共30个循环,最后72℃延伸10min,4℃保存。pcr反应体系为:10×buffer2μl,dntp(2.5mmol/l)2μl,上游引物1μl,下游引物1μl,template10~50ng,taq酶(2.5u)0.3μl,加水补足20μl。扩增产物连接pmd18-t载体。将重组质粒转化到dh5α感受态细胞中,筛选阳性克隆扩大培养并送样测序。将所测得的序列在genbank进行核酸同源性分析,测得序列与从ncbi中比对获得的相近细菌的16srdna序列采用clustalx1.83进行多序列比对,然后采用mega5.0生物学软件构建系统进化树,结果显示菌株xzbc-6的16srdna核苷酸序列与bacilluscoagulans(jx462604)的16srdna核苷酸序列同源性最高,最大相似性(maxident)达到99%。综合其形态特征、培养特征观察,将菌株xzbc-6鉴定为凝结芽孢杆菌(bacilluscoagulans)。
分离到的产阿魏酸酯酶和细菌素的凝结芽孢杆菌(bacilluscoagulans)xzbc-6,已于2020年12月24日保藏于中国微生物菌种保藏管理委员会普通微生物中心cgmcc(地址为:中国北京市朝阳区北辰西路1号院3号,邮编100101),保藏编号:cgmccno.21546。
实施例2
一种凝结芽孢杆菌的应用,包括步骤:
步骤一、液体发酵剂的制备
a)菌种活化:取甘油冷冻保存的凝结芽孢杆菌菌株在牛肉膏蛋白胨培养基上初次划线后,35℃培养36h,从以上培养基上挑取单菌落再次重复在新的牛肉膏蛋白胨培养基上再次划线,同以上相同条件下培养,得到的单菌落备用;
b)一级种子液体培养基培养:从第二次划线培养的培养基上挑取单菌落至种子液体培养基,培养条件为:150ml三角瓶装种子液体培养基20ml,ph为7.0,接种一环菌体,35℃震荡培养器按照180r/min震荡培养20h,得到一级种子液;
采用的种子液体培养基:牛肉膏8g、蛋白胨8g、酵母粉8g、葡萄糖15g、nacl0.05g、kh2po40.15g、mgso4·7h2o0.04,蒸馏水加至1000ml,ph7.0,121℃灭菌20min;
c)制备二级种子液:按照2v/v%的接种量吸取培养好的一级种子液至二级种子培养基中,培养条件为:150ml种子培养基装在500ml三角瓶中,在震荡培养器上按照180r/min震荡转速35℃下震荡培养1.5h,测定od600吸光值达到0.6-0.8,得到二级种子液;
采用的二级种子培养基:花生粕粉8g、可溶性淀粉15g、葡萄糖8g、蛋白胨8g、(nh4)2so41.5g、mgs04·7h2o0.015g、kh2po40.15g、去离子水定容至l000ml,ph7.2,121℃灭菌20min;
步骤二、液体深层通风搅拌发酵工艺
a)发酵罐及培养基消毒
30l发酵罐发酵工艺:按照发酵罐65%(v/v)装液量,将配制好的发酵培养基通过罐体顶部装料口装入发酵罐中,将校正好的溶氧电极、ph电极插入安装孔内,并用螺母固定,连接电极电缆线;开启发酵罐搅拌;高压蒸汽,通过空气过滤器,并调节过滤器排气口使过滤器压表压力控制在0.11~0.12mpa,并保持25min,同时对发酵罐的空气流通管路进行0.11~0.12mpa、25min灭菌;灭菌结束后通入除菌后的空气吹干过滤器,并保证过滤器保持正压;将蒸汽通入发酵罐夹层,温度升至95℃后,将蒸汽通入发酵罐中,通过调节发酵罐罐体顶部放气阀调节发酵罐罐压,在12l℃下保持25min,灭菌结束后冷水通入发酵罐夹层,使培养基温度降至35℃,并通入无菌空气使发酵罐保持正压,压力维持在0.03~0.04mpa;
b)深层液体通风发酵控制
将活化培养好的二级种子液火焰保护下由发酵罐接种口倾倒入罐体,接种量为6%(v/v),调节通气量并维持发酵罐罐压0.04mpa,发酵过程采取分阶段精密控制工艺:发酵开始到发酵6h,发酵温度控制在35℃,通气量为8l/min,搅拌转速130r/min,发酵初始培养基ph6.5;发酵6-12h,发酵温度维持不变,增加通气量至18l/min,提高搅拌转速至160r/min;发酵12-36h,每间隔6h向发酵液中补加浓缩补料培养基,每次补料600ml,调节发酵温度至35℃,通气量增加至30l/min,通过补加1mol/l的nano3和氨水调节发酵液ph维持在7.0;发酵36-48h,停止补料,发酵温度增加到35℃,通气量增加至35l/min,搅拌转速维持不变,ph维持7.0;在此发酵条件条件下,细菌素抑菌活性达到2512u/ml,阿魏酸酯酶酶活力达到512u/l;
发酵培养基配方:花生粕粉14g、糖化好的玉米淀粉15g、蛋白胨8g、酵母粉15g、玉米浆干粉8g、尿素3g、tween800.2g、tritonx-100(聚乙二醇辛基苯基醚)0.3g、大量元素10ml、微量元素10ml、麸皮与玉米芯浸提液150ml、泡敌0.001g,最后加去离子水定容至1000ml;
其中,所述麸皮与玉米芯浸提液制备方法:将麦麸与玉米芯粉碎,然后加水,并加入盐酸,煮沸0.5小时,过滤取滤液,得到浸提液;
所述大量元素包括:kh2po425g/l、(nh4)2so440g/l、kno315g/l、(0.1g)mgso4·7h2o8g/l、cacl2·2h2o3g/l和nacl8g/l;
所述微量元素包括:mnso4·h2o0.3g/l、feso4·7h2o60mg/l、cocl2·6h2o150mg/l、znso4·7h2o60mg/l、cuso4·5h2o40mg/l、h3bo315mg/l和namoo4·2h2o8mg/l;
所述补料培养基包括:经蛋白酶部分水解后的豆粕粉15g、玉米浆干粉15g、甘蔗糖蜜20g、蚕蛹粉15g,去离子水定容至1000ml,121℃灭菌15min。
本发明实施例所得细菌素的理化与抑菌特性
1、抗菌物质细菌素对不同蛋白酶的敏感性
将胰蛋白酶(ph7.0)、胰凝乳蛋白酶(ph7.0)、蛋白酶k(ph7.0)、胃蛋白酶(ph3.0)和过氧化氢酶(ph7.0)加入到离心后的发酵液上清,最终酶浓度为1mg/ml,37℃孵育2h,95℃孵育5min。采用琼脂孔扩散法以金黄色葡萄球菌为指示菌检测发酵液上清的抑菌活性。结果如表1所示,经蛋白酶处理后发酵液上清的抑菌活性与未处理的发酵液上清(对照组)的抑菌活性相比,均显著下降或完全丧失。另一方面,用过氧化氢酶处理后,抗菌活性没有变化。这些结果表明,凝结芽孢杆菌发酵产生的有抗菌作用的成分是一种肽或蛋白质特征,结合其他相关文献的研究结果,表明抗菌物质是细菌素。
表1酶、有机溶剂对细菌素抗菌活性的影响
2、抗菌物质细菌素热稳定性和酸碱稳定性
将发酵液离心后所得上清在37~100℃不同温度下孵育30min,或在121℃高压灭菌15min,测定细菌素的热敏性,然后采用琼脂孔扩散法以金黄色葡萄球菌为指示菌检测抑菌活性。结果如表2所示,细菌素在100℃以下30min内活性基本无变化,但当超过100℃之后稳定性下降,特别是在121℃高压灭菌15min后稳定性下降明显,其抑菌活性保留72.3%。整体说明细菌素具有优良的热稳定性。能满足饲料加工工艺的热处理过程的要求。
表2ph对细菌素抗菌活性的影响
用3mol/l的hcl或1mol/l的naoh将发酵液上清的ph调节在2~11之间,室温孵育4h,然后再用1mol/l乳酸或1mol/lnaoh中和至ph7.0后采用琼脂孔扩散法以金黄色葡萄球菌为指示菌检测抑菌活性。结果如表3所示,细菌素在弱酸性至弱碱性环境下(ph3~8)时,稳定性最佳,抑菌活性无显著变化;在ph升高至10.0时,稳定性下降明显,但其抑菌活性仍保持70%以上。整体看细菌素在酸性条件下表现出更佳的稳定性。
表3温度对细菌素抗菌活性的影响
3、经部分纯化的细菌素分子量测定
用tricine-sds-page法测定经过部分纯化的细菌素分子量大小,采用5%的堆积胶和18%的分离胶。使用大小在3.3-45kda之间的低分子量标准蛋白质做为参照。电泳结束后凝胶的一半考马斯蓝r250染色,用于分子量测定。另一半经过洗涤后置于培养皿中并覆盖一层lb软琼脂,并涂布1×106cfu/ml的金黄色葡萄球菌150μl。结果显示,用tris-tricinesds-page电泳后抑菌实验显示平板上有抑菌条带,并且同抑菌条带对应位置的凝胶上有考马斯亮蓝染色条带出现,对比标准分子量蛋白,对比标准分子量蛋白,得到细菌素分子量为6.25kda。对比国内外文献资料,未发现从凝结芽孢杆菌中分离到的相同分子量的细菌素,推测本发明发酵分离的抗菌物质为一种新的细菌素。
4、细菌素的抑菌谱特性
以革兰阳性和革兰氏阴性细菌及酵母菌、霉菌为指标,研究细菌素的抗菌谱。发酵液上清通过琼脂扩散法,对所有指标菌做抗菌活性检测。结果如表4所示,细菌素具有广泛的抗菌谱,对单核细胞增生李斯特菌、蜡状芽孢杆菌、金黄色葡萄球菌、黄色微球菌、枯草芽孢杆菌等革兰氏阳性菌有较强的抑制作用,并能抑制包括副伤寒沙门氏菌、铜绿假单胞菌、痢疾杆菌和大肠杆菌在内的革兰氏阴性菌。但对革兰氏阳性菌的抑制活性显著高于对革兰氏阴性菌的抑菌活性,对毕赤酵母、黑曲霉、米曲霉无抑菌活性。是一种具有广泛抗菌活性的细菌素,在饲料工业中具有重要应用价值。
表4凝结芽孢杆菌细菌素抑菌谱
本发明所得阿魏酸酯酶的理化特性
1、酶反应最适温度测定
在酶的最适反应ph条件下,分别测定酶在20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃酶活力,酶活力最高者以100%计,其它温度下所测为对其相对酶活,研究酶促反应最适温度。结果如图1所示,阿魏酸酯酶从20℃到35℃随着温度升高酶活性逐渐增加,温度达到35℃时,酶活达到最大值。以后随着温度升高,酶活逐渐降低,故阿魏酸酯酶最适作用温度为35℃。该温度同动物体内温度相接近,故可以在反刍动物进食后在胃内继续酶解植物纤维素类大分子糖类,该酶适合在饲料中使用。
2、酶作用最适ph测定
在35℃条件下,测定部分纯化的阿魏酸酯酶在不同ph3.0~9.0缓冲液体系中的酶活力,以测定的最高酶活力为100%,计算不同ph下的相对酶活力,确定最适反应ph。所用缓冲液为:ph2.0~3.0的甘氨酸-盐酸缓冲溶液,ph3.0~4.0柠檬酸磷酸缓冲液,ph4.0~5.0的乙酸-乙酸钠缓冲液,ph5.0~7.0磷酸氢二钠-磷酸二氢钾缓冲液,ph7.0~9.0tris-hcl缓冲溶液。结果如图2所示,阿魏酸酯酶在ph3.0~6.5之间酶活性在80%以上,最适作用ph为4.0。由此看出阿魏酸酯酶适合在酸性条件下酶解反应。
3、酶的热稳定性实验
将部分纯化的阿魏酸酯酶在40-70℃下孵育60min后,立即冰浴,再测定酶活性,以起始酶活力为100%,计算各温度处理后的相对酶活力,确定酶的热稳定性。结果见图3所示,阿魏酸酯酶随温度的上升酶活力逐渐降低,在温度70℃时酶活性下降明显,但酶活依然保持在75%以上;50-65℃酶活保存率在80%以上;50℃以下,剩余酶活都在90%以上。整体看酶的热稳定性较好。
4、ph值对酶稳定性的影响
经过部分纯化的阿魏酸酯酶在ph2.0-10.0的缓冲液中,4℃保温24h,测定阿魏酸酯酶酶活力,以最高酶活对应ph下所测酶活力记为100%,其它ph下所测得的对其相对酶活。结果见图4所示,4℃、ph3.0-8.0范围内24h阿魏酸酯酶酶活性基本不发生变化,活性稳定,相对酶活均在95%以上。8.0以上酶活力逐渐降低,10.0时酶活性显著降低,保存酶活仅有25%。整体看阿魏酸酯酶具有广泛的酸碱稳定性,在酸性条件下性能更为稳定。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换或改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!