一种抗菌有机化合物及其制备方法与应用
本发明涉及抗菌剂技术领域,尤其涉及一种新型的抗菌有机化合物。
背景技术:
细菌感染是人类健康面临的主要挑战之一。最近的预测表明,到2050年,细菌感染将导致每年一千万人的死亡,比目前由癌症引起的死亡还多。
抗生素是目前治疗浮游细菌感染和生物膜感染的主要治疗策略,他们通过靶向基本的生命过程(例如抑制细胞壁合成并干扰重要蛋白质、dna和rna的合成)而作用于细菌。然而抗生素的过度使用使得细菌对抗生素的耐药性也越来越强,多药耐药菌株的数量持续增长。万古霉素因其强大的杀菌能力被称为人类“最后的抗生素”,然而随着抗万古霉素细菌的出现,人类即将进入“后抗生素时代”。这种迅速升级的威胁促使人们迫切的寻找除抗生素之外的新型抗菌剂和新的治疗策略来对抗这些高度耐药的细菌。
技术实现要素:
为了解决现有技术中存在的问题,本发明的目的是提供一种抗菌有机化合物及其制备方法与应用。
为了实现本发明目的,本发明的技术方案如下:
第一方面,本发明提供了一种抗菌有机化合物,所述抗菌有机化合物的结构式如式ⅰ所示,其中,r选自-no2或-och3。
第二方面,本发明针对所述抗菌有机化合物,提供了具体的制备方法如下。
其一,所述抗菌有机化合物的结构式如式ⅱ所示:
所述制备方法包括如下步骤:
(1)在氮气氛,在0℃下,向二苯基甲烷的无水四氢呋喃溶液中加入正丁基锂的己烷溶液,搅拌,加入4,4'-二溴二苯甲酮,将反应混合物温热至室温,并继续搅拌反应,之后用氯化铵水溶液淬灭反应,利用二氯甲烷多次萃取,将有机层用无水硫酸钠干燥,通过蒸发溶剂,将获得的粗醇产物;将粗醇产物溶于甲苯中,加入对甲苯磺酸后,将反应混合物回流12h,然后冷却至室温,用10%碳酸氢钠水溶液洗涤甲苯层,并用无水硫酸镁干燥,将粗产物用硅胶柱纯化,用石油醚/乙酸乙酯作为洗脱剂,得到中间产物1;
(2)在剧烈搅拌下,将中间产物1加入到乙酸的二氯甲烷溶液中,通过在0℃下滴加浓硝酸到溶液中,然后将反应混合物温热至室温并继续搅拌3h,将反应混合物用水淬灭,然后将其用二氯甲烷多次萃取,合并有机层用饱和盐水溶液洗涤,并用硫酸镁干燥,将粗产物用硅胶柱纯化,用石油醚/乙酸乙酯作为洗脱剂,得到中间产物2;
(3)将中间产物2,与4-甲氧羰基苯硼酸、碳酸钾和四(三苯基膦)钯的混合物溶于四氢呋喃中,在氮气的保护下回流12小时;冷却至室温后,蒸发溶剂,并将固体溶解于二氯甲烷中,并用水洗涤;分离有机相,用硫酸镁干燥,将粗产物用硅胶柱纯化,用石油醚/乙酸乙酯作为洗脱剂;将纯化后的产物溶于水/四氢呋喃的混合溶液中,50℃反应12小时;反应完成后溶液用浓盐酸酸化,将混合物冷却离心,将沉淀物真空干燥,即得。
其二,所述抗菌有机化合物的结构式如式ⅲ所示:
所述制备方法包括如下步骤:
(1)将4,4’-二溴二苯甲酮、4,4’-二甲氧基二苯甲酮和锌粉溶于除水的四氢呋喃中,然后将反应混合物通氮气保护;将四氯化钛在氮气保护下加入上述混合物中,并保持丙酮浴0.5小时;之后将混合物在氮气的保护下回流9小时,然后冷却至室温;加入饱和碳酸钾溶液后,用二氯甲烷萃取三次,取有机相用无水硫酸钠干燥,将粗产物用硅胶柱纯化,用石油醚/二氯甲烷作为洗脱剂,得到中间产物3;
(2)将中间产物3,与4-甲氧羰基苯硼酸、碳酸钾和四(三苯基膦)钯的混合物溶于四氢呋喃中,在氮气的保护下回流12小时,冷却至室温后,蒸发溶剂,并将固体溶解于二氯甲烷中,并用水洗涤;分离有机相,用硫酸镁干燥,将粗产物用硅胶柱纯化,用石油醚/乙酸乙酯作为洗脱剂;将纯化后的产物溶于水/四氢呋喃的混合溶液中,80℃回流12小时;反应完成后,将溶液冷却至室温并减压浓缩;浓溶液用浓盐酸酸化,将混合物冷却离心,将沉淀物真空干燥,即得。
第三方面,本发明提供了一种抗菌剂或抗菌材料,所述抗菌剂或抗菌材料的特点为含有本发明所述抗菌有机化合物。本领域技术人员应当理解,含有本发明所述抗菌有机化合物的抗菌剂、抗菌材料,甚至药物,或以添加剂形式出现的试剂,均属于本发明的保护范围。
进一步地,所述抗菌剂或抗菌材料中,所述抗菌有机化合物的浓度为0.05~0.1μg/ml。
进一步优选,所述抗菌剂或抗菌材料由本发明所述抗菌有机化合物与超薄水滑石复合而成。
具体的制备方法如下:
将所述抗菌有机化合物溶解在二甲亚砜中得到浓度为0.5~8mg/ml的抗菌溶液,将抗菌溶液以1:2-8:1的质量比添加至1mg/ml的超薄水滑石悬浮液中,搅拌;
将悬浮液以12000rpm离心10分钟,收集沉淀并彻底分散在去离子水中,重复离心-重悬4次;即得。
所述超薄水滑石可为镁铝水滑石、镍铝水滑石、锌铝水滑石、钴铝水滑石、钴铁水滑石、镍铁水滑石、锌镁铝水滑石、镍锌铝水滑石和钴镁铝水滑石中的任意一种或几种。在本发明的一个具体实施方式中,采用镁铝超薄水滑石作为示例性说明。
超薄水滑石具有更高的比表面积与吸附能力,有助于有机分子的负载。所述超薄水滑石在甲酰胺的存在下通过共沉淀法制备而成,其中二价金属离子与三价金属离子的摩尔比为4:1-2:1,粒径约为70-80nm。
进一步地,本发明提供了所述抗菌有机化合物,或所述抗菌剂或抗菌材料在抑制革兰氏阳性菌方面的应用。
经过实验验证,本发明所提供的抗菌有机化合物,在浓度为0.05~0.1μg/ml时,即可对金黄色葡萄球菌、表皮葡萄球菌、耐甲氧西林金黄色葡萄球菌等革兰氏阳性菌的生长具有明显的抑制作用。
第四方面,本发明提供一种含有所述抗菌有机化合物的细菌荧光染色剂,所述抗菌有机化合物的浓度为0.05μg/ml。
所述荧光染色剂在抗菌有机化合物的浓度为0.05μg/ml时,可以对金黄色葡萄球菌、大肠杆菌染色,具有细菌荧光成像的能力。
本发明涉及到的原料或试剂均为普通市售产品,涉及到的操作如无特殊说明均为本领域常规操作。
在符合本领域常识的基础上,上述各优选条件,可以相互组合,得到具体实施方式。
本发明的有益效果在于:
本发明提供的抗菌化合物对革兰氏阳性菌抗菌效果显著,且在极低的浓度(0.05~0.1μg/ml)即可对金黄色葡萄球菌表现出明显的抑制效果,该浓度低于绝大多数常见抗生素的mic值。通过连续10次诱导后,复合纳米材料的mic值约为单独小分子诱导后的1/8。
本发明提供的抗菌化合物除具有抗菌作用外,还可以染色细菌,对细菌进行荧光成像。
将本发明提供的抗菌化合物与有机分子纳米材料水滑石进行复合,以水滑石作为纳米载体,可大大降低细菌对于有机抗菌剂产生耐药性的速度,并可借助水滑石形成有机抗菌剂的缓释,进而提高有机抗菌剂的长期抗菌能力。
本发明提供的有机抗菌剂/水滑石多功能复合纳米材料优异的抗菌效果已经在体外和动物水平上得到了很好的验证,可用于抗菌药物的研发等领域,为解决细菌耐药性问题提供了新的方法。
附图说明
此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本发明的实施例,并与说明书一起用于解释本发明的原理。
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例1中bntc的合成路线。
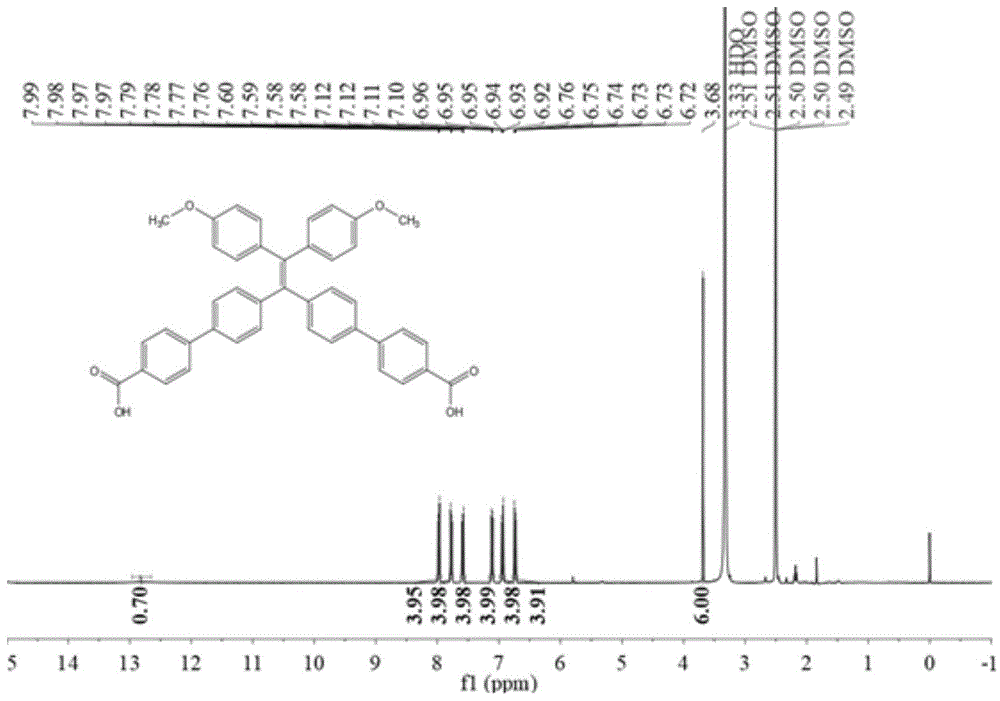
图2为本发明实施例1中bntc的核磁共振氢谱。
图3为本发明实施例1中bntc的质谱。
图4为本发明实施例2中botc的合成路线。
图5为本发明实施例2中botc的核磁共振氢谱。
图6为本发明实施例2中botc的质谱。
图7为本发明实施例3中超薄水滑石的透射电镜图。
图8为本发明实施例4中bntc、bntc/ldh、ldh的红外图。
图9为本发明实施例4中不同比例下的超薄水滑石负载bntc的负载量和包封率图。
图10为本发明实施例5中botc、botc/ldh、ldh的红外图。
图11为本发明实施例6中bntc对于s.a的抗菌示意图。
图12为本发明实施例6中botc对于s.a的抗菌示意图。
图13为本发明实施例7中bntc/ldh的mic值。
图14为本发明实施例7中bntc对于耐万古霉素肠球菌的mic值。
图15为本发明实施例7中botc/ldh的mic值。
图16为本发明实施例8中bntc对于金黄色葡萄球菌的荧光成像图。
图17为本发明实施例8中botc对于金黄色葡萄球菌的荧光成像图。
图18为本发明实施例9中bntc、bntc/ldh实验小鼠伤口愈合图。
图19为本发明实施例10中bntc、bntc/ldh连续诱导10次后细菌的耐药性变化。
具体实施方式
为了能够更清楚地理解本发明的上述目的、特征和优点,下面将对本发明的方案进行进一步描述。需要说明的是,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但本发明还可以采用其他不同于在此描述的方式来实施;显然,说明书中的实施例只是本发明的一部分实施例,而不是全部的实施例。
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1:bntc的合成
合成路线如附图1。
在氮气氛,在0℃下,向含有二苯基甲烷(2.5g,15mmol)的无水四氢呋喃(40ml)溶液中加入9ml的1.6m正丁基锂的己烷溶液,在该温度下将得到的橙红色溶液搅拌30分钟。加入4,4'-二溴二苯甲酮(5.1g,15mmol)后,将反应混合物温热至室温,并继续搅拌6小时。之后,用氯化铵水溶液淬灭反应混合物,然后用二氯甲烷进行多次萃取。将有机层用无水硫酸钠干燥,通过蒸发溶剂,获得粗醇产物。将所得粗醇产物溶于约100毫升的甲苯中,并加入对甲苯磺酸(1.15g,6.0mmol),将反应混合物回流12小时后,冷却至室温。用10%碳酸氢钠水溶液洗涤甲苯层,并用无水硫酸镁干燥,将粗产物用硅胶柱纯化,用石油醚/乙酸乙酯(10/1v/v)作为洗脱剂,得到中间产物1,为淡黄色粉末(收率56%)。
在剧烈搅拌下,将中间产物1(1.0g,2.03mmol)加入到含有乙酸(3.7g,61.2mmol)的二氯甲烷(50ml)溶液中。在0℃下滴加浓硝酸(5.14g,81.6mmol)到溶液中,然后将反应混合物温热至室温并继续搅拌3小时。将反应混合物用水淬灭,然后将其用二氯甲烷(3×50ml)萃取三次。合并有机层,用饱和盐水溶液洗涤,并用硫酸镁干燥,得到粗产物。将粗产物用硅胶柱纯化,用石油醚/乙酸乙酯(3/1v/v)作为洗脱剂,得到中间产物2,为黄色粉末(收率73%)。
将中间产物2(580mg,1.0mmol)、4-甲氧羰基苯硼酸(540.1mg,3.0mmol)、碳酸钾(2m,0.5ml)和四(三苯基膦)钯(5mg,0.05mmol)的混合物溶于四氢呋喃中。在氮气的保护下回流12小时,冷却至室温后,蒸发溶剂,并将所得固体溶解于二氯甲烷中,用水洗涤。分离有机相,用硫酸镁干燥,得到粗产物。将粗产物用硅胶柱纯化,用石油醚/乙酸乙酯(10/1v/v)作为洗脱剂,将纯化后的产物溶于水/四氢呋喃(1/1,v/v)的混合溶液中,50℃反应12小时。将反应完成后的溶液用浓盐酸hcl酸化,冷却离心,将沉淀物真空干燥,获得黄色粉末(产率为45%),即为bntc。
通过核磁共振氢谱(附图2)及质谱对产物进行表征(附图3)。
实施例2:botc的合成
合成路线如附图4。
将4,4’-二溴二苯甲酮(3.91g,11.5mmol)、4,4’-二甲氧基二苯甲酮(2.79g,11.5mmol)和锌粉(5.97g,92mmol)溶于除水的四氢呋喃中,然后将混合物通氮气保护。将四氯化钛(8.72g,46mmol)在氮气保护下加入上述混合物中,并保持丙酮浴0.5小时。之后将混合物在氮气的保护下回流9小时,然后冷却至室温。加入饱和碳酸钾溶液后,用二氯甲烷萃取三次。取有机相用无水硫酸钠干燥,得到粗产物,将粗产物用硅胶柱纯化,用石油醚/二氯甲烷(5/1v/v)作为洗脱剂,得到中间产物3,为浅黄色粉末(收率35%)。
将中间产物3(550mg,1.0mmol)、4-甲氧羰基苯硼酸(540.1mg,3.0mmol)、碳酸钾(2m,0.5ml)和四(三苯基膦)钯(5mg,0.05mmol)的混合物溶于四氢呋喃中。在氮气的保护下回流12小时,冷却至室温后,蒸发溶剂,并将所得固体溶解于二氯甲烷中,用水洗涤。分离有机相,用硫酸镁干燥,得到粗产物,将粗产物用硅胶柱纯化,用石油醚/乙酸乙酯(10/1v/v)作为洗脱剂。将纯化后的产物溶于水/四氢呋喃(1/1,v/v)的混合溶液中,80℃回流12小时。反应完成后,将溶液冷却至室温并减压浓缩。将浓缩后的溶液用浓盐酸hcl酸化,冷却离心,将沉淀物真空干燥,获得黄色粉末(产率为32%),即为botc。
通过核磁共振氢谱(附图5)及质谱对产物进行表征(附图6)。
实施例3:镁铝超薄水滑石纳米片(ldh)的制备
溶液a:将mg(no3)2·6h2o(0.4mmol),al(no3)3·9h2o(0.2mmol)溶解在20ml去离子水中。
溶液b:将nano3(0.2mmol)溶解在40ml含25%甲酰胺的去离子水中。
溶液c:naoh(4.5mmol)溶于20ml去离子水中。将溶液a和溶液c在80℃下迅速加入溶液b中,剧烈搅拌20分钟后,将所得的水滑石用水和乙醇多次洗涤至中性,然后再进行渗析(3kda)除去甲酰胺,最后在水中重悬备用。
如附图7,通过透射电镜对该超薄水滑石进行了表征,所制备的超薄水滑石为片状结构,粒径约为70nm。
实施例4:复合纳米材料(bntc/ldh)的制备
将10mg的bntc溶解在5ml二甲亚砜中以获得储备溶液。将储备液以4:1的质量比添加到超薄水滑石ldh(1mg/ml)悬浮液中,室温搅拌12小时。将悬浮液以12000rpm离心10分钟,收集沉淀并彻底分散在去离子水中。重复4次,然后将样品在水中重悬备用。如附图8,通过傅里叶变换红外光谱仪对复合材料进行了表征。复合材料兼具bntc和水滑石的特征峰,证明bntc很好的负载在了水滑石纳米片上。
负载量(loadingcontent,lc)和包封率(encapsulationefficiency,ee)通过以下公式计算:
lc=(wfed-wsupernatant)/wldh*100%(1)
ee=(wfed-wsupernatant)/wfed*100%(2)
其中:wfed为添加bntc的初始总质量,wsupernatant为离心后上清液中bntc的总质量,wldh为负载过程中水滑石的总质量。不同比例下的负载量和包封率如附图9。
实施例5:复合纳米材料(botc/ldh)的制备
本实施例与实施例4的区别在于,将bntc替换为botc。
如附图10,通过傅里叶变换红外光谱仪对复合材料进行了表征。复合材料兼具botc和水滑石的特征峰,证明botc很好的负载在了水滑石纳米片上。
实施例6:体外抗菌实验
本发明所运用的抗菌实验计数方法为主要为比浊法,以此来评估材料的抗菌性能。
1、细菌的培养:
挑取固体lb培基上的金黄色葡萄球菌菌落于10ml液体lb培养基中,振荡器混匀后放入摇床,在37℃、150rpm培养至对数期(109cfu/ml)。通过紫外分光度计测量在600nm处的光密度(od600)来确定细菌的浓度。将上述109cfu/ml细菌转移至1ml离心管中。以12000rpm离心2分钟。离心后,除去上清液并用磷酸盐缓冲溶液(pbs)洗涤三次,再用pbs稀释105倍,备用。
2、bntc的抗菌实验:
将上述备用细菌与不同浓度的bntc在37.5℃下共培养12-16小时,通过观察溶液的od600来判断细菌的生长情况。如附图11,空白组的试管明显浑浊,而实验组在bntc最低浓度为0.05μg/ml的时候,试管内培养基清澈,没有明显的细菌生长。通过紫外分光光度计测其组在600nm处的吸收也可表明在bntc浓度低至0.05μg/ml的时候,细菌的生长完全被抑制。
3、botc的抗菌实验:
将上述备用细菌与不同浓度的botc在37.5℃下共培养12-16小时,通过观察溶液的od600来判断细菌的生长情况。如附图12,空白组的试管明显浑浊,而实验组在botc最低浓度为0.1μg/ml的时候,试管内培养基清澈,没有明显的细菌生长。通过紫外分光光度计测其组在600nm处的吸收也可表明在botc浓度低至0.1μg/ml的时候,细菌的生长完全被抑制。
实施例7:最小抑菌浓度(mic)的测定
采用倍数稀释法通过96孔板测定bntc/ldh、botc/ldh的mic值。取无菌的96孔板,在最外圈加100μlpbs。除第一列孔及最后一列外的每个孔中加50μllb培养基。第一列为阴性对照,加入100μllb培养基。然后在第二列孔中加入50μl固定浓度的材料,多次吹打均匀后取50μl到第二列孔吹打均匀,再取50μl到第三列孔,吹打均匀直到第十列孔,吹打均匀后弃掉50μl。除第一列的每个孔加50μl的菌液,混匀。最后一列为阳性对照,加入100μl的备用细菌,放入培养箱,37℃培养16-20h。通过酶标仪测od600。计算mic。如附图13,在bntc/ldh最低浓度为0.05μg/ml的时候细菌的生长被完全抑制,表明了复合材料bntc/ldh依然具有优异的抗菌活性。同样,bntc还在浓度为1μg/ml展现出了对于耐万古霉素肠球菌较好的抗菌效果(附图14)。
同理,采用相同方法测定botc/ldh的mic值,结果如附图15所示,在botc/ldh最低浓度为0.1μg/ml的时候细菌的生长被完全抑制,表明了复合材料botc/ldh依然具有优异的抗菌活性。
实施例8:bntc与botc对于细菌的荧光成像
用分析天平称取一定量的bntc固体分子,溶解于二甲基亚砜中,配成10mmol/l的溶液,然后用pbs稀释为0.2-0.4μmol/l,备用。然后将990μl备用的细菌与10μl的有机分子溶液移入无菌的离心管中,在室温下孵育20-30分钟。之后,取10μl孵育好的细菌转移到载玻片上,盖玻片固定。在共聚焦激光扫描显微镜(clsm)下使用405nm激光和100倍反射镜收集图像。结果如附图16所示,bntc可以对金黄葡萄球菌进行荧光成像,可作为一种潜在的细菌荧光染色剂。
同理,采用相同方法利用botc固体分子进行上述实验,结果如附图17所示,botc也可以对金黄葡萄球菌进行荧光成像,可作为一种潜在的细菌荧光染色剂。
实施例9:小鼠伤口感染模型建立
实验使用小鼠为5-6周的雄性balb/c小鼠。将小鼠分为3组:空白对照(pbs)组和两组材料组(bntc和bntc/ldh),每组5只老鼠。用异氟烷麻醉小鼠后,在其背部制造一个直径为8mm的创口,创口处用200μl浓度为107cfu/ml的金黄色葡萄球菌液感染30min。随后,将50μl浓度为0.1μg的材料溶液滴在伤口表面。每天观察并记录伤口愈合情况。如附图18所示,经过bntc和bntc/ldh治疗的小鼠伤口恢复速度明显比对照组快,表明其炎症情况得到了明显的改善。
实施例10:bntc、bntc/ldh的诱导耐药性能
通过逐步增大浓度法评估bntc、bntc/ldh诱导细菌耐药性发展的能力。将未和药物共孵育的s.a称为第零代(g0),bntc、bntc/ldh对于改g0的mic记为mic0。随后将在亚mic0浓度(0.5mic0)下生长的细菌(g1)稀释继续测其mic。当该mic等于mic0时,延长培养时间到48小时,将此时细菌(g1)的mic值记为mic1。再取在0.5mic1生长的细菌(g2)继续测其mic值。依次往复,连续培养10代,得到g10及mic10。结果如附图19所示:在bntc连续培养10代后,mic值增加到了1.25μg/ml。而经bntc/ldh连续培养10代后,mic只增加到了0.16μg/ml,耐药性发展较慢。
以上所述仅是本发明的具体实施方式,使本领域技术人员能够理解或实现本发明。对这些实施例的多种修改对本领域的技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所述的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!