一种导电丝素蛋白膜及其制备方法和用途
本发明属于生物材料技术领域,具体涉及一种导电丝素蛋白膜及其制备方法和用途。
背景技术:
皮肤是作为人体最大的器官,大面积暴露于外部环境增加了其损伤的可能性,且其与人类生活质量及医疗负担联系紧密。根据最新研究显示,皮肤创伤伤口的患病率日益增高。其中,对糖尿病患者而言,由于血糖升高会引起基体细胞因子发生变化,导致代谢异常,对创面的修复功能减弱,而且搞得血糖含量更有利于细菌繁殖,伤口易感染,导致创面修复缓慢。糖尿病足等慢性难愈伤口还可能进一步合并截肢风险,在全世界范围内带来沉重的卫生经济负担。因此促进伤口愈合的治疗手段一直是全世界关注重要问题。
近年来,表皮生物电学在生物医学诊断和治疗方面得到应用。跨上皮电位差存在于包括皮肤上皮在内的多种类型的上皮中,一旦出现上皮层受损,生理性内源电场则发生短路,这种生物电将驱动成纤维细胞,上皮细胞等皮肤功能细胞在创伤的两端之间迁移,以完成皮肤愈合。
但目前大多数导电材料主要为金属、碳基材料,缺乏良好的生物相容性和足够的治疗特性,限制了其在皮肤缺损中的实际应用。因此开发出能利用皮肤创口生物电以实现促进创面愈合与皮肤组织再生的导电性皮肤修复产品具有重要的意义。
目前已有技术实现了天然丝素蛋白纤维的制备,丝素蛋白纤维作为一种天然高分子材料,具有很好的生物相容性、可降解性,在伤口敷料领域有广泛的应用。但由于其具有绝缘性,无法利通过表皮生物电学更好地实现皮肤修复和再生。赋予其导电性的传统方法是将导电填料与其直接混合,例如使用金属纳米粒子(银纳米粒子)或非金属纳米粒子(多壁碳纳米,石墨烯)等对纤维进行修饰,例如:liu等人将导电的银纳米线掺杂在丝素纤维中制成能够环境响应的导电丝素蛋白膜(liu,j.etal.environmentallyresponsivecompositefilmsfabricatedusingsilknanofibrilsandsilvernanowires.j.mater.chem.c6,12940-12947(2018));wang等人将石墨烯与丝素蛋白复合制得了可自愈合的导电材料(wang,q.etal.self-healablemultifunctionalelectronictattoosbasedonsilkandgraphene.adv.funct.mater.29,1808695(2019).)。然而,这些直接物理掺杂的填料容易聚集,不但机械强度有限,而且容易导致导电路径的中断,往往应用于电子皮肤、电子产品中,而非创伤敷料领域。
因此,研发一种对丝素纤维进行更优化的导电修饰的方法,从而获得能够利用皮肤创口生物电实现促进创面愈合与皮肤再生的功效的丝素蛋白纤维敷料,在创伤愈合治疗领域有重要意义。
技术实现要素:
本发明的目的在于提供一种具有优良导电性、生物相容性和机械性能,并且能够促进糖尿病皮肤创伤修复的丝素蛋白膜及其制备方法和用途。
本发明提供了一种导电丝素蛋白膜,它由如下原料制备而成:丝素蛋白溶液、导电高分子/多酚修饰的丝素纤维、交联剂。
进一步地,上述丝素蛋白溶液中含有脱胶丝素,所述脱胶丝素的质量分数为1%~7%,优选为5%;
和/或所述导电高分子/多酚修饰的丝素纤维由脱胶丝素、多酚、导电高分子单体、氧化剂制备而成;
和/或所述交联剂为聚乙二醇二缩水甘油醚或京尼平。
更进一步地,上述导电丝素蛋白膜所述交联剂、导电分子/多酚修饰的丝素蛋白纤维和丝素蛋白溶液的质量体积比为(0.01~0.05)g:(0.01~0.04)g:(3~7)ml,优选为0.025g:0.04g:5ml。
更进一步地,上述丝素蛋白溶液按照如下方法制备而成:
取脱胶丝素溶解在氯化钙、乙醇和水的三元体系中得混合溶液,将混合溶液与去离子水混合后,加入透析袋中用去离子水透析,取透析液上清液,浓缩即得;
其中,所述脱胶丝素与三元体系的质量比为1:(8~12),优选为1:10;所述混合溶剂中氯化钙、乙醇和水的质量比为(0.5~1.5):(1~3):(7~9),优选为1:2:8;和/或所述混合溶液与去离子水的体积比为1:(1~3),优选为1:1。
更进一步地,上述导电高分子/多酚修饰的丝素纤维是按照如下步骤制备而成:
(1)脱胶丝素和多酚反应制得多酚修饰的丝素纤维;其中,所述多酚和脱胶丝素的质量比为1:(2~100);
(2)多酚修饰的丝素纤维溶于水和醇的混合溶剂中,加入导电高分子单体、氧化剂形成混合溶液进行反应,即得;
其中,所述多酚修饰的丝素纤维、氧化剂、导电高分子单体和混合溶剂中的质量体积比为(0.1~1)g:(0.1~1.5)g:(0.2~0.3)ml:10ml;优选为0.5g:0.1g:0.2ml:10ml;
优选地,步骤(2)所述水和醇的混合溶剂中水和醇的体积比为(2~5):1,优选为3:1;更优选地,所述醇为乙醇。
更进一步地,上述多酚为多巴胺,单宁酸,没食子酸或木质素;和/或所述导电高分子单体为吡咯、苯胺、噻吩类化合物或5-羧基吲哚,所述噻吩类化合物优选为3,4-乙烯二氧噻吩;和/或所述氧化剂为三氯化铁、过硫酸钠,过硫酸钾、重铬酸钾、碘酸钾或高碘酸钠;和/或所述脱胶丝素为脱胶率85%以上的脱胶丝素。
本发明还提供了上述导电丝素蛋白膜的制备方法,包括如下步骤:
(1)制备丝素蛋白溶液:取脱胶丝素溶解在氯化钙、乙醇和水的混合溶剂中得混合溶液,将溶液与去离子水混合后,加入透析袋中用去离子水透析,取透析液上清液,即为丝素蛋白溶液;
(2)制备多酚修饰的丝素纤维:将多酚分散在ph为7.5~9的tris-hcl缓冲液中混匀,加入脱胶丝素反应得到多酚修饰的丝素蛋白纤维;
(3)制备导电分子/多酚修饰的丝素纤维:将步骤(2)的多酚修饰的丝素纤维加入水和醇的混合溶剂中分散均匀,然后加入导电高分子单体、氧化剂形成混合溶液反应,即得导电分子/多酚修饰的丝素纤维;
(4)将步骤(3)的导电分子/多酚修饰的丝素纤维溶解于步骤(1)得到的丝素蛋白溶液中,加入交联剂混合均匀成溶液,倒入模具交联成膜。
进一步地,上述步骤(1)所述脱胶丝素的溶解温度为60~90℃,时间大于4小时;和/或,所述透析袋为用edta和碳酸氢钠的混合溶液煮沸8~12min处理后的透析袋;和/或所述透析的温度为37℃,透析的时间为1周,期间每2~6小时更换新的纯水;
和/或,步骤(2)所述反应温度为20~37℃,反应时间为8~12小时;
和/或,步骤(3)所述反应温度为20~37℃,反应时间为3~8小时;
和/或,步骤(4)所述成膜温度为40~60℃,成膜时间为4~6小时。
进一步地,上述步骤(1)还包括如下处理步骤:将丝素蛋白溶液在40~45℃下加热搅拌,浓缩得到质量分数为2.5%~7.5%的丝素蛋白溶液;优选为5%的丝素蛋白溶液;和/或,步骤(2)还包括以下后处理步骤:离心,弃去上清液后,加去离子水分散沉淀,再重复上述步骤离心3~5次后,取沉淀于50~70℃烘干2~8h;和/或步骤(3)还包括以下后处理步骤:静置,除去上层溶液,于50~70℃烘干2~8h;和/或,步骤(4)还包括以下后处理步骤:用去离子水洗涤后干燥。
本发明还提供了上述导电丝素蛋白膜在制备促进皮肤创伤愈合的敷料中的用途;优选地,所述促进皮肤创伤愈合的敷料是促进糖尿病患者皮肤再生的敷料。
实验结果表明,本发明制备方法制得的导电丝素蛋白膜具有如下有益效果:
(1)导电性。本发明制备得到的丝素纤维为导电分子组装在多酚修饰的纤维外层,呈现芯鞘结构,具有良好且连续的导电性能。
(2)抗炎。本发明制备得到的丝素纤维利用了多酚的儿茶酚基团作为粘附位点,保留了其消除自由基的性能;
(3)机械性。本发明制备得到的丝素微纤维膜具有良好的机械性能,适合用于伤口表面。
(4)且能促进糖尿病小鼠的皮肤创伤修复,消除创伤皮肤表面炎症表达,调控皮肤组织中基质金属蛋白酶的表达,促进成纤维细胞的排列。
(5)本发明制备过程中采用的试剂,如导电分子、多酚、六水三氯化铁、乙醇、聚乙二醇二缩水甘油醚等都是无毒的,制备得到的丝素纤维膜生物相容性较好。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
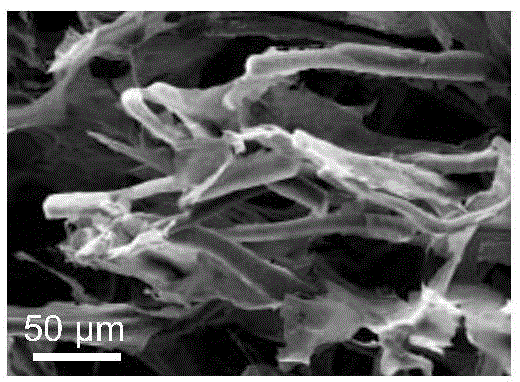
图1为本发明导电丝素蛋白膜的扫描电镜图像。
图2为本发明导电丝素蛋白膜的力学性能测试结果
图3为本发明导电丝素蛋白膜的导电性能检测结果。
图4为小鼠成肌细胞在本发明导电丝素蛋白膜上的生长形态观测结果。
图5为本发明导电丝素蛋白膜的自由基清除作用结果。
图6为本发明导电丝素蛋白膜促进糖尿病小鼠皮肤创伤愈合作用。
图7为本发明的导电丝素蛋白膜对il-6、tnf-α的相对表达量的调控作用。
图8为本发明的导电丝素蛋白膜促进伤口愈合真皮层he染色结果与对mmp-2、mmp-9的表达量的调控作用。
具体实施方式
本发明所用原料与设备均为已知产品,通过购买市售产品所得。
实施例1、本发明导电丝素蛋白膜的制备
原料脱胶丝素的制备:按照专利cn109403046a中公开的脱胶丝素的制备方法或按照如下制备方法:取10-12g蚕茧剪碎,去离子水清洗。称量10g碳酸钠溶于2000ml去离子水中,得到质量分数为0.5%的碳酸钠溶液,将剪碎的蚕丝溶于其中。煮沸1-1.5小时后使用去离子水冲洗并用力揉搓。重新配置上述碳酸钠溶液,重复该步骤3-4次使蚕丝脱胶完全,65℃下烘干5h-8h,制备得到脱胶率高于85%的脱胶丝素。
a.丝素蛋白溶液的制备
取该脱胶丝素5g,少量多次加入总体积为50ml的氯化钙、乙醇、去离子水的三元体系中(氯化钙、乙醇、去离子水质量比为1:2:8),60℃水浴加热搅拌4小时,蚕丝完全溶解。将该溶液与50ml去离子水混合均匀,倒入透析袋中,置于37℃恒温下去离子水透析,2-6小时更换一次新鲜的去离子水,一周后取出透析液取上清液低温保存,得到丝素蛋白水溶液。取5毫升溶液浓缩定容至溶液中脱胶丝素质量分数为1%。
b.多巴胺修饰的天然丝素纤维的制备;
将0.26g多巴胺分散在200mlph为8的tris-hcl缓冲液中,混合均匀后加入2g脱胶丝素,搅拌均后静置8h,得到含有聚多巴胺修饰的丝素纤维的水溶液,放入离心机器中,以8000rad转速离心10min后,除去上清液并加入去离子水分散,重复3次。后将试管下层微纤维平铺于加入直径为10mm的培养皿中后,放置于65℃的烘箱中烘干4h后得到多巴胺修饰的天然丝素微纤维。
c.聚3,4-乙烯二氧噻吩/多巴胺修饰的丝素纤维的制备
称取0.5g多巴胺修饰的天然丝素纤维于烧杯中,加入于7.5ml去离子水和2.5ml乙醇搅拌5min至混合均匀,加入3,4-乙烯二氧噻吩200微升和0.1g六水三氯化铁,持续搅拌3小时后室温静置12小时,除去上层多余溶液将获得的纤维放入直径10mm的培养皿中,将培养皿放入60℃的烘箱中3h后获得聚3,4-乙烯二氧噻吩/多巴胺修饰的丝素纤维。
d.聚3,4-乙烯二氧噻吩/多酚修饰的皮肤修复用微丝素膜皮肤修复膜材料的制备
将0.04g制备好的聚3,4-乙烯二氧噻吩/多巴胺修饰的丝素纤维加入5毫升质量分数为1%的丝素蛋白溶液中,轻微搅拌1min,加入300微升聚乙二醇二缩水甘油醚后,通过延流法倒入厚度为1.5mm的模具中,混合溶液均匀铺展成膜。
实施例2、本发明导电丝素蛋白膜的制备
a.丝素蛋白溶液的制备
参照实施例1的方法制得脱胶率高于85%的脱胶丝素,取该脱胶丝素5g,少量多次加入总体积为50ml的氯化钙、乙醇、去离子水的三元体系中(氯化钙、乙醇、去离子水质量比为1:2:8),60℃水浴加热搅拌4小时,蚕丝完全溶解。将该溶液与50ml去离子水混合均匀,倒入透析袋中,置于37℃恒温下去离子水透析,2-6小时更换一次新鲜的去离子水,一周后取出透析液取上清液低温保存,得到丝素蛋白水溶液。取5毫升溶液浓缩定容至溶液中脱胶丝素质量分数为3%。
b.多巴胺修饰的天然丝素纤维的制备;
将0.26g多巴胺分散在200mlph为8的tris-hcl缓冲液中,混合均匀后加入2g脱胶丝素,搅拌均后静置8h,得到含有聚多巴胺修饰的丝素纤维的水溶液,放入离心机器中,以8000rad转速离心10min后,除去上清液并加入去离子水分散,重复3次。后将试管下层微纤维平铺于加入直径为10mm的培养皿中后,放置于65℃的烘箱中烘干4h后得到多巴胺修饰的天然丝素微纤维。
c.聚3,4-乙烯二氧噻吩/多巴胺修饰的丝素纤维的制备
称取0.5g多巴胺修饰的天然丝素纤维于烧杯中,加入于7.5ml去离子水和2.5ml乙醇搅拌5min至混合均匀,加入3,4-乙烯二氧噻吩200微升和0.1g六水三氯化铁,持续搅拌3小时后室温静置12小时,除去上层多余溶液将获得的纤维放入直径10mm的培养皿中,将培养皿放入60℃的烘箱中3h后获得聚3,4-乙烯二氧噻吩/多巴胺修饰的丝素纤维。
d.聚3,4-乙烯二氧噻吩/多酚修饰的皮肤修复用微丝素膜皮肤修复膜材料的制备
将0.04g制备好的聚3,4-乙烯二氧噻吩/多巴胺修饰的丝素纤维加入5毫升质量分数为3%的丝素蛋白溶液中,轻微搅拌1min,加入300微升聚乙二醇二缩水甘油醚后,通过延流法倒入厚度为1.5mm的模具中,混合溶液均匀铺展成膜。
实施例3、本发明导电丝素蛋白膜的制备
a.丝素蛋白溶液的制备
参照实施例1的方法制得脱胶率高于85%的脱胶丝素。取该脱胶丝素5g,少量多次加入总体积为50ml的氯化钙、乙醇、去离子水的三元体系中(氯化钙、乙醇、去离子水质量比为1:2:8),60℃水浴加热搅拌4小时,蚕丝完全溶解。将该溶液与50ml去离子水混合均匀,倒入透析袋中,置于37℃恒温下去离子水透析,2-6小时更换一次新鲜的去离子水,一周后取出透析液取上清液低温保存,得到丝素蛋白水溶液。取5毫升溶液浓缩定容至溶液中脱胶丝素质量分数为5%。
b.多巴胺修饰的天然丝素纤维的制备;
将0.26g多巴胺分散在200mlph为8的tris-hcl缓冲液中,混合均匀后加入2g脱胶丝素,搅拌均后静置8h,得到含有聚多巴胺修饰的丝素纤维的水溶液,放入离心机器中,以8000rad转速离心10min后,除去上清液并加入去离子水分散,重复3次。后将试管下层微纤维平铺于加入直径为10mm的培养皿中后,放置于65℃的烘箱中烘干4h后得到多巴胺修饰的天然丝素微纤维。
c.聚3,4-乙烯二氧噻吩/多巴胺修饰的丝素纤维的制备
称取0.5g多巴胺修饰的天然丝素纤维于烧杯中,加入于7.5ml去离子水和2.5ml乙醇搅拌5min至混合均匀,加入3,4-乙烯二氧噻吩200微升和0.1g六水三氯化铁,持续搅拌3小时后室温静置12小时,除去上层多余溶液将获得的纤维放入直径10mm的培养皿中,将培养皿放入60℃的烘箱中3h后获得聚3,4-乙烯二氧噻吩/多巴胺修饰的丝素纤维。
d.聚3,4-乙烯二氧噻吩/多酚修饰的皮肤修复用微丝素膜皮肤修复膜材料的制备
将0.04g制备好的聚3,4-乙烯二氧噻吩/多巴胺修饰的丝素纤维加入5毫升质量分数为5%的丝素蛋白溶液中,轻微搅拌1min,加入300微升聚乙二醇二缩水甘油醚后,通过延流法倒入厚度为1.5mm的模具中,混合溶液均匀铺展成膜。
实施例4、本发明导电丝素蛋白膜的制备
a.丝素蛋白溶液的制备
参照实施例1的方法制得脱胶率高于85%的脱胶丝素。取该脱胶丝素5g,少量多次加入总体积为50ml的氯化钙、乙醇、去离子水的三元体系中(氯化钙、乙醇、去离子水质量比为1:2:8),60℃水浴加热搅拌4小时,蚕丝完全溶解。将该溶液与50ml去离子水混合均匀,倒入透析袋中,置于37℃恒温下去离子水透析,2-6小时更换一次新鲜的去离子水,一周后取出透析液取上清液低温保存,得到丝素蛋白水溶液。取5毫升溶液浓缩定容至溶液中脱胶丝素质量分数为7%。
b.多巴胺修饰的天然丝素纤维的制备;
将0.26g多巴胺分散在200mlph为8的tris-hcl缓冲液中,混合均匀后加入2g脱胶丝素,搅拌均后静置8h,得到含有聚多巴胺修饰的丝素纤维的水溶液,放入离心机器中,以8000rad转速离心10min后,除去上清液并加入去离子水分散,重复3次。后将试管下层微纤维平铺于加入直径为10mm的培养皿中后,放置于65℃的烘箱中烘干4h后得到多巴胺修饰的天然丝素微纤维。
c.聚3,4-乙烯二氧噻吩/多巴胺修饰的丝素纤维的制备
称取0.5g多巴胺修饰的天然丝素纤维于烧杯中,加入于7.5ml去离子水和2.5ml乙醇搅拌5min至混合均匀,加入3,4-乙烯二氧噻吩200微升和0.1g六水三氯化铁,持续搅拌3小时后室温静置12小时,除去上层多余溶液将获得的纤维放入直径10mm的培养皿中,将培养皿放入60℃的烘箱中3h后获得聚3,4-乙烯二氧噻吩/多巴胺修饰的丝素纤维。
d.聚3,4-乙烯二氧噻吩/多酚修饰的皮肤修复用微丝素膜皮肤修复膜材料的制备
将0.04g制备好的聚3,4-乙烯二氧噻吩/多巴胺修饰的丝素纤维加入5毫升质量分数为7%的丝素蛋白溶液中,轻微搅拌1min,加入300微升聚乙二醇二缩水甘油醚后,通过延流法倒入厚度为1.5mm的模具中,混合溶液均匀铺展成膜。
实施例5、本发明导电丝素蛋白膜的制备
a.丝素蛋白溶液的制备
参照实施例1的方法制得脱胶率高于85%的脱胶丝素。取该脱胶丝素5g,少量多次加入总体积为50ml的氯化钙、乙醇、去离子水的三元体系中(氯化钙、乙醇、去离子水质量比为1:2:8),60℃水浴加热搅拌4小时,蚕丝完全溶解。将该溶液与50ml去离子水混合均匀,倒入透析袋中,置于37℃恒温下去离子水透析,2-6小时更换一次新鲜的去离子水,一周后取出透析液取上清液低温保存,得到丝素蛋白水溶液。取5毫升溶液干燥定容至脱胶丝素质量分数5%。
b.单宁酸修饰的天然丝素微纤维的制备;
将0.08g单宁酸分散在200mlph为8的tris-hcl缓冲液中,混合均匀后加入2g脱胶丝素,搅拌均后静置8h,得到含有单宁酸修饰的丝素纤维的水溶液。放入离心机器中,以8000rad转速离心10min后,除去上清液并加入去离子水分散,重复3次。后将试管下层微纤维平铺于加入直径为10mm的培养皿中后,放置于65℃的烘箱中烘干4h后得到单宁酸修饰的天然丝素纤维。
c.聚吡咯/单宁酸修饰的丝素纤维的制备
称取0.5g单宁酸修饰的天然丝素纤维于烧杯中,加入于7.5ml去离子水和2.5ml乙醇搅拌5min至混合均匀,加入吡咯300微升和1.5g过硫酸钠,持续搅拌2小时后室温静置8小时,除去上层多余溶液将获得的纤维放入直径10mm的培养皿中,将培养皿放入60℃的烘箱中3h后获得聚吡咯/单宁酸修饰的丝素纤维。
d.聚吡咯/单宁酸修饰的皮肤修复用微丝素膜皮肤修复膜材料的制备
将0.04g制备好的聚吡咯/单宁酸修饰的丝素纤维加入5毫升质量分数为5%的丝素蛋白溶液中,轻微搅拌1min,加入300微升聚乙二醇二缩水甘油醚后,通过延流法倒入厚度为1.5mm的模具中,混合溶液均匀铺展成膜。
实施例6、本发明导电丝素蛋白膜的制备
a.丝素蛋白溶液的制备
参照实施例1的方法制得脱胶率高于85%的脱胶丝素。取该脱胶丝素5g,少量多次加入总体积为50ml的氯化钙、乙醇、去离子水的三元体系中(氯化钙、乙醇、去离子水质量比为1:2:8),60℃水浴加热搅拌4小时,蚕丝完全溶解。将该溶液与50ml去离子水混合均匀,倒入透析袋中,置于37℃恒温下去离子水透析,2-6小时更换一次新鲜的去离子水,一周后取出透析液取上清液低温保存,得到丝素蛋白溶液。取5毫升溶液干燥定容至脱胶丝素质量分数为5%。
b.没食子酸修饰的天然丝素微纤维的制备;
将0.02g没食子酸分散在10mlph为8的tris-hcl缓冲液中,混合均匀后加入0.2g脱胶丝素,搅拌均后静置8h,得到含有没食子酸修饰的丝素纤维的水溶液。放入离心机器中,以8000rad转速离心10min后,除去上清液并加入去离子水分散,重复3次。后将试管下层微纤维平铺于加入直径为10mm的培养皿中后,放置于65℃的烘箱中烘干4h后得到没食子酸修饰的天然丝素纤维。
c.聚苯胺/没食子酸修饰的丝素纤维的制备
称取0.5g没食子酸修饰的天然丝素纤维于烧杯中,加入于7.5ml去离子水和2.5ml乙醇搅拌5min至混合均匀,加入苯胺300微升和1.0g碘酸钾,持续搅拌3小时后室温静置8小时,除去上层多余溶液将获得的纤维放入直径10mm的培养皿中,将培养皿放入60℃的烘箱中3h后获得聚吡咯/单宁酸修饰的丝素纤维。
d.聚苯胺/没食子酸修饰的皮肤修复用丝素膜皮肤修复膜材料的制备
将0.04g制备好的聚苯胺/没食子酸修饰的丝素纤维加入5毫升质量分数为5%的丝素蛋白溶液中,轻微搅拌1min,加入0.025g京尼平后通过延流法倒入厚度为1.5mm的模具中,混合溶液均匀铺展成膜。
以下通过实验例证明本发明的有益效果。
试验例1、本发明的导电丝素蛋白膜的结构
使用扫描电镜观察本发明制备的导电丝素蛋白膜的截面形貌,观测到的结果如图1所示,其中,红色部分为交联的丝素蛋白形成的结构,绿色部分为导电分子及多酚修饰的丝素蛋白纤维结构,可见,导电纤维均匀地穿插在丝素蛋白交联的基体中,预示着本发明制得的膜材料具有均匀、可连续导电的微观结构。
实验例2、本发明的导电丝素蛋白膜的机械性能
1、实验方法
使用万能力学测试仪进行本发明实施例1~4的导电丝素蛋白膜进行机械性能测试。
2、实验结果
如图2所示,本发明的导电丝素蛋白膜的拉伸强度均达到了兆帕级别,其中,丝素蛋白溶液浓度为5%的导电丝素蛋白膜的断裂强度甚至达到了20mpa以上,具有极其优异的力学性能。
以上结果说明本发明的导电丝素蛋白膜不易损坏,有利于储存、运输和实际使用。
试验例3、本发明的导电丝素蛋白膜的导电性能
1、实验方法
将导电丝素蛋白膜放置在两个平行的钛电极之间,这两个钛电极通过电回路连接,在膜上施加不同大小的电流(i),并记录相应的电势(v)。使用方程式σ=il/(v*πr2)计算膜的电导率。其中l和r分别是膜的长度和直径。
2、实验结果
如图3所示,本发明制备的导电丝素蛋白膜能够成功导电点亮灯泡,电导率高达20s/m以上,其中,丝素蛋白溶液浓度为5%的导电丝素蛋白膜的电导率甚至达到80s/m左右。
以上结果说明本发明的导电丝素蛋白膜具有优异的导电性能。
试验例4、本发明的导电丝素蛋白膜的生物相容性评价
1、实验方法
将本发明实施例3的导电丝素蛋白膜用无水乙醇及去离子水交替浸泡一周,用75%酒精处理2小时后进行体内外实验。小鼠成肌细胞c2c12接种在该导电丝素蛋白膜上,使用10%胎牛血清的dmem培养基37℃下培养1天。分别将不同的电势(0、300、600和900mv)施加到丝素蛋白膜上,持续作用30分钟。通过钙黄绿素染色,荧光纤维镜观察各组细胞的形态。
2、实验结果
如图4所示,高通量电刺激实验证实本发明的导电丝素蛋白膜具有极好的生物相容性,能促进成肌细胞更好的扩散和粘附力。
试验例5、本发明的导电丝素蛋白膜的自由基清除效果
1、实验方法
将小鼠的巨噬细胞接种于本发明实施例3的导电丝素蛋白膜上,使用10%胎牛血清的dmem培养基37℃下培养1天,将检测细胞内自由基的探针(dcfh)装载于细胞中,使用300um的过氧化氢刺激细胞15分钟后,使用荧光显微镜观察自由基荧光强度,并使用流式细胞仪定量检测荧光。使用纯丝素蛋白膜、导电分子聚多巴胺(pda)修饰的丝素蛋白纤维作为对照。
2、实验结果
如图5所示,荧光图片及流式结果均证实本发明的导电丝素蛋白膜能清除自由基,显著降低小鼠巨噬细胞中的自由基积累。糖尿病本身存在局部过强的氧化应激反应,刺激免疫细胞产生过多的,进而损伤组织细胞内的蛋白及dna等。因此上述结果说明本发明的导电丝素蛋白膜具有良好的清除自由基效能,有望改善糖尿病皮肤微环境从而促进愈合。
试验例6、本发明的导电丝素蛋白膜对糖尿病小鼠皮肤创伤修复作用
1、实验方法
在成都达硕生物科技有限公司购入7周大c57雄性小鼠,适应性饲养一周后,腹腔注射链脲佐菌素(stz),剂量为55mg/kg,连续注射5天。一周后小鼠出现多饮多尿现象,3周后测其随机血糖,高于16.7mmol/l的视为糖尿病建模成功。
在糖尿病小鼠背部制造直径为10mm的圆形全层皮肤缺损,放置本发明实施例3的导电丝素蛋白膜进行修复,使用pbs处理作为空白对照,另外以纯丝素蛋白膜和导电分子聚多巴胺(pda)修饰的丝素蛋白纤维作为对照组。定期拍摄伤口区域照片,并测量愈合面积。创伤后14天取背部皮肤组织进行固定包埋切片处理,进行he染色。创伤后14天取背部皮肤组织进行固定包埋切片处理,进行特异性白介素6的荧光染色。创伤后14天取新鲜原创伤中央的背部皮肤组织,提取其中rna进行实时定量pcr,检测白介素6(il-6)、肿瘤坏死因子(tnf-α)、基质金属蛋白酶2(mmp-2)、基质金属蛋白酶9(mmp-9)相对基因表达量。
2、实验结果
如图6所示,伤口区域照片及he染色均证实了本发明的导电丝素蛋白膜促进了糖尿病小鼠皮肤创伤的修复,大大提升了愈合速度,并促进了新生皮肤的纤维排列。
如图7所示,本发明的导电丝素蛋白膜、纯丝素蛋白膜和导电分子修饰的丝素蛋白纤维,il-6、tnf-α的相对表达量都显著低于空白对照组,其中,本发明的导电丝素蛋白膜对il-6表达的降低程度显著优于纯丝素蛋白膜和导电分子修饰的丝素蛋白纤维,对tnf-α的表达的降低程度显著优于纯丝素蛋白膜。说明本发明的导电丝素蛋白膜显著降低了糖尿病小鼠皮肤创伤炎症反应。
进一步地,如图8所示,真皮层的he染色证实了本发明的导电丝素蛋白膜提高了糖尿病创伤愈合的质量,愈合的组织纤维排列更加有序。pcr实验证实了导电丝素蛋白膜调控了基质金属蛋白酶2、9的相对基因表达量,mmp-2、mmp-9的表达量显著低于空白对照组和纯丝素蛋白膜组,有利于皮肤愈合过程中的胶原沉积。
以上结果说明,本发明导电丝素蛋白膜具有优异的促糖尿病小鼠创伤愈合的效果,其提升创伤愈合质量,加强胶原沉积和对创伤炎症反应的抑制作用显著优于单纯的丝素蛋白膜,且优于导电分子修饰的丝素纤维。
综上所述,本发明的导电丝素蛋白膜具有优良导电性、生物相容性和机械性能,并且能够抗炎、促进糖尿病皮肤创伤修复,且效果显著优于纯丝素蛋白膜和导电分子修饰的丝素纤维。本发明的导电丝素蛋白膜针对因糖尿病机体的皮肤创伤的修复具有非常优异的效果,在创伤修复领域具有非常好的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!