一株高产槐糖脂的三基因敲除工程菌及其构建方法与应用
本发明涉及一株高产槐糖脂的三基因敲除工程菌及其构建方法与应用,属于基因工程技术领域。
背景技术:
槐糖脂是一种生物表面活性剂,它们具有很好的环境相容性和生物相容性,可生物降解性,低毒性,是一种环境友好的表面活性剂。由于槐糖脂的这些特性,它们能够广泛应用于日化、食品、环境保护、石油开采等工业。相比于化学合成的表面活性剂,槐糖脂不仅具有良好的表面活性,同时也具有独特的生物活性,主要体现在其具有抗细菌和真菌活性,可以治疗败血症、抑制皮肤癣菌的生产,具有抗肝癌、食管癌、宫颈癌等活性(申请人课题组先前的专利)。不同结构的槐糖脂分子具有不同的生物学活性,酸型槐糖脂具有良好的润湿,乳化和发泡能力等表面活性,而内酯型槐糖脂则具有更好的降低表面张力和抗菌,抗炎,抗病毒等生物学活性。
申请人先前的专利报道槐糖脂可以利用拟威克酵母变种(wickerhamielladomercqiaevar.sophorolipid)cgmcc1576发酵制得,相关拟威克酵母变种后更名为球拟假丝酵母starmerellabombicola)。然而目前野生型的球拟假丝酵母菌株槐糖脂的产量偏低,无法满足市场和大规模工业化生产的需求,迫切需要开发高产槐糖脂的基因工程菌。但是申请人在近期的检索中没有找到关于对槐糖脂产生菌基因组中的转录因子进行挖掘和利用多个基因连续敲除效果累加的方法构建槐糖脂高产工程菌株及其应用的报道。
技术实现要素:
针对现有技术的不足,本发明要解决的问题是提供一株高产槐糖脂的三基因敲除工程菌及其构建方法与应用。
本发明所述的高产槐糖脂的三基因敲除工程菌,其特征在于:该高产槐糖脂的三基因敲除的工程菌株是以球拟假丝酵母(s.bombicola)cgmcc1576为出发菌株,敲除其响应ph相关的蛋白rlp基因和两个转录因子基因即调控支链氨基酸合成的leu3转录因子及锌指转录因子ztf1获得,其基因型为δrlpδleu3δztf1;其中所述rlp基因的核苷酸序列如seqidno.1所示,所述leu3基因的核苷酸序列如seqidno.2所示,所述ztf1基因的核苷酸序列如seqidno.3所示。
上述高产槐糖脂的三基因敲除工程菌的构建方法是:
(1)敲除盒的构建:对球拟假丝酵母(s.bombicola)cgmcc1576中响应ph相关的蛋白rlp基因和调控支链氨基酸合成的leu3转录因子及锌指转录因子ztf1两个转录因子基因,分别使用高保真酶
(2)利用醋酸锂方法制备野生型球拟假丝酵母(s.bombicola)感受态细胞,将线性的rlp敲除盒电转化感受态细胞;在潮霉素平板的筛选下发生同源双交换的菌株能获得潮霉素抗性基因的表达,在潮霉素平板上能够生长,即可获得含有hph标记的rlp基因敲除株δrlp::six;
(3)利用半乳糖诱导δrlp::six中hph表达盒的自删除,去除rlp基因敲除株δrlp::six中的hph标记,最终获得不含潮霉素抗性筛选标记的敲除菌株,命名为δrlp;
(4)以δrlp为出发株,以如上所述方法继续敲除转录因子leu3,获得基因型为δrlpδleu3的双敲除菌株;
(5)在得到的双敲除菌株δrlpδleu3中,以如上所述方法继续敲除转录因子ztf1,获得基因型为δrlpδleu3δztf1的球拟假丝酵母(s.bombicola)工程菌,即高产槐糖脂的三基因敲除工程菌株。
其中,上述使用到的引物核苷酸序列如下所示:
rlp-5’flankingfor:cttgccgaactacgagactgg
rlp-5’flankingrev:ctgatgcggtattttctccttacgccgaagtcctctttggagtgttgtag
rlp-3’flankingfor:aacatacgagccggaagcataaagtagagccctctaatttatgctgcc
rlp-3’flankingrev:tggactggtgaagttgcgtttg
rec-hphfor:gcgtaaggagaaaataccgcatcag
rec-hphrev:actttatgcttccggctcgtatgtt
rlp-gfor:atgctctcactggaaacatttactg
rlp-grev:caaatacttgtggaacttgaatgac
rlp-p1:atgggctggcatcgatcagtttc
rlp-p2:ctatctcattccgggccgcttct
leu3-5’flankingfor:gggaggattacgcaaggt
leu3-5’flankingrev:ctgatgcggtattttctccttacgcatttatggctaccagtgacttag
leu3-3’flankingfor:aacatacgagccggaagcataaagtctggctccctactgctctact
leu3-3’flankingrev:tcacgccactttgcttctc
leu3-gfor:gtgttgcggcttagtgtcaaatg
leu3-grev:gaactcaaaggtctgctctccaaac
leu3-p1:atgagtggcctggtggcctg
leu3-p2:tcatggggaaatgtaggggagc
ztf1-5’flankingfor:atcaccactactccagcggtc
ztf1-5’flankingrev:ctgatgcggtattttctccttacgcatcttagtgatttatgccgtagcgt
ztf1-3’flankingfor:aacatacgagccggaagcataaagttgaataaatgtgataactgtgggtg
ztf1-3’flankingrev:ctatatatactcttgccccgcaac
ztf1-gfor:tcaactaagcggattggagcac
ztf1-grev:gagtctgatgaggaaaacgaagtg
ztf1-p1:gtcgcaggaaacgcaatcaa
ztf1-p2:tgacaacaggtggtattgagtgag。
本发明所述高产槐糖脂的三基因敲除工程菌在发酵生产槐糖脂中的应用。
其中,所述发酵生产槐糖脂的方法是:
将三基因敲除的δrlpδleu3δztf1基因工程菌接种到装有5mlypd种子培养基的试管中,30±2℃,转速为180-220rpm,培养24-36h,待od600=1.0时,得发酵种子液;将得到的种子液按体积比2%的接种量转移至含50ml发酵培养基的300ml摇瓶中,在26~30℃,200-300rpm下培养7~14天得到含槐糖脂的发酵液;所有发酵均有三个重复,发酵罐发酵用量按摇瓶用量比例放大;取发酵液样品对槐糖脂产量、菌体干重、残余葡萄糖量各参数进行测定,评价所用工程菌及其发酵生产效果;其中,
所述ypd种子培养基的组成成分为:葡萄糖20.0g/l,蛋白胨20.0g/l,酵母粉10.0g/l;ypd种子固体培养基还添加琼脂粉20.0g/l;
所述发酵培养基的组成成分为:葡萄糖80.0g/l,酵母粉3.0g/l,kh2po41.0g/l,na2hpo4·12h2o1.0g/l,mgso4·7h2o0.5g/l,菜籽油80ml/l。
上述种子液的培养条件优选是:30℃,转速为200rpm,培养30h。
上述摇瓶发酵的条件优选是:30℃,200rpm下培养7天。
本发明所述用三个基因连续敲除效果累加的方法构建的高产槐糖脂菌株与野生型菌株,单基因敲除株、双基因敲除株的发酵产物分析:
(1)将野生型菌株,单基因敲除株、双基因敲除株和三基因敲除株在发酵培养基中进行发酵,发酵结束后对发酵液取样进行生物量、残余葡萄糖量、槐糖脂产量以及槐糖脂的组分等参数的测定和分析。
(2)发酵液中残余的葡萄糖使用生物传感器sba-40c来测定。
将发酵液离心取上清,稀释到合适倍数,取25μl进样,发酵液残余葡糖糖含量(g/l)=n×m/100(n为仪器读数,m为稀释倍数)。
(3)细胞生物量用细胞干重法测定。
一倍体积的发酵液加入5倍体积的正丁醇/乙醇/三氯甲烷(10:10:1)的混合液,振荡充分混匀后,8,000~10,000rpm常温离心10min,弃掉上清液,用双蒸水重悬,洗涤两次,在50~60℃烘箱干燥至恒重。
(4)发酵液中槐糖脂含量采用蒽酮-硫酸法测定。
1ml发酵液加入两倍体积的乙酸乙酯,涡旋振荡充分萃取,室温静置10min,8,000rpm常温下离心10min。取上清液采用蒽酮-硫酸法测定内酯型槐糖脂含量。2ml无水乙醇加入到1ml发酵液中,充分振荡,静置10min,8,000rpm室温下离心10min,用蒽酮-硫酸法测定总糖含量,总槐糖脂的含量为总糖的量去除发酵液中残余葡糖糖量,然后乘以换算系数1.91。
本发明所述用三个基因连续敲除效果累加的方法构建的高产槐糖脂菌株发酵产物中槐糖脂组分分析:
(1)槐糖脂粗品的制备。两倍体积的色谱纯乙腈添加至1倍体积的发酵液中,充分震荡后,室温静置10min,8,000~10,000rpm常温离心10min。收集上清,50~60℃烘箱干燥后,所得到的槐糖脂粗品用正己烷洗涤两次,去除残余的油酸,再次干燥至恒重。
(2)发酵液中槐糖脂的组分用高效液相色谱hplc分析。
槐糖脂粗品用色谱纯乙腈溶解,再用0.22μm的有机滤膜过滤,槐糖脂的样品使用分析型hplc检测。使用的色谱柱为venusilmp-c18column(250mm×4.6mm,agelatechnologiesinc.,usa)。使用二元梯度洗脱,流动相是水和乙腈,流速为1.0~1.5ml/min。hplc程序如下:0-15min,乙腈由40%升到60%;15-30min,乙腈由60%缓慢上升至70%;30-40min,乙腈由原来的70%上升到90%,并保留5min。进样体积为20~25μl,检测器检测的波长为207nm。
上述步骤(1)中,所述离心转速优选10,000转/分钟。
上述步骤(1)中,所述槐糖脂的烘干温度优选50℃。
上述步骤(2)中,所述hplc的流速优选1.0ml/min。
上述步骤(2)中,所述hplc的进样体积优选20μl。
实验检测显示:本发明所述用三个基因连续敲除效果累加的方法构建的高产槐糖脂的菌株δrlpδleu3δztf1,其摇瓶发酵后槐糖脂产量达到102g/l,比野生型菌株提高了57.19%,尤其是内酯型槐糖脂产量提高了25.25%。具体的,与野生型菌株相比,δrlpδleu3δztf1的峰3(c18:2dasl)和峰5(c18:1dlsl)的产量明显增加,其中c18:1dlsl在总产物中的比例比野生株中提高了11%。据报道,c18:1dlsl具有最强的生物学活性,包括对人食道癌细胞kyae109和kyse450均有很强的抑制作用。这使得δrlpδleu3δztf1菌株成为生产总槐糖脂和c18:1dlsl的优势菌株。
本发明提供了一株高产槐糖脂的三基因敲除工程菌及其构建方法与应用。基于目前所报道的获得槐糖脂高产菌株的方法主要是诱变筛选或是对单基因进行操作,本发明所提供的对槐糖脂产生菌株中与槐糖脂合成相关的三个基因同时进行敲除获得高产槐糖脂菌株的方法为槐糖脂菌株的基因工程改造提供了新的途径,也为开发高产槐糖脂的基因工程菌并大规模工业化生产槐糖脂满足市场需求奠定了基础,应用前景、经济价值和社会效益广阔。
附图说明
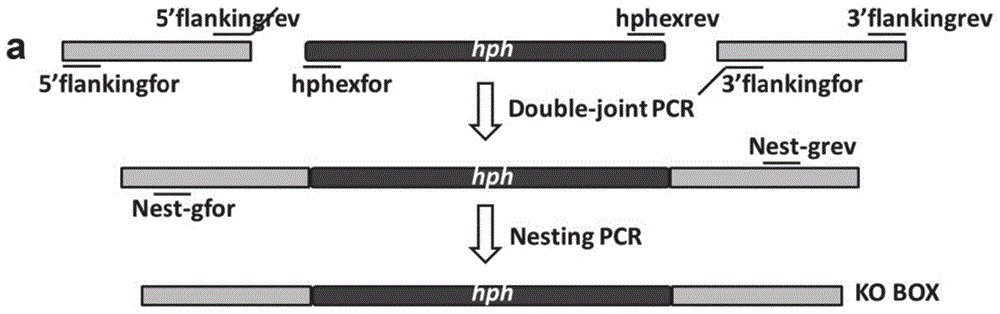
图1潮霉素敲除盒的构建。
图2利用同源重组构建rlp敲除菌株δrlp的原理图。
图3使用本发明构建的单基因敲除菌株的槐糖脂发酵结果。
图4使用本发明构建的三基因连续敲除菌株的槐糖脂发酵结果。
图5使用本发明构建的三基因敲除菌株的槐糖脂组分的hplc分析结果。
其中,a是野生株发酵液的槐糖脂组分分析结果,b是单敲除株δrlp发酵液的槐糖脂组分分析结果,c是双敲除株δrlpδleu3发酵液的槐糖脂组分分析结果,d是三敲除株δrlpδleu3δztf1发酵液的槐糖脂组分分析结果。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
一般性说明:
本发明实施例中的出发菌株球拟假丝酵母(s.bombicola)cgmcc1576是由拟威克酵母变种(wickerhamielladomercqiaevar.sophorolipidcgmcc1576更名后的菌株,该菌株是申请人课题组先前专利申请时保藏的菌株,其已于2006年9月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏号是cgmcc1576。申请人课题组已于2016年公布了球拟假丝酵母基因组序列(lij,etal.2016)。
质粒prsh购自上海北诺生物科技有限公司;omegagelextractionkit胶回收试剂盒购自美国omega公司。
ypd/yepd培养基的组成成分为:葡萄糖20.0g/l,蛋白胨20.0g/l,酵母粉10.0g/l;ypd种子固体培养基还添加琼脂粉20.0g/l。2%的接种量,200rpm,30℃培养。
sc酵母合成培养基(g/l):酵母氮基1.7,(nh4)2so45.0,酵母合成培养基补充剂1.3,半乳糖20.0(半乳糖替代葡萄糖),琼脂粉20.0(固体培养基时加)。用于突变体中诱导hph的缺失。
发酵培养基的组成成分为:葡萄糖80.0g/l,酵母粉3.0g/l,kh2po41.0g/l,na2hpo4·12h2o1.0g/l,mgso4·7h2o0.5g/l,菜籽油80ml/l。2%的接种量,200rpm,30℃,7天培养。
实施例1以潮霉素(hph)为标记的单基因敲除盒的构建
(1)以球拟假丝酵母s.bombicolacgmcc1576的基因组为模板,用引物对rlp-5’flankingfor/rlp-5’flankingrev和rlp-3’flankingfor/rlp-3’flankingrev扩增敲除盒上下游同源臂序列(1kb左右);以潮霉素筛选标记自删除质粒prsh为模板,用引物对rec-hphfor/rec-hphrev扩增含有自删除系统的hph抗性表达盒,所有的片段使用高保真酶
(2)通过double-jointpcr获得融合的目的片段。
先将步骤(1)中纯化得到的rlp上下游同源臂和潮霉素表达盒进行融合pcr,再采用引物对rlp-gfor/rlp-grev进行巢式pcr扩增,最终获得长度约7.4kb的rlp基因敲除盒。构建策略如图1所示。其中,所述rlp基因的核苷酸序列如seqidno.1所示。
其中,上述使用到的引物核苷酸序列如下所示:
rlp-5’flankingfor:cttgccgaactacgagactgg
rlp-5’flankingrev:ctgatgcggtattttctccttacgccgaagtcctctttggagtgttgtag
rlp-3’flankingfor:aacatacgagccggaagcataaagtagagccctctaatttatgctgcc
rlp-3’flankingrev:tggactggtgaagttgcgtttg
rec-hphfor:gcgtaaggagaaaataccgcatcag
rec-hphrev:actttatgcttccggctcgtatgtt
rlp-gfor:atgctctcactggaaacatttactg
rlp-grev:caaatacttgtggaacttgaatgac
rlp-p1:atgggctggcatcgatcagtttc
rlp-p2:ctatctcattccgggccgcttct。
实施例2野生型球拟假丝酵母(s.bombicola)感受态细胞的制备
(1)将甘油管保藏的s.bombicola接种到5mlyepd液体试管中,30℃,200rpm活化培养。
(2)将活化后菌液按1%接种量,转接至300ml三角瓶中含有50mlyepd液体培养基,30℃,200rpm过夜培养至od600=1。
(3)无菌环境中,将菌液导入50ml离心管中,4℃,5,000rpm离心5min,收集菌体,并用10ml预冷双蒸水重悬菌液,4℃,5,000rpm离心收集菌体,重复一次双蒸水洗涤步骤。
(4)用4ml预冷的1m的山梨醇重悬菌液,4℃,5,000rpm离心收集菌体。
(5)用4ml预冷的0.1mliac(含有2.5mmdtt)悬浮菌体,室温静置10-15min。
(6)4℃,5,000rpm离心收集菌体,再用4ml预冷的1m山梨醇溶液洗涤菌体。用250ml预冷的1m山梨醇溶液,重悬4℃离心收集的菌体,即得到s.bombicola的感受态细胞。
实施例3含有hph抗性标记的单基因敲除株的构建
(1)将50μl制备的s.bombicola感受态细胞加入1.5ml预冷的无菌离心管中,缓慢的加入668ng的上述构建的rlp敲除表达盒,轻轻混匀,置于冰上2分钟。
(2)将混合液在无菌环境中转入预冷的2mm电转杯中,冰浴5min。电穿孔仪参数如下:
(3)用吸水纸擦去电转杯外壁的水,进行电脉冲,脉冲结束立即在电转杯中加入1ml预冷的1m山梨醇,无菌环境中将混合液转入新的1.5ml无菌离心管,并在30℃水浴锅中孵育1h。
(4)准备抗性平板:将含有100mlyepd固体培养基的300ml三角瓶,微波加热至固体培养基全部溶解,待冷却至培养基不烫手背,立即加入1ml的潮霉素b,充分混匀后,倒入准备好的无菌平板中,20ml左右一个平板。
(5)从孵育的离心管中,取出200μl转化液均匀涂布于上述含有潮霉素的yepd平板,封口膜封口后,30℃,培养3-4天。
(6)待长出单菌落后,挑取转化子培养,提基因组采用引物对rlp-p1/rlp-p2进行pcr验证,纯化得到含有hph抗性自删除标记的敲除株δrlp::six。
实施例4去除hph标记的单基因敲除菌株的构建
(1)敲除株δrlp::six,在不含有潮霉素抗性的sc酵母合成培养基(半乳糖替代葡萄糖,作为碳源)中进行诱导培养,30℃,200rpm培养12h。
(2)在不含潮霉素的ypd固体平板上进行划线分纯,30℃恒温箱孵育3-4天,将单菌落分别点种在不含抗生素和含有潮霉素的ypd固体平板上,30℃恒温箱培养1天。
(3)选取能够在没有抗生素的平板上生长,且在潮霉素的平板上不能生长的单菌落,在不含潮霉素的ypd液体试管中继续培养,最终获得不含潮霉素抗性筛选标记的rlp敲除菌株δrlp。并用潮霉素表达盒缺失引物进行验证。菌株构建策略如图2所示。
实施例5三基因敲除菌株的构建
(1)与rlp基因敲除盒的构建过程相同,按照rlp基因的敲除方法,使用引物对leu3-5’flankingfor/leu3-5’flankingrev,和leu3-3’flankingfor/leu3-3’flankingrev扩增得到leu3的敲除盒上下游同源臂;使用引物对ztf1-5’flankingfor/ztf1-5’flankingrev,和ztf1-3’flankingfor/ztf1-3’flankingrev扩增得到ztf1的敲除盒上下游同源臂;leu3和ztf1的所有片段经切胶回收纯化后,利用double-jointpcr方法进行融合扩增,再分别采用引物对leu3-gfor/leu3-grev、ztf1-gfor/ztf1-grev进行巢式pcr扩增,获得leu3和ztf1基因敲除盒;其中,所述leu3基因的核苷酸序列如seqidno.2所示,所述ztf1基因的核苷酸序列如seqidno.3所示。
重复上述rlp敲除菌株δrlp的步骤,在δrlp中进一步分别敲除槐糖脂合成相关的转录因子基因gcl,ztf1和leu3,获得三个双基因敲除菌株δrlpδztf1,δrlpδleu3和δrlpδgcl。
(2)对得到的上述三个双基因敲除菌株利用发酵培养基发酵7天,分别测定其内酯型槐糖脂、酸型槐糖脂和总槐糖脂产量。其中总槐糖脂产量最高的菌株为δrlpδleu3。
(3)选择总槐糖脂产量最高的双敲除菌株δrlpδleu3作为三基因敲除菌株的起始菌株,在δrlpδleu3中进一步敲除ztf1基因,获得三基因敲除菌株δrlpδleu3δztf1。该基因型为δrlpδleu3δztf1的球拟假丝酵母(s.bombicola)工程菌,即为高产槐糖脂的三基因敲除工程菌株。
其中,上述实施例中使用到的引物核苷酸序列如下所示:
rlp-p1:atgggctggcatcgatcagtttc
rlp-p2:ctatctcattccgggccgcttct
leu3-5’flankingfor:gggaggattacgcaaggt
leu3-5’flankingrev:ctgatgcggtattttctccttacgcatttatggctaccagtgacttag
leu3-3’flankingfor:aacatacgagccggaagcataaagtctggctccctactgctctact
leu3-3’flankingrev:tcacgccactttgcttctc
leu3-gfor:gtgttgcggcttagtgtcaaatg
leu3-grev:gaactcaaaggtctgctctccaaac
leu3-p1:atgagtggcctggtggcctg
leu3-p2:tcatggggaaatgtaggggagc
ztf1-5’flankingfor:atcaccactactccagcggtc
ztf1-5’flankingrev:ctgatgcggtattttctccttacgcatcttagtgatttatgccgtagcgt
ztf1-3’flankingfor:aacatacgagccggaagcataaagttgaataaatgtgataactgtgggtg
ztf1-3’flankingrev:ctatatatactcttgccccgcaac
ztf1-gfor:tcaactaagcggattggagcac
ztf1-grev:gagtctgatgaggaaaacgaagtg
ztf1-p1:gtcgcaggaaacgcaatcaa
ztf1-p2:tgacaacaggtggtattgagtgag。
实施例6三基因连续敲除菌株δrlpδleu3δztf1的发酵
(1)菌种选择:球拟假丝酵母starmerellabombicola的野生株和三基因连续敲除株δrlpδleu3δztf1。
(2)菌种活化:将2%(体积/体积)野生株和敲除株的菌悬浮液分别接种到液体ypd种子培养基的试管中,30±2℃,转速为180-220rpm,培养24-36h,待od600=1.0时,得发酵种子液。
(3)摇瓶发酵:将步骤(2)得到的野生株和三基因敲除株种子液分别按2%(体积/体积)的接种量转移至含50ml发酵培养基的300ml摇瓶中,在26~30℃,200rpm下培养7~14天,即得到含槐糖脂的发酵液。
所有发酵均有三个重复。发酵罐发酵用量按摇瓶用量比例放大即可。
上述种子液的培养条件优选是:30℃,转速为200rpm,培养30h。
上述摇瓶发酵的条件优选是:30℃,200rpm下培养7天。
实施例7三基因敲除菌株的槐糖脂产量及组分分析
(1)野生型菌株和三基因敲除株在发酵培养基中进行发酵7天,发酵结束后对发酵液取样进行生物量、残余葡萄糖量、槐糖脂产量以及槐糖脂的组分等参数的测定和分析。
(2)发酵液中残余的葡萄糖使用生物传感器sba-40c来测定。
将发酵液离心取上清,稀释到合适倍数,取25μl进样,发酵液残余葡糖糖含量(g/l)=n×m/100(n为仪器读数,m为稀释倍数)。
(3)细胞生物量用细胞干重法测定。
一倍体积的发酵液加入5倍体积的正丁醇/乙醇/三氯甲烷(10:10:1)的混合液,振荡充分混匀后,8,000rpm常温离心10min,弃掉上清液,用双蒸水重悬,洗涤两次,在50℃烘箱干燥至恒重。
(4)发酵液中槐糖脂含量采用蒽酮-硫酸法测定。
1ml发酵液加入两倍体积的乙酸乙酯,涡旋振荡充分萃取,室温静置10min,8,000rpm常温下离心10min。取上清液采用蒽酮-硫酸法测定内酯型槐糖脂含量。2ml无水乙醇加入到1ml发酵液中,充分振荡,静置10min,8,000rpm室温下离心10min,用蒽酮-硫酸法测定总糖含量,总槐糖脂的含量为总糖的量去除发酵液中残余葡糖糖量,然后乘以换算系数1.91。
单基因敲除株的产量测定如图3所示,相比野生型菌株,总槐糖脂产量提高了10%~20%。多敲除菌株的产量测定结果如图4所示。
(5)槐糖脂粗品的制备。
两倍体积的色谱纯乙腈添加至1倍体积的发酵液中,充分震荡后,室温静置10min,10,000rpm常温离心10min。收集上清,50℃烘箱干燥后,所得到的槐糖脂粗品用正己烷洗涤两次,去除残余的油酸,再次干燥至恒重。
(6)发酵液中槐糖脂的组分用高效液相色谱hplc分析。
槐糖脂粗品用色谱纯乙腈溶解,再用0.22μm的有机滤膜过滤,槐糖脂的样品使用分析型hplc检测。使用的色谱柱为venusilmp-c18column(250mm×4.6mm,agelatechnologiesinc.,usa)。使用二元梯度洗脱,流动相是水和乙腈,流速为1.0ml/min。hplc程序如下:0-15min,乙腈由40%升到60%;15-30min,乙腈由60%缓慢上升至70%;30-40min,乙腈由原来的70%上升到90%,并保留5min。进样体积为20μl,检测器检测的波长为207nm。
结果如图5所示。槐糖脂产量达到102g/l,比野生型菌株提高了57.19%,尤其是内酯型槐糖脂产量提高了25.25%,其中c18:1dlsl槐糖脂分子的比例提高了11%,这种分子具有很好的抑菌、抗病毒和抗肿瘤等生物活性。统计结果见表1。
表1:统计结果
表1中:nasl非乙酰化酸型槐糖脂,masl单乙酰化酸型槐糖脂,dasl双乙酰化酸型槐糖脂,dlsl单乙酰化内酯型槐糖脂。
综上所述,本发明成功实现了球拟假丝酵母的高产槐糖脂工程菌株的构建,通过三基因敲除效果累加的方法,获得了槐糖脂产量显著提高的工程菌株(基因型为δrlpδleu3δztf1的球拟假丝酵母(s.bombicola)工程菌),为槐糖脂的工业化生产提供了优秀的生产菌株。其中所得的槐糖脂组分中c18:1dlsl槐糖脂分子的比例提高了11%,其具有很好的抑菌、抗病毒和抗肿瘤等生物活性,临床应用前景广阔,同时本发明的工程菌株具有很好的理论研究意义和实际应用价值。
序列表
<110>山东大学
<120>一株高产槐糖脂的三基因敲除工程菌及其构建方法与应用
<141>2021-05-14
<160>3
<210>1
<211>1437
<212>dna
<213>starmerellabombicola
<221>rlp基因的核苷酸序列
<400>1
atgggctggcatcgatcagtttcgctgttaactctggtggtattcttggcctttgggttc60
caggttgtcggtgtattttcccagccaatagcacgaaagcagctatcgatagcaaccgtt120
ggtgactacaaatatggtatactaggttggtgtccaaccgacacctctcagaactgctca180
tcctacggagtgggatacactttacaggacaactctgataccaaatggaacagctccacg240
caaaaaacactgagttccatagccatcgtgcacattgtggcggctggtctcctgctcata300
acgttattgatgtcatgtggtacggtctggagaaatcagaaatactggactgccgtagaa360
attatgctcagcttgtgcttcactgctgctgcgctctctttcgctgctgaggtggcgttg420
tttcgaacctctttgaattttgcaggatggttcacgctcgcatccaccgtgctttgtgtt480
gtcgctattgttgcgttggctctgatgcagaagagtctgcaagctagtcttggccgcacc540
aatatcaacggcaaagacacgctgctgactgatgattcggtcctgttcggaagaggcgga600
gactttgtgattggtagagacgatgaaaagatgttgcaaggtcccacgaaatcaggcttc660
tctaccacatcgctctcaagttctgcgtttcagatccccaagccgcctcagctgagaaca720
catggctcagagagtaaatatgagaggattcccgagagtagaaagggtcaaggagatagc780
tcactccaacaaccaggcatcatgtcaaataccaggaatggcacgcaatcaaattctcgc840
cttccgcagctaccagtcggcagcagtgaatccgtaggagccatcccaagacagcagcag900
ggtaactggcagagaggtccgatcgtccagaataaagcaggcgttcccccagcaagtgca960
ccaagcggcggtgctgaacagcagcaacagaaacaagatccgaattcaacaaggccgccc1020
ccagaggctgcaacacatcacaatgcgaataataatgcctcttcataccagaatgctccg1080
gctcagcagaacgacatgtacgcacagtactatcgaaacactcaaccgtaccaaggcaac1140
gaggcctcgtactcttactatccacaaactcagcccaattaccaatactatcaaaaccca1200
cagccccaatattatggacaaggaatgaatgctaattaccaacaaccgatggtttatgga1260
aatcaaaatgaaagctatcaaggtgtccaccctagtgcaggctacgcagcgtataagccg1320
gccaggcgaggccagtctcgaccccaagtcaatcaacgcagtgatctagcgctgcaatca1380
aacccggatttcagtcttggtaacctgggtagaaagaagcggcccggaatgagatag1437
<210>2
<211>2241
<212>dna
<213>starmerellabombicola
<221>leu3基因的核苷酸序列
<400>2
atgagtggcctggtggcctgcaaaaactgccgccagcaaaaggttagatgcagcggcaga60
tccgagaatggcgatccctgcgaccgatgtactcgccggacacttgattgtgttgtggac120
aacaattacaagcgcactgtaaagcgaaaagccattgaggctctggaggccgaaattagc180
gatctcaaaagaaagttgcacgcagagacaagtaactgggattccgagagcagtgcagca240
tctagaaggttgtcacctgccaagtttcagcccccggctccacgagggcttctcctcaaa300
agtaagaatggcactcttctctcgtcttcgccggtttaccaggttgagacctggttttgc360
ttgcccaaatcgactcaagggagtcagaatgagcctctgactctagactcggcgtcgatt420
gagcttcttttcaaagaatacgtctcattttatcatagagttttacccgttgtcgaggtc480
catagggggcctgagttcgtgtatggcgctagcgctgctttattctggacaataatggct540
attgctagtcgtcgacgcagcaaggacctgcccaggggaatcaacttcgagaagctttgt600
gacgttcaaaagcagcatttgagcgagatcgctgtctctccagtgttgggccagggaaaa660
tcgtccgagtttaacctgcctagcctgtatgccgtccaggcatttctattgtgcacactc720
tggccaccaccgacagcctcaatcaatgccgacatgagctggaataccagcggaatcgcc780
atactcactgcaatcagagccgggcttcattgccctggtcacgctcacgactttgagaga840
atattcaagtcgaacaaggcgcatcgcacaaatctcagagagcagttagtgacttggctt900
gcgaccaatgcactaagccaagcgatagcgaacatgttcggctatccctccgccgcgaaa960
tttcaggcgcatagacaatacctcttcaacaacgtcgagcttccgccgagggtgaggcat1020
atgtacgaaatccaacgcaacgcccacgaaattgagcaaagcctgggccagcttggccag1080
gctaacggctctccaagcttagaactctccatggcgacatctctcatcagagtgcacgcc1140
attcggtacgaccagatagaggccgaattcggagagcaaatggacgcttggacgatgttc1200
acgctgcatgccggtcgagcgcagctcttttcatattatttatttggcgacgtggacgaa1260
aatggtattttggcattgtacaatagttgccttgcgcttctcaaccatgtcgtcatccag1320
ccagacgagtatatgaagtatctccccgtggtgagcataatgattctgtggcaaacagcg1380
agtgttgtcgctcgcctatatcactctgagtggagcaaaaatttcgaccgatatagtggc1440
gagaaattgtactcttctgtcgtgaaaaaagtcagcttaagctcggtatttgaacatgat1500
cttccatatagagcctctgagatcatggctcaaatgtggggtgcatttagagcagtacgg1560
cggtctaatccgggaaaatgcatccctttgaagctatctttgaggagccgcatgtctgcg1620
tctgtgttctttgactcactatgggcgatgcgcgcaagcacagagattaaatctcaggcc1680
ccaaccactttgtcaaaaccaactgttttgaggaccgaaagcacagcagataatagcaat1740
gcctcctcagcttcgccagtgccctctggtgcttctacagatgctgcaccaccgcaaaac1800
ccgcctttcagcgcgcacctaccaatgcctgtatcaccagtcgcccctgccgctattgaa1860
caaaaaagaccttcaccaaaatactccccaatcactgaatctgccggagctaactcaggg1920
tatacacatacgagtccggcagttccctcaatagaccaaggaagccgtctcgctggacct1980
caaccacgatctaatacttcaaactgggtaagcagacaattaccgtccgtggagtctctg2040
ctctcaccagaacctggtaccccaggagtgatcaatatcaagtccccaataactcctgtc2100
tctccagcgatgtcggcgatgatagaccctacgtgggcagatattgatcccgaagccgcc2160
acttctatctggcacgatgttaacgcagtgatggaagacttcggctttggccttggagag2220
ctcccctacatttccccatga2241
<210>3
<211>2175
<212>dna
<213>starmerellabombicola
<221>ztf1基因的核苷酸序列
<400>3
atgacgcgtggcagagtctttaaggaagcacccccgagaaaatcagagtctctgagatcc60
ctgagactacgtcgcaggaaacgcaatcaagatccaacatccttggaaaatgagattgaa120
gacgagaaaggtttgactgtaccgccagaaaccgaggaaatgcgcaatgatattgcccag180
acctctagcggtcctcattctgctgtcagtgaagacacaatgccgccattaggatctttt240
gctgctcccaagcgtaaatcatcaactcagtcaacgccagggtcatcctcacctgagtct300
gccacaagttcgccgggtaagcatttgagcgatcagtcctctaatgtctcctcaccacgt360
tcgagacctgccgtccccaaagtagttgagcatgaagatagagactcagagagttcccat420
tcttctagaaatgaaaatgccagctcaccaaagacggagtcccgggcagctaacaatacc480
gcagggaaggctgcgcccagcattccgggagtccagccaggcagcattccatggccaaat540
ccattcttgggagcccatctaccatatgcgggctctttgagttatgggccttttgctggc600
tcgataccaggcgttgcaccccccgttatgctcgctgattctattctcagggatccctcc660
aaggtcatgccaccaccaccgcagggtttcaacgccctcccgcagctttctctgcctcat720
ggcctctttccagctcctttgtatcctgggtctttgccatataacgcaggttcttggtgt780
caaatcattggcccaacagggcaaccaacgatggcttgggtcccatccagtcctgggccg840
cagttgcagtcgcagaatagaatttacactccgtcaagaactaagctgaagccaagatct900
ccccaaacttttaaactgacgacctacgaagcgcaacgagagcatatcatcaacgagcaa960
aacaaagagcggcttcgcattcgcgaaatgcgtagggccgaaactctgcgtagatatatg1020
cggagtggcagcactgaagaagacgcgcatacaaatgaatcagcgcatgaaagatccaca1080
gctgaaaacaggacgttaggtgaagaaaggagatcttcggtacctcagagtaagtcatcg1140
gaattgccaagctcggcccaatccaacaatcctgtccccggtagcacaaactatctgggg1200
acacatattgctgtccaaggtcgccctatacccatgatcccaggaatggctgagagttgg1260
cgcagctggatccagcaaccaaacaataaatcggatcaaacaggtaatgctcacaacagt1320
ttaccggctagccttgtgccagattctcatacattcaagaaatccgggtatttgcgcaat1380
tctcacaagctgtatggtaaatcccaaccgagatcgtacggctatggagacatcatccct1440
caattcattgaacggaaagacactattactgaacaggatcgggagagggctttgaagatg1500
ctaacagagtcttttgaagtattcaagaaaaaaagacagagcaagccttcacataatgga1560
cccaccatagatgagcttgcagactccgctgctctcttagccaattataatcgctctgcg1620
ggattatatgttcgtaatgtggctcatcgaagaatcgaggaagaatatgcgaaccaacgg1680
agagactttcacgatgcagtcgatacgcttcaaatgccagctatcaaaaactcccaggaa1740
cgctggatctgcgccctgtgtccagcagaagcgccgaccttcctttattacaaacatctc1800
ttgaggcatgcagctcaccacctcgacataaagcccttcaagtgccctttttgctcaaga1860
tgttttcgccgtagtgatactgcaagaagacatcaattgagctgtgtccaattgtccttg1920
gcagtcaaagaacgtaatcgtaatcgcgcttcagcaggggtttctcgaaagaacaaacct1980
gaagcagccaaagtaactcgtggaaatgctaaagacaaggaatcgacctcggctcacgat2040
gacgacgaaacctccgaagaagaactcattgactctgacgatgatacacgagtaggggat2100
gagtcgtctgcgggaaatgaggtagtggctcactcaataccacctgttgtcatgcctttg2160
caagactcgaactag2175
- 还没有人留言评论。精彩留言会获得点赞!