提高雨生红球藻静置培养细胞浓度的方法
本发明涉及生物技术领域。更具体地说,本发明涉及一种提高雨生红球藻静置培养细胞浓度的方法。
背景技术:
虾青素是一种酮式类胡萝卜素,化学名为3,3′-二羟基-4,4′-二酮基-β,β′-胡萝卜素,具有强大的抗氧化能力,其清除自由基的能力是维生素c的6000倍、β-胡萝卜素的110倍、番茄红素的1800倍、叶黄素的800倍、茶多酚的320倍,具有很高的营养和药用价值,广泛应用于食品、保健品、饲料、化妆品等领域。雨生红球藻的虾青素含量可达1.5%~6%,被认为是目前含量最高的天然虾青素来源,而且雨生红球藻所含虾青素及其酯类的配比为约70%的单酯,25%的双酯及5%的单体,这与水产养殖动物自身的配比极为相似,这是通过化学合成和利用红发夫酵母等生产的虾青素所不具备的优势,因此,雨生红球藻成为近年来国际上天然虾青素生产的研究热点。
雨生红球藻(haematococcuspluvialis)是属于绿藻门、团藻目、红球藻科的一种单细胞真核生物,雨生红球藻的生命周期比较复杂,在不同的环境条件下具有不同的细胞形态,在生长环境比较适合的时候(营养充足、温度和光照合适等),藻细胞以绿色游动细胞存在,当环境条件变差时,绿色游动细胞失去鞭毛,变成绿色不动细胞,当环境条件继续变差,绿色不动细胞内积累虾青素朝不动孢子转变,最后变成含有大量虾青素的红色不动孢子。然而,当外界环境条件变好时,即外界环境适合藻细胞生长时,不动孢子又会转变成绿色游动细胞。
雨生红球藻的规模化养殖通常采用两步法进行,即营养生长分裂繁殖细胞和营养缺失诱导产虾青素,在放大培养前藻种的筛选、初步扩培及短时间保存一般均采用固体平板和培养瓶静置培养。目前,针对雨生红球藻的研究主要集中在营养生长阶段和诱导阶段如何提高产量或产率,而针对小体积培养瓶(100~250ml)种子静置培养进行初步扩培阶段的研究甚少。
目前,雨生红球藻小体积培养瓶静置培养后期由于藻液ph值升高,生长环境变不利,藻细胞失去鞭毛,变成绿色不动细胞,或藻细胞内积累虾青素朝不动孢子转变,不再进行分裂增殖,使得静置培养阶段存在培养周期长且细胞浓度低的问题,因此,如果能够开发一种可以快速促进雨生红球藻小体积培养瓶静置培养阶段不动细胞或不动孢子多分裂的方法,将会很大幅度的提高静置培养阶段种子浓度,从而提高生产效率。
技术实现要素:
本发明的一个目的是解决至少上述问题,并提供至少后面将说明的优点。
本发明还有一个目的是提供一种提高雨生红球藻静置培养细胞浓度的方法,其能够提高雨生红球藻静置培养细胞浓度。
为了实现根据本发明的这些目的和其它优点,提供了一种提高雨生红球藻静置培养细胞浓度的方法,包括以下步骤:
s1、向藻种中加入培养基后分装至培养瓶中,在光照条件下静置培养至其中无游动细胞和分裂细胞,得不动细胞,其中,培养瓶的体积为100~250ml;
s2、将不动细胞转移至光照强度<0.1μmol/m2/s,温度为10~25℃环境中,培养至镜检至少70%的不动细胞中心变黄或变红;
s3、将培养瓶内藻液摇匀,在光照条件下培养获得多分裂细胞,继而释放出游动细胞。
优选的是,步骤s1中所述藻种为雨生红球藻固体平板单藻斑、雨生红球藻游动细胞、雨生红球藻不动细胞中的一种。
优选的是,步骤s1中培养基ph值调节为6.5~7.5,培养基包括硝酸钠1.0~2.5g/l,磷酸氢二钾0.04g/l,七水硫酸镁75.0mg/l,二水氯化钙36.0mg/l,柠檬酸6.00mg/l,柠檬酸铁铵6.00mg/l,乙二胺四乙酸1.00mg/l,碳酸钠0.02g/l,硼酸2.86mg/l,氯化锰1.81mg/l,硫酸锌222μg/l,钼酸钠0.39mg/l,硫酸铜79.0μg/l,硝酸钴49.4μg/l,醋酸钠0~3.0g/l。
优选的是,步骤s1在光照条件下静置培养具体为:
培养温度为15~25℃,白色荧光灯连续光照,光照强度为3~20μmol/m2/s,每天摇瓶2~3次,培养至藻液内无游动细胞和分裂细胞,得不动细胞,即雨生红球藻不动细胞种子。
优选的是,每个培养瓶中的分装量占培养瓶体积的40~80%。
优选的是,每个培养瓶中的分装量占培养瓶体积的60%。
优选的是,步骤s1中先控制光照强度为3~10μmol/m2/s,培养至第一阶段,而后控制光照强度为10~20μmol/m2/s,培养至藻液内无游动细胞和分裂细胞,得雨生红球藻不动细胞种子;
其中,当藻种为雨生红球藻固体平板单藻斑时,第一阶段为单藻斑分散完全,且三角瓶内细胞浓度增至0.8*104~1.2*104个/ml;
当藻种为雨生红球藻游动细胞、雨生红球藻不动细胞中的一种时,第一阶段为细胞浓度为初始细胞浓度的2~3倍。
优选的是,步骤s3中在光照条件下培养具体为:白色荧光灯连续光照,光照强度为12~20μmol/m2/s,培养温度为15~25℃,培养8~48h后获得多分裂细胞,继而释放出游动细胞。
优选的是,所述培养瓶为三角瓶。
优选的是,所述培养瓶的体积为100ml或250ml。
本发明至少包括以下有益效果:
在雨生红球藻静置培养阶段,通过自养或混养获得的不动细胞或不动孢子,经过一段时间暗培养后再给予光照刺激,促进雨生红球藻培养瓶静置培养阶段不动细胞或不动孢子多分裂,有效提高小体积培养瓶(100~250ml)种子静置培养的种子浓度,从而提高生产效率。
本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
图1为本发明的其中一实施例所述雨生红球藻的镜检示意图;
图2为本发明的其中一实施例所述雨生红球藻的镜检示意图;
图3为本发明的其中一实施例所述雨生红球藻的镜检示意图;
图4为本发明的其中一实施例所述雨生红球藻的镜检示意图;
图5为本发明的其中一对比例所述雨生红球藻的镜检示意图。
具体实施方式
下面结合实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
需要说明的是,下述实施例、对比例中所述实验方法,如无特殊说明,均为常规方法,所述试剂和材料,如无特殊说明,均可从商业途径获得,其中,所用藻种为雨生红球藻haematococcuspluvialisfachb-712,购买于中科院武汉水生生物研究所。
<实施例1>
提高雨生红球藻静置培养细胞浓度的方法,其特征在于,包括以下步骤:
s1、将藻种(雨生红球藻不动细胞)沉降弃去上清液,加入培养基,而后接种至三角瓶中静置混养扩培,具体为:培养温度为15~18℃范围,白色荧光灯连续光照,每天摇瓶2~3次,培养过程中,先控制光照强度为5~7μmol/m2/s,培养至细胞浓度为初始细胞浓度的2~3倍范围内,而后控制光照强度为10~12μmol/m2/s,培养20天至其中无游动细胞和分裂细胞,得不动细胞,其中,不动细胞95%为绿色,5%略变黄;
其中,三角瓶中初始细胞数为0.1*104个/ml,三角瓶的体积为250ml,接种体积(培养基+藻种的体积和)为150ml;培养基ph值为6.8,培养基包括硝酸钠1.5g/l,磷酸氢二钾0.04g/l,七水硫酸镁75.0mg/l,二水氯化钙36.0mg/l,柠檬酸6.00mg/l,柠檬酸铁铵6.00mg/l,乙二胺四乙酸1.00mg/l,碳酸钠0.02g/l,硼酸2.86mg/l,氯化锰1.81mg/l,硫酸锌222μg/l,钼酸钠0.39mg/l,硫酸铜79.0μg/l,硝酸钴49.4μg/l,醋酸钠2.0g/l;
s2、将不动细胞转移至黑暗处(光照强度<0.1μmol/m2/s),温度为15~18℃环境中,静置放置30天,镜检藻液内无游动细胞,无分裂细胞,80%不动细胞中心变黄,10%不动细胞中心略红,10%不动细胞为绿色;
s3、将经过步骤s2处理的三角瓶藻液摇匀后置于培养架,白色荧光灯连续光照,光照强度为18~20μmol/m2/s,培养温度为15~18℃,培养48h后取样镜检发现有大量多分裂的细胞和游动细胞,继续培养至完全释放出游动细胞。
<实施例2>
提高雨生红球藻静置培养细胞浓度的方法,其特征在于,包括以下步骤:
s1、用接种环挑取藻种(单藻斑)于三角瓶的培养基中,进行静置混养扩培,具体为:培养温度为18~20℃,白色荧光灯连续光照,每天摇瓶2~3次,培养过程中,先控制光照强度为3~5μmol/m2/s,培养至单藻斑分散完全,且三角瓶内细胞浓度增至1*104个/ml(单藻斑的接种重度远低于该浓度),此时观察三角瓶内藻液呈绿色,而后控制光照强度为18~20μmol/m2/s,培养40天,镜检藻液内无游动细胞和分裂细胞,得不动细胞(即雨生红球藻不动细胞种子),其中,80%不动细胞为绿色,10%不动细胞中心变黄,10%不动细胞中心略红;
其中,初始细胞数忽略不计,三角瓶的体积为100ml,接种体积(培养基+藻种的体积和)为60ml;培养基ph值为7.0,培养基包括硝酸钠1.0g/l,磷酸氢二钾0.04g/l,七水硫酸镁75.0mg/l,二水氯化钙36.0mg/l,柠檬酸6.00mg/l,柠檬酸铁铵6.00mg/l,乙二胺四乙酸1.00mg/l,碳酸钠0.02g/l,硼酸2.86mg/l,氯化锰1.81mg/l,硫酸锌222μg/l,钼酸钠0.39mg/l,硫酸铜79.0μg/l,硝酸钴49.4μg/l,醋酸钠1.0g/l;
s2、将不动细胞转移至黑暗处(光照强度<0.1μmol/m2/s),温度为20~22℃环境中,静置培养50天,镜检藻液内至少70%的不动细胞中心变黄或变红(每隔一段时间镜检,满足该条件后停止步骤s2的静置培养),具体的,95%不动细胞中心变红,5%不动细胞中心变黄;
s3、将经过步骤s2处理的三角瓶藻液摇匀后置于培养架,白色荧光灯连续光照,光照强度为12~14μmol/m2/s,培养温度为18~20℃,培养12h后取样镜检发现有大量多分裂的细胞和游动细胞,继续培养至完全释放出游动细胞。
<实施例3>
提高雨生红球藻静置培养细胞浓度的方法,其特征在于,包括以下步骤:
s1、将藻种(雨生红球藻不动细胞)沉降弃去上清,加入培养基,分装至三角瓶中静置自养扩培,具体为:培养温度为20~22℃,白色荧光灯连续光照,每天摇瓶2~3次,培养过程中,先控制光照强度为8~10μmol/m2/s,培养至细胞浓度为初始细胞浓度的2~3倍,而后控制光照强度为18~20μmol/m2/s,培养35天后镜检发现藻液内无游动细胞,无分裂细胞,得不动细胞(20%不动细胞绿色,30%不动细胞中心变黄,50%不动细胞中心略红);
其中,初始细胞数为0.3*104个/ml,三角瓶的体积为100ml,接种体积(培养基+藻种的体积和)为60ml;培养基ph值为7.5,培养基包括硝酸钠2.5g/l,磷酸氢二钾0.04g/l,七水硫酸镁75.0mg/l,二水氯化钙36.0mg/l,柠檬酸6.00mg/l,柠檬酸铁铵6.00mg/l,乙二胺四乙酸1.00mg/l,碳酸钠0.02g/l,硼酸2.86mg/l,氯化锰1.81mg/l,硫酸锌222μg/l,钼酸钠0.39mg/l,硫酸铜79.0μg/l,硝酸钴49.4μg/l;
s2、将不动细胞转移至黑暗(光照强度<0.1μmol/m2/s),温度为10~12℃环境中,静置放置25天,镜检藻液内无游动细胞,无分裂细胞,至少70%的不动细胞中心变黄或变红(90%不动细胞中心变红,10%不动细胞中心变黄);
s3、将经过步骤s2处理的三角瓶藻液摇匀后置于培养架,白色荧光灯连续光照,光照强度为18~20μmol/m2/s,培养温度为20~22℃,培养8h后取样镜检发现有大量多分裂的细胞和游动细胞,继续培养至完全释放出游动细胞。
<实施例4>
提高雨生红球藻静置培养细胞浓度的方法,其特征在于,包括以下步骤:
s1、将藻种(雨生红球藻游动细胞)加入培养基,分装至三角瓶中混养扩培,具体为:培养温度为22~25℃,白色荧光灯连续光照,每天摇瓶2~3次,培养过程中,先控制光照强度为5~7μmol/m2/s,培养至细胞浓度为初始细胞浓度的2~3倍,而后控制光照强度为15~17μmol/m2/s,培养25天,镜检藻液内无游动细胞和分裂细胞,得不动细胞(即不动细胞种子),其中,90%不动细胞为绿色,10%不动细胞中心略变黄;
其中,初始细胞数为0.1*104个/ml,三角瓶的体积为100ml,接种体积(培养基+藻种的体积和)为60ml;培养基ph值为6.5,培养基包括硝酸钠2.0g/l,磷酸氢二钾0.04g/l,七水硫酸镁75.0mg/l,二水氯化钙36.0mg/l,柠檬酸6.00mg/l,柠檬酸铁铵6.00mg/l,乙二胺四乙酸1.00mg/l,碳酸钠0.02g/l,硼酸2.86mg/l,氯化锰1.81mg/l,硫酸锌222μg/l,钼酸钠0.39mg/l,硫酸铜79.0μg/l,硝酸钴49.4μg/l,醋酸钠3.0g/l;
s2、将不动细胞转移至黑暗(光照强度<0.1μmol/m2/s),温度为22~25℃环境中,培养20天,镜检至少70%的不动细胞中心变黄或变红(85%不动细胞中心变黄,10%不动细胞中心略红,5%不动细胞绿色);
s3、将经过步骤s2处理的三角瓶藻液摇匀后置于培养架,白色荧光灯连续光照,光照强度为15~18μmol/m2/s,培养温度为22~25℃,培养24h后取样镜检发现有大量多分裂的细胞和游动细胞,继续培养至完全释放出游动细胞。
<对比例1>
提高雨生红球藻静置培养细胞浓度的方法,其特征在于,包括以下步骤:
s1、将藻种(雨生红球藻不动细胞)沉降弃去上清液,加入培养基,而后接种至三角瓶中静置混养扩培,具体为:培养温度为15~18℃,白色荧光灯连续光照,每天摇瓶2~3次,培养过程中,先控制光照强度为5~7μmol/m2/s,培养至细胞浓度为初始细胞浓度的2~3倍范围内,而后控制光照强度为10~12μmol/m2/s,培养25天镜检藻液内无游动细胞和分裂细胞,得不动细胞种子,具体的不动细胞95%为绿色,5%略变黄;
其中,初始细胞数为0.1*104个/ml,三角瓶的体积为250ml,接种体积(培养基+藻种的体积和)为150ml;培养基ph值为6.8,培养基包括硝酸钠1.5g/l,磷酸氢二钾0.04g/l,七水硫酸镁75.0mg/l,二水氯化钙36.0mg/l,柠檬酸6.00mg/l,柠檬酸铁铵6.00mg/l,乙二胺四乙酸1.00mg/l,碳酸钠0.02g/l,硼酸2.86mg/l,氯化锰1.81mg/l,硫酸锌222μg/l,钼酸钠0.39mg/l,硫酸铜79.0μg/l,硝酸钴49.4μg/l,醋酸钠2.0g/l;
s2、不进行步骤s2;
s3、将经过步骤s1处理的三角瓶藻液摇匀后置于培养架,白色荧光灯连续光照,光照强度为18~20μmol/m2/s,培养温度为15~18℃,静置培养20天后藻液外观变黄,镜检藻液无游动细胞,无分裂细胞,不动细胞中心变红,积累虾青素朝不动孢子转变,细胞数无变化。
培养过程中,分别统计实施例1~4、对比例1的初始细胞数、步骤s1培养后细胞数、步骤s3培养后细胞数,并计算细胞浓度提高倍数f,f=(步骤s3培养后细胞数-步骤s1培养后细胞数)/步骤s1培养后细胞数,统计结果及计算结果如下表1所示:
表1
由表1可知,雨生红球藻小体积培养瓶静置培养阶段,无论是通过自养还是混养获得的不动细胞或不动孢子,经过一段时间暗培养后再给予光照刺激,均可以促进藻细胞再次进行多分裂增殖,从而提高三角瓶藻种浓度,进而提高生产效率。
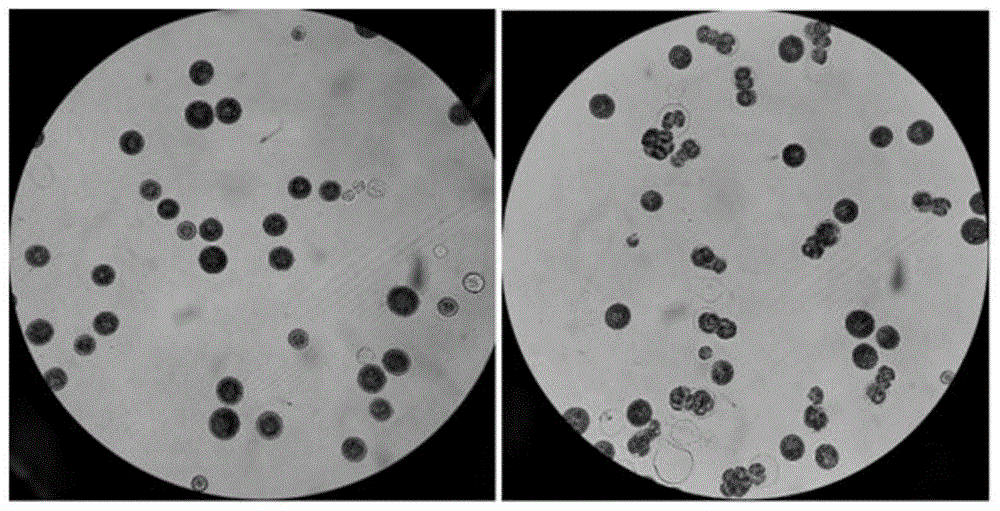
进一步,实施例1~4、对比例1的镜检结果如图1~5所示,具体的:
实施例1的镜检结果如图1所示,左侧图片为经步骤s2处理后藻细胞镜检状态,右侧图片为经步骤s3处理后藻细胞镜检状态;
实施例2的镜检结果如图2所示,左侧图片为经步骤s2处理后藻细胞镜检状态,右侧图片为经步骤s3处理后藻细胞镜检状态;
实施例3的镜检结果如图3所示,左侧图片为经步骤s2处理后藻细胞镜检状态,右侧图片为经步骤s3处理后藻细胞镜检状态;
实施例4的镜检结果如图4所示,左侧图片为经步骤s2处理后藻细胞镜检状态,右侧图片为经步骤s3处理后藻细胞镜检状态;
对比例1的镜检结果如图5所示,左侧图片为经步骤s1处理后藻细胞镜检状态,右侧图片为经步骤s3处理后藻细胞镜检状态。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
- 还没有人留言评论。精彩留言会获得点赞!